Как определить валентность по таблице менделеева?
Анонимный вопрос
18 декабря 2017 · 68,6 K
ОтветитьУточнить
Марьяна Бажан194
29 дек 2017
Номер группы, в которой расположен атом в периодической таблице равен его высшей валентности. Низшая валентность определяется разницей между числом восемь и номером группы. Натрий и алюминий имеют только одно значение валентности, равное номеру группы.
48,4 K
amina m.
24 декабря 2018
Спасибо
Большое
Тебе
Марьяна Бажан
🙏🙏😊😊 Читать дальше
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
Валентность химических элементов (Таблица)
Валентность химических элементов – это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0. Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина. Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Как можно определить валентность в соединениях:
— Валентность водорода (H) постоянна всегда 1. Отсюда в соединении H2O валентность O равна 2.
— Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
— Высшая валентность всегда равна № группы.
— Низшая валентность равна разности между числом 8 (количество групп в Таблице Менделеева) и номером группы, в которой находится элемент.
— У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
— У неметаллов обычно две валентности: высшая и низшая.

Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
Таблица валентности химических элементов
|
Атомный № |
Химический элемент |
Символ |
Валентность химических элементов |
Примеры соединений |
|
1 |
Водород / Hydrogen |
H |
I |
HF |
|
2 |
Гелий / Helium |
He |
отсутствует |
— |
|
3 |
Литий / Lithium |
Li |
I |
Li2O |
|
4 |
Бериллий / Beryllium |
Be |
II |
BeH2 |
|
5 |
Бор / Boron |
B |
III |
BCl3 |
|
6 |
Углерод / Carbon |
C |
IV, II |
CO2, CH4 |
|
7 |
Азот / Nitrogen |
N |
I, II, III, IV |
NH3 |
|
8 |
Кислород / Oxygen |
O |
II |
H2O, BaO |
|
9 |
Фтор / Fluorine |
F |
I |
HF |
|
10 |
Неон / Neon |
Ne |
отсутствует |
— |
|
11 |
Натрий / Sodium |
Na |
I |
Na2O |
|
12 |
Магний / Magnesium |
Mg |
II |
MgCl2 |
|
13 |
Алюминий / Aluminum |
Al |
III |
Al2O3 |
|
14 |
Кремний / Silicon |
Si |
IV |
SiO2, SiCl4 |
|
15 |
Фосфор / Phosphorus |
P |
III, V |
PH3, P2O5 |
|
16 |
Сера / Sulfur |
S |
VI, IV, II |
H2S, SO3 |
|
17 |
Хлор / Chlorine |
Cl |
I, III, V, VII |
HCl, ClF3 |
|
18 |
Аргон / Argon |
Ar |
отсутствует |
— |
|
19 |
Калий / Potassium |
K |
I |
KBr |
|
20 |
Кальций / Calcium |
Ca |
II |
CaH2 |
|
21 |
Скандий / Scandium |
Sc |
III |
Sc2S3 |
|
22 |
Титан / Titanium |
Ti |
II, III, IV |
Ti2O3, TiH4 |
|
23 |
Ванадий / Vanadium |
V |
II, III, IV, V |
VF5, V2O3 |
|
24 |
Хром / Chromium |
Cr |
II, III, VI |
CrCl2, CrO3 |
|
25 |
Марганец / Manganese |
Mn |
II, III, IV, VI, VII |
Mn2O7, Mn2(SO4)3 |
|
26 |
Железо / Iron |
Fe |
II, III |
FeSO4, FeBr3 |
|
27 |
Кобальт / Cobalt |
Co |
II, III |
CoI2, Co2S3 |
|
28 |
Никель / Nickel |
Ni |
II, III, IV |
NiS, Ni(CO)4 |
|
29 |
Медь / Copper |
Сu |
I, II |
CuS, Cu2O |
|
30 |
Цинк / Zinc |
Zn |
II |
ZnCl2 |
|
31 |
Галлий / Gallium |
Ga |
III |
Ga(OH)3 |
|
32 |
Германий / Germanium |
Ge |
II, IV |
GeBr4, Ge(OH)2 |
|
33 |
Мышьяк / Arsenic |
As |
III, V |
As2S5, H3AsO4 |
|
34 |
Селен / Selenium |
Se |
II, IV, VI, |
H2SeO3 |
|
35 |
Бром / Bromine |
Br |
I, III, V, VII |
HBrO3 |
|
36 |
Криптон / Krypton |
Kr |
VI, IV, II |
KrF2, BaKrO4 |
|
37 |
Рубидий / Rubidium |
Rb |
I |
RbH |
|
38 |
Стронций / Strontium |
Sr |
II |
SrSO4 |
|
39 |
Иттрий / Yttrium |
Y |
III |
Y2O3 |
|
40 |
Цирконий / Zirconium |
Zr |
II, III, IV |
ZrI4, ZrCl2 |
|
41 |
Ниобий / Niobium |
Nb |
I, II, III, IV, V |
NbBr5 |
|
42 |
Молибден / Molybdenum |
Mo |
II, III, IV, V, VI |
Mo2O5, MoF6 |
|
43 |
Технеций / Technetium |
Tc |
I — VII |
Tc2S7 |
|
44 |
Рутений / Ruthenium |
Ru |
II — VIII |
RuO4, RuF5, RuBr3 |
|
45 |
Родий / Rhodium |
Rh |
I, II, III, IV, V |
RhS, RhF3 |
|
46 |
Палладий / Palladium |
Pd |
I, II, III, IV |
Pd2S, PdS2 |
|
47 |
Серебро / Silver |
Ag |
I, II, III |
AgO, AgF2, AgNO3 |
|
48 |
Кадмий / Cadmium |
Cd |
II |
CdCl2 |
|
49 |
Индий / Indium |
In |
III |
In2O3 |
|
50 |
Олово / Tin |
Sn |
II, IV |
SnBr4, SnF2 |
|
51 |
Сурьма / Antimony |
Sb |
III, V |
SbF5, SbH3 |
|
52 |
Теллур / Tellurium |
Te |
VI, IV, II |
TeH2, H6TeO6 |
|
53 |
Иод / Iodine |
I |
I, III, V, VII |
HIO3, HI |
|
54 |
Ксенон / Xenon |
Xe |
II, IV, VI, VIII |
XeF6, XeO4, XeF2 |
|
55 |
Цезий / Cesium |
Cs |
I |
CsCl |
|
56 |
Барий / Barium |
Ba |
II |
Ba(OH)2 |
|
57 |
Лантан / Lanthanum |
La |
III |
LaH3 |
|
58 |
Церий / Cerium |
Ce |
III, IV |
CeO2 , CeF3 |
|
59 |
Празеодим / Praseodymium |
Pr |
III, IV |
PrF4, PrO2 |
|
60 |
Неодим / Neodymium |
Nd |
III |
Nd2O3 |
|
61 |
Прометий / Promethium |
Pm |
III |
Pm2O3 |
|
62 |
Самарий / Samarium |
Sm |
II, III |
SmO |
|
63 |
Европий / Europium |
Eu |
II, III |
EuSO4 |
|
64 |
Гадолиний / Gadolinium |
Gd |
III |
GdCl3 |
|
65 |
Тербий / Terbium |
Tb |
III, IV |
TbF4, TbCl3 |
|
66 |
Диспрозий / Dysprosium |
Dy |
III |
Dy2O3 |
|
67 |
Гольмий / Holmium |
Ho |
III |
Ho2O3 |
|
68 |
Эрбий / Erbium |
Er |
III |
Er2O3 |
|
69 |
Тулий / Thulium |
Tm |
II, III |
Tm2O3 |
|
70 |
Иттербий / Ytterbium |
Yb |
II, III |
YO |
|
71 |
Лютеций / Lutetium |
Lu |
III |
LuF3 |
|
72 |
Гафний / Hafnium |
Hf |
II, III, IV |
HfBr3, HfCl4 |
|
73 |
Тантал / Tantalum |
Ta |
I — V |
TaCl5, TaBr2, TaCl4 |
|
74 |
Вольфрам / Tungsten |
W |
II — VI |
WBr6, Na2WO4 |
|
75 |
Рений / Rhenium |
Re |
I — VII |
Re2S7, Re2O5 |
|
76 |
Осмий / Osmium |
Os |
II — VI, VIII |
OsF8, OsI2, Os2O3 |
|
77 |
Иридий / Iridium |
Ir |
I — VI |
IrS3, IrF4 |
|
78 |
Платина / Platinum |
Pt |
I, II, III, IV, V |
Pt(SO4)3, PtBr4 |
|
79 |
Золото / Gold |
Au |
I, II, III |
AuH, Au2O3, Au2Cl6 |
|
80 |
Ртуть / Mercury |
Hg |
II |
HgF2, HgBr2 |
|
81 |
Талий / Thallium |
Tl |
I, III |
TlCl3, TlF |
|
82 |
Свинец / Lead |
Pb |
II, IV |
PbS, PbH4 |
|
83 |
Висмут / Bismuth |
Bi |
III, V |
BiF5, Bi2S3 |
|
84 |
Полоний / Polonium |
Po |
VI, IV, II |
PoCl4, PoO3 |
|
85 |
Астат / Astatine |
At |
нет данных |
— |
|
86 |
Радон / Radon |
Rn |
отсутствует |
— |
|
87 |
Франций / Francium |
Fr |
I |
— |
|
88 |
Радий / Radium |
Ra |
II |
RaBr2 |
|
89 |
Актиний / Actinium |
Ac |
III |
AcCl3 |
|
90 |
Торий / Thorium |
Th |
II, III, IV |
ThO2, ThF4 |
|
91 |
Проактиний / Protactinium |
Pa |
IV, V |
PaCl5, PaF4 |
|
92 |
Уран / Uranium |
U |
III, IV |
UF4, UO3 |
|
93 |
Нептуний |
Np |
III — VI |
NpF6, NpCl4 |
|
94 |
Плутоний |
Pu |
II, III, IV |
PuO2, PuF3, PuF4 |
|
95 |
Америций |
Am |
III — VI |
AmF3, AmO2 |
|
96 |
Кюрий |
Cm |
III, IV |
CmO2, Cm2O3 |
|
97 |
Берклий |
Bk |
III, IV |
BkF3, BkO2 |
|
98 |
Калифорний |
Cf |
II, III, IV |
Cf2O3 |
|
99 |
Эйнштейний |
Es |
II, III |
EsF3 |
|
100 |
Фермий |
Fm |
II, III |
— |
|
101 |
Менделевий |
Md |
II, III |
— |
|
102 |
Нобелий |
No |
II, III |
— |
|
103 |
Лоуренсий |
Lr |
III |
— |
|
Номер |
Элемент |
Символ |
Валентность химических элементов |
Пример |
Поделитесь ссылкой с друзьями:
Похожие таблицы
Комментарии:
Натрий в таблице менделеева занимает 11 место, в 3 периоде.
| Символ | Na |
| Номер | 11 |
| Атомный вес | 22.9897693 |
| Латинское название | Natrium |
| Русское название | Натрий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема натрия
Na: 1s2 2s2 2p6 3s1
Короткая запись:
Na: [Ne]3s1
Одинаковую электронную конфигурацию имеют
атом натрия и
Si+3, P+4, S+5, Cl+6
Порядок заполнения оболочек атома натрия (Na) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ – до 6, на
‘d’ – до 10 и на ‘f’ до 14
Натрий имеет 11 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
1 электрон на 3s-подуровне
Степень окисления натрия
Атомы натрия в соединениях имеют степени окисления 1, -1.
Степень окисления – это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы натрия
Валентность Na
Атомы натрия в соединениях проявляют валентность I.
Валентность натрия характеризует способность атома Na к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Na
Квантовые числа определяются последним электроном в конфигурации,
для атома Na эти числа имеют значение N = 3, L = 0, Ml = 0, Ms = +½
Видео заполнения электронной конфигурации (gif):
Результат:

Соединения натрия
| Тип | Формула | Название |
|---|---|---|
| Соль | NaHCO3 | Пищевая сода |
| Основание | NaOH | Гидроксид натрия |
| Минерал | FeCr2O4 | Хромит |
Энергия ионизации
Чем ближе электрон к центру атома – тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации – это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Na:
Eo = 495 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Na в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
На уроках химии вы уже познакомились с понятием валентности химических элементов. Мы собрали в одном месте всю полезную информацию по этому вопросу. Используйте ее, когда будете готовиться к ГИА и ЕГЭ.
Валентность и химический анализ
Валентность – способность атомов химических элементов вступать в химические соединения с атомами других элементов. Другими словами, это способность атома образовывать определенное число химических связей с другими атомами.
С латыни слово «валентность» переводится как «сила, способность». Очень верное название, правда?
Понятие «валентность» – одно из основных в химии. Было введено еще до того, как ученым стало известно строение атома (в далеком 1853 году). Поэтому по мере изучения строения атома пережило некоторые изменения.
Так, с точки зрения электронной теории валентность напрямую связана с числом внешних электронов атома элемента. Это значит, что под «валентностью» подразумевают число электронных пар, которыми атом связан с другими атомами.
Зная это, ученые смогли описать природу химической связи. Она заключается в том, что пара атомов вещества делит между собой пару валентных электронов.
Вы спросите, как же химики 19 века смогли описать валентность еще тогда, когда считали, что мельче атома частиц не бывает? Нельзя сказать, что это было так уж просто – они опирались на химический анализ.
Путем химического анализа ученые прошлого определяли состав химического соединения: сколько атомов различных элементов содержится в молекуле рассматриваемого вещества. Для этого нужно было определить, какова точная масса каждого элемента в образце чистого (без примесей) вещества.
Правда, метод этот не без изъянов. Потому что определить подобным образом валентность элемента можно только в его простом соединении со всегда одновалентным водородом (гидрид) или всегда двухвалентным кислородом (оксид). К примеру, валентность азота в NH3 – III, поскольку один атом водорода связан с тремя атомами азота. А валентность углерода в метане (СН4), по тому же принципу, – IV.
Этот метод для определения валентности годится только для простых веществ. А вот в кислотах таким образом мы можем только определить валентность соединений вроде кислотных остатков, но не всех элементов (кроме известной нам валентности водорода) по отдельности.
Как вы уже обратили внимание, обозначается валентность римскими цифрами.
Валентность и кислоты
Поскольку валентность водорода остается неизменной и хорошо вам известна, вы легко сможете определить и валентность кислотного остатка. Так, к примеру, в H2SO3 валентность SO3 – I, в HСlO3 валентность СlO3 – I.
Аналогчиным образом, если известна валентность кислотного остатка, несложно записать правильную формулу кислоты: NO2(I) – HNO2, S4O6 (II) – H2 S4O6.
Валентность и формулы
Понятие валентности имеет смысл только для веществ молекулярной природы и не слишком подходит для описания химических связей в соединениях кластерной, ионной, кристаллической природы и т.п.
Индексы в молекулярных формулах веществ отражают количество атомов элементов, которые входят в их состав. Правильно расставить индексы помогает знание валентности элементов. Таким же образом, глядя на молекулярную формулу и индексы, вы можете назвать валентности входящих в состав элементов.
Вы выполняете такие задания на уроках химии в школе. Например, имея химическую формулу вещества, в котором известна валентность одного из элементов, можно легко определить валентность другого элемента.
Для этого нужно только запомнить, что в веществе молекулярной природы число валентностей обоих элементов равны. Поэтому используйте наименьшее общее кратное (соответсвует числу свободных валентностей, необходимых для соединения), чтобы определить неизвестную вам валентность элемента.
Чтобы было понятно, возьмем формулу оксида железа Fe2O3. Здесь в образовании химической связи участвуют два атома железа с валентностью III и 3 атома кислорода с валентностью II. Наименьшим общим кратным для них является 6.
- Пример: у вас есть формулы Mn2O7. Вам известна валентность кислорода, легко вычислить, что наименьше общее кратное – 14, откуда валентность Mn – VII.
Аналогичным образом можно поступить и наоборот: записать правильную химическую формулу вещества, зная валентности входящих в него элементов.
- Пример: чтобы правильно записать формулу оксида фосфора, учтем валентность кислорода (II) и фосфора (V). Значит, наименьшее общее кратное для Р и О – 10. Следовательно, формула имеет следующий вид: Р2О5.
Хорошо зная свойства элементов, которые они проявляют в различных соединениях, можно определить их валентность даже по внешнему виду таких соединений.
Например: оксиды меди имеют красную (Cu2O) и черную (CuО) окраску. Гидроксиды меди окрашены в желтый (CuОН) и синий (Cu(ОН)2) цвета.
А чтобы ковалентные связи в веществах стали для вас более наглядными и понятными, напишите их структурные формулы. Черточки между элементами изображают возникающие между их атомами связи (валентности):
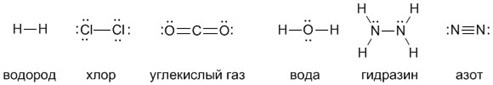
Характеристики валентности
Сегодня определение валентности элементов базируется на знаниях о строении внешних электронных оболочек их атомов.
Валентность может быть:
- постоянной (металлы главных подгрупп);
- переменной (неметаллы и металлы побочных групп):
- высшая валентность;
- низшая валентность.
Постоянной в различных химических соединениях остается:
- валентность водорода, натрия, калия, фтора (I);
- валентность кислорода, магния, кальция, цинка (II);
- валентность алюминия (III).
А вот валентность железа и меди, брома и хлора, а также многих других элементов изменяется, когда они образуют различные химические соедения.
Валентность и электронная теория
В рамках электронной теории валентность атома определеяется на основании числа непарных электронов, которые участвуют в образовании электронных пар с электронами других атомов.
В образовании химических связей участвуют только электроны, находящиеся на внешней оболочке атома. Поэтому максимальная валентность химического элемента – это число электронов во внешней электронной оболочке его атома.
Понятие валентности тесно связано с Периодическим законом, открытым Д. И. Менделеевым. Если вы внимательно посмотрите на таблицу Менделеева, легко сможете заметить: положение элемента в перодической системе и его валентность неравзрывно связаны. Высшая валентность элементов, которые относятся к одной и тоже группе, соответсвует порядковому номеру группы в периодичнеской системе.
Низшую валентность вы узнаете, когда от числа групп в таблице Менделеева (их восемь) отнимете номер группы элемента, который вас интересует.
Например, валентность многих металлов совпадает с номерами групп в таблице периодических элементов, к которым они относятся.
Таблица валентности химических элементов
|
Порядковый номер хим. элемента (атомный номер)
|
Наименование |
Химический символ |
Валентность |
| 1
2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 |
Водород / Hydrogen
Гелий / Helium Литий / Lithium Бериллий / Beryllium Бор / Boron Углерод / Carbon Азот / Nitrogen Кислород / Oxygen Фтор / Fluorine Неон / Neon Натрий / Sodium Магний / Magnesium Алюминий / Aluminum Кремний / Silicon Фосфор / Phosphorus Сера / Sulfur Хлор / Chlorine Аргон / Argon Калий / Potassium Кальций / Calcium Скандий / Scandium Титан / Titanium Ванадий / Vanadium Хром / Chromium Марганец / Manganese Железо / Iron Кобальт / Cobalt Никель / Nickel Медь / Copper Цинк / Zinc Галлий / Gallium Германий /Germanium Мышьяк / Arsenic Селен / Selenium Бром / Bromine Криптон / Krypton Рубидий / Rubidium Стронций / Strontium Иттрий / Yttrium Цирконий / Zirconium Ниобий / Niobium Молибден / Molybdenum Технеций / Technetium Рутений / Ruthenium Родий / Rhodium Палладий / Palladium Серебро / Silver Кадмий / Cadmium Индий / Indium Олово / Tin Сурьма / Antimony Теллур / Tellurium Иод / Iodine Ксенон / Xenon Цезий / Cesium Барий / Barium Лантан / Lanthanum Церий / Cerium Празеодим / Praseodymium Неодим / Neodymium Прометий / Promethium Самарий / Samarium Европий / Europium Гадолиний / Gadolinium Тербий / Terbium Диспрозий / Dysprosium Гольмий / Holmium Эрбий / Erbium Тулий / Thulium Иттербий / Ytterbium Лютеций / Lutetium Гафний / Hafnium Тантал / Tantalum Вольфрам / Tungsten Рений / Rhenium Осмий / Osmium Иридий / Iridium Платина / Platinum Золото / Gold Ртуть / Mercury Талий / Thallium Свинец / Lead Висмут / Bismuth Полоний / Polonium Астат / Astatine Радон / Radon Франций / Francium Радий / Radium Актиний / Actinium Торий / Thorium Проактиний / Protactinium Уран / Uranium |
H
He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Сu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Ac Th Pa U |
I
0 I II III (II), IV (I), II, III, IV, V II I 0 I II III (II), IV I, III, V II, IV, VI I, (II), III, (IV), V, VII 0 I II III II, III, IV II, III, IV, V II, III, VI II, (III), IV, VI, VII II, III, (IV), VI II, III, (IV) (I), II, (III), (IV) I, II, (III) II (II), III II, IV (II), III, V (II), IV, VI I, (III), (IV), V 0 I II III (II), (III), IV (II), III, (IV), V (II), III, (IV), (V), VI VI (II), III, IV, (VI), (VII), VIII (II), (III), IV, (VI) II, IV, (VI) I, (II), (III) (I), II (I), (II), III II, IV III, (IV), V (II), IV, VI I, (III), (IV), V, VII 0 I II III III, IV III III, IV III (II), III (II), III III III, IV III III III (II), III (II), III III IV (III), (IV), V (II), (III), (IV), (V), VI (I), II, (III), IV, (V), VI, VII (II), III, IV, VI, VIII (I), (II), III, IV, VI (I), II, (III), IV, VI I, (II), III I, II I, (II), III II, IV (II), III, (IV), (V) II, IV, (VI) нет данных 0 нет данных II III IV V (II), III, IV, (V), VI |
В скобках даны те валентности, которые обладающие ими элементы проявляют редко.
Валентность и степень окисления
Понятие валентности можно считать родственным такой характеристике, как степень окисления. Тем не менее, обе эти характеристики не тождественным друг другу.
Так, говоря о степени окисления, подразумевают, что атом в веществе ионной (что важно) природы имеет некий условный заряд. И если валентность – это нейтральная характеристика, то степень окисления может быть отрицательной, положительной или равной нулю.
Интересно, что для атома одного и того же элемента, в зависимости от элементов, с которыми он образует химическое соединение, валентность и степень окисления могут совпадать (Н2О, СН4 и др.) и различаться (Н2О2, HNO3).
Заключение
Углубляя свои знания о строении атомов, вы глубже и подробнее узнаете и валентность. Эта характеристика химических элементов не является исчерпывающей. Но у нее большое прикладное значение. В чем вы сами не раз убедились, решая задачи и проводя химические опыты на уроках.
Эта статья создана, чтобы помочь вам систематизировать свои знания о валентности. А также напомнить, как можно ее определить и где валентность находит применение.
Надеемся, этот материал окажется для вас полезным при подготовке домашних заданий и самоподготовке к контрольным и экзаменам.
Не забудьте поделиться ссылкой с друзьями в социальных сетях, чтобы они тоже могли воспользоваться этой полезной информацией.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Валентность натрия.
Валентность натрия
Натрий, свойства атома, химические и физические свойства
Таблица химических элементов Д.И. Менделеева
Валентность натрия:
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Валентность натрия равна I. Натрий проявляет постоянную валентность.
Все свойства атома натрия
Натрий проявляет валентность I в следующих своих соединениях:
Азид натрия (тринитрид натрия) NaN3
Альгинат натрия (альгиновокислый натрий) C6H7O6Na)n
Алюминат натрия (метаалюминат натрия) NaAlO2
Алюмонатриевые квасцы (сульфат алюминия-натрия, сернокислый алюминий-натрий) NaAl(SO4)2
Амид натрия NaNH2
Антимонат натрия (метасурьмянокислый натрий) NaSbO3
Антимонит натрия (сурьмянистокислый натрий) NaSbO2
Арсенат натрия (мышьяковокислый натрий) Na3AsO4
Арсенид тринатрия (мышьяковистый натрий) Na3As
Аскорбат натрия (аскорбиновокислый натрий) C6H7O6Na
Аурат натрия Na[AuO2]
Ацетат натрия (уксуснокислый натрий) CH3COONa
Ацетиленид натрия (этинилнатрий) NaHC2
Бензоат натрия (бензойнокислый натрий) C6H5COONa
Борогидрид натрия (тетрагидридоборат натрия) NaBH4
Бромат натрия (бромноватокислый натрий) NaBrO3
Бромид натрия (бромистый натрий) NaBr
Вольфрамат натрия (вольфрамовокислый натрий) Na2WO4
Гексагидроксохромат III натрия Na3[Сr(OH)6]
Гексатиоцианатоферрат III натрия Na3[Fe(SCN)6]
Гексафосфат натрия (гексаметафосфат натрия) Na6P6O18
Гексафторосиликат натрия (кремнефтористый натрий) Na2[SiF6]
Гексацианоферрат II натрия (гексацианоферроат натрия) Na4[Fe(CN)6]
Гексацианоферрат III натрия (гексацианоферриат натрия) Na3[Fe(CN)6]
Гептагидроксоферрат III натрия Na4[Fe(OH)7]
Гидрид натрия (водородистый натрий) NaH
Гидроарсенат натрия (мышьяковокислый кислый натрий) Na2HAsO4
Гидроарсенит натрия (мышьяковистокислый кислый натрий) Na2HAsO3
Гидрокарбонат натрия (двууглекислый натрий, сода пищевая) NaHCO3
Гидроксид натрия (каустическая сода, едкий натр, натрия гидроокись) NaOH
Гидросульфид натрия (сернистый кислый натрий) NaHS
Гипофосфат натрия (фосфорноватокислый натрий) Na4P2O6
Гипофосфит натрия (фосфорноватистокислый натрий, фосфинат натрия) Na(PH2O2)
Гипохлорит натрия (хлорноватистокислый натрий, жавелевая вода, лабарракова вода) NaOCl
Гликолят натрия (оксиацетат натрия) NaC2H3O3
Глутамат натрия (глютамат натрия, глютамат натрия) C5H8NO4Na·H2O
Глюконат натрия NaC6H11O7
Дигидрофосфат натрия (дигидроортофосфат натрия) NaH2PO4
Диселенид натрия (диселенистый натрий) Na2Se2
Диселенит натрия (селенистокислый натрий) Na2Se2O5
Дисульфид натрия (динатрийдисульфан) Na2S2
Дитионат натрия (дитионовокислый натрий) Na2S2O6
Дитиохромат III натрия (дитиохромит натрия) NaCrS2
Дихромат натрия (двухромовокислый натрий, бихромат натрия) Na2Cr2O7
Инозинат натрия C10H11N4Na2O8P
Йодат натрия (йодноватокислый натрий) NaIO3
Йодид натрия (йодистый натрий) NaI
Карбонат натрия (натрий углекислый, кальцинированная сода) Na2CO3
Лактат натрия (молочнокислый натрий) NaC3H5O3
Лауретсульфат натрия (лаурет) C12+2nH25+4nNaO4+nS
Лаурилсульфат натрия (додецилсульфат натрия) C12H25SO4Na
Манганат натрия (марганцовистокислый натрий) Na2MnO4
Метаборат натрия (метаборат натрия) NaBO2
Метаванадат натрия (ванадиевокислый натрий) NaVO3
Метависмутат натрия (висмутовокислый натрий) NaBiO3
Метасиликат натрия (кремнекислый натрий) Na2SiO3
Метафосфат натрия (фосфорнокислый натрий) NaPO3
Молибдат натрия (молибденовокислый натрий) Na2MoO4
Нитрат натрия (азотнокислый натрий, натриевая селитра) NaNO3
Нитрид натрия (азотистый натрий) Na3N
Нитрит натрия (азотистокислый натрий) NaNO2
Оксалат натрия (щавелевокислый натрий) Na2C2O4
Оксид натрия (окись натрия) Na2O
Олеат натрия (олеиновокислый натрий) NaC18H33O2
Ортованадат натрия (ортованадат натрия) Na3VO4
Пальмитат натрия (пальмитиновокислый натрий) NaC16H31O2
Пентаборат натрия (борнокислый натрий) NaB5O8
Пентасульфид натрия (динатрийпентасульфан) Na2S5
Перборат натрия (надборнокислый натрий) NaBO3
Перкарбонат натрия (гидропероксосольват карбоната натрия) Na2CO3·1,5H2O2
Перманганат натрия (марганцовокислый натрий) NaMnO4
Пероксодисульфат натрия (надсернокислый натрий) Na2S2O8
Перренат натрия (рениевокислый натрий) NaReO4
Перхлорат натрия (хлорнокислый натрий) NaClO4
Перхромат натрия (надхромовокислый натрий) Na3CrO8
Пиросульфат натрия (дисульфат натрия) Na2S2O7
Пиросульфит натрия (метабисульфит натрия) Na2(SO2SO3)
Пирофосфат натрия (пирофосфат натрия) Na4P2O7
Полиакрилат натрия (полиакрилат натрия) [-CH2-CH(COONa)-]n
Пропионат натрия (CH3CH2COONa) пропионовокислый натрий
Родизонат натрия (родизонат натрия) Na2C6O6
Салицилат натрия (салицилат натрия) C7H5NaO3
Саркозинат натрия (метиламиноацетат натрия) CH3NHCH2COONa
Селенат натрия (селеновокислый натрий) Na2SeO4
Селенид натрия (селенистый натрий) Na2Se
Селенит натрия (селенистокислый натрий) Na2SeO3
Силицид натрия (кремнистый натрий) NaSi
Сорбат натрия (сорбат натрия) C6H7NaO2
Стеарат натрия (стеариновокислый натрий) NaC18H35O2
Сукцинат натрия (янтарнокислый натрий) Na2C4H4O4
Сульфат натрия (сернокислый натрий) Na2SO4
Сульфид натрия (сернистый натрий) Na2S
Сульфит натрия (сернистокислый натрий) Na2SO3
Тартрат натрия (виннокислый натрий) Na2C4H4O6
Тетраборат натрия (тетраборнокислый натрий, бура) Na2B4O7
Тетрасульфид натрия (тетрасульфид натрия) Na2S4
Тиосульфат натрия (гипосульфит натрия) Na2S2O3
Тиоцианат натрия (роданистый натрий) NaSCN
Титанат натрия (титановокислый натрий) Na2TiO3
Трифосфат натрия Na5P3O10
Формиат натрия (муравьинокислый натрий) HCO2Na
Фосфид натрия (фосфористый натрий) Na3P
Фосфат натрия (натрий фосфорнокислый трёхзамещенный, ортофосфат натрия) Na3PO4
Фосфит натрия (фосфористокислый натрий) Na2(PHO3)
Фторид натрия (фтористый натрий) NaF
Хлорат натрия (хлорноватокислый натрий) NaClO3
Хлорацетат натрия (хлоруксуснокислый натрий) NaC2H2ClO2
Хлорид магния-натрия (хлористые магний-натрий) NaMgCl3
Хлорид натрия (хлористый натрий) NaCl
Хлорит натрия (хлористокислый натрий) NaClO2
Хромат натрия (хромовокислый натрий) Na2CrO4
Цианат натрия (циановокислый натрий) NaOCN
Цианид натрия (цианистый натрий) NaCN
Цинкат натрия (цинкат натрия) Na2ZnO2
Цирконат натрия (циркониевокислый натрий) Na2ZrO3
Цитрат натрия (лимоннокислый натрий) Na3C6H5O7
Этилат натрия (этоксид натрия) NaC2H5O
Источник: https://ru.wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности
477

