На уроках химии вы уже познакомились с понятием валентности химических элементов. Мы собрали в одном месте всю полезную информацию по этому вопросу. Используйте ее, когда будете готовиться к ГИА и ЕГЭ.
Валентность и химический анализ
Валентность – способность атомов химических элементов вступать в химические соединения с атомами других элементов. Другими словами, это способность атома образовывать определенное число химических связей с другими атомами.
С латыни слово «валентность» переводится как «сила, способность». Очень верное название, правда?
Понятие «валентность» – одно из основных в химии. Было введено еще до того, как ученым стало известно строение атома (в далеком 1853 году). Поэтому по мере изучения строения атома пережило некоторые изменения.
Так, с точки зрения электронной теории валентность напрямую связана с числом внешних электронов атома элемента. Это значит, что под «валентностью» подразумевают число электронных пар, которыми атом связан с другими атомами.
Зная это, ученые смогли описать природу химической связи. Она заключается в том, что пара атомов вещества делит между собой пару валентных электронов.
Вы спросите, как же химики 19 века смогли описать валентность еще тогда, когда считали, что мельче атома частиц не бывает? Нельзя сказать, что это было так уж просто – они опирались на химический анализ.
Путем химического анализа ученые прошлого определяли состав химического соединения: сколько атомов различных элементов содержится в молекуле рассматриваемого вещества. Для этого нужно было определить, какова точная масса каждого элемента в образце чистого (без примесей) вещества.
Правда, метод этот не без изъянов. Потому что определить подобным образом валентность элемента можно только в его простом соединении со всегда одновалентным водородом (гидрид) или всегда двухвалентным кислородом (оксид). К примеру, валентность азота в NH3 – III, поскольку один атом водорода связан с тремя атомами азота. А валентность углерода в метане (СН4), по тому же принципу, – IV.
Этот метод для определения валентности годится только для простых веществ. А вот в кислотах таким образом мы можем только определить валентность соединений вроде кислотных остатков, но не всех элементов (кроме известной нам валентности водорода) по отдельности.
Как вы уже обратили внимание, обозначается валентность римскими цифрами.
Валентность и кислоты
Поскольку валентность водорода остается неизменной и хорошо вам известна, вы легко сможете определить и валентность кислотного остатка. Так, к примеру, в H2SO3 валентность SO3 – I, в HСlO3 валентность СlO3 – I.
Аналогчиным образом, если известна валентность кислотного остатка, несложно записать правильную формулу кислоты: NO2(I) – HNO2, S4O6 (II) – H2 S4O6.
Валентность и формулы
Понятие валентности имеет смысл только для веществ молекулярной природы и не слишком подходит для описания химических связей в соединениях кластерной, ионной, кристаллической природы и т.п.
Индексы в молекулярных формулах веществ отражают количество атомов элементов, которые входят в их состав. Правильно расставить индексы помогает знание валентности элементов. Таким же образом, глядя на молекулярную формулу и индексы, вы можете назвать валентности входящих в состав элементов.
Вы выполняете такие задания на уроках химии в школе. Например, имея химическую формулу вещества, в котором известна валентность одного из элементов, можно легко определить валентность другого элемента.
Для этого нужно только запомнить, что в веществе молекулярной природы число валентностей обоих элементов равны. Поэтому используйте наименьшее общее кратное (соответсвует числу свободных валентностей, необходимых для соединения), чтобы определить неизвестную вам валентность элемента.
Чтобы было понятно, возьмем формулу оксида железа Fe2O3. Здесь в образовании химической связи участвуют два атома железа с валентностью III и 3 атома кислорода с валентностью II. Наименьшим общим кратным для них является 6.
- Пример: у вас есть формулы Mn2O7. Вам известна валентность кислорода, легко вычислить, что наименьше общее кратное – 14, откуда валентность Mn – VII.
Аналогичным образом можно поступить и наоборот: записать правильную химическую формулу вещества, зная валентности входящих в него элементов.
- Пример: чтобы правильно записать формулу оксида фосфора, учтем валентность кислорода (II) и фосфора (V). Значит, наименьшее общее кратное для Р и О – 10. Следовательно, формула имеет следующий вид: Р2О5.
Хорошо зная свойства элементов, которые они проявляют в различных соединениях, можно определить их валентность даже по внешнему виду таких соединений.
Например: оксиды меди имеют красную (Cu2O) и черную (CuО) окраску. Гидроксиды меди окрашены в желтый (CuОН) и синий (Cu(ОН)2) цвета.
А чтобы ковалентные связи в веществах стали для вас более наглядными и понятными, напишите их структурные формулы. Черточки между элементами изображают возникающие между их атомами связи (валентности):
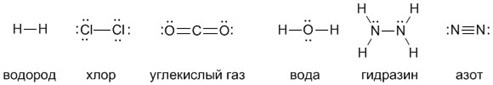
Характеристики валентности
Сегодня определение валентности элементов базируется на знаниях о строении внешних электронных оболочек их атомов.
Валентность может быть:
- постоянной (металлы главных подгрупп);
- переменной (неметаллы и металлы побочных групп):
- высшая валентность;
- низшая валентность.
Постоянной в различных химических соединениях остается:
- валентность водорода, натрия, калия, фтора (I);
- валентность кислорода, магния, кальция, цинка (II);
- валентность алюминия (III).
А вот валентность железа и меди, брома и хлора, а также многих других элементов изменяется, когда они образуют различные химические соедения.
Валентность и электронная теория
В рамках электронной теории валентность атома определеяется на основании числа непарных электронов, которые участвуют в образовании электронных пар с электронами других атомов.
В образовании химических связей участвуют только электроны, находящиеся на внешней оболочке атома. Поэтому максимальная валентность химического элемента – это число электронов во внешней электронной оболочке его атома.
Понятие валентности тесно связано с Периодическим законом, открытым Д. И. Менделеевым. Если вы внимательно посмотрите на таблицу Менделеева, легко сможете заметить: положение элемента в перодической системе и его валентность неравзрывно связаны. Высшая валентность элементов, которые относятся к одной и тоже группе, соответсвует порядковому номеру группы в периодичнеской системе.
Низшую валентность вы узнаете, когда от числа групп в таблице Менделеева (их восемь) отнимете номер группы элемента, который вас интересует.
Например, валентность многих металлов совпадает с номерами групп в таблице периодических элементов, к которым они относятся.
Таблица валентности химических элементов
|
Порядковый номер хим. элемента (атомный номер)
|
Наименование |
Химический символ |
Валентность |
| 1
2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 |
Водород / Hydrogen
Гелий / Helium Литий / Lithium Бериллий / Beryllium Бор / Boron Углерод / Carbon Азот / Nitrogen Кислород / Oxygen Фтор / Fluorine Неон / Neon Натрий / Sodium Магний / Magnesium Алюминий / Aluminum Кремний / Silicon Фосфор / Phosphorus Сера / Sulfur Хлор / Chlorine Аргон / Argon Калий / Potassium Кальций / Calcium Скандий / Scandium Титан / Titanium Ванадий / Vanadium Хром / Chromium Марганец / Manganese Железо / Iron Кобальт / Cobalt Никель / Nickel Медь / Copper Цинк / Zinc Галлий / Gallium Германий /Germanium Мышьяк / Arsenic Селен / Selenium Бром / Bromine Криптон / Krypton Рубидий / Rubidium Стронций / Strontium Иттрий / Yttrium Цирконий / Zirconium Ниобий / Niobium Молибден / Molybdenum Технеций / Technetium Рутений / Ruthenium Родий / Rhodium Палладий / Palladium Серебро / Silver Кадмий / Cadmium Индий / Indium Олово / Tin Сурьма / Antimony Теллур / Tellurium Иод / Iodine Ксенон / Xenon Цезий / Cesium Барий / Barium Лантан / Lanthanum Церий / Cerium Празеодим / Praseodymium Неодим / Neodymium Прометий / Promethium Самарий / Samarium Европий / Europium Гадолиний / Gadolinium Тербий / Terbium Диспрозий / Dysprosium Гольмий / Holmium Эрбий / Erbium Тулий / Thulium Иттербий / Ytterbium Лютеций / Lutetium Гафний / Hafnium Тантал / Tantalum Вольфрам / Tungsten Рений / Rhenium Осмий / Osmium Иридий / Iridium Платина / Platinum Золото / Gold Ртуть / Mercury Талий / Thallium Свинец / Lead Висмут / Bismuth Полоний / Polonium Астат / Astatine Радон / Radon Франций / Francium Радий / Radium Актиний / Actinium Торий / Thorium Проактиний / Protactinium Уран / Uranium |
H
He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Сu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Ac Th Pa U |
I
0 I II III (II), IV (I), II, III, IV, V II I 0 I II III (II), IV I, III, V II, IV, VI I, (II), III, (IV), V, VII 0 I II III II, III, IV II, III, IV, V II, III, VI II, (III), IV, VI, VII II, III, (IV), VI II, III, (IV) (I), II, (III), (IV) I, II, (III) II (II), III II, IV (II), III, V (II), IV, VI I, (III), (IV), V 0 I II III (II), (III), IV (II), III, (IV), V (II), III, (IV), (V), VI VI (II), III, IV, (VI), (VII), VIII (II), (III), IV, (VI) II, IV, (VI) I, (II), (III) (I), II (I), (II), III II, IV III, (IV), V (II), IV, VI I, (III), (IV), V, VII 0 I II III III, IV III III, IV III (II), III (II), III III III, IV III III III (II), III (II), III III IV (III), (IV), V (II), (III), (IV), (V), VI (I), II, (III), IV, (V), VI, VII (II), III, IV, VI, VIII (I), (II), III, IV, VI (I), II, (III), IV, VI I, (II), III I, II I, (II), III II, IV (II), III, (IV), (V) II, IV, (VI) нет данных 0 нет данных II III IV V (II), III, IV, (V), VI |
В скобках даны те валентности, которые обладающие ими элементы проявляют редко.
Валентность и степень окисления
Понятие валентности можно считать родственным такой характеристике, как степень окисления. Тем не менее, обе эти характеристики не тождественным друг другу.
Так, говоря о степени окисления, подразумевают, что атом в веществе ионной (что важно) природы имеет некий условный заряд. И если валентность – это нейтральная характеристика, то степень окисления может быть отрицательной, положительной или равной нулю.
Интересно, что для атома одного и того же элемента, в зависимости от элементов, с которыми он образует химическое соединение, валентность и степень окисления могут совпадать (Н2О, СН4 и др.) и различаться (Н2О2, HNO3).
Заключение
Углубляя свои знания о строении атомов, вы глубже и подробнее узнаете и валентность. Эта характеристика химических элементов не является исчерпывающей. Но у нее большое прикладное значение. В чем вы сами не раз убедились, решая задачи и проводя химические опыты на уроках.
Эта статья создана, чтобы помочь вам систематизировать свои знания о валентности. А также напомнить, как можно ее определить и где валентность находит применение.
Надеемся, этот материал окажется для вас полезным при подготовке домашних заданий и самоподготовке к контрольным и экзаменам.
Не забудьте поделиться ссылкой с друзьями в социальных сетях, чтобы они тоже могли воспользоваться этой полезной информацией.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
При взаимодействии основных оксидов с водой получаются основания. А вот при взаимодействии с водой кислотных оксидов получаются кислоты.
Кислоты – это большой класс химических соединений, в которых есть атом водорода и так называемый кислотный остаток.
Правильно определять кислотные остатки и понимать, как определяется их валентность, просто необходимо, иначе будет сложно составлять формулы солей. Ниже мы поговорим о классификации кислот и узнаём побольше о кислотных остатках.
Классификация кислот
Делить кислоты на группы можно по разным признакам, но нас сейчас будут интересовать два: содержание кислорода и основность.
Классификация кислот по содержанию кислорода
Тут всё просто: в составе некоторых кислот кислород есть (и они называются кислородсодержащими), в составе других кислорода нет (и эти кислоты называют бескислородными).
Примеры кислородсодержащих кислот: серная Н2SO4, фосфорная H3PO4, азотная HNO3.
Примеры бескислородных кислот: сероводородная H2S, соляная HCl, плавиковая HF.
Классификация кислот по основности
Тут мы должны остановиться более подробно.
Основность определяется числом атомов водорода в составе кислоты.
Для того, чтобы узнать основность, нужно взглянуть на формулу. Например, соляная кислота HCl одноосновная, потому что здесь только один атом водорода, сернистая кислота H2SO3 – двухосновная (здесь два атома водорода), а фосфорная H3PO4 – трёхосновная (в формуле три атома водорода). Запомните, как определять основность, тогда вам будет значительно проще составлять формулы солей при составлении химических уравнений.
Теперь давайте уделим внимание второй составной части кислоты – кислотному остатку.
Кислотный остаток – это то, что останется от кислоты, если убрать водород.
То есть, в азотной кислоте HNO3 кислотный остаток -NO3, в сероводородной Н2S кислотный остаток -S, в фосфорной кислоте H3PO4 кислотный остаток – PO4. Обратите внимание, что в кислородсодержащей кислоте остаток кислород содержит, а в бескислородной не содержит.
Валентность кислотного остатка
Говорить о валентности кислотного остатка не совсем корректно, поскольку валентность – это способность атомов образовывать химические связи. Если же речь идёт о кислотном остатке кислородсодержащей кислоты, то у нас имеется группа атомов (например, кислотный остаток –NO3). Но мы всё равно будем говорить о валентности, чтобы проще было составлять формулы.
Итак,
валентность кислотного остатка определяется числом атомов водорода.
Фактически валентность равна основности. Например, у двухосновной серной кислоты H2SO4 есть кислотный остаток –SO4, валентность которого II. И для чего же нам нужно это знание? Давайте рассмотрим примеры.
Пример 1.
Составьте формулу сульфида натрия.
Натрий – металл первой группы с валентностью I. Сульфид – соль сероводородной кислоты H2S. Когда образуется соль (в данной ситуации сульфид натрия), металл замещает водород в кислоте, то есть соль состоит из металла и кислотного остатка. Тогда в сульфиде натрия будут натрий и сера. Сероводородная кислота – двухосновная, поскольку в ней два атома водорода. Следовательно, у кислотного остатка –S валентность II. Составляем формулу, используя знания о валентности:
Ответ: формула сульфида натрия H2S.
Пример 2.
Составьте формулу сульфита калия.
Этот пример посложнее: в нём фигурирует кислородсодержащая двухосновная сернистая кислота H2SO3. Из формулы видно, что валентность кислотного остатка –SO3 будет II. Калий же – металл первой группы, его валентность I. Составляем формулу:
Ответ: формула сульфита калия К2SO3.
Пример 3.
Составьте формулу нитрата кальция.
Итак, нитрат – соль азотной кислоты HNO3. Это одноосновная кислота, поэтому кислотный остаток -NO3 имеет валентность I. Кальций – металл второй группы с валентностью II. Составляем формулу:
Ответ: формула нитрата кальция Ca(NO3)2.
Обратите внимание на очень важный момент! Мы взяли кислотный остаток NO3 в скобки и внизу поставили индекс 2. Это показывает, что в формуле два кислотных остатка! Не забывайте ставить скобки, иначе это будет ошибкой. Фактически в соединении Ca(NO3)2 один атом кальция, два атома азота и шесть атомов кислорода (если раскрыть скобки), но написание CaN2O6 ничего не показывает, а вот из формулы Ca(NO3)2 сразу видно, что у нас имеется атом кальция и два кислотных остатка азотной кислоты.
Пример 4.
В заключение самый сложный пример от репетитора по химии. Нужно составить формулу фосфата магния.
Магний – металл второй группы, его валентность II. Фосфат – соль фосфорной кислоты H3PO4. Здесь кислотный остаток PO4 и его валентность III. Составляем формулу:
Формула выглядит громоздко, но она всё предельно точно рассказывает о составе вещества: в фосфате магния имеется три атома магния и два кислотных остатка фосфорной кислоты.
Ответ: формула фосфата магния Мg3(PO4)2.
Кстати, кислоты реагируют с металлами, но не всеми. Об этом читайте в тексте «Химические свойства кислот».
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Валентность
Слово «валентность» звучит красиво и одновременно загадочно. В этой статье вместе с экспертом разберемся, что скрывается за этим словом: что такое валентность, как ее определить и какова ее роль в химии

Термин «валентность» появился еще в Средние века, где в научных трудах он имел значение «препарат», «экстракт». И только в конце ХIХ столетия его стали использовать для обозначения связей между мельчайшими частицами вещества.
В 1852 году английский химик Э. Франкленд ввел в химию понятие «соединительная сила», которое положило начало учению о валентности. В 1857 году немецкий ученый Ф. А. Кекуле, изучая свойства углерода в метане, пришел к выводу о существовании «основности» атомов – таком же важном и постоянном свойстве, как атомный вес. Спустя три года российский химик А. М. Бутлеров усовершенствовал учение о валентности, распространив его на органические соединения.
Что такое валентность в химии
Валентность – это способность атома образовывать химические связи с другими атомами. Такие связи создаются за счет электронов, расположенных на внешнем электронном слое. Поэтому количественной мерой валентности становится число совместных связей между атомами.
Химические соединения предполагают формирование общих электронных пар. Этот процесс получил наименование «ковалентная химическая связь». В зависимости от числа общих электронных пар выделяют одинарную, двойную и тройную ковалентную связь.
Большим достижением в химии стало наглядное изображение молекул, с помощью которого легко представить себе понятие валентности и ковалентной связи. К примеру, водород имеет сокращенную химическую формулу H₂ и структурную формулу: Н – Н. Во втором случае видно, что водород обладает одновалентностью, поскольку связан в молекуле только с одним своим собратом.
Формула воды H₂O и Н – О – Н наглядно свидетельствует о двухвалентности кислорода, так как он способен создавать две ковалентные связи с атомами водорода.
Углекислый газ CO₂ и О = С = О состоит из двух атомов кислорода и атома углерода, у которого валентность равна четырем. Он может присоединять 2 двухвалентных атома кислорода либо 4 одновалентных атома водорода, как в метане СН₄.
Таблица Менделеева
Рассказываем, как пользоваться таблицей, а также даем советы, как ее быстро выучить
подробнее

Как определить валентность химических элементов
Существуют разные способы определения валентности химических элементов. Самый простой заключается в том, чтобы обратиться к специальной таблице валентности химических элементов.
Другой способ связан с расчетом валентности по химической формуле. За единицу валентности принимается валентность атома водорода, так как он способен образовывать с другими атомами только одну связь. Химические элементы, взаимодействуя с водородом, показывают собственную валентность. Например, в молекуле хлористого водорода (HCl) хлор имеет валентность I. В молекуле аммиака (NН₃) азот соединен с тремя атомами водорода, следовательно, его валентность – III.
Кроме водорода, валентность химических элементов можно определять по кислороду, который во всех своих соединениях двухвалентен. Так, в оксиде серы (IV) SO₂ валентность серы равна IV (валентность кислорода умножаем на 2). А в соединении SO₃ валентность серы уже VI (два умножаем на три).
Когда речь идет о сложных соединениях, где присутствует более двух химических элементов, определить валентность каждого из них становится сложнее. О молекуле HClO₄ можно только сказать, что остаток ClO₄ одновалентен, а в соединении H₂SO₄ остаток SO₄ двухвалентен.

Таблица валентности химических элементов
Приведем в качестве примера таблицу валентности наиболее распространенных химических элементов. Звездочкой отмечены элементы с постоянной валентностью.
| Элемент | Валентность | Элемент | Валентность |
|---|---|---|---|
| Водород (H)* | I | Барий (Ba)* | II |
| Натрий (Na)* | I | Кислород (O)* | II |
| Калий (K)* | I | Цинк (Zn) | II |
| Серебро (Ag)* | I | Олово (Sn) | II (IV) |
| Фтор (F)* | I | Свинец (Pb) | II (IV) |
| Хлор (Cl) | I (III, V, VII) | Железо (Fe) | II, III |
| Бром (Br) | I (III, V, VII) | Сера (S) | II, IV, VI |
| Йод (I) | I (III, V, VII) | Марганец (Mn) | II, IV, VII |
| Ртуть (Hg) | I, II | Хром (Cr) | III, VI |
| Медь (Cu) | I, II | Алюминий (Al)* | III |
| Бериллий (Be)* | II | Азот (N) | III (и другие) |
| Магний (Mg)* | II | Фосфор (P) | III, V |
| Кальций (Ca)* | II | Углерод (C) | IV |
| Кремний (Si) | IV (II) | Цирконий (Zr) | II, III, IV |
Популярные вопросы и ответы
Отвечает Анастасия Чистякова, старший методист по естественно-научному направлению Домашней школы «ИнтернетУрок».
Что такое постоянная валентность?
В таблице Менделеева существуют так называемые элементы с постоянной валентностью. Свое название они получили из-за способности образовывать строго определенное количество химических связей. Постоянная валентность чаще всего совпадает с номером группы, где находится элемент. Таких элементов сравнительно немного, поэтому их можно легко запомнить.
Постоянную валентность I (могут присоединять или замещать только один атом другого элемента) имеют щелочные металлы (Li, Na, K, Rb, Cs, Fr) и фтор (F).
Постоянную валентность II (способность присоединить или заместить только два атома других элементов) имеют металлы второй группы, главной подгруппы (Be, Mg, Ca, Sr, Ba, Ra) и кислород (O).
Постоянную валентность III имеет всего лишь один элемент – алюминий (Al), так как только он способен присоединить либо заместить три атома других химических элементов.
Как определить валентность по таблице Менделеева?
Большинство химических элементов обладают переменной валентностью, и ее можно определить по таблице Менделеева. В этой таблице номер группы соответствует высшей валентности элемента. Если от восьми отнять номер группы, где находится элемент, мы узнаем его низшую валентность. Например, высшая валентность серы (S) – 6, так как она находится в шестой группе, а низшая – 2 (8 — 6 = 2).
Правда, бывают и исключения, которые нужно запомнить. Кремний (Si) находится в IV группе, и можно сделать предположение, что его низшая валентность – IV. Однако это не так. Низшая валентность кремния – II. Азот (N) расположен в V группе, но его низшая валентность также II.
Чем валентность отличается от степени окисления?
Понятия «валентность» и «степень окисления» являются близкими по своему значению, но далеко не тождественными. Валентность определяет количество химических связей, которыми атом элемента связан с другими атомами в молекуле. Степень окисления используется для описания тех реакций, которые сопровождаются присоединением либо отдачей электронов.
Валентность нейтральна, а степень окисления может быть положительной, отрицательной или нулевой. Положительная степень окисления соответствует количеству отданных электронов, отрицательная – числу присоединенных. Нулевая степень окисления говорит о том, что данный элемент находится или в состоянии простого вещества, или был восстановлен до нуля после окисления, или окислен до нуля после предшествующего восстановления.
Чаще всего валентность и степень окисления количественно равны, однако бывают и исключения, которые необходимо запомнить. Например, в азотной кислоте (HNO₃) валентность атома N равна IV, а степень окисления +5. В молекуле CO углерод имеет валентность II, а степень окисления +2
Правила
определения валентности
Вале́нтность
(от лат. valēns «имеющий
силу») — способность атомов химических элементов
образовывать определённое число химических связей
с атомами других элементов.
·
Валентность атомов фтора всегда равна I
·
Li,
Na, K, F,H, Rb, Cs—
одновалентны;
·
Be,
Mg, Ca, Sr, Ba, Cd, Zn, O, Ra —
обладают валентностью, равной II;
·
Al,
B Ga,
In
— трехвалентны.
·
Максимальная
валентность для атомов данного элемента совпадает с номером группы, в которой
он находится в Периодической системе. Например, для Са это II, для серы
— VI, для
хлора — VII. Исключений
из этого правила тоже немало:
-элемент
VI группы,
О, имеет валентность II (в H3O+ — III);
– одновалентен F(вместо VII);
– двух- и трехвалентно обычно железо, элемент VIII группы;
– N может удержать возле себя только 4 атома, а не 5, как следует из номера группы;
– одно- и двухвалентна медь, расположенная в I группе.
·
Минимальное
значение валентности для элементов, у которых она переменная, определяется по
формуле: № группы в ПС — 8. Так, низшая валентность серы 8 — 6 = 2, фтора
и других галогенов — (8 — 7) = 1, азота и фосфора — (8 — 5)= 3 и так
далее.
·
В
соединении сумма единиц валентности атомов одного элемента должна
соответствовать суммарной валентности другого (или общее число валентностей
одного химического элемента равно общему числу валентностей атомов другого
химического элемента). Так, в молекуле воды Н-О-Н валентность Н равна I, таких
атомов 2, значит, всего единиц валентности у водорода 2 (1×2=2). Такое же
значение имеет и валентность кислорода.
·
При
соединении металлов с неметаллами последние проявляют низшую валентность
·
В
соединении, состоящем из атомов двух видов, элемент, расположенный на втором
месте, обладает низшей валентностью. Так при соединении неметаллов между
собой, низшую валентность проявляет тот элемент, который находится в ПСХЭ
Менделеева правее и выше, а высшую соответственно левее и ниже.
·
Валентность
кислотного остатка совпадает с количеством атомов Н в формуле кислоты,
валентность группы OH равна I.
·
В
соединении, образованном атомами трех элементов, тот атом, который находится в
середине формулы, называют центральным. Непосредственно с ним связаны атомы О,
а с кислородом образуют связи остальные атомы.
·

·

Правила
определения степени окисления химических элементов.
Степень окисления – это условный заряд атомов химического
элемента в соединении, вычисленный из предположения, что соединения состоят
только из ионов. Степени окисления могут
иметь положительное, отрицательное или нулевое значение, причём знак ставится
перед числом:-1, -2, +3, в отличие от заряда иона, где знак ставится после числа.
Степени окисления металлов в соединениях всегда положительные, высшая степень
окисления соответствует номеру группы периодической системы, где находится
данный элемент (исключая некоторые элементы: золото Au+3 (I группа),
Cu+2 (II), из VIII группы степень окисления +8 может быть только у
осмия Os и рутения Ru).
Степени неметаллов могут быть как положительными так и отрицательными, в
зависимости от того с каким атомом он соединён: если с атомом металла то всегда
отрицательная, если с неметаллом-то может быть и +, и -. При определении
степеней окисления необходимо использовать следующие правила:
1.
Степень
окисления любого элемента в простом веществе равна 0.
2.
Сумма
степеней окисления всех атомов, входящих в состав частицы (молекул, ионов и т.
д.) равна заряду этой частицы.
3.
Сумма
степеней окисления всех атомов в составе нейтральной молекулы равна 0.
4.
Если
соединение образовано двумя элементами, то у элемента с большей
электроотрицательностью степень окисления меньше нуля, а у элемента с меньшей
электроотрицательностью – больше нуля.
5.
Максимальная
положительная степень окисления любого элемента равна номеру группы в
периодической системе элементов, а минимальная отрицательная равна N– 8, где N
– номер группы.
6.
Степень
окисления фтора в соединениях равна -1.
7.
Степень
окисления щелочных металлов (лития, натрия, калия, рубидия, цезия) равна +1.
8.
Степень
окисления металлов главной подгруппы II группы периодической системы (магния,
кальция, стронция, бария) равна +2.
9.
Степень
окисления алюминия равна +3.
10. Степень
окисления водорода в соединениях равна +1 (исключение – соединения с металлами
NaH, CaH2, в этих соединениях степень окисления у водорода равна -1).
11. Степень окисления
кислорода равна –2 (исключения – перекиси H2O2, Na2O2,
BaO2 в них степень окисления кислорода равна -1, а в соединении с
фтором – +2).
12. В молекулах алгебраическая сумма степеней
окисления элементов с учётом числа их атомов равна 0.
Пример. Определить
степени окисления в соединении K2Cr2O7 .
У двух химических элементов калия и кислорода степени окисления постоянны и
равны соответственно +1 и -2. Число степеней окисления у кислорода равна
(-2)·7=(-14), у калия (+1)·2=(+2). Число положительных степеней окисления равно
числу отрицательных. Следовательно (-14)+(+2)=(-12). Значит у атома хрома число
положительных степеней равно 12, но атомов 2, значит на один атом приходится
(+12):2=(+6), записываем степени окисленя над элементами К+2Cr+62O-27
План урока:
Валентность
Причины постоянной и переменной валентности
Правила определения степени окисления
Валентность
Представьте на минуточку, что атомы не могли бы соединяться между собой, какой вид имела бы планета, а вопрос: «Существовала ли вообще Солнечная система?» Именно благодаря тому, что атомы соединяются между собой, существуют вещества, а также и мы.
Вернёмся к деталям, мы их будем сравнивать с атомами, а их внешний вид, с количеством связей, которые они могут образовать.
Представим, что в нашем распоряжении есть вот такие детали.


Валентность элементов обусловлена количеством неспаренных электронов на внешнем уровне.
Рассмотрим металлы, расположенные в I группе. Их объединили в одно семейство щелочных металлов, поскольку реагируя с водою, они все образуют щёлочи, состава МеОН. Формула внешнего уровня имеет вид ns1. Если провести параллель с элементами конструктора, то они будут выглядеть следующим образом.

Они могут отличаться цветом, формой, однако их объединяет количество связей, которые они способны образовать. Иначе говоря, что щелочные металлы одновалентны.
Это правило срабатывает и для элементов II группы, только они будут иметь вид двойных деталей.

Вспоминаем, что элементы этой группы имеют формулу ns2, приходим к тому, что валентность атомов численно равна II.
Как возможно Вы заметили, или вспомнили с темы строение атома, что высшая валентность определяется номером группы, но не всегда ей равна. Исключением с данного правила являются атомы элементов таких как азот, фтор и кислород.
Почему фтор, находясь в VII группе, имеет валентность постоянную равную единице. В то время, для других его родственников, она будет равнять I, III, V или даже VII.

Источник
Поиграем с Вами в старую добрую игру «Найди … отличий». Несмотря на то, что они находятся в одной группе, имеют общую формулу внешнего слоя ns2np5, валентность их будет отличаться. Атомы хлора выигрывают за счёт свободного 3d уровня, на который при определённых условиях могут мигрировать электроны с наружного слоя, образуя при этом 3 возбуждённых состояния. Атом фтора в этом плане бедный, в распоряжении его электронов нет d-орбитали, его электронам некуда мигрировать.Поэтому имея только 1 неспаренный электрон, может образовать только единственную связь.
Причины постоянной и переменной валентности
Для большинства элементов характерно иметь переменную валентность. Но для некоторых она будет постоянной. Некоторые элементы Вам уже известны, пополнит этот список кислород и цинк, которые всегда двухвалентны, алюминий имеет число связей III.
Расположение элементов в периодической таблице подсказывает, о количестве связей, которые могут они образовать.

Источник
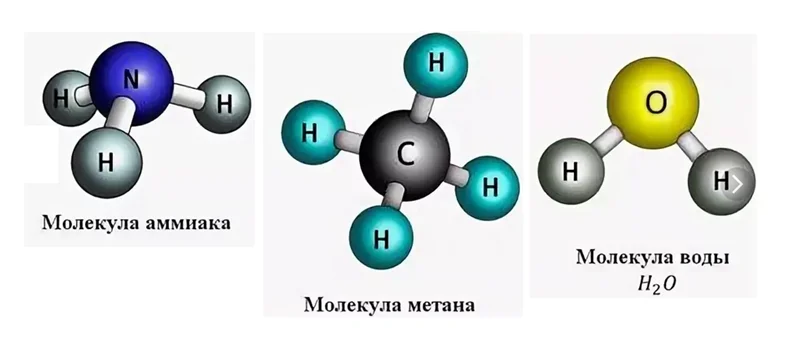
Определение валентности элементов по формулам
На рисунке изображены молекулы известных Вам веществ: это аммиак NH3, запах этого газа очень резкий и его трудно забыть, если хоть раз ощущали запах нашатырного спирта, с помощью его приводят людей в чувство после обморока.
Источник
С молекулой метана СН4 Вы встречаетесь на кухне, когда открываете газовый кран, чтобы приготовить пищу. На самом деле, метан не имеет запаха, но поскольку он относится к взрывоопасным веществам, то к нему прибавляют специальные соединения, имеющие запах, чтобы в случае утечки, его можно было обнаружить.
Молекула Н2О окружает нас повсюду. Во всех этих соединениях имеются атомы водорода, только в разных количествах. Давайте попробуем определить валентность по формуле вещества. Вспомним, что водород одновалентен. Если в аммиаке водорода насчитываем 3 атома, значит азот, условно, можем изобразить в виде такой детали.

Как видно с рисунка, он имеет валентность III. Поэтому принципу определим валентность углерода, приходим к выводу, что он четырёхвалентен.
Но не всегда мы видим структурные формулы, которые отображают связи между атомами, и не всегда имеем дело с одновалентными элементами. Возьмём, к примеру, вещество состава Р2О5. На два атома фосфора приходится 5 атомов кислорода. Постоянную валентность имеет кислород, которая равняется II. Чтобы определить, какую валентность будет иметь фосфор, необходимо выполнить следующие математические действия.

Встречаются такие соединения, где необходимо определить валентность остатков, входящих в состав кислот. Например, вещество состава Mg3(PO4)2.
Выполним согласно алгоритму. Магний всегда двухвалентен.

Искомая валентность кислотного остатка равна III. Следует заметить, что в веществе всегда находиться элемент, который проявляет постоянную валентность.
При написании уравнений реакций возникает необходимость составления формул веществ. Рассмотрим реакцию обмена между оксидом алюминия и соляной кислотой.

В результате обмена образуется два вещества состава AlCl и НО. Чтобы определить количественный состав в веществах, воспользуемся следующим алгоритмом.
Составление химических формул по валентности

Уравнение приобретает вид

Обратите внимание, что количество атомов отличается в реагентах и продуктах, его необходимо уравнять.

Составим формулы веществ по валентности элементов.

Немаловажную роль наравне с валентностью играет такое понятие как степень окисления (СО).

Термин валентность применим для соединений, имеющих молекулярное строение. Но, как известно, ещё существуют вещества ионного строения, которые образуются за счёт электростатического притяжения между разноимёнными зарядами. Каким образом они образуются? Чтобы ответить на данный вопрос, вспомним об электроотрицательности.
При образовании вещества, одни атомы будут отдавать свои электроны, другие – принимать. Рассмотрим на примере соединений молекулярного строения Cl2, HCl и ионного NaCl.

Обратите внимание, что вещества молекулярного строения, имеют структурную формулу, соединение атомов между собой показывается в виде черты – между ними. Для веществ имеющих строение, отличающее от молекулярного, более применимо понятие степени окисления, которое имеет универсальное применение для всех типов веществ.
Каким образом получается молекула вещества HCl? У водорода имеется один-единственный электрон, который располагается на 1s уровне, у хлора целых 7, занимающих уровни 3s2 и 3р5. Как Вы считаете, какой атом будет отдавать, а какой принимать электроны? При всём своём желании, атом водорода никак не сможет принять электроны хлора, ему просто некуда. Как он сможет расположить в своей 1s ячейке целых 7 электронов хлора. Логично предположить, что принимать будет хлор. Ему как раз не хватает одного электрона, чтобы завершить свой уровень. Поэтому водород будет иметь заряд +, а хлор -. Степень окисления указывается в правом верхнем углу элемента, арабскими цифрами, знак + или – ставим перед цифрой H+Cl−.
А вот какую степень окисления имеет простое вещество. Атомы равноценные партнёры, поэтому она будет нулевая.

При образовании ионного соединения NaCl натрий, как элемент имеющий малое число электронов на внешнем слое, а именно 1, подобно водороду, отдаёт его хлору, образуя при этом катион Na+, хлор при этом становится отрицательным анионом Cl−.
Правила определения степени окисления
Подобно валентности, для определённых элементов свойственна постоянная степень окисления. Это металлы, которые отличаются малым количеством электронов внешнего слоя. Отличительной характеристикой их будет невозможность иметь отрицательный заряд, поскольку они ВСЕГДА отдают электроны.
В противовес металлам существует один-единственный элемент, который абсолютно ни с кем не хочет делиться своими электронами.Ни при каких условиях он не отдаст их, это фтор, который всегда отрицателен F−.
Такой элемент, как кислород, обычно имеет отрицательный заряд, это -2. И только с фтором, он будет положительным +2.
Аналогичная ситуация с водородом, характерная СО (степень окисления) +1, однако исключения составляют соединения с металлами, где его степень окисления будет отрицательная и равняется -1.

Все эти значения вытекают с периодической системы, которая помогает определить степени окисления элементов.

Источник
С таблицы видно, что для большинства элементов эта величина не постоянная.
Чтобы вычислить степень окисления элементов в соединениях, будем руководствоваться следующими правилами.

Как бы то ни было, природа не ограничивается бинарными соединениями. Существует множество веществ состоящих из 2 и более элемента. Впрочем вычисление совсем не отличается, первоначально определяем элементы, имеющие постоянную степень окисления, а дальше проделав нехитрые математические действия находим СО для остальных. Главное правило, чтобы вещество было нейтральным, количество плюсов должно равняться количеству минусов.
К примеру, в веществе H2SO3 самым электроотрицательным является кислород, он заберёт электроны как в водороде, так и в серы, вследствие этого имеет отрицательную СО, а Hи Sстанут положительными. В этом соединение имеются 2 элемента, имеющих известную СО – это Н и О.
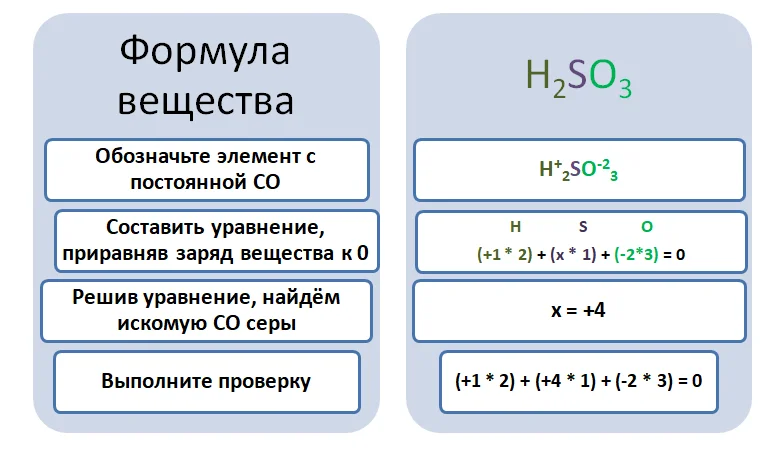
Обратите внимание, на нахождение СО в кислотном остатке. В данном случае, мы приравниваем не к 0, а к заряду аниона.

Здесь у серы х внизу
Как правило, валентность и степень окисления совпадают по абсолютной величине. Но исключения составляют простые вещества, например, в простом веществе азот, формула которого N2, степень окисления равняется 0, в тоже время, валентность атомов азота равна III. N0 ≡ N0.
Либо в катионе аммония NH4+. Азот имеет СО -3, а валентность IV.

