Как определить валентность вещ-ва по таблице растворимости?
Знаток
(430),
закрыт
4 года назад
Вера Гиренко
Знаток
(470)
4 года назад
можно определить валентность химического элемента и кислотного остатка.
просто смотришь на цифру возле хим. эл-та или кислотного остатка. Это и есть валентность. Если плюс или минус, то это валентность один.
mic mic
Просветленный
(26110)
4 года назад
можно лишь определить валентность отдельного химического элемента, входящего в состав вещества
валентность — это количество химических связей, которые атом данного химического элемента может образовывать с другими атомами
определить валентность химического элемента можно по таблице Менделеева
высшая валентность атома совпадает с номером группы, в которой расположен химический элемент
а низшая равна разнице между числом восемь и номером группы
Валентность химических элементов
Из материалов урока вы узнаете, что постоянство состава вещества объясняется наличием у атомов химических элементов определенных валентных возможностей; познакомитесь с понятием «валентность атомов химических элементов»; научитесь определять валентность элемента по формуле вещества, если известна валентность другого элемента; научитесь составлять химические формулы по валентности.
I. Понятие “валентность”
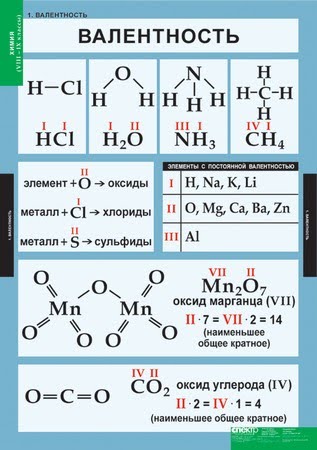
Состав большинства веществ постоянен. Например, молекула воды всегда содержит 2 атома водорода и 1 атом кислорода – Н2О. Возникает вопрос: почему вещества имеют постоянный состав?
Проанализируем состав предложенных веществ: Н2О, NaH, NH3, CH4, HCl. Все они состоят из атомов двух химических элементов, один из которых водород. На один атом химического элемента может приходиться 1,2,3,4 атома водорода. Но ни в одном веществе не будет на один атом водорода приходиться несколько атомов другого химического элемента. Таким образом, атом водорода может присоединять к себе минимальное количество атомов другого элемента, а точнее, только один.
Валентность – это способность атомов присоединять к себе определенное число других атомов.
Валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента. Валентность элемента – это число связей, которое образует атом:
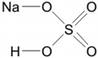
Na – одновалентен (одна связь)
H – одновалентен (одна связь)
O – двухвалентен (две связи у каждого атома)
S – шестивалентна (образует шесть связей с соседними атомами)
II. Правила определения валентности элементов в соединениях
Посмотрите видео по данной теме:
- Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н2О к одному атому кислорода присоединено два атома водорода.
- Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО2 (углекислый газ) имеет валентность IV.
- Высшая валентность равна номеру группы.
- Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 – N группы.
- У металлов, находящихся в «А» подгруппах, валентность равна номеру группы.
- У неметаллов в основном проявляются две валентности: высшая и низшая. Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
- Валентность может быть постоянной или переменной.
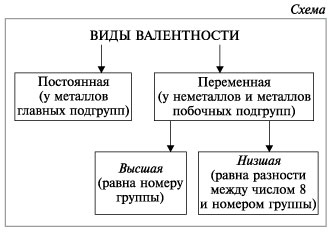
Валентность элементов необходимо знать, чтобы составлять химические формулы соединений.
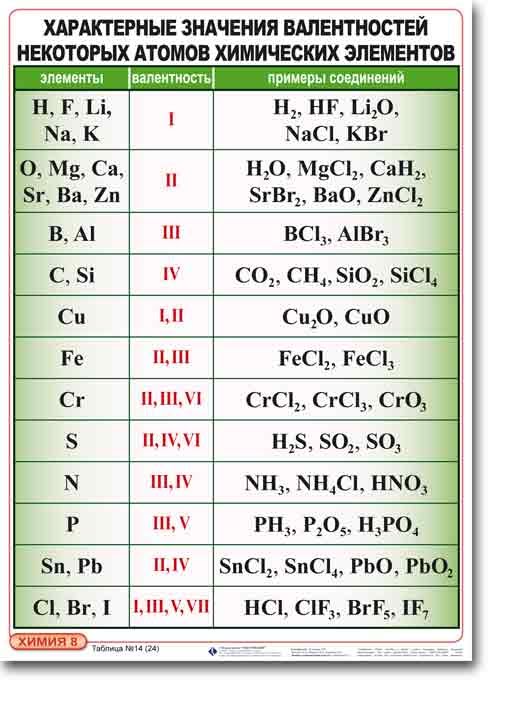
III. Алгоритм определения валентности по формуле
Зная формулу вещества, состоящего из атомов двух химических элементов, и валентность одного из них, можно определить валентность другого элемента.
Пример 1. Определим валентность углерода в веществе СН4.
Зная, что валентность водорода всегда равна I, а углерод присоединил к себе 4 атома водорода, можно утверждать, что валентность углерода равна IV. Валентность атомов обозначается римской цифрой над знаком элемента.
Пример 2. Определим валентность фосфорав соединении Р2О5.
Для этого необходимо выполнить следующие действия:
1. Над знаком кислорода записать значение его валентности – II (кислород имеет постоянное значение валентности);
2. Умножив валентность кислорода на число атомов кислорода в молекуле, найти общее число единиц валентности – 2·5=10;
3. Разделить полученное общее число единиц валентностей на число атомов фосфора в молекуле – 10:2=5.
IV. Cоставление бинарных формулпо валентностям химических элементов
Бинарная химическая формула – это формула химического соединения, в состав которого входят два вида атомов.
V. Задания для закрепления
Задание №1.
Даны химические элементы и указана их валентность. Составьте соответствующие химические формулы:
I II V IV III VII III II IV III
Li O, Ba O, P O, SnO, P H, MnO, Fe O, H S, N O, Cr Cl
Задание №2.
Составьте формулы молекул для следующих соединений:
1) меди и кислорода,
2) цинка и хлора,
3) калия и йода,
4) магния и серы.
Задание №3.
Используя материалы лекции составьте бинарные формулы следующими элементами:
А) бор и кислород;
Б) алюминий и хлор;
В) литий и сера.
Задание №4
Определите валентность химических элементов по формулам их соединений:
NH3, FeCl3, Cr2O3, SO3, CH4, P2O5
ferpsi493
Вопрос по химии:
Как определить валентность по таблице растворимости?
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок – бесплатно!
Ответы и объяснения 1
geybouarpe452
Функциональная группа – это группа атомов, отвечающая за химические свойства данного класса соединений. Например, функциональная группа спиртов – ОН (гидроксогруппа) и т. д.
Валентность – это свойства атомов данного химического элемента образовывать определенное количество ковалентных связей. Валентность можно определить не только по количеству неспаренных электронов, но валентность может определяться и парой электронов. Например, в ионе аммония NH4+ одна из связей образована за счет пары электронов азота и свободной электоронной орбитали иона водорода H+
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат – это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи –
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Валентность
Валентность (лат. valere – иметь значение) – мера “соединительной способности” химического элемента, равная числу индивидуальных
химических связей, которые может образовать один атом.
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы

Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю
вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.

В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном
состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для
полного понимания.

Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди,
железа, фосфора, хрома, серы.
Ниже вы увидите элементы с переменной валентностью и их соединения. Заметьте, определить их непостоянную валентность нам помогают другие
элементы – с постоянной валентностью.

Запомните, что у некоторых простых веществ валентность принимает значения: III – у азота, II – кислорода. Подведем итог полученным знаниям,
написав графические формулы азота, кислорода, углекислого и угарного газов, карбоната натрия, фосфата лития, сульфата железа (II) и ацетата калия.

Как вы заметили, валентности обозначаются римскими цифрами: I, II, III и т.д. На представленных формулах валентности веществ равны:
- N – III
- O – II
- H, Na, K, Li – I
- S – VI
- C – III (в угарном газе CO, так как одна связь образована по донорно-акцепторному механизму), IV (в углекислом газе CO2 и карбонате натрия Na2CO3)
- Fe – II
Степень окисления
Степенью окисления (СО) называют условный показатель, который характеризует заряд атома в соединении и его поведение в ОВР (окислительно-восстановительной
реакции). В простых веществах СО всегда равна нулю, в сложных – ее определяют исходя из постоянных степеней окисления у некоторых элементов.
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны,
образующие связи, перешли к более электроотрицательному элементу.
Определяя степень окисления, одним элементам мы приписываем условный заряд “+”, а другим “-“. Это связано с электроотрицательностью –
способностью атома притягивать к себе электроны. Знак “+” означает недостаток электронов, а “-” – их избыток. Повторюсь, СО – условное
понятие.

Сумма всех степеней окисления в молекуле равна нулю – это важно помнить для самопроверки.
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент
принимает “+”, а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Кто более электроотрицательный, тот сильнее притягивает к себе электроны и “уходит в минус”. Кто отдает свои электроны и испытывает их недостаток –
получает знак “+”.

Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2,
KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание
степеней окисления должно заменить даже самую развитую интуицию 😉

Особо хочу выделить тему ионов. Ион – атом, или группа атомов, которые за счет потери или приобретения одного или нескольких
электронов приобрел(и) положительный или отрицательный заряд.
Определяя СО атомов в ионе, не следует стремиться привести общий заряд иона к “0”, как в молекуле. Ионы даны в таблице растворимости, они имеют
разные заряды – к такому заряду и нужно в сумме привести ион. Объясню на примере.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
