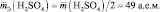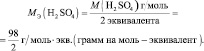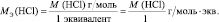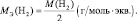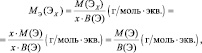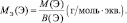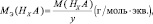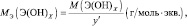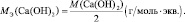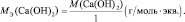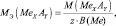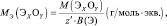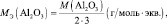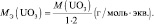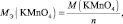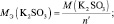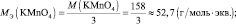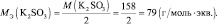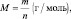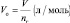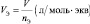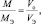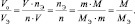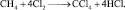Эквивале́нт вещества́ или просто эквивале́нт — реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в кислотно-осно́вных (ионообменных) химических реакциях или электрону в окислительно-восстановительных реакциях[1][2].
Например, в реакции 



Под эквивалентом вещества также часто подразумевается количество эквивалентов вещества или эквивалентное количество вещества — число молей вещества, эквивалентное одному молю катионов водорода в рассматриваемой реакции.
Эквивалентная масса[править | править код]
Эквивалентная масса — это масса одного эквивалента данного вещества.
Эквивалентная молярная масса вещества[править | править код]
Молярная масса эквивалентов обычно обозначается как 

Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества:
Фактор эквивалентности[править | править код]
Отношение эквивалентной молярной массы к собственной молярной массе вещества называется фактором эквивалентности (обозначается обычно как 
Число эквивалентности[править | править код]
Число эквивалентности 


Например, в реакции
эквивалентом является мнимая частица 



| вещество | реакция | |||
|---|---|---|---|---|
| простое * | сложное | ОВР (Окислительно-восстановительная реакция) | обменная | |

|
число атомов в формульной единице | число катионов (анионов) | число атомов элемента, поменявших степень окисления | число замещенных частиц в формульной единице |

|
характерная валентность элемента | фиктивный заряд на катионе (анионе) | число принятых (отданных) элементом электронов | фиктивный заряд на частице |
*Для инертных газов 
Фактор эквивалентности помогает сформулировать закон эквивалентности.
Закон эквивалентов[править | править код]
В результате работ И. В. Рихтера (1792—1800) был открыт закон эквивалентов:
- все вещества реагируют и образуются в эквивалентных отношениях.
- формула, выражающая закон эквивалентов: m1Э2 = m2Э1
См. также[править | править код]
- Электрохимический эквивалент
Примечания[править | править код]
- ↑ IUPAC Gold Book internet edition: «equivalent entity».
- ↑ International Union of Pure and Applied Chemistry (1998). Compendium of Analytical Nomenclature (definitive rules 1997, 3rd. ed.). Oxford: Blackwell Science. ISBN 0-86542-6155. section 6.3.
Литература[править | править код]
- Кремлёв А. М. Эквиваленты химические // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
МОСКОВСКИЙ ЭНЕРГЕТИЧЕСКИЙ ИНСТИТУТ
(ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ)
В.К.Камышова,
И.Л.Волчкова
Химический эквивалент. Расчетные задачи
Методическое
пособие для студентов 1-го курса всех
направлений
Москва Издательство МЭИ
2010
ВВЕДЕНИЕ
К
началу XIX
века произошел резкий прорыв в изучении
количественных методов исследования
веществ, что привело к новому
фундаментальному изменению в естествознании
вообще и в химии в частности.
Резкий
прорыв в изучении количественных методов
исследования веществ в началу XIX
века привел к новому фундаментальному
изменению в естествознании вообще и в
химии в частности.
После
открытия Лавуазье закона сохранения
массы последовал целый ряд новых
количественных закономерностей –
стехиометрических законов.

стехиометрическим законом стал закон
эквивалентов, который сформулировал
немецкий химик Иеремия Вениамин Рихтер
в результате проведенных им в 1791-1798
г.г. опытов по изучению количеств веществ
в реакциях нейтрализации и обмена,
обобщенных в работе «Начальные основания
стехиометрии или искусства измерения
химических элементов». Первоначальная
формулировка закона эквивалентов
(термин «эквивалент» ввел в 1767 г.
Г.Кевендиш) была следующей: «Если одно
и то же количество какой либо кислоты
нейтрализуется различными количествами
двух оснований, то эти количества
эквивалентны и нейтрализуются одинаковым
количеством любой другой кислоты».
Открытый
В.Рихтером закон подтвердил убеждения
многих химиков в том, что химические
соединения взаимодействуют не в
произвольных, а в строго определенных
количественных соотношениях.
-
Теоретическая часть
-
Понятие «химический эквивалент»
Химическим
эквивалентом (Э(В)) (по рекомендациям
ИЮПАК) называется условная или реальная
частица, равная или в целое число раз
меньшая соответствующей ей формульной
единице*:
где
В – формульная единица вещества:
реально
существующая частица, такая как атом
(Cu,
Na,
C),
молекула (N2,
HCl,
KOH,
Al2(SO4)3,
CO2),
анионы (OH–,
SO42-),
катионы (Cu
2+, K+),
радикалы (-NО2,
С2Н5-),
условные молекулы кристаллических
веществ и полимеров, любые другие частицы
вещества;
–
эквивалентное число, показывающее какое
число эквивалентов вещества В условно
содержится в данной формульной единице
этого вещества;
=
fэкв.
– фактор эквивалентности.
Использование
фактора эквивалентности как дробной
величины менее удобно.
Эквивалентное
число Z
всегда
больше или равно 1 и является безразмерной
величиной; при Z=1
эквивалент соответствует формульной
единице вещества.
Расчет
эквивалентного числа различных формульных
единиц представлен в таблице 1.1.
Величины
эквивалентного числа, а, следовательно,
и эквивалента зависят от химической
реакции, в которой участвует данное
вещество.
*
ранее под химическим эквивалентом
понимали количество вещества, которое
присоединяет или замещает 1 моль атомов
водорода в ходе реакции. Однако это
понятие относится не к самому эквиваленту,
а к количеству вещества эквивалента.
В
обменных реакциях,
например, в реакции нейтрализации
фосфорной кислоты, эквивалентное число
(эквивалент) кислоты меняется в зависимости
от полноты протекания реакции:
для
реакции H3PO4
+ 3KOH
→ K3PO4
+ 3H2O
эквивалентное число Z(H3PO4)=
=n(Н+)=3,
т.к. в реакции участвуют три иона Н+
фосфорной кислоты, и эквивалентом H3PO4
будет являться условная частица 1/3H3PO4
(Э (H3PO4)=
1/3H3PO4).
Таблица
1.1. Расчет эквивалентного числа Z
вещества.
|
частица |
эквивалентное |
Пример |
|
Элемент |
Z(Э) В(Э) |
Z(S)H2SO4 Z(C)CO2 |
|
Простое |
Z(в-ва) n(Э) В(Э) |
Z(O2) Z(Cl2) |
|
Оксид |
Z(Э2Ох) n(Э) В(Э) |
Z(Н2О) Z(SО2) Z(Al2О3) |
|
Кислота |
Z(к-ты) n(Н+) |
Z(Н2SО4) Z(Н2SО4) |
|
Основание |
Z(осн-я) n(ОН–) |
Z(Са(ОН)2 Z(Са(ОН)2) |
|
Соль |
Z(соли) n(А), |
Z(Na2SО4) Z(Al2(CO3)3) |
|
Частица |
Z(частицы) n |
SO42-+2H++ Z(SО42-)=2, 2Cl– Z(Cl–)=1, |
|
ион |
Z(иона) n |
Z(SО42-) |
В
реакции H3PO4
+ KOH
→ KН2PO4
+ H2O
замещается только один ион водорода Н+
и поэтому Z(H3PO4)=1,
а эквивалентом кислоты является частица
H3PO4
(Э(H3PO4)=
1H3PO4).
Эквивалентное
число (эквивалент) элемента также может
меняться в зависимости от вида соединения,
в состав которого он входит. Например,
в оксиде Cr2O3
эквивалентное число хрома Z(Cr)=3
и, следовательно, эквивалентом хрома
является условная частица 1/3Cr,
а в хромовой кислоте Н2CrО3
эквивалентное число хрома Z(Cr)=6,
а эквивалент Э(Cr)=1/6Cr.
В
обменных реакциях эквивалентное число
(эквивалент) определяется стехиометрией
реакции. Например,
Cr2(SO4)3
+ 12KOH
→ 2K3[Cr(OH)6]
+ 3K2SO4
на
одну формульную единицу Cr2(SO4)3
затрачивается 12 формульных единиц КОН.
Следовательно, эквивалентное число
Z(Cr2(SO4)3)=12,
а Z(КОН)=1.
Эквивалентом Cr2(SO4)3
будет являться условная частица 1/12
Cr2(SO4)3,
а Э(КОН)=1КОН.
Для
установления значений эквивалентных
чисел Z(В)
по уравнениям реакций обмена достаточно
найти наименьшее общее кратное всех
стехиометрических коэффициентов в
уравнении реакции и разделить их на
него. В рассматриваемом выше уравнении
наименьшее общее кратное равно 12:
1/12Cr2(SO4)3
+ KOH → 1/6K3[Cr(OH)6]
+ 1/4K2SO4
Для
данной реакции эквивалентные числа
равны: Z(Cr2(SO4)3)=12,
Z(КОН)=1,
Z(K3[Cr(OH)6])=6,
а Z(K2SO4)=4.
В
окислительно-восстановительных реакциях
эквивалентные числа окислителя и
восстановителя определяются числом
электронов, которое принимает одна
формульная единица окислителя или
отдает одна формульная единица
восстановителя.
Для
окислительно-восстановительной реакции
K
+ 14HCl = 2CrCl3
+ 3Cl2
+ 2KCl + 7H2O
Cr2O72-
+ 14H+
+
6e → 2Cr3+
+ 7H2O
6 1
2Cl–
– 2e → Cl2
3
Эквивалентные
числа определяют по числу электронов,
участвующих в соответствующих
полуреакциях, в расчете на одну формульную
единицу Cr2O72-,
Cr3+,
Cl–,
Cl2,
то есть Z(Cr2O72-)=6,
Z(Cr3+)=3,
Z(Cl–)=1,
Z(Cl2)=2.
Соответственно эквивалентные числа
веществ также будут равны: Z(К2Cr2O7)=6,
Z(Cr
Cl3)=3,
Z(НCl)=1.
Соседние файлы в предмете Химия
- #
- #
- #
- #
- #
- #
§ 2.1.2. Эквивалент
Эквивалент молекулы сложного вещества – это условная часть молекулы, являющаяся носителем одной функциональной связи или одного электрона, участвующего в окислительно-восстановительном процессе.
Эквивалентная масса 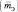
Например, если серная кислота (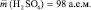
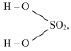
М (Н2 SO4) = 98 г/моль), имеющая структурную формулу:
взаимодействует с NaOH по реакции:
Н2SO4 + 2NaOH = Na2SO4 + 2Н2О, (2.1),
то у неё функциональны две связи Н – О. Вся молекула оказывается носительницей двух функциональных связей, а, значит, двух эквивалентов. Поэтому эквивалентом в данном случае является половина молекулы Н2SO4. Следовательно,
Молярная масса эквивалента (МЭ) – это масса одного моля эквивалента. В данном случае (MЭ(Н2SO4)) для приведённой реакции рассчитывается по формуле:
В аналогичной реакции взаимодействия NaOH с НСl молярная масса эквивалента соляной кислоты численно совпадает с молярной массой НСl:
НСl + NaOH = NaСl + Н2О;
Эквивалент молекулы простого вещества – это условная часть молекулы, являющаяся носителем одной валентности.
Например, молекула водорода состоит из двух атомов, каждый из которых обладает валентностью, равной единице. Поэтому, суммарная валентность молекулы этого простого вещества равна двум. Вся молекула оказывается носительницей двух валентностей, а, значит, согласно последнему определению, двух эквивалентов. Эквивалентом водорода оказывается половина молекулы. Молярная масса эквивалента ((MЭ(Н2)) рассчитывается по формуле:
Следует подчеркнуть, что хотя молекула водорода, также как и молекула соляной кислоты, содержит только одну функциональную связь, однако формулы для расчёта молярных масс эквивалентов этих веществ существенно различаются, потому что одно из них является простым, а другое сложным.
В общем случае, молярные массы эквивалентов (МЭ) рассчитываются следующим образом.
Для простых веществ:
где МЭ(ЭХ) – молярная масса эквивалента простого вещества, состоящего из х атомов элемента Э; М(ЭХ) – молярная масса этого вещества; М(Э) – молярная масса элемента; В(Э) – валентность элемента.
Для элементов (Э), входящих в состав сложного вещества:
То есть, молярные массы эквивалентов простых веществ и молярные массы эквивалентов элементов, входящих в состав сложного вещества, могут рассчитываться по одной и той же формуле.
Для кислот НХА, где А – кислотный остаток:
где y – основность кислоты, т. е. количество ионов H+, принимающих участие в процессе (y ≤ х).
Например, в реакции (2.1) основность серной кислоты равна двум. А для процесса:
Н2SO4 + NaOH = NaНSO4 + Н2О,
основность кислоты равна единице и не совпадает с общим количеством ионов Н+, принимающих участие в процессе.
Для оснований (Э(ОН)Х):
где у’ – кислотность основания, т. е. количество гидроксогрупп, принимающих участие в процессе. (y’ ≤ х).
Например, для реакции:
Са(ОН)2 + 2НСl = СаСl2 + 2Н2О;
А для процесса:
Са(ОН)2 + НСl = СаОНСl + Н2О;
Для солей (МеХАу, где Ме – металл):
где В(Ме) – валентность металла; z – количество атомов металла, принимающих участие в процессе (z ≤ х).
Для оксидов (ЭХОY):
где Э – элемент или фрагмент молекулы, неизменяемый в реакции; z′ – количество Э, принимающее участие в процессе.
Например, для реакции:
Аl2O3 + 6HCl = 2АlCl3 + 3H2O;
Э ≡ Al;
а для реакции:
UO3 + 2HCl = UO2Cl2 + H2O;
Э ≡ UO2;
Из приведённых примеров видно, что значение молярной массы эквивалента сложных веществ зависит от конкретной реакции, в которой они принимают участие. А значение молярной массы эквивалента элементов, входящих в состав сложного вещества – не зависит от реакции.
Следует подчеркнуть, что рассмотренные выше формулы для нахождения молярных масс эквивалентов сложных веществ, справедливы только в том случае если эти вещества не участвуют в окислительно – восстановительном процессе. Например, в реакции
2КMnO4 + 3 K2SO3 + H2O = 2MnO2 + 3 K2SO4 + 2KOH;
где n – количество электронов, получаемых перманганатом калия
n′ – количество электронов, отдаваемых сульфитом калия. В данном случае
Обобщив, приведённые выше равенства, можно утверждать, что молярную массу эквивалента любого вещества (МЭ) рассчитывают по формуле (2.2):
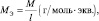
где M – молярная масса вещества, измеряемая в г/моль; l – количество эквивалентов, приходящееся на одну молекулу, численно равное количеству:
– валентностей (для простых веществ);
– функциональных связей (для сложных веществ, не участвующих в окислительно-восстановительном процессе);
– электронов, получаемых или отдаваемых молекулой (для сложных веществ, участвующих в окислительно-восстановительном процессе).
Подобно тому, как молярная масса вещества (М) представляет собой отношение массы (m) к количеству этого вещества (n)
а молярный объём газа (Vo) – отношение объёма (V), занимаемого им при нормальных условиях (p ≈ 105 Па; t °C ≈ 0 °C)[19] к количеству газа (nг):
молярный объём эквивалента газообразного вещества (VЭ) представляет собой отношение V к количеству молярных масс эквивалента nЭ:
из последних двух равенств вытекает соотношение
в котором все величины являются параметрами одного и того же газа.
Действительно:
Задачи для самостоятельного решения
1. Определить молярные массы эквивалентов соединения Н3РО4 в реакциях:
Н3РО4 + 3КОН = К3РО4 + 3Н2О;
Н3РО4 + 2КОН = К2НРО4 + 2Н2О;
Н3РО4 + КОН = КН2РО4 + Н2О.
Рассчитать молярные массы эквивалентов каждого из атомов в Н3РО4.
2. Определить эквивалентную массу Na2SO4 в реакциях:
Na2SO4 + ВаСl2 = ВаSO4 + 2NaСl;
Na2SO4 + H2SO4 = 2NaHSO4.
3. Определить молярную массу эквивалента Na2O в реакциях:
Na2O + 2НСl = 2NaСl + Н2О;
Na2O + Н2О = 2NaOН.
4. Определить эквивалентную массу Аl(OH)3 в реакциях:
2Аl(OH)3 + 3H2SO4 = Аl2(SO4)3 + 6Н2О;
Аl(OH)3 + H2SO4 = АlOHSO4 + 2Н2О.
5. Рассчитать молярную массу эквивалента кислорода и определить объём, занимаемый молярной массой эквивалента кислорода при н.у.
6. Определить эквивалентные массы, молярные массы эквивалента метана (СН4) и хлора в реакции
1. Дайте определения эквиваленту молекулы сложного вещества и эквиваленту молекулы простого вещества?
2. По какой формуле можно рассчитать молярную массу эквивалента любого вещества?
3. Какое уравнение связывает молярную массу, молярный объём, молярную массу эквивалента и молярный объём эквивалента одного и того же газа.