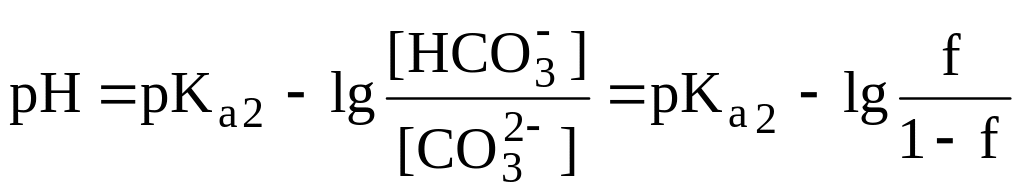Расчёты для построения кривой титрования
0,10 М Na2co3 0,10 м раствором hCl
|
f |
Компонент, определяющий |
Формула для (pKa1 |
рН |
|
0 |
слабое основание СO32- |
|
11,7 |
|
0,50 |
буферная смесь HCO3–/CO32- |
|
10,4 |
|
0,90 |
то же |
аналогично |
9,37 |
|
0,95 |
то же |
аналогично |
9,04 |
|
1,00 |
амфолит |
|
8,34 |
|
1,05 |
буферная смесь H2CO3/HCO3– |
|
7,63 |
|
1,50 |
то же |
аналогично |
6,35 |
|
1,90 |
то же |
аналогично |
5,40 |
|
1,99 |
то же |
аналогично |
4,45 |
|
2,00 |
слабая |
|
3,91 |
|
2,01 |
сильная кислота |
|
3,48 |
|
2,10 |
то же |
аналогично |
2,48 |
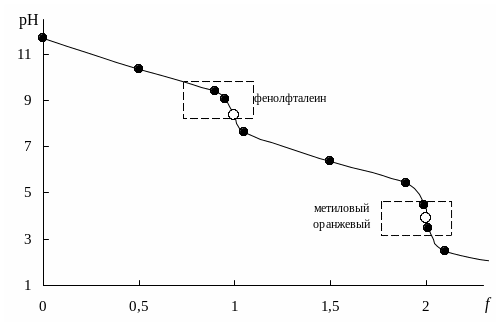
Рис.
13.3
Кривая
титрования 0,10 М Na2CO3
0,10 М раствором HCl
13.4. Факторы, влияющие на величину скачка титрования
На
величину скачка титрования в
кислотно-основном титровании влияют:
-
концентрация
титруемого вещества и титранта, -
сила
титруемой кислоты или основания, -
температура,
-
ионная
сила раствора.

Рис.
13.4. Кривые
титрования 0,1М CH3COOH
0,1М NaOH
(1),
0,001М HCl
0,001М NaOH
(2) и 0,1М HCl
0,1М NaOH
(3)
При уменьшении
концентрации титруемого вещества и
титранта величина скачка титрования
уменьшается (рис. 13.4), поэтому
кислотно-основное титрование нельзя
использовать для определения веществ
в сильно разбавленных растворах. Величина
скачка титрования также становится
меньше при уменьшении силы титруемой
кислоты или основания (рис. 13.4). Прямое
титрование таких кислот как H3BO3
(pKa
= 9,2) или NH4+
(pKa
= 9,24) в водных растворах с удовлетворительной
погрешностью невозможно и поэтому для
их определения используют специальные
приёмы.
Температура
и ионная сила влияют на величину скачка
титрования менее заметно, чем концентрация
или сила титруемой кислоты или основания.
При повышении температуры константа
автопротолиза воды увеличивается,
поэтому величина скачка кислотно-основного
титрования в водном растворе уменьшается.
Аналогичным образом влияет на величину
скачка титрования ионная сила раствора.
13.5. Погрешности титрования
Методика
титриметрического анализа многостадийна,
погрешности могут возникать на любой
стадии её проведения: при измерении
массы навески, объёма приготовленного
раствора или аликвоты, при проведении
титрования, обнаружении конечной точки
титрования. В зависимости от причины
возникновения погрешности в титриметрических
методах анализа, как и погрешности
вообще, могут быть:

К
появлению систематических погрешностей
в титриметрических методах анализа
может приводить:
-
использование
неверно градуированной посуды; -
неправильная
техника титрования
(слишком быстрое добавление титранта); -
неточное
считывание объёма титранта,
израсходованного для титрования;
![]()
несовпадение
точки эквивалентности и рТ индикатора.
Погрешности,
обусловленные несовпадением точки
эквивалентности и рТ индикатора,
называются индикаторными.
Индикаторные
погрешности в кислотно-основном
титровании удобно разделить на 4 вида:

Водородная
индикаторная погрешность
может возникнуть при недотитровании
сильной кислоты (в таком случае погрешность
отрицательная) либо когда сильная
кислота используется в качестве титранта
и добавлена в избытке (положительная
погрешность).
![]()
Если
концентрации титруемого вещества и
титранта одинаковы, то Vконечн
= 2V0,
тогда
![]()
Гидроксидная
погрешность может
возникнуть при недотитровании сильного
основания (отрицательная погрешность)
либо в том случае, когда сильное основание
используется в качестве титранта и
добавлено в избытке (положительная
погрешность).
![]()
Кислотная
и основная индикаторные
погрешности могут
быть только отрицательными (если,
конечно, исключить гипотетический
случай использования слабой кислоты
или основания в качестве титранта).
Величина
кислотной погрешности представляет
собой молярную долю неоттитрованной
кислоты.

![]()
Если
![]()
,
то
![]()
Формула
для расчёта основной погрешности
выводится аналогичным образом и выглядит
следующим образом
![]()
или в
упрощённом виде
![]()
Пример
13.1. Рассчитать
систематическую индикаторную погрешность
титрования 0,1 М HCl
и 0,1 М HCOOH
при использовании в качестве титранта
0,1 М NaOH
и индикатора метилового оранжевого (рТ
= 4).
В
случае HCl
титрование заканчивается при рН меньшем
(4), чем рН в точке эквивалентности (7),
поэтому имеет место водородная
индикаторная погрешность. Поскольку в
конечной точке титрования определяемое
вещество будет недотитровано, величина
систематической индикаторной погрешности
будет отрицательной
![]()
При
титровании HCOOH
в конечной точке титрования будет
оставаться неоттитрованная слабая
кислота, поэтому в данном случае будет
кислотная индикаторная погрешность.
![]()
Совершенно
очевидно, что метиловый оранжевый не
может быть использован для обнаружения
конечной точки титрования раствора
HCOOH
раствором NaOH.
Даже
в том случае, если систематическая
индикаторная погрешность равна 0 (pHэкв
= рТ), всё равно будет иметься случайная
погрешность визуального обнаружения
конечной точки титрования с помощью
индикатора. Вследствие физиологических
особенностей нашего зрения рТ индикатора
можно определить лишь с неопределённостью
примерно
0,4 ед. рН. Величина случайной индикаторной
погрешности зависит от крутизны
скачка титрования –
чем она больше, тем случайная погрешность
меньше. Индекс крутизны скачка титрования
рассчитывается следующим образом:
![]()
При
титровании слабых кислот (оснований)
крутизна скачка титрования меньше,
следовательно, случайная индикаторная
погрешность больше, чем при титровании
сильных кислот (оснований) (рис 13.5). Для
0,1 М сильных кислот и оснований величина
случайной индикаторной погрешности
составляет 210-7.
По мере уменьшения силы кислоты
(основания) и концентрации случайная
погрешность увеличивается.

Рис.
13.5.
Влияние
крутизны скачка титрования на случайную
индикаторную погрешность: 1 – 0,1 М HCOOH;
2 – 0,1 М HCl
В виде полосы
показана область неопределённости
обнаружения конечной точки титрования
для индикатора, имеющего рТ 8
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Величина – скачок – титрование
Cтраница 3
Резкое изменение рН вблизи точки эквивалентности называется скачком титрования. Величина скачка титрования определяет точность титрования; чем больше скачок, тем она выше.
[31]
Наличие скачка на кривой титрования и его величина предопределяют возможность, а также погрешность титри-метрического определения. Величина скачка титрования зависит прежде всего от константы равновесия используемой реакции: чем больше константа равновесия, тем больше скачок титрования, а также от концентрации определяемого компонента А и титранта В.
[32]
Знание пределов скачка титрования может существенно помочь в выборе условий проведения реакции и концентрации титранта. Величина скачка титрования должна быть достаточно большой. Увеличить ее можно введением в систему веществ, реагирующих с компонентами, которые определяют свойства системы.
[33]
Факторы, влияющие на форму кривой титрования. Величина скачка титрования определяет правильность обнаружения точки эквивалентности. Что касается кривой титрования, изображенной яа рис. 8 – 1, то существуют два фактора, которые влияют яа скачок этой кривой титрования в области точки эквивалентности: во-первых, исходная концентрация ( раствора хлорида, во-вторых, константа равновесия ( соответствующая произведению растворимости) реакции титрования.
[34]
Такое резкое изменение величины рН, вызванное прибавлением последней капли рабочего раствора носит название скачка титрования и соответствует вертикальному участку кривой титрования. Величина скачка титрования имеет очень важное значение, так как чем больше интервал изменения рН, тем с большей точностью можно провести титрование.
[35]
Такое резкое изменение величины рН, вызванное прибавлением последней капли рабочего раствора, носит название скачка титрования и соответствует вертикальному участку кривой титрования. Величина скачка титрования имеет очень важное значение, так как чем больше интервал изменения рН, тем с большей точностью можно провести титрование.
[36]
Особенно резкое изменение рН наблюдается в интервале, когда остались 0 1 % неоттитрованной НС1 или когда прилито 0 1 % избытка щелочи. Величину скачка титрования измеряют высотой вертикального участка кривой титрования.
[37]
Полученные количественные характеристики могут быть использованы в практическом анализе. Существенное значение здесь имеют применявшиеся параметры титрования: потенциалы начала и окончания скачка титрования, величина скачка титрования, потенциал эквивалентной точки и др. Приведенными выше ( см. гл.
[38]
Результаты проделанных расчетов представлены графически на рис. 12.1. Кривая аргентометрического титрования, как показывает этот рисунок, сохраняет традиционный вид. Сначала от первых капель до оттитровывания 90 % имеющегося хлорида pAg изменяется всего на одну единицу, затем то же изменение р Ag вызывает только 9 0 мл раствора AgNOs, а в области точки эквивалентности наблюдается скачок титрования. Величина скачка титрования возрастает с увеличением концентрации реагирующих веществ и с уменьшением температуры, так как понижение температуры вызывает уменьшение ПР.
[40]
Результаты проделанных расчетов представлены графически на рис. 12.1. Кривая аргентометрического титрования, как показывает этот рисунок, сохраняет традиционный вид. Сначала от первых капель до оттитровывания 90 % имеющегося хлорида pAg изменяется всего на одну единицу, затем то же изменение р Ag вызывает только 9 0 мл раствора AgNOa, а в области точки эквивалентности наблюдается скачок титрования. Величина скачка титрования возрастает с увеличением концентрации реагирующих веществ и с уменьшением температуры, так как понижение температуры вызывает уменьшение ПР.
[42]
Изменение рН описывается логарифмической функцией. В точке эквивалентности ( т 1) ветви кривых, относящихся к системам титруемого вещества и титранта, переходят одна в другую так же, как это было показано для окислительно-восстановительных систем. Но величина скачка титрования при кислотно-основном титровании зависит не только от значения константы диссоциации титруемого вещества кислого или основного характера, но также и от его общей концентрации. Поэтому здесь, строго говоря, необходимо учитывать изменение объема титруемого раствора в процессе титрования.
[43]
Страницы:
1
2
3

Расчет кривых титрования в методе комплексонометрии
Комплексонометрическое титрование основано на способности ионов металлов образовывать устойчивые комплексные соединения с органическими полидентатными лигандами анионами аминополикарбоновых кислот, из которых чаще всего используется комплексон III (трилон Б, ЭДТА). Так называют двунатриевую соль этилендиамиитетрауксусной кислоты  , кристаллогидрат которой
, кристаллогидрат которой  хорошо растворим в воде. В реакциях ЭДТА проявляет себя как шестидентатный лиганд и образует бесцветные октаэдрические комплексы состава
хорошо растворим в воде. В реакциях ЭДТА проявляет себя как шестидентатный лиганд и образует бесцветные октаэдрические комплексы состава  , т. е. реагирует с ионами металлов в молярном отношении 1:1.
, т. е. реагирует с ионами металлов в молярном отношении 1:1.
В комплексонометрии применяют металлохромные индикаторы — красители, способные образовывать окрашенные внутри-комлексные соединения с ионами металлов: кислотный хром темно-синий, хромоген черный специальный ЕТ-00 (эриохромовый черный Т), мурексид и др. В условиях титрования комплекс  должен иметь окраску, резко отличающуюся от окраски свободного индикатора, и прочность его должна быть значительно меньше прочности комплекса
должен иметь окраску, резко отличающуюся от окраски свободного индикатора, и прочность его должна быть значительно меньше прочности комплекса  .
.
В частности, эриохромовый черный Т имеет синюю окраску при pH 7-10. С катионами металлов образует комплексы красного цвета, поэтому в ТЭ, вследствие перехода ионов металла из комплекса с индикатором в комплекс с ЭДТА, появляется синяя окраска свободного индикатора. В растворах ЭДТА устанавливается равновесие между различными протонированными формами и депротонированным анионом  :
:

При pH 0 — 1,5 существуют незаряженные молекулы  . Полностью депротонированный анион
. Полностью депротонированный анион  образуется при
образуется при  , а при pH 8-9 преобладает
, а при pH 8-9 преобладает  В связи с этим, комплексонометрическое титрование проводят в присутствии буферов. Большая группа ионов
В связи с этим, комплексонометрическое титрование проводят в присутствии буферов. Большая группа ионов  титруется в среде аммиачного буферного раствора с эриохромовым черным Т. Поэтому для ряда катионов возможны побочные реакции комплексообразования: с
титруется в среде аммиачного буферного раствора с эриохромовым черным Т. Поэтому для ряда катионов возможны побочные реакции комплексообразования: с  , с
, с  и др. Их следует учитывать при выборе условий титрования и при вычислении условной (см. разделы 2, 3, 4) константы реакции титрования
и др. Их следует учитывать при выборе условий титрования и при вычислении условной (см. разделы 2, 3, 4) константы реакции титрования  .
.
Реакцию образования комплексоната металла (титрования) можно представить в упрощенном виде (упуская заряды):

При протекании побочных реакций М и У их равновесные концентрации выражают через аналитические и молярную долю частицы (формулы (2.4), (2.5), (2.8)).

Значения  при разных значениях pH приведены в табл.7, значения
при разных значениях pH приведены в табл.7, значения  — в табл. 4 приложения. Условная константа равновесия реакции титрования вычисляется по формуле (в случае
— в табл. 4 приложения. Условная константа равновесия реакции титрования вычисляется по формуле (в случае  ,
,  и др.):
и др.):

Если ион  не вступает в побочные взаимодействия (
не вступает в побочные взаимодействия ( ,
,  ),
),  и формула (8.16) преобразуется в (8.17):
и формула (8.16) преобразуется в (8.17):

Кривая титрования в комплексонометрии строится в координатах  . Для вычисления
. Для вычисления  ионов, участвующих в побочных реакциях, используют соотношение:
ионов, участвующих в побочных реакциях, используют соотношение:

Пример 8.27.
Рассмотрим построение кривых титрования в среде аммиачного буфера  с учетом разбавления раствора:
с учетом разбавления раствора:

Поскольку М и Y реагируют в соотношении 1:1, в обоих случаях справедливо: 
Ион  не образует комплексов с
не образует комплексов с  , поэтому
, поэтому  . Для иона
. Для иона  необходимо вычислить
необходимо вычислить  по формуле (2.8), используя табличные значения
по формуле (2.8), используя табличные значения  . Можно считать, что
. Можно считать, что  вследствие большого избытка по отношению к
вследствие большого избытка по отношению к  .
.

Используя табличные значения  , вычисляем для всех случаев
, вычисляем для всех случаев 

Далее определяем  для точек кривых титрования и проводим расчеты рМ. При вычислениях руководствуемся теми же правилами, как и для других типов реакций:
для точек кривых титрования и проводим расчеты рМ. При вычислениях руководствуемся теми же правилами, как и для других типов реакций:
Необходимые формулы и результаты расчетов приведены в табл. 8.11, кривые титрования — на рис. 8.5.
Таблица 8.11
Данные для расчета и построения кривых титрования растворов  и
и  раствором ЭДТА в условиях примера 8.27
раствором ЭДТА в условиях примера 8.27

Анализ кривых титрования (рис. 8.5) и расчетных формул показывает, что:
- рМ не зависит от pH раствора до ТЭ, но зависит в ТЭ и после ТЭ;
- величина скачка титрования и положение ТЭ зависит от величины pH — чем больше pH, тем больше скачок титрования;
- на величину скачка титрования влияют концентрация ионов металла и все факторы, определяющие ионное равновесие и константу устойчивости комплексоната; чем больше
 , тем больше скачок.
, тем больше скачок.
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:

Кривая титрования строится в объемном (титриметрическом) анализе вещества.
В зависимости от вида титрования (кислотно-основное, потенциометрическое, амперометрическое и т.д.) она может принимать самый различный вид. Основной принцип построения кривых титрования разберем на примере кислотно-основного титрования.
Для чего вообще необходимо строить эту кривую? В данном случае это делают, чтобы верно подобрать индикатор, который позволит наглядно оценить ход титрования, а также вычислить погрешность этого процесса.
Содержание
Кривая титрования и ее основные составляющие
Основные процессы кислотно-основного титрования
Построение кривой кислотно-основного титрования
Выбор подходящего индикатора
КРИВАЯ ТИТРОВАНИЯ И ЕЕ ОСНОВНЫЕ СОСТАВЛЯЮЩИЕ
Кривая титрования – это своего рода графическое изображение процесса титрования. Она показывает, как зависит связанный с концентрацией титруемого вещества или титранта выбранный параметр системы от изменения состава раствора в ходе титрования.
Дадим определения, связанные с кривой титрования, и укажем ее основные составляющие.

Скачок титрования – интервал, в котором резко изменяется рН около точки эквивалентности.
Линия нейтральности – прямая, соответствующая pH 7,0 и параллельная оси абсцисс.
Линия эквивалентности – прямая, соответствующая эквивалентному объему титранта и параллельная оси ординат.
Точка эквивалентности – момент титрования, когда прибавляемое растворенное вещество полностью прореагировало с растворенным веществом, находящимся в анализируемом (титруемом) растворе.
ОСНОВНЫЕ ПРОЦЕССЫ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
Существует два основных метода кислотно-основного титрования: ацидиметрия и алкалиметрия.
В случае алкалиметрии титрантом является раствор щелочи. Пусть это будет гидроксид натрия NaOH.

В ходе титрования находящийся в бюретке титрант (прозрачный раствор щелочи) по каплям добавляется к прозрачному раствору соляной кислоты, находящейся в колбе-приемнике.
В колбе происходит взаимодействие между кислотой и щелочью – реакция нейтрализации, приводящая к образованию соли NaCl, которая не подвергается гидролизу:

Таким образом, процесс сводится к образованию молекул воды.
Титрование складывается из нескольких этапов, по которым и строят кривую.

В точке эквивалентности титрование (то есть постепенное приливание титранта) прекращают. Но как визуально определить этот момент, если реагируют два прозрачных вещества и образуется опять-таки прозрачное вещество?
Нужен индикатор. В кислотно-основном титровании используются индикаторы двух видов: кислотные и основные. Они меняют свой цвет в определенном промежутке рН, в пределах которого есть момент, когда окраска изменяется наиболее резко. Этот момент наступает при конкретном значении рН, которое называется показателем титрования рТ.
При подборе индикатора очень важно, чтобы значение его рТ находилось как можно ближе к точке эквивалентности и лежало на участке скачка титрования. Может оказаться, что таких индикаторов будет несколько.
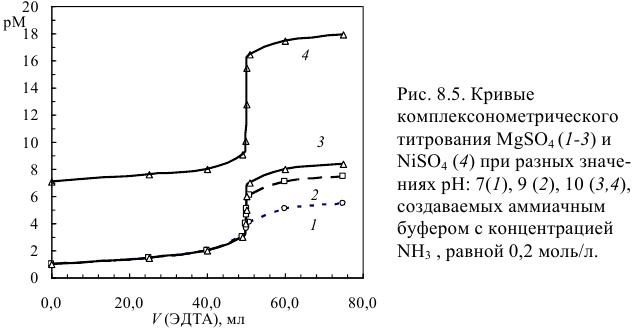
ПОСТРОЕНИЕ КРИВОЙ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
Применяют раствор щелочи (NaOH, KOH) для титрования раствора сильной кислоты (например, HCl) или раствора слабой кислоты (например, CH3COOH). В обоих случаях внешний вид кривой будет несколько отличаться. Иным будет и внешний вид кривой в случае с многоосновной кислотой (например, H3PO4).
Задание. Построить кривую титрования 20 мл (0,02л) раствора соляной кислоты (С=0,1н.) раствором гидроксида натрия (С=0,1н.)
Введем обозначения:
Ск – концентрация кислоты, н.;
Сосн – концентрация основания, н.;
Vк – объем кислоты, л;
Vосн – объем основания, л;
Vобщ – общий объем раствора в колбе (Vобщ= Vк + Vосн), л;
КН2О – ионное произведение воды (КН2О = 10-14).
Водородный показатель считаем по формуле: pH = -lg[H+].
Записи и расчеты будем вести в виде таблицы. Основные расчетные формулы, а также точки, по которым будем строить кривую: добавленный объем щелочи (мл) и рН раствора в колбе-приемнике, – обозначим красным цветом.
Итак, первый этап построения кривой титрования («до начала титрования»), когда в колбе-приемнике нет ни капли щелочи. Концентрация ионов водорода H+ соответствует концентрации кислоты, так как HCl → H+ + Cl— (при диссоциации 1 моля кислоты образуется 1 моль ионов H+).

Второй этап построения кривой титрования («до точки эквивалентности»), когда в колбе-приемнике происходит нейтрализация лишь части кислоты.
Учтем, что взаимодействие NaOH и HCl с одинаковыми концентрациями происходит в эквивалентных количествах (см.уравнение реакции выше). Значит, на 20 мл 0,1н. кислоты HCl будет приходиться 20 мл 0,1н. щелочи NaOH. Таким образом, 10 мл добавленной NaOH – это 50% всей требуемой для нейтрализации щелочи. В последующих расчетах рассуждаем аналогично.

«В точке эквивалентности» происходит полная нейтрализация кислоты щелочью, образуется хлорид натрия NaCl, не подвергающийся гидролизу. Именно поэтому концентрацию ионов Н+ водорода рассчитываем как квадратный корень из ионного произведения воды:

«После точки эквивалентности» добавляем к нейтральному раствору избыток щелочи. В растворе в таком случае присутствуют H2O, NaCl (в виде ионов Na+ и Cl—) и NaOH (в виде ионов Na+ и OH—).
 Для наглядности объединим все необходимые числа в одну таблицу:
Для наглядности объединим все необходимые числа в одну таблицу:

На основании полученных данных построим кривую титрования:

Покажем все линии и скачок титрования:

Проанализируем полученную кривую:
— линия нейтральности и прямя рН 7 совпадают;
— точка эквивалентности находится в значении рН 7;
— линия эквивалентности совпадает с прямой 20 мл;
— скачок титрования соответствует интервалу рН 3,3…10,7.
ВЫБОР ПОДХОДЯЩЕГО ИНДИКАТОРА
При выборе индикатора важно, чтобы его показатель титрования рТ был как можно ближе к точке эквивалентности. Наиболее часто используются следующие кислотно-основные индикаторы:
 Проанализируем рТ индикаторов, расположенных в таблице. Выберем два наиболее подходящих.
Проанализируем рТ индикаторов, расположенных в таблице. Выберем два наиболее подходящих.
Таковыми оказались бромтимоловый синий рТ 7,3 (интервал изменения окраски ∆рН = 6,0 … 7,6) и феноловый красный рТ 7,5 (интервал изменения окраски ∆рН = 6,4 … 8,2). Их показатели титрования ближе всего к точке эквивалентности, а интервал изменения окраски проходит через нее.

При выборе индикатора следует учесть ошибку, которая может возникнуть из-за того, что рТ не совпадает с рН в точке эквивалентности.
И действительно, рН в точке эквивалентности в нашем случае равен 7. Показатель титрования бромтимолового синего составляет 7,3, а фенолового красного – 7,5. Это не совпадает с рН в точке эквивалентности, хотя и очень близко к ней. Такие значения рТ индикаторов говорят о наличии некоторого избыточного количества гидроксид-ионов в растворе.
Кривая титрования может быть построена с помощь приложения Excel.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.

В основе титриметрического анализа лежит химическое взаимодействие между титруемым раствором и добавляемым титрантом. Рабочий раствор подбирают таким образом, чтобы реакция протекала количественно.
Химические реакции в титриметрическом анализе
Химические процессы, которые лежат в основе взаимодействия между титрантом и определяемым веществом, могут иметь различную природу. Наиболее часто встречаются:
-
реакции ионного обмена;
-
окислительно-восстановительные процессы;
Зная механизм реакции, можно посчитать ее стехиометрию, а значит определить концентрацию титруемого раствора.
Обменные реакции могут:
-
протекать с образованием малодиссоциирующих соединений (например, воды в реакциях нейтрализации);
-
сопровождаться выпадением осадка;
-
проходить с образованием комплексов.
Все эти взаимодействия должны протекать необратимо, чтобы исходные реагенты расходовались полностью. В этом случае для вычисления концентрации определяемого раствора применим закон эквивалентов.
Как контролировать точку эквивалентности в процессе титрования
В ручных методах титриметрического анализа используют особенности каждого типа реакции:
-
В осадительном (седиметрическом) титровании точку эквивалентности определяют по выпадению осадка.
-
В окислительно-восстановительном титровании подбирают индикаторы, которые меняют окраску при изменении степени окисления компонентов раствора.
-
В кислотно-основном титровании важно подобрать индикатор, который будет менять свой цвет вблизи точки эквивалентности.
-
Комплексонометрическое титрование позволяет определять содержание металлов, способных образовывать комплексы с реагентом, выступающим в качестве титранта. Эта реакция обычно также сопровождается изменением цветности раствора.
Рассмотрим несколько примеров реакций, лежащих в основе различных методов титрования.
Реакция нейтрализации. Кислотно-основное титрование.
В основе этого взаимодействия лежат реакции между кислотой и основанием. При этом сила кислоты и основания будет влиять на вид кривой титрования и расположение точки эквивалентности на ней.
При взаимодействие сильных кислот и оснований ТЭ лежит в районе нейтрального pH. Ее определение не вызывает особых сложностей, поскольку скачок титрования составляет порядка ΔрН = 5,4. В этом случае для нахождения точки эквивалентности обычно используют два распространенных индикатора: фенолфталеин или метиловый оранжевый. Их интервал перехода окраса пересекается со скачком титрования.
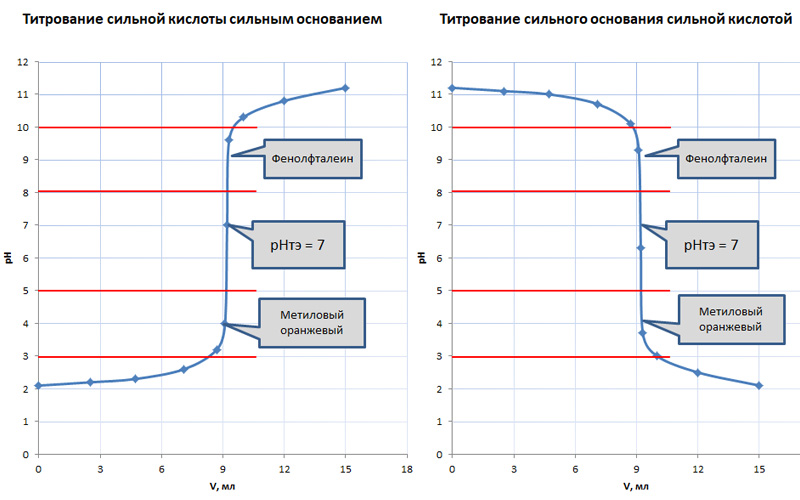
Таблица 1. Анализ кривых титрования при взаимодействии сильных кислот и оснований
| Тип взаимодействия | Титрование сильной кислоты сильным основанием | Титрование сильного основания сильной кислотой |
| Химическая реакция | HCl + NaOH = NaCl + H2O | NaOH + HCl = NaCl + H2O |
| Точка эквивалентности | рН т.э. = 7 | рН т.э. = 7 |
| Величина скачка титрования | Δ рН = 5,4 | Δ рН = 5,4 |
Если происходит взаимодействие между слабой кислотой и слабым основанием, то в этом случае вид кривой титрования меняется.
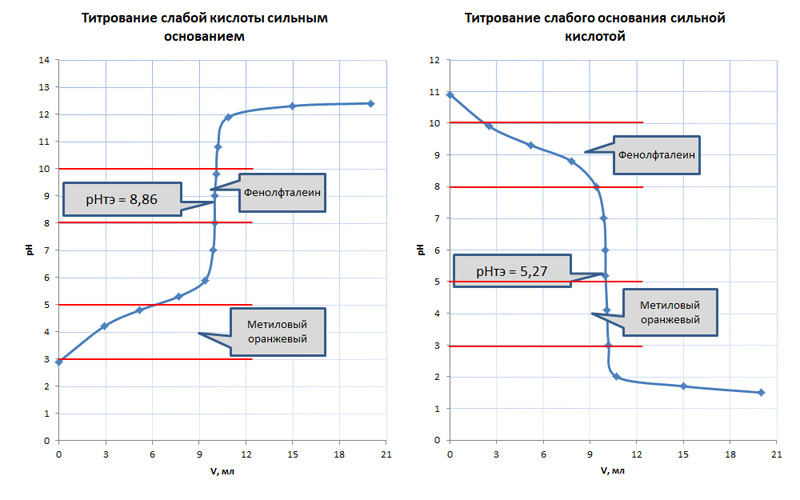
В первую очередь уменьшается скачок титрования ΔрН, а выбор индикатора будет зависеть от pH точки эквивалентности. Точка эквивалентности в этом случае не будет совпадать с точкой нейтрализации. В случае титрования слабых кислот она будет лежать в области изменения окраса фенолфталеина, а у слабых оснований ТЭ попадает в кислый диапазон, где может применяться метиловый оранжевый или метиловый красный, у которого цвет изменяется в диапазоне pH 4,4-6,2.
Таблица 2. Анализ кривых титрования при взаимодействии слабых кислот с сильными основанями и слабых оснований с сильными кислотами
| Тип взаимодействия | Титрование слабой кислоты сильным основанием | Титрование слабого основания сильной кислотой |
| Химическая реакция | CH3COOН + NaOH = CH3COONa + H2O | NaOH + HCl = NaCl + H2O |
| Точка эквивалентности | рН т.э. = 8,86 | рН т.э. = 5,27 |
| Величина скачка титрования | Δ рН = 2 | Δ рН = 2 |
Таким образом, представленные методы анализа позволяет количественно определять искомые компоненты растворов при условии правильного подбора индикатора.
При взаимодействии между собой слабых кислот и оснований в водных растворах скачок титрования будет слишком малым для идентификации, поэтому такие реакции не имеют практического смысла. Для анализа этих систем используют различные ухищрения: проводят титрование в неводных средах или вводят дополнительные комплексообразователи, которые способны разрушаться в присутствии титранта.
Титрование многоосновных кислот проходит ступенчато с постепенным замещением атомов водорода в молекуле кислоты. Скачок на первой ступени соответствует образованию однозамещенной соли, на следующем этапе уходит второй атом водорода. Замещение последнего атома водорода происходит крайне медленно и эта реакция характеризуется очень маленькой константой диссоциации (≈10-13), поэтому на кривой титрования третья ступень практически невидна. Важно отметить, что на каждой ступени титрования многоосновной кислоты необходим свой индикатор.
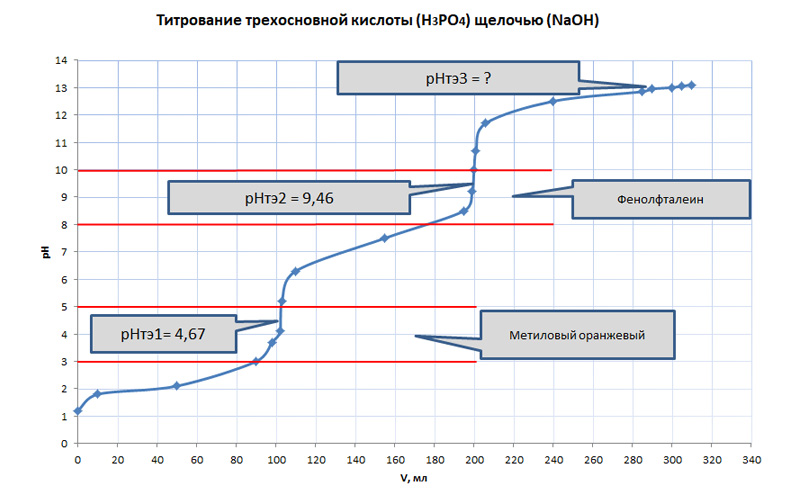
Если фосфорную кислоту необходимо оттитровать по всем трем ступеням, то в этом случае к ней добавляют известное количество раствора хлорида кальция (CaCl2). В результате реакции в осадок выпадет соль фосфорной кислоты, а в растворе остается свободная соляная кислота:
2H3PO4 + 3 CaCl2 = Ca3(PO4)2↓ + 6HCl
Определить содержание образовавшейся HCl можно щелочным рабочим раствором, а далее вычисляется количество исходной ортофосфорной кислоты. Такой способ называется обратным титрованием.
Аналогичный подход можно применять и для количественного анализа других слабых многоосновных кислот, в том числе и органических.
Следует отметить, что фиксация точки эквивалентности может происходить не только по изменениям окраски раствора, но и по изменениям других свойств. В потенциометрическом титровании регистрируются изменения электрохимических свойств системы по ходу взаимодействия титранта с анализируемым раствором. Этот подход позволяет автоматизировать методику титрования и избежать влияния человеческого фактора на результат анализа.