Для решения и понимания подобных задачь необходимо хорошо знать тему БИОСИНТЕЗ БЕЛКА”.
И внимательно читать условие задачи, выделяя в нём опорные и ключевые слова
РЕШЕНИЕ: 1) Определяем, сколько в одной цепи ДНК нуклеотидов: 248400:345=720.
2) Узнаём, сколько триплетов ( кодонов, и, соответственно антикодонов) можно составить из стольких нуклеотидов: 720:3=240 .
3) Находим массу белка: 240 умножаем на 100 Да, получаем 24000 Да (дальтон) .
———————————————————————————————————————-
ОБЪЯСНЕНИЕ: предположим, что тема “Биосинтез белка” усвоена, тогда остаётся понять, ЧТО:
1) ТРАНСКРИПЦИЯ идёт на одной цепи ДНК.
ДНК состоит из нуклеотидов (это мономеры этого биополимера) , известны массы одного нуклеотида и всей цепи. Поделив их, узнаём искомое.
2) ТРАНСЛЯЦИЯ идёт прерывисто, триплет за триплетом.
На и-РНК триплет назван КОДОНОМ, к нему подходит АНТИКОДОН т-РНК, транспортируя по ОДНОЙ АК к месту сборки белка.
Мы узнаём количество триплетов, а заодно и количество кодонов и антикодонов будет столько же. 240 раз подходили т-РНК к рибосоме, принося каждый раз по одной АК. Значит, в синтезирумом белке – 240 аминокислот.
3) Зная вес одной АК, нетрудно узнать вес всех АК ( а это и есть весь белок) , умножив 240 на 100.

Определение нуклеотидов в ДНК и РНК. Примеры решения задач
Определение массы и длины белка закодированного на ДНК
Задача 5.
Масса гена, который кодирует белок, равна 207000. Определите массу и длину белка закодированного на ДНК.
Решение:
Линейная длина одного аминокислотного остатка в полипептидной цепи – 0,35 нм, или 3,5 А0 (Ангстрем);
Средняя молекулярная масса одного аминокислотного остатка – 110 г/ моль;
Средняя молекулярная масса одного нуклеотидного остатка – 345 г/ моль.
Определим сколько нуклеотидов содержится в гене имеющем массу 207000, зная, что молекулярная масса одного нуклеотида равна 345 г/ моль. Тогда получим число нуклеотидов в гене:
207000/345 = 600 нуклеотидов.
Известно, что одну аминокислоту кодирует триплет, состоящий из трех нуклеотида. Определим сколько аминокислот содержит белок, если ген содержит 600 нуклеотидов, получим:
600/3 =200 аминокислот.
Так как масса одной аминокислоты рана 120 г/моль, то массу всего белка рассчитаем, получим:
200 . 110 = 22000 г/ моль.
Длина одной аминокислоты равна 0,3 нм. Тогда весь белок имеет длину:
200 . 0,35 = 70 нм.
Ответ: масса белка рана 22000 г/моль; длина белка – 70 нм.
Определение длины фрагмента молекулы ДНК
Задача 6.
Дана молекула ДНК с относительной молекулярной массой 75 900, из них 10350 приходится на долю адениловых нуклеотидов.
Найдите количество всех нуклеотидов в этой ДНК. Определите длину этого фрагмента.
Решение:
Расстояние между двумя нуклеотидами – 0,34 нм;
молекулярная масса одного нуклеотида – 345 г/моль.
1) Находим количество нуклеотидов:
а) 75 900 : 345 = 220 (нуклеотидов в ДНК),
б) 10350 : 345 = 30 (адениловых нуклеотидов в этой ДНК),
в) ∑(Г + Ц) = 220 – (30 + 30) = 160, т.е. Г = Ц = 80, их по 80;
2) Определяем длину фрагмента ДНК, получим:
220 нуклеотидов в двух цепях, значит в одной – 110.
Тогда
L(ДНК) = 110 . 0,34 = 37,4 (нм).
Ответ: 37,4 (нм).
Определение аминокислотных остатков в молекуле белка
Задача 7.
Белок содержит 0,5% глицина. Чему равна минимальная молекулярная масса этого белка, если Мглицина = 75,1 г/моль? Сколько аминокислотных остатков в этом белке?
Решение:
Молекулярная масса одной аминокислоты = 110 г/моль;
М(глицина) = а = 75,1 г/моль;
в = 0,5%.
1) Находим минимальну массу белка
Вычисление минимальной молекулярной массы белка определяем по формуле:
Мmin = (а/в) . 100%,
где
Мmin – минимальная молекулярная масса белка, а – атомная или молекулярная масса компонента,
в – процентное содержание компонента.
Тогда
Мmin = (75,1 г/моль /0,5%) . 100% = 15 020 г/моль.
2) Расчитаем количество аминокислотных остатков, получим:
15 020 : 110 ≈ 136 (аминокислот в этом белке).
Ответ: Аминокислотных остатков в белке 136.
Вычисление процентного содержания нуклеотидов в ДНК и длину ее молекулы
Задача 8.
В молекуле ДНК 20% гуаниловых нуклеотидов. Определите процентное содержание Ц, Т, А и длину молекулы ДНК, если в ней всего 400 нуклеотидов.
Решение:
Расстояние между двумя нуклеотидами – 0,34 нм.
В соответствии с принципом комплементарности количество (Г) равно количеству (Ц), т.е. (Г) = (Ц) = 30%. Тогда их совместное количество: (Г + Ц) = 60%, а количество (А + Т) = 100 – 60 = 40%, а в отдельности (А) = (Т) = 40/2 = 20%. Длина молекулы ДНК определяется количеством нуклеотидов в одной цепи (т.е. количеством пар нуклеотидов) умноженным на длину нуклеотида. В ДНК 400 нуклеотидов (шт.) или 200 пар, расстояние между соседними парами 0,34 нм, следовательно длина молекулы ДНК будет: 200 х 0,34 = 68 нм.
Ответ: (Г) = 30%, (Ц) = 30%, (А) = 20%, (Т) = 20%; длина ДНК 68 нм.
Молекулярная масса и размеры белков. Методы определения молекулярной массы белков. Необходимость применения комплекса методов для точной оценки молекулярной массы белков
Белки относятся
к высокомолекулярным соединениям, в
состав которых входят сотни и даже
тысячи аминокислотных остатков,
объединенных в макромолекулярную
структуру. Молекулярная масса белков
колеблется от 6000 (нижний предел) до
1000000 и выше в зависимости от количества
отдельных полипептидных цепей в составе
единой молекулярной структуры белка.
Такие полипептидные цепи называются
субъединицами. Их молекулярная масса
варьирует в широких пределах: от 6000 до
100000 и более. Для выражения молекулярной
массы белков используют также специальную
единицу – дальтон.
Дальтон (Да) –
единица массы, практически равная массе
атома водорода (т.е. 1,0000 по шкале атомных
масс). Терминами «дальтон» и «молекулярная
масса» пользуются как взаимозаменяемыми:
например, белок в 20000 дальтон имеет
молекулярную массу 20000. Наименование
дано в честь Джона Дальтона, разработавшего
атомарную теорию строения материи.
Килодальтон (кДа) – единица массы, равная
1000 дальтон. Масса большинства белков
лежит в пределах от 10 до 100 кДа.
Аминокислотный
состав и последовательность аминокислот
выяснены для многих тысяч белков. В
связи с этим стало возможным вычисление
их молекулярной массы химическим путем
с высокой точностью. Однако для огромного
количества встречающихся в природе
белков химическое строение не выяснено,
поэтому основными методами определения
молекулярной массы все еще остаются
физико-химические методы (гравиметрические,
осмометрические, вискозиметрические,
электрофоретические, оптические и др.).
На практике чаще всего используются
методы седиментационного анализа,
гель-хроматография и гель-электрофорез.
При определении
молекулярной массы белков методами
седиментационного анализа используют
аналитические ультрацентрифуги (первая
ультрацентрифуга была сконструирована
в 1923 г. Т. Сведбергом), в которых удается
создать центробежные ускорения (g), в
200000 и более раз превышающие ускорение
земного притяжения. Обычно молекулярную
массу вычисляют по скорости седиментации
молекул белка или седиментационному
равновесию. По мере перемещения молекул
от центра к периферии образуется резкая
граница «растворитель-белок»
(регистрируется автоматически). Оптические
свойства растворителя и белка используются
при определении скорости седиментации;
которую выражают через константу
седиментации s, зависящую как от массы,
так и от формы белковой частицы:
v
S = —— ,
ω2 ∙ r
где v – скорость
перемещения границы растворитель-белок,
см/с; ω – угловая скорость ротора, рад/с;
r – расстояние от центра ротора до
середины ячейки с раствором белка, см.
Константа седиментации имеет размерность
времени (ее выражают в секундах). Величина
константы седиментации, равная 1·10–13
с, условно принята за единицу и названа
сведбергом (S). Значения констант
седиментации большинства белков лежат
в пределах 1–50 S, хотя в ряде случаев эти
значения превышают 100 S.
Для вычисления
молекулярной массы, помимо константы
седиментации, необходимы дополнительные
сведения о плотности растворителя и
белка и другие согласно уравнению
Сведберга:
RTS
M = ————
D (1- v ρ)
где R – газовая
постоянная, эрг/(моль∙гр.); Т – абсолютная
температура (по шкале Кельвина); S
– константа седиментации; ρ – плотность
растворителя; v – парциальный удельный
объем молекулы белка; D ‒ коэффициент
диффузии.
Определение
молекулярной массы белков методом
ультрацентрифугирования требует много
времени и дорогостоящей аппаратуры.
Поэтому в последние годы разработаны
простые методы (гель-хроматография и
электрофорез).
Гель-хроматографию
проводят при заполнении колонки пористым
гелем сефадекса. Через колонку пропускают
ряд белков с известной молекулярной
массой и строят график зависимости
логарифма молекулярной массы от значений
их элюционных объемов. Между логарифмом
молекулярной массы белка, имеющего
сферическую форму, и элюционным объемом
существует прямая зависимость. Легко
определить молекулярную массу исследуемого
белка, зная его объем элюции.
Второй разновидностью
этого метода является тонкослойная
гель-хроматография. Длина пробега белка
через тонкий слой сефадекса находится
в логарифмической зависимости от его
молекулярной массы (рис.7.1).

Рис.7.1. Зависимость
между длиной пробега белковых частиц
при гель-хроматографии в тонком слое
сефадекса G-150
и их молекулярными массами
При использовании
диск-электрофореза в полиакриламидном
геле строят график зависимости между
логарифмом молекулярной массы
калибровочных белков и подвижностью
белковых частиц в полиакриламидном
геле, а затем, определив подвижность
исследуемого белка, по графику находят
его массу (рис.7.2).

Рис.7.2. Зависимость
между молекулярной массой и относительной
подвижностью белка при диск-электрофорезе
в полиакриламидном геле. присутствии
додецилсульфата натрия
Электрофорез
проводят в присутствии детергента –
додецилсульфата натрия (SDS), т.к. только
в этом случае наблюдается прямая
пропорциональная зависимость между
логарифмом молекулярной массы и
подвижностью белков.

Додецилсульфат
натрия
Соседние файлы в предмете Биохимия
- #
- #
- #
- #
- #
- #
- #
- #
- #
Molar mass of PrOTeIN = 425.41822 g/mol
Convert grams PrOTeIN to moles
or
moles PrOTeIN to grams
Molecular weight calculation:
140.90765 + 15.9994 + 127.6 + 126.90447 + 14.0067
Percent composition by element
Element: Tellurium
Symbol: Te
Atomic Mass: 127.60
# of Atoms: 1
Mass Percent: 29.994%
Element: Praseodymium
Symbol: Pr
Atomic Mass: 140.90765
# of Atoms: 1
Mass Percent: 33.122%
Element: Nitrogen
Symbol: N
Atomic Mass: 14.0067
# of Atoms: 1
Mass Percent: 3.292%
Element: Oxygen
Symbol: O
Atomic Mass: 15.9994
# of Atoms: 1
Mass Percent: 3.761%
Element: Iodine
Symbol: I
Atomic Mass: 126.90447
# of Atoms: 1
Mass Percent: 29.831%
Similar chemical formulas
Note that all formulas are case-sensitive.
Did you mean to find the molecular weight of one of these similar formulas?
PrOTeIN
PrOTeIn
Calculate the
molecular weight of a chemical compound
More information
on molar mass and molecular weight
In chemistry, the formula weight is a quantity computed by multiplying the atomic weight (in atomic mass units) of each element in a chemical formula by the number of atoms of that element present in the formula, then adding all of these products together.
A common request on this site is to convert grams to moles. To complete this calculation, you have to know what substance you are trying to convert. The reason is that the molar mass of the substance affects the conversion. This site explains how to find molar mass.
Formula weights are especially useful in determining the relative weights of reagents and products in a chemical reaction. These relative weights computed from the chemical equation are sometimes called equation weights.
Finding molar mass starts with units of grams per mole (g/mol). When calculating molecular weight of a chemical compound, it tells us how many grams are in one mole of that substance. The formula weight is simply the weight in atomic mass units of all the atoms in a given formula.
The atomic weights used on this site come from NIST, the National Institute of Standards and Technology. We use the most common isotopes. This is how to calculate molar mass (average molecular weight), which is based on isotropically weighted averages. This is not the same as molecular mass, which is the mass of a single molecule of well-defined isotopes. For bulk stoichiometric calculations, we are usually determining molar mass, which may also be called standard atomic weight or average atomic mass.
Using the chemical formula of the compound and the periodic table of elements, we can add up the atomic weights and calculate molecular weight of the substance.
If the formula used in calculating molar mass is the molecular formula, the formula weight computed is the molecular weight. The percentage by weight of any atom or group of atoms in a compound can be computed by dividing the total weight of the atom (or group of atoms) in the formula by the formula weight and multiplying by 100.
Молекулярная масса белков
Белки
относятся к высокомолекулярным соединениям, в состав которых входят сотни и
даже тысячи аминокислотных остатков, объединенных в макромолекулярную структуру.
Молекулярная масса белков колеблется от 6000 (нижний предел) до 1000000 и выше
в зависимости от количества отдельных полипептидных цепей в составе единой
молекулярной структуры белка. Такие полипептидные цепи получили название
субъединиц. Их мол. масса варьирует в широких пределах – от 6000 до 100000 и
более.
Аминокислотный
состав и последовательность аминокислот выяснены для многих тысяч белков. В
связи с этим стало возможным вычисление их молекулярной массы химическим путем
с высокой точностью. Однако для огромного количества встречающихся в природе
белков химическое строение не выяснено, поэтому основными методами определения
молекулярной массы все еще остаются физико-химические методы (гравиметрические,
осмометрические, вискозиметрические, электрофоретические, оптические и др.). На
практике наиболее часто используются методы седиментационного анализа,
гель-хроматография и гель-электрофорез. Определение молекулярной массы белков
методами седиментационного анализа проводят в ультрацентрифугах , в которых
удается создать центробежные ускорения (g), превышающие в 200000 и более раз ускорение
земного притяжения. Обычно вычисляют молекулярную массу по скорости
седиментации молекул белка или седиментационному равновесию. По мере
перемещения молекул от центра к периферии образуется резкая граница
растворитель-белок (регистрируется автоматически). Оптические свойства
растворителя и белка используются при определении скорости седиментации;
последнюю выражают через константу седиментации s, которая
зависит как от массы, так и от формы белковой частицы:
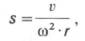
где v – скорость перемещения границы
растворитель-белок, см/с; ω – угловая скорость
ротора, рад/с; r – расстояние от центра ротора до середины
ячейки с раствором белка, см. Константа седиментации имеет размерность времени
(ее выражают в секундах). Величина константы седиментации, равная 1•10–13
с, условно принята за единицу и названа сведбергом (S). Значения
констант седиментации большинства белков лежат в пределах 1–50 S, хотя
в ряде случаев эти значения превышают 100 S.
Для
вычисления молекулярной массы (М), помимо константы седиментации, необходимы
дополнительные сведения о плотности растворителя и белка и другие согласно
уравнению Сведберга:
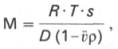
где R – газовая постоянная, эрг/(моль•град); Т – абсолютная температура (по шкале
Кельвина); s – константа седиментации; ρ –
плотность растворителя; v –
парциальный удельный объем молекулы белка; D – коэффициент диффузии.
Определение
молекулярной массы белков методом ультрацентрифугирования требует много времени
и сложной и дорогостоящей аппаратуры. Поэтому в последние годы разработаны два
более простых метода (гель-хроматография и электрофорез). При использовании
гель-хроматографии в первую очередь требуется откалибровать колонку. Для этого
через колонку с сефадексом пропускают несколько белков с известными
молекулярными массами и строят график, откладывая значения логарифмов
молекулярной массы против их элюционных объемов, которые находят, как показано
на рис. 1.9.
Известно, что
между логарифмом молекулярной массы белка, имеющего сферическую форму, и
элюционным объемом существует прямая зависимость. Поэтому легко определить
молекулярную массу исследуемого белка, зная его объем элюции. Второй
разновидностью этого метода является тонкослойная гель-хроматография. Длина
пробега белка (в миллиметрах) через тонкий
слой сефадекса находится в логарифмической зависимости от молекулярной массы
белка (рис. 1.10).
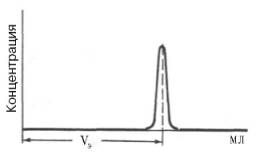
Рис. 1.9. Измерение
объема элюции (VЭ).
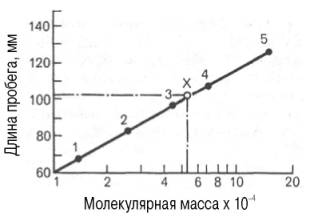
Рис. 1.10. Зависимость
между длиной пробега белковых частиц при гель-хроматографии в тонком слое
сефадекса Г-150 (сверхтонкого) и их молекулярными массами (в
полулогарифмической системе координат).
1 –
рибонуклеаза; 2 – химотрипсиноген; 3 -яичный альбумин; 4 – сывороточный
альбумин; 5 – γ-глобулин; Х – белок с неизвестной молекулярной массой.
Гель-хроматография,
кроме простоты и быстроты, имеет дополнительное преимущество: не требуется
выделять белок в чистом виде, так как примеси других белков не мешают
определению, поскольку каждый из них проходит через колонку со свойственной ему
скоростью, определяемой молекулярной массой. Это обстоятельство широко
используется в энзимологии, когда оказывается возможным определение
молекулярной массы даже очень небольшого количества фермента в присутствии
других белков, не обладающих аналогичной каталитической активностью.
При
использовании диск-электрофореза в полиакриламидном геле для определения
молекулярной массы белков также строят график зависимости между логарифмом
молекулярной массы калибровочных белков и подвижностью белковых частиц в
полиакриламидном геле, а затем, определив подвижность исследуемого белка, по
графику находят его массу (рис. 1.11). Электрофорез проводят в присутствии
детергента додецилсульфата натрия, так как только в этом случае наблюдается
прямая пропорциональная зависимость между молекулярной массой и подвижностью
белков. Белки с четвертичной структурой при этих условиях распадаются на
субъединицы, поэтому метод находит широкое применение для определения
молекулярной массы субъединиц белка.
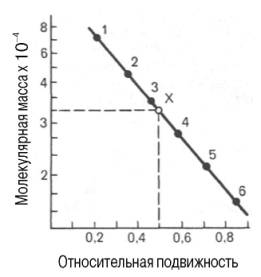
Рис. 1.11. Зависимость
между молекулярной массой и относительной подвижностью белка при
диск-электрофорезе в полиакриламидном геле в присутствии додецилсульфата натрия
(в полулогарифмической системе координат).
1 –
сывороточный альбумин; 2 – яичный альбумин; 3 – пепсин; 4 – химотрипсиноген; 5
– мио-глобин; 6 – цитохром с; Х –
белок с неизвестной молекулярной массой.
Недавно
предложен новый масс-спектрометрический метод (так называемый лазерный
десорбционно-ионизационный метод), позволяющий определять молекулярную массу
небольших пептидов (вазопрессин, инсулин) и крупных биополимерных молекул и,
кроме того, структуру биомолекул.
