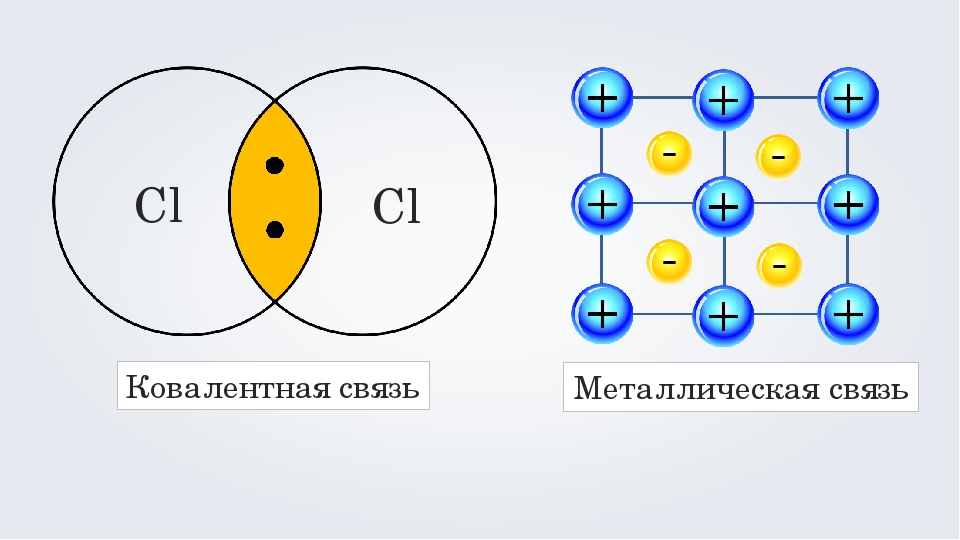
В этой статье мы подробно рассмотрим металлическую связь, ее характеристики и факты, а также некоторые примеры металлической связи.
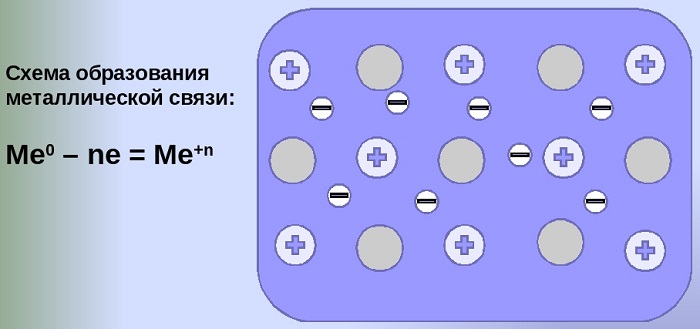
Металлическую связь можно описать как силу притяжения между отрицательно заряженными подвижными электронами и положительно заряженными ионами металлов. Эта сила притяжения используется для удержания атомов металла вместе в металлическом кристалле. Примеры металлической связи:
- Соль
- алюминий
- магниевый
- Медь
- Утюг
В одном из геометрических расположений, таких как центральное кубическое расположение тела, гексагональная плотноупакованная или центрально-кубическая плотноупакованная грань, металл состоит из положительных ионов. Отрицательно заряженные делокализованные электроны удерживают положительно заряженные ионы вместе в кристаллической решетке. Следовательно, положительные и отрицательные заряды уравновешиваются.
Согласно теории электронного облака, металлическая связь представляет собой электростатические силы притяжения между положительно заряженными ионами металлов, заключенными в море отрицательно заряженных мобильных электронов. Как показано на рисунке.

Кредиты изображений: Wikimedia
Характеристики металлической связки
- Металлы могут проводить через них тепло. Когда один конец металла нагревается, подвижные электроны поглощают тепловую энергию и быстро движутся к другому концу, поэтому металл проявляет теплопроводность.
- Металлы также являются хорошими проводниками электричества, так как в них присутствуют свободные электроны, которые переносят ток.
- Металлы непрозрачны, и они также имеют металлические кластеры.
- Металлы пластичны и податливы.
- Металлы проявляют свойство блеска, так как подвижные электроны поглощают и излучают видимые световые излучения.
- Металлическая связь возникает в твердом состоянии вещества.
- Металлам требовались высокие температуры для разрыва связей между ними, поэтому они имели высокие температуры плавления и кипения.
Подробнее о: 5+ примеров двойных облигаций: подробные сведения и факты
Металлическая связка Примеры
Натрий (Na)
Атом натрия имеет один электрон на валентной оболочке. Когда более одного атома натрия располагаются в кристаллической решетке (ОЦК), электроны, присутствующие в самой внешней оболочке, делят междоузельное пространство с другим атомом натрия, образуются молекулярные орбитали. Валентные электроны, находящиеся на внешней оболочке атома, распределяются в пространственной решетке металла. это металлик пример облигации.
Положительно заряженные ионы металла натрия и отрицательно заряженные электроны соединяются вместе, образуя металлические связи.

Кредиты изображений: химик
Алюминий (Al)
Атом алюминия имеет три электрона на валентной оболочке. Когда атомы алюминия располагаются в кристаллической решетке (ГЦК), электроны, присутствующие в самой внешней оболочке, делят междоузельное пространство с другими атомами алюминия, и образуются молекулярные орбитали. Эти электроны делокализованы в пространственной решетке. По мере увеличения числа валентных электронов становится доступным больше свободных электронов. Это пример металлической связи. Металлическая связь, образованная между положительно заряженными ионами металла алюминия и электронами.

Изображение Кредиты: химик
Магний (Mg)
Атом магния имеет два валентных электрона. Когда атомы магния располагаются в кристаллической решетке (ГПУ), электроны, присутствующие в валентной оболочке, делят пространство с другими атомами магния, и образуются молекулярные орбитали. Электроны, находящиеся на валентной оболочке, могут свободно перемещаться в кристалле. Металлическая связь, образованная между положительно заряженными ионами металлического магния (2+) и электроны. следовательно, это пример металлической связи.

Изображение Кредиты: химик
Медь (Cu)
Один электрон находится на внешней оболочке атома меди. Когда более одного атома меди располагаются в кристаллической решетке (ГЦК), электроны, присутствующие в самой внешней оболочке, делят междоузельное пространство с другим атомом меди, образуются молекулярные орбитали. Электроны, находящиеся на валентной оболочке, распределяются в междоузлиях металлического кристалла. Они могут свободно двигаться. Это пример металлической связки. В качестве металлической связи, образованной между ионами металла меди и электронами.
Железо (Fe)
Атом железа имеет восемь электронов в своей электронной оболочке. Когда атомы железа располагаются в кристаллической решетке (ОЦК и ГЦК), электроны, присутствующие в самой внешней оболочке, делят междоузельное пространство с другими атомами железа, и образуются молекулярные орбитали. Делокализация этих электронов происходит в междоузельном пространстве. Чем больше электронов, не связанных с атомами, становится доступным по мере увеличения числа валентных электронов. Это пример металлической связи. Металлическая связь, образованная между положительно заряженными ионами металла железа и электронами.
Подробнее о: 15 примеров координационных ковалентных связей: подробные сведения и факты
Часто задаваемые вопросы:
Вопрос 1. Что такое металлическое соединение?
Ответ: Металлическая связь может быть определена как
Сила притяжения существует между отрицательно заряженными подвижными электронами и положительно заряженными ионами металлов. Эта сила притяжения используется для удержания атомов металла вместе в металлическом кристалле.
Вопрос 2 . Растворяются ли металлические связи в воде?
Ответ: Растворимость металлических связей в воде
Металлические связи не растворяются в воде, но некоторые щелочные металлы, натрий и калий, растворяются в воде.
Вопрос 3. Являются ли металлические связи прочными?
Ответ: Да, металлические связи не являются слабыми связями.
Поскольку металлы требуют высоких температур для плавления и кипения. Для разрыва связей между атомами металла требуется большое количество энергии, поэтому они считаются прочными связями.
Подробнее о: Примеры тройной связи: подробные сведения и факты
Вопрос 4. В чем разница между металлической и ковалентной связью?
Ответ: Разница между металлическими и ковалентными связями заключается в следующем:
| Металлическая связка | Ковалентная связь |
| Сила притяжения существует между отрицательно заряженными подвижными электронами и положительно заряженными ионами металлов. | Ковалентная связь образуется, когда два атома стабилизируются, разделяя свои электроны. |
| Металлическая связь является ненаправленной связью. | Компания Ковалентная связь является направленным. |
| Металлическая связь формируется в твердом состоянии. | Ковалентная связь образуется в твердом, жидком и газообразном состоянии. |
| Металлические связи обладают высокой проводимостью тепла и электричества. | Ковалентные связи обладают низкой проводимостью тепла и электричества. |
| Металлические связи обладают такими свойствами, как пластичность и пластичность. | Ковалентные связи не обладают такими свойствами, как пластичность и пластичность. |
Читать еще : 4 примера неполярных ковалентных связей: подробные сведения и факты
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов – металлическую, ионную и водородную, свойственную кристаллам льда.
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
Me – ne⁻ ⇆ Me,
здесь n – число электронов, участвующих в образовании связи, как правило, от 1 до 3.
В левой части уравнения – атом металла, отдающий электроны, в правой – образовавшийся в результате ион.
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
- K – e⁻ ⇆ K;
- Cu – 2e⁻ ⇆ Cu;
- Al – 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
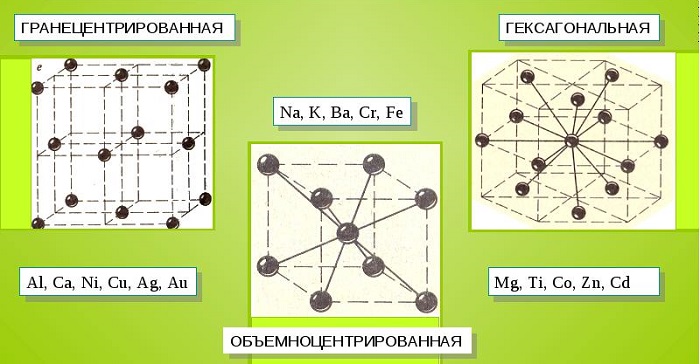
Металлические кристаллы подразделяются на 3 основных типа:
- Объемно-центрированную кубическую решетку, в которой, помимо размещения атомов в четырех вершинах куба, один из них размещается в центре объемной фигуры. Такой тип организации твердого вещества характерен для ряда металлов, включая K, Na и Li, вольфрам, хром, ниобий и др.
- Гранецентрированная кубическая решетка характеризуется расположением атомов в центре граней. Всего в ячейке задействовано 10 атомов, 4 в вершинах и 6 на гранях. Такая решетка встречается у меди, драгметаллов (серебра и золота) и металлов платиновой группы: Pd, Pt.
- Гексагональное строение решетки предполагает размещение атомов в углах и внутри 6-гранной призмы. Ячейка состоит из 15 атомов и свойственна магнию, кальцию, осмию, бериллию и ряду других металлических элементов.
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni – в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.
Характеристики, отличающие подобные вещества:
-
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
-
высокая проводимость тепла;
-
низкая реакционная способность или инертность;
-
пластичность – большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
Их общие черты:
-
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
-
металл высвобождает электроны и становится катионом;
-
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
- В узлах размещаются как положительно, так и отрицательно заряженные ионы. Каркас металлической решетки формируют исключительно катионы.
- Узлы удерживаются за счет электростатического взаимодействия.
- При низких температурах кристаллические вещества, образованные за счет ионного взаимодействия, проявляют свойства диэлектриков (не проводят ток).
- Переход электронов с атома металла происходит на орбиты атома неметалла.
Характерный пример кристалла с ионной связью – поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
Все металлы имеют сходные свойства: у них характерный металлический блеск, высокая ковкость, хорошая электропроводность и теплопроводность.

Рис. (1). Цинк
Рис. (2). Золото
Эти свойства металлов обусловлены наличием у них особого вида химической связи — металлической связи.
Особенность атомов металлов — небольшое число электронов на внешнем уровне и сравнительно большие радиусы. Поэтому атомы металлов в отличие от атомов неметаллов легко отдают наружные электроны и превращаются в положительные ионы:
Оторвавшиеся от атомов электроны перемещаются от одного иона к другому. Соединяясь с ионами, электроны временно превращают их в атомы:
Потом электроны снова отрываются и присоединяются к другим ионам и так далее.
Эти процессы происходят бесконечно, что можно выразить общей схемой:
Между электронами и положительными ионами возникает электростатическое взаимодействие. Отрицательные электроны и положительно заряженные ионы металла притягиваются.
Суть металлической связи заключается в притяжении положительных ионов металлов и обобществлённых электронов.
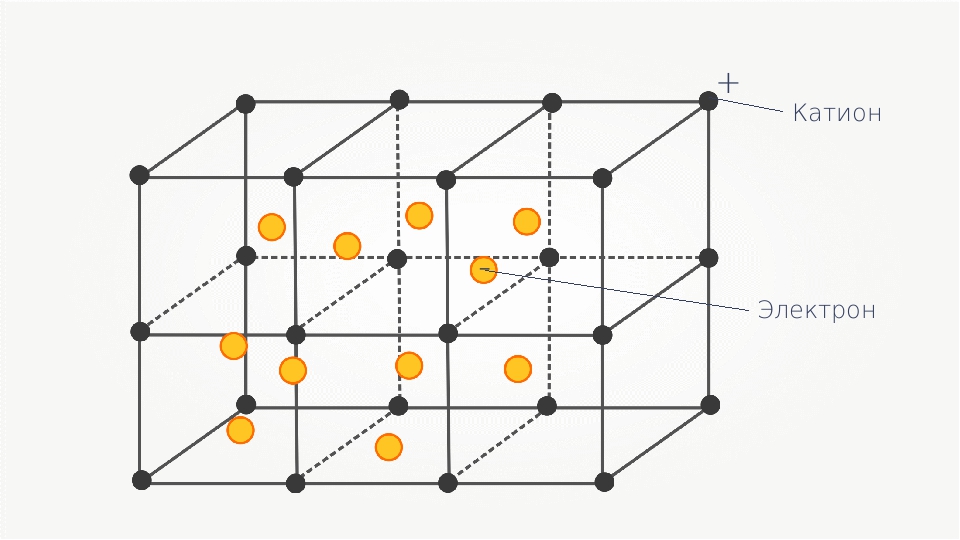
Кристаллическая структура металла — это катионы металла, вокруг которых свободно движется обобществлённое электронное облако, принадлежащее всему куску металла.
Рис. (3). Строение кристалла металла
Наличие свободных электронов в металлах обуславливает их общие физические свойства. Металлы хорошо проводят тепло и электрический ток, имеют характерный блеск и ковкость.
Число внешних электронов у атомов металлов различается. Оно равно номеру группы Периодической системы, в которой находится металл. Так, у щелочных металлов способен отрываться от атома один электрон, а у алюминия таких электронов три:
Металлическая связь характерна для чистых металлов и для смесей различных металлов — сплавов (бронза, сталь, чугун, латунь и т. д.), если они находятся в твёрдом или жидком состоянии.

Рис. (4). Сталь
Рис. (5). Изделия из латуни
В парообразном состоянии атомы металлов связаны между собой ковалентной связью. Например, парами натрия заполнены лампы жёлтого цвета для уличных фонарей. Натрий в газообразном состоянии образует двухатомные молекулы. Молекулы натрия неустойчивы, так как при их образовании атомы не получают
восьмиэлектронный внешний слой.
Источники:
Рис. 1. Цинк https://image.shutterstock.com/image-photo/close-zinc-metal-using-be-600w-1496747426.jpg
Рис. 2. Золото https://cdn.pixabay.com/photo/2014/11/01/22/33/gold-513062_960_720.jpg
Рис. 3. Строение кристалла металла © ЯКласс
Рис. 4. Сталь https://cdn.pixabay.com/photo/2020/08/30/04/58/steel-tube-5528518_960_720.jpg
Рис. 5. Изделия из латуни https://cdn.pixabay.com/photo/2016/11/15/18/46/sanitary-engineering-1827125_960_720.jpg
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 2 октября 2021 года; проверки требуют 10 правок.
Металли́ческая связь — химическая связь между атомами в металлическом кристалле, возникающая за счёт перекрытия (обобществления) их валентных электронов. Металлическая связь описывается многими физическими свойствами металлов, такими как прочность, пластичность, теплопроводность, удельное электрическое сопротивление и проводимость, непрозрачность и блеск[1][2][3][4].
Механизм металлической связи[править | править код]
В узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся электроны проводимости, происходящие из атомов металлов при образовании ионов. Эти электроны играют роль «цемента», удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Когда металл принимает какую-либо форму или растягивается, он не разрушается, потому что ионы в его кристаллической структуре довольно легко смещаются относительно друг друга[5]. Силы связи не локализованы и не направлены. В металлах в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).
Рис. 1. Расположение ионов в кристалле щелочного металла
Так, щелочные металлы кристаллизуются в кубической объёмно-центрированной решётке, и каждый положительно заряженный ион щелочного металла имеет в кристалле по восемь ближайших соседей — положительно заряженных ионов щелочного металла (рис. 1). Кулоновское отталкивание одноимённо заряженных частиц (ионов) компенсируется электростатическим притяжением к электронам связывающих звеньев, имеющих форму искажённого сплющенного октаэдра — квадратной бипирамиды, высота которой и рёбра базиса равны величине постоянной решётки aw кристалла щелочного металла (рис. 2).
Связывающие электроны становятся общими для системы из шести положительных ионов щелочных металлов и удерживают последние от кулоновского отталкивания.
Величина постоянной трансляционной решётки aw кристалла щелочного металла значительно превышает длину ковалентной связи молекулы щелочного металла, поэтому принято считать, что электроны в металле находятся в свободном состоянии:
| Щелочной металл | Li | Na | K | Rb | Cs |
|---|---|---|---|---|---|
| Постоянная решётки aw, Å[6] | 3,502 | 4,282 | 5,247 | 5,690 | 6,084 |
| Длина ковалентной связи для Me2, Å[7] | 2,67 | 3,08 | 3,92 | 4,10 | 4,30 |
Математическое построение, связанное со свойствами свободных электронов в металле, обычно отождествляют с «поверхностью Ферми», которую следует рассматривать как геометрическое место в k-пространстве, где пребывают электроны, обеспечивая основное свойство металла — проводить электрический ток[8]. Таким образом, электрический ток в металлах — это движение сорванных с орбитального радиуса электронов в поле положительно заряженных ионов, находящихся в узлах кристаллической решётки металла. Выход и вход свободных электронов в связывающее звено кристалла осуществляется через точки «0», равноудалённые от положительных ионов атомов (рис. 2).
Свободное движение электронов в металле подтверждено в 1916 году опытом Толмена и Стюарта по резкому торможению быстро вращающейся катушки с проводом — свободные электроны продолжали двигаться по инерции, в результате чего гальванометр регистрировал импульс электрического тока. Свободное движение электронов в металле обусловливает высокую теплопроводность металла и склонность металлов к термоэлектронной эмиссии, происходящей при умеренной температуре.
Колебание ионов кристаллической решётки создаёт сопротивление движению электронов по металлу, сопровождающееся разогревом металла. В настоящее время важнейшим признаком металлов считается положительный температурный коэффициент электрической проводимости, то есть понижение проводимости с ростом температуры. С понижением температуры электросопротивление металлов уменьшается, вследствие уменьшения колебаний ионов в кристаллической решётке. В процессе исследования свойств материи при низких температурах Камерлинг-Оннес открывает явление сверхпроводимости. В 1911 году ему удаётся обнаружить уменьшение электросопротивления ртути при температуре кипения жидкого гелия (4,2 К) до нуля. В 1913 году Камерлинг-Оннесу присуждается Нобелевская премия по физике со следующей формулировкой: «За исследование свойств веществ при низких температурах, которые привели к производству жидкого гелия».
Однако теория сверхпроводимости была создана позднее. В её основе лежит концепция куперовской электронной пары — коррелированного состояния связывающих электронов с противоположными спинамии и импульсами, и, следовательно, сверхпроводимость можно рассматривать как сверхтекучесть электронного газа, состоящего из куперовских пар электронов, через ионную кристаллическую решётку. В 1972 году авторам теории БКШ — Бардину, Куперу и Шрифферу присуждена Нобелевская премия по физике «За создание теории сверхпроводимости, обычно называемой БКШ-теорией».
Характерные кристаллические решётки[править | править код]
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Другие свойства[править | править код]
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Многие металлы обладают высокой твёрдостью, например хром, молибден, тантал, вольфрам и др. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей.
Расплавы металлов[править | править код]
Расплавы не теряют свойств кристаллических металлов. И теплопроводность и электропроводность остаётся высокой. В качестве примера можно привести ртутные контакты, в которых в полной мере используются электропроводность жидкой ртути.
Примечания[править | править код]
- ↑ Metallic bonding Архивная копия от 25 июля 2017 на Wayback Machine. chemguide.co.uk
- ↑ Metal structures Архивная копия от 24 апреля 2021 на Wayback Machine. chemguide.co.uk
- ↑ Chemical Bonds Архивная копия от 20 сентября 2015 на Wayback Machine. chemguide.co.uk
- ↑ PHYSICS 133 Lecture Notes Spring, 2004 Marion Campus. physics.ohio-state.edu
- ↑ Metallic bond (англ.). — статья из Encyclopædia Britannica Online. Дата обращения: 1 марта 2020.
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — Л.-М.: ГНТИ Химической литературы, 1962. — Т. 1. — С. 402—513. — 1072 с.
- ↑ Лидин Р. А., Андреева Л. Л., Молочко В. А. Справочник по неорганической химии. Константы неорганических веществ.. — М.: Химия, 1987. — С. 132—136. — 320 с.
- ↑ Зиман Дж. Электроны в металлах (введение в теорию поверхностей Ферми) // Успехи физических наук. — 1962. — Т. 78, вып. 2. — С. 291. — doi:10.3367/UFNr.0078.196210c.0291.
Что такое металлическая химическая связь
Добавлено: 17 марта 2022 в 11:38
Что представляет из себя химическая связь?
Как всем известно со школьного курса химии, объединение атомов в молекулу вещества происходит посредством образования химических связей — электростатического взаимодействия ядер атомов и электронов. Так как электроны на внешнем слое связаны с ядром гораздо слабее, следовательно, являются более подвижными и называются валентными.
Химические связи классифицируются на несколько типов:
- ионная;
- ковалентная;
- водородная;
- вандерваальсова;
- металлическая.
Металлическая связь: механизм образования, примеры веществ, особенности
Металлическая химическая связь
Если обратиться к таблице Менделеева, можно заметить, что большинство металлов содержит малое число валентных электронов на внешнем уровне. Ввиду высокой подвижности в кристаллической решетке довольно легко происходит их отрыв с образованием положительно заряженного катиона металла и свободных электронов — т.н. «электронного газа».
Таким образом, в структуре металла происходит постоянный обмен электронами и образование как ионов, так и электрически нейтральных атомов металла по механизму:
атом M0 — ne ↔ ион Mn+
Кристаллическую решетку металлов можно представить как «скелет» из атомов, по которому перемещаются электроны из «электронного газа». Для разных металлов характерны различные виды строения решеток:
- объёмно-центрическая кубическая решетка (Li, Na, K, Rb, Cs, Fr);
- гранецентрическая кубическая решетка (Zn, Al, Cu и другие переходные металлы);
- гексагональная (все щелочноземельные металлы, кроме бария);
- тетрагональная — у индия;
- ромбоэдрическая — у ртути.
Металлическая связь: механизм образования, примеры веществ, особенности
Отличия от других видов
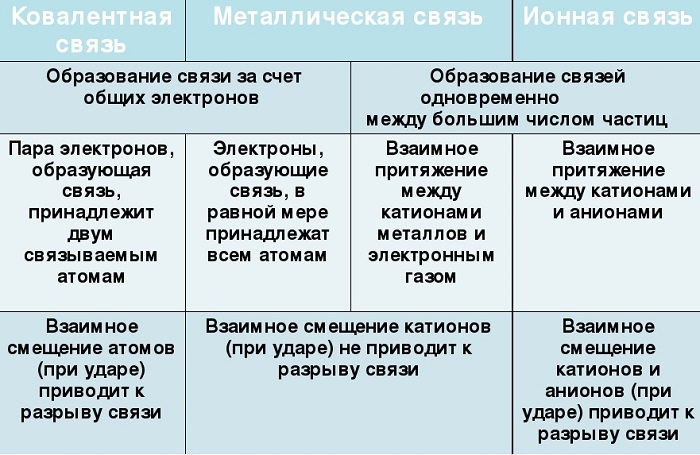
Главными характеристиками сравнения типов химических связей являются прочность, энергия образования (разрыва) и насыщаемость.
Рассмотрим их более подробно:
- Энергия металлической связи гораздо ниже, чем в ковалентной и ионной, что и обуславливает их прочность, согласно принципу стремления любой системы к минимуму энергии.
- Насыщаемость также не характерна для взаимодействия между атомами металлов. То есть количество атомов, вступающих во взаимодействие, не ограничивается числом валентных электронов, в отличие от тех же ковалентных связей.
Металлическая связь: механизм образования, примеры веществ, особенности
Схема связи и примеры
Обмен электронами в металлах происходит по следующему механизму:
- К — nе <—> Кn+
- Al — 3e <—> Al3+
- Li — e <—> Li+
- Mg — 2e <—> Mg2+
- In — 3e <—> In3+
Как показывает данная схема, образование металлической связи зависит от числа валентных электронов на внешнем слое — одновалентные ионы натрия могут отдать один электрон в образование общего «электронного облака», двухвалентные ионы магния — два электрона и так далее.
Голова кругом, да?
Разобраться в сложном переплетении электронов и ионов вам помогут наши онлайн курсы по химии для школьников. Занятия проходят в узком кругу слушателей, что позволяет уделять внимание каждому ребенку и отвечать развернуто на все заданные вопросы по предмету.
Свойства металлов
Металлическая связь: механизм образования, примеры веществ, особенности
Особый вид взаимодействия, который характерен для атомов металлов, определяет ряд объединяющих их свойств и отличающих металлы от других веществ:
- высокие температуры плавления и кипения;
Высокие температуры плавления и кипения обусловлены тем, что катионы металла прочно связаны «электронным газом». При этом выявлена тенденция зависимости прочности связи от числа валентных электронов. Например, калий и натрий с температурой плавления 64 и 98 градусов Цельсия соответственно как одновалентные металлы являются легкоплавкими веществами по сравнению с, например, тугоплавким хромом (1615 градусов Цельсия).
- ковкость и пластичность (при механическом воздействии металлы не бьются и не крошатся, а подвергаются неупругой деформации);
Металлическая связь: механизм образования, примеры веществ, особенности
Равномерностью распределения валентных электронов по кристаллу объясняется, например, такое свойство металлов, как пластичность — смещение ионов и атомов в любых направлениях без разрушения взаимодействия между ними.
- способность отражать свет (характерный для всех элементов-металлов серебристо-серый блеск на срезе),
- высокая электропроводность и теплопроводность (использование металлов в электрических цепях приборов в качестве проводников).
Свободный обмен электронами между атомными орбиталями обуславливает и электропроводность металлов. «Электронный газ» с учетом разности электрохимических потенциалов переходит из беспорядочного движения к направленному.
Большое значение в промышленности играют сплавы металлов, сочетающие в себе свойства входящих в состав элементов.
Металлический тип взаимодействия также характерен и для сплавов, находящихся в твёрдом и жидком состояниях. Однако, если металл нагреть до состояния пара, то связь между его атомами будет ковалентная и структура металла из цельной решетки перейдет в одно- или двухатомное состояние.
Занимайтесь на курсах ЕГЭ и ОГЭ в паре TwoStu и получите максимум баллов на экзамене:

Эксперт по подготовке к ЕГЭ, ОГЭ и ВПР
Задать вопрос
Закончил Московский физико-технический институт (Физтех) по специальности прикладная физика и математика. Кандидат физико-математичеких наук. Преподавательский стаж более 10 лет. Соучредитель курсов ЕГЭ и ОГЭ в паре TwoStu.