Недавно
мы говорили о размерах молекул и выяснили, что они очень малы. Как вы
понимаете, измерять массу молекул в обычных единицах массы, таких как
килограммы или граммы, крайне неудобно. Поэтому люди придумали относительную
молекулярную массу. Относительная молекулярная (или атомная) масса вещества —
это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
Дело
в том, что углерод входит в множество веществ, и по международному соглашению
было решено использовать углеродную шкалу атомных масс. Нетрудно догадаться,
что относительная молекулярная масса — это безразмерная величина, поскольку
она показывает во сколько раз масса данной молекулы (или атома) больше массы
одной двенадцатой атома углерода. Тем не менее, молекулярную массу
условились измерять в атомных единицах массы (а. е. м.).
Относительные
массы всех химических элементов измерены с высокой точностью, и их можно найти
в таблице Менделеева.
Например,
относительная атомная масса водорода равна 1, относительная атомная масса гелия
равна 4 и так далее.
Зная
атомные массы можно вычислить и молекулярную массу. Например, относительная
молекулярная масса соляной кислоты равна
Аналогичным
способом можно вычислить массы других молекул. Например, молекула серной кислоты
состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода.
Таким образом, относительная молекулярная масса серной кислоты равна .
Еще
одно понятие, с которым необходимо ознакомиться при изучении
молекулярно-кинетической теории — это количество вещества. Можно,
конечно, определить количество вещества, как количество молекул, содержащихся в
данном теле. Но, как мы уже убедились, это количество просто огромно для любого
макроскопического тела, поэтому нам снова нужно ввести специальную величину.
Эта величина так и называется «количество вещества» и обозначается буквой ν.
Единицей измерения количества вещества является моль: .
1
моль — это количество вещества, в котором содержится столько же молекул или
атомов, сколько содержится атомов в 12 г углерода.
Это
число было определено Амедео Авогадро еще в 19 веке. Один моль любого вещества
содержит 6,02 х 1023 молекул. Это число называется числом
Авогадро или постоянной Авогадро.
Таким
образом, зная число молекул в теле, можно определить количество вещества:
С
постоянной Авогадро связана и другая величина, которая называется молярной
массой — это масса данного вещества, взятого в количестве 1 моль.
Исходя
из этого, можно заключить, что молярная масса вещества равна .
Как
видно из этого уравнения, молярная масса измеряется .
Заметим, что массу любого вещества можно представить, как произведение массы
молекулы этого вещества и количества молекул, содержащегося в данном веществе:
Тогда
можно записать:
Необходимо
отметить, что молярную массу можно также взять из таблицы Менделеева, как и
молекулярную массу. Они численно равны, но следует понимать, что они обозначают
различные величины, а потому измеряются в различных единицах измерения. В
таблице Менделеева молярная масса указана в г/моль, поэтому нельзя забывать
переводить её в кг/моль при решении задач по физике.
Пример
решения задачи.
Задача
1. Определите
массу 3 моль углекислого газа.
Масса молекул. Количество вещества
У нас есть пластмассовые шарики и гирька, как нам определить, где больше вещества?
Положим шарики и гирьку на весы для сравнения массы (Рис. 1):
Рис. 1. Определение массы
Мы видим, что одна гирька значимо перевешивает семь пластмассовых шариков. Опыт с весами дает нам ответ – больше вещества в железной гирьке, это если мы сравниваем массы – меры инертности железа и пластмассы.
А что если мы сравним не массы, а количество вещества, которое пошло на изготовление шариков и гирьки, фактически количество частиц, из которых они состоят? Взяв в руки шарики и гирьку, мы увидим, что гирька фактически теряется на фоне этих шариков. Если бы мы умели считать количество частиц, которые входят в железо и пластмассу, то мы бы увидели, что количество атомов железа окажется значительно меньше количества молекул во всех пластмассовых шариках. Значит вещества больше в пластмассе.
Правильными являются оба ответа.
Все дело в том, что в первом случае мы сравнивали массу, то есть меру инертности тел, а во втором случае мы сравнивали количество молекул, количество вещества.
Простую аналогию мы можем провести с сахаром в мерном стаканчике. На вопрос, сколько там сахара, можно ответить, посмотрев на деление стаканчика и ориентировочно сказать, сколько там граммов сахара. Можно пересчитать каждую крупинку, находящуюся в стаканчике, и ответить, какое количество их содержит стаканчик. Правильными будут и первый, и второй ответы. Когда же удобнее говорить о массе молекул, а когда удобнее говорить о количестве вещества? Именно это и является темой урока: «Масса молекул, Количество вещества».
Количество молекул. Число Авогадро
В XIX веке итальянский ученый Авогадро установил интересный факт: если два разных газа, например водород и кислород, находятся в одинаковых сосудах, при одинаковых давлениях и температурах, то в каждом сосуде будет одинаковое количество молекул, хотя массы газов могут отличаться очень сильно, в нашем примере – в 16 раз (рис. 2).
Рис. 2. Опыт Авогадро
Все это обозначает, что некоторые свойства тела определяются именно количеством молекул, а не только массой.
Что же мы понимаем под термином «количество вещества»? Любое вещество состоит из молекул, атом, ионов – значит, имеет смысл под количеством вещества понимать количество молекул.
Физическая величина, которая определяет количество молекул в данном теле, называется количеством вещества. Обозначается греческой буквой ν – ню.
Условились за единицу количества вещества принять такое его количество, в котором содержится столько частиц (атомов, молекул), сколько атомов содержится в 0,012 кг (12 граммах) изотопа углерода с атомной массой 12.
Называется эта единица моль.
Из этого определения выходит, что в одном моле любого вещества будет одинаковое количество молекул. В одном моле любого вещества содержится 6,02·1023 молекул или частиц. Эта величина носит название постоянная Авогадро.
Рис. 3. Определение полного числа молекул
Эта формула позволяет узнать полное число молекул при известном количестве вещества.
Масса молекул
Масса молекулы крайне мала. Определили это физики при помощи так называемого масс-спектрографа. К примеру, значение массы молекулы воды (рис. 4):
Рис. 4. Определение массы молекулы воды
Как мы видим, так же, как и в случаях с количеством вещества, сравнивать массу одной молекулы с эталоном массы, килограммом, не очень удобно. Если в случаях с количеством вещества числа огромны, то в случаях с массой молекул числа очень малы. Именно поэтому в качестве единицы измерения массы молекулы или атома была выбрана особая внесистемная единица – атомная единица массы. Мы будем сравнивать единицу массы не с эталоном, а с массой молекулы какого-то вещества.
Этим веществом стал самый распространенный в природе элемент – углерод, который входит во все органические соединения. Атомная единица массы равна:
1 а.е.м. = 1/12 массы углерода – 12 (изотоп, в котором 12 нуклонов)
1 а.е.м. = 1, 66·10-27 кг
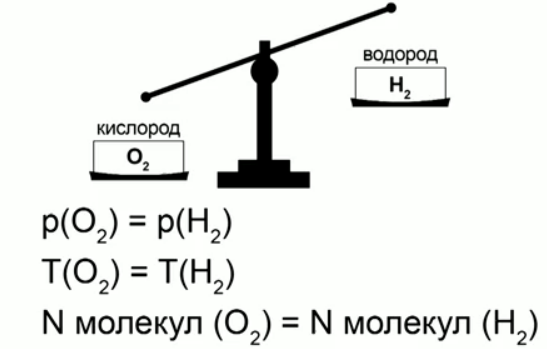
Так как мы будем измерять массу молекул в атомных единицах массы, то мы приходим к новой физической величине – относительная молекулярная масса.
Отношение массы молекулы (атома) данного вещества к 1/12 массы атома углерода называется относительной молекулярной массой (или относительной атомной массой) в случае атомарного строения вещества.
Формулы, выражающие это определение:
Относительная молекулярная масса – это безразмерная величина, она ни в чем не измеряется. Нам ничего не мешает по-прежнему измерять массы атомов и молекул в килограммах тогда, когда нам это будет удобно. Из курса химии мы знаем, что: относительная молекулярная масса вещества равна сумме относительных атомных масс элементов, входящих в него. Например, для воды Н2О относительная молекулярная масса будет:
Мr = 1·2 + 16 = 18
Сумма относительной молекулярной массы кислорода (16) и двух водородов (2•1) даст 18
Как же найти общее между массой в килограммах и количеством вещества в молях? Это величина – молярная масса.
Молярная масса – это масса одного моля вещества.
Обозначается [ М ], измеряется в кг/моль.
Молярная масса равна отношению массы к количеству вещества:
М = 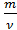
Получим формулы, которые связывают различные характеристики молекул.
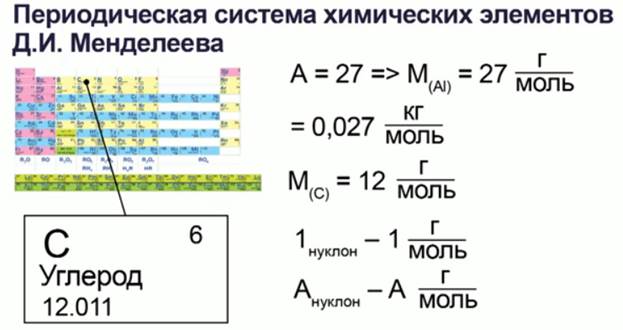
Для определения молярной массы химического элемента обратимся к периодической таблице химических элементов Менделеева – берем просто атомную массу А (число нуклонов необходимого элемента) – это и будет его молярная масса, выраженная в г/моль.
Например, для алюминия (рис. 5):
Рис. 5. Определение молярной массы вещества
Атомная масса алюминия будет равна 27, а молярная масса будет равна 0,027 кг/моль.
Это объясняется тем, что молярная масса углерода равна 12 г/моль по определению, в то же время ядро атома углерода содержит 12 нуклонов – 6 протонов и 6 нейтронов, выходит, что каждый нуклон вносит в молярную массу 1 г/моль, поэтому молярная масса химического элемента с атомной массой А окажется равной А г/моль.
Молярная масса вещества, молекула которого состоит из нескольких атомов, получается простым суммированием малярных масс, так например (рис. 6):
Рис. 6. Молярная масса углекислого газа
Нужно быть особо внимательными с молярными массами некоторых газов, таких как газообразный водород, азот, кислород – их молекула состоит из двух атомов – H2, N2, O2, а гелий, часто встречающийся в задачах, является одноатомным и имеет молекулярную массу 4 г/моль, предписанную таблицей Менделеева (рис. 7).
Рис. 7. Молярные массы некоторых газов
В одном моле любого вещества содержится число Авогадро молекул, значит, если умножить число Авогадро (число молекул в одном моле) на массу одной молекулы m0, то мы получим молярную массу вещества, то есть массу одного моля вещества:
М = m0 · NА
Если 25 учеников занимаются в классе, площадь которого 50 м2, то на каждого ученика приходится 2 м2. При переходе их на занятие в спортзал, площадь которого 500 м2, на каждого ученика уже будет приходиться 20 м2. Число учеников не изменилось, но они стали реже расположенными, в этом случае говорят: уменьшилась концентрация людей. Точно так же для молекул вводится понятие концентрации в молекулярной кинетической теории.
Концентрацией (n) называется количество молекул, приходящихся на единицу объема вещества. Она равна отношению числа молекул к объему:
n =
[n] = 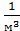
Формулы, связывающие концентрацию с другими характеристиками молекул:
Пользуясь этими формулами, мы можем сравнивать вещества как по количеству молекул, так и по массе.
Основные положения МКТ. Масса и размер молекул. Количество вещества. Молекулярная физика
- Подробности
- Обновлено 07.10.2018 21:04
- Просмотров: 1192
МКТ – это просто!
«Ничто не существует, кроме атомов и пустого пространства …» – Демокрит
«Любое тело может делиться до бесконечности» – Аристотель
Основные положения молекулярно-кинетической теории (МКТ)
Цель МКТ – это объяснение строения и свойств различных макроскопических тел и тепловых явлений, в них протекающих, движением и взаимодействием частиц, из которых состоят тела.
Макроскопические тела – это большие тела, состоящие из огромного числа молекул.
Тепловые явления – явления, связанные с нагреванием и охлаждением тел.
Основные утверждения МКТ
1. Вещество состоит из частиц (молекул и атомов).
2. Между частицами есть промежутки.
3. Частицы беспорядочно и непрерывно движутся.
4. Частицы взаимодействуют друг с другом (притягиваются и отталкиваются).
Подтверждение МКТ:
1. экспериментальное
– механическое дробление вещества; растворение вещества в воде; сжатие и расширение газов; испарение; деформация тел; диффузия; опыт Бригмана: в сосуд заливается масло, сверху на масло давит поршень, при давлении 10 000 атм масло начинает просачиваться сквозь стенки стального сосуда;
– диффузия; броуновское движение частиц в жидкости под ударами молекул;
– плохая сжимаемость твердых и жидких тел; значительные усилия для разрыва твердых тел; слияние капель жидкости;
2. прямое
– фотографирование, определение размеров частиц.
Броуновское движение
Броуновское движение – это тепловое движение взвешенных частиц в жидкости (или газе).
Броуновское движение стало доказательством непрерывного и хаотичного (теплового) движения молекул вещества.
– открыто английским ботаником Р. Броуном в 1827 г.
– дано теоретическое объяснение на основе МКТ А. Эйнштейном в 1905 г.
– экспериментально подтверждено французским физиком Ж. Перреном.
Масса и размеры молекул
Размеры частиц
Диаметр любого атома составляет около см.
Число молекул в веществе
где V – объем вещества, Vo – объем одной молекулы
Масса одной молекулы
где m – масса вещества,
N – число молекул в веществе
Единица измерения массы в СИ: [m]= 1 кг
В атомной физике массу обычно измеряют в атомных единицах массы (а.е.м.).
Условно принято считать за 1 а.е.м. :
Относительная молекулярная масса вещества
Для удобства расчетов вводится величина – относительная молекулярная масса вещества.
Массу молекулы любого вещества можно сравнить с 1/12 массы молекулы углерода.
где числитель – это масса молекулы, а знаменатель – 1/12 массы атома углерода
– это величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса химического элемента
где числитель – это масса атома, а знаменатель – 1/12 массы атома углерода
– величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса каждого химического элемента дана в таблице Менделеева.
Другой способ определения относительной молекулярной массы вещества
Относительная молекулярная масса вещества равна сумме относительных атомных масс химических элементов, входящих в состав молекулы вещества.
Относительную атомную массу любого химического элемента берем из таблицы Менделеева!)
Количество вещества
Количество вещества (ν) определяет относительное число молекул в теле.
где N – число молекул в теле, а Na – постоянная Авогадро
Единица измерения количества вещества в системе СИ: [ν]= 1 моль
1 моль – это количество вещества, в котором содержится столько молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг.
Запомни!
В 1 моле любого вещества содержится одинаковое число атомов или молекул!
Но!
Одинаковые количества вещества для разных веществ имеют разную массу!
Постоянная Авогадро
Число атомов в 1 моле любого вещества называют числом Авогадро или постоянной Авогадро:
Молярная масса
Молярная масса (M) – это масса вещества, взятого в одном моле, или иначе – это масса одного моля вещества.
где
– масса молекулы
– постоянная Авогадро
Единица измерения молярной массы: [M]=1 кг/моль.
Формулы для решения задач
Эти формулы получаются в результате подстановки вышерассмотренных формул.
Масса любого количества вещества
и формула для 7 класса
Количество вещества
Число молекул в веществе
Молярная масса
Масса одной молекулы
Связь между относительной молекулярной массой и молярной массой
Молекулярная физика. Термодинамика – Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. —
Взаимодействие молекул. Строение твердых тел, жидкостей и газов. —
Идеальный газ. Основное уравнение МКТ. —
Температура. Тепловое равновесие. Абсолютная шкала температур. —
Уравнение состояния идеального газа. —
Изопроцессы. Газовые законы. —
Взаимные превращения жидкостей и газов. Влажность воздуха. —
Твердые тела. Кристаллические тела. Аморфные тела.
Перейти к содержимому
- Свойства паров, жидкостей и твердых тел
- Давление насыщенного пара
Давление насыщенного пара (p0) не зависит от объёма, а зависит от температуры (T) и концентрации молекул пара (n)
,
где k – постоянная Больцмана
СИ: Па - Относительная влажность воздуха
Относительной влажностью воздуха (φ) называют отношение парциального давления (р) водяного пара, содержащегося в воздухе при данной температуре, к давлению (р0) насыщенного пара при той же температуре, выраженной в процентах.
%
СИ: % - Абсолютная влажность воздуха
Абсолютная влажность воздуха (ρ):
1) давление, оказываемое водяным паром при данных условиях:;
2) это масса (m) водяного пара в единице объёма (V = 1 м3) воздуха:;
СИ: Па, кг/м3 - Коэффициент поверхностного натяжения жидкости
Коэффициент поверхностного натяжения (σ) жидкости равен отношению модуля силы поверхностного натяжения (F) к длине (l) границы поверхности натяжения, на которую действует эта сила.
СИ: Н/м - Высота поднятия жидкости в капилляре
Высота (h) поднятия жидкости в капиллярной трубке (капилляре) прямо пропорциональна коэффициенту поверхностного натяжения (σ) и обратно пропорциональна плотности жидкости (ρ) и радиусу (r) капиллярной трубки.
- Капиллярное давление
Капиллярное давление (p) жидкости в капилляре пропорционально коэффициенту поверхностного натяжения (σ) и обратно пропорционально радиусу капиллярной трубки (r).
СИ: Па - Абсолютная деформация (удлинение — сжатие)
Абсолютная деформация (Δl) — разность линейных размеров (l0 и l) твердого тела до и после приложения к нему силы.
СИ: мм - Относительная деформация (удлинение — сжатие)
Относительная деформация (ε) — отношение абсолютной деформации (Δl) к начальной длине твердого тела (l0).
- Механическое напряжение
Механическое напряжение (σ) — это отношение модуля силы упругости (F) к площади поперечного сечения (S) тела.
СИ: Па - Закон Гука для твердого тела
При малых деформациях напряжение (σ) прямо пропорционально относительному удлинению (ε)
СИ: Па - Модуль упругости (модуль Юнга)
Модуль продольной упругости (Е) — постоянная для данного материала величина, численно равная механическому напряжению (σ), которое необходимо создать в теле, чтобы его относительное удлинение (ε) достигло единицы
СИ: Па - Коэффициент запаса прочности
Коэффициент запаса прочности (n) — это величина, показывающая во сколько раз напряжение (σпч), соответствующее пределу прочности, превышает напряжение (σдоп), допустимое для твердого тела в данных условиях нагружения.
n=σпч/σдоп
- Основы термодинамики
- Внутренняя энергия одноатомного газа
Внутренняя энергия (U) идеального одноатомного газа прямо пропорциональна количеству вещества (m/М) и его абсолютной температуре (T)
СИ: Дж - Внутренняя энергия многоатомного газа
Внутренняя энергия (U) идеального многоатомного газа прямо пропорциональна его абсолютной температуре (Т) и определяется числом степеней свободы (i) идеального газа.
,
где i=3 – одноатомного;
i=5 – двухатомных;
i=6 – трехатомных и более.
СИ: Дж - Работа внешних сил над газом
Работа (А) внешних сил, изменяющих объём газа при изобарном процессе, равна произведению давления (p) на изменение объёма (ΔV) газа.
СИ: Дж - Первый закон термодинамики
1) Изменение внутренней энергии (ΔU) системы при переходе её из одного состояния в другое равно сумме работы внешних сил (А) и количества теплоты (Q), переданного системе:;
2) Количество теплоты (Q), переданное системе, идет на изменение её внутренней энергии (ΔU) и на совершение системой работы (А’) над внешними телами:.
СИ: Дж - Применение первого закона термодинамики
1) При изохорном процессе изменение внутренней энергии (ΔU) равно количеству переданной теплоты (Q):, (при V=const)
2) При изотермическом процессе все переданное газу количество теплоты (Q) идет на совершение работы (А’):, (при T=const)
3) При изобарном процессе передаваемое газу количество теплоты (Q) идет на изменение его внутренней энергии (ΔU) и на совершение работы (А’):, (при p=const)
4) При адиабатном процессе изменение внутренней энергии (ΔU) происходит только за счет совершение работы (А):, (при Q=0)
СИ: Дж - Работа теплового двигателя
Работа (А’), совершаемая тепловым двигателем, равна разности количества теплоты (Q1), полученного от нагревателя, и количества теплоты (Q2), отданного холодильнику
СИ: Дж - КПД теплового двигателя
Коэффициентом (η) полезного действия (КПД) теплового двигателя называют отношение работы (А’), совершаемой двигателем, к количеству теплоты (Q1), полученному от нагревателя.
;
СИ: Дж - КПД идеальной Тепловой машины
Реальная тепловая машина, работающая с нагревателем, имеющим температуру (T1), и холодильником с температурой (Т2), не может иметь КПД, превышающий КПД (7 тах) идеальной тепловой машины.
- Электростатика
- Закон сохранения заряда
В замкнутой системе алгебраическая сумма зарядов (q1, q2,…, qn,) всех частиц остается неизменной.
СИ: Кл - Закон Кулона
Сила взаимодействия (F) двух точечных неподвижных заряженных тел в вакууме прямо пропорциональна произведению модулей заряда (q1 и q2) и обратно пропорциональна квадрату расстояния между ними.
,
где k=9×109 (Н×м2)/Кл2 — коэффициент пропорциональности.
СИ: Н - Заряд электрона
Заряд электрона (е) — минимальный, механически неделимый, отрицательный заряд, существующий в природе.
e=1,6×10-19
СИ: Кл - Напряженность электрического поля
Напряженность электрическою поля () равна отношению силы (
), с которой поле действует на точечный заряд, к этому заряду (q).
СИ: Н/Кл; В/м - Напряженность поля точечного заряда (в вакууме)
Модуль напряженности (Е) поля точечного заряда (q0) на расстоянии (r) от него равен:,
где k=9×109 (Н×м2)/Кл2 — коэффициент пропорциональности.
СИ: Н/Кл - Принцип суперпозиции полей
Если в данной точке пространства заряженные частицы создают электрические поля, напряженности которых (), то результирующая напряженность поля в этой точке равна геометрической (векторной) сумме напряженностей.
СИ: Н/Кл - Диэлектрическая проницаемость
Диэлектрическая проницаемость (ε) — это физическая величина, показывающая, во сколько раз модуль напряженности (Е) электрического поля внутри однородного диэлектрика меньше модуля напряженности (Е0) поля в вакууме.
- Работа при перемещении заряда в однородном электростатическом поле
Работа (А) при перемещении заряда (q) в однородном электростатическом поле напряженностью (Е) не зависит от формы траектории движения заряда, а определяется величиной перемещения (Δd=d2-d1) заряда вдоль силовых линий поля.
СИ: Дж - Потенциальная энергия заряда
Потенциальная энергия (Wp) заряда в однородном электростатическом поле равна произведению величины заряда (q) на напряженность (Е) поля и расстояние (d) от заряда до источника поля.
СИ: Дж - Потенциал электростатического поля
Потенциал (φ) данной точки электростатического поля численно равен:
1) потенциальной энергии (Wp) единичного заряда (q) в данной точке:;
2) произведению напряженности (Е) поля на расстояние (d) от заряда до источника поля:
СИ: В - Напряжение (разность потенциалов)
Напряжение (U) или разность потенциалов (φ1-φ2) между двумя точками равна отношению работы поля (А) при перемещении заряда из начальной точки в конечную к этому заряду (q).
СИ: В - Связь между напряженностью и напряжением
Чем меньше меняется потенциал () на расстоянии (Δd), тем меньше напряженность (Е) электростатического поля.
СИ: В/м - Электроёмкость
Электроёмкость (C) двух проводников — это отношение заряда (q) одного из проводников к разности потенциалов (U) между этим проводников и соседним.
СИ: Ф - Электроёмкость конденсатора
Электроёмкость плоского конденсатора (C) прямо пропорциональна площади пластин (S), диэлектрической проницаемости (ε) размещенного между ними диэлектрика, и обратно пропорциональна расстоянию между пластинами (d).
,
ε0=8,85×10-12 Кл2/(Н×м2) – электрическая постоянная
СИ: Ф - Энергия заряженного конденсатора
Энергия (W) заряженного конденсатора равна:
1) половине произведения заряда (q) конденсатора на разность потенциалов (U) между его обкладками:;
2) отношению квадрата заряда (q) конденсатора к удвоенной его ёмкости (С):;
3) половине произведения ёмкости конденсатора (C) на квадрат разности потенциалов (U) между его обкладками:.
СИ: Дж - Электроёмкость шара
Электроёмкость шара радиусом R, помещенного в диэлектрическую среду с проницаемостью ε, равна:
СИ: Ф - Параллельное соединение конденсаторов
Общая ёмкость (Cобщ) конденсаторов, параллельно соединенных на участке электрической цепи, равна сумме ёмкостей (C1, C2, C3,…) отдельных конденсаторов.
Cобщ=C1+C2+C3+…+ Cn
СИ: Ф - Последовательное соединение конденсаторов
Величина, обратная общей ёмкости (Cобщ) конденсаторов, последовательно соединенных на участке электрической цепи, равна сумме величин, обратных ёмкостям (C1, C2, C3,…) отдельных конденсаторов.
1/Cобщ= 1/C1+1/C2+1/C3+…+ 1/Cn
СИ: Ф
- Законы постоянного тока
- Сила тока
Сила тока (I) равна:
1) отношению заряда (Δq), переносимого через поперечное сечение проводника за интервал времени (Δt), к этому интервалу времени;
2) произведению концентрации (n) заряженных частиц в проводнике, заряду каждой частицы (q0), скорости (v) движения заряженных частиц в проводнике и площади поперечного сечения (S) проводника.
,
СИ: A - Закон Ома для участка цепи
Сила тока (I) прямо пропорциональна приложенному напряжению (U) и обратно пропорциональна сопротивлению проводника (R)
СИ: A - Сопротивление проводника
Сопротивление (R) проводника зависит от материала проводника (удельного сопротивления ρ) и его геометрических размеров (длины l и площади поперечного сечения S).
СИ: Ом - Удельное сопротивление проводника
Удельное сопротивление (ρ) проводника — величина, численно равная сопротивлению проводника длиной (l) один метр и площадью поперечного сечения (S) один квадратный метр.
СИ: Ом×м - Работа постоянного тока
Работа (А) постоянного тока на участке цепи:
1) равна произведению силы тока (I), напряжения (U) и времени (t), в течение которого совершалась работа:;
2) равна произведению квадрата силы тока (I), сопротивления участка цепи (R) и времени (t):;
3) пропорциональна квадрату напряжения (U), времени (t) и обратно пропорционально сопротивлению (R) участка цепи:.
СИ: Дж - Мощность тока
Мощность (Р) постоянного тока на участке цепи равна:
1) работе (А) тока, выполняемой за единицу времени (t):;
2) произведению напряжения (U) и силы тока (I):;
3) произведению квадрата силы тока (I) и сопротивления (R):;
4) отношению квадрата напряжения (U) к сопротивлению (R):
СИ: Вт - Электродвижущая сила (ЭДС)
Электродвижущая сила в замкнутом контуре (ξ) представляет собой отношение работы сторонних сил (Аст) при перемещении заряда внутри источника тока к заряду (q).
ξ=Аст/q
СИ: В - Закон Ома для полной цепи
Сила тока (I) в полной цепи равна отношению ЭДС(ξ) цепи к её полному сопротивлению (внутреннему сопротивлению r и внешнему R).
СИ: A - Последовательное соединение источников тока
Если цепь содержит несколько последовательно соединенных элементов с ЭДС (ξ1, ξ2, ξ3,…), то полная ЭДС цепи (ξ) равна алгебраической сумме ЭДС отдельных элементов.
ξ=ξ1+ξ2+ξ3+…
СИ: В - Параллельное соединение источников тока
Если цепь содержит несколько параллельно соединенных элементов с равными ЭДС (ξ1=ξ2=ξ3=…), то полная ЭДС цепи (ξ) равна ЭДС каждого элемента.
ξ=ξ1=ξ2=ξ3=…
СИ: В
Основные формулы молекулярной физики
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
В кодификаторе ЕГЭ нет тем, непосредственно относящихся к содержанию данного листка. Однако без этого вводного материала дальнейшее изучение молекулярной физики невозможно.
Введём основные величины молекулярной физики и соотношения между ними.
— масса вещества,
— объём вещества,
— плотность вещества (масса единицы объёма). Отсюда
— число частиц вещества (атомов или молекул).
— масса частицы вещества. Тогда
— концентрация вещества (число частиц в единице объёма),
. Отсюда
Что получится, если умножить на
? Произведение массы частицы на число частиц в единице объёма даст массу единицы объёма, т. е. плотность. Формально:
Итак,
Массы и размеры частиц невообразимо малы по нашим обычным меркам. Например, масса атома водорода порядка г, размер атома порядка
см. Из-за столь малых значений масс и размеров число частиц в макроскопическом теле огромно.
Оперировать столь грандиозными числами, как число частиц, неудобно. Поэтому для измерения количества вещества используют специальную единицу — моль.
Один моль — это количество вещества, в котором содержится столько же атомов или молекул, сколько атомов содержится в граммах углерода. А в
граммах углерода содержится примерно
атомов. Стало быть, в одном моле вещества содержится
частиц. Это число называется постоянной Авогадро:
моль
.
Количество вещества обозначается . Это число молей данного вещества.
Что получится, если умножить на
? Число молей, умноженное на число частиц в моле, даст общее число частиц:
Масса одного моля вещества называется молярной массой этого вещества и обозначается (
= кг/моль). Ясно, что
Как найти молярную массу химического элемента? Оказывается, для этого достаточно заглянуть в таблицу Менделеева! Нужно просто взять атомную массу (число нуклонов) данного элемента — это будет его молярная масса, выраженная в г/моль. Например, для алюминия
, поэтому молярная масса алюминия равна
г/моль или
кг/моль.
Почему так получается? Очень просто. Молярная масса углерода равна г/моль по определению. В то же время ядро атома углерода содержит
нуклонов. Выходит, что каждый нуклон вносит в молярную массу
г/моль. Поэтому молярная масса химического элемента с атомной массой
оказывается равной
г/моль.
Молярная масса вещества, молекула которого состоит из нескольких атомов, получается простым суммированием молярных масс. Так, молярная масса углекислого газа равна
г/моль
кг/моль.
Будьте внимательны с молярными массами некоторых газов! Так, молярная масса газообразного водорода равна г/моль, поскольку его молекула состоит из двух атомов
. То же касается часто встречающихся в задачах азота и кислорода
Вместе с тем, наиболее частый персонаж задач — гелий
— является одноатомным газом и имеет молярную массу
г/моль, предписанную таблицей Менделеева.
Ещё раз предостережение: при расчётах не забывайте переводить молярную массу в кг/моль! Если ваш ответ отличается от правильного на три порядка, то вы наверняка сделали именно эту, очень распространённую ошибку 🙂
Что получится, если умножить на
? Масса частицы, умноженная на число частиц в моле, даст массу моля, т. е. молярную массу:
Благодарим за то, что пользуйтесь нашими публикациями.
Информация на странице «Основные формулы молекулярной физики» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.05.2023



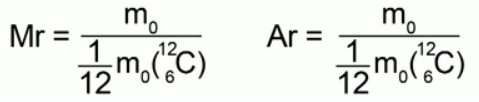



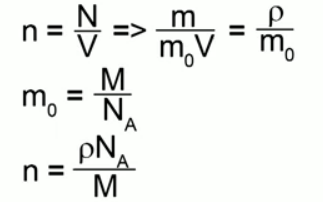















 ,
, %
% ;
; ;
;








 ,
,
 ;
; .
. , (при V=const)
, (при V=const) , (при T=const)
, (при T=const) , (при Q=0)
, (при Q=0)
 ;
;


 ,
, ) равна отношению силы (
) равна отношению силы ( ), с которой поле действует на точечный заряд, к этому заряду (q).
), с которой поле действует на точечный заряд, к этому заряду (q).
 ,
, ), то результирующая напряженность поля в этой точке равна геометрической (векторной) сумме напряженностей.
), то результирующая напряженность поля в этой точке равна геометрической (векторной) сумме напряженностей.



 ;
;

 ) на расстоянии (Δd), тем меньше напряженность (Е) электростатического поля.
) на расстоянии (Δd), тем меньше напряженность (Е) электростатического поля.

 ,
, ;
; ;
; .
.
 ,
,



 ;
; ;
; .
. ;
; ;
; ;
;

