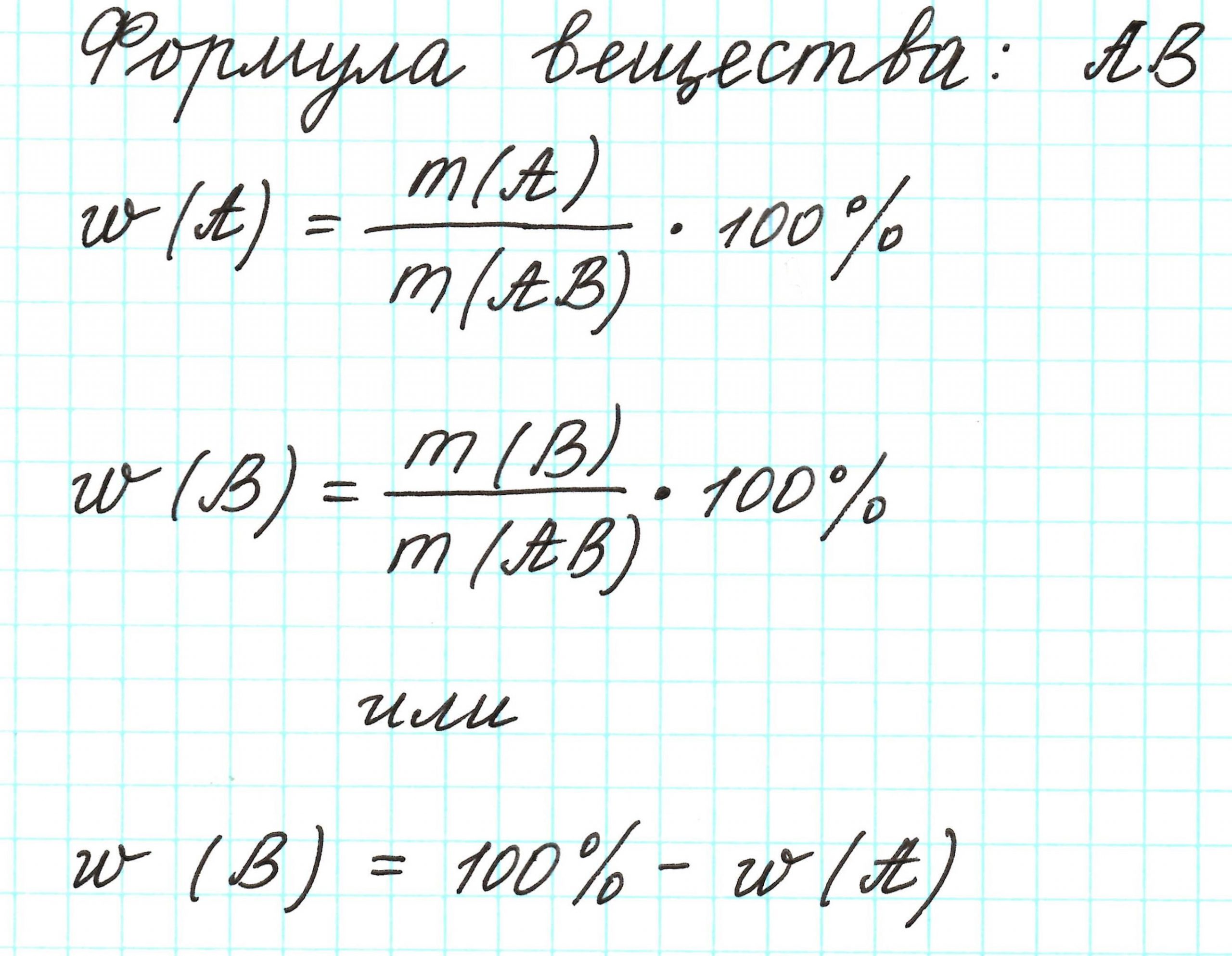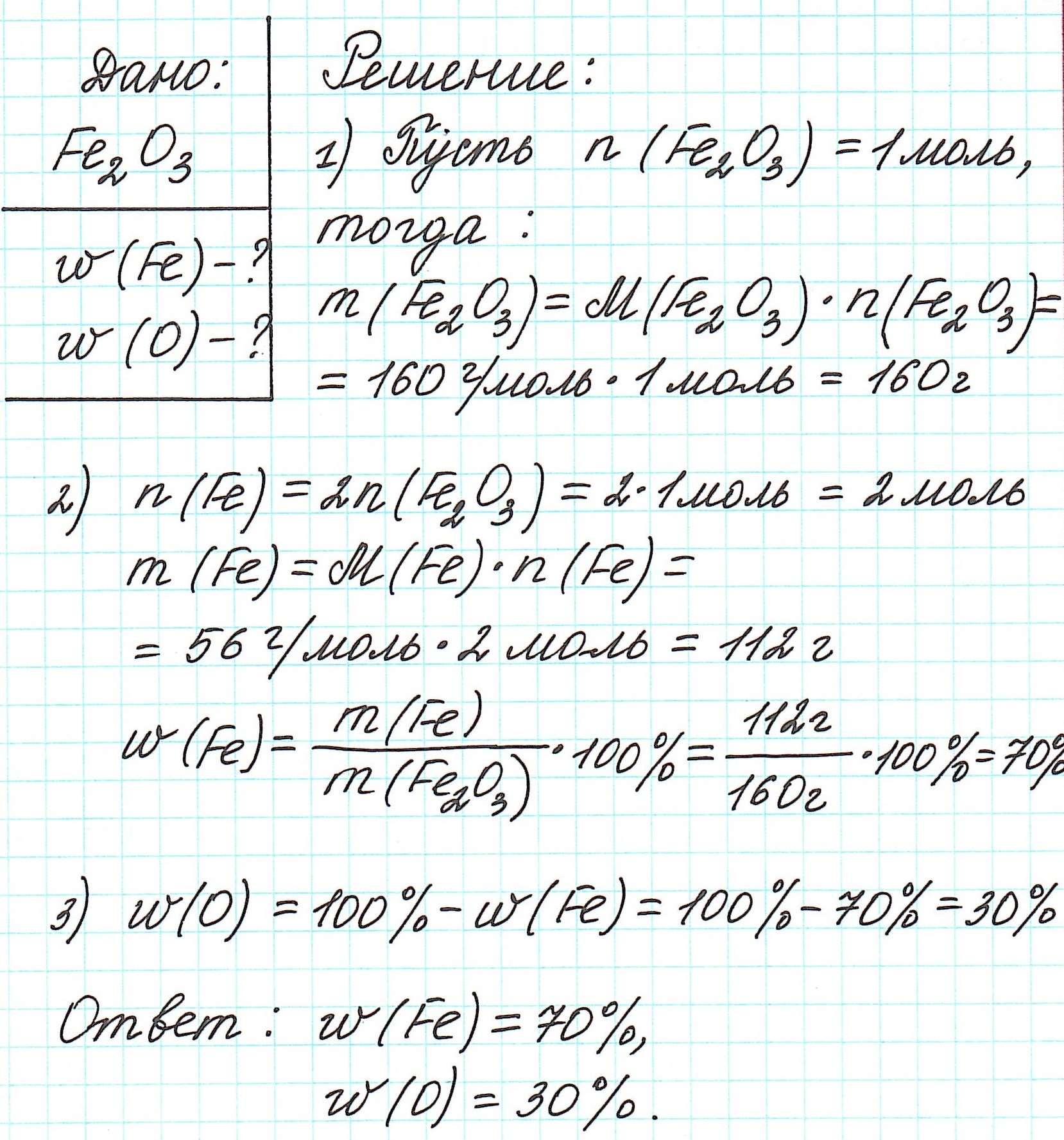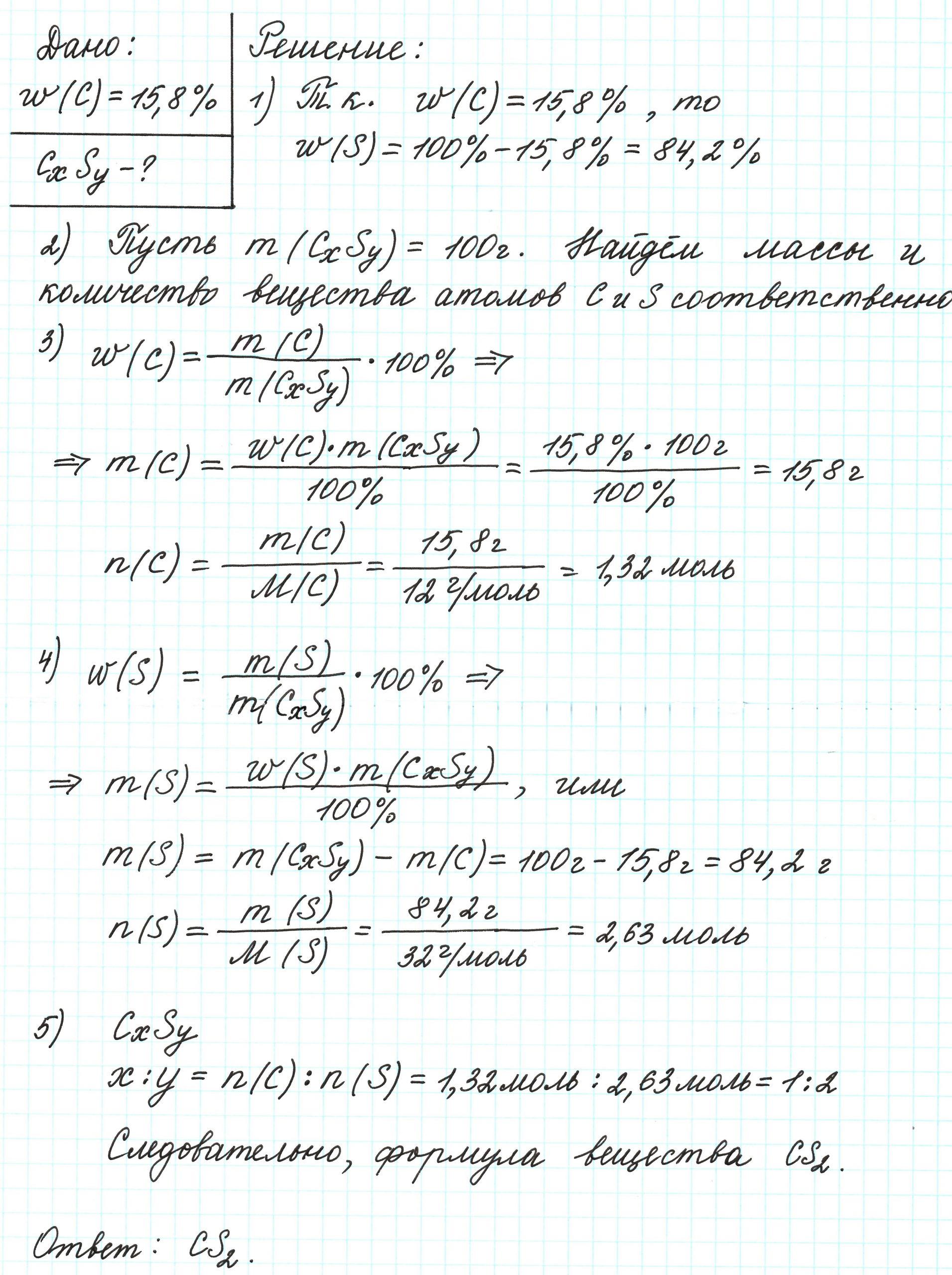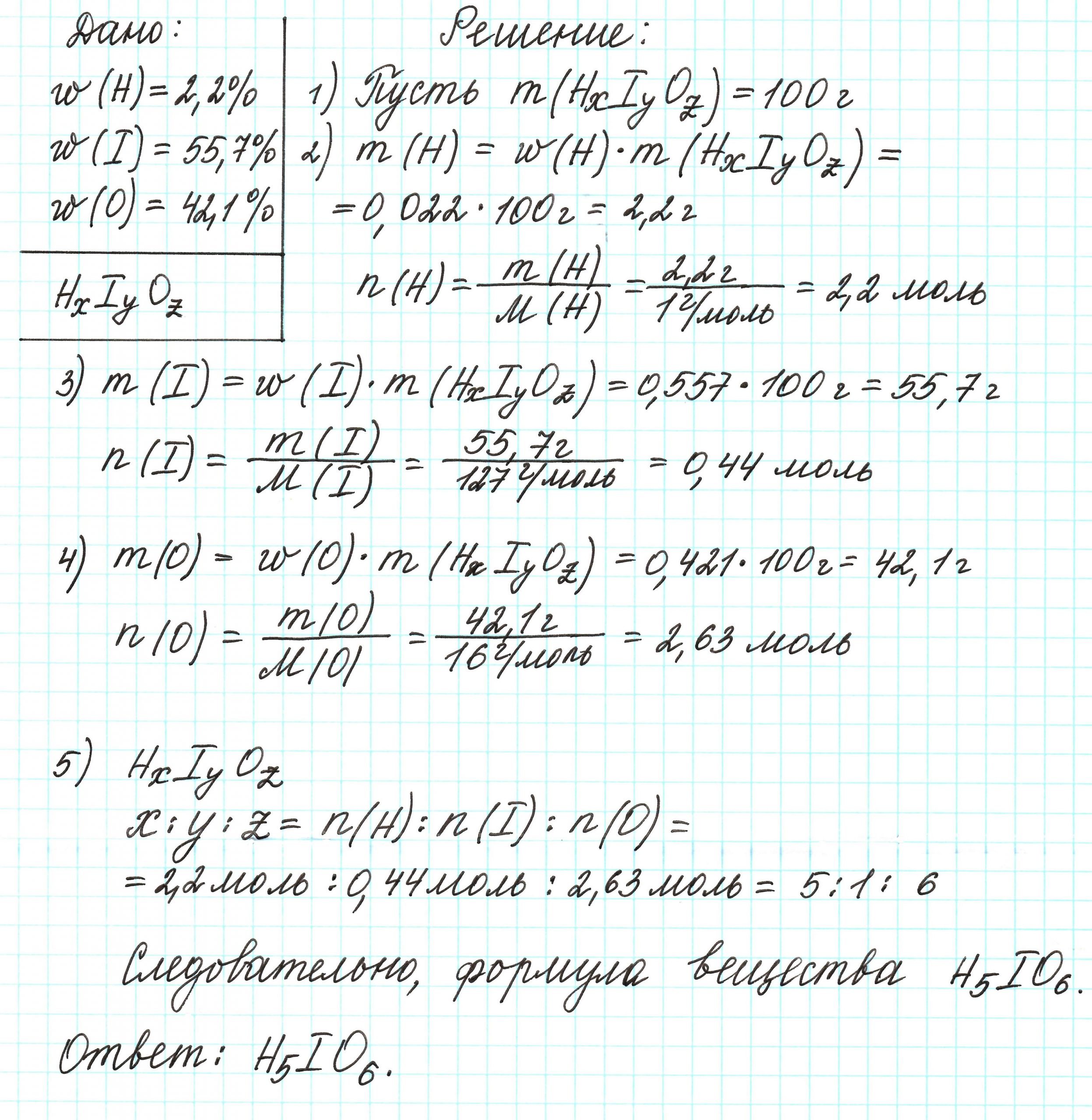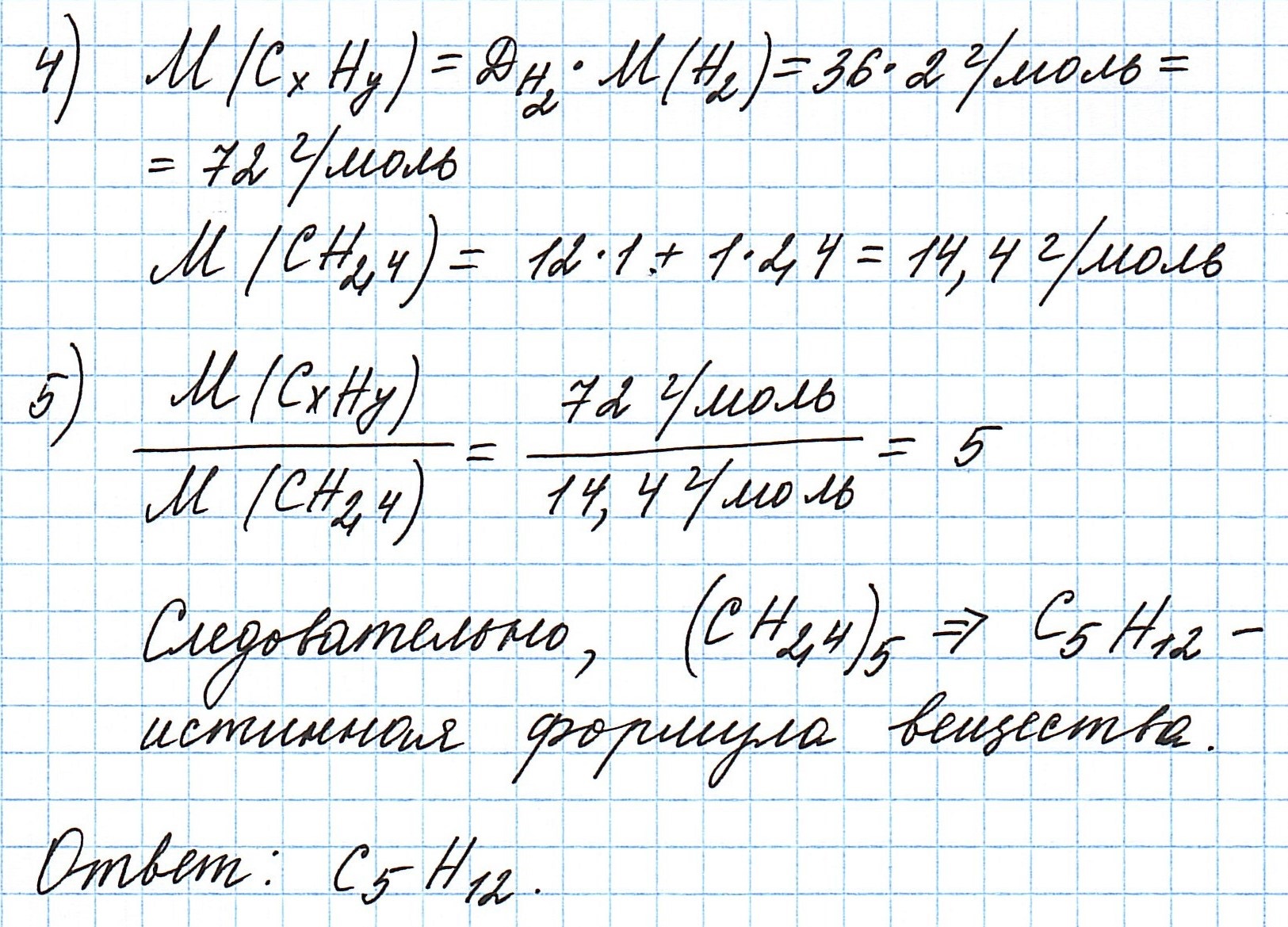Способов, как определить формулу вещества, достаточно много. Все зависит от исходных данных. Наиболее разнообразны подобные вычисления в органической химии. И это не удивительно, так как органических соединений значительно больше, чем неорганических.
Содержание:
1.Понятие простейшей и истинной формулы вещества
2.Массовая доля химического элемента: что означает и как высчитывается
3.Как определить формулу вещества по массовым долям элементов
4.Как определить формулу органического соединения:
4.1. по общей формуле вещества
4.2. по продуктам сгорания вещества
5. Как определить формулу вещества: комбинированные задачи
1.Понятие простейшей и истинной формулы вещества
В одних задачах на определение формулы вещества необходимо найти его простейшую формулу, а в других – истинную. В чем разница?
Простейшая, или иными словами, эмпирическая формула, указывает на соотношение атомов в молекуле (или в формульной единице, если речь идет о не ковалентном соединении).
Так, например: СН2 – простейшая формула алкена – показывает, что на каждый 1 атом углерода приходится 2 водородных атома. То есть существует соотношение 1:2. Поэтому для нахождения простейшей (эмпирической) формулы вещества важно рассчитать количество вещества атомов, которые входят в его состав, то есть n(C) и n(H).
Истинная формула, или иначе молекулярная, отражает действительное количество атомов всех элементов в молекуле.
Например, для пропилена, относящегося к классу алкенов, истинная (молекулярная) формула будет C3H6. Она говорит о том, что молекула данного вещества включает 3 атома С и 6 атомов Н. Это вполне соответствует простейшей формуле, отвечающей соотношению атомов 1:2. Для нахождения истинной (молекулярной) формулы соединения требуется посчитать его относительную молекулярную (Mr) или молярную массу (M).
2.Массовая доля химического элемента: что означает и как высчитывается
Массовая доля – это отношение массы компонента системы к массе системы, выраженное в процентах или долях от единицы.
Ну, а теперь проще.
Молекула имеет массу. Все атомы в молекуле также имеют свои массы. Атомов одного химического элемента в молекуле может быть 1 или несколько. Важна масса всех атомов одного элемента. Если ее разделить на массу молекулы, то получится массовая доля этого элемента. Ее выражают либо в процентах, которые всегда меньше 100%, либо в долях от единицы, которые всегда меньше 1.
Массовая доля элемента обозначается греческой буквой «омега» — ω. И записывается, например, так: ω(Н), ω(Сl), ω(С) и т.д. и рассчитывается:
Пример 1. Каковы массовые доли элементов в оксиде железа (III) Fe2O3.
3.Как определить формулу вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов применимо как к органическим, так и к неорганическим соединениям.
Пример 2. Сероуглерод содержит 15,8% углерода по массе. Какова простейшая формула этого вещества?
Поскольку речь идет о массовых долях элементов, то необходимо знать массу вещества. В нашем случае – массу сероуглерода. В условии задачи о ней ничего не говорится. Поэтому допускаем, что масса вещества равна 100 г.
Почему 100 г? Это «круглое» число, и его использование облегчает все расчеты. Так как в итоге будем находить соотношения количеств веществ элементов, то какое-то особенное значение массы вещества не играет никакой роли.
Попробуйте ради эксперимента принять массу сероуглерода равной 23 г, 467 г и т.п. Результат будет один и тот же.
Допустим, что атомов углерода в молекуле х, а атомов серы – у. В таком случае формула вещества примет вид: СхSу.
Пример 3. Содержание углерода в углеводороде составляет 83,33%. Плотность паров соединения по водороду – 36. Какова молекулярная формула углеводорода?
Из данных задачи следует, что углеводород может находиться в газообразном состоянии, так как известна плотность его паров. Эта величина всегда требуется для нахождения молярной (относительной молекулярной) массы вещества. Как она находится и что это такое читайте подробнее здесь.
Чтобы не загромождать записи, массовую долю элементов будем считать не в процентах, а в долях от единицы.
Пусть вас не удивляет получившаяся простейшая формула. Ведь, исходя из определения простейшей формулы, на каждый 1 атом углерода приходится 2,4 атома водорода. Это всего лишь соотношение. Соединения с формулой СН2,4 в принципе не существует. Не всегда простейшая и истинная формулы совпадают друг с другом.
А если полученная формула СН2,4 вас все же смущает, вы можете решать задачу и вторым способом. Но это несколько более сложный способ, когда требуется составить и решить уравнение с двумя неизвестными.
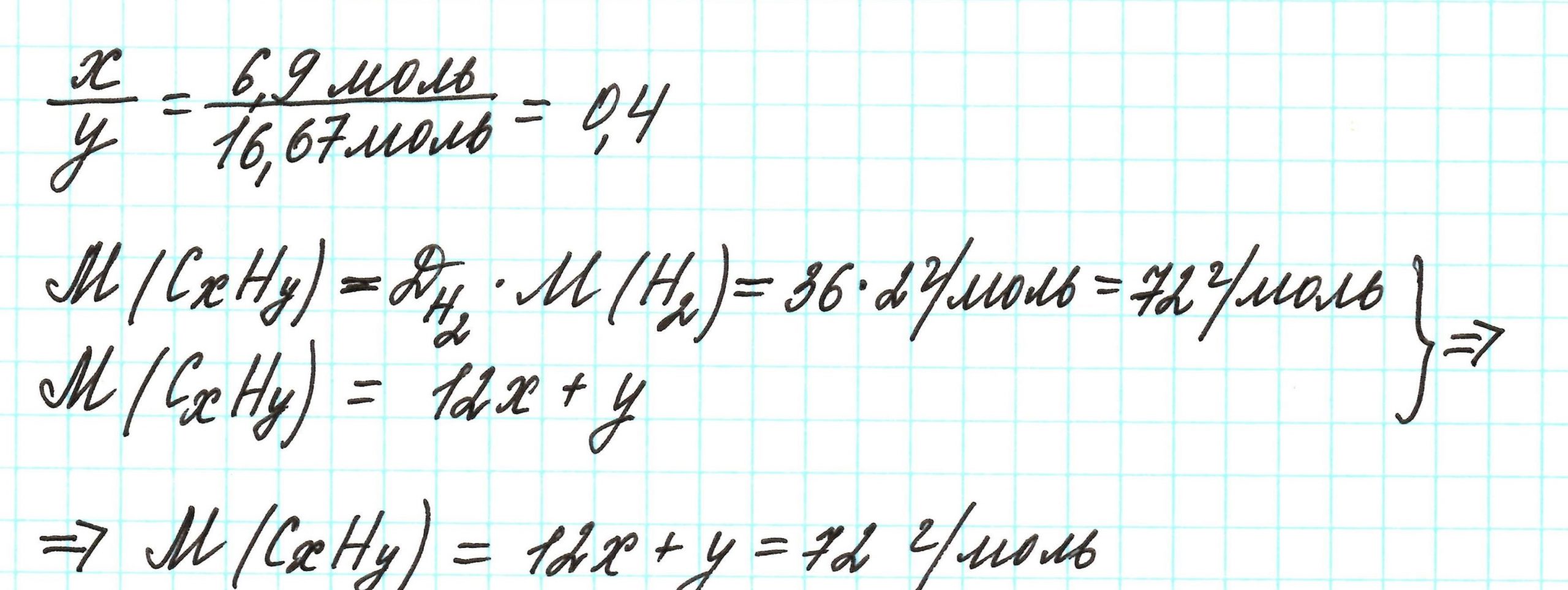
Не все химические вещества являются бинарными, то есть состоят из атомов двух химических элементов. Но в любом случае, алгоритм решения задачи тот же.
Пример 4. Некоторая кислота содержит водород (2,2%), иод (55,7%) и кислород (42,1%). Определите простейшую формулу этой кислоты.
4.Как определить формулу органического соединения
Определить формулу органического вещества можно не только зная массовые доли элементов в его составе.
4.1. Как определить формулу органического соединения
по общей молекулярной формуле вещества
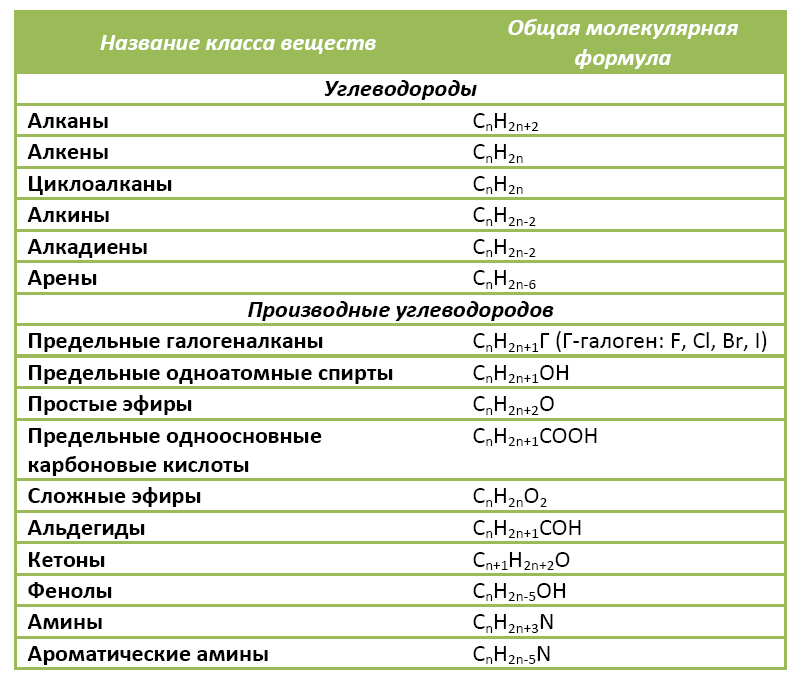
Органические вещества сгруппированы по самостоятельным классам на основе общности строения и свойств. Каждый класс соединений характеризуется своей общей молекулярной формулой. Особенно это наглядно видно на примере углеводородов.
Если другие органические вещества рассматривать как их производные, в молекулы которых введена какая-либо функциональная группа, то и для них также можно составить общую молекулярную формулу.
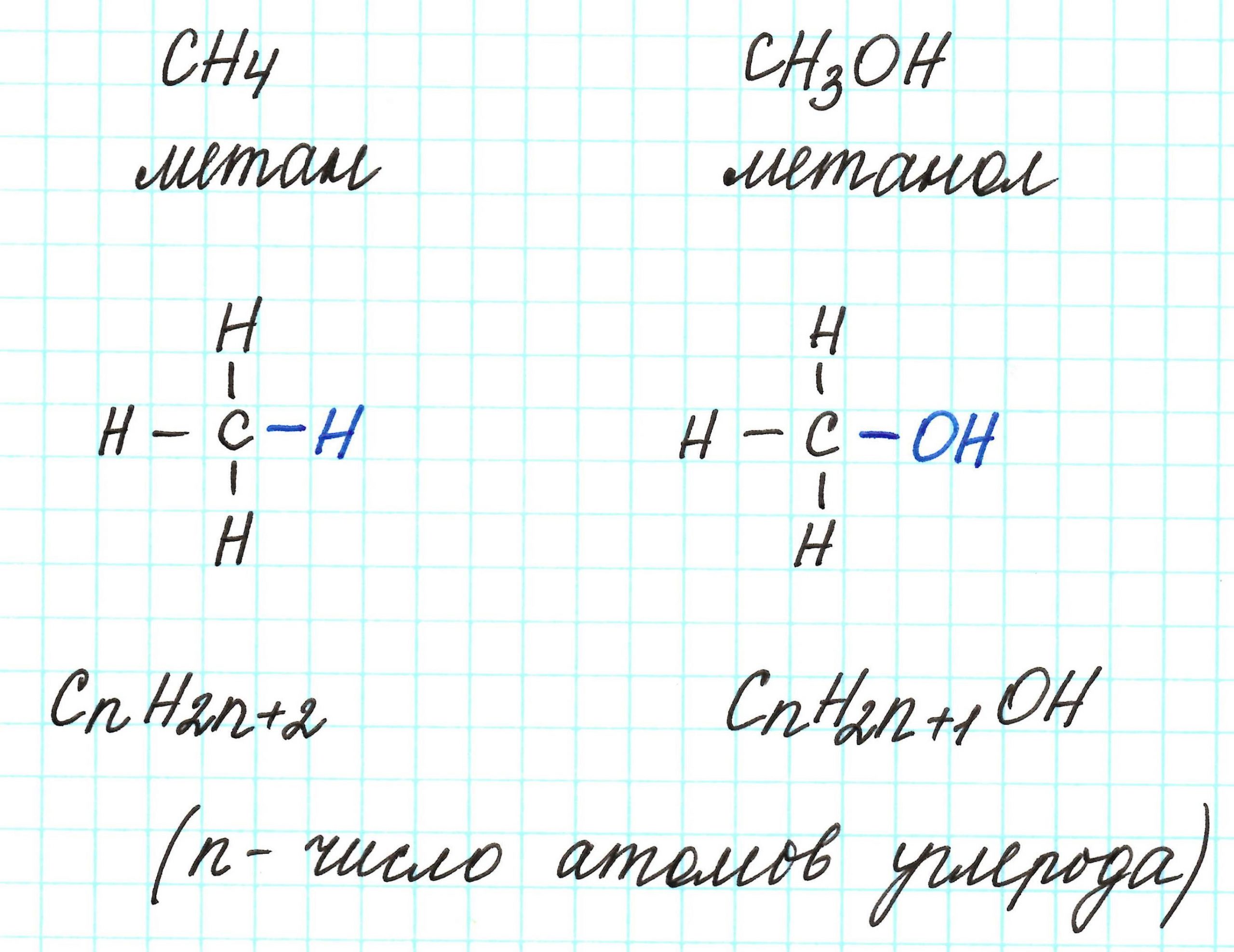
К слову, метан СН4 является представителем алканов, в молекулах которых на n атомов углерода и приходится 2n+2 атомов водорода. Алканы имеют общую молекулярную формулу, отражающую их состав: СnH2n+2.
Предельные одноатомные спирты можно рассматривать как производные алканов, в молекулах которых 1 атом водорода замещен на гидроксильную группа –ОН. Таким образом, их общая молекулярная формула такая: СnH2n+1ОН.
Ниже в таблице приведены общие молекулярные формулы основных классов органических соединений.
Пример 5. Плотность паров по воздуху некоторого алкана 4,414. Какова формула алкана?

4.2. Как определить формулу органического соединения
по продуктам его сгорания
Это еще один распространенный тип задач на определение формулы органического соединения.
Необходимо запомнить и понять основные моменты:
— так как все органические вещества содержат атомы С, Н, а также атомы О (кислородсодержащие соединения), то всегда при их сгорании выделяется углекислый газ СО2 и образуется вода Н2О;
— все углеродные атомы, входящие в состав органического соединения, окажутся в составе углекислого газа СО2; следовательно, n(С) как в соединении, так и в СО2 – это одна и та же величина;
— все атомы водорода Н, которые имеются в составе вещества, перейдут в состав воды Н2О; следовательно, n(Н) и в данном веществе, и в Н2О – это одна и та же величина;
— при сгорании веществ, включающих в себя азот (например, амины), кроме СО2 и Н2О, образуется еще и N2.
Разберем несколько примеров.
Пример 6. Сожгли 7,2 г углеводорода. Плотность его паров по водороду составляет 36. В результате реакции образовалось 22 г оксида углерода (IV) и 10,8 г воды. Какова молекулярная формула соединения?
Пример 7. В результате сгорания 4,8 г органического соединения выделилось 3,36 л (н.у.) оксида углерода (IV) и образовалось 5,4 г воды. Плотность паров искомого соединения по кислороду равна 1. Вычислите молекулярную формулу вещества.
Пример 8. Результатом сжигания 0,31 г газообразного органического соединения, имеющего плотность 1,384 г/л, стало выделение 0,224 л (с.у.) оксида углерода (IV), 0,112 л азота и образование 0,45 г воды. Вычислите молекулярную формулу этого вещества.

5. Как определить формулу вещества: комбинированные задачи
Наибольший интерес и некоторую трудность представляют комбинированные задачи, сочетающие в себе необходимость найти формулу соединения:
— используя приемы, применяемые в рассмотренных выше задачах;
— используя сведения не только о химических, но и физических свойствах вещества.
Вот несколько примеров.
Пример 9. Какова молекулярная формула предельного углеводорода, при полном сгорании 8,6 г которого выделилось 13, 44 л (н.у.) оксида углерода (IV).
В этой задаче:
1) известен класс вещества, поэтому возможно применить его общую молекулярную формулу;
2) речь идет о сгорании вещества, поэтому количество атомов в составе молекулы будем искать, используя данные о продукте сгорания – СО2.
Пример 10. Алкен нормального строения содержит двойную связь при первом углеродном атоме. Образец этого алкена массой 0,7 г присоединил бром массой 1,6 г. Вычислите формулу алкена и назовите его.
В предлагаемых условиях:
1) известен класс вещества, следовательно, применим его общую молекулярную формулу;
2) речь идет об одном из химических свойств: способности алкенов присоединять галогены по месту разрыва двойной связи.
Пример 11. После полного сжигания в кислороде арена, имевшего массу 0,92 г, выделился оксид углерода (IV). Пропуская газ через избыток раствора щелочи Ca(OH)2, получили 7 грамм осадка. Какова молекулярная формула арена?
В предлагаемой задаче:
1) известен класс вещества;
2) речь идет о сжигании соединения и образовании в качестве продукта горения углекислого газа, который при взаимодействии со щелочью Са(ОН)2 привел к выпадению осадка известной массы.
Следующий пример очень характерен для задач, встречающихся в заданиях второй части ЕГЭ по химии.
Пример 12. Некоторое соединение, образующее альдегид в реакции окисления, взаимодействует с избытком бромоводородной кислоты, образуя 9,84 г продукта (выход составляет 80% от теоретического), имеющего плотность паров по Н2 61,5. Определите строение этого соединения, а также его массу, вступившую в реакцию?
В этой задаче:
1) говорится о химических свойствах искомого соединения; анализируя их, приходим к выводу, что заданным веществом является предельный одноатомный спирт;
2) известна общая молекулярная формула предельных одноатомных спиртов;
3) более подробно говорится о взаимодействии заданного вещества с бромоводородной кислотой; спирт, реагируя с HBr, дает галогеналкан, для которого известны его масса, практический выход и относительная плотность по Н2; именно от этих данных и нужно отталкиваться при решении данной задачи.
Итак, способов, как определить формулу вещества, действительно, множество. Мы рассмотрели лишь основные из них. Важно правильно уяснить понятия «простейшая формула вещества» и «истинная формула вещества», чтобы не путать их.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Как найти массовую долю вещества 🚩 Массовая доля формула 🚩 Разное
26 июня 2011
Автор КакПросто!
Людям в зависимости от рода их профессии приходится сталкиваться с растворами, имеющими строго заданное содержание в них растворенного вещества: приготовление лекарственных растворов, растворение проявителя для фотографий, раствор для аккумулятора с содержанием серной кислоты и т.д. Поэтому на уроках химии школьники с помощью задач учатся рассчитывать массовую долю растворенных веществ – отношение массы растворенного вещества к общей массе раствора.
Инструкция
Прочитайте внимательно задачу. Кратко с левой стороны страницы запишите ее данные с использованием буквенных обозначений и формул химических веществ, если они есть. Определите из вопроса задачи, что нужно найти. Запишите с правой стороны листа общую формулу массовой доли растворенного вещества
ω = m1 / m,
где m1 – масса растворенного вещества, а m – масса всего раствора.
Если содержание массовой доли растворенного вещества нужно узнать в процентах, умножьте полученное число на 100%:
ω = m1 / m х 100%
В задачах, где нужно вычислить массовые доли каждого из элементов, входящих в состав химического вещества, используйте таблицу Д.И. Менделеева. Например, узнайте массовые доли каждого из элементов, входящих в состав углеводорода, формула которого C6h22
m (C6h22) = 6 х 12 + 12 х 1= 84 г/моль
ω (С) = 6 m1(С) / m (C6h22) х 100% = 6 х 12 г / 84 г/моль х 100% = 85%
ω (Н) = 12 m1(Н) / m (C6h22) х 100% = 12 х 1 г / 84 г/моль х 100% = 15%
Выпишите ответ задачи.
Полезный совет
Задачи на нахождение массовой доли вещества после упаривания, разбавления, концентрирования, смешивания растворов решайте с помощью формул, полученных из определения массовой доли. Например, задачу на упаривание можно решить с помощью такой формулы
ω 2= m1 / (m – Dm) = (ω 1• m) / (m – Dm), где ω 2 – массовая доля вещества в упаренном растворе, Dm — разница между массами до нагревания и после.
Источники:
- как определить массовую долю вещества
Массовая доля показывает в процентах или в долях содержание вещества в каком–либо растворе или элемента в составе вещества. Умение вычислить массовую долю полезно не только на уроках химии, но и когда вы хотите приготовить раствор или смесь, например, в кулинарных целях. Или изменить процентное отношение, в уже имеющемся у вас составе.
Инструкция
Массовая доля вычисляется как отношение массы данного компонента к общей массе раствора. Для получения результата в процентах, надо полученное частное умножить на 100.
Выглядит формула следующим образом:
ώ=m (растворенного вещества)/m (раствора)
ώ, % = ώ*100
Рассмотрим для примера прямую и обратную задачи.
Например, вы растворили в 100 граммах воды 5 грамм поваренной соли. Какой процентности раствор вы получили? Решение очень простое. Массу вещества (поваренной соли) вы знаете, масса раствора будет равна сумме из масс воды и соли. Таким образом, следует 5 г разделить на 105 г и результат деления умножить на 100 – это и будет ответ: 4,7%-ый раствор у вас получится.
Теперь обратная задача. Вы желаете приготовить 200 гр 10%-ого водного раствора чего угодно. Сколько вещества брать для растворения? Действуем в обратном порядке, массовую долю, выраженную в процентах (10%) делим на 100. Получим 0,1. Теперь составим несложное уравнение, где нужное количество вещества обозначим x и, следовательно, массу раствора как 200 г+x. Наше уравнение будет выглядеть так: 0,1=x/200г+x. Когда мы его решим то получим что х равняется примерно 22,2 г. Проверяется результат решением прямой задачи.
Сложнее узнать какие количества растворов известной процентности надо взять для получения определенного количества раствора с новыми заданными качествами. Здесь требуется составить и решить уже систему уравнений. В этой системе первое уравнение — это выражение известной массы получаемой смеси, через две неизвестные массы исходных растворов. Например, если наша цель получить 150 гр раствора, уравнение будет иметь вид x+y=150 г. Второе уравнение – масса растворенного вещества приравненная к сумме этого же вещества, в составе двух смешиваемых растворов. Например, если хотите иметь 30%-ый раствор, а растворы, которые вы смешиваете 100%-ый, то есть чистое вещество, и 15%-ый, то второе уравнение будет иметь вид: x+0,15y = 45 г. Дело за малым, решить систему уравнение и выяснить сколько надо добавить вещества к 15%-ому раствору, чтобы получить 30%-ый раствор. Попробуйте.
Видео по теме
Растворы различных веществ находят значительное применение в медицине, машиностроении и химическом производстве. Поскольку они состоят из двух компонентов — растворителя и растворенного вещества, при работе с ними приходится иметь дело с такой величиной, как массовая доля вещества. Она является неотъемлемой характеристикой любого раствора, независимо от его компонентов.
Инструкция
При решении задач, в которых фигурируют растворы одних веществ в других, приходится иметь дело с величиной, называемой массовой долей. Она выражает количество растворенного вещества по отношению к количеству растворителя.Массовая доля — безразмерная величина, равная отношению массы растворенного вещества к массе всего раствора в целом. Ее обычно выражают в процентах или долях единицы. Вычисляется она следующим образом:?в=m в/m р-ра, где m в — масса растворенного вещества, m р-ра — масса раствора.Масса раствора складывается из двух составляющих: массы растворенного вещества и массы растворителя. Примером может служить раствор серной кислоты. Оксид серы SO3 растворяют в воде h3O и получают серную кислоту. Это выглядит следующим образом:m р-ра=m в+m h3O=m SO3+m h3O=m h3SO4.Формулу, представленную ниже, чаще всего используют тогда, когда в задаче не указана масса раствора, а имеется лишь масса растворенного вещества и воды. По-другому массовая доля выражается следующим образом:? в=m в/(m в+m h3O).
При известных массе раствора и массе растворенного вещества массовая доля определяется по формуле, приведенной в предыдущем шаге. При этом возникает вопрос: в каких единицах выражать массовую долю растворенного вещества? В случае если ее необходимо выразить в процентах, результат вычислений умножают на сто:? в=m в*100/m р-ра.В случае же, если необходимо выразить результат вычисления в долях единицы, дополнительных вычислений не осуществляют.
Существуют задачи, в которых наоборот, дана массовая доля, а определить требуется массу вещества, которое понадобится для приготовления раствора. В таком случае массу растворенного вещества находят по формуле:m в-ва=m*? в/100.
Для приготовления некоторых растворов используют кристаллогидраты. Как правило, они представляют собой сложные химические структуры вида: FxNOy*5h3O. Методика нахождения массовой доли растворенного вещества в данном случае иная. Во-первых, в любой задаче, где фигурирует кристаллогидрат, указаны масса самого кристаллогидрата m кр и масса безводного вещества FxNOy. Отношение массы кристаллогидрата к его молярной массе равно отношению массы безводного вещества к его молярной массе, умноженной на коэффициент FxNOy:m кр/M кр=mв/x*Mв.Массовая доля безводного вещества равна его массе, деленной на массу раствора:? в = m в/m р.Формулу кристаллогидрата необходимо преобразовать следующим образом:m кр/M кр=? в*mр/x *Mв, где m кр — масса кристаллогидрата, M кр — молярная масса кристаллогидрата, ? в — массовая доля безводного растворенного вещества, m р — масса раствора, x — коэффициент безводного вещества, Mв — молярная масса безводного вещества.Отсюда массовая доля растворенного вещества будет равна:? в=m р*M кр/m кр*x *Mв.
Видео по теме
Чтобы рассчитать количество вещества, узнайте его массу с помощью весов, выразите ее в граммах и поделите на молярную массу, которую можно найти с помощью таблицы Менделеева. Для определения количества вещества газа в нормальных условиях примените закон Авогадро. Если газ находится в других условиях, измерьте давление, объем и температуру газа, после чего рассчитайте количество вещества в нем.
Вам понадобится
- Вам понадобятся весы, термометр, манометр, линейка или рулетка, периодическая таблица Менделеева.
Инструкция
Определение количества вещества в твердом теле или жидкости. Найдите массу исследуемого тела при помощи весов, выразите ее в граммах. Определите, из какого вещества состоит тело, затем с помощью периодической таблицы Менделеева найдите молярную массу вещества. Для этого найдите элементы, входящие в состав молекулы вещества из которого состоит тело. По таблице определите их атомные массы, если в таблице указывается дробное число, округлите его до целого. Найдите сумму масс всех атомов, входящих в молекулу вещества, получите молекулярную массу, которая численно равна молярной массе вещества в граммах на моль. После этого, измеренную ранее массу поделите на молярную массу. В результате получите количество вещества в молях (υ=m/M). Количество вещества газа в нормальных условиях. Если газ находится нормальных условиях (0 градусов Цельсия и 760 мм рт. ст.), найдите его объем. Для этого измерьте объем помещения, баллона или сосуда, где он находится, поскольку газ занимает весь объем, ему предоставленный. Чтобы получить его значение измерьте геометрические размеры сосуда, где он находится с помощью рулетки и с помощью математических формул, найдите его объем. Наиболее типичным случаем является комната в форме параллелепипеда. Измерьте ее длину, ширину и высоту в метрах, затем перемножьте их и получите объем газа, который в ней находится в кубических метрах. Чтобы найти количество вещества газа, полученный объем поделите на число 0,0224 – молярный объем газа при нормальных условиях.
Количество вещества газа с произвольными параметрами. Измерьте давление газа манометром в паскалях, его температуру в кельвинах, для чего к градусам Цельсия, в которых измеряет термометр, прибавьте число 273. Определите также объем газа в кубических метрах. Чтобы найти количество вещества произведение давления и объема поделите на температуру и число 8,31 (универсальную газовую постоянную), υ=PV/(RT).
Видео по теме
Многие жидкости представляют собой растворы. Именно таковы, в частности, кровь человека, чай, кофе, морская вода. Основой раствора является растворенное вещество. Существуют задачи на нахождение массовой доли этого вещества.
Инструкция
Растворами называются однородные гомогенные системы, которые состоят из двух и более компонентов. Они делятся на три категории:
— жидкие растворы;
— твердые растворы;
— газообразные растворы.
К жидким растворам относится, например, разбавленная серная кислота, к твердым — сплав железа и меди, а к газообразным — любые смеси газов. Независимо от того, в каком агрегатном состоянии находится раствор, он состоит из растворителя и растворенного вещества. Растворителем чаще всего обычно является вода, которой разбавляют вещество. Состав растворов выражается различным образом, наиболее часто для этого используют значение массовой доли растворенного вещества. Массовая доля является безразмерной величиной, и она равна отношению массы растворенного вещества к общей массе всего раствора:
ωв=mв/m
Массовую долю выражают в процентах или десятичных дробях. Чтобы вычислить этот параметр в процентах, применяйте следующую формулу:
w(вещества)=mв/m (раствора)·100 %.
Для нахождения того же параметра в виде десятичной дроби умножение на 100 % не осуществляйте.
Масса всего раствора представляет собой сумму масс воды и растворенного вещества. Поэтому иногда формулу, указанную выше, записывают несколько иным образом:
ωв=mв/(mв+m(h3O)), где m (раствора)=mв+m(h3O)
Например, разбавленная азотная кислота состоит из растворителя — воды, и растворенного вещества -кислоты. Из этого следует, что масса растворенного вещества вычисляется следующим образом:
ωв=mHNO3/mHNO3+mh3O
Если масса вещества неизвестна, а дана лишь масса воды, то в таком случае массовая доля находится по несколько иной формуле. Когда известен объем растворенного вещества, массу его находите по следующей формуле:
mв=V*ρ
Из этого следует, что массовая доля вещества вычисляется следующим образом:
ωв=V*ρ/V*ρ+m(h3O)
Нахождение массовой доли вещества нередко осуществляется и в практических целях. Например, при отбеливании какого-либо материала необходимо знать концентрацию пергидроля в растворе перекиси. Кроме того, точное вычисление массовой доли иногда требуется во врачебной практике. Помимо формул и приблизительного вычисления массовой доли в медицине используют еще и экспериментальную проверку с помощью приборов, что позволяет уменьшить вероятность ошибок.
Существует несколько физических процессов, в ходе которых меняется массовая доля вещества и состав раствора. Первый из них, называемый упариванием, представляет собой процесс, обратный растворению вещества в воде. При этом, растворенное вещество остается, а вода полностью упаривается. В этом случае массовая доля быть измерена не может — раствор отсутствует. Прямо противоположный процесс — разбавление концентрированного раствора. Чем больше он разбавляется, тем сильнее уменьшается массовая доля вещества, растворенного в нем. Концентрирование представляет собой частичное упаривание, при котором испаряется не вся вода, а лишь ее часть. Массовая доля вещества в растворе при этом увеличивается.
Видео по теме
Что такое массовая доля элемента? Из самого названия можно понять, что это величина, указывающая, в каком соотношении находятся масса элемента, входящего в состав вещества, и общая масса этого вещества. Она выражается в долях единицы: процентах (сотых долях), промилле (тысячных) и т.д. Как можно вычислить массу какого-либо элемента?
Инструкция
Для наглядности рассмотрите хорошо известный всем углерод, без которого не было бы органики. Если углерод представляет собою чистое вещество (например, алмаз), то его массовую долю можно смело принять за единицу или за 100%. Разумеется, алмаз тоже содержит примеси других элементов, но в большинстве случаев, в столь малых количествах, что ими можно пренебречь. А вот в таких модификациях углерода, как каменный уголь или графит, содержание примесей довольно высокое, и такое пренебрежение недопустимо.
Если же углерод входит в состав сложного вещества, надо действовать следующим образом: запишите точную формулу вещества, затем, зная молярные массы каждого элемента, входящего в его состав, вычислите точную молярную массу этого вещества (разумеется, с учетом «индекса» каждого элемента). После этого определить массовую долю, разделив общую молярную массу элемента на молярную массу вещества.
Например, нужно найти массовую долю углерода в уксусной кислоте. Напишите формулу уксусной кислоты: СН3СООН. Для облегчения подсчетов преобразуйте ее в вид: С2Н4О2. Молярная масса этого вещества складывается из молярных масс элементов: 24 + 4 + 32 = 60. Соответственно, массовая доля углерода в этом веществе вычисляется так: 24/60 = 0,4.
Если нужно исчислить ее в процентном соотношении, соответственно, 0,4 * 100 = 40%. То есть в каждом килограмме уксусной кислоты содержится (приблизительно) 400 грамм углерода.
Разумеется, совершенно аналогичным образом можно найти массовые доли всех других элементов. Например, массовая доля кислорода в той же уксусной кислоте вычисляется так: 32/60 = 0,533 или примерно 53,3%; а массовая доля водорода равна 4/60 = 0,666 или примерно 6,7%.
Для проверки точности вычислений сложите процентные доли всех элементов:40% (углерод) + 53,3% (кислород) + 6,7% (водород) = 100%. Счет сошелся.
Источники:
- массовые доли элементов
Бывает, что возникает такая задача: как найти массу вещества, содержащегося в том или ином объеме раствора? Ход ее решения зависит от того, какими исходными данными вы располагаете. Оно может быть и очень простым, буквально в одно действие, и более сложным.
Инструкция
Например, вам надо узнать, какое количество поваренной соли содержится в 150 миллилитрах 25%-го раствора. Решение: 25%-й раствор – это значит, что в 100 миллилитрах раствора содержится 25 грамм растворенного вещества (в данном случае поваренной соли). В 150 миллилитрах, соответственно, в полтора раза больше. Произведите умножение: 25* 1,5 = 37,5. Вот и ответ: 37,5 грамм поваренной соли. Немного видоизмените условия задачи. Предположим, вам даны те же 150 миллилитров раствора поваренной соли. Но вместо массовой концентрации известна молярная – 1 М. Сколько поваренной соли содержится в растворе в этом случае? И здесь нет ничего сложного. Прежде всего, вспомните химическую формулу поваренной соли: NaCl. Заглянув в таблицу Менделеева, уточните атомные массы (округленные) элементов, составляющих это вещество: натрия – 23, хлора – 35,5. Следовательно, молярная масса поваренной соли – 58,5 г/моль. А что такое молярная концентрация? Это – количество молей растворенного вещества в 1 1 литре 1-молярного раствора поваренной соли содержалось бы 58,5 грамм этого вещества. Сколько же его содержится в 150 миллилитрах? Произведя умножение, получите: 58,5* 0,15 = 8,775 г. Если вам не нужна высокая точность, можно принять результат за 8,78 грамм или за 8,8 грамм.
Предположим, вам известен точный объем раствора и его плотность, но неизвестна концентрация вещества. Как в таком случае определить его количество в растворе? Тут решение займет немного больше времени, но опять-таки не вызовет затруднений. Надо лишь найти любой справочник, где есть таблицы плотностей растворов. Для каждого показателя плотности там приведены соответствующие значения его массовой и молярной концентраций.
Например: даны 200 миллилитров водного раствора вещества Х, с плотностью 1,15 г/мл. По таблице растворимости вы выяснили, что такая плотность соответствует 30%-й концентрации раствора. Сколько вещества Х находится в растворе? Решение: если в 100 миллилитрах раствора содержалось бы 30 грамм вещества Х, то в 200 миллилитрах: 30*2 = 60 грамм.
Объем — это количественная характеристика, указывающая, какое именно пространство занимает то или иное вещество (тело). В системе СИ объем измеряется в кубических метрах. Как же можно найти объем какого-нибудь вещества?
Инструкция
Проще всего – если вам известна точная масса этого вещества (М) и его плотность (ρ). Тогда объем находится в одно действие, по формуле:
V = M/ρ.
Можете воспользоваться методом, открытым еще в глубокой древности великим ученым Архимедом. Наверняка вам известна история, как сиракузский царь Гиерон, заподозрив своего ювелира в мошенничестве, приказал Архимеду определить, из чистого ли золота сделана его корона или же в сплав подмешаны дешевые примеси. Казалось бы, все просто: известна точная масса короны, известна плотность чистого золота. Но перед ученым встала задача: как определить объем короны, если она очень сложна по форме? Архимед блестяще решил ее, взвесив корону сначала в воздухе, а потом в воде.
Разница в весе – так называемая «выталкивающая сила», равная весу воды в объеме короны. Ну а зная плотность воды, определить объем несложно. Действуя по аналогии, можно определить объем любого твердого вещества, разумеется, если оно не растворяется в воде и тем более не вступает с ней в реакцию.
Если вы имеете дело с газом, находящимся при условиях, близких к нормальным, то определить его объем очень просто. Надо лишь запомнить, что один моль любого газа при таких условиях занимает объем, равный 22,4 литра. Далее можно производить вычисления, исходя из данных вам условий.
Например, надо определить, какой объем занимает 200 грамм чистого азота? Прежде всего вспомните формулу молекулы азота (N2) и атомный вес азота (14). Следовательно, молярный вес азота: 28 грамм/моль. То есть в 22,4 литра содержалось бы 28 грамм этого газа. А сколько будет его в 200 граммах? Вычислите: 200х28/22,4 = 250 грамм.
Ну, а как найти объем газа, если он находится не при нормальных условиях? Тут вам придет на помощь уравнение Менделеева-Клапейрона. Хоть оно выведено для модели «идеального газа», вы вполне можете им воспользоваться.
Зная такие необходимые вам параметры, как давление газа, его массу и температуру, вы вычислите объем по формуле:
V = MRT / mP, где R – универсальная газовая постоянная, равная 8,31, m – молярная масса газа.
Полезный совет
Переведите все величины в одну систему, иначе получится бессмыслица.
Массовая доля вещества показывает его содержание в более сложной структуре, например, в сплаве или смеси. Если известна общая масса смеси или сплава, то зная массовые доли составляющих веществ можно найти их массы. Найти массовую долю вещества, можно зная его массу и массу всей смеси. Эта величина, может выражаться в дольных величинах или процентах.
Вам понадобится
- весы;
- периодическая таблица химических элементов;
- калькулятор.
Инструкция
Определите массовую долю вещества, которое находится в смеси через массы смеси и самого вещества. Для этого с помощью весов определите массы веществ, составляющих смесь или сплав. Затем сложите их. Полученную массу примите за 100%. Чтобы найти массовую долю вещества в смеси, поделите его массу m на массу смеси M, а результат умножьте на 100% (ω%=(m/M)∙100%). Например, в 140 г воды растворяют 20 г поваренной соли. Чтобы найти массовую долю соли, сложите массы этих двух веществ М=140+20=160 г. Затем найдите массовую долю вещества ω%=(20/160)∙100%=12,5%. Если требуется найти содержание или массовую долю элемента в веществе с известной формулой, воспользуйтесь периодической таблицей химических элементов. По ней найдите атомные массы элементов, которые входят в состав вещества. Если один элемент встречается в формуле несколько раз, умножьте его атомную массу на это число и сложите полученные результаты. Это будет молекулярная масса вещества. Чтобы найти массовую долю любого элемента в таком веществе, поделите его массовое число в данной химической формуле M0 на молекулярную массу данного вещества M. Результат множьте на 100 % (ω%=(M0/M)∙100%).
Например, определите массовую долю химических элементов в медном купоросе. Медный купорос (сульфат меди II), имеет химическую формулу CuSO4. Атомные массы элементов, входящих в его состав равны Ar(Cu)=64, Ar(S)=32, Ar(O)=16, массовые числа этих элементов будут равны M0(Cu)=64, M0(S)=32, M0(O)=16∙4=64, с учетом того, что в молекуле содержится 4 атома кислорода. Рассчитайте молекулярную массу вещества, она равна сумме массовых чисел составляющих молекулу веществ 64+32+64=160. Определите массовую долю меди (Cu) в составе медного купороса (ω%=(64/160)∙100%)=40%. По такому же принципу можно определить массовые доли всех элементов в этом веществе. Массовая доля серы (S) ω%=(32/160)∙100%=20 %, кислорода (О) ω%=(64/160)∙100%=40%. Обратите внимание на то, что сумма всех массовых долей вещества должна составить 100%.
Массовая доля — это процентное содержание компонента в смеси или элемента в веществе. С задачами на вычисление массовой доли сталкиваются не только школьники и студенты. Умение вычислять процентную концентрацию вещества находит вполне практическое применение и в реальной жизни — там, где требуется составление растворов — начиная со строительства и заканчивая кулинарией.
Вам понадобится
- — таблица Менделеева;
- — формулы для расчета массовой доли.
Инструкция
Рассчитайте массовую долю по определению. Так как масса вещества слагается из масс элементов, которые его составляют, то на долю любого составляющего элемента приходится некоторая часть массы вещества. Массовая доля раствора равна отношению массы растворенного вещества к массе всего раствора.
Масса раствора равна сумме масс растворителя (обычно воды) и вещества. Массовая доля смеси равна отношению массы вещества к массе смеси, содержащей вещество. Полученный результат умножьте на 100%.
Найдите массовую долю выхода с помощью формулы ω=mд/mп, где mп и mд — величина предполагаемого и действительного полученного выхода вещества (массы) соответственно. Вычисляйте предполагаемую массу из уравнения реакции, пользуясь формулой m=nM, где n — химическое количество вещества, M — молярная масса вещества (сумма атомных масс всех элементов, входящих в вещество), или формулой m=Vρ, где V- объем вещества, ρ — его плотность. Количество вещества в свою очередь при необходимости замените на формулу n=V/Vm или также находите из уравнения реакции.
Массовую долю элемента сложного вещества вычислите с помощью таблицы Менделеева. Сложите атомные массы всех элементов, входящих в вещество, при необходимости домножая на индексы. Вы получите молярную массу вещества. Найдите молярную массу элемента из таблицы Менделеева. Рассчитайте массовую долю, разделив молярную массу элемента на молярную массу вещества. Умножьте на 100%.
Полезный совет
Обращайте внимание на физический процесс, который имеет место быть. При упаривании не рассчитывайте массовую долю, так как раствора (воды или иной любой жидкости) нет. Не забывайте, что при концентрировании, иначе называемом частичным упариванием, массовая доля вещества увеличивается. Если вы разбавляете концентрированный раствор, массовая доля уменьшается.
Источники:
- Атомно-молекулярное учение и его законы
- как вычислять проценты формула
www.kakprosto.ru
Как найти массу растворенного вещества, если известен объем раствора и массовая доля в процентах?
В данном задании вам необходимо определить массу растворенного вещества, если известны следующие данные задачи:
- Объем раствора;
- Массовая доля в процентах.
Определите основные понятия, которые используются в формулах
- Массовой долей называется отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах.
- Количеством вещества называется физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе.
- Объемом называется количественная характеристика пространства, занимаемого телом или веществом.
- Массой называется физическая величина, определяющая инерционные и гравитационные свойства тела в ситуациях, когда его скорость много меньше скорости света.
- Молярной массой называется характеристика вещества, отношение массы вещества к количеству молей этого вещества, то есть масса одного моля вещества.
-
Молярным объёмом называется объём одного моля вещества.
Далее запишите необходимые формулы
W = m р.в./m р-ра * 100 %.
Где W — массовая доля вещества.
m р.в. — масса растворенного вещества.
m р-ра — масса раствора.
Выразите массу растворенного вещества.
m р.в. = m р-ра * W/100 %.
В данной формуле неизвестна масса раствора. Для того чтобы найти массу раствора примените следующие формулы.
n = m/M.
n = V/Vm.
m/M = V/Vm.
m р-ра = V р-ра * M/Vm.
Где V р-ра — объем раствора.
М — молярная масса.
V m — молярный объем, равный 22,4 л/моль.
По данной формуле находите массу раствора, затем подставляете в предыдущую формулу.
С помощью данных формул можно определить массу растворенного вещества, зная объем раствора и массовую долю.
vashurok.ru
Вычисление массовой доли элемента или вещества
Как вычислить массовую долю элемента в веществе
Массовая доля элемента ω(Э) % — это отношение массы данного элемента m (Э) во взятой молекуле вещества к молекулярной массе этого вещества Mr (в-ва).
Массовую долю элемента выражают в долях от единицы или в процентах:
ω(Э) = m (Э) / Мr(в-ва) (1)
ω% (Э) = m(Э) · 100%/Мr(в-ва)
Сумма массовых долей всех элементов вещества равна 1 или 100%.
Как правило, для расчетов массовой доли элемента берут порцию вещества, равную молярной массе вещества, тогда масса данного элемента в этой порции равна его молярной массе, умноженной на число атомов данного элемента в молекуле.
Так, для вещества АxВy в долях от единицы:
ω(A) = Ar(Э) · Х / Мr(в-ва) (2)
Из пропорции (2) выведем расчетную формулу для определения индексов (х, y) в химической формуле вещества, если известны массовые доли обоих элементов и молярная масса вещества:
Х = ω%(A) · Mr(в-ва) / Аr(Э) · 100% (3)
Разделив ω% (A) на ω% (В) , т.е. преобразовав формулу (2), получим:
ω(A) / ω(В) = Х · Ar(А) / У · Ar(В) (4)
Расчетную формулу (4) можно преобразовать следующим образом:
Х : У = ω%(A) / Ar(А) : ω%(В) / Ar(В) = X(А) : У(В) (5)
Расчетные формулы (3) и (5) используют для определения формулы вещества.
Если известны число атомов в молекуле вещества для одного из элементов и его массовая доля, можно определить молярную массу вещества:
Mr(в-ва) = Ar(Э) · Х / W(A)
Примеры решения задач на вычисление массовых долей химических элементов в сложном веществе
Пример 1. Определите массовые доли химических элементов в серной кислоте H2SO4 и выразите их в процентах.
1. Вычисляем относительную молекулярную массу серной кислоты:
Mr (H2SO4) = 1 · 2 + 32 + 16 · 4 = 98
2. Вычисляем массовые доли элементов.
Для этого численное значение массы элемента (с учетом индекса) делят на молярную массу вещества:
Учитывая это и обозначая массовую долю элемента буквой ω, вычисления массовых долей проводят так:
ω(Н) = 2 : 98 = 0,0204, или 2,04%;
ω(S) = 32 : 98 = 0,3265, или 32,65%;
ω(О) = 64 : 98 =0,6531, или 65,31%
Пример 2. Определите массовые доли химических элементов в оксиде алюминия Al2O3 и выразите их в процентах.
1. Вычисляем относительную молекулярную массу оксида алюминия:
Mr( Al2O3) = 27 · 2 + 16 · 3 = 102
2. Вычисляем массовые доли элементов:
ω(Al) = 54 : 102 = 0,53 = 53%
ω(O) = 48 : 102 = 0,47 = 47%
Как вычислить массовую долю вещества в кристаллогидрате
Массовая доля вещества — отношение массы данного вещества в системе к массе всей системы, т.е. ω(Х) = m(Х) / m,
где ω(X) — массовая доля вещества Х,
m(X) — масса вещества Х,
m — масса всей системы
Массовая доля — безразмерная величина. Её выражают в долях от единицы или в процентах.
Пример 1. Определите массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl
2·2H2O.
Молярная масса BaCl2·2H2O составляет:
М(BaCl2·2H2O) = 137+ 2 · 35,5 + 2 · 18 = 244 г/моль
Из формулы BaCl2·2H2O следует, что 1 моль дигидрата хлорида бария содержит 2 моль H2O. Отсюда можно определить массу воды, содержащейся в BaCl2·2H2O:
m(h3O) = 2 · 18 = 36 г.
Находим массовую долю кристаллизационной воды в дигидрате хлорида бария BaCl2·2H2O.
ω(H2O) = m(H2O)/m(BaCl2 · 2H2O) = 36 / 244 = 0,1475 = 14,75%.
Пример 2. Из образца горной породы массой 25 г, содержащей минерал аргентит Ag2S, выделено серебро массой 5,4 г. Определите массовую долю аргентита в образце.
|
Дано: m(Ag )=5,4 г m = 25 г |
Решение Определяем количество вещества серебра, находящегося в аргентите: n(Ag ) = m(Ag) / M(Ag) = 5,4 / 108 = 0,05 моль. Из формулы Ag2S следует, что количество вещества аргентита в два раза меньше количества вещества серебра. Определяем количество вещества аргентита: n(Ag2S) = 0,5 · n(Ag) = 0,5 · 0,05 = 0,025 моль Рассчитываем массу аргентита: m(Ag2S) = n(Ag2S) · М(Ag2S) = 0,025 · 248 = 6,2 г . Теперь определяем массовую долю аргентита в образце горной породы, массой 25 г. ω(Ag2S) = m(Ag2S) / m = 6,2/25 = 0,248 = 24,8%. |
|
Найти: ω(Ag2S) = ? |
examchemistry.com
Как определить массовую долю 🚩 Массовая доля 🚩 Математика
3 февраля 2011
Автор КакПросто!
Есть два варианта постановки задачи: 1) когда нужно определить массовую долю элемента в веществе; 2) когда нужно определить массовую долю растворенного вещества.
Статьи по теме:
Вам понадобится
- Нужно определить, к какому варианту относится ваша задача. В случае первого варианта вам понадобится таблица Менделеева. В случае второго — надо знать, что раствор состоит из двух компонентов: растворенного вещества и растворителя. И масса раствора равна массам этих двух компонентов.
Инструкция
В случае первого варианта задачи:
По таблице Менделеева находим молярную массу вещества. Молярная масса равна сумме атомных масс элементов, входящих в состав вещества.
Например, молярная масса (Mr) гидрокисда кальция Са(ОН)2: Mr(Са(ОН)2) = Ar(Ca) + (Ar(O) + Ar(H))*2 = 40 + (16 + 1)*2 = 74.
Молярные массы атомов берутся из таблицы Менделеева.
Вычисляем массовую долю элемента (ω), например кальция в гидроксиде кальция.
Массовая доля равна отношению атомной массы элемента к молярной массе вещества: ω = Ar:Mr.
В случае гидроксида кальция: ω(Са) = 40:74 = 0,54. Это массовая доля элемента в долях единицы.
В случае второго варианта задачи:
Определить, какие массы вам даны, а именно: масса растворенного вещества и масса раствора или масса растворенного вещества и масса растворителя.
Если даны массы растворенного вещества и раствора, то массовая доля равна отношению массы растворенного (р.в.) вещества к массе раствора (р-ра).
ω = m(р.в.):m(р-ра)
Например, если масса соли 40 г, а масса раствора 100 г, то ω(соли) = 40:100 = 0,4. Это массовая доля растворенного вещества в долях единицы.
Если даны массы растворенного вещества и растворителя, то сначала надо определить массу раствора. Масса раствора (р-ра) равна сумме масс растворенного вещества (р.в.) и растворителя (р-ля).
m(р-ра) = m(р.в.) + m(р-ля)
Например, если масса соли 40 г, а масса воды 60 г, то m(р-ра) = 40 + 60 = 100 (г).
Затем вычисляется массовая доля растворенного вещества аналогично предыдущему шагу.
Чтобы найти массовую долю в процентах нужно умножить массовую долю в долях единицы на 100.
ω(Са) = 0,54 * 100 = 54 %
Видео по теме
Обратите внимание
При вычислении массовой доли раствора нужно четко определить, что является растворенным веществом, а что растворителем. Чаще всего растворенным веществом является какая-либо соль, растворителем — вода.
Полезный совет
При вычислении массовой доли всегда меньшее число делиться на большее, т.к. массовая доля всегда меньше единицы.
Источники:
- массовая доля это
Совет полезен?
Статьи по теме:
Не получили ответ на свой вопрос?
Спросите нашего эксперта:
www.kakprosto.ru
Как найти массу раствора в химии, не зная массовую долю?
Совет 1: Как найти массовую долю вещества
Людям в зависимости от рода их профессии приходится сталкиваться с растворами, имеющими строго заданное содержание в них растворенного вещества: приготовление лекарственных растворов, растворение проявителя для фотографий, раствор для аккумулятора с содержанием серной кислоты и т. д. Поэтому на уроках химии школьники с помощью задач учатся рассчитывать массовую долю растворенных веществ – отношение массы растворенного вещества к общей массе раствора.
Как найти массовую долю вещества
Статьи по теме:
Как найти массовую долю вещества
Как рассчитать массовую долю вещества
Как определить массовую долю элемента
Вопрос «Как просмотреть где идет заказ» — 2 ответа
Инструкция
1
Прочитайте внимательно задачу. Кратко с левой стороны страницы запишите ее данные с использованием буквенных обозначений и формул химических веществ, если они есть. Определите из вопроса задачи, что нужно найти.
2
Запишите с правой стороны листа общую формулу массовой доли растворенного вещества
ω = m1 / m,
где m1 – масса растворенного вещества, а m – масса всего раствора.
Если содержание массовой доли растворенного вещества нужно узнать в процентах, умножьте полученное число на 100%:
ω = m1 / m х 100%
3
В задачах, где нужно вычислить массовые доли каждого из элементов, входящих в состав химического вещества, используйте таблицу Д. И. Менделеева. Например, узнайте массовые доли каждого из элементов, входящих в состав углеводорода, формула которого C6h22
m (C6h22) = 6 х 12 + 12 х 1= 84 г/моль
ω (С) = 6 m1(С) / m (C6h22) х 100% = 6 х 12 г / 84 г/моль х 100% = 85%ω (Н) = 12 m1(Н) / m (C6h22) х 100% = 12 х 1 г / 84 г/моль х 100% = 15%
4
Выпишите ответ задачи.
Полезный совет
Задачи на нахождение массовой доли вещества после упаривания, разбавления, концентрирования, смешивания растворов решайте с помощью формул, полученных из определения массовой доли. Например, задачу на упаривание можно решить с помощью такой формулы
ω 2= m1 / (m – Dm) = (ω 1• m) / (m – Dm), где ω 2 – массовая доля вещества в упаренном растворе, Dm — разница между массами до нагревания и после.
Пришлите лучше на студенческий портал:
s 3 s . s o /dU204
Или на тот сайт, что красным написано на картинке.
Только пробелы между буквами поубирайте. <img src=»//otvet.imgsmail.ru/download/256454083_71156c65be801de6053b9732bbc58827_800.png» alt=»» data-lsrc=»//otvet.imgsmail.ru/download/256454083_71156c65be801de6053b9732bbc58827_120x120.png» data-big=»1″>
Это вопрос ни о чем — приведи конкретную ситуацию что есть, и что надо найти. Тогда обсудим…
touch.otvet.mail.ru
Как найти массовую долю?
Даже в одном грамме вещества может содержаться до тысячи различных соединений. Каждое соединение отвечает за определенное свойство вещества, а бывает так, что это не определенное вещество, а смесь. В любом случае на производстве часто возникает ситуация утилизации химических отходов и задача использования вторичного сырья. Именно химические реакции, позволяющие найти и выделить определенное вещество являются главенствующими. Но для этого надо сначала узнать как найти массовую долю.
Понятие массовой доли вещества отражает его содержание и концентрацию в сложной химической структуре, будь то смесь или сплав. Зная общую массу сплава или смеси, можно найти массы составляющих их веществ, при условии, что известны их массовые доли. Как найти массовую долю, формула обычно выражается в виде дроби: массовая доля вещества масса вещества/масса всей смеси.
Давайте проведем небольшой эксперимент! Для этого нам понадобятся периодическая таблица химических элементов им. Менделеева, весы и калькулятор.
Как найти массовую долю вещества
Необходимо определить массовую долю вещества, вещество находится в виде смеси. Первоначально кладем на весы само вещество. Получили массу вещества. Зная определенную массу вещества в смеси мы с легкостью получим его массовую долю. К примеру есть 170г. воды. В них находится 30 грамм вишневого сока. Общая масса=170+30=230 грамм. Поделим массу вишневого сока к общей массе смеси: 30/200=0.15 или 15% .
Как найти массовую долю раствора
Решение данной проблемы может понадобиться при определении концентрации пищевых растворов(уксус) или лекарственных препаратов. Дана масса раствора KOH, он же гидроксид калия, массой в 400 грамм. KOH (масса самого вещества) составляет 80 грамм. Необходимо найти массовую долю желчи в полученном растворе. Формула нахождения решения: KOH (масса раствора гидроксида калия) 300 г, масса растворенного вещества (KOH) 40 г. Найдите KOH (массовую долю щелочи) в полученном растворе, t- массовая доля. m- масса, t (вещества) = 100%* m (вещества) / m (раствора (вещества). Таким образом KOH (массовая доля раствор
elhow.ru
Примеры решения типовых задач на массовую долю растворённого вещества в растворе
Важно знать! Как научиться решать задачи по химии.
Задача 3.1. Определите массу воды в 250 г 10%-ного раствора хлорида натрия.
Решение. Из w = mв-ва / mр-ра находим массу хлорида натрия:
mв-ва = w • mр-ра = 0,1 • 250 г = 25 г NaCl
Поскольку mр-ра = mв-ва + mр-ля, то получаем:
m(Н20) = mр-ра — mв-ва = 250 г — 25 г = 225 г Н20.
Задача 3.2. Определите массу хлороводорода в 400 мл раствора соляной кислоты с массовой долей 0,262 и плотностью 1,13 г/мл.
Решение. Поскольку w = mв-ва / (V • ρ), то получаем:
mв-ва = w • V • ρ = 0,262 • 400 мл • 1,13 г/мл = 118 г
Задача 3.3. К 200 г 14%-ного раствора соли добавили 80 г воды. Определите массовую долю соли в полученном растворе.
Решение. Находим массу соли в исходном растворе:
mсоли = w • mр-ра = 0,14 • 200 г = 28 г.
Эта же масса соли осталась и в новом растворе. Находим массу нового раствора:
mр-ра = 200 г + 80 г = 280 г.
Находим массовую долю соли в полученном растворе:
w = mсоли / mр-ра = 28 г / 280 г = 0,100.
Задача 3.4. Какой объем 78%-ного раствора серной кислоты с плотностью 1,70 г/мл надо взять для приготовления 500 мл 12%-ного раствора серной кислоты с плотностью 1,08 г/мл?
Решение. Для первого раствора имеем:
w1 = 0,78 и ρ1 = 1,70 г/мл.
Для второго раствора имеем:
V2 = 500 мл, w2 = 0,12 и ρ2 = 1,08 г/мл.
Поскольку второй раствор готовим из первого добавлением воды, то массы вещества в обоих растворах одинаковы. Находим массу вещества во втором растворе. Из w2 = m2 / (V2 • ρ2) имеем:
m2 = w2 • V2 • ρ2 = 0,12 • 500 мл • 1,08 г/мл = 64,8 г.
Масса вещества в первом растворе также равна m2 = 64,8 г. Находим
объем первого раствора. Из w1 = m1 / (V1 • ρ1) имеем:
V1= m1 / (w1 • ρ1) = 64,8 г / (0,78 • 1,70 г/мл) = 48,9 мл.
Задача 3.5. Какой объем 4,65%-ного раствора гидроксида натрия с плотностью 1,05 г/мл можно приготовить из 50 мл 30%-ного раствора гидроксида натрия с плотностью 1,33 г/мл?
Решение. Для первого раствора имеем:
w1 = 0,0465 и ρ1 = 1,05 г/мл.
Для второго раствора имеем:
V2 = 50 мл, w2 = 0,30 и ρ2 = 1,33 г/мл.
Поскольку первый раствор готовим из второго добавлением воды, то массы вещества в обоих растворах одинаковы. Находим массу вещества во втором растворе. Из w2 = m2 / (V2 • ρ2) имеем:
m2 = w2 • V2 • ρ2 = 0,30 • 50 мл • 1,33 г/мл = 19,95 г.
Масса вещества в первом растворе также равна m2 = 19,95 г.
Находим объем первого раствора. Из w1 = m1 / (V1 • ρ1) имеем:
V1= m1 / (w1 • ρ1) = 19,95 г / (0,0465 • 1,05 г/мл) = 409 мл.
Коэффициент растворимости (растворимость) — максимальная масса вещества, растворимая в 100 г воды при данной температуре. Насыщенный раствор — это раствор вещества, который находится в равновесии с имеющимся осадком этого вещества.
Задача 3.6. Коэффициент растворимости хлората калия при 25 °С равен 8,6 г. Определите массовую долю этой соли в насыщенном растворе при 25 °С.
Решение. В 100 г воды растворилось 8,6 г соли.
Масса раствора равна:
mр-ра = mводы + mсоли = 100 г + 8,6 г = 108,6 г,
а массовая доля соли в растворе равна:
w = mсоли / mр-ра = 8,6 г / 108,6 г = 0,0792.
Задача 3.7. Массовая доля соли в насыщенном при 20 °С растворе хлорида калия равна 0,256. Определите растворимость этой соли в 100 г воды.
Решение. Пусть растворимость соли равна х г в 100 г воды.
Тогда масса раствора равна:
mр-ра = mводы + mсоли = (х + 100) г,
а массовая доля равна:
w = mсоли / mр-ра = х / (100 + х) = 0,256.
Отсюда
х = 25,6 + 0,256х; 0,744х = 25,6; х = 34,4 г на 100 г воды.
Молярная концентрация с — отношение количества растворенного вещества v (моль) к объему раствора V (в литрах), с = v(моль) / V(л), с = mв-ва / (М • V(л)).
Молярная концентрация показывает число моль вещества в 1 л раствора: если раствор децимолярный (с = 0,1 М = 0,1 моль/л) значит, что в 1 л раствора содержится 0,1 моль вещества.
Задача 3.8. Определите массу КОН, необходимую для приготовления 4 л 2 М раствора.
Решение. Для растворов с молярной концентрацией имеем:
с = m / (М • V),
где с — молярная концентрация,
m — масса вещества,
М — молярная масса вещества,
V — объем раствора в литрах.
Отсюда
m = с • М • V(л) = 2 моль/л • 56 г/моль • 4 л = 448 г КОН.
Задача 3.9. Сколько мл 98%-ного раствора Н2SO4 (ρ = 1,84 г/мл) необходимо взять для приготовления 1500 мл 0,25 М раствора?
Решение. Задача на разбавление раствора. Для концентрированного раствора имеем:
w1 = m1 / (V1(мл) • ρ1).
Необходимо найти объем этого раствора V1(мл) = m1 / (w1 • ρ1).
Поскольку разбавленный раствор готовится из концентрированного смешиванием последнего с водой, то масса вещества в этих двух растворах будет одинакова.
Для разбавленного раствора имеем:
с2 = m2 / (М • V2(л)) и m2 = с2 • М • V2(л).
Найденное значение массы подставляем в выражение для объема концентрированного раствора и проводим необходимые вычисления:
V1(мл) = m / (w1 • ρ1) = (с2 • М • V2) / (w1 • ρ1) = (0,25 моль/л • 98 г/моль • 1,5 л) / (0,98 • 1,84 г/мл) = 20,4 мл.
[Сборник задач, упражнений и тестов по химии: 11 класс: к учебнику Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия: 11 класс» / М.А. Рябов]
Решение задач на растворы (массовая доля). Массовая доля. Расчеты по химическим формулам. Задачи по химии.
Видео ютуб канала «День знаний»
Поделитесь с друзьями:
zadachi-po-ximii.megapetroleum.ru
Найди верный ответ на вопрос ✅ «Как найти количества вещества (n) если известна только массовая доля (w) ? …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Главная » Химия » Как найти количества вещества (n) если известна только массовая доля (w) ?