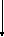Термодинамика – раздел физики, изучающий превращения энергии в макроскопических системах и основные свойства этих систем.
Термодинамика опирается на общие закономерности тепловых процессов и свойств макроскопических систем. Выводы термодинамики эмпирические, то есть опираются на факты, проверенные опытным путем с использованием молекулярно-кинетической модели.
Для описания термодинамических процессов в системах, состоящих из большого числа частиц, используются величины, не применимые к отдельным молекулам и атомам: температура, давление, концентрация, объем, энтропия)
Термодинамическое равновесие – состояние макросопической системы, когда описывающие ее макроскопические величины остаются неизменными.
В термодинамике рассматриваются изолированные системы тел, находящиеся в термодинамическом равновесии. То есть в системах с прекращением всех наблюдаемых макроскопических процессов. Особую важность представляет свойство, которое получило название выравнивания температуры всех ее частей.
При внешнем воздействии на термодинамическую систему наблюдается переход в другое равновесное состояние. Он получил название термодинамического процесса. Когда время его протекания достаточно медленное, система приближена к состоянию равновесия. Процессы, состоящие из последовательности равновесных состояний, называют квазистатическими.
Внутренняя энергия. Формулы
Внутренняя энергия считается важнейшим понятием термодинамики. Макроскопические тела (системы) имеют внутреннюю энергию, состящую из энергии каждой молекулы. Исходя из молекулярно-кинетической теории, внутренняя энергия состоит из кинетической энергии атомов и молекул, а также потенциальной энергии их взаимодействия.
Например, внутренняя энергия идеального газа равняется сумме кинетических энергий частиц газа, которые находятся в непрерывном беспорядочном тепловом движении. После подтверждений большим количеством экспериментов, был получен закон Джоуля:
Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема.
Применение молекулярно-кинетической теории говорит о том, что выражение для определения внутренней энергии 1 моля одноатомного газа, с поступательными движениями молекул записывается как:
U=32NАkT=32RT.
Зависимость от расстояния между молекулами у потенциальной энергии очевидна, поэтому внутренняя U и температура Т обусловлены изменениями V:
U=U(T, V).
Определение внутренней энергии U производится с помощью наличия макроскопических параметров, характеризующих состояние тела. Изменение внутренней энергии происходит по причине действия на тело внешних сил, совершающих работу. Внутренняя энергия является функцией состояния системы.
Когда газ в цилиндре сжимается под поршнем, то внешние силы совершают положительную работу A’. Силы давления газа на поршень также совершают работу, но равную A=-A’. При изменении объема газа на величину ∆V, говорят, что он совершает работу pS∆x=p∆V, где p – давление газа, S – площадь поршня, ∆x – его перемещение. Подробно показано в примере на рисунке 1.
Наличие знака перед работой говорит о работе газа в разных состояниях: положительная при расширении и отрицательная при сжатии. Переход из начального в конечное состояние работы газа может быть описан с помощью формулы:
A=∑pidVi или в пределе при ∆Vi→0:
A=∫V1V2pdV.
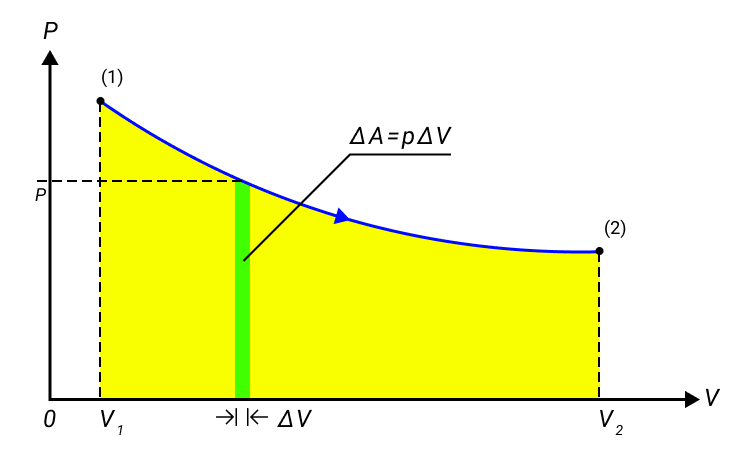
Рисунок 1. Работа газа при расширении.
Обратимые и необратимые процессы
Работа численно равняется площади процесса, изображенного на диаграмме p, V. Величина А зависит от метода перехода от начального состояния в конечное. Рисунок 2 показывает 3 процесса, которые переводят газ из состояние (1) в состояние (2). Во всех случаях газ совершает работу.
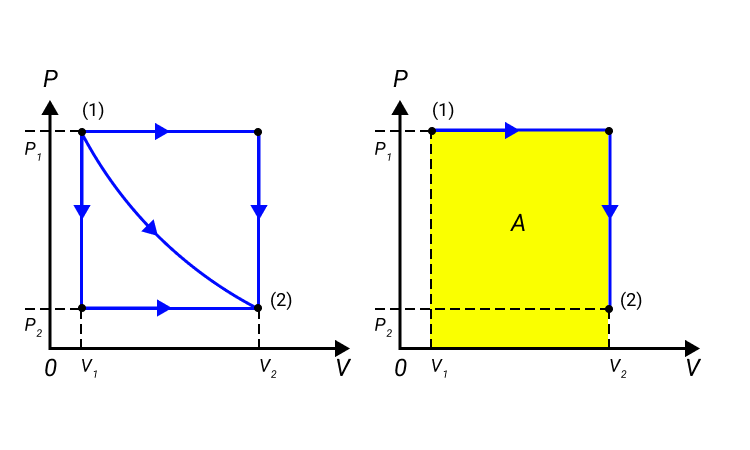
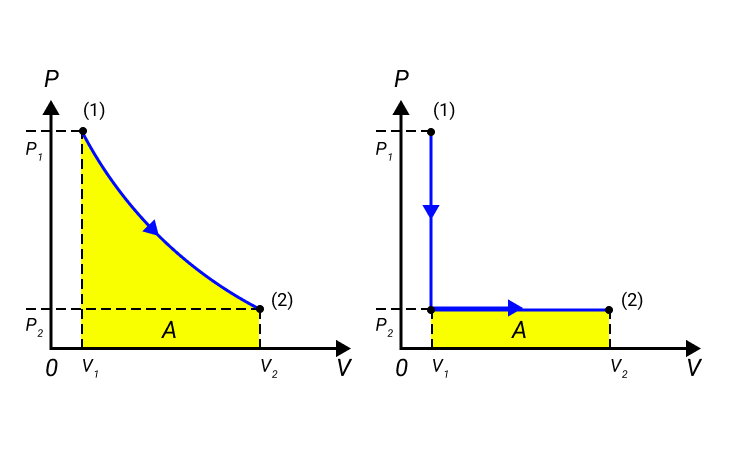
Рисунок 2. Три различных пути перехода из состояния (1) в состояние (2). Во всех трех случаях газ совершает разную работу, равную площади под графиком процесса.
Процессы из рисунка 2 возможно провести в обратном направлении. Тогда произойдет изменение знака А на противоположный.
Процессы, которые возможно проводить в обоих направлениях, получили название обратимых.
Жидкости и твердые тела могут незначительно изменять свой объем, поэтому при совершении работы разрешено им пренебречь. Но их внутренняя энергия подвергается изменениям посредствам совершения работы.
Механическая обработка деталей нагревает их. Это способствует изменению внутренней энергии. Имеется еще один пример опыта Джоуля 1843 года, служащий для определения механического эквивалента теплоты, изображенного на рисунке 3. Во время вращения катушки, находящейся в воде, внешние силы совершают положительную работу A’>0, тогда жидкость повышает температуру из-за наличия силы трения, то есть происходит увеличение внутренней энергии.
Процессы примеров не могут проводиться в противоположных направлениях, поэтому они получили название необратимых.

Рисунок 3. Упрощенная схема опыта Джоуля по определению механического эквивалента теплоты.
Изменение внутренней энергии возможно при наличии совершаемой работы и при теплообмене. Тепловой контакт тел позволяет увеличиваться энергии одного тела с уменьшением энергии другого. Иначе это называется тепловым потоком.
Количество теплоты
Количество теплоты Q, полученное телом, называется его внутренней энергией, получаемой в результате теплообмена.
Рисунок 4. Модель работы газа.
Процесс передачи тепла тел возможен только при разности их температур.
Направление теплового потока всегда идет к холодному телу.
Количество теплоты Q считается энергетической величиной и измеряется в джоулях (Дж).
Физика, 10 класс
Урок 23. Внутренняя энергия. Работа. Количество теплоты
Список вопросов, рассмотренных в уроке: внутренняя энергия; способы изменения внутренней энергии; различные виды теплообмена; уравнение теплового баланса; работа в термодинамике; нахождение численного значения работы в различных тепловых процессах.
Глоссарий по теме
Термодинамическая система представляет собой систему тел, которые взаимодействуют и обмениваются энергией и веществом.
Состояние равновесия – это состояние системы, в которой нет теплообмена между телами, составляющими систему.
Термодинамический процесс – процесс изменения состояния системы, который изменяет параметры системы.
Внутренняя энергия представляет собой сумму кинетической энергии хаотичного теплового движения и потенциальной энергии взаимодействия всех молекул, составляющих тело.
Теплоемкость представляет собой энергию, которая численно равна количеству тепла, которое выделяется или поглощается, когда температура тела изменяется на 1 К.
Теплопередача- это передача энергии от одного тела другому без выполнения работы.
Количество тепла является количественной мерой изменения внутренней энергии во время теплообмена.
Работа в термодинамике – это взаимодействие системы с внешними объектами, в результате чего изменяются параметры системы.
Список литературы
Г.Я. Мякишев., Б. Буховцев., Н. Н. Соцкий. Физика.10. Учебник для образовательных организаций М .: Просвещение, 2017. – С. 243-254.
Рымкевич А.П. Сборник задач по физике. 10-11 класс М.: Дрофа, 2009.- с.75-84
Основное содержание урока
Внутренняя энергия тела – это полная энергия всех молекул, которые его составляют. Внутренняя энергия идеального газа пропорциональна его температуре.
U = 3/2 · ν · R · T
Чтобы изменить внутреннюю энергию вещества, надо сообщить ему некоторое количество тепла или совершить работу.
Работа в термодинамике равна изменению внутренней энергии системы: A = ΔU.
Работа газа в изобарном процессе равна A = P · ΔV. Если газ расширяется, то А > 0, если газ сжимается, то А < 0.
Кроме того, работа газа может быть определена с использованием графика давления в зависимости от объема.
Работа газа численно равна площади под графиком давления.
Количество теплоты – это энергия, которую система получает или теряет во время теплообмена.
Количество тепла для различных термических процессов определяется по-разному.
При нагревании и охлаждении: Q = c_ ∙ m ∙ ΔT;
Во время плавления и кристаллизации: Q = ℷ ∙ m;
Во время испарения и конденсации; Q = r ∙ m;
При сжигании: Q = q ∙ m.
Для замкнутой и адиабатически изолированной системы тел выполняется уравнение теплового баланса: Q1 + Q2 + … + Qn = 0
Выражение для внутренней энергии одноатомного идеального или разреженного реального газа имеет следующий вид:
U = 3/2 ν ∙ R ∙ T
Для идеального газа из молекул с двумя, тремя или более атомами необходимо учитывать кинетическую энергию вращения молекул (они больше не могут считаться материальными точками), поэтому выражение для их внутренней энергии отличается от U = 3/2 ν ∙ R ∙ T числовым коэффициентом.
Для двухатомного газа (например, O2, CO и т. д.):
U = 5/2 ν ∙ R ∙ T
Для газа с тремя атомами или более (например, O3, CH4):
U = 3ν · R · T
Изменить внутреннюю энергию вещества можно, передав ему некоторое количество тепла или выполнить над ним работу.
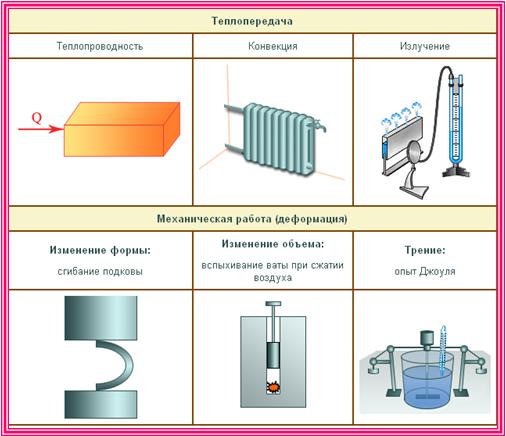
Существует три типа теплопередачи:
1) Теплопроводность представляет собой процесс переноса энергии от более теплого тела к менее нагретому телу с прямым контактом или от более нагретых частей тела к менее нагретым, осуществляемый хаотично движущимися частицами тела (атомы, молекулы, электроны , и т.д.). Простым примером является нагревание чашки, в которую выливают горячий чай.
2) Конвекция – это своего рода передача тепла, в которой внутренняя энергия передается снизу вверх струями или потоками жидкости или газа. Пример: нагревание воды в чайнике, который стоит на горячей плите.
3) Лучистый обмен или излучение – это процесс передачи энергии через электромагнитное излучение. Простой пример: солнечный свет.
Механическая работа изменяет механическую энергию тела. Термодинамическая работа изменяет внутреннюю энергию газа.
Если газ расширяется, то работа газа считается положительной. Если он сжат, то отрицательной.
Формула для нахождения работы газа в изобарном процессе имеет следующий вид:
A = p · ΔV
Для изотермического процесса формула принимает следующий вид: A = ν ∙ R ∙ T ∙ ln (V_2 / V_1)
Разбор тренировочных заданий
1. Объём газа, расширяющегося при постоянном давлении 100 кПа, увеличился на 20 литров. Работа, выполняемая газом в этом процессе, – _____.
Варианты ответов:
2000 Дж;
20 000 Дж;
200 Дж;
50 МДж.
Правильный вариант / варианты (или правильные комбинации вариантов): 3) 2000 Дж.
Совет: используйте формулу работы.
2. Чтобы из 5 кг снега, при температуре 0ºС, получить воду при 20ºС, необходимо сжигать в печке с КПД 40% __ кг дров.
Решение: при сгорании дров выделится количество теплоты:

из этого количества на полезную работу пойдёт только:

Для плавления снега необходимо количество теплоты:

для нагревания воды понадобится:

Согласно уравнению теплового баланса:

Отсюда следует:

Подставим числовые значения в формулу:

Ответ: 0,5175 кг.
Содержание:
Внутренняя энергия:
Вы знаете, что движущееся тело обладает кинетической энергией. А если оно еще и взаимодействует с другим телом, то обладает потенциальной энергией. Оба вида энергии представляют собой механическую энергию. Они взаимно превращаемы: кинетическая энергия может переходить в потенциальную и наоборот. Кроме того, вы знаете, что любое тело имеет дискретную структуру, т. е. состоит из частиц (атомов, молекул). Частицы находятся в непрерывном хаотическом движении. А частицы жидкости и твердого тела еще и взаимодействуют между собой. Следовательно, частицы обладают кинетической, а частицы жидкости и твердых тел — еще и потенциальной энергией. Сумма кинетической и потенциальной энергий всех частиц тела называется внутренней энергией. Внутренняя энергия измеряется в джоулях. Чем отличается внутренняя энергия от механической? В чем ее особенности? Может ли механическая энергия переходить во внутреннюю?
Для ответа на эти вопросы рассмотрим пример. Шайба, двигавшаяся горизонтально по льду (рис. 1), остановилась. Как изменилась ее механическая энергия относительно льда?
Кинетическая энергия шайбы уменьшилась до нуля. Положение шайбы над уровнем льда не изменилось, шайба не деформировалась. Значит, изменение потенциальной энергии равно нулю. Означает ли это, что се механическая (кинетическая) энергия исчезла бесследно? Нет. Механическая энергия шайбы перешла во внутреннюю энергию шайбы и льда.
А может ли внутренняя энергия тела, как механическая, быть равной нулю? Движение частиц, из которых состоит тело, не прекращается даже при самых низких температурах. Значит, тело всегда (подчеркиваем, всегда) обладает некоторым запасом внутренней энергии. Его можно либо увеличить, либо уменьшить — и только!
Велико ли значение внутренней энергии тела? Энергия одной частицы, например кинетическая, в силу незначительности ее массы чрезвычайно мала. Расчеты для средней энергии поступательного движения молекулы кислорода показывают, что ее значение при комнатной температуре 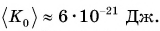
Главные выводы:
- Независимо от того, есть у тела механическая энергия или нет, оно обладает внутренней энергией.
- Внутренняя энергия тела равна сумме кинетической и потенциальной энергий частиц, из которых оно состоит.
- Внутренняя энергия тела всегда не равна нулю.
Способы изменения внутренней энергии
Чтобы изменить механическую энергию тела, надо изменить скорость его движения, взаимодействие с другими телами или взаимодействие частей тела. Вы уже знаете, что это достигается совершением работы.
Как можно изменить (увеличить или уменьшить) внутреннюю энергию тела? Рассуждаем логически. Внутренняя энергия определяется как сумма кинетической и потенциальной энергий частиц. Значит, нужно изменить либо скорость движения частиц, либо их взаимодействие (изменить расстояния между ними). Очевидно, можно изменить и скорость, и расстояния между частицами одновременно. Изменить скорость частиц тела можно, увеличив или уменьшив его температуру. Действительно, наблюдения за диффузией показывают, что быстрота ее протекания увеличивается при нагревании (рис. 4, а, б).
Значит, увеличивается средняя скорость движения частиц, а следовательно, их средняя кинетическая энергия. Отсюда следует важный вывод: температура является мерой средней кинетической энергии частиц.
Как изменить кинетическую энергию частиц тела? Существуют два способа. Рассмотрим их на опытах. Будем натирать колбу с воздухом полоской сукна (рис. 5).
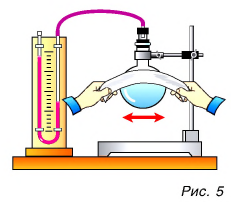
Через некоторое время уровень жидкости в правом колене манометра (см. рис. 5) опустится, т. е. давление воздуха в колбе увеличится. Это говорит о нагревании воздуха. Значит, увеличилась скорость движения и кинетическая энергия его молекул, а следовательно, и внутренняя энергия. Но за счет чего? Очевидно, за счет совершения механической работы при трении сукна о колбу. Нагрелась колба, а от нее — газ.
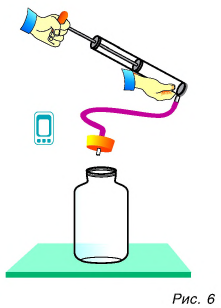
Проведем еще один опыт. В толстостенный стеклянный сосуд нальем немного воды (чайную ложку для увлажнения воздуха в нем. Насосом (рис. 6) будем накачивать в сосуд воздух. Через несколько качков пробка вылетит, а в сосуде образуется туман. Из наблюдений за окружающей средой мы знаем, что туман появляется тогда, когда после теплого дня наступает холодная ночь. Образование тумана в сосуде свидетельствует об охлаждении воздуха, т. е. об уменьшении его внутренней энергии. Но почему уменьшилась энергия? Потому что за ее счет совершена работа по выталкиванию пробки из сосуда.
Сравним результаты опытов. В обоих случаях изменилась внутренняя энергия газа, но в первом опыте она увеличилась, так как работа совершалась внешней силой (над колбой с газом), а во втором — уменьшилась, ибо работу совершала сила давления самого газа.
А можно ли, совершая работу, изменить потенциальную энергию взаимодействия молекул?
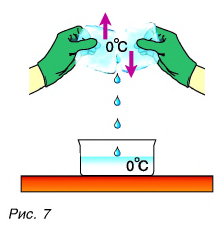
Опять обратимся к опыту. Два куска льда при О °C будем тереть друг о друга (рис. 7).
Лед превращается в воду, при этом температура воды и льда остается постоянной, равной О °C (см. рис. 7). На что тратится механическая работа силы трения?
Конечно же, на изменение внутренней энергии!
Но кинетическая энергия молекул не изменилась, так как температура не изменилась. Лед превратился в воду. При этом изменились силы взаимодействия молекул  (напоминаем, что лед и вода состоят из одинаковых молекул), а следовательно, изменилась их потенциальная энергия.
(напоминаем, что лед и вода состоят из одинаковых молекул), а следовательно, изменилась их потенциальная энергия.
Совершение механической работы — один из способов изменения внутренней энергии тела.
А есть ли возможность изменить внутреннюю энергию тела, не совершая механическую работу?
Да, есть. Нагреть воздух в колбе (рис. 8), расплавить лед (рис. 9) можно с помощью спиртовки, передав и воздуху, и льду теплоту. В обоих случаях внутренняя энергия увеличивается.
При охлаждении тел (если колбы со льдом и воздухом поместить в морозильник) их внутренняя энергия уменьшается. Теплота от тел передается окружающей среде.
Процесс изменения внутренней энергии тела, происходящий без совершения работы, называется теплопередачей (теплообменом).
Таким образом, совершение механической работы и теплопередача — два способа изменения внутренней энергии тела.
Величину, равную изменению внутренней энергии при теплопередаче, называют количеством теплоты (обозначается Q). Единицей количества теплоты, как работы и энергии, в СИ является 1 джоуль.
Для любознательных:
Физики XVIII в. и первой половины XIX в. рассматривали теплоту не как изменение энергии, а как особое вещество — теплород — жидкость (флюид), которая может перетекать от одного тела к другому. Если тело нагревалось, то считалось, что в него вливался теплород, а если охлаждалось — то выливался. При нагревании тела расширяются. Это объяснялось тем, что теплород имеет объем. Но если теплород — вещество, то тела при нагревании должны увеличивать свою массу. Однако взвешивания показывали, что масса тела не менялась. Поэтому теплород считали невесомым. Теорию теплорода поддерживали многие ученые, в том числе и такой гениальный ученый, как Г. Галилей. Позже Дж. Джоуль на основании проведенных им опытов пришел к выводу, что теплород не существует и что теплота есть мера изменения кинетической и потенциальной энергий движущихся частиц тела.
В дальнейшем выражение «сообщить телу количество теплоты» мы будем понимать как «изменить внутреннюю энергию тела без совершения механической работы, т. е. путем теплообмена». А выражение «нагреть тело» будем понимать как «повысить его температуру» любым из двух способов.
Главные выводы:
- Внутреннюю энергию тела можно изменить путем совершения механической работы или теплопередачи (теплообмена).
- Изменение внутренней энергии при нагревании или охлаждении тела при постоянном объеме связано с изменением средней кинетической энергии его частиц.
- Изменение внутренней энергии тела при неизменной температуре связано с изменением потенциальной энергии его частиц.
Основы термодинамики
МКТ стала общепризнанной на рубеже XIX и XX веков. Задолго до ее создания исследованием тепловых процессов занималась термодинамика — раздел физики, изучающий превращение внутренней (тепловой) энергии в другие виды энергии и наоборот, а также количественные соотношения при таких превращениях.
- Заказать решение задач по физике
Внутренняя энергия и ее особенности
Внутренняя энергия макроскопического тела определяется характером движения и взаимодействия всех микрочастиц, из которых состоит тело (система тел). Таким образом, к внутренней энергии следует отнести:
- кинетическую энергию хаотического (теплового) движения частиц вещества (атомов, молекул, ионов);
- потенциальную энергию взаимодействия частиц вещества;
- энергию взаимодействия атомов в молекулах (химическую энергию);
- энергию взаимодействия электронов и ядра в атоме и энергию взаимодействия нуклонов в ядре (внутриатомную и внутриядерную энергии).
Однако для описания тепловых процессов важно не столько значение внутренней энергии, как ее изменение. При тепловых процессах химическая, внутриатомная и внутриядерная энергии практически не изменяются. Именно поэтому внутренняя энергия в термодинамике определяется как сумма кинетических энергий хаотического (теплового) движения частиц вещества (атомов, молекул, ионов), из которых состоит тело, и потенциальных энергий их взаимодействия.
Внутреннюю энергию обозначают символом U.
Единица внутренней энергии в СИ — джоуль: [U]=1 Дж (J).
Особенности внутренней энергии идеального газа
- Атомы и молекулы идеального газа практически не взаимодействуют друг с другом, поэтому внутренняя энергия идеального газа равна кинетической энергии поступательного и вращательного движений его частиц.
- Внутренняя энергия данной массы идеального газа прямо пропорциональна его абсолютной температуре. Докажем данное утверждение для одноатомного газа. Атомы такого газа движутся только поступательно, поэтому, чтобы определить его внутреннюю энергию, следует среднюю кинетическую энергию поступательного движения атомов умножить на количество атомов:
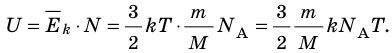 Итак, для одноатомного идеального газа:
Итак, для одноатомного идеального газа: 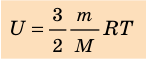 . Используя уравнение состояния
. Используя уравнение состояния 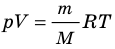 , выражение для внутренней энергии идеального одноатомного газа можно представить так:
, выражение для внутренней энергии идеального одноатомного газа можно представить так: 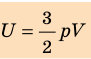
- Внутренняя энергия — функция состояния системы, то есть она однозначно определяется основными макроскопическими параметрами (p, V, T), характеризующими систему. Независимо от того, каким образом система переведена из одного состояния в другое, изменение внутренней энергии будет одинаковым.
- Внутреннюю энергию можно изменить двумя способами: совершением работы и теплопередачей.
Какие существуют виды теплопередачи
Теплопередача (теплообмен) — процесс изменения внутренней энергии тела или частей тела без совершения работы. Процесс теплопередачи возможен только при наличии разности температур. Самопроизвольно тепло всегда передается от более нагретого тела к менее нагретому. Чем больше разность температур, тем быстрее — при прочих равных условиях — протекает процесс передачи тепла.
| Виды теплопередачи | ||
|---|---|---|
| Теплопроводность | Конвекция | Излучение |
|
Вид теплопередачи, который обусловлен хаотическим движением частиц вещества и не сопровождается переносом этого вещества. Лучшие проводники тепла — металлы, плохо проводят тепло дерево, стекло, кожа, жидкости (за исключением жидких металлов); самые плохие проводники тепла — газы. Передача энергии от горячей воды к батарее отопления, от поверхности воды до ее нижних слоев и т. д. происходит благодаря теплопроводности. |
Вид теплопередачи, при котором тепло переносится потоками жидкости или газа. Теплые потоки жидкости или газа имеют меньшую плотность, поэтому под действием архимедовой силы поднимаются, а холодные потоки — опускаются. Благодаря конвекции происходит циркуляция воздуха в помещении, нагревается жидкость в стоящей на плите кастрюле, существуют ветры и морские течения и т. д. В твердых телах конвекция невозможна. | Вид теплопередачи, при котором энергия передается посредством электромагнитных волн. Излучение — универсальный вид теплопередачи: тела всегда излучают и поглощают инфракрасное (тепловое) излучение. Это единственный вид теплообмена, возможный в вакууме (энергия от Солнца передается только излучением). Лучше излучают и поглощают энергию тела с темной поверхностью. |
Как определить количество теплоты
Количество теплоты Q — это физическая величина, равная энергии, которую тело получает (или отдает) в ходе теплопередачи.
Единица количества теплоты в СИ — джоуль: [П] =1 Дж (J).
Из курса физики 8 класса вы знаете, что количество теплоты, которое поглощается при нагревании вещества (или выделяется при его охлаждении), вычисляют по формуле: Q=cm∆Т=cm∆t , где c — удельная теплоемкость вещества; m — масса вещества; 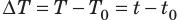 — изменение температуры.
— изменение температуры.
Обратите внимание! Произведение удельной теплоемкости на массу вещества, из которого изготовлено тело, называют теплоемкостью тела: C=cm . Если известна теплоемкость C тела, то количество теплоты, которое получает тело при изменении температуры на ∆T, вычисляют по формуле: Q=C∆T .
| Расчет количества теплоты при фазовых переходах | |
|---|---|
| Кристаллическое состояние ↔ Жидкое состояние | Жидкое состояние ↔ Газообразное состояние |
|
Температуру, при которой происходят фазовые переходы «кристалл → жидкость» и «жидкость → кристалл», называют температурой плавления. Температура плавления зависит от рода вещества и внешнего давления. Количество теплоты Q, которое поглощается при плавлении кристаллического вещества (или выделяется при кристаллизации жидкости), вычисляют по формуле: Q = λm, где m — масса вещества; λ — удельная теплота плавления. |
Фазовые переходы «жидкость → пар» и «пар → жидкость» происходят при любой температуре. Количество теплоты Q, которая поглощается при парообразовании (или выделяется при конденсации), вычисляют по формуле: Q=rm (Q=Lm), где m — масса вещества; r (L) — удельная теплота парообразования при данной температуре (обычно в таблицах представлена удельная теплота парообразования при температуре кипения жидкости). |
| Напомним: и при плавлении, и при кипении температура вещества не изменяется. |
Пример решения задачи №1
Неон массой 100 г находится в колбе объемом 5,0 л. В процессе изохорного охлаждения давление неона уменьшилось с 100 до 50 кПа. На сколько при этом изменились внутренняя энергия и температура неона?

Решение:
Неон — одноатомный газ; для таких газов изменение внутренней энергии равно:
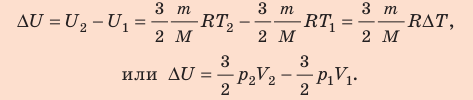
Поскольку охлаждение изохорное, объем неона не изменяется: 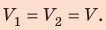 После преобразований получим:
После преобразований получим:
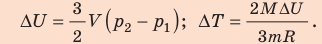
Проверим единицы, найдем значения искомых величин:
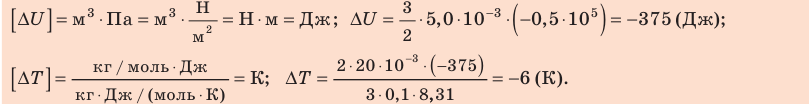
Анализ результатов. Знак «–» свидетельствует о том, что внутренняя энергия и температура неона уменьшились, — это соответствует изохорному охлаждению. Ответ: ∆U = –375 Дж; ∆T = –6 К.
Пример решения задачи №2
Внутренний алюминиевый сосуд калориметра имеет массу 50 г и содержит 200 г воды при температуре 30 °С. В сосуд бросили кубики льда при температуре 0 °С, в результате чего температура воды в калориметре снизилась до 20 °С. Определите массу льда. Удельные теплоемкости воды и алюминия: 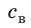 = 4200 Дж/(кг · К),
= 4200 Дж/(кг · К), 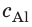 = 920 Дж/(кг · К); удельная теплота плавления льда — 334 кДж/кг.
= 920 Дж/(кг · К); удельная теплота плавления льда — 334 кДж/кг.
Анализ физической проблемы.
Калориметр имеет такое устройство, что теплообмен с окружающей средой практически отсутствует, поэтому для решения задачи воспользуемся уравнением теплового баланса. В теплообмене участвуют три тела: вода, внутренний сосуд калориметра, лед.
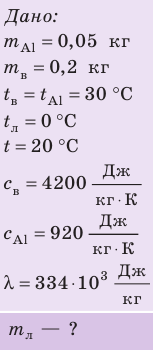
Решение:
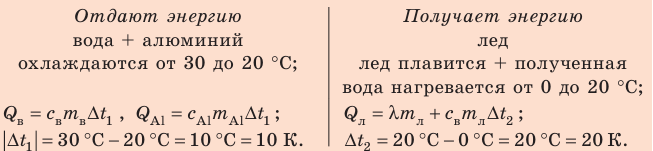
Запишем уравнение теплового баланса:
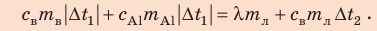
После преобразований получим:
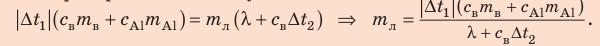
Проверим единицу, найдем значение искомой величины:
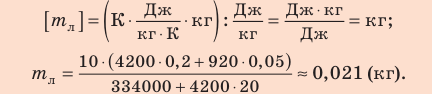
Ответ: 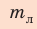 = 21 г.
= 21 г.
Выводы:
- В термодинамике под внутренней энергией U тела понимают сумму кинетических энергий хаотического движения частиц вещества, из которых состоит тело, и потенциальных энергий их взаимодействия. Внутренняя энергия однозначно определяется основными макроскопическими параметрами (p, V, T), характеризующими термодинамическую систему. Внутреннюю энергию идеального одноатомного газа определяют по формулам:
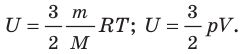
- Внутреннюю энергию можно изменить двумя способами: совершением работы и теплопередачей. Существует три вида теплопередачи: теплопроводность, конвекция, излучение.
- Физическую величину, равную энергии, которую тело получает или отдает при теплопередаче, называют количеством теплоты (Q): Q=cm∆T = С∆T — количество теплоты, которое поглощается при нагревании тела (или выделяется при его охлаждении); Q = λm — количество теплоты, которое поглощается при плавлении вещества (или выделяется при кристаллизации); Q=rm (Q=Lm) — количество теплоты, которое поглощается при парообразовании вещества (или выделяется при конденсации).
- Теплопроводность в физике
- Конвекция в физике
- Излучение тепла в физике
- Виды излучений в физике
- Машины и механизмы в физике
- Коэффициент полезного действия (КПД) механизмов
- Тепловые явления в физике
- Тепловое движение в физике и его измерение
Внутренняя энергия
Любая
термодинамическая система состоит из
атомов и молекул, находящихся в непрерывном
движении. Количественной характеристикой
движения является энергия.
Внутренняя
энергия (U)
характеризует общий запас энергии
системы. Она включает все виды движения
и взаимодействия частиц, составляющих
систему: кинетическую энергию молекулярного
движения, межмолекулярную энергию
притяжения и отталкивания частиц,
внутримолекулярную или химическую
энергию, энергию электронного возбуждения,
внутриядерную и лучистую энергию.
Величина
внутренней энергии зависит от природы
вещества,
его массы
и параметров
состояния системы.
Определение
полного запаса внутренней энергии
вещества невозможно, т.к. нельзя перевести
систему в состояние, лишенное внутренней
энергии. Поэтому в термодинамике
рассматривают изменение внутренней
энергии (∆U),
которое представляет собой разность
величин внутренней энергии системы в
конечном и начальном состояниях:
∆U
= Ukoh.
– Uнач.
Бесконечно
малое изменение внутренней энергии
обозначают через du
т.к. внутренняя энергия является функцией
состояния и ее изменение не зависит от
пути процесса, а определяется только
начальным и конечным состоянием системы,
то du
будет полным дифференциалом. Величины
∆U
и du
считают положительными, если внутренняя
энергия при протекании процесса
возрастает, а
отрицательными
если убывает.
Теплота и работа
Передача
энергии от системы к окружающей среде
и наоборот осуществляется в виде теплоты
(Q)
и работы (А).
|
Система |
||||||
|
|
|
|
||||
|
-Q |
+Q |
+А |
-А |
|||
|
Окружающая |
Форма
передачи энергии от одной части системы
к другой вследствие неупорядоченного
движения молекул, зависящая лишь от
температуры частей системы и не связанная
с перекосом вещества в системе называется
теплотой.
Теплота
связана с процессом, а не с состоянием
системы, т.е. теплота
является функцией состояния
она зависит от пути процесса поэтому
бесконечно малое количество теплоты
обозначается δQ
и не является полным дифференциалом.
Теплота, подводимая к системе, считается
положительной,
а отданная ею – отрицательной.
Работа
процесса –
это энергия, передаваемая одним телом
другому при их взаимодействии, не
зависящая от температуры этих тел и не
связанная с переносом вещества от одного
тела к другому.
Работа,
как и теплота, связана с процессом и не
является свойством системы, т.е. функцией
состояния. Paбoту,
совершаемую системой против внешних
сил. принято считать положительной,
а совершаемую над системой – отрицательной.
Первый закон термодинамики
Первый
закон имеет несколько формулировок:
-
Внутренняя
энергия изолированной системы постоянна. -
Работа
и теплота эквивалентны. -
Вечный
двигатель I
рода невозможен. (Двигатель I
рода дает работу без затраты энергии
из окружающей среды.)
Математическое
выражение I
закона:
Q
= ∆U
+ A, (1)
где
Q
– количество сообщенной системе теплоты;
∆U
– изменение
внутренней энергии;
А
– суммарная работа, совершаемая системой.
Для
бесконечно малых элементарных процессов
уравнение (1) имеет вид:
δQ
= du
– δА = du
– pdV
+ δА,
где
pdV
– работа расширения;
δА
– сумма всех остальных видов элементарных
работ (магнитная, электрическая и др.).
Величину
δА называют полезной работой. В химической
термодинамике принимают во внимание
только работу расширения, а работу δА
считают равной 0. Поэтому
δА
= pdV, тогда δQ=
du
+ pdV (2)
Из
уравнений (1.2) следует, что количество,
теплоты подведенное к системе или
отведенное от нее идет на изменение
внутренней энергии и на работу, совершаемую
системой или совершаемую над системой.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Наука о тепловых явлениях называется термодинамика. Термодинамика исходит из наиболее общих закономерностей тепловых процессов и свойств макроскопических систем.
При изучении основ термодинамики необходимо помнить следующие определения. Физическая система, состоящая из большого числа частиц — атомов или молекул, которые совершают тепловое движение и, взаимодействуя между собой, обмениваются энергиями, называется термодинамической системой.
Состояние термодинамической системы определяется макроскопическими параметрами, например удельным объемом, давлением, температурой.
Термодинамика рассматривает изолированные системы тел, находящиеся в состоянии термодинамического равновесия. Это означает, что в таких системах прекратились все наблюдаемые макроскопические процессы. Важным свойством термодинамически равновесной системы является выравнивание температуры всех ее частей.
Термодинамика рассматривает только равновесные состояния, т.е. состояния, в которых параметры термодинамической системы не меняются со временем.
Если термодинамическая система была подвержена внешнему воздействию, то в конечном итоге она перейдет в другое равновесное состояние. Такой переход называется термодинамическим процессом.
Термодинамическим процессом называется переход системы из начального состояния в конечное через последовательность промежуточных состояний.
Процессы бывают обратимыми и необратимыми.
Обратимым называется такой процесс, при котором возможен обратный переход системы из конечного состояния в начальное через те же промежуточные состояния, чтобы в окружающих телах не произошло никаких изменений. Обратимый процесс является физической абстракцией. Примером процесса, приближающегося к обратимому, является колебание тяжелого маятника на длинном подвесе. В этом случае кинетическая энергия практически полностью превращается в потенциальную, и наоборот. Колебания происходят долго без заметного уменьшения амплитуды ввиду малости сопротивления среды и сил трения.
Любой процесс, сопровождаемый трением или теплопередачей от нагретого тела к холодному, является необратимым. Примером необратимого процесса является расширение газа, даже идеального, в пустоту. Расширяясь, газ не преодолевает сопротивления среды, не совершает работы, но, для того чтобы вновь собрать все молекулы газа в прежний объем, т. е. привести газ в начальное состояние, необходимо затратить работу. Таким образом, все реальные процессы являются необратимыми.
Изменение внутренней энергии газа в процессе теплообмена и совершаемой работы.
Одним из важнейших понятий термодинамики является внутренняя энергия тела. Все макроскопические тела обладают энергией, заключенной внутри самих тел. С точки зрения молекулярно-кинетической теории внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом.
Внутренняя энергия – это сумма энергий молекулярных взаимодействий и энергии теплового движения молекул.
В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема (закон Джоуля).
Молекулярно-кинетическая теория приводит к следующему выражению для внутренней энергии одного моля идеального одноатомного газа (гелий, неон и др.), молекулы которого совершают только поступательное движение:
Поскольку потенциальная энергия взаимодействия молекул зависит от расстояния между ними, в общем случае внутренняя энергия ![]()
U тела зависит наряду с температурой T также и от объема V: U = U(T, V).
Таким образом, внутренняя энергия системы зависит только от её состояния и является однозначной функцией состояния, внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Она не зависит от того, каким путем было реализовано данное состояние.
Внутреннюю энергию тела можно изменить разными способами:
- Совершение механической работы.
- Теплообмен.
Внутренняя энергия тела может изменяться, если действующие на него внешние силы совершают работу (положительную или отрицательную).
Например, газ подвергается сжатию в цилиндре под поршнем площадью S. Поршень, сжимая газ, движется с некоторой скоростью v. Молекулы газа, беспорядочно двигаясь, ударяются о поршень. После упругого удара молекулы о поршень скорость молекулы возрастает, а значит возрастает и её кинетическая энергия, что приводит к увеличению внутренней энергии газа.
При сжатии газа его внутренняя энергия увеличивается за счет совершения поршнем механической работы. При расширении газа его внутренняя энергия уменьшается, превращаясь в механическую энергию поршня.
При сжатии газа внешние силы совершают над газом некоторую положительную работу A’.
В то же время силы давления, действующие со стороны газа на поршень, совершают работу
A = –A’.
Если объем газа изменился на малую величину ΔV, то газ совершает работу pSΔx = pΔV, где p – давление газа, S – площадь поршня, Δx – его перемещение.
При расширении работа, совершаемая газом, положительна, при сжатии – отрицательна.
В общем случае при переходе из некоторого начального состояния (1) в конечное состояние (2) работа газа выражается формулой:
![]()
или в пределе при ΔVi → 0: 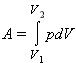
Работа численно равна площади под графиком процесса на диаграмме (p, V):
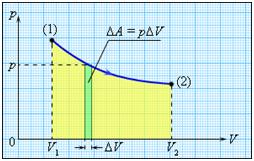
Величина работы зависит от того, каким путем совершался переход из начального состояния в конечное. На рис. 2 изображены три различных процесса, переводящих газ из состояния (1) в состояние (2). Во всех трех случаях газ совершает различную работу.
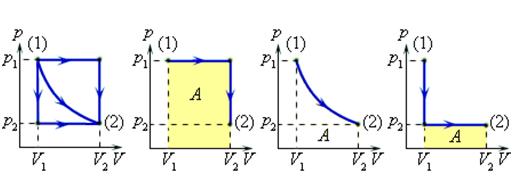
Рисунок 2.
Три различных пути перехода из состояния (1) в состояние (2).
Во всех трех случаях газ совершает разную работу, равную площади под графиком процесса.
Процессы, изображенные на рис. 2, можно провести и в обратном направлении; тогда работа A просто изменит знак на противоположный.
Процессы которые можно проводить в обоих направлениях, называются обратимыми.
В отличие от газа, жидкости и твердые тела мало изменяют свой объем, так что во многих случаях работой, совершаемой при расширении или сжатии, можно пренебречь. Однако, внутренняя энергия жидких и твердых тел также может изменяться в результате совершения работы. При механической обработке деталей (например, при сверлении) они нагреваются. Это означает, что изменяется их внутренняя энергия.
Внутренняя энергия тела может изменяться не только в результате совершаемой работы, но и вследствие теплообмена.
При тепловом контакте тел внутренняя энергия одного из них может увеличиваться, а внутренняя энергия другого – уменьшаться. В этом случае говорят о тепловом потоке от одного тела к другому. Передача энергии от одного тела другому в форме тепла может происходить только при наличии разности температур между ними.
Приведем в соприкосновение два тела с разными температурами. Пусть температура первого тела выше, чем второго. В результате обмена энергиями температура первого тела уменьшается, а второго — увеличивается. В рассматриваемом примере кинетическая энергия хаотического движения молекул первого тела переходит в кинетическую энергию хаотического движения молекул второго тела.
Тепловой поток всегда направлен от горячего тела к холодному.
Процесс передачи внутренней энергии без совершения механической работы называется теплообменом.
Мерой энергии, получаемой или отдаваемой телом в процессе теплообмена, служит физическая величина, называемая количеством теплоты.
Количеством теплоты Q, полученной телом, называют изменение внутренней энергии тела в результате теплообмена.
Количество теплоты Q является энергетической величиной. В СИ количество теплоты измеряется в единицах механической работы – джоулях (Дж).
До введения СИ количество теплоты выражали в калориях.
Калория – это количество теплоты, необходимое для нагревания 1 г дистиллированной воды на 1°С, от 19,5°С до 20,5°С.
Единица, в 1000 раз большая калории, называется килокалорией (1 ккал = 1000 кал). Соотношение между единицами: 1 кал =4,19 Дж.
Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются.
Чтобы нагреть тело массой m от температуры t1 до температуры t2 ему необходимо сообщить количество теплоты
Q = cm(t2 – t1)
Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c.
c = Q / (mΔT).
Во многих случаях удобно использовать молярную теплоемкость C:
C = M · c, где M – молярная масса вещества.
При передаче тепла от одного тела к другому всегда выполняется уравнение теплового баланса, по которому количество теплоты Q1, отданное первым телом, равно количеству теплоты Q2, полученному вторым телом.
Q1 = Q2
Теплота и работа являются не видом энергии, а формой ее передачи, они существуют лишь в процессе передачи энергии.
В реальных условиях оба способа передачи энергии системе в форме работы и форме теплоты обычно сопутствуют друг другу.
Первое начало термодинамики.
На рисунке изображены энергетические потоки между термодинамической системой и окружающими телами. в результате теплообмена и совершаемой работы:
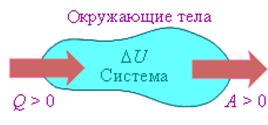
Величина Q > 0, если тепловой поток нправлен в сторону термодинамической системы. Величина A > 0, если система совершает положительную работу над окружающими телами.
Если система обменивается теплом с окружающими телами и совершает работу (положительную или отрицательную), то изменяется состояние системы, то есть изменяются ее макроскопические параметры (температура, давление, объем).
Процессы теплообмена и совершения работы сопровождаются изменением ΔU внутренней энергии системы.
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом:
Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
ΔU = Q – A.
Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме:
Q = ΔU + A.
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики является обобщением опытных фактов. Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. Если между телами, составляющими замкнутую систему, действуют силы трения, то часть механической энергии превращается во внутреннюю энергию тел (нагревание).
При любых физических взаимодействиях энергия не возникает и не исчезает. Она лишь превращается из одной формы в другую. Этот экспериментально установленный факт выражает фундаментальный закон природы – закон сохранения и превращения энергии.
Задачи для самостоятельного решения ( Дмитриева В.Ф. Задачи по физике)
№ 2, стр. 148
Определите p – давление насыщенного водяного пара при температуре Т=290 К, если пло ность насыщенного водяного пара при этой температуре ρ=2,56·10-2 кг/м3 (ответ р=3,43 Па)
№ 12, стр. 149
Определите m – массу стоградусного водяного пара, необходимого для нагревания m1=10 кг воды от t1=100С до t2=600С. (ответ m=0,086 кг)
№ 1, стр. 156
Поверхностное натяжение керосина α=2,4·10-2 Н/м. Какую работу А совершат силы поверхностного натяжения при уменьшении поверхностного слоя керосина на 25 см2? (ответ А=60 мкДж)
№ 7, стр. 156
В одной и той же капиллярной трубке вода поднимается на 50 мм, а спирт на 19 мм. Определите поверхностное натяжение спирта αс. Поверхностное натяжение воды αв=0,072 Н/м (ответ αс=22·10-3 Н/м)
№ 8, стр. 163
Определите Q – теплоту, необходимую для плавления свинца массой m=10 кг, находящегос при температуре плавления. Удельная теплота плавления свинца λ=25 кДж/кг. (ответ Q=250 кДж)