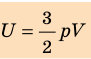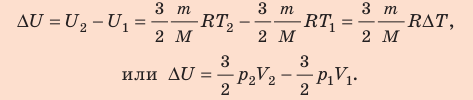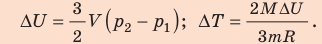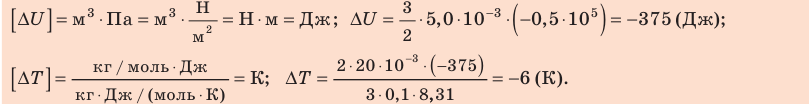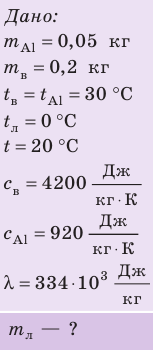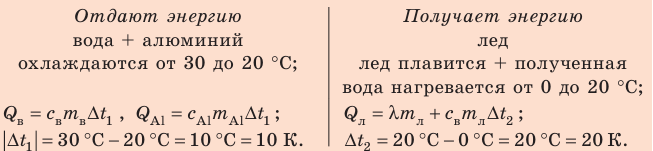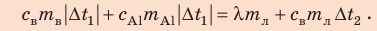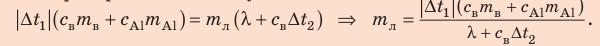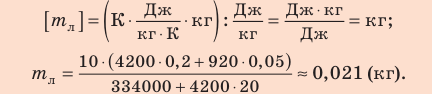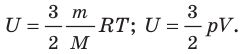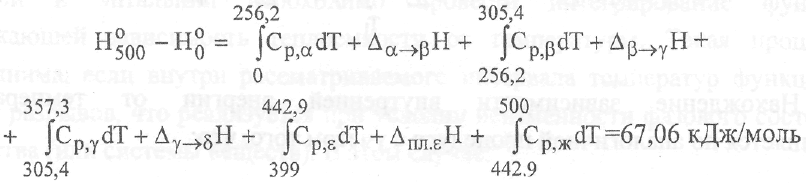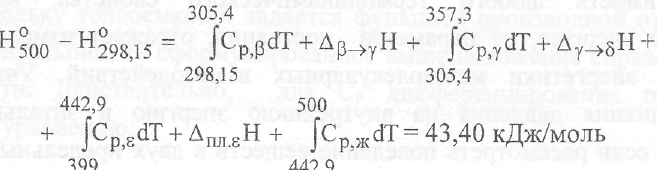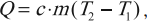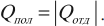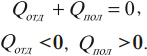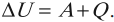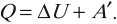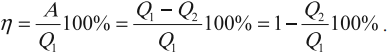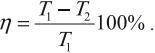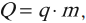Содержание:
Внутренняя энергия:
Вы знаете, что движущееся тело обладает кинетической энергией. А если оно еще и взаимодействует с другим телом, то обладает потенциальной энергией. Оба вида энергии представляют собой механическую энергию. Они взаимно превращаемы: кинетическая энергия может переходить в потенциальную и наоборот. Кроме того, вы знаете, что любое тело имеет дискретную структуру, т. е. состоит из частиц (атомов, молекул). Частицы находятся в непрерывном хаотическом движении. А частицы жидкости и твердого тела еще и взаимодействуют между собой. Следовательно, частицы обладают кинетической, а частицы жидкости и твердых тел — еще и потенциальной энергией. Сумма кинетической и потенциальной энергий всех частиц тела называется внутренней энергией. Внутренняя энергия измеряется в джоулях. Чем отличается внутренняя энергия от механической? В чем ее особенности? Может ли механическая энергия переходить во внутреннюю?
Для ответа на эти вопросы рассмотрим пример. Шайба, двигавшаяся горизонтально по льду (рис. 1), остановилась. Как изменилась ее механическая энергия относительно льда?
Кинетическая энергия шайбы уменьшилась до нуля. Положение шайбы над уровнем льда не изменилось, шайба не деформировалась. Значит, изменение потенциальной энергии равно нулю. Означает ли это, что се механическая (кинетическая) энергия исчезла бесследно? Нет. Механическая энергия шайбы перешла во внутреннюю энергию шайбы и льда.
А может ли внутренняя энергия тела, как механическая, быть равной нулю? Движение частиц, из которых состоит тело, не прекращается даже при самых низких температурах. Значит, тело всегда (подчеркиваем, всегда) обладает некоторым запасом внутренней энергии. Его можно либо увеличить, либо уменьшить — и только!
Велико ли значение внутренней энергии тела? Энергия одной частицы, например кинетическая, в силу незначительности ее массы чрезвычайно мала. Расчеты для средней энергии поступательного движения молекулы кислорода показывают, что ее значение при комнатной температуре
Главные выводы:
- Независимо от того, есть у тела механическая энергия или нет, оно обладает внутренней энергией.
- Внутренняя энергия тела равна сумме кинетической и потенциальной энергий частиц, из которых оно состоит.
- Внутренняя энергия тела всегда не равна нулю.
Способы изменения внутренней энергии
Чтобы изменить механическую энергию тела, надо изменить скорость его движения, взаимодействие с другими телами или взаимодействие частей тела. Вы уже знаете, что это достигается совершением работы.
Как можно изменить (увеличить или уменьшить) внутреннюю энергию тела? Рассуждаем логически. Внутренняя энергия определяется как сумма кинетической и потенциальной энергий частиц. Значит, нужно изменить либо скорость движения частиц, либо их взаимодействие (изменить расстояния между ними). Очевидно, можно изменить и скорость, и расстояния между частицами одновременно. Изменить скорость частиц тела можно, увеличив или уменьшив его температуру. Действительно, наблюдения за диффузией показывают, что быстрота ее протекания увеличивается при нагревании (рис. 4, а, б).
Значит, увеличивается средняя скорость движения частиц, а следовательно, их средняя кинетическая энергия. Отсюда следует важный вывод: температура является мерой средней кинетической энергии частиц.
Как изменить кинетическую энергию частиц тела? Существуют два способа. Рассмотрим их на опытах. Будем натирать колбу с воздухом полоской сукна (рис. 5).
Через некоторое время уровень жидкости в правом колене манометра (см. рис. 5) опустится, т. е. давление воздуха в колбе увеличится. Это говорит о нагревании воздуха. Значит, увеличилась скорость движения и кинетическая энергия его молекул, а следовательно, и внутренняя энергия. Но за счет чего? Очевидно, за счет совершения механической работы при трении сукна о колбу. Нагрелась колба, а от нее — газ.
Проведем еще один опыт. В толстостенный стеклянный сосуд нальем немного воды (чайную ложку для увлажнения воздуха в нем. Насосом (рис. 6) будем накачивать в сосуд воздух. Через несколько качков пробка вылетит, а в сосуде образуется туман. Из наблюдений за окружающей средой мы знаем, что туман появляется тогда, когда после теплого дня наступает холодная ночь. Образование тумана в сосуде свидетельствует об охлаждении воздуха, т. е. об уменьшении его внутренней энергии. Но почему уменьшилась энергия? Потому что за ее счет совершена работа по выталкиванию пробки из сосуда.
Сравним результаты опытов. В обоих случаях изменилась внутренняя энергия газа, но в первом опыте она увеличилась, так как работа совершалась внешней силой (над колбой с газом), а во втором — уменьшилась, ибо работу совершала сила давления самого газа.
А можно ли, совершая работу, изменить потенциальную энергию взаимодействия молекул?
Опять обратимся к опыту. Два куска льда при О °C будем тереть друг о друга (рис. 7).
Лед превращается в воду, при этом температура воды и льда остается постоянной, равной О °C (см. рис. 7). На что тратится механическая работа силы трения?
Конечно же, на изменение внутренней энергии!
Но кинетическая энергия молекул не изменилась, так как температура не изменилась. Лед превратился в воду. При этом изменились силы взаимодействия молекул 
Совершение механической работы — один из способов изменения внутренней энергии тела.
А есть ли возможность изменить внутреннюю энергию тела, не совершая механическую работу?
Да, есть. Нагреть воздух в колбе (рис. 8), расплавить лед (рис. 9) можно с помощью спиртовки, передав и воздуху, и льду теплоту. В обоих случаях внутренняя энергия увеличивается.
При охлаждении тел (если колбы со льдом и воздухом поместить в морозильник) их внутренняя энергия уменьшается. Теплота от тел передается окружающей среде.
Процесс изменения внутренней энергии тела, происходящий без совершения работы, называется теплопередачей (теплообменом).
Таким образом, совершение механической работы и теплопередача — два способа изменения внутренней энергии тела.
Величину, равную изменению внутренней энергии при теплопередаче, называют количеством теплоты (обозначается Q). Единицей количества теплоты, как работы и энергии, в СИ является 1 джоуль.
Для любознательных:
Физики XVIII в. и первой половины XIX в. рассматривали теплоту не как изменение энергии, а как особое вещество — теплород — жидкость (флюид), которая может перетекать от одного тела к другому. Если тело нагревалось, то считалось, что в него вливался теплород, а если охлаждалось — то выливался. При нагревании тела расширяются. Это объяснялось тем, что теплород имеет объем. Но если теплород — вещество, то тела при нагревании должны увеличивать свою массу. Однако взвешивания показывали, что масса тела не менялась. Поэтому теплород считали невесомым. Теорию теплорода поддерживали многие ученые, в том числе и такой гениальный ученый, как Г. Галилей. Позже Дж. Джоуль на основании проведенных им опытов пришел к выводу, что теплород не существует и что теплота есть мера изменения кинетической и потенциальной энергий движущихся частиц тела.
В дальнейшем выражение «сообщить телу количество теплоты» мы будем понимать как «изменить внутреннюю энергию тела без совершения механической работы, т. е. путем теплообмена». А выражение «нагреть тело» будем понимать как «повысить его температуру» любым из двух способов.
Главные выводы:
- Внутреннюю энергию тела можно изменить путем совершения механической работы или теплопередачи (теплообмена).
- Изменение внутренней энергии при нагревании или охлаждении тела при постоянном объеме связано с изменением средней кинетической энергии его частиц.
- Изменение внутренней энергии тела при неизменной температуре связано с изменением потенциальной энергии его частиц.
Основы термодинамики
МКТ стала общепризнанной на рубеже XIX и XX веков. Задолго до ее создания исследованием тепловых процессов занималась термодинамика — раздел физики, изучающий превращение внутренней (тепловой) энергии в другие виды энергии и наоборот, а также количественные соотношения при таких превращениях.
- Заказать решение задач по физике
Внутренняя энергия и ее особенности
Внутренняя энергия макроскопического тела определяется характером движения и взаимодействия всех микрочастиц, из которых состоит тело (система тел). Таким образом, к внутренней энергии следует отнести:
- кинетическую энергию хаотического (теплового) движения частиц вещества (атомов, молекул, ионов);
- потенциальную энергию взаимодействия частиц вещества;
- энергию взаимодействия атомов в молекулах (химическую энергию);
- энергию взаимодействия электронов и ядра в атоме и энергию взаимодействия нуклонов в ядре (внутриатомную и внутриядерную энергии).
Однако для описания тепловых процессов важно не столько значение внутренней энергии, как ее изменение. При тепловых процессах химическая, внутриатомная и внутриядерная энергии практически не изменяются. Именно поэтому внутренняя энергия в термодинамике определяется как сумма кинетических энергий хаотического (теплового) движения частиц вещества (атомов, молекул, ионов), из которых состоит тело, и потенциальных энергий их взаимодействия.
Внутреннюю энергию обозначают символом U.
Единица внутренней энергии в СИ — джоуль: [U]=1 Дж (J).
Особенности внутренней энергии идеального газа
- Атомы и молекулы идеального газа практически не взаимодействуют друг с другом, поэтому внутренняя энергия идеального газа равна кинетической энергии поступательного и вращательного движений его частиц.
- Внутренняя энергия данной массы идеального газа прямо пропорциональна его абсолютной температуре. Докажем данное утверждение для одноатомного газа. Атомы такого газа движутся только поступательно, поэтому, чтобы определить его внутреннюю энергию, следует среднюю кинетическую энергию поступательного движения атомов умножить на количество атомов:
Итак, для одноатомного идеального газа:
. Используя уравнение состояния
, выражение для внутренней энергии идеального одноатомного газа можно представить так:
- Внутренняя энергия — функция состояния системы, то есть она однозначно определяется основными макроскопическими параметрами (p, V, T), характеризующими систему. Независимо от того, каким образом система переведена из одного состояния в другое, изменение внутренней энергии будет одинаковым.
- Внутреннюю энергию можно изменить двумя способами: совершением работы и теплопередачей.
Какие существуют виды теплопередачи
Теплопередача (теплообмен) — процесс изменения внутренней энергии тела или частей тела без совершения работы. Процесс теплопередачи возможен только при наличии разности температур. Самопроизвольно тепло всегда передается от более нагретого тела к менее нагретому. Чем больше разность температур, тем быстрее — при прочих равных условиях — протекает процесс передачи тепла.
| Виды теплопередачи | ||
|---|---|---|
| Теплопроводность | Конвекция | Излучение |
|
Вид теплопередачи, который обусловлен хаотическим движением частиц вещества и не сопровождается переносом этого вещества. Лучшие проводники тепла — металлы, плохо проводят тепло дерево, стекло, кожа, жидкости (за исключением жидких металлов); самые плохие проводники тепла — газы. Передача энергии от горячей воды к батарее отопления, от поверхности воды до ее нижних слоев и т. д. происходит благодаря теплопроводности. |
Вид теплопередачи, при котором тепло переносится потоками жидкости или газа. Теплые потоки жидкости или газа имеют меньшую плотность, поэтому под действием архимедовой силы поднимаются, а холодные потоки — опускаются. Благодаря конвекции происходит циркуляция воздуха в помещении, нагревается жидкость в стоящей на плите кастрюле, существуют ветры и морские течения и т. д. В твердых телах конвекция невозможна. | Вид теплопередачи, при котором энергия передается посредством электромагнитных волн. Излучение — универсальный вид теплопередачи: тела всегда излучают и поглощают инфракрасное (тепловое) излучение. Это единственный вид теплообмена, возможный в вакууме (энергия от Солнца передается только излучением). Лучше излучают и поглощают энергию тела с темной поверхностью. |
Как определить количество теплоты
Количество теплоты Q — это физическая величина, равная энергии, которую тело получает (или отдает) в ходе теплопередачи.
Единица количества теплоты в СИ — джоуль: [П] =1 Дж (J).
Из курса физики 8 класса вы знаете, что количество теплоты, которое поглощается при нагревании вещества (или выделяется при его охлаждении), вычисляют по формуле: Q=cm∆Т=cm∆t , где c — удельная теплоемкость вещества; m — масса вещества; 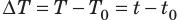
Обратите внимание! Произведение удельной теплоемкости на массу вещества, из которого изготовлено тело, называют теплоемкостью тела: C=cm . Если известна теплоемкость C тела, то количество теплоты, которое получает тело при изменении температуры на ∆T, вычисляют по формуле: Q=C∆T .
| Расчет количества теплоты при фазовых переходах | |
|---|---|
| Кристаллическое состояние ↔ Жидкое состояние | Жидкое состояние ↔ Газообразное состояние |
|
Температуру, при которой происходят фазовые переходы «кристалл → жидкость» и «жидкость → кристалл», называют температурой плавления. Температура плавления зависит от рода вещества и внешнего давления. Количество теплоты Q, которое поглощается при плавлении кристаллического вещества (или выделяется при кристаллизации жидкости), вычисляют по формуле: Q = λm, где m — масса вещества; λ — удельная теплота плавления. |
Фазовые переходы «жидкость → пар» и «пар → жидкость» происходят при любой температуре. Количество теплоты Q, которая поглощается при парообразовании (или выделяется при конденсации), вычисляют по формуле: Q=rm (Q=Lm), где m — масса вещества; r (L) — удельная теплота парообразования при данной температуре (обычно в таблицах представлена удельная теплота парообразования при температуре кипения жидкости). |
| Напомним: и при плавлении, и при кипении температура вещества не изменяется. |
Пример решения задачи №1
Неон массой 100 г находится в колбе объемом 5,0 л. В процессе изохорного охлаждения давление неона уменьшилось с 100 до 50 кПа. На сколько при этом изменились внутренняя энергия и температура неона?
Решение:
Неон — одноатомный газ; для таких газов изменение внутренней энергии равно:
Поскольку охлаждение изохорное, объем неона не изменяется: 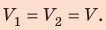
Проверим единицы, найдем значения искомых величин:
Анализ результатов. Знак «–» свидетельствует о том, что внутренняя энергия и температура неона уменьшились, — это соответствует изохорному охлаждению. Ответ: ∆U = –375 Дж; ∆T = –6 К.
Пример решения задачи №2
Внутренний алюминиевый сосуд калориметра имеет массу 50 г и содержит 200 г воды при температуре 30 °С. В сосуд бросили кубики льда при температуре 0 °С, в результате чего температура воды в калориметре снизилась до 20 °С. Определите массу льда. Удельные теплоемкости воды и алюминия: 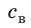
Анализ физической проблемы.
Калориметр имеет такое устройство, что теплообмен с окружающей средой практически отсутствует, поэтому для решения задачи воспользуемся уравнением теплового баланса. В теплообмене участвуют три тела: вода, внутренний сосуд калориметра, лед.
Решение:
Запишем уравнение теплового баланса:
После преобразований получим:
Проверим единицу, найдем значение искомой величины:
Ответ: 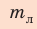
Выводы:
- В термодинамике под внутренней энергией U тела понимают сумму кинетических энергий хаотического движения частиц вещества, из которых состоит тело, и потенциальных энергий их взаимодействия. Внутренняя энергия однозначно определяется основными макроскопическими параметрами (p, V, T), характеризующими термодинамическую систему. Внутреннюю энергию идеального одноатомного газа определяют по формулам:
- Внутреннюю энергию можно изменить двумя способами: совершением работы и теплопередачей. Существует три вида теплопередачи: теплопроводность, конвекция, излучение.
- Физическую величину, равную энергии, которую тело получает или отдает при теплопередаче, называют количеством теплоты (Q): Q=cm∆T = С∆T — количество теплоты, которое поглощается при нагревании тела (или выделяется при его охлаждении); Q = λm — количество теплоты, которое поглощается при плавлении вещества (или выделяется при кристаллизации); Q=rm (Q=Lm) — количество теплоты, которое поглощается при парообразовании вещества (или выделяется при конденсации).
- Теплопроводность в физике
- Конвекция в физике
- Излучение тепла в физике
- Виды излучений в физике
- Машины и механизмы в физике
- Коэффициент полезного действия (КПД) механизмов
- Тепловые явления в физике
- Тепловое движение в физике и его измерение
В
разделе 2.6. уже отмечалось, что по
физическому смыслу Cv
и СР
являются,
соответственно, температурными
коэффициентами внутренней энергии
и энтальпии:
Это
означает, что для нахождения температурной
зависимости внутренней энергии
и энтальпии необходимо провести
интегрирование функции, выражающей
зависимость теплоемкости от температуры.
Такая процедура выполнима, если внутри
рассматриваемого интервала температур
функция не имеет
разрывов, что реализуется при условии
неизменности фазового состояния вещества
(или системы веществ). В этом случае:
42
[p# 47]
Так
как при всех температурах теплоемкость
индивидуальных веществ больше
нуля (нагревание вещества всегда
сопровождается поглощением энергии),
то внутри области существования любой
фазы как внутренняя энергия, так
и энтальпия монотонно возрастают с
температурой.
Если
же в интервале температур (Т2
– Т]) фазовое состояние вещества изменяется,
то уравнения для расчета AU
и АН будут включать слагаемые,
учитывающие
вклад теплоёмкостной составляющей, и
слагаемые, связанные с энергетическими
изменениями, имеющими место при фазовых
превращениях.
В
простейшем случае при наличии одного
фазового перехода I
рода (например,
плавления) изменение энтальпии вычисляется
по уравнению:
*
которое
включает энтальпию плавления и интегралы,
соответствующие изменениям
энтальпии кристаллической фазы при
нагревании от Tj
до Тпл
и жидкой
фазы от Тпл
до Т2.
В
общем же случае, когда внутри интервала
T2-Ti
могут существовать несколько
фаз, следует учесть энтальпии всех
фазовых превращений и взять интегралы,
характеризующие изменение энтальпии
при нагревании каждой из фаз,
существующих в рассматриваемом
температурном интервале:
Нахождение
зависимости внутренней энергии
от температуры выполняется
по аналогичной процедуре с учетом того,
что:
[p# 48]
2.
Энергетика 43
-
[p# 49]
-
для
газов Cv
= Cp-R; -
для конденсированных
фаз: Су~ Ср; -
для
фазовых переходов: Аф.пи
= Лф.пН~рЛфпУ
На
практике интегрирование удобно проводить
графически, представив теплоемкость
как функцию температуры (рис.6) с учетом
разрывов, обусловленных
фазовыми переходами, и аномалий в
окрестностях фазовых переходов II
рода (если, разумеется, такие переходы
происходят).
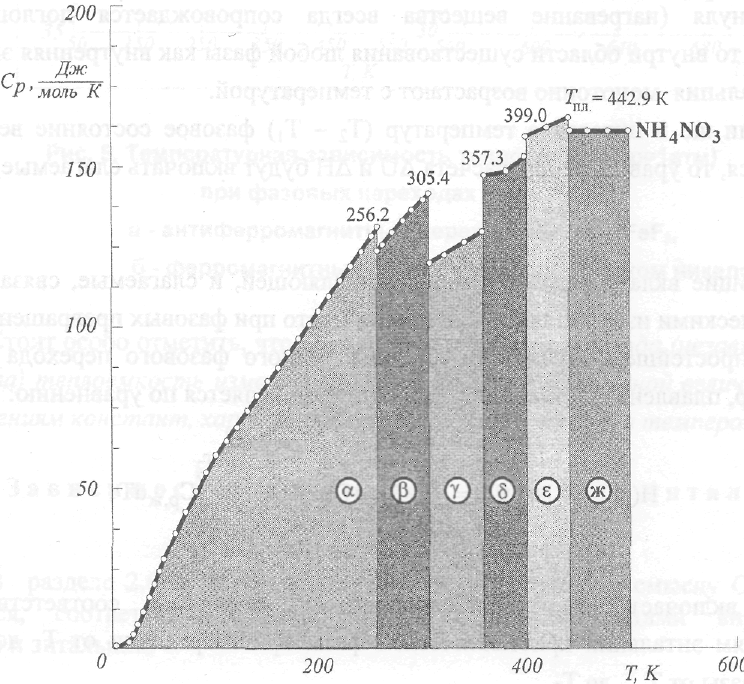
Рис.6.
Интегрирование температурной зависимости
теплоёмкости NH4NO3
(р=1атм)
с целью нахождения высокотемпературных
составляющих энтальпии
в интервалах температур (0 – 500 К) и (298,15
–
500
К )
Уравнение,
выражающее зависимость энтальпии в
интервале 0-500 К, имеет вид:
2. Энергетика
44
[p# 50]
Для
интервала температур 298-500 К оно
не содержит слагаемых, относящихся
к области низких температур:
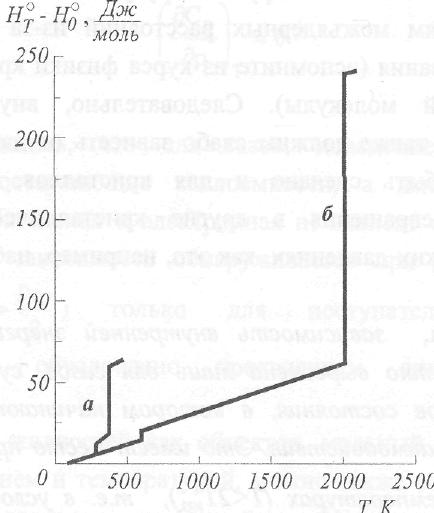
На
рис. 7 приведены температурные
зависимости энтальпии воды и свинца.
Рис.7
Температурная зависимость (р=1атм)
энтальпии воды (а) и свинца (б)
Обратите
внимание, что на шкале ординат
указана не абсолютная энтальпия,
а разность НТ-Щ.
Малое отклонение зависимости H=f(T)
от
линейности,
наблюдаемое для жидкого свинца,
указывает на слабую зависимость
теплоемкости от температуры (наклон
зависимости H=f(T)
равен
теплоемкости).
Можно отметить также, что для фазовых
переходов справедливо неравенство:
АПЛН
«ДпарообрН,
которое выражено тем сильнее, чем
больше
разность между
температурами плавления и кипения.
2. Энергетика
45
[p# 46]
Содержание:
- Изменение внутренней энергии
- Внутренняя энергия тела
- Теплообмен
- Виды теплообмена
- Изменение внутренней энергии при нагревании и охлаждении
- Уравнение теплового баланса при теплообмене
- Подсчет теплоты, выделяемой при сжигании топлива. К. П. Д. нагревателя
- Изменение внутренней энергии при выполнении механической работы
- Закон сохранения и превращения энергии в механике
- Закон сохранения и превращения энергии в механических и тепловых процессах
- Первое начало термодинамики
- Применение первого начала термодинамики к изопроцессам в идеальном газе
- Адиабатный процесс
- Понятие о строении солнца и звезд
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе Q = ΔU · A
На странице -> решение задач по физике собраны решения задач и заданий с решёнными примерами по всем темам физики.
Изменение внутренней энергии
Внутренняя энергия тела – это полная энергия всех молекул, которые его составляют. Внутренняя энергия идеального газа пропорциональна его температуре.
Чтобы изменить внутреннюю энергию вещества, надо сообщить ему некоторое количество тепла или совершить работу.
Внутренняя энергия тела
Под внутренней энергией тела подразумевается сумма кинетической и потенциальной энергий всех частиц тела и энергии ядер его атомов. Возникает вопрос: какая же энергия не входит во внутреннюю энергию тела?
Пусть для примера таким телом является наша Земля. Известно, что Земля притягивается к Солнцу и движется по орбите вокруг него, т. е. обладает по отношению к Солнцу как потенциальной, так и кинетической энергией. Эта энергия не входит во внутреннюю энергию Земли, так как она связана с телом, находящимся вне Земли. Таким образом, во внутреннюю энергию тела не входит кинетическая и потенциальная энергия этого тела относительно всех тех тел, которые находятся вне его. Аналогично во внутреннюю энергию системы тел не входит кинетическая и потенциальная энергия этой системы относительно тех тел, которые не входят в эту систему.
Не менее важным является вопрос о том, как вычислять внутреннюю энергию тела или системы тел. Оказывается, что только для идеального газа имеется соответствующая формула . Во всех других случаях вычислять внутреннюю энергию мы не умеем. Однако для решения практических вопросов существенную роль играет не сама внутренняя энергия, а ее изменение, т. е. разность между ее значениями в начале и в конце того или иного процесса. А для этого не нужно знать числового значения всей внутренней энергии. Это относится не только к внутренней энергии. Примером сказанного может служить и разность температур, которая и по термодинамической шкале и по шкале Цельсия одинакова, т. е. не зависит от числового значения самой температуры, если ее единица не меняется.
Поскольку в молекулярной физике рассматриваются только такие явления, при которых молекулы не изменяются, то можно считать, что в этих явлениях изменяются только молекулярно-кинетическая и молекулярно-потенциальная энергии. Это упрощение значительно облегчает многие расчеты.
На основании закона сохранения энергии можно утверждать, что изменение внутренней энергии тела всегда связано с его взаимодействием с другими телами и с окружающей средой. В некоторых случаях, узнав, какое количество энергии теряют или получают при взаимодействии эти тела и окружающая среда, определяют изменение внутренней энергии тела. В других случаях, наоборот, по изменению внутренней энергии тела определяют, сколько энергии получила окружающая среда и другие взаимодействующие тела.
Одним из важнейших видов обмена энергией между телами и окружающей средой является теплообмен.
Теплообмен
Стоящий на столе горячий чайник через некоторое время остывает. Солнечные лучи летом заметно нагревают поверхность Земли. Металлическая ручка сковороды, стоящей на газовой плите, сильно нагревается. Все это примеры теплообмена. Обмен внутренней энергией между телами и окружающей средой или между частями тела без совершения механической работы называется теплообменом.
Обмен энергией при теплообмене обусловлен множеством актов отдельных взаимодействий между молекулами, иначе говоря, множеством микропроцессов. Например, остывание горячей воды в воздухе объясняется обменом энергией между молекулами воды и воздуха при их столкновениях. При этом нагревание воздуха и остывание воды обусловлено тем, что при большинстве таких столкновений молекулы воды теряют энергию, а молекулы воздуха приобретают ее. Однако при отдельных столкновениях молекулы воздуха могут терять энергию, а молекулы воды — приобретать, так как у некоторых молекул величина энергии может значительно отличаться от ее среднего значения (§3.4). Такие случаи будут происходить тем чаще, чем ближе станут температуры воды и воздуха. А при равенстве их температур случаи увеличения и уменьшения энергии молекул воздуха при столкновениях с молекулами воды будут равновероятны и никакой передачи энергии от воды к воздуху или обратно в целом происходить не будет.
Таким образом, при теплообмене большинство актов молекулярного взаимодействия способствует передаче энергии от тела с большей температурой к телу с меньшей температурой и ведет к выравниванию температур этих тел.
В силу исторических условий изменение внутренней энергии тела при теплообмене часто называют переданным или полученным количеством теплоты 






Подчеркнем, что количество теплоты 
Виды теплообмена
Теплообмен в природе осуществляется с помощью теплопроводности, конвекции и излучения (лучепоглощения и лучеиспускания).
Механизм теплопроводности фактически объяснен в предыдущем параграфе. Приведем еще одни пример. При нагревании конца металлического стержня его молекулы начинают двигаться быстрее, т. е. внутренняя энергия этого конца возрастает. Так как на другом конце стержня молекулы движутся медленнее, то внутри стержня с помощью хаотического движения атомов и электронов происходит передача внутренней энергии от горячего к холодному концу. Передача внутренней энергии от одних частей вещества к другим, обусловленная хаотическим движением молекул и других частиц вещества, называется теплопроводностью.
Среди различных видов вещества наилучшей теплопроводностью обладают металлы. Это объясняется тем, что в них находятся свободные электроны, Отметим еще, что теплопроводность вещества в твердом состоянии больше, чей в жидком, а в жидком больше, чей в газообразном. (Объясните, почему.)
Рассмотрим сущность конвекции. Чтобы показать плохую теплопроводность воды, обычно сосуд с водой нагревают сверху. При этом вверху вода может закипеть, а внизу останется холодной. Однако если сосуд нагревать снизу, то вода нагревается равномерно во всем объеме. Объясняется это тем, что вода при нагревании расширяется и ее плотность уменьшается. Если нагретая вода находится внизу, то верхние, более плотные слои воды под действием силы тяжести опускаются и вытесняют теплую воду вверх. Такое перемешивание воды будет происходить до тех пор, пока вся вода не закипит. Теплообмен, который происходит при перемешивании неравномерно нагретых слоев жидкости или газа под действием силы тяжести, называется конвекцией. Нетрудно сообразить, что в космическом корабле при состоянии невесомости конвекция отсутствует. (Подумайте, почему морозильная камера в холодильниках укрепляется вверху, а не внизу.)
Может показаться, что конвекцию нельзя причислять к теплообмену, так как она связана с работой силы тяжести. Однако при конвекции увеличение внутренней энергии жидкости или газа происходит только за счет подводимого извне тепла, а действие силы тяжести сводится только к ускорению равномерного прогрева жидкости или газа. Дополнительного вклада во внутреннюю энергию жидкости или газа действие силы тяжести при конвекции не дает. Поэтому конвекцию относят к теплообмену.
Теплообмен между Солнцем и Землей осуществляется посредством электромагнитного излучения. Электромагнитное излучение создается’ движением электрических зарядов и резко возрастает при повышении температуры. Излучение тела, которое определяется только его температурой, называется тепловым излучением.
Процесс излучения происходит за счет внутренней энергии тела. Когда излучение поглощается каким-либо другим телом, то внутренняя энергия тела увеличивается за счет энергии поглощенного излучения. Таким образом, посредством излучения происходит передача энергии от более нагретых тел к менее нагретым. Этот вид теплообмена происходит и при отсутствии вещества между телами.
Изменение внутренней энергии при нагревании и охлаждении
Выясним, как можно вычислять изменение внутренней энергии при теплообмене. Чтобы возможно точнее это сделать, нужно свести к минимуму неучтенные потери теплоты при теплообмене. Поэтому при научных исследованиях теплообмен осуществляют в калориметре (рис. 6.1), применение которого позволяет достаточно точно определять теплоту 
Калориметр состоит из двух сосудов: внешнего и внутреннего. Внутренний сосуд делается из хорошего проводника тепла (латуни, меди), так как его температура должна быть такой же, как у налитой в него жидкости. Наружный сосуд предохраняет внутренний сосуд от потерь тепла путем конвекции и излучения. Поэтому его обычно окрашивают белой краской или делают из блестящей жести. Чтобы предохранить внутренний сосуд от потерь тепла путем теплопроводности, его ставят на деревянные подставки (у дерева плохая теплопроводность). Во внутренний сосуд помещают мешалку (из такого же материала, как сосуд) и термометр.
Теплообмен осуществляют следующим образом. С помощью весов определяют массу внутреннего сосуда калориметра и мешалки, а затем и массу налитой в него жидкости, например воды. После этого измеряют массу тела, нагревают его до известной температуры и, заметив начальную температуру жидкости, опускают нагретое тело в калориметр. Измерив конечную температуру жидкости, можно подсчитать, сколько теплоты отдало тело в процессе теплообмена.
С помощью таких опытов легко установить, что изменение внутренней энергии какого-либо тела прямо пропорционально его массе т и изменению температуры тела 
здесь с — коэффициент пропорциональности. Поскольку изменение внутренней энергии при теплообмене оценивается количеством теплоты 
Начальную температуру тела обычно обозначают 



Опыты показывают, что 
Величина с, характеризующая зависимость изменения внутренней энергии тела при нагревании или охлаждении от рода вещества и от внешних условий, называется удельной теплоемкостью вещества. Удельная теплоемкость вещества измеряется количеством теплоты, необходимым для нагревания единицы массы вещества на единицу температуры:
Выведем единицу удельной теплоемкости в СИ:
В СИ за единицу удельной теплоемкости принимается удельная теплоемкость такого вещества, для которого при нагревании массы в 1 кг на 1 К затрачивается 1 Дж энергии. При небольших изменениях температуры удельную теплоемкость можно считать постоянной. Для решения задач ее берут из таблиц.
Следует иметь в виду, что при определении количества теплоты, необходимой для нагревания или выделенной при охлаждении тела, иногда пользуются теплоемкостью тела С — величиной, измеряемой количеством теплоты, необходимым для нагревания тела на единицу температуры. Следовательно,
Пользоваться при расчетах теплоемкостью всего тела особенно удобно, когда отдельные части тела сделаны из разного вещества. В СИ за единицу теплоемкости тела принимается 1 Дж/К. (Покажите это с помощью формулы (6.3).)
Отметим еще, что удельная теплоемкость газа зависит от характера процесса, при котором происходит его нагревание. Например, удельная теплоемкость газа при постоянном давлении 

Уравнение теплового баланса при теплообмене
Вспомним, что при отсутствии механической работы изменение внутренней энергии тела оценивают количеством теплоты 
Теплообмен происходит до тех пор, пока температуры тел не сравняются. Общую температуру, которая получается после окончания теплообмена, обозначают 
Для примера составим уравнение теплового баланса, которое используется при определении удельной теплоемкости вещества с помощью калориметра. Приближенно можно считать, что в этом случае в теплообмене участвуют три тела: калориметр, жидкость и тело, удельную теплоемкость вещества которого определяют. Это тело предварительно нагревают до известной температуры 





Поскольку
имеем
или
Подставляя в правую часть последней формулы числовые значения величин, полученные из опыта, вычисляют удельную теплоемкость вещества тела.
Подсчет теплоты, выделяемой при сжигании топлива. К. П. Д. нагревателя
Внутренняя энергия тела частично может освобождаться, когда с веществом тела происходит химическая реакция. Особенно много теплоты выделяется при реакции горения. Вещества, которые используют для получения теплоты, называют топливом. Энергию, выделяемую при сгорании топлива, широко используют на производстве, на транспорте и в быту. Топливо бывает твердое, жидкое и газообразное.
Опыт показывает, что количество теплоты 
Теплота 

Величина 
Найдем единицу удельной теплоты сгорания 
Формула (6.4) удобна для вычисления теплоты, выделяемой при сжигании твердого и жидкого топлива. Расход газообразного топлива удобнее выражать не массой, а объемом сгоревшего газа. Поскольку давление газа в газопроводе повышено, газовые счетчики устраиваются так, что они показывают объем израсходованного газа, приведенный к нормальным условиям — 


Здесь 
(Покажите, что в СИ 
Отметим, что потребность в топливе часто выражают в тоннах условного топлива, удельная теплота сгорания которого принята равной 29,3 .106 Дж/кг.
Топливо сжигают в печах, топках, форсунках и т. д., которые условно называют нагревателями. Тип устройства для сжигания топлива в основном определяется видом топлива и назначением выделенной теплоты. Полностью использовать теплоту, выделяющуюся в нагревателях, не удается, так как часть теплоты уносится с продуктами сгорания и рассеивается в окружающей среде.
Величина 

Отметим, что величина 

Изменение внутренней энергии при выполнении механической работы
Опыт Джоуля. Внутренняя энергия может изменяться не только при теплообмене, но и при выполнении механической работы. Например, при пилке дров происходит нагревание пилы. При сверлении механической детали сверло и деталь сильно нагреваются. Резец токарного станка при обработке деталей становится горячим. Такого рода примеров можно привести очень много. Все они показывают, что когда совершается механическая работа А по преодолению трения или разрушению материала, то происходит нагревание тел, т. е. увеличение их внутренней энергии, аналогичное тому, какое происходит при получении этими телами некоторого количества теплоты 
Если с помощью механической работы можно получить неограниченное количество теплоты, то возникает вопрос: существует ли при этом между механической работой и теплотой определенное количественное соотношение? Иначе говоря, всегда ли за счет одинакового количества работы получается одно и то же количество теплоты? Для ответа на этот вопрос английский ученый Д. Джоуль выполнил серию опытов, которые дали утвердительный ответ. Свой первый опыт он произвел в 1843 г.
На рис. 6.2 изображена схема одного из опытов Джоуля. Установка состояла из калориметра с ртутью.
Через калориметр проходила ось, заканчивавшаяся валиком с ручкой. На валик наматывалась нить, к концам которой были прикреплены равные грузы массой т каждый. Рядом с грузами укреплялись линейки, с помощью которых измеряли перемещение грузов. Для усиления трения при движении грузов внутри калориметра делались выступы, а к оси прикреплялись лопасти.
Перед началом опыта с помощью ручки грузы поднимали в верхнее положение и измеряли температуру ртути. Затем ручка освобождалась, и при движении вниз грузы приводили во вращение лопасти внутри калориметра. При этом, вследствие большого трения между лопастями и ртутью, в калориметре выделялось тепло за счет работы, совершаемой при движении грузов на некотором пути h. Поскольку трение в других частях установки было ничтожно малым, можно считать, что в этом опыте увеличение внутренней энергии калориметра равно уменьшению механической энергии грузов в процессе их движения. В то время закон сохранения энергии еще не был твердо установлен, но Джоуль считал, что количество теплоты 

Такого рода опытами Джоулю удалось доказать, что количество теплоты, выделенное при трении, прямо пропорционально произведенной работе.
По современным данным, для нагревания 1 кг воды от 292,5 К до 293,5 К, т. е. на 1 К, требуется 4186,8 Дж энергии. Это означает, что удельная теплоемкость воды
Отметим, что до опытов Джоуля с помощью теплообмена можно было находить только относительные удельные теплоемкости, т. е. узнавать, во сколько раз удельная теплоемкость одного вещества больше удельной теплоемкости другого. При этом удельная теплоемкость воды условно принималась за единицу. Количество теплоты, нужное для нагревания 1 кг воды на 1°С, было названо килокалорией (ккал). Удельная теплоемкость воды выражалась следующим образом:
Таким образом, на основании опытов Джоуля имеем
Из этого соотношения вытекает связь между килокалорией и джоулем:
В XVIII в. для объяснения тепловых явлений пользовались теорией теплорода. Ученые предполагали, что существует особый невесомый вид материи — теплород, количество которого в природе неизменно. Считалось,’ что при охлаждении тела теплород перетекает из тела в окружающую среду, а при нагревании тела в него перетекает теплород из других тел.
Одним из первых выступил против теории теплорода М. В. Ломоносов (1711— 1765 гг.), который объяснял тепловые явления движением невидимых частиц тела. В 1798 г. англичанин Б. Румфорд показал, что при сверлении пушечных стволов теплота может быть получена в неограниченном количестве (за счет механической работы). Эти исследования Румфорда доказали несостоятельность теории теплорода. Не менее важными для опровержения теории теплорода были и исследования французского ученого С. Карно, который создал теорию работы тепловых машин.
Закон сохранения и превращения энергии в механике
Назовем процессы, при которых не происходит превращения механического движения в другие формы движения материи, чисто механическими. Система, в которой происходят чисто механические процессы, называется консервативной. Эта система является идеализированной, так как в ней отсутствуют силы трения и другие сопротивления, приводящие к рассеянию механической энергии, т. е. к ее превращению в другие формы энергии. В консервативной системе может происходить только превращение кинетической энергии в потенциальную и обратно. Работа сил, действующих на тело в консервативной системе, не зависит от формы пути, а определяется только начальным и конечным положением тела. Напомним, что примером такого рода сил является сила тяжести. Из сказанного следует, что в консервативной системе работа силы на замкнутом пути равна нулю.
Для такой системы справедлив закон сохранения энергии в следующей форме: в замкнутой консервативной системе сумма кинетической и потенциальной энергий всех тел, составляющих систему, есть величина постоянная. Если обозначить эту сумму Е, то при отсутствии внешних воздействий на консервативную систему
Например, при свободном падении тела сумма его кинетической и потенциальной энергий остается постоянной.
Вспомним, что единственной мерой передачи механической энергии от одного тела к другому является работа А. Поэтому, если механическая энергия консервативной системы в каком-либо состоянии равна

Напомним еще, что в более широком смысле механическая работа А при любых явлениях природы служит единственной мерой передачи и превращения механического движения в другие формы движения материи и обратно.
Закон сохранения и превращения энергии в механических и тепловых процессах
Было объяснено, что механическая энергия сохраняется только при отсутствии трения’ и других сопротивлений. Действие сил трения ведет к уменьшению механической энергии. Действительно, после выключения двигателя автомобиль постепенно теряет кинетическую энергию и останавливается; скатившись с горы, санки постепенно теряют скорость и т. д. Нетрудно сообразить, что бесследное исчезновение энергии в такого рода случаях является лишь кажущимся: при этом всегда происходит выделение некоторого количества теплоты. Таким образом, при трении и вообще при любом сопротивлении движению происходит превращение механической энергии во внутреннюю энергию.
Как известно, мерой уменьшения механической энергии в подобного рода случаях является работа А, а мерой увеличения внутренней энергии — полученная теплота 

Это означает, что сумма механической и внутренней энергий всех тел, составляющих замкнутую систему, есть величина постоянная. Иначе говоря, суммарное изменение механической и внутренней энергий всех тел замкнутой системы в любом процессе, найденное по выполненной работе и переданной теплоте, равно нулю.
Изучение явлений природы показало, что изменение энергии тела происходит только при выполнении работы и при теплообмене. Следовательно, работа и количество теплоты — единственно возможные формы обмена энергией между телами. Таким образом, переданное телу количество теплоты 
Немецкий врач Р. Майер в 1842 г. обратил внимание на взаимную превращаемость всех форм движения материи друг в друга и пытался распространить принцип сохранения энергии на все явления природы. Однако научно обосновал этот принцип в 1847 г. немецкий ученый Г. Гельмгольц.
Сформулируем теперь закон сохранения и превращения энергии: энергия замкнутой системы никогда не исчезает и не создается из ничего. При всех явлениях внутри системы она только превращается из одного вида в другой или передается от одного тела к другому, не изменяясь количественно.
Закон сохранения энергии является всеобщим законом природы, на котором базируется все современное естествознание. С его помощью проверяются новые теории и оцениваются результаты новых экспериментов. Нарушение этого закона в каких-либо явлениях природы привело бы к полной перестройке всех естественных наук и к изменению нашего миропонимания.
Первое начало термодинамики
Весьма важным способом изучения тепловых процессов служит термодинамический метод. Сущность этого метода заключается в следующем. При выполнении экспериментов измеряют числовые значения макроскопических величин, характеризующих изучаемый процесс. Их часто называют термодинамическими параметрами (§ 5.1). По результатам таких экспериментов находят закономерную связь между параметрами, а затем производят математический анализ этой связи на основе всеобщих законов природы, в справедливости которых нет никаких сомнений. Всеобщие законы природы, на основе которых проводят такой анализ, называют началами термодинамики.
Чтобы успешно проводить анализ связей между параметрами, математические выражения начал термодинамики должны иметь специфический, удобный для такого анализа вид. Поскольку все выводы термодинамики делают на основе экспериментов и незыблемых законов природы, они всегда оказываются верными. Термодинамический метод изучения природы позволяет предсказать ход многих явлений, но не дает наглядной модели, объясняющей физический смысл происходящих явлений. Этот недостаток термодинамического метода восполняет молекулярно-кинетическая теория, которая объясняет многие явления с помощью таких моделей. Таким образом, оба эти важнейших метода исследования явлений дополняют друг друга и совместно помогают нам глубоко осмыслить происходящие процессы.
Первым всеобщим законом природы, на основе которого строится термодинамика, является закон сохранения энергии. Его называют первым началом термодинамики и формулируют следующим образом: подведенное к системе количество теплоты 

Отметим, что система, к которой применима формула (6.9), может состоять из одного тела. Напомним еще, что работа А в (6.9) численно равна энергии, переданной системой окружающим телам в форме механического движения.
Применение первого начала термодинамики к изопроцессам в идеальном газе
Выясним, какой вид принимает формула (6.9) для различных изопроцессов в идеальном газе. Мы уже знаем, что при изохорическом процессе работа газа А равна нулю. Следовательно, формула (6.9) для этого процесса принимает вид
Это означает, что при изохорическом процессе все подведенное к газу количество теплоты идет на увеличение его внутренней энергии.
Для изобарического процесса формула первого начала термодинамики имеет вид (6.9):
Действительно, в этом случае 

При изотермическом процессе температура газа не изменяется. Поэтому на основании формул (5.22)—(5.24) можно утверждать, что в этом случае внутренняя энергия газа остается постоянной, т. е. 
Это означает, что при изотермическом процессе все подведенное к газу количество теплоты идет на выполнение газом работы.
Анализ формулы (6.9) показывает, что с газом может происходить еще один важный процесс, при котором 
Адиабатный процесс
Процесс в какой-либо системе, который происходит без обмена теплом с окружающей средой, называется адиабатным. Так как при таком процессе 
Это означает, что при адиабатном процессе система может выполнять работу над внешними телами только за счет своей внутренней энергии. Наоборот, когда при адиабатном процессе внешние тела совершают работу над системой, то ее внутренняя энергия увеличивается.
Если газ при адиабатном расширении совершает работу над окружающей средой, то его внутренняя энергия уменьшается. Следовательно, в этом случае газ должен охлаждаться. (Подумайте, охладится ли газ, если он будет адиабат-но расширяться в вакуум.) Очевидно, что при адиабатном сжатии газ должен нагреваться. График адиабатного процесса в координатах р и V изображен на рис.6.3.
Он называется адиабатой. Для сравнения на рис. 6.3 изображена одна из изотерм для этой же массы идеального газа. С помощью формулы (4.9): 


В реальных условиях адиабатный процесс осуществить невозможно, так как в природе не существуют идеальные тепловые изоляторы. Однако при хорошей тепловой изоляции процесс в газе может быть близок к адиабатному, особенно если он протекает в течение короткого времени, так как при этом заметного обмена теплотой между газом и окружающей средой не успеет произойти. Поэтому любой газ при быстром сжатии нагревается, а при быстром расширении охлаждается.
Это можно показать на следующем опыте. Возьмем стеклянную бутыль с узким горлом и нальем в нее немного воды. Заткнем бутыль резиновой пробкой, в которой имеется трубка, соединенная с нагнетающим насосом, и будем накачивать в бутыль воздух. При этом вода в бутыли исчезает. Следовательно, температура воздуха в бутыли повысилась. При достаточно большом давлении пробка вылетает и в бутыли появляется туман, что свидетельствует об охлаждении воздуха при расширении.
При быстром несильном сжатии газ может нагреваться очень сильно. Если при этом в газе находятся пары бензина или других горючих веществ, то они воспламеняются. Это явление используют в двигателях Дизеля для зажигания горючей смеси.
Понятие о строении солнца и звезд
Солнце является типичной звездой и представляет собой гигантский газовый шар. По своим физическим характеристикам Солнце — средняя звезда с массой около 2 . 1030 кг и радиусом 7 . 108 м.
Солнце состоит в основном из водорода (~70% по массе) и гелия (~29%). (Водорода по числу атомов в 10 раз больше, чем остальных элементов.) Масса Солнца в 330 ООО раз больше массы Земли, и огромное гравитационное притяжение сильно сжимает эти газы. Вычислив объем солнечного шара, можно подсчитать, что средняя плотность солнечного вещества составляет 1,4 . 103 кг/м3, т. е. больше плотности воды. По направлению к центру давление вышележащих слоев растет и плотность газа увеличивается, достигая в центре Солнца около 1,5 . 105 кг/м3, что более чем в 10 раз превышает плотность свинца.
Солнце излучает в мировое пространство ежесекундно огромное количество энергии. Источником этой энергии являются термоядерные реакции, которые протекают в его недрах. Температура в центре Солнца достигает 13 . 106 К и постепенно уменьшается по мере удаления от центра.
Передача энергии из недр Солнца осуществляется главным образом излучением. Излучение внутренних слоев поглощается вышележащими слоями, которые в свою очередь посредством излучения передают энергию следующим слоям, и так далее, до слоя, излучение которого прорывается, наконец, наружу, в космическое пространство.
Слой, в котором образуется видимое излучение Солнца, называемый фотосферой, мы наблюдаем как солнечный диск. Толщина фотосферы составляет несколько сотен километров, давление — порядка 0,1 атм. Температура внутренних слоев фотосферы около 6000 К и уменьшается до 4500 К в ее внешнем слое. Фотосфера составляет нижний слой атмосферы Солнца. Над ней расположена хромосфера, а самую наружную разреженную часть атмосферы называют короной (рис. 6.4).
Газ в хромосфере и короне очень сильно разрежен: в верхних слоях хромосферы содержится только около 1015 атомов/м3, а в короне — еще на порядок меньше (сравните с атмосферой Земли: 
Теряя энергию на излучение в мировое пространство, газ в фотосфере быстро охлаждается, и в слое, лежащем под фотосферой, происходит вертикальное перемешивание — конвекция. При наблюдении в телескоп видно, что фотосфера состоит из множества гранул — небольших облаков более горячего газа, которые поднимаются из глубины, вытесняя остывший газ, и через несколько минут распадаются, заменяясь новыми. Иногда образуются устойчивые восходящие потоки горячих газов, которые называют факелами. Они видны в виде более ярких областей. Время от времени в фотосфере появляются темные пятна, представляющие собой более холодные области. Кстати, по движению этих пятен было обнаружено вращение Солнца.
Под действием мощных конвективных движений в солнечном веществе возникают механические колебания и образуются волны, похожие на звуковые. По мере распространения этих волн в верхние слои атмосферы, где газ сильно разрежен, амплитуда (размах) колебаний частиц газа увеличивается до нескольких километров и сильно увеличиваются скорости колебательного движения частиц. Однако такие колебания не могут долго сохранять правильный характер, и волнообразные движения протяженных областей газа разбиваются на отдельные мелкие беспорядочно движущиеся массы газа. В результате за счет механической энергии волн сильно возрастает средняя энергия хаотического движения частиц газа, и температура увеличивается в хромосфере до десятков тысяч Кельвинов, а в короне — до 106 К *).
*) См, замечание о кинетической температуре в § 3.10.
Вследствие очень низкой плотности вещества яркость короны в миллион раз меньше, чем фотосферы, и не превышает яркости Луны. Корону удобно наблюдать во время полного солнечного затмения, когда Луна закрывает от нас яркий диск фотосферы. Корона имеет лучистую структуру, причем длина лучей может более чем в десять раз превышать радиус фотосферы.
Кинетическая энергия частиц газа в короне- так велика, что многие из них преодолевают притяжение Солнца и улетают в межпланетное пространство. Поток этих частиц, движущихся со скоростью в сотни км/с, называют солнечным ветром. Заметим, что солнечный ветер, а также давление света вызывают образование «хвоста кометы», который всегда направлен в сторону от Солнца.
Услуги по физике:
- Заказать физику
- Заказать контрольную работу по физике
- Помощь по физике
Лекции по физике:
- Физические величины и их измерение
- Основные законы механики
- Прямолинейное равномерное движение
- Прямолинейное равнопеременное движение
- Сила
- Масса
- Взаимодействия тел
- Механическая энергия
- Импульс
- Вращение твердого тела
- Криволинейное движение тел
- Колебания
- Колебания и волны
- Механические колебания и волны
- Бегущая волна
- Стоячие волны
- Акустика
- Звук
- Звук и ультразвук
- Движение жидкости и газа
- Молекулярно-кинетическая теория
- Молекулярно-кинетическая теория строения вещества
- Молекулярно – кинетическая теория газообразного состояния вещества
- Теплота и работа
- Температура и теплота
- Термодинамические процессы
- Идеальный газ
- Уравнение состояния идеального газа
- Переход вещества из жидкого состояния в газообразное и обратно
- Кипение, свойства паров, критическое состояние вещества
- Водяной пар в атмосфере
- Плавление и кристаллизация
- Тепловое расширение тел
- Энтропия
- Процессы перехода из одного агрегатного состояния в другое
- Тепловое расширение твердых и жидких тел
- Свойства газов
- Свойства жидкостей
- Свойства твёрдых тел
- Изменение агрегатного состояния вещества
- Тепловые двигатели
- Электрическое поле
- Постоянный ток
- Переменный ток
- Магнитное поле
- Электромагнитное поле
- Электромагнитное излучение
- Электрический заряд (Закон Кулона)
- Электрический ток в металлах
- Электрический ток в электролитах
- Электрический ток в газах и в вакууме
- Электрический ток в полупроводниках
- Электромагнитная индукция
- Работа, мощность и тепловое действие электрического тока
- Термоэлектрические явления
- Распространение электромагнитных волн
- Интерференционные явления
- Рассеяние
- Дифракция рентгеновских лучей на кристалле
- Двойное лучепреломление
- Магнитное поле и электромагнитная индукция
- Электромагнитные колебания и волны
- Природа света
- Распространение света
- Отражение и преломление света
- Оптические приборы и зрение
- Волновые свойства света
- Действия света
- Линзы и получение изображений с помощью линз
- Оптические приборы и глаз
- Фотометрия
- Излучение и спектры
- Квантовые свойства излучения
- Специальная теория относительности в физике
- Теория относительности
- Квантовая теория и природа поля
- Строение и свойства вещества
- Физика атомного ядра
- Строение атома
Термодинамика
Термодинамика – это раздел физики, изучающий тепловые свойства макроскопических тел и систем тел, находящихся в состоянии теплового равновесия, на основе закона сохранения энергии, без учета внутреннего строения тел, составляющих систему.
Термодинамика не рассматривает микроскопические величины – размеры атомов и молекул, их массы и количество.
Законы термодинамики устанавливают связи между непосредственно наблюдаемыми физическими величинами, характеризующими состояние системы, такими как давление ( p ), объем ( V ), температура ( T ).
Содержание
- Внутренняя энергия
- Тепловое равновесие
- Теплопередача
- Количество теплоты. Удельная теплоемкость вещества
- Работа в термодинамике
- Уравнение теплового баланса
- Первый закон термодинамики
- Второй закон термодинамики
- КПД тепловой машины
- Принципы действия тепловых машин
- Проблемы энергетики и охрана окружающей среды
Внутренняя энергия
Внутренняя энергия – это физическая величина, равная сумме кинетической энергии теплового движения частиц тела и потенциальной энергии их взаимодействия друг с другом.
Обозначение – ( U ), в СИ единица измерения – Джоуль (Дж).
В термодинамике внутренняя энергия зависит от температуры и объема тела.
Внутренняя энергия тел зависит от их температуры, массы и агрегатного состояния. С ростом температуры внутренняя энергия увеличивается. Наибольшая внутренняя энергия у вещества в газообразном состоянии, наименьшая – в твердом.
Внутренняя энергия идеального газа представляет собой только кинетическую энергию теплового движения его частиц; потенциальная энергия взаимодействия частиц равна нулю.
Внутренняя энергия идеального газа прямо пропорциональна его температуре, а от объема не зависит (молекулы идеального газа не взаимодействуют друг с другом):
где ( i ) – коэффициент, равный числу степеней свободы молекулы, ( nu ) – количество вещества, ( R ) – универсальная газовая постоянная, ( T ) – абсолютная температура.
Число степеней свободы равно числу возможных движений частицы.
Важно!
Для одноатомных газов коэффициент ( i ) = 3, для двухатомных газов ( i ) = 5.
На практике часто важно уметь находить изменение внутренней энергии:
При решении задач можно записать формулу для вычисления внутренней энергии, используя уравнение Менделеева–Клапейрона:
где ( p ) – давление, ( V ) – объем газа.
Внутренняя энергия реальных газов зависит как от температуры, так и от объема.
Изменить внутреннюю энергию можно за счет изменения температуры (при теплопередаче) и за счет изменения давления и объема (при совершении работы).
Тепловое равновесие
Тепловое равновесие – это состояние системы, при котором все ее макроскопические параметры остаются неизменными сколь угодно долго.
Величины, характеризующие состояние макроскопических тел без учета их молекулярного строения, называются макроскопическими параметрами. К ним относятся давление и температура, объем, масса, концентрация отдельных компонентов смеси газа и др. В состоянии теплового равновесия отсутствует теплообмен с окружающими телами, отсутствуют переходы вещества из одного агрегатного состояния в другое, не меняются температура, давление, объем.
Любая термодинамическая система переходит самопроизвольно в состояние теплового равновесия. Каждому состоянию теплового равновесия, в которых может находиться термодинамическая система, соответствует определенная температура.
Важно!
В состоянии теплового равновесия объем, давление могут быть различными в разных частях термодинамической системы, и только температура во всех частях термодинамической системы, находящейся в состоянии теплового равновесия, является одинаковой. Микроскопические процессы внутри тела не прекращаются и при тепловом равновесии: меняются положения молекул, их скорости при столкновениях.
Теплопередача
Теплопередача – процесс изменения внутренней энергии тела без совершения работы.
Существуют три вида теплопередачи: теплопроводность, конвекция и излучение (лучистый теплообмен). Теплопередача происходит между телами, имеющими разную температуру. Тепло передается от тела с более высокой температурой к телу с более низкой температурой.
Теплопроводность – это процесс переноса энергии от более нагретых тел (частей тела) к менее нагретым в результате движения и взаимодействия частиц тела. Высокую теплопроводность имеют металлы – так, лучшие проводники тепла – медь, золото, серебро. Теплопроводность жидкостей меньше, а газы являются плохими проводниками тепла. Пористые тела плохо проводят тепло, так как в порах содержится воздух. Вещества с низкой теплопроводностью используют в качестве теплоизоляторов. Теплопроводность невозможна в вакууме. При теплопроводности не происходит переноса вещества.
Явление теплопроводности газов аналогично явлению диффузии. Быстрые молекулы из слоя с более высокой температурой перемещаются в более холодный слой, а молекулы из холодного слоя перемещаются в более нагретый. За счет этого средняя кинетическая энергия молекул более теплого слоя уменьшается, и его температура становится ниже.
В жидкостях и твердых телах при повышении температуры какого-либо участка твердого тела или жидкости его частицы начинают колебаться сильнее. Соударяясь с соседними частицами, где температура ниже, эти частицы передают им часть своей энергии, и температура этого участка возрастает.
Конвекция – перенос энергии потоками жидкости или газа.
Объяснить механизм конвекции можно на основе теплового расширения тел и закона Архимеда. При нагревании объем жидкости увеличивается, а плотность уменьшается. Нагретый слой под действием силы Архимеда поднимается вверх, а холодный опускается вниз. Это естественная конвекция. Она возникает при неравномерном нагревании жидкости или газа снизу в поле тяготения.
При вынужденной конвекции перемещение вещества происходит под действием насосов, лопастей вентилятора. Такая конвекция применяется в состоянии невесомости. Интенсивность конвекции зависит от разности температур слоев среды и агрегатного состояния вещества. Конвекционные потоки поднимаются вверх. При конвекции происходит перенос вещества.
В твердых телах конвекция невозможна, так как частицы не могут из-за сильного взаимодействия покидать свои места. В вакууме конвекция также невозможна.
Примером конвективных потоков в природе являются ветры (бризы дневной и ночной, муссоны).
Излучение (лучистый теплообмен) – перенос энергии электромагнитными волнами. Перенос тепла излучением возможен в вакууме. Источником излучения является любое тело, температура которого отлична от нуля К. При поглощении энергия теплового излучения переходит во внутреннюю энергию. Темные тела быстрее нагреваются излучением, чем тела с блестящей поверхностью, но и остывают быстрее. Мощность излучения зависит от температуры тела. С увеличением температуры тела энергия излучения увеличивается. Чем больше площадь поверхности тела, тем интенсивнее излучение.
Количество теплоты. Удельная теплоемкость вещества
Количество теплоты – это скалярная физическая величина, равная энергии, которую тело получило или отдало при теплопередаче.
Обозначение – ( Q ), в СИ единица измерения – Дж.
Удельная теплоемкость – это скалярная физическая величина, численно равная количеству теплоты, которое тело массой 1 кг получает или отдает при изменении его температуры на 1 К.
Обозначение – ( c ), в СИ единица измерения – Дж/(кг·К).
Удельная теплоемкость определяется не только свойствами вещества, но и тем, в каком процессе осуществляется теплопередача. Поэтому выделяют удельную теплоемкость газа при постоянном давлении – ( c_P ) и удельную теплоемкость газа при постоянном объеме – ( c_V ). Для нагревания газа на 1 К при постоянном давлении требуется большее количество теплоты, чем при постоянном объеме – ( c_P > c_V ).
Формула для вычисления количества теплоты, которое получает тело при нагревании или отдает при охлаждении:
где ( m ) – масса тела, ( c ) – удельная теплоемкость, ( T_2 ) – конечная температура тела, ( T_1 ) – начальная температура тела.
Важно!
При решении задач на расчет количества теплоты при нагревании или охлаждении можно не переводить температуру в кельвины. Так как 1К=1°С, то( Delta T=Delta t ).
Работа в термодинамике
Работа в термодинамике равна изменению внутренней энергии тела.
Обозначение работы газа – ( A’ ), единица измерения в СИ – джоуль (Дж). Обозначение работы внешних сил над газом – ( A ).
Работа газа ( A’ =-A ).
Работой расширения идеального газа называют работу, которую газ совершает против внешнего давления.
Работа газа положительна при расширении и отрицательна при его сжатии. Если объем газа не изменяется (изохорный процесс), то работы газ не совершает.
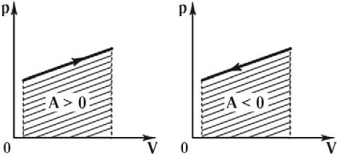
Графически работа газа может быть вычислена как площадь фигуры под графиком зависимости давления от объема в координатных осях ( (p,V) ), ограниченная графиком, осью ( V ) и перпендикулярами, проведенными из точек начального и конечного значений объема.
Формула для вычисления работы газа:
в изобарном процессе ( A’=pcdotDelta V. )
в изотермическом процессе ( A’=frac{m}{M}RTlnfrac{V_2}{V_1}. )
Уравнение теплового баланса
Если система тел является теплоизолированной, то ее внутренняя энергия не будет изменяться несмотря на изменения, происходящие внутри системы. Если ( A ) = 0, ( Q ) = 0, то и ( Delta U ) = 0 .
При любых процессах, происходящих в теплоизолированной системе, ее внутренняя энергия не изменяется (закон сохранения внутренней энергии).
Рассмотрим теплоизолированную систему из двух тел с разными температурами. При контакте между ними будет проходить теплообмен. Тело с большей температурой будет отдавать некоторое количество теплоты, а тело с меньшей температурой – получать, пока температуры тел не станут равными. Так как суммарная внутренняя энергия не должна изменяться, то, на сколько уменьшится внутренняя энергия более нагретого тела, на столько должна увеличиться внутренняя энергия второго тела. Так как работа не совершается, то изменение внутренней энергии равно количеству теплоты.
Количество теплоты, отданное при теплообмене телом с большей температурой, равно по модулю количеству теплоты, полученному телом с меньшей температурой:
Другая формулировка: если тела образуют замкнутую систему и между ними происходит только теплообмен, то алгебраическая сумма отданных ( Q_{отд} ) и полученных ( Q_{пол} ) количеств теплоты равна нулю:
Первый закон термодинамики
Закон сохранения и превращения энергии, распространенный на тепловые явления, называется первым законом (началом) термодинамики.
Можно дать формулировку этого закона исходя из способов изменения внутренней энергии.
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
Если рассматривать работу самой системы над внешними телами, то закон может быть сформулирован так:
количество теплоты, переданное системе, идет на изменение ее внутренней энергии и совершение системой работы над внешними телами:
Если система изолирована и над ней не совершается работа и нет теплообмена с внешними телами, то в этом случае внутренняя энергия не изменяется. Если к системе не поступает теплота, то работа системой может совершаться только за счет уменьшения внутренней энергии. Это значит, что невозможно создать вечный двигатель – устройство, способное совершать работу без каких-либо затрат топлива.
Первый закон термодинамики для изопроцессов
Изотермический процесс: ( Q=A’,(T=const, Delta U=0) )
Физический смысл: все переданное газу тепло идет на совершение работы.
Изобарный процесс: ( Q=Delta U+A’ )
Физический смысл: подводимое к газу тепло идет на увеличение его внутренней энергии и на совершение газом работы.
Изохорный процесс: ( Q=Delta U,(V=const, A’=0) )
Физический смысл: внутренняя энергия газа увеличивается за счет подводимого тепла.
Адиабатный процесс: ( Delta U=-A’ ) или ( A=Delta U,mathbf{(Q=0)} )
Физический смысл: внутренняя энергия газа уменьшается за счет совершения газом работы. Температура газа при этом понижается.
Задачи об изменении внутренней энергии тел
Такие задачи можно разделить на группы:
- При взаимодействии тел изменяется их внутренняя энергия без совершения работы над внешней средой.
- Рассматриваются явления, связанные с превращением одного вида энергии в другой при взаимодействии двух тел. В результате происходит изменение внутренней энергии одного тела вследствие совершенной им или над ним работы.
При решении задач первой группы:
- установить, у каких тел внутренняя энергия уменьшается, а у каких – возрастает;
- составить уравнение теплового баланса ( (Delta U=0) ), при записи которого в выражении ( Q =cm(t_2 – t_1) ) для изменения внутренней энергии нужно вычитать из конечной температуры тела начальную и суммировать члены с учетом получающегося знака;
- решить полученное уравнение относительно искомой величины;
- проверить решение.
При решении задач второй группы:
- убедиться, что в процессе взаимодействия тел теплота извне к ним не подводится, т.е. действительно ли ( Q = 0 );
- установить, у какого из двух взаимодействующих тел изменяется внутренняя энергия и что является причиной этого изменения – работа, совершенная самим телом, или работа, совершенная над телом;
- записать уравнение ( Q = Delta U + A ) для тела, у которого изменяется внутренняя энергия, учитывая знак перед работой и КПД рассматриваемого процесса;
- если работа совершается за счет уменьшения внутренней энергии одного из тел, то ( А= -Delta U ), а если внутренняя энергия тела увеличивается за счет работы, совершенной над телом, то ( A=Delta U );
- найти выражения для ( Delta U ) и ( A );
- подставить в исходное уравнение вместо ( Delta U ) и ( A ) выражения для них, получить окончательное соотношение для определения искомой величины;
- решить полученное уравнение относительно искомой величины;
- проверить решение.
Второй закон термодинамики
Все процессы в природе протекают только в одном направлении. В обратном направлении самопроизвольно они протекать не могут. Необратимым называется процесс, обратный которому может протекать только как составляющая более сложного процесса.
Примеры необратимых процессов:
- переход тепла от более нагретого тела к менее нагретому телу;
- переход механической энергии во внутреннюю энергию.
Первый закон термодинамики ничего не говорит о направлении процессов в природе.
Второй закон термодинамики выражает необратимость процессов, происходящих в природе. Существует несколько его формулировок.
Второй закон термодинамики (формулировка Клаузиуса):
невозможно перевести тепло от более холодной системы к более горячей при отсутствии одновременных изменений в обеих системах или окружающих телах.
Второй закон термодинамики (формулировка Кельвина):
невозможно осуществить такой периодический процесс, единственным результатом которого было бы получение работы за счет теплоты, взятой от одного источника.
Эта формулировка говорит также и о том, что невозможно построить вечный двигатель второго рода, то есть двигатель, совершающий работу за счет охлаждения какого-либо одного тела.
Важно!
В формулировке второго закона термодинамики большое значение имеют слова «единственным результатом». Если процессы, о которых идет речь, не являются единственными, то запреты снимаются. Например, в холодильнике происходит передача тепла от более холодного тела к нагретому и при этом осуществляется компенсирующий процесс превращения механической энергии окружающих тел во внутреннюю энергию.
Второй закон термодинамики выполняется для систем с огромным числом частиц. В системах с малым количеством частиц возможны флуктуации – отклонения от равновесия.
КПД тепловой машины
Коэффициентом полезного действия (КПД) тепловой машины (двигателя) называется отношение работы ( A ), совершаемой двигателем за цикл, к количеству теплоты ( Q_1 ), полученному за цикл от нагревателя:
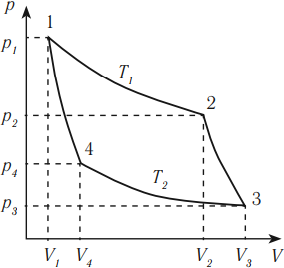
Тепловая машина с максимальным КПД была создана Карно. В машине осуществляется круговой процесс (цикл Карно), при котором после ряда преобразований система возвращается в начальное состояние.
Цикл Карно состоит из четырех стадий:
- Изотермическое расширение (на рисунке — процесс 1–2). В начале процесса рабочее тело имеет температуру ( T_1 ), то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передает ему количество теплоты ( Q_1 ). При этом объем рабочего тела увеличивается.
- Адиабатное расширение (на рисунке — процесс 2–3). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника ( T_2 ).
- Изотермическое сжатие (на рисунке — процесс 3–4). Рабочее тело, имеющее к тому времени температуру ( T_2 ), приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты ( Q_2 ).
- Адиабатное сжатие (на рисунке — процесс 4–1). Рабочее тело отсоединяется от холодильника. При этом его температура увеличивается до температуры нагревателя ( T_1 ).
КПД цикла Карно:
Отсюда видно, что КПД цикла Карно с идеальным газом зависит только от температуры нагревателя ( (T_1) ) и холодильника ( (T_2) ).
Из уравнения следуют выводы:
- для повышения КПД тепловой машины нужно увеличить температуру нагревателя и уменьшить температуру холодильника;
- КПД тепловой машины всегда меньше 1.
Цикл Карно обратим, так как все его составные части являются равновесными процессами.
КПД тепловых двигателей: двигатель внутреннего сгорания — 30%, дизельный двигатель — 40%, паровая турбина — 40%, газовая турбина — 25–30%.
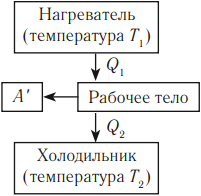
Принципы действия тепловых машин
Тепловым двигателем называют устройство, преобразующее внутреннюю энергию топлива в механическую энергию.
Основные части теплового двигателя:
- Нагреватель – тело с постоянной температурой, преобразующее внутреннюю энергию топлива в энергию газа. В каждом цикле работы двигателя нагреватель передает рабочему телу некоторое количество теплоты.
- Рабочее тело – это газ, совершающий работу при расширении.
- Холодильник – тело с постоянной температурой, которому рабочее тело передает часть тепла.
Любая тепловая машина получает от нагревателя некоторое количество теплоты ( Q_1 ) и передает холодильнику количество теплоты ( Q_2 ). Так как ( Q_1 > Q_2 ), то совершается работа ( A’ = Q_1 – Q_2 ).
Тепловой двигатель должен работать циклически, поэтому расширение рабочего тела должно сменяться его сжатием. Работа расширения газа должна быть больше работы сжатия, совершаемой внешними силами (условие совершения полезной работы). Температура газа при расширении должна быть выше, чем температура при сжатии. Тогда давление газа во всех промежуточных состояниях при сжатии будет меньше, чем при расширении.
В реальных тепловых машинах нагревателем является камера сгорания. В них рабочее тело нагревается за счет тепла, выделяющегося при сгорании топлива. Количество теплоты, выделяющееся при сгорании топлива, вычисляется по формуле:
где ( q ) – удельная теплота сгорания топлива, ( m ) – масса топлива.
Холодильником чаще всего у реальных двигателей служит атмосфера.
Виды тепловых двигателей:
- паровой двигатель;
- турбина (паровая, газовая);
- двигатель внутреннего сгорания (карбюраторный, дизельный);
- реактивный двигатель.
Тепловые двигатели широко используются на всех видах транспорта: на автомобилях – двигатели внутреннего сгорания; на железнодорожном транспорте – дизельные двигатели (на тепловозах); на водном транспорте – турбины; в авиации – турбореактивные и реактивные двигатели. На тепловых и атомных электростанциях тепловые двигатели приводят в движение роторы генераторов переменного тока.
Проблемы энергетики и охрана окружающей среды
Тепловые двигатели широко применяются на транспорте и в энергетике (тепловые и атомные электростанции). Использование тепловых двигателей сильно влияет на состояние биосферы Земли. Можно выделить следующие вредные факторы:
- при сжигании топлива используется кислород из атмосферы, что приводит к снижению содержания кислорода в воздухе;
- при сгорании топлива в атмосферу выделяется углекислый газ. Концентрация углекислого газа в атмосфере повышается. Это изменяет прозрачность атмосферы, так как молекулы углекислого газа поглощают инфракрасное излучение, что ведет к повышению температуры (парниковый эффект);
- при сжигании угля в атмосферу поступают азотные, серные соединения и соединения свинца, вредные для здоровья человека.
Решение проблемы охраны окружающей среды от вредного воздействия предприятий тепловой энергетики требует комплексного подхода. Массовыми загрязнителями при работе тепловых электростанций являются летучая зола, диоксид серы и оксиды азота. Методы сокращения выбросов зависят от свойств топлива и условия его сжижения. Предотвращение загрязнения летучей золой достигается очисткой всего объема продуктов сгорания твердого топлива в высокоэффективных золоуловителях. Сокращение выбросов оксидов азота с продуктами сгорания топлива на тепловых электростанциях, а также в парогазовых и газотурбинных установках обеспечивается, главным образом, технологией сжигания топлива. Уменьшение выброса диоксида серы может быть достигнуто различными методами облагораживания и переработки топлива вне тепловых электростанций либо непосредственно на тепловых электростанциях, а также очисткой дымовых газов.
Контроль за выбросом вредных веществ электростанций осуществляется специальными приборами.
В ряде случаев достаточно эффективным решением вопросов очистки выбросов в атмосферу остается сооружение фильтров-уловителей и дымовых труб. У дымовой трубы два назначения: первое — создавать тягу и тем самым заставлять воздух — обязательный участник процесса горения — в нужном количестве и с должной скоростью входить в топку; второе — отводить продукты горения (вредные газы и имеющиеся в дыме твердые частицы) в верхние слои атмосферы. Благодаря непрерывному турбулентному движению вредные газы и твердые частицы уносятся далеко от источника их возникновения и рассеиваются.
Для рассеивания сернистого ангидрида, содержащегося в дымовых трубах тепловых электростанций, сооружаются дымовые трубы высотой 180, 250 и 320 м. Тепловые электростанции России, работающие на твердом топливе, за год выбрасывают в отвалы около 100 млн т золы и шлаков. Зола и шлаки занимают большие площади земель, неблагоприятно влияют на окружающую среду.
Более половины всех загрязнений создает транспорт. Один из путей решения проблемы защиты окружающей среды заключается в переходе на дизельные двигатели, электродвигатели, повышение КПД.
Алгоритм решения задач раздела «Термодинамика»:
- выделить систему тел и определить ее тип (замкнутая, адиабатически замкнутая, замкнутая в механическом смысле, незамкнутая);
- выяснить, как изменяются параметры состояния ( (p,V,T) ) и внутренняя энергия каждого тела системы при переходе из одного состояния в другое;
- записать уравнения, связывающие параметры двух состояний системы, формулы для расчета изменения внутренней энергии каждого тела системы при переходе из одного состояния в другое;
- определить изменение механической энергии системы и работу внешних сил по изменению ее объема;
- записать формулу первого закона термодинамики или закона сохранения и превращения энергии;
- решить систему уравнений относительно искомой величины;
- проверить решение.
Основные формулы раздела «Термодинамика»
Термодинамика
3 (60.68%) 206 votes
На этой странице вы можете рассчитать внутреннюю энергию идеального газа с помощью калькулятора онлайн или самостоятельно по формулам.
Содержание:
- калькулятор внутренней энергии идеального газа
- внутренняя энергия идеального газа через массу, молярную массу и температуру
- внутренняя энергия идеального газа через давление и объем
- внутренняя энергия идеального газа через количество вещества и температуру
- внутренняя энергия идеального газа через степени свободы
- степени свободы идеальных газов
Формула внутренней энергии идеального газа через массу, молярную массу и температуру
{U = dfrac{3}{2} cdot dfrac{m}{M} cdot R T}
U – внутренняя энергия газа
m – масса газа
M – молярная масса газа
R – универсальная газовая постоянная R = 8,314 462 618 153 24 Дж/(моль∙К)
T – абсолютная температура газа
Формула внутренней энергии идеального газа через давление и объем
{U = dfrac{3}{2} cdot p V}
U – внутренняя энергия газа
p – давление газа
V – объем газа
Формула внутренней энергии идеального газа через количество вещества и температуру
{U = dfrac{3}{2} cdot nu RT}
U – внутренняя энергия газа
ν – количество вещества (в молях)
R – универсальная газовая постоянная R = 8,314 462 618 153 24 Дж/(моль∙К)
T – абсолютная температура газа
Формула внутренней энергии идеального газа через степени свободы
{U = dfrac{i}{2} cdot nu RT}
U – внутренняя энергия газа
i – количество степеней свободы
ν – количество вещества (в молях)
R – универсальная газовая постоянная R = 8,314 462 618 153 24 Дж/(моль∙К)
T – абсолютная температура газа
Количество степеней свободы молекулы идеального газа
Число степеней свободы (i) – наименьшее число независимых координат, которое необходимо ввести, чтобы определить положение тела в пространстве.
- для одноатомного газа (гелий, неон, аргон, криптон, ксенон, радон, оганесон и т. д.) i=3;
- для двухатомного газа (водород, азот, кислород, фтор, хлор и т. д.) i=5;
- для трехатомного газа i=6;
- для многоатомного (>3) газа i=6;
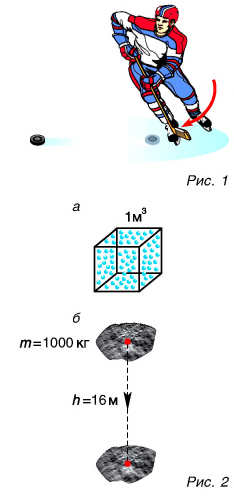
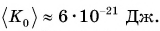
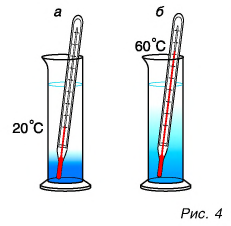
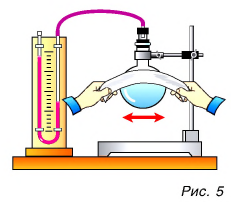
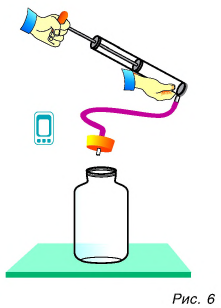
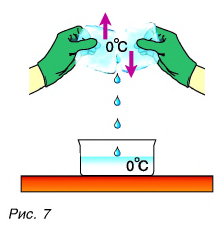
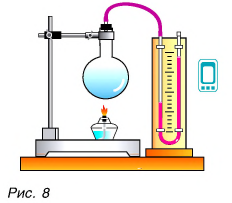
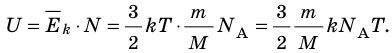 Итак, для одноатомного идеального газа:
Итак, для одноатомного идеального газа: 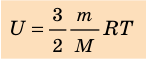 . Используя уравнение состояния
. Используя уравнение состояния 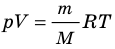 , выражение для внутренней энергии идеального одноатомного газа можно представить так:
, выражение для внутренней энергии идеального одноатомного газа можно представить так: