При
изучении тепловых явлений наряду с
механической энергией тел вводится
новый вид энергии —
внутренняя
энергия. Вычислить внутреннюю энергию
идеального газа не составляет большого
труда.
Наиболее
прост по своим свойствам одноатомный
газ, т. е. газ, состоящий из отдельных
атомов, а не молекул. Одноатомными
являются инертные газы — гелий, неон,
аргон и др. Можно получить одноатомный
(атомарный) водород, кислород и т. д.
Однако такие газы будут неустойчивыми,
так как при столкновениях атомов
образуются молекулы Н2,
О2
и др.
Молекулы
идеального газа не взаимодействуют
друг с другом, кроме моментов
непосредственного столкновения. Поэтому
их средняя потенциальная энергия очень
мала и вся
энергия представляет собой кинетическую
энергию хаотического движения молекул.
Это,
конечно, справедливо, если сосуд с газом
покоится, т. е. газ как целое не движется
(его центр масс находится в покое). В
этом случае упорядоченное движение
отсутствует и механическая энергия
газа равна нулю. Газ обладает энергией,
которую называют внутренней.
Для
вычисления внутренней энергии идеального
одноатомного газа массой т
нужно
умножить среднюю энергию одного атома,
выражаемую формулой (4.5.5), на число
атомов. Это число равно произведению
количества вещества
![]()
на
постоянную Авогадро NA.
Умножая
выражение (4.5.5) на
![]() ,
,
получим
внутреннюю энергию идеального одноатомного
газа:
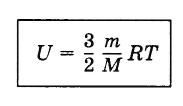
(4.8.1)
Внутренняя
энергия идеального газа прямо
пропорциональна его абсолютной
температуре. От
объема газа она не зависит. Внутренняя
энергия газа представляет собой среднюю
кинетическую энергию всех его атомов.
Если
центр масс газа движется со скоростью
v0,
то
полная энергия газа равна сумме
механической (кинетической) энергии
![]() и внутренней энергииU:
и внутренней энергииU:
![]()
(4.8.2)
Внутренняя энергия молекулярных газов
Внутренняя энергия
одноатомного газа (4.8.1) — это по существу
средняя кинетическая энергия
поступательного движения молекул. В
отличие от атомов молекулы, лишенные
сферической симметрии, могут еще
вращаться. Поэтому наряду с кинетической
энергией поступательного движения
молекулы обладают и кинетической
энергией вращательного движения.
В
классической молекулярно-кинетической
теории атомы и молекулы рассматриваются
как очень маленькие абсолютно твердые
тела. Любое тело в классической механике
характеризуется определенным числом
степеней свободы
f
— числом независимых переменных
(координат), однозначно определяющих
положение тела в пространстве.
Соответственно число независимых
движений, которые тело может совершать,
также равно f.
Атом
можно рассматривать как однородный
шарик с числом степеней свободы f
=
3 (рис. 4.16, а). Атом может совершать только
поступательное движение по трем
независимым взаимно перпендикулярным
направлениям. Двухатомная молекула
обладает осевой симметрией (рис. 4.16, б)
и
имеет пять степеней свободы. Три степени
свободы соответствуют ее поступательному
движению и две — вращательному вокруг
двух осей, перпендикулярных друг другу
и оси симметрии (линии, соединяющей
центры атомов в молекуле). Многоатомная
молекула, подобно, твердому телу
произвольной формы, характеризуется
шестью степенями свободы (рис. 4.16, в);
наряду
с поступательным движением молекула
может совершать вращения вокруг трех
взаимно перпендикулярных осей.
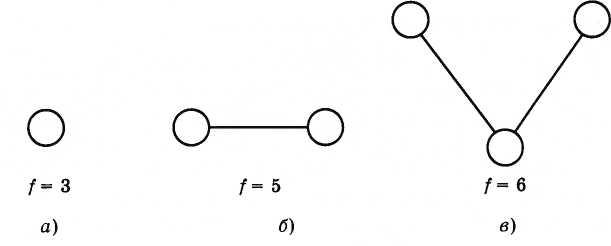
Рис. 4.16
От числа степеней
свободы молекул зависит внутренняя
энергия газа. Вследствие полной
беспорядочности теплового движения ни
один из видов движения молекулы не имеет
преимущества перед другим. На каждую
степень свободы, соответствующую
поступательному или вращательному
движению молекул, приходится одна и та
же средняя кинетическая энергия. В этом
состоит теорема о равномерном распределении
кинетической энергии по степеням свободы
(она строго доказывается в статистической
механике).
Средняя
кинетическая энергия поступательного
движения молекул равна
![]() .
.
Поступательному
движению соответствуют три степени
свободы. Следовательно, средняя
кинетическая энергия
![]() ,
,
приходящаяся на одну степень свободы,
равна:
![]()
(4.8.3)
Если
эту величину умножить на число степеней
свободы и число молекул газа массой т,
то
получится внутренняя энергия произвольного
идеального газа:
![]()
(4.8.4)
Эта
формула отличается от формулы (4.8.1) для
одноатомного газа заменой множителя 3
на множитель f.
Внутренняя
энергия идеального газа прямо
пропорциональна абсолютной температуре
и не зависит от объема газа.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Внутренняя энергия
-
Темы кодификатора ЕГЭ: внутренняя энергия, теплопередача, виды теплопередачи.
-
Внутренняя энергия одноатомного идеального газа
-
Функция состояния
-
Изменение внутренней энергии: совершение работы
-
Изменение внутренней энергии: теплопередача
-
Теплопроводность
-
Конвекция
-
Тепловое излучение
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: внутренняя энергия, теплопередача, виды теплопередачи.
Частицы любого тела — атомы или молекулы — совершают хаотическое непрекращающееся движение (так называемое тепловое движение). Поэтому каждая частица обладает некоторой кинетической энергией.
Кроме того, частицы вещества взаимодействуют друг с другом силами электрического притяжения и отталкивания, а также посредством ядерных сил. Стало быть, вся система частиц данного тела обладает ещё и потенциальной энергией.
Кинетическая энергия теплового движения частиц и потенциальная энергия их взаимодействия вместе образуют новый вид энергии, не сводящийся к механической энергии тела (т.е. кинетической энергии движения тела как целого и потенциальной энергии его взаимодействия с другими телами). Этот вид энергии называется внутренней энергией.
Внутренняя энергия тела — это суммарная кинетическая энергия теплового движения его частиц плюс потенциальная энергия их взаимодействия друг с другом.
Внутренняя энергия термодинамической системы — это сумма внутренних энергий тел, входящих в систему.
Таким образом, внутреннюю энергию тела образуют следующие слагаемые.
1. Кинетическая энергия непрерывного хаотического движения частиц тела.
2. Потенциальная энергия молекул (атомов), обусловленная силами межмолекулярного взаимодействия.
3. Энергия электронов в атомах.
4. Внутриядерная энергия.
В случае простейшей модели вещества — идеального газа — для внутренней энергии можно получить явную формулу.
к оглавлению ▴
Внутренняя энергия одноатомного идеального газа
Потенциальная энергия взаимодействия частиц идеального газа равна нулю (напомним, что в модели идеального газа мы пренебрегаем взаимодействием частиц на расстоянии). Поэтому внутренняя энергия одноатомного идеального газа сводится к суммарной кинетической энергии поступательного (у многоатомного газа приходится ещё учитывать вращение молекул и колебания атомов внутри молекул) движения его атомов. Эту энергию можно найти, умножив число атомов газа на среднюю кинетическую энергию
одного атома:
или
Мы видим, что внутренняя энергия идеального газа (масса и химический состав которого неизменнны) является функцией только его температуры. У реального газа, жидкости или твёрдого тела внутренняя энергия будет зависеть ещё и от объёма — ведь при изменении объёма изменяется взаимное расположение частиц и, как следствие, потенциальная энергия их взаимодействия.
к оглавлению ▴
Функция состояния
Важнейшее свойство внутренней энергии заключается в том, что она является функцией состояния термодинамической системы. А именно, внутренняя энергия однозначно определяется набором макроскопических параметров, характеризующих систему, и не зависит от «предыстории» системы, т.е. от того, в каком состоянии система находилась прежде и каким конкретно образом она оказалась в данном состоянии.
Так, при переходе системы из одного состояния в другое изменение её внутренней энергии определяется лишь начальным и конечным состояниями системы и не зависит от пути перехода из начального состояния в конечное. Если система возвращается в исходное состояние, то изменение её внутренней энергии равно нулю.
Опыт показывает, что существует лишь два способа изменения внутренней энергии тела:
• совершение механической работы;
• теплопередача.
Попросту говоря, нагреть чайник можно только двумя принципиально разными способами: тереть его чем-нибудь или поставить на огонь 🙂 Рассмотрим эти способы подробнее.
к оглавлению ▴
Изменение внутренней энергии: совершение работы
Если работа совершается над телом, то внутренняя энергия тела возрастает.
Например, гвоздь после удара по нему молотком нагревается и немного деформируется. Но температура — это мера средней кинетической энергии частиц тела. Нагревание гвоздя свидетельствует об увеличении кинетической энергии его частиц: в самом деле, частицы разгоняются от удара молотком и от трения гвоздя о доску.
Деформация же есть не что иное, как смещение частиц друг относительно друга; гвоздь после удара испытывает деформацию сжатия, его частицы сближаются, между ними возрастают силы отталкивания, и это приводит к увеличению потенциальной энергии частиц гвоздя.
Итак, внутренняя энергия гвоздя увеличилась. Это явилось результатом совершения над ним работы — работу совершили молоток и сила трения о доску.
Если же работа совершается самим телом, то внутренняя энергия тела уменьшается.
Пусть, например, сжатый воздух в теплоизолированном сосуде под поршнем расширяется и поднимает некий груз, совершая тем самым работу (процесс в теплоизолированном сосуде называется адиабатным. Мы изучим адиабатный процесс при рассмотрении первого закона термодинамики). В ходе такого процесса воздух будет охлаждаться — его молекулы, ударяя вдогонку по движущемуся поршню, отдают ему часть своей кинетической энергии. (Точно так же футболист, останавливая ногой быстро летящий мяч, делает ею движение от мяча и гасит его скорость.) Стало быть, внутренняя энергия воздуха уменьшается.
Воздух, таким образом, совершает работу за счёт своей внутренней энергии: поскольку сосуд теплоизолирован, нет притока энергии к воздуху от каких-либо внешних источников, и черпать энергию для совершения работы воздух может только из собственных запасов.
к оглавлению ▴
Изменение внутренней энергии: теплопередача
Теплопередача — это процесс перехода внутренней энергии от более горячего тела к более холодному, не связанный с совершением механической работы. Теплопередача может осуществляться либо при непосредственном контакте тел, либо через промежуточную среду (и даже через вакуум). Теплопередача называется ещё теплообменом.
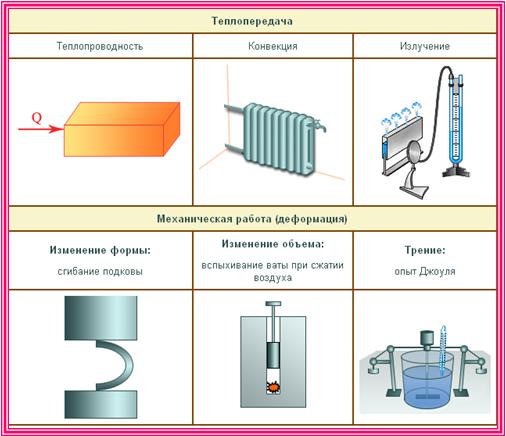
Различают три вида теплопередачи: теплопроводность, конвекция и тепловое излучение.
Сейчас мы рассмотрим их более подробно.
к оглавлению ▴
Теплопроводность
Если железный стержень сунуть одним концом в огонь, то, как мы знаем, долго его в руке не продержишь. Попадая в область высокой температуры, атомы железа начинают колебаться интенсивнее (т.е. приобретают добавочную кинетическую энергию) и наносят более сильные удары по своим соседям.
Кинетическая энергия соседних атомов также возрастает, и теперь уже эти атомы сообщают дополнительную кинетическую энергию своим соседям. Так от участка к участку тепло постепенно распространяется по стержню — от помещённого в огонь конца до нашей руки. Это и есть теплопроводность (рис. 1)(Изображение с сайта educationalelectronicsusa.com).

Рис. 1. Теплопроводность
Теплопроводность — это перенос внутренней энергии от более нагретых участков тела к менее нагретым за счёт теплового движения и взаимодействия частиц тела.
Теплопроводность разных веществ различна. Высокую теплопроводность имеют металлы: лучшими проводниками тепла являются серебро, медь и золото. Теплопроводность жидкостей гораздо меньше. Газы проводят тепло настолько плохо, что относятся уже к теплоизоляторам: молекулы газов из-за больших расстояний между ними слабо взаимодействуют друг с другом. Вот почему, например, в окнах делают двойные рамы: прослойка воздуха препятствует уходу тепла).
Плохими проводниками тепла являются поэтому пористые тела — такие, как кирпич, вата или мех. Они содержат в своих порах воздух. Недаром кирпичные дома считаются самыми тёплыми, а в мороз люди надевают меховые шубы и куртки с прослойкой пуха или синтепона.
Но если воздух так плохо проводит тепло, то почему тогда прогревается от батареи комната?
Происходит это вследствие другого вида теплопередачи — конвекции.
к оглавлению ▴
Конвекция
Конвекция — это перенос внутренней энергии в жидкостях или газах в результате циркуляции потоков и перемешивания вещества.
Воздух вблизи батареи нагревается и расширяется. Действующая на этот воздух сила тяжести остаётся прежней, а выталкивающая сила со стороны окружающего воздуха увеличивается, так что нагретый воздух начинает всплывать к потолку. На его место приходит холодный воздух (тот же процесс, но в куда более грандиозных масштабах, постоянно происходит в природе: именно так возникает ветер), с которым повторяется то же самое.
В результате устанавливается циркуляция воздуха, которая и служит примером конвекции — распространение тепла в комнате осуществляется воздушными потоками.
Совершенно аналогичный процесс можно наблюдать и в жидкости. Когда вы ставите на плиту чайник или кастрюлю с водой, нагревание воды происходит в первую очередь благодаря конвекции (вклад теплопроводности воды тут весьма незначителен).
Конвекционные потоки в воздухе и жидкости показаны на рис. 2 (изображения с сайта physics.arizona.edu).

Рис. 2. Конвекция
В твёрдых телах конвекция отсутствует: силы взаимодействия частиц велики, частицы колеблются вблизи фиксированных пространственных точек (узлов кристаллической решётки), и никакие потоки вещества в таких условиях образоваться не могут.
Для циркуляции конвекционных потоков при отоплении комнаты необходимо, чтобы нагретому воздуху было куда всплывать. Если радиатор установить под потолком, то никакая циркуляция не возникнет — тёплый воздух так под потолком и останется. Именно поэтому нагревательные приборы помещают внизу комнаты. По той же причине чайник ставят на огонь, в результате чего нагретые слои воды, поднимаясь, уступают место более холодным.
Наоборот, кондиционер нужно располагать как можно выше: тогда охлаждённый воздух начнёт опускаться, и на его место будет приходить более тёплый. Циркуляция пойдёт в обратном направлении по сравнению с движением потоков при обогреве комнаты.
к оглавлению ▴
Тепловое излучение
Каким образом Земля получает энергию от Солнца? Теплопроводность и конвекция исключены: нас разделяет 150 миллионов километров безвоздушного пространства.
Здесь работает третий вид теплопередачи — тепловое излучение. Излучение может распространяться как в веществе, так и в вакууме. Как же оно возникает?
Оказывается, электрическое и магнитное поля тесно связаны друг с другом и обладают одним замечательным свойством. Если электрическое поле изменяется со временем, то оно порождает магнитное поле, которое, вообще говоря, также изменяется со временем (подробнее об этом будет рассказано в листке про электромагнитную индукцию). В свою очередь переменное магнитное поле порождает переменное электрическое поле, которое опять порождает переменное магнитное поле, которое опять порождает переменное электрическое поле…
В результате развития этого процесса в пространстве распространяется электромагнитная волна —«зацепленные» друг за друга электрическое и магнитное поля. Как и звук, электромагнитные волны обладают скоростью распространения и частотой — в данном случае это частота, с которой колеблются в волне величины и направления полей. Видимый свет — частный случай электромагнитных волн.
Скорость распространения электромагнитных волн в вакууме огромна: км/с. Так, от Земли до Луны свет идёт чуть больше секунды.
Частотный диапазон электромагнитных волн очень широк. Подробнее о шкале электромагнитных волн мы поговорим в соответствующем листке. Здесь отметим лишь, что видимый свет — это крохотный диапазон данной шкалы. Ниже него лежат частоты инфракрасного излучения, выше — частоты ультрафиолетового излучения.
Вспомним теперь, что атомы, будучи в целом электрически нейтральными, содержат положительно заряженные протоны и отрицательно заряженные электроны. Эти заряженные частицы, совершая вместе с атомами хаотическое движение, создают переменные электрические поля и тем самым излучают электромагнитные волны. Эти волны и называются тепловым излучением — в напоминание о том, что их источником служит тепловое движение частиц вещества.
Источником теплового излучения является любое тело. При этом излучение уносит часть его внутренней энергии. Встретившись с атомами другого тела, излучение разгоняет их своим колеблющимся электрическим полем, и внутренняя энергия этого тела увеличивается. Именно так мы и греемся в солнечных лучах.
При обычных температурах частоты теплового излучения лежат в инфракрасном диапазоне, так что глаз его не воспринимает (мы не видим, как мы «светимся»). При нагревании тела его атомы начинают излучать волны более высоких частот. Железный гвоздь можно раскалить докрасна — довести до такой температуры, что его тепловое излучение выйдет в нижнюю (красную) часть видимого диапазона. А Солнце кажется нам жёлто-белым: температура на поверхности Солнца настолько высока , что в спектре его излучения присутствуют все частоты видимого света, да ещё ультрафиолет, благодаря которому мы загораем.
Давайте ещё раз взглянем на три вида теплопередачи (рис. 3)(изображения с сайта beodom.com).

Рис. 3. Три вида теплопередачи: теплопроводность, конвекция и излучение
Спасибо за то, что пользуйтесь нашими материалами.
Информация на странице «Внутренняя энергия» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена:
08.05.2023
Внутренняя энергия
Тело состоит из молекул и, каждая молекула движется. Значит, она обладает энергией движения. Энергию движения называют кинетической энергией. Чем выше температура, тем быстрее двигаются молекулы, значит, тем больше их кинетическая энергия.
Молекулы могут действовать друг на друга – взаимодействовать. То есть, могут притягиваться к другим молекулам, или отталкиваться от других молекул. Физики говорят, когда есть взаимодействие (притяжение, или отталкивание), есть потенциальная энергия такого взаимодействия. Значит, каждая молекула обладает потенциальной энергией.
Способ подсчета внутренней энергии тел
Найдем внутреннюю энергию тела. Для этого посчитаем кинетическую энергию каждой молекулы. Затем сложим кинетические энергии всех молекул тела, получим суммарную кинетическую энергию.
Точно так же поступим с потенциальной энергией – посчитаем потенциальную энергию каждой молекулы тела и сложим потенциальные энергии всех молекул тела. Получим суммарную потенциальную энергию всех молекул.
Сложив общую кинетическую энергию молекул и общую потенциальную энергию, получим внутреннюю энергию тела.
Внутреннюю энергию тела обозначают символом U и измеряют в Джоулях в честь физика Джеймса Прескотта Джоуля.
[large boxed{ U = E_{text{к всех молекул}} + E_{text{п всех молекул}} }]
Примечание: Внутренняя энергия тела – это сумма кинетической и потенциальной энергии всех молекул этого тела.
(large U left( text{Дж} right) ) – внутренняя энергия тела.
(large E_{text{к всех молекул}} left( text{Дж} right) ) – суммарная энергия движения молекул (кинетическая энергия).
(large E_{text{п всех молекул}} left( text{Дж} right) ) – суммарная энергия притяжения и отталкивания молекул (потенциальная энергия).
Можно ли изменять внутреннюю энергию тел
Внутреннюю энергию тела можно изменять – увеличивать, или уменьшать. Это можно сделать двумя способами: с помощью работы, либо с помощью теплопередачи.
Для того, чтобы увеличить внутреннюю энергию тела, нужно его нагреть (передать ему тепловую энергию), или совершить работу над телом.
А чтобы внутреннюю энергию тела уменьшить, его нужно охладить (отобрать у него тепловую энергию), или сделать так, чтобы тело совершило работу над каким-либо другим телом.
Примечание: Внутренняя энергия тела уменьшается, когда тело совершает работу.

Рис.1. Два способа изменить внутреннюю энергию тела
Читайте подробнее о нескольких способах теплопередачи.
От чего зависит внутренняя энергия тела
Внутренняя энергия тела зависит от:
— температуры тела,
— агрегатного состояния (газообразное, жидкое, твердое),
— некоторых других факторов.
Чем выше температура тела, тем больше его внутренняя энергия.
Математики запишут это так: Внутренняя энергия – это функция температуры. Или сокращенно:
[large boxed{ U = f(T)}]
Символом T обозначена температура тела.
При равных температурах газы обладают наибольшей внутренней энергией. Внутренняя энергия жидкостей меньше, чем у газов. А внутренняя энергия твердых тел ниже, чем энергия жидкостей. Это можно изобразить с помощью рисунка 2:

Рис.2. При переходе из одного агрегатного состояния в другое, внутренняя энергия тела изменяется
Выводы
- Внутренняя энергия – это энергия, скрытая внутри тела;
- Эта энергия является суммарной энергией движения и взаимодействия всех молекул, из которых состоит тело;
- Можно изменять внутреннюю энергию тел двумя способами: либо работой, либо теплопередачей;
- Нагревая тело, повышаем его внутреннюю энергию, а охлаждая – понижаем ее, так как внутренняя энергия зависит от температуры. Математики скажут: Энергия, скрытая внутри тела, является функцией температуры.
- Внутренняя энергия тела зависит и от агрегатного состояния, в котором находится вещество (газообразное, жидкое, твердое), а, так же, от некоторых других факторов;
- Когда тело совершает работу, его внутренняя энергия уменьшается (например, воздух, расширяясь, теряет часть внутренней энергии);
- Когда мы совершаем работу над телом, то мы увеличиваем его внутреннюю энергию.
Оценка статьи:
![]() Загрузка…
Загрузка…
Наука о тепловых явлениях называется термодинамика. Термодинамика исходит из наиболее общих закономерностей тепловых процессов и свойств макроскопических систем.
При изучении основ термодинамики необходимо помнить следующие определения. Физическая система, состоящая из большого числа частиц — атомов или молекул, которые совершают тепловое движение и, взаимодействуя между собой, обмениваются энергиями, называется термодинамической системой.
Состояние термодинамической системы определяется макроскопическими параметрами, например удельным объемом, давлением, температурой.
Термодинамика рассматривает изолированные системы тел, находящиеся в состоянии термодинамического равновесия. Это означает, что в таких системах прекратились все наблюдаемые макроскопические процессы. Важным свойством термодинамически равновесной системы является выравнивание температуры всех ее частей.
Термодинамика рассматривает только равновесные состояния, т.е. состояния, в которых параметры термодинамической системы не меняются со временем.
Если термодинамическая система была подвержена внешнему воздействию, то в конечном итоге она перейдет в другое равновесное состояние. Такой переход называется термодинамическим процессом.
Термодинамическим процессом называется переход системы из начального состояния в конечное через последовательность промежуточных состояний.
Процессы бывают обратимыми и необратимыми.
Обратимым называется такой процесс, при котором возможен обратный переход системы из конечного состояния в начальное через те же промежуточные состояния, чтобы в окружающих телах не произошло никаких изменений. Обратимый процесс является физической абстракцией. Примером процесса, приближающегося к обратимому, является колебание тяжелого маятника на длинном подвесе. В этом случае кинетическая энергия практически полностью превращается в потенциальную, и наоборот. Колебания происходят долго без заметного уменьшения амплитуды ввиду малости сопротивления среды и сил трения.
Любой процесс, сопровождаемый трением или теплопередачей от нагретого тела к холодному, является необратимым. Примером необратимого процесса является расширение газа, даже идеального, в пустоту. Расширяясь, газ не преодолевает сопротивления среды, не совершает работы, но, для того чтобы вновь собрать все молекулы газа в прежний объем, т. е. привести газ в начальное состояние, необходимо затратить работу. Таким образом, все реальные процессы являются необратимыми.
Изменение внутренней энергии газа в процессе теплообмена и совершаемой работы.
Одним из важнейших понятий термодинамики является внутренняя энергия тела. Все макроскопические тела обладают энергией, заключенной внутри самих тел. С точки зрения молекулярно-кинетической теории внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом.
Внутренняя энергия – это сумма энергий молекулярных взаимодействий и энергии теплового движения молекул.
В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема (закон Джоуля).
Молекулярно-кинетическая теория приводит к следующему выражению для внутренней энергии одного моля идеального одноатомного газа (гелий, неон и др.), молекулы которого совершают только поступательное движение:
Поскольку потенциальная энергия взаимодействия молекул зависит от расстояния между ними, в общем случае внутренняя энергия ![]()
U тела зависит наряду с температурой T также и от объема V: U = U(T, V).
Таким образом, внутренняя энергия системы зависит только от её состояния и является однозначной функцией состояния, внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Она не зависит от того, каким путем было реализовано данное состояние.
Внутреннюю энергию тела можно изменить разными способами:
- Совершение механической работы.
- Теплообмен.
Внутренняя энергия тела может изменяться, если действующие на него внешние силы совершают работу (положительную или отрицательную).
Например, газ подвергается сжатию в цилиндре под поршнем площадью S. Поршень, сжимая газ, движется с некоторой скоростью v. Молекулы газа, беспорядочно двигаясь, ударяются о поршень. После упругого удара молекулы о поршень скорость молекулы возрастает, а значит возрастает и её кинетическая энергия, что приводит к увеличению внутренней энергии газа.
При сжатии газа его внутренняя энергия увеличивается за счет совершения поршнем механической работы. При расширении газа его внутренняя энергия уменьшается, превращаясь в механическую энергию поршня.
При сжатии газа внешние силы совершают над газом некоторую положительную работу A’.
В то же время силы давления, действующие со стороны газа на поршень, совершают работу
A = –A’.
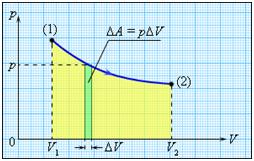
Если объем газа изменился на малую величину ΔV, то газ совершает работу pSΔx = pΔV, где p – давление газа, S – площадь поршня, Δx – его перемещение.
При расширении работа, совершаемая газом, положительна, при сжатии – отрицательна.
В общем случае при переходе из некоторого начального состояния (1) в конечное состояние (2) работа газа выражается формулой:
![]()
или в пределе при ΔVi → 0: 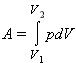
Работа численно равна площади под графиком процесса на диаграмме (p, V):
Величина работы зависит от того, каким путем совершался переход из начального состояния в конечное. На рис. 2 изображены три различных процесса, переводящих газ из состояния (1) в состояние (2). Во всех трех случаях газ совершает различную работу.
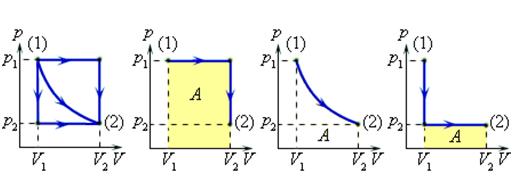
Рисунок 2.
Три различных пути перехода из состояния (1) в состояние (2).
Во всех трех случаях газ совершает разную работу, равную площади под графиком процесса.
Процессы, изображенные на рис. 2, можно провести и в обратном направлении; тогда работа A просто изменит знак на противоположный.
Процессы которые можно проводить в обоих направлениях, называются обратимыми.
В отличие от газа, жидкости и твердые тела мало изменяют свой объем, так что во многих случаях работой, совершаемой при расширении или сжатии, можно пренебречь. Однако, внутренняя энергия жидких и твердых тел также может изменяться в результате совершения работы. При механической обработке деталей (например, при сверлении) они нагреваются. Это означает, что изменяется их внутренняя энергия.
Внутренняя энергия тела может изменяться не только в результате совершаемой работы, но и вследствие теплообмена.
При тепловом контакте тел внутренняя энергия одного из них может увеличиваться, а внутренняя энергия другого – уменьшаться. В этом случае говорят о тепловом потоке от одного тела к другому. Передача энергии от одного тела другому в форме тепла может происходить только при наличии разности температур между ними.
Приведем в соприкосновение два тела с разными температурами. Пусть температура первого тела выше, чем второго. В результате обмена энергиями температура первого тела уменьшается, а второго — увеличивается. В рассматриваемом примере кинетическая энергия хаотического движения молекул первого тела переходит в кинетическую энергию хаотического движения молекул второго тела.
Тепловой поток всегда направлен от горячего тела к холодному.
Процесс передачи внутренней энергии без совершения механической работы называется теплообменом.
Мерой энергии, получаемой или отдаваемой телом в процессе теплообмена, служит физическая величина, называемая количеством теплоты.
Количеством теплоты Q, полученной телом, называют изменение внутренней энергии тела в результате теплообмена.
Количество теплоты Q является энергетической величиной. В СИ количество теплоты измеряется в единицах механической работы – джоулях (Дж).
До введения СИ количество теплоты выражали в калориях.
Калория – это количество теплоты, необходимое для нагревания 1 г дистиллированной воды на 1°С, от 19,5°С до 20,5°С.
Единица, в 1000 раз большая калории, называется килокалорией (1 ккал = 1000 кал). Соотношение между единицами: 1 кал =4,19 Дж.
Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются.
Чтобы нагреть тело массой m от температуры t1 до температуры t2 ему необходимо сообщить количество теплоты
Q = cm(t2 – t1)
Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c.
c = Q / (mΔT).
Во многих случаях удобно использовать молярную теплоемкость C:
C = M · c, где M – молярная масса вещества.
При передаче тепла от одного тела к другому всегда выполняется уравнение теплового баланса, по которому количество теплоты Q1, отданное первым телом, равно количеству теплоты Q2, полученному вторым телом.
Q1 = Q2
Теплота и работа являются не видом энергии, а формой ее передачи, они существуют лишь в процессе передачи энергии.
В реальных условиях оба способа передачи энергии системе в форме работы и форме теплоты обычно сопутствуют друг другу.
Первое начало термодинамики.
На рисунке изображены энергетические потоки между термодинамической системой и окружающими телами. в результате теплообмена и совершаемой работы:
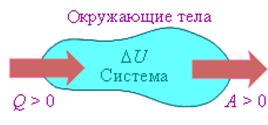
Величина Q > 0, если тепловой поток нправлен в сторону термодинамической системы. Величина A > 0, если система совершает положительную работу над окружающими телами.
Если система обменивается теплом с окружающими телами и совершает работу (положительную или отрицательную), то изменяется состояние системы, то есть изменяются ее макроскопические параметры (температура, давление, объем).
Процессы теплообмена и совершения работы сопровождаются изменением ΔU внутренней энергии системы.
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом:
Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
ΔU = Q – A.
Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме:
Q = ΔU + A.
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики является обобщением опытных фактов. Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. Если между телами, составляющими замкнутую систему, действуют силы трения, то часть механической энергии превращается во внутреннюю энергию тел (нагревание).
При любых физических взаимодействиях энергия не возникает и не исчезает. Она лишь превращается из одной формы в другую. Этот экспериментально установленный факт выражает фундаментальный закон природы – закон сохранения и превращения энергии.
Задачи для самостоятельного решения ( Дмитриева В.Ф. Задачи по физике)
№ 2, стр. 148
Определите p – давление насыщенного водяного пара при температуре Т=290 К, если пло ность насыщенного водяного пара при этой температуре ρ=2,56·10-2 кг/м3 (ответ р=3,43 Па)
№ 12, стр. 149
Определите m – массу стоградусного водяного пара, необходимого для нагревания m1=10 кг воды от t1=100С до t2=600С. (ответ m=0,086 кг)
№ 1, стр. 156
Поверхностное натяжение керосина α=2,4·10-2 Н/м. Какую работу А совершат силы поверхностного натяжения при уменьшении поверхностного слоя керосина на 25 см2? (ответ А=60 мкДж)
№ 7, стр. 156
В одной и той же капиллярной трубке вода поднимается на 50 мм, а спирт на 19 мм. Определите поверхностное натяжение спирта αс. Поверхностное натяжение воды αв=0,072 Н/м (ответ αс=22·10-3 Н/м)
№ 8, стр. 163
Определите Q – теплоту, необходимую для плавления свинца массой m=10 кг, находящегос при температуре плавления. Удельная теплота плавления свинца λ=25 кДж/кг. (ответ Q=250 кДж)
Физическая дисциплина «Термодинамика», имеющая дословный перевод с греческого как θέρμη — «тепло», δύναμις — «сила», занимается изучением общих характеристик макросистем и обращения энергии внутри них. Эту науку относят к феноменологическому типу, хотя опирается она на факты, полученные опытным путем.
Термодинамическая система, рассматриваемая в данном ракурсе, имеет конкретные характеристики, не применимые к единичным атомам и молекулам. К ним относят температуру, энергию, объем, концентрацию растворов, давление.
Определение таких параметров происходит по формулам термодинамики.
Основные формулы термодинамики
Особенностью термодинамики является то, что ее постулаты не касаются взаимодействия отдельных единиц (атомов, молекул), как в молекулярной физике. Предметом изучения предстают общие взаимопревращения энергии, образование теплоты, теплопередача и совершение работы.
Исходя из этого, выделяют основные формулы термодинамики, к которым относятся:
- Уравнение Менделеева-Клайперона: (PV=(m/M)*RT). Его смысл — в изменениях трех входящих величин, которые направлены на характеристику состояния идеального газа.
- Количество вещества, обозначаемое буквой (ν). (nu=N/NA=m/mu)
Величина, выражающая, сколько одинаковых структурных компонентов (единиц) находится в веществе.
- Закон Дальтона: давление смеси газов на стенку сосуда равно сумме давлений каждого входящего в смесь элемента: (p=p1+p2+…pn.)
- Главное уравнение МКТ (молекулярно-кинетической теории): (p=2n/3<varepsilon>n=N/V). Выражает математическое соотношение таких параметров, как давление газа и микропараметров: массы молекул, их скорости движения, концентрации.
- Средняя кинетическая энергия поступательного движения молекулы газа. Для обозначения применяется (E_k), выражается через формулу: (E_k=E_{моля}/NA=3/2ast RT/NA). Ее мерой является абсолютная температура идеального газа, поскольку потенциальная энергия (вследствие взаимодействия молекул друг с другом) равна нулю. Зная, что R/NA=k, получается формула: (E_k=3/2ast kT).
- Давление идеального газа прямо пропорционально концентрации и его температуре: (P=nkT.)
- Скорость молекул определяется по формулам:
(V=surd(2kT/m_o)=surd(2RT/mu)) — наиболее вероятная;
(<V>=surd(8kT/pi m_o)=surd(8RT/pimu)) — среднеарифметическая;
(<Vкв>surd(3kT/m_o)=surd(3RT/mu)) — средняя квадратичная. - Сумма кинетических энергий всех молекул определяет внутреннюю энергию всего идеального газа. Математически выражение выглядит так: (U=i/2ast(m/mu)ast RT.)
- Формула для определения работы, которую совершает идеальный газ при расширении:( A=P(V_2-V_1).)
- Формула первого закона термодинамики: (Q=Delta U+A.)
- Для определения удельной теплоемкости вещества применяется математическое выражение: (С=Delta Q/mdT.)
- Кроме удельной теплоемкости, существует понятие молярной теплоемкости. Для ее определения применяется формула: (C=cmu). Для изохорного процесса правильная формула принимает вид: (C_v=1/2ast R), для изобарного: (C_p=((i+2)/2)ast R).
Первое начало термодинамики
Согласно первому закону термодинамики, (Q) (количество внутренней теплоты), которое получил газ извне, расходуется на совершение работы (А) и изменение внутренней энергии (U). Формула закона: (Q=Delta U+A).
На практике газ может быть нагрет либо охлажден. Однако в данном случае рассматривается изотермический процесс, в котором один из характеризующих параметров остается неизменным.
Если процесс изотермичен, в химии включается закон Бойля-Мариота. В нем говорится, что давление газа соотносится к изначальному объему, при стабильной температуре, обратно пропорционально.
(Q=A)
Когда процесс происходит при неизменном объеме, говорят об изохорности. Здесь вступает в действие закон Шарля. В обозначенных условиях то тепло, которое поступило к газу, расходуется на изменение внутренней энергии. Другими словами, (P) пропорционально (T).
(Q=Delta U)
Протекание процессов в идеальном газе при неизменном давлении носит характер изобарного. Здесь действует закон Гей-Люссака, который выражается уравнением:
(Q=Delta U=pDelta V)
Полная формулировка закона гласит: полученное тепло при изобарном процессе расходуется на совершение работы газом, а также изменяет его внутреннюю энергию.
Часть процессов происходят изолированно от внешней среды. Газ не получает дополнительной энергии. Такая ситуация носит название адиабатной и математически записывается: (Q=0). Работа (А) в таком случае выражается: (A=-Delta U.)
Уравнение идеального газа в термодинамике
Молекулы идеального газа постоянно движутся. От того насколько велика скорость их движения, зависит общее состояние газа, а также величина его воздействия, например, на стенки сосуда. Поэтому одним из основных уравнений термодинамики является Клайперона-Менделеева:
(PV=(m/M)ast RT)
В уравнении (m) — единица массы газа, (M) — его молекулярная масса, (R) — универсальная величина, называемая газовой постоянной. Ее значение = 8,3144598. Измеряется в Дж/(моль*кг).
В основе термодинамики лежат и другие газовые постоянные, например, число Авогадро, постоянная Больцмана. Таким образом, (R=kNA.)
Из уравнения Клайперона-Менделеева можно также вычислить массу. Она будет равна произведению плотности на объем: (m=rho V).
Основное уравнение молекулярно-кинетической теории (МКТ)
Решение части задач зависит от знания особенностей взаимосвязи между давлением газа и характеристикой кинетической энергии его молекул. Математическое выражение такой зависимости носит название основного уравнения МКТ:
(p=2/3ast nE)
В данном выражении кинетическая энергия обозначена буквой (Е), а концентрация молекул — (n). Каждую из этих величин физики можно найти исходя из соответствующих формул, после чего уравнение для молекулярно-кинетической теории (МКТ) приобретает вид:
(p=nkT)
Формула теплоемкости и главная формула КПД в термодинамике
Когда теплообмен проявляется передачей телу определенного количества теплоты, его энергия, как и температура, меняются.
То количество теплоты, обозначаемое (Q), которое понадобится для того, чтобы 1 кг определенного вещества нагреется на 1 К, носит определение теплоемкости вещества и обозначается с.
Математическое выражение относительно переданного количества теплоты выглядит формулой:
(Q=cm(t_2-t_1)=cmDelta t)
Измеряется величина в Дж/(кг∙К).
При t2⟩t1, количество теплоты со знаком плюс, следовательно, вещество нагревается. Если наоборот, то Q — со знаком минус, и вещество остывает.
В физике, характеризуя свойства вещества, говорят о его теплоемкости. Это имеет значение, например, при выборе стройматериалов или сырья для изготовления нагревательных приборов. Теплоемкость равна произведению массы на удельную теплоемкость данного тела:
(C=cm)
Учитывая, что в величине теплоемкости уже отражена масса, то сокращенная формула для определения (Q) выглядит так:
(Q=C(t_2-t_1))
С другой стороны, то количество теплоты, которое отдает источник, можно высчитать по формуле:
(Q=Pt.)
В выражении буквой (P) обозначается мощность нагревателя, а (t) — время их контакта.
Конструкция, состоящая из нагревателя, тела-реципиента теплоты и охладителя, носит название тепловой машины. В качестве примера рассматривается двигатель внутреннего сгорания. Как и любой механизм, она имеет такую характеристику, как КПД — коэффициент полезного действия. Для его расчета применяется формула:
(eta=(Q_н-Q_x)/Q_н)
Внутренняя энергия одноатомного и двухатомного идеального газа
Характерной особенностью идеального газа является отсутствие у его составляющих частей потенциальной энергии. Вся внутренняя энергия — это сумма кинетических энергий всех молекул. Она является величиной, прямо пропорциональной температуре идеального газа:
(mw2/2=alpha T)
В этом уравнении:
(alpha T=3Rmu/2Nmu)
Исходя из приведенных формул, величина кинетической энергии поступательного движения идеального газа должна определяться исходя из выражения:
(mv2/2=(3Rmu/2Nmu)ast T)
Поступательное движение характеризуется тремя степенями свободы. На каждую из них приходится одна треть общей кинетической энергии.
Двух- и более атомные молекулы газа характеризуются степенями свободы, касающимися вращательного движения.
Если обозначить число молекул в одном киломоле за (Nμ), то внутренняя энергия идеального газа будет измеряться по формуле:
(Umu=1/2(Rmu Ti))
В формуле (i) — число степеней свобод.
Если газ одноатомный, (i=3), двуатомный — 5, трех- и более — 6.
Задачи на термодинамику характеризуют распространенные физические процессы, поэтому часть включаются в программы экзаменов. Если для их решения не хватает времени, можно обратиться за помощью в Феникс.Хелп. На профильном сайте вам помогут справиться с любой, даже запутанной задачей, экономя ваши время и силы.
