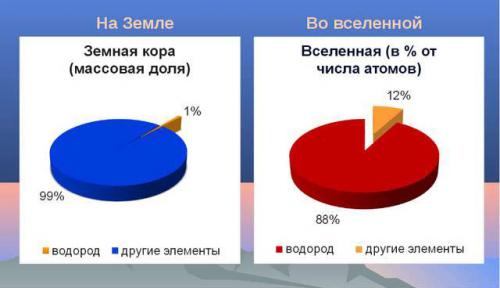
Водород (Н) очень легкий химический элемент, с содержанием в Земной коре 0,9% по массе, а в воде 11,19%.
Характеристика водорода
По легкости он первый среди газов. При нормальных условиях безвкусен, бесцветен, и абсолютно без запаха. При попадании в термосферу улетает в космос из-за малого веса.
Во всей вселенной это самый многочисленный химический элемент (75% от всей массы веществ). Настолько, что многие звезды в космическом пространстве состоят полностью из него. Например, Солнце. Его основной компонент – водород. А тепло и свет это итог выделения энергии при слиянии ядер материала. Так же в космосе есть целые облака из его молекул различной величины, плотности и температуры.
Физические свойства
Высокая температура и давление значительно меняют его качества, но при обычных условиях он:
• обладает высокой теплопроводностью, если сравнивать с другими газами,
• нетоксичен и плохо растворим в воде,
• с плотностью 0,0899 г/л при 0°С и 1 атм.,
• превращается в жидкость при температуре -252,8°С
• становится твердым при -259,1°С.,
• удельная теплота сгорания 120,9•106 Дж/кг.
Для превращения в жидкость или твердое состояние требуются высокое давление и очень низкие температуры. В сжиженном состоянии он текуч и легок.
Химические свойства
Под давлением и при охлаждении (-252,87 гр. С) водород обретает жидкое состояние, которое по весу легче любого аналога. В нем он занимает меньше места, чем в газообразном виде.
Он типичный неметалл. В лабораториях его получают путем взаимодействия металлов (например, цинка или железа) с разбавленными кислотами. При обычных условиях малоактивен и вступает в реакцию только с активными неметаллами. Водород может отделять кислород из оксидов, и восстанавливать металлы из соединений. Он и его смеси образуют водородную связь с некоторыми элементами.
Газ хорошо растворяется в этаноле и во многих металлах, особенно в палладии. Серебро его не растворяет. Водород может окисляться во время сжигания в кислороде или на воздухе, и при взаимодействии с галогенами.
Во время соединения с кислородом, образуется вода. Если температура при этом обычная, то реакция идет медленно, если выше 550°С – со взрывом (превращается в гремучий газ).
Нахождение водорода в природе
Хотя водорода очень много на нашей планете, но в чистом виде его найти нелегко. Немного можно обнаружить при извержении вулканов, во время добычи нефти и в месте разложения органических веществ.
Больше половины всего количества находится в составе с водой. Так же он входит в структуру нефти, различной глины, горючих газов, животных и растений (присутствие в каждой живой клетке 50% по числу атомов).
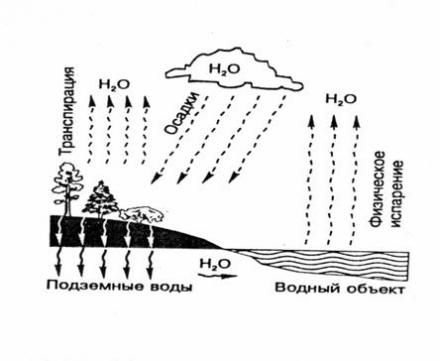
Круговорот водорода в природе
Каждый год в водоемах и почве разлагается колоссальное количество (миллиарды тонн) остатков растений и это разложение выплескивает в атмосферу огромную массу водорода. Так же он выделяется при любом брожении, вызываемом бактериями, сжигании и наравне с кислородом участвует в круговороте воды.
Области применения водорода
Элемент активно используется человечеством в своей деятельности, поэтому мы научились получать его в промышленных масштабах для:
• метеорологии, химпроизводства;
• производства маргарина;
• как горючее для ракет (жидкий водород);
• электроэнергетики для охлаждения электрических генераторов;
• сварки и резки металлов.
Масса водорода используется при производстве синтетического бензина (для улучшения качества топлива низкого качества), аммиака, хлороводорода, спиртов, и других материалов. Атомная энергетика активно использует его изотопы.
Препарат «перекись водорода» широко применяют в металлургии, электронной промышленности, целлюлозно-бумажном производстве, при отбеливании льняных и хлопковых тканей, для изготовления красок для волос и косметики, полимеров и в медицине для обработки ран.
«Взрывной» характер этого газа может стать гибельным оружием – водородной бомбой. Ее взрыв сопровождается выбросом огромного количества радиоактивных веществ и губительно для всего живого.
Соприкосновение жидкого водорода и кожных покровов грозит сильным и болезненным обморожением.
Водород – самый распространенный элемент во вселенной: по современным данным, он составляет примерно 92% от общего числа ее атомов. Водород содержится в газовых туманностях, в межзвездном газе, кометах, входит в состав звезд. В недрах звезд на определенной стадии их эволюции протекают разнообразные термоядерные реакции с участием водорода. Классический пример: превращение ядер атомов водорода в ядра атомов гелия. Для большинства звезд, в том числе и для нашего Солнца, водород служит главным источником энергии. Скорость процесса (число ядер водорода, превращающихся в ядра гелия в одном кубическом метре вещества за единицу времени) мала. Поэтому и количество энергии, выделяющейся за единицу времени в единице объема, мало. Однако, вследствие огромной массы Солнца, общее количество выделяемой энергии огромно. Оно соответствует уменьшению массы Солнца приблизительно на 4 миллиона тонн в секунду!

Водород в Солнечной системе.
Основная масса водорода в Солнечной системе сосредоточена, конечно же, в самом Солнце, а так же в далеких холодных планетах-гигантах: на Юпитере, Сатурне, Уране и Нептуне. В небольших количествах он содержится в атмосфере всех планет и входит в состав минералов и других соединений (аммиак, метан, синильная кислота). Ядра атомов водорода – основа так называемого солнечного ветра. Общее содержание атомов водорода в Солнечной системе составляет 84%.
Водород на Земле.
Общее содержание водорода на Земле составляет всего 0,15% по массе или 3,0% мольных долей. Водород составляет 0,88-1,0% массы земной коры, считая воду и воздух. Его содержание в атмосфере планеты 5·10-5 % по объему. По распространенности на Земле этот элемент занимает 9-е место. В свободном состоянии встречается сравнительно редко – содержится в нефтяных, горячих и вулканических газах, присутствует в виде включений в некоторых минералах. Некоторое количество водорода появляется постоянно в атмосфере в результате разложения органических веществ микроорганизмами (процессы гниения), но затем водород быстро поднимается в стратосферу благодаря своей легкости. По этой же причине постоянно покидает атмосферу Земли.
Большая часть водорода связана в форме воды, глин и углеводородов; последние составляют основу нефти и входят составной частью в природные горючие газы. Водород в составе воды и органических соединений входит в состав всех растительных и животных организмов. Также водород содержится в буром и каменном угле, входит в состав целого ряда минералов (в виде кристаллизационной воды, например, KCl·MgCl2·6H2O).
| Водород | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ← Нейтроний | Гелий → | ||||||||||||||||||||
|
||||||||||||||||||||
| Внешний вид простого вещества | ||||||||||||||||||||

Свечение водорода в газоразрядной трубке |
||||||||||||||||||||
| Свойства атома | ||||||||||||||||||||
| Название, символ, номер | Водоро́д / Hydrogenium (H), 1 | |||||||||||||||||||
| Группа, период, блок |
1, 1, s-элемент |
|||||||||||||||||||
| Атомная масса (молярная масса) |
[1,00784; 1,00811][комм 1][1] а. е. м. (г/моль) | |||||||||||||||||||
| Электронная конфигурация | 1s1 | |||||||||||||||||||
| Радиус атома | 53 пм | |||||||||||||||||||
| Химические свойства | ||||||||||||||||||||
| Ковалентный радиус | 32 пм | |||||||||||||||||||
| Радиус иона | 54 (−1 e) пм | |||||||||||||||||||
| Электроотрицательность | 2,20[2] (шкала Полинга) | |||||||||||||||||||
| Степени окисления | -1, 0, +1 | |||||||||||||||||||
| Энергия ионизации (первый электрон) |
1311,3 (13,595) кДж/моль (эВ) | |||||||||||||||||||
| Термодинамические свойства простого вещества | ||||||||||||||||||||
| Плотность (при н. у.) | 0,0000899 (при 273 K (0 °C)) г/см³ | |||||||||||||||||||
| Температура плавления | 14,01 K; −259,14 °C | |||||||||||||||||||
| Температура кипения | 20,28 K; −252,87 °C | |||||||||||||||||||
| Тройная точка | 13,96 К (−259,19°C), 7.205[4] кПа | |||||||||||||||||||
| Критическая точка | 32,24 К, 1,30[5] МПа | |||||||||||||||||||
| Уд. теплота плавления | 0,117 кДж/моль | |||||||||||||||||||
| Уд. теплота испарения | 0,904 кДж/моль | |||||||||||||||||||
| Молярная теплоёмкость | 28,47[3] Дж/(K·моль) | |||||||||||||||||||
| Молярный объём | 22,4⋅103 см³/моль | |||||||||||||||||||
| Кристаллическая решётка простого вещества | ||||||||||||||||||||
| Структура решётки | гексагональная | |||||||||||||||||||
| Параметры решётки | a = 3,780 c = 6,167 Å | |||||||||||||||||||
| Отношение c/a | 1,631 | |||||||||||||||||||
| Температура Дебая | 110 K | |||||||||||||||||||
| Прочие характеристики | ||||||||||||||||||||
| Теплопроводность | (300 K) 0,1815 Вт/(м·К) | |||||||||||||||||||
| Номер CAS | 12385-13-6 | |||||||||||||||||||
| Эмиссионный спектр | ||||||||||||||||||||
|
|
||||||||||||||||||||
| Наиболее долгоживущие изотопы | ||||||||||||||||||||
|
Основная статья: Изотопы водорода
|
Водоро́д (химический символ — H, от лат. hydrogenium) — химический элемент первого периода периодической таблицы химических элементов Д. И. Менделеева, с атомным номером 1.
Одноатомная форма водорода — самое распространённое химическое вещество во Вселенной, составляющее примерно 75 % всей барионной массы. Звёзды, кроме компактных, в основном состоят из водородной плазмы. Самый лёгкий из элементов периодической таблицы.
Три изотопа водорода имеют собственные названия: 1H — протий, 2H — дейтерий и 3H — тритий (радиоактивен).
Ядро самого распространённого изотопа — протия — состоит из одного только протона и не содержит нейтронов.
При стандартной температуре и давлении водород — бесцветный, не имеющий запаха и вкуса, нетоксичный двухатомный газ (химическая формула — H2), который в смеси с воздухом или кислородом горюч и крайне пожаро- и взрывоопасен[3]. В присутствии других окисляющих газов, например фтора или хлора, водород также взрывоопасен. Поскольку водород охотно формирует ковалентные связи с большинством неметаллов, большая часть водорода на Земле существует в молекулярных соединениях, таких как вода или органические вещества. Водород играет особенно важную роль в кислотно-основных реакциях.
Растворим в этаноле и ряде металлов: железе, никеле, палладии, титане, платине, ниобии.
История открытия[править | править код]
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Впервые водород получил Парацельс, погружая железные опилки в серную кислоту в XVI веке.
В 1671 году Роберт Бойль подробно описал реакцию между железными опилками и разбавленными кислотами, при которой выделяется газообразный водород[7][8].
В 1766 году Генри Кавендиш был первым, кто признал газообразный водород индивидуальным элементом, назвав газ, выделяющийся при реакции металла с кислотой, «горючим воздухом». Он предположил, что «горючий воздух» идентичен гипотетическому веществу, называемому «флогистон», и в 1781 году обнаружил, что при его сгорании образуется вода[9][10].
Прямо указывал на выделение водорода и Михаил Ломоносов, но он уже понимал, что это не флогистон.
Французский химик Антуан Лавуазье совместно с инженером Жаном Мёнье, используя специальные газометры, в 1783 году осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Так он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Происхождение названия[править | править код]
Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — вода и γεννάω — рождаю) — «рождающий воду». В 1801 году последователь Лавуазье, академик Василий Севергин, называл его «водотворное вещество», он писал[11]:
Водотворное вещество в соединении с кислотворным составляет воду. Сие можно доказать, как через разрешение, так и через составление.
Русское наименование «водород» предложил химик Михаил Соловьёв в 1824 году — по аналогии с «кислородом» Ломоносова.
Распространённость[править | править код]
Во Вселенной[править | править код]
В настоящее время водород — самый распространённый элемент во Вселенной. На его долю приходится около 88,6 % всех атомов (около 11,3 % составляют атомы гелия, доля всех остальных вместе взятых элементов — порядка 0,1 %)[12]. Таким образом, водород — основная составная часть звёзд и межзвёздного газа. Повсеместное возникновение атомарного водорода впервые произошло в эпоху рекомбинации.
В условиях звёздных температур (например, температура поверхности Солнца ~6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы[править | править код]
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода.
В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму для сухого воздуха[13][14]).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках, где по числу атомов на водород приходится почти 63 %[15].
Получение[править | править код]
В промышленности[править | править код]
На 2019 год в мире потребляется 75 млн тонн водорода, в основном в нефтепереработке и производстве аммиака. Из них более 3/4 производится из природного газа, для чего расходуется более 205 млрд м3 газа[16]. Почти все остальное получают из угля. Около 0,1 % (~100 тыс. тонн) вырабатывается электролизом. При производстве водорода в атмосферу поступает ~830 млн тонн CO2. Себестоимость водорода, полученного из природного газа, оценивается в 1,5-3 доллара за 1 кг.
- Конверсия метана с водяным паром при 1000 °C:
- Пропускание паров воды над раскалённым коксом при температуре около 1000 °C:
- Электролиз водных растворов солей:
- Электролиз водных растворов гидроксидов активных металлов (преимущественно гидроксида калия)[17] (англ.)
-
- Кроме того, существует промышленная технология электролиза химически чистой воды, без применения каких-либо добавок. Фактически, устройство представляет собой обратимый топливный элемент с твёрдой полимерной мембраной[17] (англ.) или без мембраны http://kyivtoulouse.univ.kiev.ua/journal/index.php/fruajc/article/view/201 Архивная копия от 5 февраля 2020 на Wayback Machine.
- Каталитическое окисление метана кислородом:
- Крекинг и риформинг углеводородов в процессе переработки нефти.
В лаборатории[править | править код]
- Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную серную кислоту:
- Взаимодействие кальция с водой:
- Гидролиз гидридов:
- Действие щелочей на цинк или алюминий:
- С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
Очистка[править | править код]
В промышленности реализованы несколько способов очистки водорода из водородосодержащего сырья (так называемый водородсодержащий газ)[18]. Водородсодержащий газ (ВСГ) — это газ с высоким содержанием водорода (10 % и выше). Переход на сжигание водородсодержащих газов — один из способов снижения выбросов углекислого газа в атмосферу.
- Низкотемпературная конденсация: ВСГ охлаждают до температур конденсации метана и этана, после чего водород отделяют ректификацией. Процесс ведут при температуре −158 °C и давлении 4 МПа. Чистота очищенного водорода составляет 93—94 % при его концентрации в исходном ВСГ до 40 %.
- Адсорбционное выделение на цеолитах: настоящий метод на сегодняшний день наиболее распространён в мире. Метод достаточно гибок и может использоваться как для выделения водорода из ВСГ, так и для доочистки уже очищенного водорода. В первом случае процесс ведут при давлениях 3,0—3,5 МПа. Степень извлечения водорода составляет 80—85 % с чистотой 99 %. Во втором случае часто используют процесс «PSA» фирмы «Union Carbide». Он впервые был реализован в промышленности в 1978 году. На настоящий момент функционирует более 250 установок от 0,6 до 3,0 млн м3 Н2/сут. Образуется водород высокой чистоты — 99,99 %.
- Абсорбционное выделение жидкими растворителями: Этот метод применяется редко, хотя водород получается высокой чистоты — 99,9 %.
- Концентрирование водорода на мембранах: На лучших образцах метод позволяет получать водород чистотой 95—96 %, однако производительность таких установок невысока.
- Селективное поглощение водорода металлами: Метод основан на способности сплавов лантана с никелем, железа с титаном, циркония с никелем и других поглощать до 30 объёмов водорода.
Стоимость[править | править код]
Стоимость водорода при крупнооптовых поставках колеблется в диапазоне 2—7 USD/кг[19]. В небольших количествах перевозится в стальных баллонах зелёного или тёмно-зелёного цвета.
Физические свойства[править | править код]
Эмиссионный спектр атомов водорода. Четыре видимые глазом спектральные линии серии Бальмера
Водород — самый лёгкий газ: он легче воздуха в 14,5 раз. Поэтому, например, мыльные пузыри, наполненные водородом, на воздухе стремятся вверх[20]. Шары, наполненные водородом, также стремятся вверх. Водород использовался для воздухоплавания, но из-за взрывоопасности от водорода отказались в пользу гелия. Чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа, за счёт чего быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в 7 раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н. у.), температура кипения −252,76 °C, удельная теплота сгорания 120,9⋅106 Дж/кг, малорастворим в воде — 18,8 мл/л при н.у. Растворимость водорода в воде возрастает с увеличением давления и снижается с увеличением температуры.
Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов H2 на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см³) и текучая (вязкость при −253 °C 13,8 сП). Критические параметры водорода: температура −240,2 °C, давление 12,8 атм, критическая плотность 0,0312 г/см³ и критический объём 66,95—68,9 см³/моль (0,033 м³/кг). Указанными значениями критических параметров объясняются трудности при ожижении водорода.
В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2[⇨].
Твёрдый водород, температура плавления −259,2 °C, плотность 0,0807 г/см³ (при −262 °C) — снегоподобная масса, кристаллы гексагональной сингонии, пространственная группа P6/mmc, параметры ячейки a = 0,378 нм и c = 0,6167 нм.
Металлический водород[править | править код]
В 1935 году Уингер и Хантингтон высказали предположение о том, что при давлении свыше 250 тысяч атм водород может перейти в металлическое состояние. Получение этого вещества в устойчивом состоянии открывало очень заманчивые перспективы его применения — ведь это был бы сверхлёгкий металл, компонент лёгкого и энергоёмкого ракетного топлива. В 2014 году было установлено, что при давлении порядка 1,5—2,0 млн атм водород начинает поглощать инфракрасное излучение, а это означает, что электронные оболочки молекул водорода поляризуются. Возможно, при ещё более высоких давлениях водород превратится в металл[21]. В 2017 году появилось сообщение о возможном экспериментальном наблюдении перехода водорода в металлическое состояние под высоким давлением[22][23].
Спиновые изомеры[править | править код]
Спиновые изомеры молекулярного водорода
Равновесная мольная концентрация параводорода в смеси в зависимости от температуры
Молекулярный водород существует в двух спиновых формах (модификациях): ортоводород и параводород.
Модификации немного различаются по физическим свойствам, оптическим спектрам, также по характеристикам рассеивания нейтронов. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) спины ядер параллельны, а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположны друг другу (антипараллельны). Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.
Разделить спиновые изомеры водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону параводорода, так как энергия пара-молекулы немного ниже энергии орто-молекулы. При 80 К соотношение модификаций приблизительно 1:1. Десорбированный с угля параводород при нагревании превращается в ортоводород с образованием равновесной смеси. При комнатной температуре равновесна смесь ортоводорода и параводорода в отношении около 75:25[24]. Без катализатора взаимное превращение происходит относительно медленно, что даёт возможность изучить свойства обеих модификаций. В условиях разреженной межзвёздной среды характерное время перехода в равновесную смесь очень велико, вплоть до космологических.
Изотопы[править | править код]
Термодинамическое состояние насыщенного пара водорода с различным изотопным составом
Наиболее известны три изотопа водорода: протий 1H (атомное ядро — протон), дейтерий 2Н (ядро состоит из одного протона и одного нейтрона) и тритий 3Н (ядро состоит из одного протона и двух нейтронов). Эти изотопы имеют собственные химические символы: протий — H, дейтерий — D, тритий — T.
Протий и дейтерий стабильны. Содержание этих изотопов в природном водороде составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 % соответственно[25]. Оно может незначительно меняться в зависимости от источника и способа получения водорода. Тритий нестабилен, претерпевает бета-распад с периодом 12,32 года, превращаясь в стабильный гелий-3[25]. Тритий встречается в природе в следовых количествах, образуясь главным образом при взаимодействии космических лучей со стабильными ядрами, при захвате дейтерием тепловых нейтронов и при взаимодействии природного изотопа лития-6 с нейтронами, порождёнными космическими лучами.
Искусственно получены также тяжёлые радиоактивные изотопы водорода с массовыми числами 4—7 и периодами полураспада 10−21—10−23 с[25].
Природный молекулярный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание в нём молекул из чистого дейтерия D2 ещё меньше, отношение концентраций HD и D2 составляет примерно 6400:1.
Из всех изотопов химических элементов физические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов[26].
-
Температура
плавления,
KТемпература
кипения,
KТройная
точкаКритическая
точкаПлотность,
кг/м³T, K P, кПа T, K P, МПа жидкий газ H2 13,96 20,39 13,96 7,3 32,98 1,31 70,811 1,316 HD 16,65 22,13 16,6 12,8 35,91 1,48 114,0 1,802 HT 22,92 17,63 17,7 37,13 1,57 158,62 2,31 D2 18,65 23,67 18,73 17,1 38,35 1,67 162,50 2,23 DT 24.38 19,71 19,4 39,42 1,77 211,54 2,694 T2 20,63 25,04 20,62 21,6 40,44 1,85 260,17 3,136
Молекулы чистых протия, дейтерия и трития могут существовать в двух аллотропных модификациях (отличающихся взаимной ориентацией спинов ядер) — орто- и параводород: o-D2, p-D2, o-T2, p-T2. Молекулы водорода с другим изотопным составом (HD, HT, DT) не имеют орто- и парамодификаций.
Свойства изотопов[править | править код]
Свойства изотопов водорода представлены в таблице[25][27].
| Изотоп | Z | N | Масса, а. е. м. | Период полураспада | Спин | Содержание в природе, % | Тип и энергия распада | |
|---|---|---|---|---|---|---|---|---|
| 1H | 1 | 0 | 1,007 825 032 07(10) | стабилен | 1⁄2+ | 99,9885(70) | ||
| 2H | 1 | 1 | 2,014 101 777 8(4) | стабилен | 1+ | 0,0115(70) | ||
| 3H | 1 | 2 | 3,016 049 277 7(25) | 12,32(2) года | 1⁄2+ | β− | 18,591(1) кэВ | |
| 4H | 1 | 3 | 4,027 81(11) | 1,39(10)⋅10−22 с | 2− | -n | 23,48(10) МэВ | |
| 5H | 1 | 4 | 5,035 31(11) | более 9,1⋅10−22 с | (1⁄2+) | -nn | 21,51(11) МэВ | |
| 6H | 1 | 5 | 6,044 94(28) | 2,90(70)⋅10−22 с | 2− | −3n | 24,27(26) МэВ | |
| 7H | 1 | 6 | 7,052 75(108) | 2,3(6)⋅10−23 с | 1⁄2+ | -nn | 23,03(101) МэВ |
В круглых скобках приведено среднеквадратическое отклонение значения в единицах последнего разряда соответствующего числа.
Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
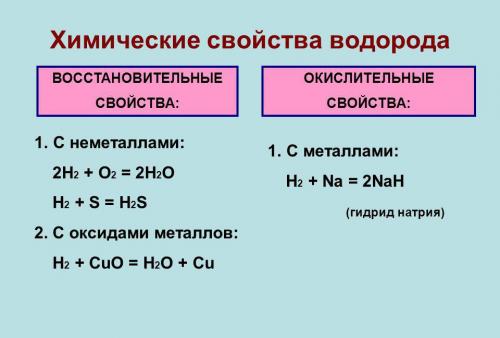
Химические свойства[править | править код]
Доля диссоциировавших молекул водорода при атмосферном давлении в зависимости от температуры
Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Поэтому окислительная способность водорода проявляется в реакциях с активными металлами, как правило, при повышенных температуре и давлении. При обычных температурах водород реагирует только с очень активными металлами, например, с кальцием, образуя гидрид кальция:
и с единственным неметаллом — фтором, образуя фтороводород:
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например, при освещении:
Записанное уравнение отражает восстановительные свойства водорода.
С галогенами образует галогеноводороды:
-
, реакция протекает со взрывом в темноте и при любой температуре,
-
, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
Взаимодействие со щелочными и щёлочноземельными металлами[править | править код]
При взаимодействии с активными металлами водород образует гидриды:
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
Взаимодействие с оксидами металлов[править | править код]
Оксиды металлов (как правило, d-элементов) восстанавливаются до металлов:
Гидрирование органических соединений[править | править код]
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр., Катализатор Уилкинсона), так и гетерогенным (напр., никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
Геохимия водорода[править | править код]
На Земле содержание водорода понижено по сравнению с Солнцем, планетами-гигантами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована: основная масса водорода, как и других летучих элементов, покинула планету во время аккреции или вскоре после неё.[источник не указан 3628 дней] Однако точное содержание данного газа в составе геосфер нашей планеты (исключая земную кору) — астеносферы, мантии, ядра Земли — неизвестно.[источник не указан 3628 дней]
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах. Известно содержание водорода в составе вулканических газов, истечение некоторых количеств водорода вдоль разломов в зонах рифтогенеза, выделение этого газа в некоторых угольных месторождениях[28][29].
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и воды.
В атмосфере молекулярный водород непрерывно образуется в результате разложения формальдегида, образующегося в цепочке окисления метана или другой органики, солнечным излучением (31—67 гигатонн/год), неполного сгорания различных топлив и биомасс (по 5—25 гигатонн/год), в процессе фиксации азота микроорганизмами из воздуха (3—22 гигатонн/год)[30][31][32].
Имея малую массу, молекулы водорода в составе воздуха обладают высокой тепловой скоростью (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут навсегда улететь в космическое пространство (см. Диссипация атмосфер планет). Объёмы потерь оцениваются в 3 кг в секунду[33][34].
Меры предосторожности[править | править код]
Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Считается, что взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75 (74) % по объёму. Такие цифры фигурируют сейчас в большинстве справочников, и ими вполне можно пользоваться для ориентировочных оценок. Однако следует иметь в виду, что более поздние исследования (примерно конец 80-х) выявили, что водород в больших объёмах может быть взрывоопасен и при меньшей концентрации.[источник не указан 1123 дня] Чем больше объём, тем меньшая концентрация водорода опасна.
Источник этой широко растиражированной ошибки в том, что взрывоопасность исследовалась в лабораториях на малых объёмах. Поскольку реакция водорода с кислородом — это цепная химическая реакция, которая проходит по свободнорадикальному механизму, «гибель» свободных радикалов на стенках (или, скажем, поверхности пылинок) критична для продолжения цепочки. В случаях, когда возможно создание «пограничных» концентраций в больших объёмах (помещения, ангары, цеха), следует иметь в виду, что реально взрывоопасная концентрация может отличаться от 4 % как в большую, так и в меньшую стороны.
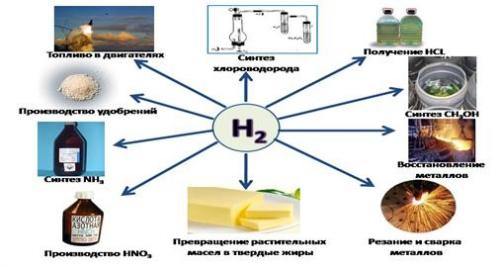
Применение[править | править код]
Водород сегодня применяется во многих областях.
Структура мирового потребления водорода представлена в следующей таблице
| Применение | Доля |
|---|---|
| Производство аммиака | 54 % |
| Нефтепереработка (гидрогенизация ненасыщенных углеводородов и гидросульфирование) и синтез метанола | 35 % |
| Производство полупроводников | 6 % |
| Металлургия и стекольная промышленность | 3 % |
| Пищевая промышленность | 2 % |
Химическая промышленность[править | править код]
Химическая промышленность — это крупнейший потребитель водорода. Более 50 % мирового выпуска водорода идёт на производство аммиака. Ещё около 8 % используется для производства метанола[36]. Из аммиака производят пластмассы, удобрения, взрывчатые вещества и прочее. Метанол является основой для производства некоторых пластмасс.
Топливно-энергетический комплекс[править | править код]
В нефтепереработке около 37 % мирового выпуска водорода используется в процессах гидрокрекинга и гидроочистки, способствуя увеличению глубины переработки сырой нефти и повышению качества конечных продуктов[36].
Водород используют и в качестве ракетного топлива. Ввиду крайне узкого диапазона температур (менее 7 кельвинов), при котором водород остаётся жидкостью, на практике чаще используется смесь жидкой и твёрдой фаз.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
Транспорт[править | править код]
Водород используется в качестве топлива для серийно выпускаемых автомобилей на Водородных топливных элементах: Toyota Mirai, Hyundai Nexo. Американская компания[37] представила линейку коммерческих автомобилей на водороде, а также пикап Nikola Badger с запасом хода 960 км[38]
Компания Alstom в 2018 году запустила в Германии первый коммерческий поезд на топливных элементах Coradia iLint, способный проходить 1000 км на одном резервуаре с водородом. Поезда совершают 100-километровые рейсы со скоростью до 140 километров в час[39].
Электроэнергетика[править | править код]
В электроэнергетике водород применяется для охлаждения мощных электрических генераторов[40].
Пищевая и косметическая промышленность[править | править код]
При производстве саломаса (твёрдый жир, производимый из растительных масел) используется около 2 % мирового выпуска водорода. Саломас является основой для производства маргарина, косметических средств, мыла. Водород зарегистрирован в качестве пищевой добавки под номером E949.
Лабораторное[править | править код]
Водород используется в химических лабораториях в качестве газа-носителя в газовой хроматографии. Такие лаборатории есть на многих предприятиях в пищевой, парфюмерной, металлургической и химической промышленности. Несмотря на горючесть водорода, его использование в такой роли считается достаточно безопасным, поскольку водород используется в незначительных количествах. Эффективность водорода как газа-носителя при этом лучше, чем у гелия, при существенно более низкой стоимости[41].
Метеорология[править | править код]
Водород используется в метеорологии для заполнения оболочек метеозондов. Водород в этом качестве имеет преимущество перед гелием, так как он дешевле. Ещё более существенно, что водород вырабатывается прямо на метеостанции с помощью простого химического генератора или с помощью электролиза воды. Гелий же должен доставляться на метеостанцию в баллонах, что может быть затруднительно для удалённых мест[42].
Авиационная промышленность[править | править код]
В настоящее время водород в авиации не используется. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько катастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
Прочее[править | править код]
Атомарный водород используется для атомно-водородной сварки. Высокая теплопроводность водорода используется для заполнения сфер гирокомпасов и стеклянных колб филаментных LED-лампочек.
См. также[править | править код]
- Антиводород
Примечания[править | править код]
- Комментарии
- ↑ Указан диапазон значений атомной массы в связи с различной распространённостью изотопов в природе.
- Источники
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02. Архивировано 5 февраля 2014 года.
- ↑ Hydrogen: electronegativities (англ.). Webelements. Дата обращения: 15 июля 2010. Архивировано 27 июня 2010 года.
- ↑ 1 2 Водород // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: А — Дарзана. — С. 400—402. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
- ↑ Фёдоров П. И., Тройная точка, 1998, с. 12.
- ↑ Хазанова Н. Е., Критическое состояние, 1990, с. 543.
- ↑ Standard atomic weights of the elements 2021 (IUPAC Technical Report) (англ.) — IUPAC, 1960. — ISSN 0033-4545; 1365-3075; 0074-3925 — doi:10.1515/PAC-2019-0603
- ↑ Boyle, R. (1672). «Tracts written by the Honourable Robert Boyle containing new experiments, touching the relation betwixt flame and air…» London.
- ↑ Winter, M. Hydrogen: historical information. WebElements Ltd (2007). Дата обращения: 5 февраля 2008. Архивировано 10 апреля 2008 года.
- ↑ Musgrave, A. Why did oxygen supplant phlogiston? Research programmes in the Chemical Revolution // Method and appraisal in the physical sciences (англ.) / Howson, C.. — Cambridge University Press, 1976. — (The Critical Background to Modern Science, 1800–1905).
- ↑ Cavendish, Henry. Three Papers, Containing Experiments on Factitious Air, by the Hon. Henry Cavendish, F. R. S (англ.) // Philosophical Transactions : journal. — 1766. — 12 May (vol. 56). — P. 141—184. — doi:10.1098/rstl.1766.0019. — Bibcode: 1766RSPT…56..141C. — JSTOR 105491.
- ↑ Севергин В. М. Пробирное искусство, или руководство к химическому испытанию металлических руд и других ископаемых тел. СПб.: Издание Имп. АН, 1801. C. 2.
- ↑ Н. Гринвуд, А. Эрншо. Химия элементов: в 2 томах. — БИНОМ. Лаборатория знаний, 2008. — Т. 1. — С. 11. — 607 с. — (Лучший зарубежный учебник). — ISBN 978-5-94774-373-9.
- ↑ Gribbin, John. Science. A History (1543-2001). — L.: Penguin Books, 2003. — 648 с. — ISBN 978-0-140-29741-6.
- ↑ Source for figures: Carbon dioxide, NOAA Earth System Research Laboratory Архивная копия от 25 декабря 2018 на Wayback Machine, (updated 2010.06). Methane, IPCC TAR table 6.1 Архивная копия от 15 июня 2007 на Wayback Machine, (updated to 1998). The NASA total was 17 ppmv over 100 %, and CO2 was increased here by 15 ppmv. To normalize, N2 should be reduced by about 25 ppmv and O2 by about 7 ppmv.
- ↑ Хорнак Д. П. Основы МРТ. Дата обращения: 23 августа 2013. Архивировано 9 февраля 2014 года.
- ↑ «Перепись ВОДОРОДА» Журнал «Газпром», сентябрь 2019, стр 42-43. Дата обращения: 22 октября 2019. Архивировано 22 октября 2019 года.
- ↑ 1 2 Da Rosa, Aldo Vieira. Fundamentals of renewable energy processes. — Amsterdam: Elsevier Academic Press, 2005. — С. 370. — xvii, 689 pages с. — ISBN 0120885107.
- ↑ А.К.Мановян. Технология переработки природных энергоносителей. — Москва: Химия, КолосС, 2004. — 456 с. — ISBN 5-98109-004-9, 5-9532-0219-97.
- ↑ Аркадий Шварц. Снова о водороде Архивная копия от 30 сентября 2010 на Wayback Machine. Вестник online № 19(356) 15 сентября 2004.
- ↑ Мыльные пузыри с водородом Архивная копия от 26 июля 2014 на Wayback Machine — видеоопыт в Единой коллекции цифровых образовательных ресурсов.
- ↑ Неограническая химия. Том 2. Химия непереходных элементов / под ред. акад. Ю. Д. Третьякова. — Москва: Академия, 2004. — 368 с. — ISBN 5-7695-1436-1.
- ↑ Dias Ranga P., Silvera Isaac F. Observation of the Wigner-Huntington transition to metallic hydrogen // Science. — 2017. — 26 января (т. 355, № 6326). — С. 715—718. — ISSN 0036-8075. — doi:10.1126/science.aal1579. [исправить]
- ↑ Алексей Понятов. Десять крупнейших событий 2017 года в физике и астрономии. Стабильный металлический водород // Наука и жизнь. — 2018. — № 1. — С. 9. Архивировано 12 января 2018 года.
- ↑ Фаркаш Л. Орто- и параводород. [[Успехи физических наук]], т. 15, вып. 3. 1935 г. Дата обращения: 22 сентября 2018. Архивировано 22 сентября 2018 года.
- ↑ 1 2 3 4 Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — doi:10.1016/j.nuclphysa.2003.11.001. — Bibcode: 2003NuPhA.729….3A.
- ↑ Züttel A., Borgschulte A., Schlapbach L. Hydrogen as a Future Energy Carrier. — Wiley-VCH Verlag GmbH & Co. KGaA, 2008. — ISBN 978-3-527-30817-0.
- ↑ Audi G., Wapstra A. H., Thibault C. The AME2003 atomic mass evaluation (II). Tables, graphs, and references (англ.) // Nuclear Physics A. — 2003. — Vol. 729. — P. 337—676. — doi:10.1016/j.nuclphysa.2003.11.003. — Bibcode: 2003NuPhA.729..337A.
- ↑ Портнов Александр. Вулканы — месторождения водорода. Архивная копия от 6 июня 2013 на Wayback Machine / Промышленные ведомости, № 10—12, октябрь—декабрь 2010.
- ↑ Гресов А. И., Обжиров А. И., Яцук А. В. К вопросу водородоносности угольных бассейнов Дальнего востока/ Вестник КРАУНЦ. Науки о Земле. 2010, № 1, Выпуск 15. С. 19—32.
- ↑ http://www.atmos-chem-phys.net/11/3375/2011/acp-11-3375-2011.pdf Архивная копия от 21 мая 2013 на Wayback Machine A new estimation of the recent tropospheric molecular hydrogen budget using atmospheric observations and variational inversion] doi:10.5194/acp-11-3375-2011, 2011 «The main sources of H2 are photochemical production by the transformation of formaldehyde (HCHO) in the atmosphere and incomplete combustion processes. Photolysis of HCHO, a product in the oxidation chain of methane and other volatile organic compounds (VOCs) accounts for 31 to 77 Tg yr−1 and represents half of the total H2 source. Fossil fuel and biomass burning emissions, two incomplete combustion sources, account for similar shares of the global H2 budget (5−25 Tg yr−1). H2 emissions (3−22 Tg yr−1) originating from nitrogen fixation in the continental and marine biosphere complete the sources. H2 oxidation by free hydroxyl radicals (OH) and enzymatic H2 destruction in soils must balance these sources because tropospheric H2 does not show a significant long term trend (Grant et al., 2010)»
- ↑ Chemistry of the Natural Atmosphere Архивная копия от 10 декабря 2017 на Wayback Machine pages 207—201, table 4.14
- ↑ Global environmental impacts of the hydrogen economy Архивная копия от 5 декабря 2014 на Wayback Machine page 61 table 1
- ↑ David C. Catling and Kevin J. Zahnle, The Planetary Air Leak. As Earth’s atmosphere slowly trickles away into space, will our planet come to look like Venus? Архивная копия от 2 февраля 2014 на Wayback Machine //SCIENTIFIC AMERICAN, May 2009
- ↑ Ferronsky V. I., Denisik S. A., Ferronsky S. V. Chapter 8. Global Dynamics of the Earth // Jacobi Dynamics: Many-Body Problem in Integral Characteristics. — (Astrophysics and Space Science Library. Vol. 130). — Springer Science & Business Media, 1986. — P. 296. — ISBN 9027724180, 9789027724182.
- ↑ Olu Ajayi-Oyakhire. Hydrogen – Untapped Energy? Institution of Gas Engineers and Managers. Institution of Gas Engineers and Managers (2012). Дата обращения: 24 марта 2018. Архивировано из оригинала 17 апреля 2018 года.
- ↑ 1 2 Р. В. Радченко, А. С. Мокрушин, В. В. Тюльпа. Водород в энергетике. — Екатеринбург: Издательство Уральского университета, 2014. — С. 24. — 229 с. — ISBN 978-5-7996-1316-7.
- ↑ Nikola Архивная копия от 13 февраля 2020 на Wayback Machine
- ↑ Nikola Badger. Дата обращения: 14 февраля 2020. Архивировано 13 февраля 2020 года.
- ↑ Первый водородный поезд в Германии. Дата обращения: 14 февраля 2020. Архивировано 24 января 2020 года.
- ↑ Принцип действия и конструкция синхронных машин. Дата обращения: 9 июня 2014. Архивировано 13 сентября 2014 года.
- ↑ Helium – what is the current cost to labs? www.peakscientific.com. Дата обращения: 17 ноября 2015. Архивировано 18 ноября 2015 года.
- ↑ А.А. Иванов (руководитель разработки). Наставление гидрометеорологическим постам и станциям. Выпуск 4. Росгидромет. Росгидромет (16 июля 2003). Дата обращения: 24 марта 2018. Архивировано 3 июня 2021 года.
Литература[править | править код]
- Дигонский С. В., Тен В. В. Неизвестный водород. — СПб: Наука, 2006. ISBN 5-02-025114-3.
- Кузьменко Н. Е., Ерёмин В. В., Попков В. А. Начала химии. Современный курс для поступающих в вузы: Учебное пособие для вузов. — М.: Издательство «Экзамен», 2005.
- Фёдоров П. И. Тройная точка // Химическая энциклопедия. — Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — С. 12.
- Хазанова Н. Е. Критическое состояние // Химическая энциклопедия. — Советская энциклопедия, 1990. — Т. 2: Даф — Мед. — С. 541—543.
- Chart of the Nuclides. — 17th. — Knolls Atomic Power Laboratory, 2010. — ISBN 978-0-9843653-0-2.
- Newton, David E. The Chemical Elements. — New York: Franklin Watts (англ.) (рус., 1994. — ISBN 978-0-531-12501-4.
- Rigden, John S. Hydrogen: The Essential Element. — Cambridge, Massachusetts: Harvard University Press, 2002. — ISBN 978-0-531-12501-4.
- Romm, Joseph, J. The Hype about Hydrogen, Fact and Fiction in the Race to Save the Climate (англ.). — Island Press (англ.) (рус., 2004. — ISBN 978-1-55963-703-9.
- Scerri, Eric. The Periodic System, Its Story and Its Significance (англ.). — New York: Oxford University Press, 2007. — ISBN 978-0-19-530573-9.
Ссылки[править | править код]
- Hydrogen Архивная копия от 10 января 2016 на Wayback Machine at The Periodic Table of Videos (University of Nottingham)
- Ferreira-Aparicio, P.; Benito, M. J.; Sanz, J. L. New Trends in Reforming Technologies: from Hydrogen Industrial Plants to Multifuel Microreformers (англ.) // Catalysis Reviews : journal. — 2005. — Vol. 47, no. 4. — P. 491—588. — doi:10.1080/01614940500364958.
Водород. Нахождение в природе. Физические и химические
свойства. Получение и применение
Цели:
обучающая
- изучить
способы получения и собирания водорода - повторить
строение атома, химическую применять алгоритм изучения свойств элементов
на примере связь - уметь
составлять уравнения химических реакций - повторить
понятие “изотопы”
развивающая
- развитие
речи (обогащение и усложнение словарного запаса при использовании
химической номенклатуры) - развитие
научного мышления: умения сравнивать, проводить анализ, прогнозировать ,
делать выводы - развитие
наблюдательности - развитие
экспериментальных умений и навыков
воспитательная
- воспитание
дисциплинированности, аккуратности, терпимого отношения к ошибкам
товарищей, умения слушать собеседника.
Методы обучения: репродуктивный,
частично-поисковый, использование ИКТ.
Формы организации познавательной деятельности:
фронтальная, индивидуальная, групповая.
Задачи:
- рассмотреть
строение атома и молекулы водорода - формы
нахождения водорода в природе - изучить
физические свойства водорода, способы его получения и собирания - научиться
распознавать водород.
Оборудование и реактивы:
аппарат Киппа, приборы для получения газов, пробирки, спиртовки, спички,
мыльный раствор, лабораторный штатив, цинк, растворы серной и соляной кислот,
мультимедийная презентация.
Ход урока.
Учитель: Используя оксид ртути (II)
запишите уравнения реакций с помощью которых можно осуществить следующие
превращения. Назовите вещества и укажите тип реакций.
HgO O2
H2O
H2
Учитель: При разложении воды, кроме
кислорода образуется газ – водород.
Водород – самый распространенный элемент в космосе. Основная
масса звезд состоит из водорода: Юпитер, Сатурн – 92% Н, 8 % Н е, 0,1 % все
остальные химические элементы; водород преимущественно составляет межзвездное
вещество. Водород входит в состав основного вещества Земли – воды. Если
посмотреть на схему распространения химических элементов, то можно увидеть, что
доля водорода в земной коре составляет около 1% ее массы. Однако, роль его в
природе определяется не массой, а числом атомов, доля которых составляет около
17%.
Множество органических веществ, представляют собой соединения
водорода с углеродом – нефть, природный газ метан СН4,
углеводы, белки, жиры, нуклеиновые кислоты, витамины и другие органические
вещества. В теле человека около 10% водорода.
Учитель: Никто не знал, сколько
водороду лет, хотя он сам утверждал, что родился в 1766 году в семье Генри. Но
злые языки говорили, что был он в этой семье приемышем и отца его звали то ли
Теофаст или Гельмонт, то ли Роберт или Джозеф, то ли Михайло или Николя, но
никак не Генри. Эти же языки шепотом добавляли, что мальчика называли тогда
иначе, настоящее имя он получил от своего учителя Антуана, который и ввел юношу
в “большой мир”.
Водород был известен еще в XVI в. Теофрасту Парацельсу
(1493-1541), его получали также Ван – Гельмонт (1577-1644), Роберт Бойль
(1627-1691), Николя Лемери (1645-1715), Михаил Васильевич Ломоносов
(1711-1765), Джозеф Пристли и другие ученые. В 1766 году известный английский
ученый Генри Кавендиш получил “искусственный воздух” действием цинка, железа
или олова на разведенную соляную или серную кислоту. Это было совершенно новое
вещество, которое хорошо горело и получило название “горючего воздуха”. Но лишь
в 1787 году Лавуазье доказал, что этот воздух” входит в состав воды и дал ему
название “ гидрогениум”, т. е. “рождающий воду”, “водород”.
Водород – первый химический элемент периодической системы
химических элементов Д.И. Менделеева. Атомный номер водорода – 1, относительная
атомная масса равна 1,008. В ядре атома водорода один протон, масса которого
равна 1 а. е. м. Почему же масса химического элемента водорода равна 1,008 а.
е. м? Масса не равна единице, так как кроме обычного водорода, называемого
протий, существуют изотопы водорода с большей массой: дейтерий и тритий.
Молекула водорода двухатомна. При образовании 1 моль Н2 из
2 моль атомов Н выделяется 436 кДж. В молекуле атомы связаны одной электронной
парой Н : Н или Н -Н.В рамках метода молекулярных орбиталей прочность молекулы
Н2 объясняется тем, что в ней
электронная пара занимает связующую – орбиталь.
Учитель:
Продолжаем работать. Познакомимся с основными способами получения водорода.
1. В промышленности:
- 2NaCl
+ 2H22O → H2↑ +
2NaOH + Cl2 - СН4 +
2Н20 = CO2 +
4Н2 —
165 кДж - H2O + C ⇄ H2 +
CO - CH4 +
H22O ⇄ CO +
3H2 (1000
°C) - 2CH4 +
O2 ⇄ 2CO +
4H2 - Крекинг
и реформинг углеводородов в процессе переработки нефти
2. В лаборатории:
- Zn +
2HCl → ZnCl2 + H2↑ - Ca +
2H2O →
Ca(OH)2 +
H2↑ - NaH +
H2O →
NaOH + H2↑
2Al + 2NaOH + 6H2O →
2Na[Al(OH)4] + 3H2
Учитель: Применение водорода:
Учитель: Итог нашего урока: мы познакомились
со вторым после кислорода элементом в химии – водородом. Вы узнали его свойства
и уникальность. Я думаю, вам понятно, почему надо обращаться с газом очень
осторожно. Возможен взрыв, вот почему вы должны быть всегда начеку!
Закрепление изученного: просмотр презентации
Как в недрах Земли образуется водород?
В последнее время обнаружено ряд признаков того, что в недрах Земли может содержаться большое количество водорода. Причем речь идет не просто о предположениях ученых. Ранее мы рассказывали, что в разных точках мира уже имеются несколько работающих скважин, из которых добывается водород. В ближайшее время их наверняка станет больше, так как десятки стартапов, многие из которых находятся в Австралии, борются за права на разведку этого газа. В прошлом году Американская ассоциация геологов-нефтяников сформировала свой первый комитет по природному водороду, а Геологическая служба США начала свою первую работу по выявлению перспективных зон его добычи. Даже нефтегазовые компании, такие как бразильская GEO4U, все больше начинают заниматься водородом. Но откуда вообще берется этот газ в недрах нашей планеты и действительно ли он является возобновляемым?
Водород может быть возобновляемым источником энергии, который образуется в недрах Земли
Водород в недрах Земли возобновляется?
Ранее мы рассказывали, что водород, в отличие от нефти, возобновляется. Причем, судя по всему, существует сразу несколько механизмов образования этого газа. Один из наиболее распространенных называется серпентинизацией.
В результате воздействия воды, высокой температуры и давления, минерал оливин превращается в другой вид минерала, который называется серпентинитом. В ходе этой реакции железо окисляется, захватывая атомы кислорода из молекул воды и выделяя при этом водород. Как показало исследование, проведенное в 2014 году, в результате серпентизации образуется 80% от всего водорода, возникающего внутри Земли.
Оливин — минерал, благодаря которому в недрах Земли образуется большое количество водорода
Другой механизм образования водорода называется радиолизом. Радиоактивные элементы в земной коре, такие как уран и торий, распадаются, в результате чего излучают альфа-частицы. Это излучение в свою очередь может расщеплять молекулы воды под землей и генерировать водорода.
Некоторые ученые выдвигают более радикальную версию — на поверхность земной коры просачивается первичный водород, попавший в железное ядро планеты вскоре после ее рождения. То есть он поднимается на поверхность, преодолевая тысячи километров.
Однако информации о формировании водорода пока еще не так много, поэтому ученые досконально не знают как он возникает и мигрирует. Кроме того, неизвестно, может ли водород накапливаться в достаточном количестве, чтобы его можно было использоваться для коммерческих целей. Дело в том, что в большинстве известных источников водорода слишком мало, чтобы можно было добывать газ в промышленных масштабах.
“Интерес быстро растет, но научных фактов по-прежнему не хватает” — говорит Фредерик-Виктор Донзе, геофизик, сотрудник Университета Гренобль-Альпы.
Где имеются месторождения водорода?
Ученые обнаружили множество водорода вблизи вулканического Срединно-Атлантического хребта на дне Атлантического океана. Газ в большом количестве выделяется на участке, известном как “Затерянный город”. Свое название он получил из-за возвышающихся “дымоходов” так называемых “белых курильщиков”. Из них бьет богатая минералами горячая вода.
Учены обнаружили водород на дне Атлантического океана на участке, именуемом «Затерянным городом»
В Исландии, расположенной между Срединно-Атлантическим хребтом, ученые зафиксировали сопоставимые потоки водорода в некоторых горячих источниках и геотермальных скважинах, которые находятся на разных участках страны. Об этом сообщалось в исследовании, опубликованном в прошлом году.
Отсюда следует, что водород имеется на стыке тектонических плит. Однако для коммерческих целей исследователи ищут этот в кратонах, то есть самых древних слоях земной коры, которые еще называют древними “фундаментами” континентов. Внутри них содержатся полосы богатых железом пород, которые называются зеленокаменными поясами. Они представляют собой остатки океанической коры, зажатой между плитами в результате древних столкновений континентов.
Скважину в Мали питает водород, возникающий в западноафриканском кратоне
По мнению ученых, оливин и другие минералы залегают здесь достаточно глубоко, в результате чего их температура превышает 200 градусов. В то же время на эту глубину еще просачивается вода. Как мы сказали выше, такие условия являются идеальными для образования водорода. К примеру, зеленокаменные пояса в западноафриканском кратоне стимулируют производство водорода, который вырывается на поверхность из скважины в Мали.
Обязательно переходите по этой ссылке, чтобы подписаться на наш ЯНДЕКС.ДЗЕН КАНАЛЕ. С ним вы будете в курсе самых последних событий в мире науки и высоких технологий.
Надо сказать, что по мнению ученых все вышеперечисленные версии образования водорода могут быть ошибочными. Однако для отрасли это не имеет значение. Напомним, что нефтяная промышленность возникла задолго до того, как ученые выяснили происхождение нефти. Более того, даже сейчас относительно происхождения нефти ведутся споры. Некоторые ученые считают, что нефть способна возобновляться. Поэтому в настоящее время для индустрии важно лишь одно — выяснить каковы запасы водорода, на которые можно рассчитывать.







![{displaystyle {ce {2H2O ->[4e^{-}] 2H2 ^ + O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bfd0a4659edb19836248c5e04532377ec8f41ec6)




![{displaystyle {ce {2Al + 2NaOH + 6H2O -> 2Na[Al(OH)4] + 3H2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/84f7a05865559a196245e28733d1bf2484c8869b)
![{displaystyle {ce {Zn + 2KOH + 2H2O -> K2[Zn(OH)4] + H2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f189643478d6d572c065da234fc21a7f5a9244fb)































