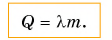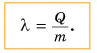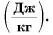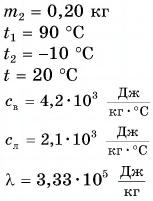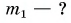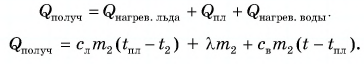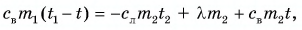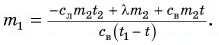1
|
Оглавление |
||
|
ЛАБОРАТОРНАЯ РАБОТА № 13……………………………………………………………………………………………….. |
2 |
|
|
1. |
ОПИСАНИЕ УСТАНОВКИ И МЕТОДА ИЗМЕРЕНИЙ ……………………………………………………. |
2 |
|
2. |
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ………………………………………………………………………………… |
4 |
|
3. |
ОБРАБОТКА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ……………………………………………………………………. |
5 |
|
ДАННЫЕ УСТАНОВКИ ……………………………………………………………………………………………………….. |
5 |
|
|
МАТЕМАТИЧЕСКАЯ ОБРАБОТКА ДАННЫХ…………………………………………………………………. |
6 |
|
|
ГРАФИЧЕСКАЯ ОБРАБОТКА РЕЗУЛЬТАТОВ……………………………………………………………….. |
7 |
|
|
КОНТРОЛЬНЫЕ ВОПРОСЫ……………………………………………………………………………………………………. |
8 |
|
|
ПРИЛОЖЕНИЕ………………………………………………………………………………………………………………………….. |
9 |

2
Лабораторная работа № 13
ОПРЕДЕЛЕНИЕ УДЕЛЬНОЙ ТЕПЛОТЫ
КРИСТАЛЛИЗАЦИИ И ИЗМЕНЕНИЯ ЭНТРОПИИ
ПРИ ОХЛАЖДЕНИИ СПЛАВА ОЛОВА
Цель работы: экспериментально определить изменение энтропии при фазовом переходе первого рода на примере кристаллизации олова (сплава олова со свинцом) из расплава при его охлаждении и удельную теплоту кристаллизации из закона сохранения энергии.
1. Описание установки и метода измерений
Кристаллизация – процесс перехода вещества из жидкого состояния в твёрдое. Кристаллизация связана с выделением количества теплоты, равного теплоте плавления, и для химически чистых веществ протекает при постоянной температуре, равной температуре плавления.
В процессе кристаллизации упорядочивается движение частиц жидкости. Постепенно движение частиц превращается в связанные тепловые колебания около узлов кристаллической решётки.
Для начала кристаллизации необходимо, чтобы в жидкости имелись центры кристаллизации – неоднородности, вокруг которых начинается образование твердой фазы.
Если в жидкости отсутствуют центры кристаллизации, то она может быть охлаждена до температуры более низкой, чем температура плавления. Это состояние жидкости называется метастабильным.
Количество теплоты, которое необходимо отвести от единицы массы жидкости при температуре кристаллизации Тк для перехода её в твердое состояние, называется удельной теплотой кристаллизации λк. Согласно первому началу термодинамики
где Uт, Uж – внутренняя энергия единицы массы в твёрдом и жидком состоянии; Vт, Vж – удельный объём твердой и жидкой фаз; p – давление в процессе кристаллизации.
|
Так как p(Vт Vж) << Uт Uж, то |
|
|
λк Uт Uж . |
(2) |
Для характеристики состояния вещества используется понятие энтропии – функции состояния, определяемой с точностью до постоянной.
Изменение энтропии в двух состояниях при обратимом процессе
|
2 |
||||
|
S2 S1 |
δQ |
, |
(3) |
|
|
1 |
T |
|||

3
где
– элементарное приведённое количество теплоты. В процессе
кристаллизации вещество отдаёт количество теплоты Q окружающей среде при
Т = const;
где Мс – масса олова (или сплава). Из (3) и (4) следует, что
или с учётом (2)
S2
Q λкMс 0
|
S |
S |
λ М |
||||
|
к |
с |
|||||
|
2 |
1 |
Т |
||||
|
к |
S1 Uт Uж
Тк
.
В процессе кристаллизации происходит возрастание упорядоченности (создание структуры) молекул вещества, что приводит к убыванию энтропии системы.
Рис. 1
Ампула со сплавом 2 (РИС. 1) нагревается в электрической печи 1, питающейся переменным током. Внутри ампулы находится металлическая труба – чехол с диф-
4
ференциальной хромель-копелевой термопарой, горячий спай 3 которой находится в ампуле, а холодный 4 – на воздухе. Концы термопары через гнёзда и провода соединены с милливольтметром 5, измеряющем термо-ЭДС. Электрическая печь 1 находится в модуле экспериментального стенда 6. Подключение электрической печи к сети производится вилкой и тумблером 9 ВКЛ на стенде. Для подъёма ампулы 2 необходимо отвинтить зажим 8 и переместить ползунок 7 вверх.
Простейшей моделью охлаждения тела является медленное охлаждение в среде с постоянной температурой Тс, когда внутри тела в течение всего процесса кристаллизации температура в любой точке тела одинакова в любой момент времени. Такой процесс состоит из непрерывно следующих друг за другом равновесных состояний и, следовательно, является квазистационарным обратимым процессом.
Применяя закон сохранения энергии к процессу охлаждения твёрдого сплава после кристаллизации, запишем
где dТ(СсМс + СаМа) < 0 – количество теплоты, отданное сплавом и ампулой среде при охлаждении за время dτ; αF(T – Tc) dτ > 0 – количество теплоты, полученное окружающей средой через поверхность ампулы F за время dτ; Cс, Ca – удельные теплоёмкости сплава и материала ампулы; Mс, Ma – массы сплава и ампулы; Т – температура твёрдого сплава; Тc – температура окружающей среды; α – коэффициент теплоотдачи с поверхности ампулы в окружающую среду. Будем считать, что α – постоянная величина в течение всего опыта.
Применяя закон сохранения энергии к процессу кристаллизации сплава, получим уравнение
где λкМс < 0 – количество теплоты, отданное сплавом при его кристаллизации окружающей среде за время τ кристаллизации; αF(Тк – Tс)Δτ > 0 – количество теплоты, полученное окружающей средой через поверхность ампулы за время кристаллизации.
Из соотношений (6) и (7) получаем формулу для удельной теплоты кристаллизации
|
λк (СсМс |
СаМа ) |
τ dT |
(T Т ) |
. |
(8) |
||||||
|
к |
с |
||||||||||
|
М dτ |
(Т Т |
) |
|||||||||
|
с |
с |
||||||||||
|
Изменение энтропии |
|||||||||||
|
S |
S |
λкМс |
. |
(9) |
|||||||
|
2 |
1 |
||||||||||
|
Тк |
|||||||||||
Следовательно, для определения S2 – S1 необходимо измерить температуру кристаллизации Тк, время кристаллизации τ и вычислить производную dT/dτ функции T = f(τ) в точке начала охлаждения твёрдого сплава после полной кристаллизации. Эти величины можно найти, измеряя температуру сплава в процессе охлаждения от полного расплава до температуры остывшего сплава Тc в конце опыта.
2. Порядок выполнения работы
1.Выписать данные установки.
2.Включить стенд (рубильник на установке). При этом проверить, выключен ли
тумблер электрической печи.

5
3.Включить цифровой милливольтметр 5. Проверить его показания при выключенном нагревателе печи: на табло должны быть высвечены нули. Если его показания не равны нулю, подождать, пока сплав в ампуле охладится до комнатной температуры.
4.Включить тумблер 9 электрической печи. Проследить в течение 10-15 мин за тем, чтобы сплав, находящийся в ампуле, расплавился. Процесс плавления проис-
ходит при постоянной температуре Тк, при этом показания милливольтметра не изменяются. Конец плавления определяется после того, как показания милливольтметра начинают расти. Это означает, что температура расплавленного сплава начинает увеличиваться.
5.Через 1 мин после окончания плавления сплава отключить электрический нагреватель – тумблер 9. Показания милливольтметра не должны превышать
15мВ, что соответствует температуре плавления термопары. Нагрев выше ука-
занной температуры недопустим!
6.Отвернуть винт 8 ползунка 7 и поднять ампулу со сплавом 2 из печи 1. Зафиксировать положение ампулы тем же винтом.
7.Включить секундомер и через каждые 15 с снимать показания милливольтметра, фиксирующего разность температур сплава и окружающей среды. Измерения продолжить в течение 10 мин. Данные занести в ТАБЛ. 1.
Зависимость ε = f(τ) изображена на РИС. 2. I – область полного расплава
II – область кристаллизации
III – область охлаждения твёрдого тела
τ= τ2 – τ1 – время кристаллизации.
8.Получив 40-50 экспериментальных точек, выключить вольтметр.
Рис. 2
3. Обработка результатов измерений
Данные установки
Масса сплава Мс = …

6
Масса ампулы Ма = … Теплоемкость сплава Сс = …
Теплоемкость материала ампулы Са = … Температура окружающей среды tс = …
Термо-ЭДС εс, соответствующая температуре окружающей среды Тс, берётся из
ПРИЛОЖЕНИЯ.
Таблица 1
|
№ п/п |
τ ,с |
ε, мВ |
t, °C |
Т, К |
Т – Тс = θ, К |
ln θ |
|
1 |
||||||
|
2 |
||||||
|
3 |
||||||
|
. |
||||||
|
. |
||||||
|
. |
1. Величину λк и S2 – S1 при кристаллизации сплава можно определить графической обработкой экспериментальных данных.
Математическая обработка данных
Согласно принятой модели, процесс охлаждения твердого сплава от точки полной кристаллизации описывается уравнением (6), решение которого
где θ = T – Tc; θк = Tк – Tc;
m
,
(10)
Дифференцируя (10) по τ и подставляя значение τ = τ2 (τ2 – время конца кристаллизации), получим
Коэффициент m называется темпом охлаждения и характеризует относительную скорость изменения температуры тела. Темп охлаждения можно определить из линейной зависимости, полученной логарифмированием функции (10):
lnθ lnθк m τ
Для этого строится график зависимости ln θ =
деляется m (см. раздел «ГРАФИЧЕСКАЯ ОБРАБОТКА
Из (7), (9), (10), (12) следует
f(τ τ2) и по наклону графика опре-
РЕЗУЛЬТАТОВ»).
|
λ (С М |
С М ) |
τ mθ , |
(13) |
||||||||
|
к |
с с |
а |
а |
М |
к |
||||||
|
с |
|||||||||||
|
S |
S |
(С М С |
М ) |
τ mθ . |
(14) |
||||||
|
2 |
1 |
с |
с |
а |
а |
T |
к |
||||
|
к |

7
Графическая обработка результатов
1) По полученным данным построить график зависимости ε = f(τ) и найти время кристаллизации сплава τ τ2 τ1 (см. РИС. 2).
2) Измерить по лабораторному термометру температуру окружающей среды – воздуха tc и по ПРИЛОЖЕНИЮ соответствующее ей значение термо-ЭДС εс хромелькопелевой термопары.
3) Прибавляя к каждому измеренному значению εi величину εс, найти по ПРИЛОЖЕНИЮ температуру сплава ti в процессе охлаждения в соответствующие моменты времени.
4)Найти θi = ti – tc и построить график зависимости ln θ = f(τ – τ2) для участка III (см. РИС. 2), определить θ = tк – tc.
5)Провести «среднюю» прямую через экспериментальные точки и найти тангенс угла наклона этой прямой
где θ0 и τ0 – выбранные на графике значения разности температур и времени в конце опыта.
6) Рассчитать удельную теплоту кристаллизации по формуле
|
λ |
(С М С М ) |
τ(lnθ lnθ ) |
θ |
(C M C M )m |
θ |
τ |
|||||
|
0 |
к |
||||||||||
|
к |
с с |
а |
а |
M (τ |
τ) |
к |
c c |
a |
a |
M |
|
|
c 0 |
с |
7) Рассчитать изменение энтропии по формуле
.
(16)
|
S2 S1 |
λ М |
. |
|||
|
к |
с |
||||
|
Т |
|||||
|
к |
2. Рассчитать погрешность измерения λк из формулы
|
λ |
2 |
С |
2 |
М |
2 |
М |
2 |
С |
2 |
С |
2 |
М |
2 |
М |
2 |
С |
2 |
|||||||||||
|
2 |
а |
|||||||||||||||||||||||||||
|
к |
с |
с |
с |
с |
а |
а |
а |
|||||||||||||||||||||
|
λ |
(С |
с |
М |
с |
С |
М |
а |
) |
||||||||||||||||||||
|
к |
а |
|||||||||||||||||||||||||||
|
θ |
2 |
Δ(Δτ) |
2 |
М |
2 |
m |
2 |
|||||||||||||||||||||
|
к |
с |
. |
||||||||||||||||||||||||||
|
θ |
τ |
М |
с |
m |
||||||||||||||||||||||||
|
к |
При расчёте погрешности
λк λк
можно пренебречь несущественными слагаемыми.
|
Считая, что относительные погрешности величин Сс, |
Мс, Са, Ма, τ, θк значительно |
|
меньше относительной погрешности величины λк, |
последнюю определить по |
|
формуле |
λк |
m |
, погрешность m найти из графика (РИС. 3): |
|||||||||||
|
m |
||||||||||||||
|
λ |
||||||||||||||
|
к |
||||||||||||||
|
m m m |
y |
y |
xy |
x |
y . |
|||||||||
|
x |
x |
x(x x) |
x2 |
|||||||||||
|
1 2 |
x |

8
Рис. 3 3. Записать окончательный результат в виде
λк λк λ .
Контрольные вопросы
1.Записать первый закон термодинамики для процесса кристаллизации.
2.Как изменяется энтропия в процессе кристаллизации?
3.Записать закон сохранения энергии для процесса кристаллизации олова (сплава).
4.Получить формулу для расчёта теплоты кристаллизации олова (сплава).
5.Каким уравнением описывается процесс охлаждения твёрдого олова (сплава)?
6.Как проводится графическая обработка результатов эксперимента?
7.Для чего в работе используется милливольтметр?
8.Как находят время кристаллизации олова (сплава)?
Приложение
Градуировочная характеристика хромель-копелевой термопары (по СТ СЭВ 1059-78)
|
t, °C |
Термоэлектродвижущая сила, мВ |
||||||||||
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
||
|
0 |
0,000 |
0,064 |
0,128 |
0,192 |
0,256 |
0,331 |
0,386 |
0,451 |
0,516 |
0,581 |
|
|
10 |
0,646 |
0,711 |
0,776 |
0,841 |
0,307 |
0,973 |
1,039 |
1,105 |
1,171 |
1,237 |
|
|
20 |
1,303 |
1,360 |
1,437 |
1,504 |
1,571 |
1,638 |
1,705 |
1,772 |
1,840 |
1,908 |
|
|
30 |
1,976 |
2,044 |
2,112 |
2,108 |
2,248 |
2,316 |
2,384 |
2,452 |
2,520 |
2,589 |
|
|
40 |
2,658 |
2,727 |
2,796 |
2,965 |
2,934 |
3,003 |
3,073 |
3,141 |
3,210 |
3,280 |
|
|
50 |
3,350 |
3,420 |
3,490 |
3,560 |
3,630 |
3,700 |
3,770 |
3,840 |
3,910 |
3,983 |
|
|
60 |
4,050 |
4,121 |
4,192 |
4,263 |
4,334 |
4,405 |
4,476 |
4,547 |
4,618 |
4,689 |
|
|
70 |
4,780 |
4,831 |
4,920 |
4.973 |
5,544 |
5,115 |
5,186 |
5,257 |
5,327 |
5,398 |
|
|
80 |
5,469 |
5,540 |
5,611 |
5,682 |
5,753 |
5,824 |
5,895 |
5,966 |
6,037 |
6,108 |
|
|
90 |
6,179 |
6,250 |
6,322 |
6,394 |
6,466 |
6,538 |
6,610 |
6,682 |
6,574 |
6,526 |
|
|
100 |
6,898 |
6,970 |
7,043 |
7,116 |
7,180 |
7,262 |
7,335 |
7,408 |
7,481 |
6,554 |
|
|
110 |
7,627 |
7,700 |
7,774 |
7,848 |
7,922 |
7,996 |
8,070 |
8,144 |
8,218 |
8,292 |
|
|
120 |
8,366 |
8,440 |
8,515 |
8,590 |
8,665 |
8,740 |
8,815 |
8,890 |
8,965 |
9,040 |
|
|
130 |
9,115 |
9,190 |
9,265 |
9,430 |
9,150 |
9,470 |
9,565 |
9,640 |
9,715 |
9,790 |
|
|
140 |
9,865 |
9,940 |
10,016 |
10,092 |
10,168 |
10,244 |
10,320 |
10,396 |
10,472 |
10,548 |
|
|
150 |
10,624 |
10,700 |
10,777 |
10,854 |
10,931 |
11,008 |
11,085 |
11,162 |
11,239 |
11,316 |
|
|
160 |
11,393 |
11,470 |
11,548 |
11,626 |
11,704 |
11,782 |
11,860 |
11,938 |
12,016 |
12,094 |
|
|
170 |
12,172 |
12,250 |
12,229 |
12,408 |
12,487 |
12,566 |
12,645 |
12,724 |
12,803 |
12,882 |
|
|
180 |
12,961 |
13,040 |
13,120 |
13,200 |
13,280 |
13,360 |
13,440 |
13,520 |
13,600 |
13,680 |
Соседние файлы в папке I семестр
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Плавление и кристаллизация:
При теплопередаче внутренняя энергия тела изменяется. Чаще всего это выражается в изменении его температуры. При этом агрегатное состояние вещества остается прежним. Однако существуют процессы, при которых внутренняя энергия вещества при получении теплоты увеличивается, а температура остается постоянной.
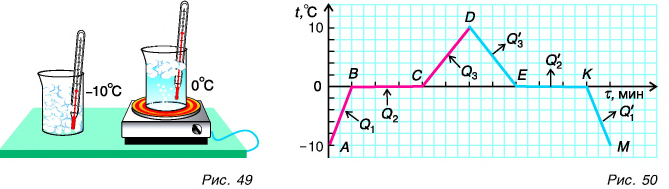
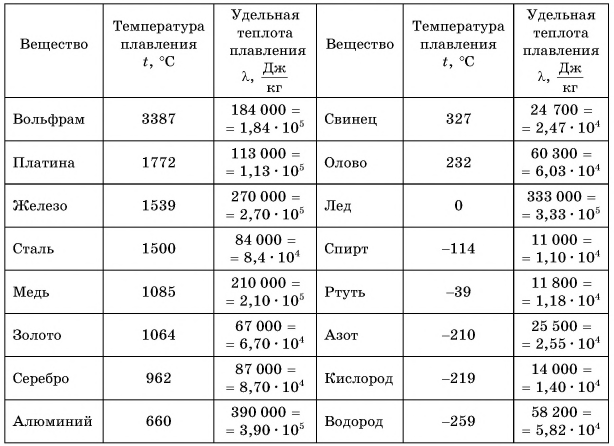
К таким процессам относятся плавление и кристаллизация (отвердевание). Изучим эти процессы с помощью опыта. В стакан поместим кусочки льда из морозильной камеры, охлажденные до температуры, например, -10 °C. Вставим в стакан термометр и начнем нагревать (рис. 49). Температура льда повышается. Он нагревается. Внутренняя энергия льда увеличивается за счет кинетической энергии его молекул. Изменение температуры вещества в стакане с течением времени будем изображать на графике (рис. 50). Участок АВ соответствует нагреванию льда от -10 °C до 0 °C. При дальнейшей передаче льду теплоты его температура остается постоянной, равной 0 °C (участок ВС). На что же уходит получаемая льдом теплота? Наблюдения показывают, что кристаллический лед превращается в воду.
Процесс перехода вещества из твердого состояния в жидкое называется плавлением.
Получаемая от плитки теплота по-прежнему превращается во внутреннюю энергию вещества, увеличивая ее. Это увеличение связано с изменением потенциальной энергии взаимодействия частиц при разрушении кристалла. Кинетическая же энергия не изменяется, так как температура постоянна. Аналогично идет процесс плавления других кристаллических веществ: железа, меди, стали и т. д.
Температура, при которой вещество переходит из твердого состояния в жидкое, т. е. плавится, называется температурой плавления.
Температура плавления у разных кристаллических веществ неодинакова (табл. 3). Она очень высокая у вольфрама и очень низкая у водорода.
Таблица 3. Температура плавления и удельная теплота плавления некоторых веществ (при нормальном атмосферном давлении)
Продолжим опыт. Как только весь лед расплавится, температура воды в стакане начнет возрастать (участок CD, см. рис. 50). На всех рассмотренных участках теплота веществом (льдом, водой) поглощалась.
А теперь снимем стакан с плитки, поставим в морозильную камеру и будем периодически наблюдать за показаниями термометра и состоянием вещества. Вода сначала охлаждается до 0 °C (участок DE). Ее внутренняя энергия уменьшается, теплота 
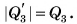
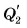
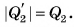
Процесс перехода вещества из жидкого состояния в твердое называется кристаллизацией.
Обратите внимание, что температура плавления и температура кристаллизации одинаковы. Например, если олово плавится при температуре 232 °C (см. табл. 3), то и отвердевать оно будет при температуре 232 °C.
Для любознательных:
В таблице 3 даны температуры плавления веществ при нормальном атмосферном давлении. И это не случайно. Для большинства веществ с увеличением давления температура плавления увеличивается. Но для льда — наоборот: при повышении давления лед может плавиться, например, при температуре -5 °C.
Понятия «температура плавления» и «температура кристаллизации» применимы не ко всем веществам. Согрев рукой кусок холодного твердого пластилина, мы ощутим постепенное уменьшение его твердости. Нагревая пластилин далее, можно перевести его в состояние вязкой жидкости. Но мы не обнаружим определенной температуры плавления. То же самое происходит при нагревании стекла: наблюдается непрерывное уменьшение его твердости (рис. 51) и увеличение текучести. Причина такого поведения указанных веществ (их называют аморфными) в отсутствии в их строении упорядоченного расположения частиц.
Понятия «температура плавления» и «температура кристаллизации» применимы лишь к веществам, имеющим кристаллическое строение.
Температуру плавления приходится учитывать при создании бытовой и промышленной техники. Спирали лампочек, нагревательных элементов (рис. 52) делают из тугоплавких материалов. В самолетостроении, в ракетной и космической промышленности используют материалы с высокой температурой плавления. Объясните причину этого.
Температуру плавления одних веществ можно изменить, смешивая их с другими. Так, добавляя поваренную соль ко льду, можно получить смесь с температурой плавления -21 °C. Это свойство активно используют дорожные службы, посыпая зимой улицы смесью песка и соли.
- Заказать решение задач по физике
Главные выводы:
- Для перехода кристаллического вещества из твердого состояния в жидкое его необходимо нагреть до температуры плавления.
- В процессах плавления и кристаллизации температура вещества не изменяется.
- Температуры плавления и кристаллизации для данного вещества одинаковы.
- При плавлении вещество поглощает энергию, при кристаллизации столько же энергии выделяется.
Удельная теплота плавления и кристаллизации
Как определить количество теплоты, которое должно поглотить твердое кристаллическое тело массой т, чтобы перейти в жидкое состояние, т. е. расплавиться? Еще раз обращаем ваше внимание на то, что температура во время плавления не изменяется (см. рис. 50, участок ВС), но теплота телу сообщается. Значит, она идет на разрушение кристаллической упорядоченной структуры вещества тела.
Физическая величина, численно равная количеству теплоты, которое необходимо передать твердому телу массой 1 кг при температуре плавления для перехода в жидкое состояние, называется удельной теплотой плавления.
Удельная теплота плавления обозначается греческой буквой 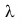
Чтобы расплавить твердое тело массой 2 кг, ему надо передать энергии (теплоты) Q в 2 раза больше. А если масса тела равна m? Очевидно, для перехода в жидкое состояние тело должно получить теплоты Q в m раз больше, т. е.
Из этой формулы следует, что удельная теплота плавления определяется как
В СИ единицей удельной теплоты плавления является 1 джоуль на килограмм
У различных веществ удельная теплота плавления 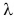
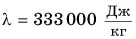
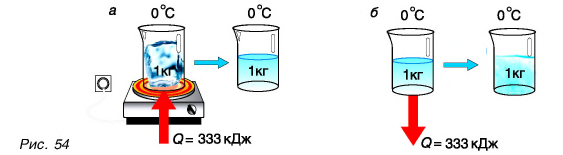
Большая удельная теплота плавления объясняет затяжное таяние льда озер, рек и других водоемов. А так как теплоту лед поглощает из окружающей среды, то погода в это время, как правило, прохладная. И наоборот, при замерзании озер, рек и других водоемов (рис. 55) выделяется большое количество энергии, что делает более теплой позднюю осеннюю погоду, а климат вблизи морей и океанов более умеренным.
Главные выводы:
- При переходе 1 кг вещества из твердого состояния в жидкое поглощается количество теплоты, численно равное удельной теплоте плавления, и ровно столько же теплоты выделяется при его переходе из жидкого состояния в твердое.
- Температуры плавления и кристаллизации для данного вещества одинаковы.
- Удельная теплота плавления у разных веществ различная.
Пример решения задачи
В горячую воду температурой 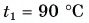
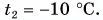
Дано:
Решение:
Составим уравнение теплового баланса: 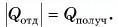
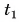
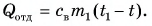
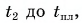
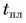
Тогда
откуда
Ответ: 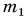
- Испарение жидкостей в физике
- Поверхностное натяжение жидкости
- Свойства паров в физике
- Кипение жидкостей в физике
- Инфракрасные излучения
- Количество теплоты в физике
- Расчет количества теплоты при нагревании и охлаждении
- Удельная теплота сгорания топлива
График плавления и отвердевания тела показывает нам
все этапы процесса. Из него мы можем извлечь информацию о температуре плавления
тела, например, о том, как долго это тело потребовалось нагревать, чтобы
достичь той или иной температуры. Для понимания того, как строятся подобные
графики, рассмотрим некоторые примеры.
На рисунке представлен график плавления и отвердевания
железа.
В начальный момент времени, температура была равна
1200 оС, и пока она не достигла 1539 оС, плавление не
началось. Молекулы сохраняли свой порядок, что характерно для твёрдого тела. По
достижении температуры плавления, порядок нарушается, поскольку тело переходит
в жидкое состояние. Его температура какое-то время остаётся постоянной, о чем
свидетельствует горизонтальный участок графика. После того, как железо
полностью расплавилось, температура снова начала увеличиваться. Порядок
полностью нарушился, поскольку этот участок графика соответствует периоду,
когда железо было полностью жидким. Достигнув отметки 1880 оС,
железо перестали нагревать, и температура начала падать. Достигнув температуры
кристаллизации, железо начало твердеть. Это заняло какое-то время, в течение
которого температура вновь не менялась, начал восстанавливаться порядок. После
этого, температура стала ниже температуры отвердевания, и железо вновь стало
полностью твёрдым, а порядок молекул восстановился. Этому соответствует
последний участок графика.
Упаржнения.
1. Построить график
плавления олова. Температура плавления составляет 232 оС, а
начальная температура 200 оС. За 5 мин олово достигнет температуры
плавления, и ещё 5 мин будет плавиться. 2,5 мин занимает нагревание олова от
температуры плавления до 250 оС, и столько же займет охлаждение до
232 оС.
Итак, возьмём 20 оС за одну клетку по
вертикали и 2,5 мин за одну клетку по горизонтали. Тогда первая точка будет
иметь координаты 0 минут и 200 градусов, а вторая — 5 минут и 232 градуса.
Соединим эти две точки. В этой точке начинается плавление длительностью 5
минут. Температура не меняется, поэтому координаты третьей точки будет 10 минут
и 232 градуса. После этого, олово нагревается до 250 градусов за 2,5 минуты,
поэтому координаты четвёртой точки будут 12,5 минут и 250 градусов. Это точка
является пиком графика, поскольку в этот момент олово достигло наивысшей
температуры. Дальше график симметричен, поэтому абсолютно аналогичным способом
достраиваем и вторую часть графика.
Для построения этого графика мы использовали некую
начальную информацию о теле. Значит, из готового графика можно извлечь
информацию.
2. На рисунке представлен график
плавления и отвердевания для какого-то вещества.
И нам надо найти ответы на вопросы:
— Какой самой высокой температуры достигло вещество?
Итак, смотрим на график. Вертикальная ось
соответствует температуре, следовательно, наивысшая температура соответствует
пику графика. Это 1250 оС.
— Какова температура плавления данного вещества?
Температуре плавления соответствуют горизонтальные
участки графика, поскольку температура остаётся неизменной во время плавления
или кристаллизации. На графике видно, что горизонтальные участки соответствуют
температуре 1000 оС, поэтому, это и есть температура плавления.
— Сколько времени заняло плавление, и сколько времени
заняла кристаллизация?
На графике мы видим, что по горизонтальной оси,
соответствующей времени между отметкой 0 и отметкой 40 — две клетки. Длина
горизонтальных отрезков тоже составляет две клетки. Поэтому, и плавление, и
кристаллизация заняли по 40 минут.
— Какова скорость нагревания данного вещества в
твердом состоянии, и какова скорость нагревания в жидком состоянии?
По вертикальной оси расстояние между отметкой 1000 и
отметкой 1250 — одна клетка. Следовательно, расстояние в две клетки
соответствует пятистам градусам. Тогда, в начальный момент времени, температура
составляла 500 градусов. Мы видим на графике, что температура достигла
температуры плавления за 40 минут. Поэтому, скорость нагревания в твердом
состоянии равна 500 оС за 40 минут, т.е. 12,5 оС/мин.
На графике видно, что вещество в жидком состоянии
нагрелось от 1000 оС до 1250 оС. По горизонтальной оси,
длина этого процесса соответствует одной клетке, а, значит, двадцати минутам,
т.к. 40 минут — это две клетки. Значит, скорость нагревания в жидком состоянии
равна 250 оС за 20 минут, т.е. 12,5 оС/мин.
Следует помнить о том, что нагревание вещества в
твердом состоянии на самом деле может происходить не с той же скоростью, что и
нагревание вещества в жидком состоянии. Да и зависимость скорости нагревания
или остывания от температуры может быть нелинейной. Несмотря на это, даже из
такого графика можно извлечь, некоторую информацию.
Данный график предполагает достаточно сложные математические
операции для подробного анализа, с которыми мы познакомимся намного позже.
Однако, у нас достаточно знаний, чтобы ответить на следующие вопросы:
— Какая максимальная температура была достигнута
данным веществом?
Опять же, обращаемся к самой высокой точке. Она
соответствует 450 оС.
Держалась ли в какой-нибудь момент времени постоянная
температура свыше 315 оС?
Постоянной температуре будет соответствовать
горизонтальный участок графика. На данном графике, такой участок только один.
Исходя из того, что отметка 450 оС находится на расстоянии 3 клетки
от нулевой отметки по оси температуры, одна клетка соответствует 150 оС,
а 2 клетки — 300 оС. Мы видим, что наш горизонтальный участок
находится ниже отметки оС градусов, следовательно, температура выше
315 оС не держалась.
— Определите, нагревалось тело или остывало в первые
12 минут?
Одна клетка по горизонтальной оси соответствует 20
минутам. Мы видим, что на промежутке, более длительном, чем 12 минут,
температура увеличивалась с течением времени. Следовательно, тело нагревалось.
Определите среднюю скорость нагревания в период с 40
до 100 минут.
Итак, отмечаем на графике интервал от 40 до 100 минут.
Мы видим, что в этот период температура менялась по какому-то сложному закону.
Однако, мы знаем, что бы ни происходило в этот период, температура возросла от
150 оС до 450 оС за 60 минут. Поэтому, в среднем, тело
нагревалось со скоростью 300 оС в час или 5 оС в минуту.
При построении графиков помните, что очень важно
соблюдать масштабирование, т.е. равные интервалы, относящиеся к одной и той же
величине, обозначать равным количеством клеток.
«Плавление и кристаллизация.
Удельная теплота плавления»
Плавление
Плавление — это процесс превращения вещества из твёрдого состояния в жидкое.
Наблюдения показывают, что если измельчённый лёд, имеющий, например, температуру –10 °С, оставить в тёплой комнате, то его температура будет повышаться. При 0 °С лёд начнет таять, а температура при этом не будет изменяться до тех пор, пока весь лёд не превратится в жидкость. После этого температура образовавшейся изо льда воды будет повышаться.
Это означает, что кристаллические тела, к которым относится и лед, плавятся при определённой температуре, которую называют температурой плавления. Важно, что во время процесса плавления температура кристаллического вещества и образовавшейся в процессе его плавления жидкости остаётся неизменной.
В описанном выше опыте лёд получал некоторое количество теплоты, его внутренняя энергия увеличивалась за счёт увеличения средней кинетической энергии движения молекул. Затем лёд плавился, его температура при этом не менялась, хотя лёд получал некоторое количество теплоты. Следовательно, его внутренняя энергия увеличивалась, но не за счёт кинетической, а за счёт потенциальной энергии взаимодействия молекул. Получаемая извне энергия расходуется на разрушение кристаллической решетки. Подобным образом происходит плавление любого кристаллического тела.
Аморфные тела не имеют определённой температуры плавления. При повышении температуры они постепенно размягчаются, пока не превратятся в жидкость.
Кристаллизация
Кристаллизация — это процесс перехода вещества из жидкого состояния в твёрдое состояние. Охлаждаясь, жидкость будет отдавать некоторое количество теплоты окружающему воздуху. При этом будет уменьшаться её внутренняя энергия за счёт уменьшения средней кинетической энергии его молекул. При определённой температуре начнётся процесс кристаллизации, во время этого процесса температура вещества не будет изменяться, пока всё вещество не перейдет в твёрдое состояние. Этот переход сопровождается выделением определённого количества теплоты и соответственно уменьшением внутренней энергии вещества за счёт уменьшения потенциальной энергии взаимодействия его молекул.
Таким образом, переход вещества из жидкого состояния в твёрдое состояние происходит при определённой температуре, называемой температурой кристаллизации. Эта температура остаётся неизменной в течение всего процесса плавления. Она равна температуре плавления этого вещества.
На рисунке приведён график зависимости температуры твёрдого кристаллического вещества от времени в процессе его нагревания от комнатной температуры до температуры плавления, плавления, нагревания вещества в жидком состоянии, охлаждения жидкого вещества, кристаллизации и последующего охлаждения вещества в твёрдом состоянии.
Удельная теплота плавления
Различные кристаллические вещества имеют разное строение. Соответственно, для того, чтобы разрушить кристаллическую решётку твёрдого тела при температуре его плавления, необходимо ему сообщить разное количество теплоты.
Удельная теплота плавления — это количество теплоты, которое необходимо сообщить 1 кг кристаллического вещества, чтобы превратить его в жидкость при температуре плавления. Опыт показывает, что удельная теплота плавления равна удельной теплоте кристаллизации.
Удельная теплота плавления обозначается буквой λ. Единица удельной теплоты плавления — [λ] = 1 Дж/кг.
Значения удельной теплоты плавления кристаллических веществ приведены в таблице. Удельная теплота плавления алюминия 3,9*105 Дж/кг. Это означает, что для плавления 1 кг алюминия при температуре плавления необходимо затратить количество теплоты 3,9*105 Дж. Этому же значению равно увеличение внутренней энергии 1 кг алюминия.
Чтобы вычислить количество теплоты Q, необходимое для плавления вещества массой m, взятого при температуре плавления, следует удельную теплоту плавления λ умножить на массу вещества: Q = λm.
Эта же формула используется при вычислении количества теплоты, выделяющегося при кристаллизации жидкости.
Конспект урока «Плавление и кристаллизация. Удельная теплота плавления».
Следующая тема: «Тепловые машины. ДВС. Удельная теплота сгорания топлива».
Время – кристаллизация
Cтраница 1
Время кристаллизации определяется количеством жидкой фазы. Применив правило отрезков, вы убедитесь, что в выбранном варианте оно не самое большое.
[1]
Время кристаллизации определяется количеством жидкой фазы, а оно к моменту образования эвтектики во всех сплавах различно.
[2]
Время кристаллизации определяется количеством жидкой фазы. Применив правило отрезков, вы убедитесь, что в выбранном варианте оно не самое большое.
[3]
Времена кристаллизации при этом оцениваются в сотни лет. Разработан ряд способов произ-ва металлич.
[4]
Время кристаллизации для обоих образцов составляло 6 – 8 час. Для обоих образцов дебаеграммы практически идентичны с дебаеграммой натриевой формы цеолита 4А фнцшы Линде ( см. стр.
[5]
Время кристаллизации выбирается таким образом, чтобы процесс протекал в основном при выбранной температуре.
[7]
Время кристаллизации дигидрата в превращении П – Г при содержании в фосфорнокислом растворе как 3 % MgO, так и 2 молей S03 на 1 моль СаО в растворе, здесь также совершенно снималось, и отрезок, характеризующий время собственно превращения в новую фазу – дигидрат, располагался вертикально.
[8]
Во время кристаллизации увеличивается среднее время оседлой жизни молекул жидкости ( 11.1.6.8), упорядочивается их движение, которое постепенно превращается в тепловые колебания около некоторых средних положений – узлов кристаллической решетки. Кристаллизация единичной массы жидкости сопровождается выделением некоторого количества теплоты – удельной теплоты кристаллизации, – равной удельной теплоте плавления.
[9]
Во время кристаллизации из тротила выделяются примеси. Распределяются они на поверхности кристаллов чистого а-изомера, а поэтому становятся более доступными действию сульфита. Если нарушить пра-ъильность кристаллизации резким охлаждением или неравномерным перемешиванием в различные периоды кристаллизации, то могут образоваться сростки кристаллов или гранулы. Внутри этих сростков и гранул кристаллы тротила будут недоступны для промывки раствором сульфита, что снизит качество тротила н приведет к получению некондиционного продукта. Даже если в лучшем случае гранулы образуются после воздействия сульфита на примеси, они все же могут явиться причиной выхо – ia некондиционного продукта, так как при этом будут внутри содержать маточный раствор сульфита, не поддающийся промывке водой на воронке.
[10]
Во время кристаллизации жидкость перемешивают во избежание образования кристаллических корок. Кристаллическую кашицу отсасывают на фильтре с пористой стеклянной пластинкой и несколько раз промывают соляной кислотой, охлажденной льдом. Вторичный фильтрат упаривают на водяной бане до 1 / 4 объема и из него, насыщая газообразным НС1, получают третью фракцию кристаллов.
[11]
Во время кристаллизации количество растворителя ( воды) в жидкой фазе не изменяется.
[12]
Во время кристаллизации жидкость перемешивают во избежание образования кристаллических корок. Кристаллическую кашицу отсасывают на фильтре с пористой стеклянной пластинкой и несколько раз промывают соляной кислотой, охлажденной льдом. Фильтрат насыщают ( под тягой) газообразным НС1 при охлаждении смесью льда и соли и получают вторую фракцию кристаллов HSbCle. Вторичный фильтрат упаривают на водяной бане до 1 / 4 объема и из него, насыщая газообразным НС1, получают третью фракцию кристаллов.
[13]
Во время кристаллизации в твердую фазу выделяется только главный компонент.
[14]
За время кристаллизации структура поверхностного слоя меняется слабо, т.е. доля объемного зародышеобразования твердых фаз стали мала по сравнению с процессами роста отдельных блоков и субзерен. Времена полного затвердевания соответственно уменьшаются с 30 до 10 мс.
[15]
Страницы:
1
2
3
4