Unit Converter
Enter the mass of the ice and the power delivered to the ice per second to determine the total time to melt the ice.
- Freezing Point Depression Calculator
- Freezing Point Calculator
- Annealing Temperature Calculator
- Heat Absorption Calculator
- Dry Ice Calculator
- Water Freeze Time Calculator
Ice Melting Time Formula
The following formula is used to estimate the amount of time it takes to melt ice.
- Where T is the total time (seconds)
- HoF is the heat of fusion of ice (335,000 J/kg)
- m is the mass of the ice (kg)
- P is the power delivered to the ice over time (Watts = Joules / Second)
In the case of this formula, it assumes the power or heat transferred per time is exactly constant. In real-world scenarios, this would not hold up as accurately.
How much time does it take to melt ice?
The amount of time it takes to melt ice depends on the size of the ice and the amount of heat being transferred to the ice per unit time.
The larger the ice cube, the longer it will take to melt.
The quicker the heat transfer, or greater the heat differential, the faster the ice will melt.
How to calculate ice melt time?
Example Problem:
The following example problem outlines the steps needed to calculate an ice cube melt time.
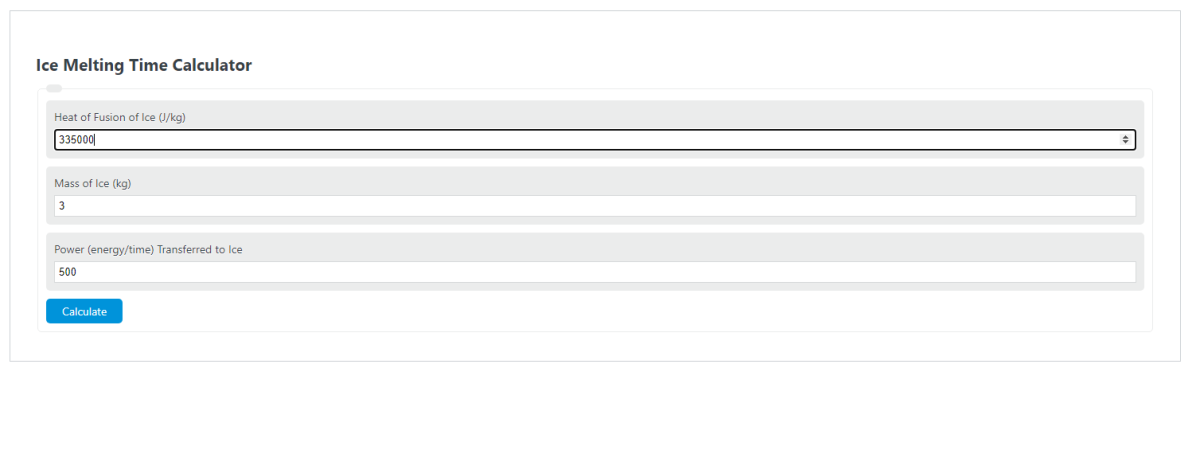
First, determine the heat of the fusion of ice. This is the amount of energy it takes for ice to change forms from ice to liquid per unit of mass. This is always a constant 335/kJ/kg = 335,000 J/kg.
Next, determine the mass of the ice cube. In this example, the mass of the ice cube is 3 kg.
Next, determine the power that will be transferred to the ice cube over time. In this case, the power transferred is 500 watts = 500 Joules/Second.
Finally, calculate the amount of time required to melt the ice cube using the formula above:
T = HoF * m / P
T = 335,000 * 3 / 500
T = 2010 seconds
|
|
Время плавления льда
|
|
20/06/16 |
Здравствуйте Ситуация у меня ну совсем грустная – не думал, что настолько туп, что не смогу решить задачу определения времени таяния льда Есть брусок льда находящийся в коробке из термоизолированного картона. Изначально воздух в коробке и за её пределами 293 К (20 С). Лёд изначально при температуре 261 К (- 12 С). Пока стенки льда нагревались до 273 К (0 С) я все чудесно посчитал – численное решение дифференциальных уравнений в пакете Flow Simulation. А дальше оказалось, что это не совсем простая задача. Flow Simulation фазовые переходы не считает и я пробовал решать в COMSOL Multiphisics. Но в COMSOL я возможности решить именно эту задачу пока не вижу – там есть близкие, но не такая: https://www.comsol.com/model/download/2 … change.pdf https://www.comsol.com/model/tin-melting-front-6234 https://www.comsol.com/model/continuous-casting-382 https://www.comsol.com/model/cooling-an … etal-12701 В общем все упирается в задачу Стефана – приходится рассматривать “слойку” из трех фаз – лёд-вода-воздух. Мне необходимо посчитать во времени динамику температурного поля и время таяния льда в том числе. Пробовал искать решение в ANSYS но пока тоже глухо: http://cccp3d.ru/index.php?app=core&mod … h_id=41814 https://www.google.com.ua/url?sa=t&rct= … hNrJh4NjkA Остановился на таком решении: взять время за которое лёд нагрелся от 261 К (-12 С) до 273 К (0 С) и количество тепла которое отдал лед за это время – эти данные у меня есть по расчетам в Flow Simulation, а потом для времени фазового перехода когда работает энтальпия сделать как советуют здесь: http://ivandriver.blogspot.com/2014/01/blog-post_2.html Время за которое лед нагревается до температуры плавления в моем случае достаточно большое (более 2-х суток) поэтому среднее значение “теплопроводности” воздуха и коробки ИМХО можно взять за рабочее. У кого какие мысли и кто какие материалы может посоветовать ?
|
|
|
|
|
GraNiNi |
Re: Время плавления льда
|
|
01/04/08 |
Попробуйте так. Также допустим, что форма куска льда и его наружная поверхность, воспринимающая тепловой поток, при плавлении остается неизменной. Поделив этот поток на теплоту плавления – узнаем скорость плавления льда. Но фактически, вокруг льда будет образовываться слой воды, который будет уменьшать начальный коэффициент теплопередачи, что также можно попытаться учесть.
|
|
|
|
|
Entomo |
Re: Время плавления льда
|
|
20/06/16 |
Попробуйте так. Поделив этот поток на теплоту плавления узнаем скорость плавления льда. Спасибо. Ну мне кажется это то, что я и имел ввиду в конце своего спича которым открыл данную тему и то на что я собрался опираться с учетом последней моей ссылки выше на русскоязычный блог. Также допустим, что форма куска льда и его наружная поверхность, воспринимающая тепловой поток, при плавлении остается неизменной. Но фактически, вокруг льда будет образовываться слой воды, который будет уменьшать начальный коэффициент теплопередачи, что также можно попытаться учесть. Ну да – ничего не остается делать как упрощать задачу. Но согласитесь это далеко от точного решения задачи Стефана. Честно говоря никогда не думал, что обыденная задача по таянию льда может быть столь сложной: http://www.scienceforum.ru/2014/482/2505 Цитата: Аналитический подход при решении краевых задач теплообмена в системах со свободными границами относится к числу труднейших проблем в современной аналитической теории математической физики. Вследствие зависимости положения характеристического раздела области от времени к этому классу задач неприменимы классические методы дифференциальных уравнений в частных производных, так как оставаясь в рамках этих методов, не удается согласовать решение уравнения теплопроводности с движением границы фазового перехода. Имеется целый ряд аналитических и численных методов решения указанных задач. Но формулы распределения температурных полей, полученные этими методами, носят весьма приближенный характер, или же, как это наиболее типично для задач подобного рода, дают неопределенность решения в начальный момент времени.
|
|
|
|
|
GraNiNi |
Re: Время плавления льда
|
|
01/04/08 |
Какой получился расчетный коэффициент теплопередачи?
|
|
|
|
|
Entomo |
Re: Время плавления льда
|
|
20/06/16 |
Какой получился расчетный коэффициент теплопередачи? Я ещё не считал – у меня на домашнем компе Flow Simulation не установлен – завтра на работе посчитаю. Однако я нашел обнадеживающие фрагменты вот в этом опусе: http://www.scienceforum.ru/2014/482/2505 Цитата: Ко времени 1200 с (кривая 20) стержень полностью находится В общем-то я намедни пытался считать по такой схеме, но меня смутили некоторые временные характеристики – я брал температуру воды 0,1 С а не как в примере по ссылке 80 С и у меня температура в начале стержня длиной 5 см вырастала весьма быстро (за полчаса) с – 5 С до температуры таяния. Что-то это у меня вызывает сомнение. Может потому что задачу я брал из руководства COMSOL одномерную. Если попробовать трехмерную может дольше плавиться будет
|
|
|
|
|
Munin |
Re: Время плавления льда
|
||
30/01/06 |
За время плавления, вода будет или стекать со льда, или лёд будет всплывать в воде, или вода будет просачиваться в окружающий картон – в общем, “слоя воды” не будет.
|
||
|
|
|||
|
amon |
Re: Время плавления льда
|
||
04/09/14 |
“слоя воды” не будет. Угу. А еще будет меняться форма (“срезаться” углы). На Comsol’e это, наверно, моделируется, но готового, скорее всего, ничего нет.
|
||
|
|
|||
|
Munin |
Re: Время плавления льда
|
||
30/01/06 |
Может, можно по шагам? Оценить тепловой поток, из него – изменение размера и формы, потом на следующем шаге снова…
|
||
|
|
|||
|
amon |
Re: Время плавления льда
|
||
04/09/14 |
Видимо, только так и можно, но при этом надо на каждом шаге пересчитывать границу, а это – некоторый геморрой.
|
||
|
|
|||
|
Entomo |
Re: Время плавления льда
|
|
20/06/16 |
|
|
|
|
|
GraNiNi |
Re: Время плавления льда
|
|
01/04/08 |
Однако я нашел обнадеживающие фрагменты вот в этом опусе: http://www.scienceforum.ru/2014/482/2505 К этой студенческой работе нет особого доверия. На рис. 12 графики №2 и №3 – распределение температуры в стержне через 15 и 30 сек. Время прогрева ограничено 180 сек, так как далее будет только жидкая вода, что уже не интересно, хоть в студенческой работе на это отведено целых 14 совершенно бесполезных графиков. Вот здесь моделирование этой задачи в ELCUT – распределение температуры в стержне через 30 сек после начала прогрева.
А здесь – изменение температуры во времени на холодном (дальнем) конце стержня и в его середине (верхний график).
|
|
|
|
|
Munin |
Re: Время плавления льда
|
||
30/01/06 |
Так что, ELCUT умеет решать задачу Стефана?
|
||
|
|
|||
|
GraNiNi |
Re: Время плавления льда
|
|
01/04/08 |
Так что, ELCUT умеет решать задачу Стефана? Нет, напрямую фазовые переходы не решает, но скачкообразные изменения физических параметров – теплопроводности, теплоемкости – от изменения температуры в ходе прогрева – можно завести.
|
|
|
|
|
Entomo |
Re: Время плавления льда
|
|
20/06/16 |
… …Очевидно, они считают… хоть в студенческой работе … Я никоим образом не умаляю доли самостоятельной работы студента, но… если Вы откроете эту задачу на сайте COMSOL (а ссылку не эту же задачу на сайте COMSOL я дал в первом посте этой темы), то увидите… в общем увидите то, что Вы там увидите… не больше и не меньше. А вопрос Мунина об ELCUT и задаче Стефана считаю очень вовремя заданным… присоединяюсь к вопросу — 21.06.2016, 19:16 — Нет, напрямую фазовые переходы не решает, но скачкообразные изменения физических параметров – теплопроводности, теплоемкости – от изменения температуры в ходе прогрева – можно завести. Пусть Мунин как грамотный физик меня поправит, но ИМХО “скачкообразные изменения теплоёмкости” в простонародье именуются фазовыми переходами II рода. Ну а меня интересует фазовый переход I рода. Какая мне польза от ELCUT если она плавление не решает ?
|
|
|
|
|
GraNiNi |
Re: Время плавления льда
|
|
01/04/08 |
если Вы откроете эту задачу на сайте COMSOL (а ссылку не эту же задачу на сайте COMSOL я дал в первом посте этой темы), то увидите. Да, здесь, как говорят – две большие разницы – все как и должно быть. Приношу свои извинения за скептицизм, непонятно только, чем обусловлены ляпы в русскоязычном варианте.
|
|
|
|
Модераторы: photon, whiterussian, profrotter, Jnrty, Aer, Парджеттер, Eule_A, Супермодераторы
Плавлением в физике называют переход вещества из твердого состояния в жидкое. Классическими примерами процесса плавления являются таяние льда и превращение твердого куска олова в жидкий припой при нагревании паяльником. Передача телу определенного количества тепла приводит к изменению его агрегатного состояния.
Изменение внутренней энергии и температуры при плавлении
Так на что же уходит энергия, которую мы сообщаем телу, при плавлении?
Вы знаете, что в кристаллических твердых телах атомы (или молекулы) расположены в строгом порядке (рисунок 1). Они не двигаются так активно, как в газах или жидкостях. Тем не менее, они также находятся в тепловом движении – колеблются.
Взгляните еще раз на график плавления и отвердевания льда (рисунок 2).
Нагревание льда идет на участке AB. В это время увеличивается средняя скорость движения его молекул. Значит, возрастает и их средняя кинетическая энергия и температура. Размах колебаний атомов (или молекул) увеличивается.
Так происходит то того момента, пока нагреваемое тело не достигнет температуры плавления.
При температуре плавления нарушается порядок в расположении частиц в кристаллах.
Так вещество начинает переход из твердого состояния в жидкое.
Значит, энергия, которую получает тело после достижения температуры плавления, расходуется на разрушение кристаллической решетки. Поэтому температура тела не повышается – участок графика BC.
Почему твердое становится жидким?
Нагревание твердого тела приводит к увеличению кинетической энергии атомов и молекул, которые при нормальной температуре находятся четко в узлах кристаллической решетки, что и позволяет телу сохранять постоянные форму и размеры. При достижении некоторых критических значений скоростей атомы и молекулы начинают покидать свои места, происходит разрыв связей, тело начинает терять свою форму — становится жидким. Процесс плавление происходит не резким скачком, а постепенно, так, что некоторое время твердая и жидкая компоненты (фазы) находятся в равновесии. Плавление относится к эндотермическим процессам, то есть к таким которые происходят с поглощением теплоты. Противоположный процесс, когда жидкость затвердевает называется кристаллизацией.
Было обнаружено, что до окончания процесса плавления температура не изменяется, хотя тепло все время поступает. Никакого противоречия здесь нет, так как поступающая энергия в этот период времени уходит на разрыв кристаллических связей решетки. После разрушения всех связей приток тепла будет повышать кинетическую энергию молекул, а следовательно, температура начнет расти.
Изменение внутренней энергии и температуры при отвердевании
При отвердевании происходит обратное.
Средняя скорость движения молекул и их средняя кинетическая энергия в жидкости (расплавленном веществе) уменьшается при охлаждении. Этому соответствует участок графика DE на рисунке 2.
Теперь силы притяжения между молекулами могут удерживать их друг около друга. Расположение частиц становится упорядоченным – образуется кристалл (участок графика EF).
Куда расходуется энергия, которая выделяется при кристаллизации? Температура тела остается постоянной во время этого процесса. Значит, энергия расходуется на поддержание этой температуры, пока тело полностью не отвердеет.
Теперь мы можем сказать, что
При температуре плавления внутренняя энергия вещества в жидком состоянии больше внутренней энергии такой же массы вещества в твёрдом состоянии.
Эта избыточная энергия выделяется при кристаллизации и поддерживает температуру тела на одном уровне во время всего процесса отвердевания.
Общая информация
Правильное понимание удельного значения теплоты плавления невозможно без изучения ключевых особенностей самого процесса расплавки. И при плавлении, и при кристаллизации какого-либо вещества его внутренняя энергия изменяется. При первом процессе она возрастает, так как он неизменно сопровождается нагреванием — главным условием для увеличения энергии. Температура же при расплавке остается неизменной. В определенном смысле это парадоксально, ведь внутренняя энергия может характеризоваться температурой.
Однако увеличению энергии при неизменной температуре существует весьма простое и логичное объяснение. Во время процесса расплавки разрушается пространственная решетка кристаллического тела, на это уходит вся энергия. Разрушение кристаллической решетки требует расходования определенного количества энергии со стороны какого-либо внешнего источника. Как следствие, в ходе процесса расплавки происходит увеличение внутренней энергии тела.
В процессе отвердевания тела или, иначе говоря, кристаллизации, напротив, происходит уменьшение его внутренней энергии, так как оно отдает тепло телам, которые его окружают. Отвердевание (кристаллизация) — это обратный процесс по отношению к расплавке. Молекулы вещества образуют общую (единую) систему, и в ходе этого объединения отдаваемая составляющими вещества избыточная энергия поглощается внешней средой.
Основные сведения о теплоте плавления
По закону сохранения энергии тело поглощает в ходе плавления и отдает во время отвердевания (при необходимой для каждого из этих процессов температуре) равное количество тепла.
Теплотой плавления называют количество теплоты, которое необходимо для того, чтобы физическое тело при температуре плавления перешло в жидкое состояние из твердого. Это тепловое явление — частный случай фазового перехода в термодинамике.
На теплоту расплавки влияют масса плавящегося вещества, а также свойства, которыми оно обладает и которые для него характерны. Эта связь между теплотой расплавки физического тела и родом вещества, выражающаяся через зависимость первого от второго, измеряется удельной величиной.
Для плавления вещества требуется такое же количество тепла, которое выделяется при кристаллизации, поэтому определение удельного значения теплоты существует в двух равнозначных понятиях — для плавления и для кристаллизации. У этой величины есть и альтернативное наименование — энтальпия плавления.
Особенности измерения
Экспериментальным путем ученые-физики установили, что для перевода одного и того же вещества в жидкое из твердого состояния требуется разное количество теплоты. Затем исследователями-экспериментаторами было принято решение сравнить эти показатели при одинаковой массе вещества. Так появилось понятие удельной величины.
Согласно ее упрощенному определению, она показывает соотношение теплоты плавления тела из определенного вещества и его массы. Этот показатель считается главной характеристикой как для плавления, так и для кристаллизации.
Единицей измерения этой величины, согласно Международной системе единиц, считается Дж/кг (джоуль на килограмм). Обозначается удельный показатель буквой лямбда (реже встречается прочтение как ламбда) из греческого алфавита (аналог кириллической буквы «л»).
Находят удельную теплоту плавления по формуле: лямбда = Q/m, где Q — это обозначение количества теплоты, которое вещество получило при плавлении или выделило в процессе кристаллизации, а m — масса вещества (плавящегося или кристаллизующегося). Отсутствие температурного показателя в размерности обусловлено тем, что температура не меняется ни при плавлении, ни при кристаллизации.
Удельная величина при расплавке всегда положительна, а при кристаллизации — отрицательна. Исключение из этого правила существует (или, вернее, известно науке) только единственное — это химический элемент системы Менделеева под названием гелий, находящийся под высоким давлением. Он при расплавке отрицателен.
Чтобы перевести вещество в размере одного килограмма из твердого состояния в жидкое, нужно нагреть его до температуры плавления и подвести к нему теплоту в количестве, равном удельному показателю. В процессе кристаллизации одного килограмма вещества тепло выделяется ровно в том же количестве.
Для нахождения количества теплоты, необходимого для расплавки или кристаллизации вещества при соответствующих температурах, нужно удельную величину умножить на массу вещества. Для кристаллизующихся тел этот показатель будет со знаком минус, то есть отрицательным. Это связано с тем, что в процессе отвердевания все тепло теряется — выделяется не сохраняясь.
Сравнительная таблица
Таблица с удельной теплотой плавления некоторых веществ и химических элементов (вещества в таблице расположены не в алфавитном порядке, а по уменьшению их удельного показателя):
| Название вещества или элемента | Удельный показатель теплоты плавления в кДж/кг |
| Алюминий | 390 |
| Лед | 330 |
| Железо | 277 |
| Медь | 213 |
| Нафталин | 151 |
| Парафин | 150 |
| Эфир | 113 |
| Цинк | 112 |
| Серебро | 105 |
| Платина | 101 |
| Серый чугун | 100 |
| Сталь | 83 |
| Золото | 66 |
| Олово | 61 |
| Свинец | 25 |
| Белый чугун | 14 |
| Ртуть | 12 |
Удельные величины для этих веществ считаются табличными (постоянными и известными) значениями, поэтому производить расчеты для их поиска нет никакой необходимости.
Удельная теплота плавления
Опытным путем доказано, что для превращения твердых кристаллических тел одинаковой массы в жидкость необходимо разное количество теплоты. Тела при этом рассматриваются при их температурах плавления.
Удельная теплота плавления – это физическая величина, показывающая, какое количество теплоты необходимо сообщить кристаллическому телу массой $1 space кг$, чтобы при температуре плавления полностью перевести его в жидкое состояние.
- обозначается буквой $lambda$
- единица измерения – $1 frac{Дж}{кг}$
Тематические задания
Изучение тепловых явлений и их особенностей, к числу которых относится и удельная теплота, входит в школьную программу по физике для старших классов. Для проверки усвоения пройденного материала используются тематические задачи.
Задания на нахождение удельной теплоты парообразования помимо обычных текстовых условий в большинстве случаев сопровождаются графиками, отображающими температурные изменения, которые происходили с веществом по мере поглощения им теплоты.
Но графические задачи — не самые интересные. В число наиболее занимательных заданий входят такие:
- Кусок льда, размещавшийся в температуре -90 градусов Цельсия, начали нагревать посредством подведения к нему тепловой мощности постоянного типа. По прошествии 63 секунд от начала нагревания лед достиг температуры, необходимой для плавления. Требуется найти время в секундах, которое займет процесс плавления льда от момента его достижения нужного нагрева при условии, что потери теплоты нет. Ответ: 110 секунд.
- Кусок свинца, пребывавший в температуре +27,5 градуса Цельсия, путем подведения к нему постоянной тепловой мощности начали нагревать. Спустя 39 секунд после начала нагревания температура свинца достигла уровня плавления (+327,5 градуса Цельсия). Нужно определить продолжительность процесса плавления свинца в секундах от этого момента, с учетом отсутствия тепловых потерь. Ответ: 25 секунд.
Сравнение ответов этих задач позволяет оценить разницу между удельными величинами плавления льда и свинца. У первого она очень большая, а у второго, наоборот, маленькая. Это неудивительно — количество теплоты, нужное для плавления, напрямую зависит от свойств и характеристик вещества, в частности — от энергии связей, соединяющих частицы этого вещества между собой.
Роль большой удельной величины, которой обладает лед, неоценима как для природы, так и для человечества. Если бы этот показатель был меньше, то по весне все льды и снега растаяли, что обернулось бы ужасными последствиями. Потоки воды, образовавшиеся в результате такого таяния, смыли бы все на своем пути.
К счастью, ледяные и снежные массы не способны растаять за несколько мгновений. Физические свойства этих веществ лишний раз доказывают, что природа — гениальный и неподражаемый творец.
Удельная теплота плавления некоторых веществ
В таблице 1 представлены экспериментально полученные величины удельной теплоты плавления для некоторых веществ.
| Вещество | $lambda, frac{Дж}{кг}$ | Вещество | $lambda, frac{Дж}{кг}$ |
| Алюминий | $8.9 cdot 10^5$ | Сталь | $0.84 cdot 10^5$ |
| Лёд | $3.4 cdot 10^5$ | Золото | $0.67 cdot 10^5$ |
| Железо | $2.7 cdot 10^5$ | Водород | $0.59 cdot 10^5$ |
| Медь | $2.1 cdot 10^5$ | Олово | $0.59 cdot 10^5$ |
| Парафин | $1.5 cdot 10^5$ | Свинец | $0.25 cdot 10^5$ |
| Спирт | $1.1 cdot 10^5$ | Кислород | $0.14 cdot 10^5$ |
| Серебро | $0.87 cdot 10^5$ | Ртуть | $0.12 cdot 10^5$ |
Таблица 1. Удельная теплота плавления некоторых веществ (при нормальном атмосферном давлении)
Удельная теплота плавления золота составляет $0.67 cdot 10^5 frac{Дж}{кг}$. Что это означает?
Для того, чтобы расплавить кусок золота массой $1 space кг$, взятого при температуре $1064 degree C$ (температура плавления золота), до жидкого состояния, нам потребуется затратить $0.67 cdot 10^5 space Дж$ энергии.
Опытным путём доказано, что
при отвердевании кристаллического вещества выделяется точно такое же количество теплоты, которое поглощается при его плавлении.
То есть, при кристаллизации расплавленного золота массой $1 space кг$ выделится $0.67 cdot 10^5 space Дж$ энергии.
Кипение
Кипение — это парообразование, происходящее по всему объёму жидкости.
Кипение оказывается возможным потому, что в жидкости всегда растворено какое-то количество воздуха, попавшего туда в результате диффузии. При нагревании жидкости этот воздух расширяется, пузырьки воздуха постепенно увеличиваются в размерах и становятся видимы невооружённым глазом (в кастрюле с водой они осаждают дно и стенки). Внутри воздушных пузырьков находится насыщенный пар, давление которого, как вы помните, быстро растёт с повышением температуры.
Чем крупнее становятся пузырьки, тем большая действует на них архимедова сила, и определённого момента начинается отрыв и всплытие пузырьков. Поднимаясь вверх, пузырьки попадают в менее нагретые слои жидкости; пар в них конденсируется, и пузырьки сжимаются опять. Схлопывание пузырьков вызывает знакомый нам шум, предшествующий закипанию чайника. Наконец, с течением времени вся жидкость равномерно прогревается, пузырьки достигают поверхности и лопаются, выбрасывая наружу воздух и пар — шум сменяется бульканьем, жидкость кипит.
Пузырьки, таким образом, служат «проводниками» пара изнутри жидкости на её поверхность. При кипении наряду с обычным испарением идёт превращение жидкости в пар по всему объёму — испарение внутрь воздушных пузырьков с последующим выводом пара наружу. Вот почему кипящая жидкость улетучивается очень быстро: чайник, из которого вода испарялась бы много дней, выкипит за полчаса.
В отличие от испарения, происходящего при любой температуре, жидкость начинает кипеть только при достижении температуры кипения — именно той температуры, при которой пузырьки воздуха оказываются в состоянии всплыть и добраться до поверхности. При температуре кипения давление насыщенного пара становится равно внешнему давлению на жидкость (в частности, атмосферному давлению). Соответственно, чем больше внешнее давление, тем при более высокой температуре начнётся кипение.
При нормальном атмосферном давлении ( атм или Па) температура кипения воды равна . Поэтому давление насыщенного водяного пара при температуре равно Па. Этот факт необходимо знать для решения задач — часто он считается известным по умолчанию.
На вершине Эльбруса атмосферное давление равно атм, и вода там закипит при температуре . А под давлением атм вода начнёт кипеть только при .
Температура кипения (при нормальном атмосферном давлении) является строго определённой для данной жидкости величиной (температуры кипения, приводимые в таблицах учебников и справочников — это температуры кипения химически чистых жидкостей. Наличие в жидкости примесей может изменять температуру кипения. Скажем, водопроводная вода содержит растворённый хлор и некоторые соли, поэтому её температура кипения при нормальном атмосферном давлении может несколько отличаться от ). Так, спирт кипит при , эфир — при , ртуть — при . Обратите внимание: чем более летучей является жидкость, тем ниже её температура кипения. В таблице температур кипения мы видим также, что кислород кипит при . Значит, при обычных температурах кислород — это газ!
Мы знаем, что если чайник снять с огня, то кипение тут же прекратится — процесс кипения требует непрерывного подвода тепла. Вместе с тем, температура воды в чайнике после закипания перестаёт меняться, всё время оставаясь равной . Куда же при этом девается подводимое тепло?
Ситуация аналогична процессу плавления: тепло идёт на увеличение потенциальной энергии молекул. В данном случае — на совершение работы по удалению молекул на такие расстояния, что силы притяжения окажутся неспособными удерживать молекулы неподалёку друг от друга, и жидкость будет переходить в газообразное состояние.
Расчет количества теплоты, необходимого для плавления или отвердевания вещества
Чтобы вычислить количество теплоты $Q$, необходимое для плавления кристаллического тела массой $m$, взятого при его температуре плавления и нормальном атмосферном давлении, нужно удельную теплоту плавления $lambda$ умножить на массу тела $m$: $Q = lambda m$.
Мы можем выразить из этой формулы массу $m$ и удельную теплоту плавления $lambda$:
$m = frac{Q}{lambda}$, $lambda = frac{Q}{m}$.
Количество теплоты, которое выделится при отвердевании, рассчитывается по этой же формуле. Но при этом необходимо помнить, что внутренняя энергия тела будет уменьшаться.
Родственные величины
Так называемые удельные показатели существуют для характеристики не только плавления и кристаллизации. В физической науке помимо этих процессов удельными величинами теплоты характеризуются:
- парообразование;
- конденсация;
- теплоемкость.
Удельный показатель теплоты парообразования и конденсации отображает объем теплоты, необходимый для обращения единицы массы жидкости в пар и наоборот. Формула этой величины: Q/m. Таким образом, по сути, это то же самое, что и энтальпия расплавки и кристаллизации.
Что касается удельной теплоемкости, то это показатель соотношения теплоемкости и массы вещества. Он равен объему теплоты, передача которого единичной массе вещества необходима для изменения его температуры на один градус.
Особенности
Наряду с великим разнообразием известных металлов рассматриваемый элемент имеет относительно небольшую тепловую емкость при средней степени подогрева. Величина в отношении стали соответствует 440 – 550 Дж/(кг · град), чугуна – 370 – 550 Джоулей/(кг · градус), никеля – 440 Дж/(кг · град).
Отдельное внимание стоит уделить тому, что показатели тяжелых металлических компонентов не имеют высокого значения. А потому знаменитые физики выявили следующую зависимость: чем выше плотность, тем меньше коэффициент теплоты.
Чем характеризуется теплота?
Теплообмен подразумевает увеличение внутренней энергии одних тел и ее уменьшение у других тел. Все это сопровождается отсутствием изменения механических действий и совершения работы. Однако внутренняя энергия нагревающего предмета снижается, а нагреваемого тела – повышается.
Как говорилось, процесс теплообмена обуславливается величиной тепла. Данное понятие обозначает изменение внутренней энергии предмета, которое происходит в конце теплообмена. Для расчета зачастую применяется физическая единица, называемая калорией.
Калория равняется объему тепла, нужного для нагревания грамма воды на 1° по Цельсию. Исследователи выяснили, что для этого следует выполнить работу, соответствующую 4,18 Дж. Это означает, что калория равна 4,18 Джоулей.
Так как теплота равняется изменению энергии внутри предмета, нужно сказать, что c отображает, насколько изменяется энергия одного кг предмета при его нагреве.
Виды теплопередачи
- Теплопередача — это физический процесс передачи тепловой энергии от более нагретого тела к менее нагретому.
Здесь все совсем несложно, их всего три: теплопроводность, конвекция и излучение.
Теплопроводность
Тот вид теплопередачи, который можно охарактеризовать, как способность тел проводить энергию от более нагретого тела к менее нагретому.
Речь о том, чтобы передать тепло с помощью соприкосновения. Признавайтесь, грелись же когда-нибудь возле батареи. Если вы сидели к ней вплотную, то согрелись вы благодаря теплопроводности. Обниматься с котиком, у которого горячее пузо, тоже эффективно.
Порой мы немного перебарщиваем с возможностями этого эффекта, когда на пляже ложимся на горячий песок. Эффект есть, только не очень приятный. Ну а ледяная грелка на лбу дает обратный эффект — ваш лоб отдает тепло грелке.
Конвекция
Когда мы говорили о теплопроводности, мы приводили в пример батарею. Теплопроводность — это когда мы получаем тепло, прикоснувшись к батарее. Но все вещи в комнате к батарее не прикасаются, а комната греется. Здесь вступает конвекция.
Дело в том, что холодный воздух тяжелее горячего (холодный просто плотнее). Когда батарея нагревает некий объем воздуха, он тут же поднимается наверх, проходит вдоль потолка, успевает остыть и спуститься обратно вниз — к батарее, где снова нагревается. Таким образом, вся комната равномерно прогревается, потому что все более горячие потоки сменяют все менее холодные.
Излучение
Пляж мы уже упоминали, но речь шла только о горячем песочке. А вот тепло от солнышка — это излучение. В этом случае тепло передается через волны.
Если мы греемся у камина, то получаем тепло конвекцией или излучением?











