Возможные степени окисления элементов
Перед тем как начать писать окислительно-восстановительные реакции, необходимо знать какие степени окисления может проявлять тот или иной химический элемент. Рассмотрим степени окисления, знание которых необходимо для успешной сдачи ЕГЭ.
Элементы с постоянными степенями окисления в сложных соединениях:
| Степень окисления | Элементы | Примеры соединений | Названия соединений |
|---|---|---|---|
| -1 | F | NaF OF2 |
Фторид натрия Фторид кислорода |
| +1 | Все металлы 1-ой группы главной подгруппы (Li-Fr) | Na2O KH |
Оксид натрия Гирид калия |
| +2 | Все металлы 2-ой группы главной подгруппы (Be-Ra), а также Zn и Cd | BeO CaH2 |
Оксид бериллия Гидрид кальция |
| +3 | Al | Al2O3 Al(OH)3 Al2(SO4)3 |
Оксид алюминия Гидроксид алюминия Сульфат алюминия |
Элементы с переменными степенями окисления:
1. Водород
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | H2 | Водород (простое вещество) | В твердом состоянии, как и все газы, образует молекулярную кристаллическую решетку |
| +1 | H2O H2O2 H2SO4 KOH NaHSO3 |
Вода Пероксид водорода Серная кислота Гидроксид калия Гидросульфит натрия |
В таких соединениях, как вода, пероксид водорода, все кислоты, основания, кислые соли, все органические соединения |
| -1 | NaH CaH2 |
Гидрид натрия Гидрид кальция |
Только с металлами водород может проявлять степень окисления -1 |
2. Кислород
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | O2 | Кислород (простое вещество) | В твердом состоянии, как и все газы, образует молекулярную кристаллическую решетку |
| -2 | H2O Na2O H2SO4 KOH NaHSO3 |
Вода Оксид натрия Серная кислота Гидроксид калия Гидросульфит натрия |
В таких соединениях, как вода, все оксиды, кислоты, основания, кислые соли, все органические соединения |
| -1 | H2O2 Na2O2 BaO2 |
Пероксид водорода Пероксид натрия Пероксид бария |
В пероксиде водорода и всех других пероксидах |
| -1/2 | KO2 | Супероксид калия (надпероксид калия) |
Во всех супероксидах |
| -1/3 | KO3 Sr(O3)2 |
Озонид калия Озонид стронция |
Во всех озонидах |
| +1 | O2F2 | Дифторид кислорода |
Положительные степени окисления кислород проявляет только в соединениях с фтором |
| +2 | OF2 | Фторид кислорода |
3. Сера
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | S8 | Сера | Светло-желтый порошок; нерастворим в воде, тяжелее её, но в воде не тонет, плавает на её поверхности, так как ею не смачивается. Молекулы S8 образуют молекулярную кристаллическую решетку. Сера существует в виде нескольких аллотропных модификаций: ромбическая, моноклинная, пластическая. |
| -2 | H2S CaS |
Сероводородная кислота Сульфид кальция |
Все сульфиды |
| -1 | FeS2 | Персульфид железа (II) (пирит, серный колчедан, железный колчедан) |
Единственное соединение со ст. ок. -1 |
| +4 | SO2 H2SO3 CaSO3 |
Оксид серы (IV) Сернистая кислота Сульфит кальция |
В таких соединениях как оксид серы (IV), сернистой кислоте и всех её солях |
| +6 | SO3 H2SO4 CaSO4 |
Оксид серы (VI) Серная кислота Сульфат кальция |
В таких соединениях как оксид серы (VI), серной кислоте и всех её солях |
4. Азот
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | N2 | Азот (простое вещество) | В твердом состоянии, как и все газы, образует молекулярную кристаллическую решетку |
| -3 | NH3 Na3N Ca3N2 |
Аммиак Нитрид натрия Нитрид кальция |
В таких соединениях, как аммиак и все нитриды |
| -2 | N2H4 | Гидразин | Степени окисления -2 и -1 встречаются только в органических соединениях |
| -1 | NH2OH | Гидроксиламин | |
| +1 | N2O | Оксид азота (I) | Азот проявляет положительные степени окисления только в соединениях с кислородом и фтором |
| +2 | NO | Оксид азота (II) | |
| +3 | N2O3 HNO2 NF3 |
Оксид азота (III) Азотистая кислота Фторид азота (III) |
В таких соединениях, как оксид азота (III), азотистой кислоте и всех её солях, фториде азота (III) |
| +4 | NO2 | Оксид азота (IV) | Смешанный оксид азота (IV) |
| +5 | N2O5 HNO3 |
Оксид азота (V) Азотная кислота |
В таких соединениях, как оксид азота (V), азотной кислоте и всех её солях |
5. Галогены*
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | F2 Cl2 Br2 I2 |
Фтор Хлор Бром Йод |
Светло-зеленый газ Желто-зеленый газ Темно-красная жидкость Серо-черные кристаллы |
| -1 | HF HCl HBr HI |
Фтороводород (соли кислоты: фториды) Хлороводород (соли кислоты: хлориды) Бромоводород (соли кислоты: бромиды) Йодоводород (соли кислоты: йодиды) |
Бесцветные ядовитые газы. При растворении в воде образуют соответствующие кислоты. |
| +1 | HClO HBrO HIO |
Хлорноватистая кислота (соли: гипохлориты) Бромноватистая кислота (соли: гипобромиты) Йодноватистая кислота (соли: гипоиодиты) |
В приведенных кислотах, а также всех их солях |
| +3 | HClO2 HBrO2 HIO2 |
Хлористая кислота (соли: хлориты) Бромистая кислота (соли: бромиты) Йодистая кислота (соли: иодиты) |
В приведенных кислотах, а также всех их солях |
| +5 | HClO3 HBrO3 HIO3 |
Хлорноватая кислота (соли: хлораты) Бромноватая кислота (соли: броматы) Йодноватая кислота (соли: иодаты) |
В приведенных кислотах, а также всех их солях |
| +7 | HClO4 HBrO4 HIO4 |
Хлорная кислота (соли: перхлораты) Бромная кислота (соли: перброматы) Йодная кислота (соли: периодаты) |
В приведенных кислотах, а также всех их солях |
* Для фтора только 0 и -1; At также является галогеном, но его не рассматриваем, так как в природе его практически нет.
6. Углерод**
| Степень окисления | Примеры соединений | Названия соединений | Комментарий |
|---|---|---|---|
| 0 | C | Углерод | Аллотропные модификации: алмаз, графит, карбин (черный порошок, полимерные цепи -C=C-, =С=С=), фуллерены (темные, похожие на сажу, C60-C200) |
| +2 | CO | Оксид углерода (II) (угарный газ) |
В таких соединениях как CO, а также в некоторых органических соединениях |
| +4 | CO2
H2CO3 |
Оксид углерода (IV) (углекислый газ) Угольная кислота |
В таких соединениях как оксид углерода (IV), угольная кислота и все ее соли |
** В органических соединениях углерод проявляет все степени окисления от -4 (например, CH4) до +3 (например, CH3COOH).
7. Фосфор
| Степень окисления | Примеры соединений | Названия соединений | Тип соединения | Комментарий |
|---|---|---|---|---|
| 0 | P | Фосфор | Неметалл | В природе в свободном состоянии не встречается. Наиболее устойчивые аллотропные модификации: белый фосфор (P4, молекулярная кристаллическая решетка), красный и черный фосфор (атомные кристаллические решетки) |
| -3 | PH3 | Фосфин | Летучее водородное соединение | Бесцветный ядовитый газ с запахом чеснока |
| +1 | H3PO2 NaH2PO2 |
Фосфорноватистая кислота Гипофосфит натрия |
Кислота Средняя соль |
Только в кислоте и ее солях |
| +3 | P2O3 H3PO3 Na2HPO3 |
Оксид фосфора (III) Фосфористая кислота Фосфит натрия |
Кислотный оксид Кислота Средняя соль |
В таких соединениях, как оксид фосфора (III), фосфористая кислота и все её соли |
| +5 | P2O5 H3PO4 Na3PO4 |
Оксид фосфора (V) (Орто)фосфорная кислота Фосфат натрия |
Кислотный оксид Кислота Средняя соль |
В таких соединениях, как оксид фосфора (V), фосфорная кислота и все её соли |
8. Хром
| Степень окисления | Примеры соединений | Названия соединений | Тип соединения | Комментарий |
|---|---|---|---|---|
| 0 | Cr | Хром | Металл | Голубовато-белый металл. В обычных условиях покрыт оксидной пленкой и поэтому инертен по отношению к кислороду воздуха и воде. |
| +2 | CrO Cr(OH)2 |
Оксид хрома (II) Гидроксид хрома (II) |
Основный оксид Нерастворимое основание |
Нестабильная степень окисления, сильные восстановители |
| +3 | Cr2O3 Cr(OH)3 H3CrO3 HCrO2 NaCrO2 |
Оксид хрома (III) Гидроксид хрома (III) Хромистая кислота (соли: хромиты) Метахромистая кислота (соли: (мета)хромиты) Метахромит натрия Гексагидроксохромат (III) натрия |
Амфотерный оксид Амфотерный гидроксид Кислота Кислота Средняя соль |
Степень окисления стабильная, проявляется в оксиде, гидроксиде, хромитах и гидроксокомплексах с хромом |
| +6 | CrO3 H2CrO4 H2Cr2O7 |
Оксид хрома (VI) Хромовая кислота (соли: хроматы, желтые) Дихромовая кислота (соли: дихроматы, оранжевые) |
Кислотный оксид Кислота Кислота |
Степень окисления стабильная (соединения являются сильными окислителями) проявляется в оксиде, кислотах (хромовой, дихромовой) и их солях |
9. Железо
| Степень окисления | Примеры соединений | Названия соединений | Тип соединения | Комментарий |
|---|---|---|---|---|
| 0 | Fe | Железо | Металл | Серебристо-белый, блестящий металл |
| +2 | FeO Fe(OH)2 |
Оксид железа (II) Гидроксид железа (II) |
Основный оксид Нерастворимое основание |
Оксид черного цвета Гидроксид серо-зеленого цвета |
| +3 | Fe2O3 Fe(OH)3 HFeO2 KFeO2 K3[Fe(OH)6] |
Оксид железа (III) Гидроксид железа (III) Железистая кислота Феррит калия Гексагидроксоферрат (III) калия |
Амфотерный оксид Амфотерный гидроксид Кислота Средняя соль Гидроксокомплекс |
Оксид и гидроксид бурого цвета (цвет ржавчины) |
| +6 | K2FeO4 | Феррат калия | Средняя соль | Кислота H2FeO4 как индивидуальное вещество не выделена |
10. Медь
| Степень окисления | Примеры соединений | Названия соединений | Тип соединения | Комментарий |
|---|---|---|---|---|
| 0 | Cu | Медь | Металл | Розово-красный, пластичный металл |
| +1 | Cu2O CuOH |
Оксид меди (I) Гидроксид меди (I) |
Основный оксид |
Кирпично-красного цвета |
| +2 | CuO Cu(OH)2 |
Оксид меди (II) Гидроксид меди (II) |
Основный оксид Нерастворимое основание |
Оксид черного цвета Гидроксид голубого цвета |
11. Марганец
| Степень окисления | Примеры соединений | Названия соединений | Тип соединения | Комментарий |
|---|---|---|---|---|
| 0 | Mn | Марганец | Металл | Металл серебристо-белого цвета |
| +2 | MnO Mn(OH)2 |
Оксид марганца (II) Гидроксид марганца (II) |
Основный оксид Нерастворимое основание |
Оксид зеленого цвета Основание светло-розового цвета |
| +3 | Mn2O3 | Оксид марганца (III) | Амфотерный оксид | Коричнево-чёрные кристаллы, не растворимые в воде |
| +4 | MnO2 | Оксид марганца (IV) | Амфотерный оксид | Порошок тёмно-коричневого цвета, нерастворимый в воде |
| +6 | MnO3 K2MnO4 |
Оксид марганца (VI) Манганат калия |
Кислотный оксид Средняя соль |
Оксид тёмно-красного цвета Соль темно-зеленого цвета |
| +7 | Mn2O7 HMnO4 KMnO4 |
Оксид марганца (VII) Марганцовая кислота Перманганат калия |
Кислотный оксид Кислота Средняя соль |
Красная маслянистая жидкость Кислота и соль фиолетово-красного цвета |
12. Кремний
| Степень окисления | Примеры соединений | Названия соединений | Тип соединения | Комментарий |
|---|---|---|---|---|
| 0 | Si | Кремний | Неметалл | Две аллотропные модификации: кристаллический (серый) и аморфный (белый порошок) |
| -4 | Mg2Si | Силицид магния | Бинарное соединение | Темно-синие кристаллы (Mg2Si). Ст. окисления -4 в соединениях кремния с металлами |
| +2 | SiO | Оксид кремния (II) | Несолеобразующий оксид | Смолоподобное аморфное вещество |
| +4 |
SiO2 SiC |
Оксид кремния (IV) Силан Карборунд |
Кислотный оксид Летучее водородное соединение Бинарное соединение |
Кремнезём (SiO2) Бесцветный неустойчивый газ (SiH4) Кристаллическое вещество (SiC) Степень окисления +4 в соединениях кремния с неметалами |
Таблица окисления химических элементов


4.7
Средняя оценка: 4.7
Всего получено оценок: 558.
4.7
Средняя оценка: 4.7
Всего получено оценок: 558.
Чтобы определить условный заряд атомов в окислительно-восстановительных реакциях, используют таблицу окисления химических элементов. В зависимости от свойств атома элемент может проявлять положительную или отрицательную степень окисления.
Что такое степень окисления
Условный заряд атомов элементов в сложных веществах называется степенью окисления. Значение заряда атомов записывается в окислительно-восстановительных реакциях, чтобы понять, какой элемент является восстановителем, а какой – окислителем.
Степень окисления взаимосвязана с электроотрицательностью, которая показывает возможность атомов принимать или отдавать электроны. Чем выше значение электроотрицательности, тем больше способность атома отнимать электроны в реакциях.

Степень окисления может иметь три значения:
- нулевое – атом находится в состоянии покоя (все простые вещества имеют степень окисления 0);
- положительное – атом отдаёт электроны и является восстановителем (все металлы, некоторые неметаллы);
- отрицательное – атом принимает электроны и является окислителем (большинство неметаллов).
Например, степени окисления в реакции натрия с хлором выглядят следующим образом:
2Na0 + Cl20 → 2Na+1Cl-1
В реакции металлов с неметаллами металл всегда является восстановителем, а неметалл – окислителем.
Как определить
Существует таблица, в которой указаны все возможные степени окисления элементов.
|
Название |
Символ |
Степень окисления |
|
Водород |
H |
+1, -1 |
|
Гелий |
He |
0 |
|
Литий |
Li |
+1 |
|
Бериллий |
Be |
+2 |
|
Бор |
B |
-1, 0, +1, +2, +3 |
|
Углерод |
C |
-4, -3, -2, -1, 0, +2, +4 |
|
Азот |
N |
-3, -2, -1, 0, +1, +2, +3, +4, +5 |
|
Кислород |
O |
-2, -1, 0, +1, +2 |
|
Фтор |
F |
-1 |
|
Неон |
Ne |
0 |
|
Натрий |
Na |
+1 |
|
Магний |
Mg |
+2 |
|
Алюминий |
Al |
+3 |
|
Кремний |
Si |
-4, 0, +2, +4 |
|
Фосфор |
P |
3, 0, +3, +5 |
|
Сера |
S |
2, 0, +4, +6 |
|
Хлор |
Cl |
1, 0, +1, +3, +5, +7, редко +2 и +4 |
|
Аргон |
Ar |
0 |
|
Калий |
K |
+1 |
|
Кальций |
Ca |
+2 |
|
Скандий |
Sc |
+3 |
|
Титан |
Ti |
+2, +3, +4 |
|
Ванадий |
V |
+2, +3, +4, +5 |
|
Хром |
Cr |
+2, +3, +6 |
|
Марганец |
Mn |
+2, +3, +4, +6, +7 |
|
Железо |
Fe |
+2, +3, редко +4 и +6 |
|
Кобальт |
Co |
+2, +3, редко +4 |
|
Никель |
Ni |
+2, редко +1, +3, +4 |
|
Медь |
Cu |
+1, +2, редко +3 |
|
Цинк |
Zn |
+2 |
|
Галлий |
Ga |
+3, редко +2 |
|
Германий |
Ge |
-4, +2, +4 |
|
Мышьяк |
As |
-3, +3, +5, редко +2 |
|
Селен |
Se |
-2, +4, +6, редко +2 |
|
Бром |
Br |
-1, +1, +5, редко +3, +4 |
|
Криптон |
Kr |
0 |
|
Рубидий |
Rb |
+1 |
|
Стронций |
Sr |
+2 |
|
Иттрий |
Y |
+3 |
|
Цирконий |
Zr |
+4, редко +2, +3 |
|
Ниобий |
Nb |
+3, +5, редко +2, +4 |
|
Молибден |
Mo |
+3, +6, редко +2, +3, +5 |
|
Технеций |
Tc |
+6 |
|
Рутений |
Ru |
+3, +4, +8, редко +2, +6, +7 |
|
Родий |
Rh |
+4, редко +2, +3, +6 |
|
Палладий |
Pd |
+2, +4, редко +6 |
|
Серебро |
Ag |
+1, редко +2, +3 |
|
Кадмий |
Cd |
+2, редко +1 |
|
Индий |
In |
+3, редко +1, +2 |
|
Олово |
Sn |
+2, +4 |
|
Сурьма |
Sb |
-3, +3, +5, редко +4 |
|
Теллур |
Te |
-2, +4, +6, редко |
|
Иод |
I |
-1, +1, +5, +7, редко +3, +4 |
|
Ксенон |
Xe |
0 |
|
Цезий |
Cs |
+1 |
|
Барий |
Bа |
+2 |
|
Лантан |
La |
+3 |
|
Церий |
Ce |
+3, +4 |
|
Празеодим |
Pr |
+3 |
|
Неодим |
Nd |
+3, +4 |
|
Прометий |
Pm |
+3 |
|
Самарий |
Sm |
+3, редко +2 |
|
Европий |
Eu |
+3, редко +2 |
|
Гадолиний |
Gd |
+3 |
|
Тербий |
Tb |
+3, +4 |
|
Диспрозий |
Dy |
+3 |
|
Гольмий |
Ho |
+3 |
|
Эрбий |
Er |
+3 |
|
Тулий |
Tm |
+3, редко +2 |
|
Иттербий |
Ib |
+3, редко +2 |
|
Лютеций |
Lu |
+3 |
|
Гафний |
Hf |
+4 |
|
Тантал |
Ta |
+5, редко +3, +4 |
|
Вольфрам |
W |
+6, редко +2, +3, +4, +5 |
|
Рений |
Re |
+2, +4, +6, +7, редко -1, +1, +3, +5 |
|
Осмий |
Os |
+3, +4, +6, +8, редко +2 |
|
Иридий |
Ir |
+3, +4, +6, редко +1, +2 |
|
Платина |
Pt |
+2, +4, +6, редко +1, +3 |
|
Золото |
Au |
+1, +3, редко +2 |
|
Ртуть |
Hg |
+1, +2 |
|
Талий |
Tl |
+1, +3, редко +2 |
|
Свинец |
Pb |
+2, +4 |
|
Висмут |
Bi |
+3, редко +3, +2, +4, +5 |
|
Полоний |
Po |
+2, +4, редко -2, +6 |
|
Астат |
At |
– |
|
Радон |
Ra |
0 |
|
Франций |
Fr |
– |
|
Радий |
Ra |
+2 |
|
Актиний |
Ac |
+3 |
Или использовать на уроках этот вариант таблицы.

Кроме того, степени окисления химических элементов можно определить по периодической таблице Менделеева:
- высшая степень (максимально положительная) совпадает с номером группы;
- для определения минимального значения степени окисления из номера группы вычитается восемь.
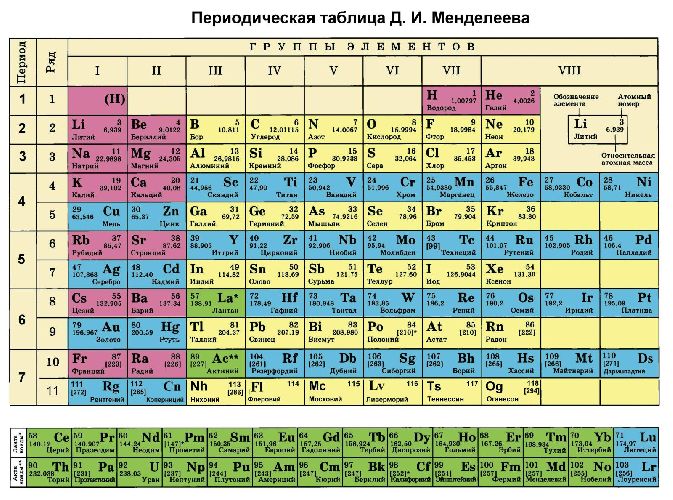
Большинство неметаллов имеют положительную и отрицательную степени окисления. Например, кремний находится в IV группе, значит, его максимальная степень окисления +4, а минимальная -4. В соединениях неметаллов (SO3, CO2, SiC) окислителем является неметалл с отрицательной степенью окисления или с большим значением электроотрицательности. Например, в соединении PCl3 фосфор имеет степень окисления +3, хлор -1. Электроотрицательность фосфора – 2,19, хлора – 3,16.
Второе правило не работает для щелочных и щелочноземельных металлов, которые всегда имеют одну положительную степень окисления, равную номеру группы. Исключения составляют магний и бериллий (+1, +2). Также постоянную степень окисления имеют:
- алюминий (+3);
- цинк (+2);
- кадмий (+2).
Остальные металлы имеют непостоянную степень окисления. В большинстве реакций выступают в качестве восстановителя. В редких случаях могут быть окислителями с отрицательной степенью окисления.
Фтор – самый мощный окислитель. Его степень окисления всегда -1.

Что мы узнали?
Из урока 8 класса узнали о степени окисления. Это условная величина, показывающая, сколько электронов может отдать или принять атом в ходе химической реакции. Значение связано с электроотрицательностью. Окислители принимают электроны и имеют отрицательную степень окисления, восстановители отдают электроны и проявляют положительную степень окисления. Большинство металлов – восстановители с постоянной или переменной степенью окисления. Неметаллы могут проявлять свойства окислителя и восстановителя в зависимости от вещества, с которым реагируют.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Александр Котков
5/5
-

Александр Котков
5/5
-

Паша Кривов
4/5
-

Александр Котков
5/5
-

Лидия Маслова
5/5
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 558.
А какая ваша оценка?
Темы кодификатора ЕГЭ: Электроотрицательность. Степень окисления и валентность химических элементов.
Когда атомы взаимодействуют и образуют химическую связь, электроны между ними в большинстве случаев распределяются неравномерно, поскольку свойства атомов различаются. Более электроотрицательный атом сильнее притягивает к себе электронную плотность. Атом, который притянул к себе электронную плотность, приобретает частичный отрицательный заряд δ—, его «партнер» — частичный положительный заряд δ+. Если разность электроотрицательностей атомов, образующих связь, не превышает 1,7, мы называем связь ковалентной полярной. Если разность электроотрицательностей, образующих химическую связь, превышает 1,7, то такую связь мы называем ионной.
Степень окисления – это вспомогательный условный заряд атома элемента в соединении, вычисленный из предположения, что все соединения состоят из ионов (все полярные связи – ионные).
Что значит «условный заряд»? Мы просто-напросто договариваемся, что немного упростим ситуацию: будем считать любые полярные связи полностью ионными, и будем считать, что электрон полностью уходит или приходит от одного атома к другому, даже если на самом деле это не так. А уходит условно электрон от менее электроотрицательного атома к более электроотрицательному.
Например, в связи H-Cl мы считаем, что водород условно «отдал» электрон, и его заряд стал +1, а хлор «принял» электрон, и его заряд стал -1. На самом деле таких полных зарядов на этих атомах нет.
Наверняка, у вас возник вопрос — зачем же придумывать то, чего нет? Это не коварный замысел химиков, все просто: такая модель очень удобна. Представления о степени окисления элементов полезны при составлении классификации химических веществ, описании их свойств, составлении формул соединений и номенклатуры. Особенно часто степени окисления используются при работе с окислительно-восстановительными реакциями.
Степени окисления бывают высшие, низшие и промежуточные.
Высшая степень окисления равна номеру группы со знаком «плюс».
Низшая определяется, как номер группы минус 8.
И промежуточная степень окисления — это почти любое целое число в интервале от низшей степени окисления до высшей.

Например, для азота характерны: высшая степень окисления +5, низшая 5 — 8 = -3, а промежуточные степени окисления от -3 до +5. Например, в гидразине N2H4 степень окисления азота промежуточная, -2.
Чаще всего степень окисления атомов в сложных веществах обозначается сначала знаком, потом цифрой, например +1, +2, -2 и т.д. Когда речь идет о заряде иона (предположим, что ион реально существует в соединении), то сначала указывают цифру, потом знак. Например: Ca2+, CO3 2-.
Для нахождения степеней окисления используют следующие правила:
- Степень окисления атомов в простых веществах равна нулю;
- В нейтральных молекулах алгебраическая сумма степеней окисления равна нулю, для ионов эта сумма равна заряду иона;
- Степень окисления щелочных металлов (элементы I группы главной подгруппы) в соединениях равна +1, степень окисления щелочноземельных металлов (элементы II группы главной подгруппы) в соединениях равна +2; степень окисления алюминия в соединениях равна +3;
- Степень окисления водорода в соединениях с металлами (солеобразные гидриды — NaH, CaH2 и др.) равна -1; в соединениях с неметаллами (летучие водородные соединения) +1;
- Степень окисления кислорода равна -2. Исключение составляют пероксиды – соединения, содержащие группу –О-О-, где степень окисления кислорода равна -1, и некоторые другие соединения (супероксиды, озониды, фториды кислорода OF2 и др.);
- Степень окисления фтора во всех сложных веществах равна -1.
Выше перечислены ситуации, когда степень окисления мы считаем постоянной. У всех остальных химических элементов степень окисления — переменная, и зависит от порядка и типа атомов в соединении.
Примеры:
Задание: определите степени окисления элементов в молекуле дихромата калия: K2Cr2O7.
Решение: степень окисления калия равна +1, степень окисления хрома обозначим, как х, степень окисления кислорода -2. Сумма всех степеней окисления всех атомов в молекуле равна 0. Получаем уравнение: +1*2+2*х-2*7=0. Решаем его, получаем степень окисления хрома +6.
В бинарных соединениях более электроотрицательный элемент характеризуется отрицательной степенью окисления, менее электроотрицательный – положительной.
Обратите внимание, что понятие степени окисления – очень условно! Степень окисления не показывает реальный заряд атома и не имеет реального физического смысла. Это упрощенная модель, которая эффективно работает, когда нам необходимо, например, уравнять коэффициенты в уравнении химической реакции, или для алгоритмизации классификации веществ.
Степень окисления – это не валентность! Степень окисления и валентность во многих случаях не совпадают. Например, валентность водорода в простом веществе Н2 равна I, а степень окисления, согласно правилу 1, равна 0.
Это базовые правила, которые помогут Вам определить степень окисления атомов в соединениях в большинстве случаев.
В некоторых ситуациях вы можете столкнуться с трудностями при определении степени окисления атома. Рассмотрим некоторые из этих ситуаций, и разберем способы их разрешения:
- В двойных (солеобразных) оксидах степень у атома, как правило, две степени окисления. Например, в железной окалине Fe3O4 у железа две степени окисления: +2 и +3. Какую из них указывать? Обе. Для упрощения можно представить это соединение, как соль: Fe(FeO2)2. При этом кислотный остаток образует атом со степенью окисления +3. Либо двойной оксид можно представить так: FeO*Fe2O3.
- В пероксосоединениях степень окисления атомов кислорода, соединенных ковалентными неполярными связями, как правило, изменяется. Например, в пероксиде водорода Н2О2, и пероксидах щелочных металлов степень окисления кислорода -1, т.к. одна из связей – ковалентная неполярная (Н-О-О-Н). Другой пример – пероксомоносерная кислота (кислота Каро) H2SO5 (см. рис.) содержит в составе два атома кислорода со степенью окисления -1, остальные атомы со степенью окисления -2, поэтому более понятной будет такая запись: H2SO3(O2). Известны также пероксосоединения хрома – например, пероксид хрома (VI) CrO(O2)2 или CrO5, и многие другие.
- Еще один пример соединений с неоднозначной степенью окисления – супероксиды (NaO2) и солеобразные озониды KO3. В этом случае уместнее говорить о молекулярном ионе O2 с зарядом -1 и и O3 с зарядом -1. Строение таких частиц описывается некоторыми моделями, которые в российской учебной программе проходят на первых курсах химических ВУЗов: МО ЛКАО, метод наложения валентных схем и др.
- В органических соединениях понятие степени окисления не очень удобно использовать, т.к. между атомами углерода существует большое число ковалентных неполярных связей. Тем не менее, если нарисовать структурную формулу молекулы, то степень окисления каждого атома также можно определить по типу и количеству атомов, с которыми данный атом непосредственно связан. Например, у первичных атомов углерода в углеводородах степень окисления равна -3, у вторичных -2, у третичных атомов -1, у четвертичных — 0.
Потренируемся определять степень окисления атомов в органических соединениях. Для этого необходимо нарисовать полную структурную формулу атома, и выделить атом углерода с его ближайшим окружением — атомами, с которыми он непосредственно соединен.
Полезные советы:
- Для упрощения расчетов можно использовать таблицу растворимости – там указаны заряды наиболее распространенных ионов. На большинстве российских экзаменов по химии (ЕГЭ, ГИА, ДВИ) использование таблицы растворимости разрешено. Это готовая шпаргалка, которая во многих случаях позволяет значительно сэкономить время.
- При расчете степени окисления элементов в сложных веществах сначала указываем степени окисления элементов, которые мы точно знаем (элементы с постоянной степенью окисления), а степень окисления элементов с переменной степенью окисления обозначаем, как х. Сумма всех зарядов всех частиц равна нулю в молекуле или равна заряду иона в ионе. Из этих данных легко составить и решить уравнение.
Тренировочный тест по теме «Степени окисления и валентность» 10 вопросов, при каждом прохождении новые.
201
Создан на
07 января, 2022 От Admin

Тренировочный тест “Степени окисления”
1 / 10
1) Al 2) Sr 3) In 4) Tl 5) C
Из числа указанных в ряду элементов выберите два элемента, каждый из которых может образовать оксид с общей формулой ЭО.
Запишите в поле ответа номера выбранных элементов.
2 / 10
1) Al 2) Si 3) Mg 4) C 5) N
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях проявляют постоянную степень окисления.
3 / 10
1) С 2) N 3) F 4) Be 5) Ne
Из числа указанных в ряду элементов выберите два элемента, которые не проявляют положительной степени окисления.
4 / 10
1) N 2) He 3) C 4) F 5) Be
Из числа указанных в ряду элементов выберите два элемента, которые не проявляют отрицательной степени окисления.
5 / 10
1) Ca 2) Cl 3) Si 4) S 5) Mn
Из числа указанных в ряду элементов выберите два элемента, степень окисления которых в высших гидроксидах равна +7.
6 / 10
1) S 2) Si 3) Ne 4) Al 5) Mg
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять отрицательную степень окисления.
7 / 10
1) N 2) С 3) B 4) Na 5) Al
Из числа указанных в ряду элементов выберите два элемента, степень окисления которых в оксидах может принимать значение +1.
8 / 10
1) Cl 2) Sr 3) Se 4) P 5) K
Из числа указанных в ряду элементов выберите два элемента, которые в составе образованных ими кислородсодержащих анионов могут иметь одинаковую степень окисления.
9 / 10
1) S 2) Ca 3) Mn 4) Al 5) Cl
Из числа указанных в ряду элементов выберите два элемента, которые в высших оксидах проявляют одинаковую степень окисления.
10 / 10
1) Na 2) S 3) F 4) V 5) Si
Из числа указанных в ряду элементов выберите два элемента, которые в образованных ими анионах с общей формулой ЭOx2− могут иметь одинаковую степень окисления.
Ваша оценка
The average score is 57%
| Элемент | Название | Степень окисления |
|
7N |
Азот (степень окисления) |
-III, 0, +I, II, III, IV, V |
|
89Ас |
Актиний (степень окисления) |
0, + III |
|
13Al |
Алюминий (степень окисления) |
0, +III |
|
95Am |
Америций (степень окисления) |
0, + II , III, IV |
|
18Ar |
Аргон (степень окисления) |
0 |
|
85At |
Астат (степень окисления) |
-I, 0, +I, V |
|
56Ba |
Барий (степень окисления) |
0, +II |
|
4Be |
Бериллий (степень окисления) |
0,+ IV |
|
97Bk |
Берклий (степень окисления) |
0, +III, IV |
|
5B |
Бор (степень окисления) |
-III, 0, +III |
|
107Bh |
Борий (степень окисления) |
0, +VII |
|
35Br |
Бром (степень окисления) |
-I, 0, +I, V, VII |
|
23V |
Ванадий (степень окисления) |
0, + II , III, IV, V |
|
83Bi |
Висмут (степень окисления) |
0, +III, V |
|
1H |
Водород (степень окисления) |
-I, 0, +I |
|
74W |
Вольфрам (степень окисления) |
0, +IV, VI |
|
64Gd |
Гадолиний (степень окисления) |
0, +III |
| Элемент | Название | Степень окисления |
|
31Ga |
Галлий (степень окисления) |
0, +III |
|
72Hf |
Гафний (степень окисления) |
0,+IV |
|
2He |
Гелий (степень окисления) |
0 |
|
32Ge |
Германий (степень окисления) |
0, +II, IV |
|
67Ho |
Гольмий (степень окисления) |
0, + III |
|
66Dy |
Диспрозий (степень окисления) |
0, + III |
|
105Db |
Дубний (степень окисления) |
0, +V |
|
63Еu |
Европий (степень окисления) |
0, +II, III |
|
26Fe |
Железо (степень окисления) |
0, +II, III, VI |
|
79Au |
Золото (степень окисления) |
0, + I , III |
|
49In |
Индий (степень окисления) |
0 , + III |
|
77Ir |
Иридий (степень окисления) |
0, +III, IV |
|
39Y |
Иттрий (степень окисления) |
0, +III |
|
70Yb |
Иттербий (степень окисления) |
0, + II , III |
|
53I |
Йод (степень окисления) |
-I, 0, +I, V, VII |
|
48Cd |
Кадмий (степень окисления) |
0, + II |
|
19К |
Калий (степень окисления) |
0, +I |
|
98Cf |
Калифорний (степень окисления) |
0, +Ш, IV |
| Элемент | Название | Степень окисления |
|
20Ca |
Кальций (степень окисления) |
0, + II |
|
54Xe |
Ксенон (степень окисления) |
0, + II , IV, VI, VIII |
|
8O |
Кислород (степень окисления) |
-II, I, 0, +II |
|
27Co |
Кобальт (степень окисления) |
0, +II, III |
|
36Кr |
Криптон (степень окисления) |
0, + II |
|
14Si |
Кремний (степень окисления) |
-IV, 0, +11, IV |
|
96Cm |
Кюрий (степень окисления) |
0, +III, IV |
|
57La |
Лантан (степень окисления) |
0, +III |
|
3Li |
Литий (степень окисления) |
0, +I |
|
103Lr |
Лоуренсий (степень окисления) |
0, +III |
|
71Lu |
Лютеций (степень окисления) |
0, +III |
|
12Mg |
Магний (степень окисления) |
0, + II |
|
25Mn |
Марганец (степень окисления) |
0, +II, IV, VI, VIII |
|
29Cu |
Медь (степень окисления) |
0, +I, -II |
|
109Mt |
Мейтнерий (степень окисления) |
0, +IV? |
|
101Md |
Менделевий (степень окисления) |
0, +II, III |
|
42Mo |
Молибден (степень окисления) |
0 , +IV, VI |
|
33As |
Мышьяк (степень окисления) |
– III , 0 , +III, V |
|
11Na |
Натрий (степень окисления) |
0, +I |
| Элемент | Название | Степень окисления |
|
60Nd |
Неодим (степень окисления) |
0, +III |
|
10Ne |
Неон (степень окисления) |
0 |
|
93Np |
Нептуний (степень окисления) |
0, +III, IV, VI, VII |
|
28Ni |
Никель (степень окисления) |
0, +II, III |
|
41Nb |
Ниобий (степень окисления) |
0, +IV, V |
|
102No |
Нобелий (степень окисления) |
0, +II, III |
|
50Sn |
Олово (степень окисления) |
0, + II , IV |
|
76Os |
Осмий (степень окисления) |
0, +IV, VI, VIII |
|
46Pd |
Палладий (степень окисления) |
0, +II, IV |
|
91Pa. |
Протактиний (степень окисления) |
0, +IV, V |
|
61Pm |
Прометий (степень окисления) |
0, + III |
|
84Рo |
Полоний (степень окисления) |
0, +II, IV |
|
59Рг |
Празеодим (степень окисления) |
0, +III, IV |
|
78Pt |
Платина (степень окисления) |
0, +II, IV |
|
94PU |
Плутоний (степень окисления) |
0, +III, IV, V, VI |
|
88Ra |
Радий (степень окисления) |
0, + II |
|
37Rb |
Рубидий (степень окисления) |
0, +I |
|
75Re |
Рений (степень окисления) |
0, +IV, VII |
|
104Rf |
Резерфордий (степень окисления) |
0, +IV |
| Элемент | Название | Степень окисления |
|
45Rh |
Родий (степень окисления) |
0, +III, IV |
|
86Rn |
Радон (степень окисления) |
0, + II , IV, VI, VIII |
|
44Ru |
Рутений (степень окисления) |
0, +II, IV, VI, VIII |
|
80Hg |
Ртуть (степень окисления) |
0 , +I, II, IV |
|
16S |
Сера (степень окисления) |
-II, 0, +IV, VI |
|
47Ag |
Серебро (степень окисления) |
0, +I |
|
51Sb |
Сурьма (степень окисления) |
0, +III, V |
|
21Sc |
Скандий (степень окисления) |
0, +III |
|
34Se |
Селен (степень окисления) |
-II, 0,+IV, VI |
|
106Sg |
Сиборгий (степень окисления) |
0, +VI |
|
62Sm |
Самарий (степень окисления) |
0, + II , III |
|
38Sr |
Стронций (степень окисления) |
0, + II |
|
82РЬ |
Свинец (степень окисления) |
0, +II, IV |
|
81Тl |
Таллий (степень окисления) |
0, + I , II |
|
73Ta |
Тантал (степень окисления) |
0, +IV, V |
|
52Te |
Теллур (степень окисления) |
-II, 0, +IV, VI |
|
65Tb |
Тербий (степень окисления) |
0, +III, IV |
|
43Tc |
Технеций (степень окисления) |
0, +IV, VII |
|
22Ti |
Титан (степень окисления) |
0, + II , III, IV |
| Элемент | Название | Степень окисления |
|
90Th |
Торий (степень окисления) |
0, +IV |
|
69Tm |
Тулий (степень окисления) |
0 , +III |
|
6C |
Углерод (степень окисления) |
-IV, I, 0, +II, IV |
|
92U |
Уран (степень окисления) |
0, +III, IV, VI |
|
100Fm |
Фермий (степень окисления) |
0, +II, III |
|
15P |
Фосфор (степень окисления) |
-III, 0, +I, III, V |
|
87Fr |
Франций (степень окисления) |
0, +I |
|
9F |
Фтор (степень окисления) |
-I, 0 |
|
108Hs |
Хассий (степень окисления) |
0, +VIII |
|
17Cl |
Хлор (степень окисления) |
-I, 0, +I, III, IV, V, VI, VII |
|
24Cr |
Хром (степень окисления) |
0, + II , III , VI |
|
55Cs |
Цезий (степень окисления) |
0, +I |
|
58Ce |
Церий (степень окисления) |
0, + III , IV |
|
30Zn |
Цинк (степень окисления) |
0, + II |
|
40Zr |
Цирконий (степень окисления) |
0, +IV |
|
99ES |
Эйнштейний (степень окисления) |
0, +II, III |
|
68Еr |
Эрбий (степень окисления) |
0, +III |
| Элемент | Название | Степень окисления |
|
1H |
Водород (степень окисления) |
-I, 0, +I |
|
2He |
Гелий (степень окисления) |
0 |
|
3Li |
Литий (степень окисления) |
0, +I |
|
4Be |
Бериллий (степень окисления) |
0,+ IV |
|
5B |
Бор (степень окисления) |
-III, 0, +III |
|
6C |
Углерод (степень окисления) |
-IV, I, 0, +II, IV |
|
7N |
Азот (степень окисления) |
-III, 0, +I, II, III, IV, V |
|
8O |
Кислород (степень окисления) |
-II, I, 0, +II |
|
9F |
Фтор (степень окисления) |
-I, 0 |
|
10Ne |
Неон (степень окисления) |
0 |
|
11Na |
Натрий (степень окисления) |
0, +I |
|
12Mg |
Магний (степень окисления) |
0, + II |
|
13Al |
Алюминий (степень окисления) |
0, +III |
|
14Si |
Кремний (степень окисления) |
-IV, 0, +II, IV |
|
15P |
Фосфор (степень окисления) |
-III, 0, +I, III, V |
|
16S |
Сера (степень окисления) |
-II, 0, +IV, VI |
|
17Cl |
Хлор (степень окисления) |
-I, 0, +I, III, IV, V, VI, VII |
| Элемент | Название | Степень окисления |
|
18Ar |
Аргон (степень окисления) |
0 |
|
19К |
Калий (степень окисления) |
0, +I |
|
20Ca |
Кальций (степень окисления) |
0, + II |
|
21Sc |
Скандий (степень окисления) |
0, +III |
|
22Ti |
Титан (степень окисления) |
0, + II , III, IV |
|
23V |
Ванадий (степень окисления) |
0, + II , III, IV, V |
|
24Cr |
Хром (степень окисления) |
0, + II , III , VI |
|
25Mn |
Марганец (степень окисления) |
0, +II, IV, VI, VIII |
|
26Fe |
Железо (степень окисления) |
0, +II, III, VI |
|
27Co |
Кобальт (степень окисления) |
0, +II, III |
|
28Ni |
Никель (степень окисления) |
0, +II, III |
|
29Cu |
Медь (степень окисления) |
0, +I, -II |
|
30Zn |
Цинк (степень окисления) |
0, + II |
|
31Ga |
Галлий (степень окисления) |
0, +III |
|
32Ge |
Германий (степень окисления) |
0, +II, IV |
|
33As |
Мышьяк (степень окисления) |
– III , 0 , +III, V |
|
34Se |
Селен (степень окисления) |
-II, 0,+IV, VI |
|
35Br |
Бром (степень окисления) |
-I, 0, +I, V, VII |
| Элемент | Название | Степень окисления |
|
36Кr |
Криптон (степень окисления) |
0, + II |
|
37Rb |
Рубидий (степень окисления) |
0, +I |
|
38Sr |
Стронций (степень окисления) |
0, + II |
|
39Y |
Иттрий (степень окисления) |
0, +III |
|
40Zr |
Цирконий (степень окисления) |
0, +IV |
|
41Nb |
Ниобий (степень окисления) |
0, +IV, V |
|
42Mo |
Молибден (степень окисления) |
0 , +IV, VI |
|
43Tc |
Технеций (степень окисления) |
0, +IV, VII |
|
44Ru |
Рутений (степень окисления) |
0, +II, IV, VI, VIII |
|
45Rh |
Родий (степень окисления) |
0, +III, IV |
|
46Pd |
Палладий (степень окисления) |
0, +II, IV |
|
47Ag |
Серебро (степень окисления) |
0, +I |
|
48Cd |
Кадмий (степень окисления) |
0, + II |
|
49In |
Индий (степень окисления) |
0 , + III |
|
50Sn |
Олово (степень окисления) |
0, + II , IV |
|
51Sb |
Сурьма (степень окисления) |
0, +III, V |
|
52Te |
Теллур (степень окисления) |
-II, 0, +IV, VI |
|
53I |
Йод (степень окисления) |
-I, 0, +I, V, VII |
|
54Xe |
Ксенон (степень окисления) |
0, + II , IV, VI, VIII |
| Элемент | Название | Степень окисления |
|
55Cs |
Цезий (степень окисления) |
0, +I |
|
56Ba |
Барий (степень окисления) |
0, +II |
|
57La |
Лантан (степень окисления) |
0, +III |
|
58Ce |
Церий (степень окисления) |
0, + III , IV |
|
59Рг |
Празеодим (степень окисления) |
0, +III, IV |
|
60Nd |
Неодим (степень окисления) |
0, +III |
|
61Pm |
Прометий (степень окисления) |
0, + III |
|
62Sm |
Самарий (степень окисления) |
0, + II , III |
|
63Еu |
Европий (степень окисления) |
0, +II, III |
|
64Gd |
Гадолиний (степень окисления) |
0, +III |
|
65Tb |
Тербий (степень окисления) |
0, +III, IV |
|
66Dy |
Диспрозий (степень окисления) |
0, + III |
|
67Ho |
Гольмий (степень окисления) |
0, + III |
|
68Еr |
Эрбий (степень окисления) |
0, +III |
|
69Tm |
Тулий (степень окисления) |
0 , +III |
|
70Yb |
Иттербий (степень окисления) |
0, + II , III |
|
71Lu |
Лютеций (степень окисления) |
0, +III |
|
72Hf |
Гафний (степень окисления) |
0,+IV |
|
73Ta |
Тантал (степень окисления) |
0, +IV, V |
| Элемент | Название | Степень окисления |
|
74W |
Вольфрам (степень окисления) |
0, +IV, VI |
|
75Re |
Рений (степень окисления) |
0, +IV, VII |
|
76Os |
Осмий (степень окисления) |
0, +IV, VI, VIII |
|
77Ir |
Иридий (степень окисления) |
0, +III, IV |
|
78Pt |
Платина (степень окисления) |
0, +II, IV |
|
79Au |
Золото (степень окисления) |
0, + I , III |
|
80Hg |
Ртуть (степень окисления) |
0 , +I, II, IV |
|
81Тl |
Таллий (степень окисления) |
0, + I , II |
|
82РЬ |
Свинец (степень окисления) |
0, +II, IV |
|
83Bi |
Висмут (степень окисления) |
0, +III, V |
|
84Рo |
Полоний (степень окисления) |
0, +II, IV |
|
85At |
Астат (степень окисления) |
-I, 0, +I, V |
|
86Rn |
Радон (степень окисления) |
0, + II , IV, VI, VIII |
|
87Fr |
Франций (степень окисления) |
0, +I |
|
88Ra |
Радий (степень окисления) |
0, + II |
|
89Ас |
Актиний (степень окисления) |
0, + III |
|
90Th |
Торий (степень окисления) |
0, +IV |
|
91Pa. |
Протактиний (степень окисления) |
0, +IV, V |
|
92U |
Уран (степень окисления) |
0, +III, IV, VI |
| Элемент | Название | Степень окисления |
|
93Np |
Нептуний (степень окисления) |
0, +III, IV, VI, VII |
|
94PU |
Плутоний (степень окисления) |
0, +III, IV, V, VI |
|
95Am |
Америций (степень окисления) |
0, + II , III, IV |
|
96Cm |
Кюрий (степень окисления) |
0, +III, IV |
|
97Bk |
Берклий (степень окисления) |
0, +III, IV |
|
98Cf |
Калифорний (степень окисления) |
0, +Ш, IV |
|
99ES |
Эйнштейний (степень окисления) |
0, +II, III |
|
100Fm |
Фермий (степень окисления) |
0, +II, III |
|
101Md |
Менделевий (степень окисления) |
0, +II, III |
|
102No |
Нобелий (степень окисления) |
0, +II, III |
|
103Lr |
Лоуренсий (степень окисления) |
0, +III |
|
104Rf |
Резерфордий (степень окисления) |
0, +IV |
|
105Db |
Дубний (степень окисления) |
0, +V |
|
106Sg |
Сиборгий (степень окисления) |
0, +VI |
|
107Bh |
Борий (степень окисления) |
0, +VII |
|
108Hs |
Хассий (степень окисления) |
0, +VIII |
|
109Mt |
Мейтнерий (степень окисления) |
0, +IV? |
