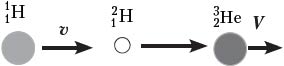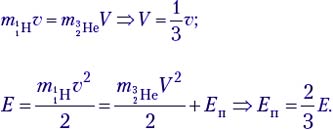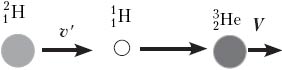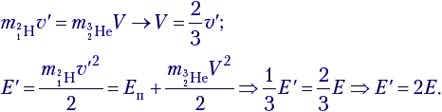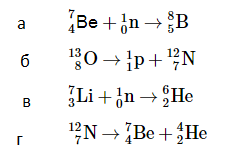Задачи, тесты
А. А.
Найдин,
< naidin_anatoli@mail.ru >, МОУ гимназия № 44, г. Новокузнецк, Кемеровская обл.
Расчёт энерговыделения при ядерной реакции
Всё прекрасное так же трудно, как и редко…
Спиноза
Расчёт энерговыделения при ядерных реакциях традиционно труден для учеников средней школы, однако происходящие внутри атомного ядра процессы всегда вызывают у них живой интерес. В школьных учебниках на примерах показано, как определить энергию связи ядра и энергетический выход ядерной реакции, однако совсем не обсуждаются условия протекания ядерной реакции и другие способы расчёта энерговыделения. Попробуем этот недочёт устранить, сгруппировав решаемые на уроке задачи так, чтобы они образовали систему задач, которая будет развивать ученика. Напомним, что ядерные реакции – превращения атомных ядер при взаимодействии с частицами, в том числе с фотонами или друг с другом.
Для протекания ядерной реакции необходимо сближение частиц до расстояний порядка 10–13 см. Что конкретно произойдёт с ядром, зависит от энергии налетающей частицы и энергии связи нуклонов: частица может быть захвачена ядром атома и вызвать ядерную реакцию, может расщепить ядро на фрагменты, может отлететь от ядра при упругом ударе. Ядерные реакции подчиняются законам сохранения электрического заряда, энергии, импульса.
Примеры ядерных реакций (запись комментируют учащиеся):
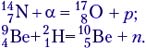
Ядерные реакции могут протекать как с выделением, так и с поглощением энергии. Причём эта энергия по порядку величины в 106 раз больше, чем при химической реакции! Произведём расчёт энерговыделения на примере ядерной реакции:
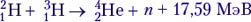
(такие ядерные реакции называются реакциями синтеза):
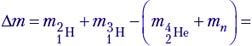
E = Δmc2 = 0,28221 · 10–11 Дж ≈ 17,6 МэВ.
Ядерные реакции деления покажем на примере одной из возможных схем деления изотопа урана 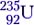
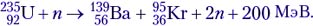
Эта реакция идёт при взрыве атомной бомбы, а также в недрах ядерного реактора. Расчёт энерговыделения производить не будем, но на будущее будем знать, что в среднем на одну реакцию деления изотопа урана выделяется около 200 МэВ энергии.
Реакцию распада удобно показать на примере реакции 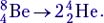
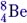
Сокращённую запись уравнения ядерной реакции покажем на примере реакции 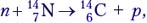
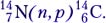
«Установленное Эйнштейном соотношение является основанием для дальнейших, значительно более важных выводов. Радиоактивная отслойка является с этой точки зрения одной из возможностей получения из материи огромных запасов энергии, техническое использование таких запасов энергии в принципе не представляется невыполнимым и совсем недавно Резерфорд получил, по-видимому, подобные количества энергии, – правда, в микроскопическом масштабе, когда ему удалось разложить азот путём радиоактивного расщепления. Но не нужно предаваться иллюзии, будто техническая добыча указанной здесь энергии является вопросом непосредственного будущего и что этим будет достигнуто обесценивание угля; с другой стороны, нельзя возражать и против того, что тут раскрывается одна из серьёзнейших технических проблем».
В.Нернст, 1918
Теперь в процессе решения задач ученикам можно продемонстрировать и другие методы расчёта энерговыделения при ядерной реакции.
«Прибавь ещё один оттенок к радуге…»
У.Шекспир
Задача 1. Одной из наиболее известных реакций термоядерного синтеза является реакция слияния дейтерия и трития: 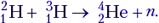
Решение. В данной реакции происходит разделение ядер дейтерия и трития на составляющие их частицы, на что затрачивается энергия связи, после чего образуется ядро гелия с выделением энергии. Энергетический выход реакции: Е = 28,294 МэВ – (2,228 МэВ
+ 8,483 МэВ) = 17,583 МэВ. Энергию связи любого ядра ученики уже могут рассчитывать, поэтому для них не представляет большого труда рассчитать энергетический выход любой ядерной реакции таким способом.
Задача 2. Определите энергию реакции 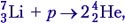
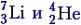
Решение. Под действием протона ядро лития разрушается, на что затрачивается энергия связи, но при этом возникают два ядра гелия и выделяется энергия Е = 2(4 ∙ 7,06 МэВ/нуклон) – 7 ∙ 5,60 МэВ/нуклон = 17,28 МэВ.
Задача 3. В ядерной реакции 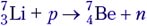
Решение. Это первый пример ядерной реакции, в которой энергия поглощается (Еп). В лабораторной системе отсчёта имеем движущийся со скоростью υ протон и покоящееся ядро лития (рис. а). После ядерной реакции нейтрон неподвижен, а ядро бериллия приобретает некоторую скорость V (рис. б).

По закону сохранения импульса, mpυ = mBeV. Зная массовое число каждой частицы, находим V = (1/7)υ. В лабораторной системе отсчёта 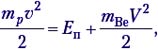
Теперь выясним, при какой минимальной энергии налетающих протонов Е′ эта реакция вообще может идти. В системе отсчёта «центр масс системы протон–ядро лития», которая движется вправо с некоторой скоростью υ′, их импульс mp(υ – υ′) – mLiυ′ = 0, откуда υ′ = 1/8 υ. Если протон обладает минимальной энергией Е′, то в данной системе отсчёта вся она поглощается и возникшие в реакции частицы не разлетаются: 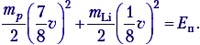
Задача 4. Если направить поток протонов на кусок льда из тяжёлой воды D2O, то при минимальной кинетической энергии протонов Е = 1,4 МэВ происходит ядерная реакция с образованием ядер 
Решение. Запишем закон сохранения импульса и закон сохранения энергии для данной реакции V:
где Еп – энергия, поглощаемая в данной реакции.
Запишем закон сохранения импульса и закон сохранения энергии для случая, когда ядра дейтерия попадают на кусок льда из обычной воды:
Задача 5. В реакции 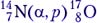
Решение. Найдём дефект массы: 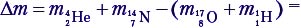
Эта реакция идёт с поглощением энергии! Еп = 1,2 МэВ.
Запишем закон сохранения импульса и закон сохранения энергии для этой реакции:
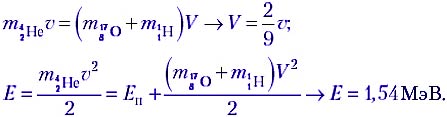
Энергии налетающей частицы вполне достаточно для того, чтобы данная реакция протекала! Полная кинетическая энергия продуктов распада Е – Еп = 6,14 МэВ.
Литература
- Джанколи Д. Физика. – М.: Мир, 1989.
- Савченко О.Я. Задачи по физике. – Новосибирск: НГУ, 1999.
Содержание:
- Энергия в химических реакциях
- Горение топлива и выделение энергии
- Твердое топливо
- Жидкое топливо
- Экзотермические и эндотермические реакции, термохимические уравнения
- Изменение энергии с точки зрения кинетической теории частиц
- Расчеты по термохимическим уравнениям
- Определение количества выделяемого или поглощаемого тепла по массе (количеству, объему) вещества
- Определение массы вещества, вступившего в реакцию, по количеству выделившегося или поглощенного тепла
- Составление термохимического уравнения реакции по массе реагирующих веществ и по количеству поглощенного или выделившегося тепла
Энергия Гиббса (или потенциал Гиббса) — это величина, показывающая изменение энергии в ходе химической реакции. G = U + PV – TS, где U — внутренняя энергия, P — давление, V — объем, T — абсолютная температура, S — энтропия. В химических процессах одновременно действуют два противоположных фактора – энтропийный (T·ΔтS) иэнтальпийный (ΔтH).
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Энергия в химических реакциях
Химическая энергия — потенциал вещества трансформируется в химической реакции или трансформирует другие вещества.
Горение топлива и выделение энергии
Вспомните: топливо, горение, окисление, медленное окисление, пожары. В
каких регионах Казахстана добывают газ, каменный уголь и нефть?
Топливо – горючие вещества, основным компонентом которых является углерод. Топливо используется для получения при его сжигании тепловой энергии, а также в качестве сырья в химической промышленности.
По агрегатному состоянию топливо делится на твердое, жидкое и газообразное; по происхождению – на природное и искусственное.
Природные виды топлива используются в том виде, в каком они добываются. К ним относятся каменные и бурые угли, природные газы, древесина, горючие сланцы, торф. К другой подгруппе топлива (искусственные) относятся продукты переработки природных топлив (бензин, керосин, лигроин, мазут).
Все виды топлива состоят из одних и тех же элементов. Разница в них заключается в процентном содержании этих элементов. Топливо состоит из двух групп элементов. В первую группу входят элементы, которые горят или же поддерживают горение, такие как: углерод, водород, сера, кислород. А во вторую входит элемент – азот, который и не горит и не поддерживает горение.
При сжигании любого вида топлива образуются оксиды. Например, при сгорании угля и углеродсодержащего топлива образуется углекислый газ, оксид углерода (II) и другие вещества:
где Q – тепловая энергия.
Виды топлива отличаются друг от друга по количеству выделяемого тепла при полном сгорании. Основным качественным показателем любого топлива является теплотворная способность топлива.
Теплотворной способностью топлива называется количество тепла, которое выделяется при полном сгорании 1 м3 газообразного или 1 кг твердого топлива. Теплотворная способность каменного угля 7000 ккал/кг, мазута –10 000 ккал/кг, природного газа – до 15 000 ккал/
по сравнению с древесиной такой же массы. Чем выше теплотворная способность топлива, тем оно ценнее, так как для получения одного и того же количества тепла его потребуется меньше.
Все виды топлива можно рассматривать как продукт разложения (в отсутствие воздуха), и преобразования растительного и животного мира под воздействием высокого давления толстого слоя земли.
Твердое топливо
К естественным твердым видам топлива относятся: древесина, каменный уголь, антрацит, торф, сланец. К искусственным – кокс, пылевидный уголь, древесный уголь.
При обработке каменного угля в специальных печах без доступа воздуха при температуре 1000 – 1100°С получают кокс. Кокс является топливом в металлургических доменных печах. Древесный уголь получают в специальных печах. Он является лучшим топливом для кузнечных горнов. В нем не содержится золы и практически отсутствует сера.
Жидкое топливо
К естественным жидким видам топлива относят нефть.
Но сырую нефть, как топливо в печах не применяют. А применяют продукты
переработки:
легкий бензин, авиационное топливо.
тяжелый бензин (топливо для автотранспорта).
керосин (дизельное, котельное топливо и для реактивных самолетов).
мазут – остаток перегонки нефти, применяют как котельное топливо.
Газовое топливо – выделяется из земли через естественные выходы буровых скважин. В настоящее время они находят широкое применение в промышленности и в быту.
А искусственное газовое топливо получают путем газификации твердых видов топлива в газогенераторах или как побочный продукт при коксовании угля. Теплотворная способность генераторного газа зависит от вида твердого топлива, из которого получен газ, и от способа газификации. Например, у торфяного генераторного газа теплотворная способность от 1500 до 1600 ккал/

Водород – топливо будущего, он имеет массу преимуществ по сравнению с другими видами топлива.
Водород сгорает намного эффективнее, не имеет вредных выбросов. Самое главное – при сгорании водорода образуется природное вещество – вода. Природа не получит никакого вреда, т. е. он кроме эффективности еще и экологичен!
Водород – легко возобновляемое топливо, т. к. его можно получить из воды.
Он может быть использован во всех без исключения отраслях современного производства и транспорта.
Тогда почему же он не получил широкого внедрения и применения? Этому есть серьезные причины:
– технология получения (электролиз);
– способность хранения (занимают большой объем);
– взрывоопасен (дает «гремучую смесь» с кислородом).
Глобальное потепление – это постепенный подъем температуры на Земле.
Глобальное потепление является результатом скопления в атмосфере избыточного количества углекислого газа. Этот газ удерживает солнечное тепло и повышает температуру на Земле.
Земная атмосфера состоит из газов, которые удерживают тепловую энергию, приходящую от Солнца. Без этих газов солнечное тепло попросту уходило бы в Космос и на Земле было бы гораздо холоднее. Эти газы еще называют парниковыми, поскольку они удерживают тепло в атмосфере во многом так же, как тепло накапливается в парнике (парниковый эффект).
Однако равновесие этих газов было нарушено человеческой деятельностью, например, сжиганием горючих ископаемых (каменного угля и нефти), и сейчас в атмосфере гораздо больше углекислого газа. Он удерживает больше тепла, чем требуется Земле.
Ученые предсказывают, что к 2100 году средняя температура земной поверхности повысится на 1–5 градусов по Цельсию. Это глобальное потепление станет следствием парникового эффекта – образования газового слоя, задерживающего солнечную энергию в атмосфере Земли. Повышение температуры, в свою очередь, может повлечь за собой повышение уровня Мирового океана и помимо наводнений привести к очень резким переменам погоды на нашей планете.
Природные горючие богатства отличаются исчерпаемостью и не восстанавливаются. К тому же применение топлива в таких больших масштабах приводит к парниковому эффекту, потеплению и изменению климата. Поэтому человечество обеспокоено состоянием в этой области и собирается переходить на возобновляемые виды энергии солнца, ветра, воды. Глобальному вопросу современности была посвящена Всемирная выставка в Астане
(ЭКСПО–2017), которая прошла с 10 июня по 10 сентября 2017 года. На ней все страны-участницы продемонстрировали свои инновационные технологии и достижения в этой сфере.
Экзотермические и эндотермические реакции, термохимические уравнения
Вспомните о реакциях, где выделяется тепло.
Все химические реакции протекают в различных условиях. Некоторые реакции идут с выделением теплоты, самопроизвольно (например горение бензина, керосина, газа), а некоторые требуют постоянного притока тепла (например, приготовление пищи).
Реакции, идущие с выделением тепла, называются экзотермическими, а с поглощением тепла – эндотермическими (от греческого экзо – внешний, эндо – внутренний).
Количество тепла, выделяющегося или поглощающегося при химической реакции, называется тепловым эффектом. Единицей его измерения является джоуль (Дж) или килоджоуль (кДж). Уравнения химических реакций, в которых указаны значения тепловых эффектов 
Зная значения тепловых эффектов реакций, можно управлять ходом этих реакций.
Рассмотрим величины теплоты образования 1 моля воды в жидком и газообразном состояниях:
Теплота образования – это тепло, которое выделяется или поглощается при образовании 1 моля сложного вещества из простых веществ:
Из этого примера видно, что величина теплоты образования воды в разных агрегатных состояниях различна. Эти значения даны при стандартных условиях (t = 25°С, p = 101,3 кПа).
Каждое вещество располагает определенным запасом энергии, которая называется химической энергией. В химических реакциях она может превращаться в другие виды энергии (тепловую, световую, электрическую и т. д.) всегда в соответствии с законом сохранения и превращения энергии.
Изменение энергии с точки зрения кинетической теории частиц
Химические реакции протекают с выделением или поглощением тепла. А теплота является мерой хаотического движения частиц. Кинетическая теория исследует процессы, происходящие в веществе за счет движений частиц. Эта идея была предложена еще 460–360 лет до н. э. древнегреческим философом Демокритом.
Все вещества до реакции обладают определенным запасом внутренней энергии. А эта энергия слагается из кинетической и потенциальной энергии частиц. Кинетическая энергия обусловлена энергией поступательного, вращательного движения молекул, а потенциальная энергия – силами притяжения и отталкивания частиц.
Химическая реакция происходит за счет разрыва одних связей и образования новых. Происходит перегруппировка частиц, составляющих исходные вещества, что сопровождается выделением или поглощением энергии в виде тепла.
Экзотермическая, эндотермическая реакции, тепловой эффект, теплота образования.
Лабораторный опыт №4
Химические реакции, сопровождающиеся изменением энергии
Цель: исследовать химические процессы, которые идут с изменением
Обратите внимание: Будьте осторожны при работе с растворами кислот и щелочей.
Опыт А. Экзотермические реакции.
Ход работы:
1. Отмерьте в цилиндре по 25 мл растворов гидроксида натрия и соляной кислоты.
2. Измерьте их температуру.
3. Быстро налейте их в химический стакан и отметьте максимальную температуру.
Опыт б. Эндотермические реакции.
Свежеприготовленный осадок 
Расчеты по термохимическим уравнениям
Термохимические уравнения широко используются при выполнении термохимических расчётов для того, чтобы: определить количество теплоты, выделяющейся или поглощающейся в результате реакции, если известны её тепловой эффект и химическое количество (масса, объём) одного из участников реакции.
Определение количества выделяемого или поглощаемого тепла по массе (количеству, объему) вещества
1. Если при окислении 1 моль глюкозы в организме человека выделилось 2870 кДж тепла, какое количество тепла выделится при окислении 40 г глюкозы?
Определение массы вещества, вступившего в реакцию, по количеству выделившегося или поглощенного тепла
1. Какая масса карбоната кальция разложилась и сколько образовалось оксида кальция и диоксида углерода, если в результате реакции поглотилось 1064,4 кДж тепла
Составление термохимического уравнения реакции по массе реагирующих веществ и по количеству поглощенного или выделившегося тепла
Составьте термохимическое уравнение реакции, если в результате горения 16 г серы выделилось 148,5 кДж тепла.
При сгорании 16 г серы выделяется 148,5 кДж теплоты.
При сгорании 32 г серы выделяется х кДж теплоты.
16 г S : 148,5 кДж = 32 г S : х кДж
ДЕЛАЕМ ВЫВОДЫ
- 1. Реакции, идущие с выделением тепла, называются экзотермическими, а с поглощением – эндотермическими.
- 2. Термохимические уравнения – это химические уравнения, в которых указаны значения тепловых эффектов (Q).
- 3. Теплота образования – это тепло, которое выделяется или поглощается при образовании 1 моль сложного вещества из простых веществ.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
Тема: Найти энергию, выделяющуюся при реакции (Прочитано 94890 раз)
0 Пользователей и 1 Гость просматривают эту тему.
Найти энергию, выделяющуюся при реакции 37Li + 11H => 24He + 24He.
« Последнее редактирование: 20 Января 2015, 15:36 от Сергей »
Записан
Решение.
В данной задаче необходимо определить энергетический выход ядерной реакции:
37Li + 11H => 24He + 24He.
Энергетический выход ядерной реакции определяется по формуле:
∆Е = ∆m а.е.м.∙931,5 МэВ/а.е.м. (1).
∆m – изменение массы.
∆m = m1 – m2 (2).
m1 – масса ядер до реакции, m2 – масса ядер после реакции.
m1 = m(37Li) + m(11Н) = 7,01601 а.е.м. + 1,00783 а,е.м. = 8,02384 а,е.м.
m2 = m(24Не) + m(24Не) = 4,00260 а.е.м. + 4,00260 а,е.м. = 8,0052 а,е.м.
∆m = 0,01864 а.е.м.
∆Е = 17,36 МэВ.
« Последнее редактирование: 15 Февраля 2015, 07:21 от alsak »
Записан
Ядерная реакция — процесс взаимодействия атомного ядра с другим ядром или элементарной частицей, сопровождающийся изменением состава и структуры ядра, а также выделением вторичных частиц или γ-квантов.
Осуществление ядерной реакции возможно только при сближении ядер атомов вещества вплотную и их попадании в радиус действия ядерных сил. Но ядра любых химических элементов имеют положительный заряд. Поэтому при сближении они отталкиваются за счет действия кулоновских сил. Ядра могут сблизиться друг с другом только в случае, если им сообщить достаточно большую кинетическую энергию. Такую энергию можно им сообщить с помощью специальных ускорителей. Однако для легких ядер достаточно использовать α-частицы или дейтроны — ядро атома дейтерия.
Первая ядерная реакция была осуществлена Э. Резерфордом в 1919 году в опытах по обнаружению протонов в продуктах распада ядер. Ученый бомбардировал атомы азота α-частицами. При соударении частиц происходила ядерная реакция, протекавшая по следующей схеме:
147N+42He→178O+11H
Первая реакция с использованием ускорителей была проведена в 1932 году. Во время нее удалось расщепить атом лития на две α-частицы :
73Li+11H→42He+42He
На фотографии треков в камере Вильсона (см. рисунок выше) видно, что ядра гелия разлетаются в разные стороны вдоль одной прямой. Это соответствует закону сохранения импульса (импульс протона много меньше импульса возникающих α-частиц; на фотографии треки протонов не видны).
Внимание! Количество нуклонов до и после реакции есть число постоянное.
Пример №1. При бомбардировке ядер бора 115B протонами получается бериллий 84Be. Какое еще ядро образуется при этой реакции?
Составим схему реакции:
115B+11p=84Be+AZX
Количество нуклонов до и после реакции постоянно. Поэтому зарядовое число нового элемента будет равно разнице суммы зарядов бора и протона и заряда бериллия:
Z=(5+1)−4=2
Массовое число нового элемента будет равно разнице суммы массовых чисел бора и протона и массового числа бериллия:
A=(11+1)−8=4
Вещество с зарядовым числом 2 и массовым числом 4 — гелий. Следовательно, схема получает вид:
115B+11p=84Be+42He
Энергетический выход ядерных реакций
В ядерной реакции по распаду лития при столкновении с быстрым протоном кинетическая энергия двух образующихся ядер гелия оказалась больше кинетической энергии протона, который вступил в реакцию. И разница между ними составила 7,3 МэВ. Это говорит о том, что превращение ядер сопровождается изменением их внутренней энергии, т. е. изменение энергии связи. В рассмотренной реакции удельная энергия связи в ядрах гелия больше удельной энергии связи в ядре лития. Поэтому часть внутренней энергии ядра лития превращается в кинетическую энергию разлетающихся α-частиц.
Изменение энергии связи ядер означает, что суммарная энергия покоя участвующих в реакциях ядер и частиц не остается постоянной. Ведь энергия покоя ядра выражается через энергию связи. В соответствии с законом сохранения энергии изменение кинетической энергии в процессе ядерной реакции равно изменению энергии покоя участвующих в реакции ядер и частиц.
Энергетический выход ядерной реакции — разность энергий покоя ядер и частиц до реакции и после реакции.
Q = (MA + MB – MC – MD)c2 = ΔMc2
где MA и MB – массы исходных продуктов, MC и MD – массы конечных продуктов реакции.
Энергетический выход ядерной реакции равен изменению кинетической энергии частиц, участвующих в реакции. Причем:
- Если суммарная кинетическая энергия ядер и частиц после реакции больше, чем до реакции, то энергия выделяется.
- Если суммарная кинетическая энергия ядер и частиц после реакции меньше, чем до реакции, то энергия поглощается.
Выделяющаяся при ядерных реакциях энергия может быть колоссальной. Но использовать ее при столкновениях ускоренных частиц (или ядер) с неподвижными ядрами мишени практически нельзя. Это связано с тем, что основная часть ускоренных частиц пролетает мимо ядер мишени, не приводя к возникновению реакции.
Пример №2. В результате деления ядра урана 23592U, захватившего нейтрон, образуются ядра бария 14256Ba и криптона 9136Kr, а также три свободных нейтрона. Удельная энергия связи ядер бария 8,38 МэВ/нуклон, криптона – 8,55 МэВ/нуклон и урана – 7,59 МэВ/нуклон. Чему равна энергия, выделенная из одного ядра урана?
Составим схему реакции:
23592U+10n→14256Ba+9136Kr+310n
Из условия задачи известно, сколько энергии имеет каждый нуклон. Нуклон — это 1 протон или нейтрон. Каждый элемент до и после реакции имеет определенные массовые числа:
AU=235
ABa=142
AKr=91
Следовательно, чтобы найти выделившуюся энергию, нужно умножить количество нуклонов на их энергии, а затем найти разность энергий до и после реакции:
Q=EсвUAU−EсвBaABa−EсвKrAKr
Q=7,59·235−8,38·142−8,55·91=−184,36 (МэВ)
Отрицательное число получилось в связи с тем, что суммарная энергия связи ядер образовавшихся элементов больше энергии связи ядра атома урана. Это говорит о том, что энергия при проведении этой реакции будет выделяться в количестве 184,36 МэВ.
Ядерные реакции на нейтронах
Нейтроны не имеют заряда. Поэтому они беспрепятственно проникают в атомные ядра и вызывают их изменения. Например, столкновение нейтрона с ядром атома алюминия может вызвать следующую реакцию:
2713Al+10n→2411Na+42He
Итальянский физик Энрико Ферми, изучавший ядерные реакции на нейтронах, обнаружил, что ядерные превращения вызываются, как быстрыми, так и медленными нейтронами. Причем применение медленных нейтронов часто дает лучшие результаты. Поэтому быстрые нейтроны стали замедлять в воде. После соударения с ядрами водорода, которые по массе примерно равны массе нейтрона, эти нейтроны замедлялись. Их скорость становилась равной скорости теплового движения молекул воды.
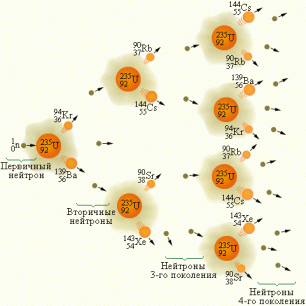
Деление ядер урана
В отличие от радиоактивного распада ядер, сопровождающегося испусканием α- или β-частиц, реакции деления —процесс, при котором нестабильное ядро делится на два крупных фрагмента сравнимых масс. В 1939 году немецкие ученые Ган и Штрассман открыли деление ядер урана. Они обнаружили, что при бомбардировке урана нейтронами возникают элементы средней части периодической системы – радиоактивные изотопы бария (Z = 56), криптона (Z = 36) и пр.
Уран встречается в природе в виде двух изотопов: 23892U (99,3 %) и 23592U (0,7 %). При бомбардировке нейтронами ядра обоих изотопов расщепляются на 2 части. Причем реакция деления 23592U лучше идет на медленных нейтронах, в то время как ядра 23892U вступают в реакцию деления только с быстрыми нейтронами, энергия которых составляет около 1 МэВ.
Наибольший интерес для ученых представила реакция деления ядра 23592U. Сегодня известны около 100 различных изотопов с массовыми числами примерно от 90 до 145, которые образуются при делении этого ядра. Две наиболее распространенные реакции деления этого ядра имеют вид:
23592U+10n→14456Ba+8936Kr+310n
23592U+10n→14454Xe+9438Sr+210n
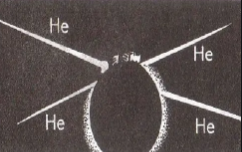
Ядро урана-235 имеет форм шара. При поглощении лишнего нейтрона (рис. а) оно переходит в возбужденное состояние и начинает деформироваться — удлиняться (рис. б). Оно растягивается дальше (рис. в.) до тех пор, пока не распадется с образованием двух новых ядер и испусканием нескольких нейтронов (рис. г).
Кинетическая энергия, выделяющаяся при делении одного ядра урана, огромна – порядка 200 МэВ. Оценку выделяющейся при делении ядра энергии можно сделать с помощью понятия удельной энергии связи нуклонов в ядре. Удельная энергия связи нуклонов в ядрах с массовым числом A ≈ 240 порядка 7,6 МэВ/нуклон, в то время как в ядрах с массовыми числами A = 90–145 удельная энергия примерно равна 8,5 МэВ/нуклон. Следовательно, при делении ядра урана освобождается энергия порядка 0,9 МэВ/нуклон или приблизительно 210 МэВ на один атом урана. При полном делении всех ядер, содержащихся в 1 г урана, выделяется такая же энергия, как и при сгорании 3 т угля или 2,5 т нефти.
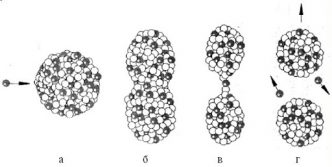
Цепные ядерные реакции
При делении ядра урана-235, вызванного столкновением с нейтроном, освобождается 2 или 3 нейтрона. При соблюдении некоторых условий эти нейтроны могут попасть в другие ядра урана и вызвать их деление. На этом этапе появятся уже от 4 до 9 нейтронов, способных вызвать новые распады ядер урана и т. д. Такой лавинообразный процесс называется цепной реакцией.
Цепная реакция — ядерная реакция, при которой вызывающие ее частицы (нейтроны), образуются как продукт этой реакции.
Схема цепной реакции урана-235 выглядит так:
Для осуществления цепной реакции необязательно каждый выделенный нейтрон должен вызывать распад другого ядра урана. Важно лишь, чтобы среднее число освобожденных нейтронов с течением времени не уменьшалось. Такое условие выполняется, если коэффициент размножения нейтронов (k) больше или равен единице: k ≥1.
Коэффициент размножения нейтронов — отношение числа нейтронов в каком-либо «поколении» к числу нейтронов предшествующего поколения.
Коэффициент размножения определяется не только числом нейтронов, образующихся в каждом элементарном акте, но и условиями, в которых протекает реакция – часть нейтронов может поглощаться другими ядрами или выходить из зоны реакции. Нейтроны, освободившиеся при делении ядер урана-235, способны вызвать деление лишь ядер этого же урана, на долю которого в природном уране приходится всего лишь 0,7 %. Такая концентрация оказывается недостаточной для начала цепной реакции. Изотоп урана-238 также может поглощать нейтроны, но при этом не возникает цепной реакции.
Ядерный реактор
Ядерный реактор — устройство, в котором осуществляется и поддерживается управляемая цепная реакция деления некоторых тяжелых ядер.
Первый ядерный реактор был построен в 1942 году в США под руководством Э. Ферми. В нашей стране первый реактор был построен в 1946 году под руководством И. В. Курчатова.
Ядерные энергетические реакторы используются для выработки электроэнергии на атомных электростанциях, в судовых энергетических установках, атомных теплоэлектроцентралях, а также на атомных станциях теплоснабжения.
Основные элементами ядерного реактора:
- ядерное горючее (обычно уран-235);
- замедлитель нейтронов — для получения медленных электронов (тяжелая вода, захватывающая нейтроны, или графит, не захватывающий их);
- теплоноситель для вывода энергии, образующейся при работе реактора (вода, жидкий натрий);
- регулирующие стержни (бор, кадмий) — для регулирования количества высвобожденных электронов (эти вещества способны поглощать много нейтронов);
- защитная оболочка, которая задерживает излучения (железобетон).
Цепная реакция, как известно, может протекать только при коэффициенте размножения нейтронов k ≥1. Но он может поддерживаться в этом значении только при условии, что масса урана превышает некоторое критическое значение.
Критическая масса — наименьшая масса делящегося вещества, при которой может протекать цепная реакция.
Для чистого урана-235 критическая масса равна 50 кг. При такой массе шар из урана имеет радиус всего 9 см. Если в реакторе использовать оболочку, которая отражает уран, то критическую массу можно снизить до 250 г.
Это интересно! Реактор, работающий на уране-235 и медленных нейтронах, является энергетическим. Его применяют для производства энергии. Но реактор, работающий на уране-235 и быстрых нейтронах, является реактором-размножителем. При распаде 1 кг урана в этом случае образуется 1,5 кг плутония, который также можно использовать как ядерное топливо. При делении урана медленными нейтронами входит в 2,5 раза меньше плутония.
Термоядерные реакции
Масса покоя ядра урана больше суммы масс покоя осколков, на которые делится ядро. Для легких ядер дело обстоит как раз наоборот. Так, масса покоя ядра гелия значительно меньше суммы масс покоя двух ядер тяжелого водорода, на которые можно разделить ядро гелия. Поэтому при слиянии легких ядер масса покоя уменьшается. Следовательно, должна выделяться значительная энергия. Подобного рода реакции слияния легких ядер могут протекать только при очень высоких температурах. Поэтому они называются термоядерными.
Термоядерные реакции — это реакции слияния легких ядер при очень высокой температуре.
Ядра сливаются только при сближении на расстоянии около 10-12 см — тогда они попадают в сферу действия ядерных сил. Этому сближению препятствует кулоновское отталкивание ядер, которое может быть преодолено лишь за счет большой кинетической энергии теплового движения ядер.
Энергия, которая выделяется при термоядерных реакциях в расчете на один нуклон, превышает удельную энергию, выделяющуюся при цепных реакциях деления ядер. Так, при слиянии тяжелого водорода — дейтерия — со сверхтяжелым изотопом водорода — тритием — выделяется около 3,5 МэВ на один нуклон. При делении же урана выделяется примерно 1 МэВ энергии на один нуклон.
Термоядерные реакции играют большую роль в эволюции Вселенной. Энергия излучения Солнца и звезд имеет термоядерное происхождение. По современным представлениям, на ранней стадии развития звезда в основном состоит из водорода. Температура внутри звезды столь велика, что в ней протекают реакции слияния ядер водорода с образованием гелия. Затем при слиянии ядер гелия образуются и более тяжелые элементы.
Если человечество научится управлять термоядерными реакциями, то на Земле появится неисчерпаемый источник энергии. Но пока это невозможно, так как нет таких веществ, которые могли бы выдержать температуру, при которых могут сливаться ядра. Однако неуправляемые реакции проведены уже были. Речь идет о термоядерных бомбах, которые могут уничтожить все человечество.
Задание EF17710
Каково массовое число ядра Х в реакции 95241 Am + 24 He→ X + 2 01 n?
Алгоритм решения
- Записать правило сохранения нуклонов до и после реакции.
- Составить уравнение и вычислить искомое массовое число.
Решение
Количество нуклонов до и после реакции постоянно. Поэтому сумма массовых чисел до реакции и после нее не изменится. Составим уравнение, используя только массовые числа ядер и частиц:
241 + 4 = A + 2
A = 243
Ответ: 243
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18442
Определите массовое и зарядовое число частицы, которая вызывает ядерную реакцию37 Li + … → 48 Вe + 01 n?
Алгоритм решения
- Записать правило сохранения нуклонов до и после реакции.
- Составить уравнение и вычислить искомое массовое число.
- Составить уравнение и вычислить искомое зарядовое число.
Решение
Количество нуклонов до и после реакции постоянно. Поэтому сумма массовых чисел до реакции и после нее не изменится. Составим уравнение, используя только массовые числа ядер и частиц:
7 + А = 8 + 1
A = 2
Составим уравнение, используя только массовые числа ядер и частиц:
3 + Z = 4 + 0
Z = 1
Ответ: 21
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18660
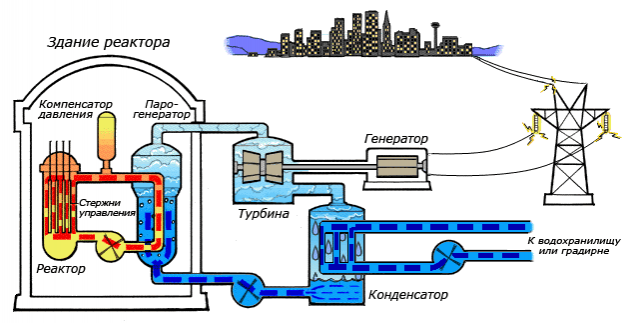
Закону сохранения электрического заряда не противоречит реакция:
Алгоритм решения
- Записать правило сохранения нуклонов до и после реакции.
- Проверить, где выполняется это правило.
Решение
Количество нуклонов до и после реакции постоянно. Поэтому сумма массовых и зарядовых чисел до реакции и после нее не изменится. Проверим правильность реакций.
Реакция «а»:
7 + 1 = 8
4 + 0 < 5
Реакция «б»:
13 = 1 + 12
8 = 1 + 7
Реакция «в»:
7 + 1 > 6
3 + 0 > 2
Реакция «г»:
12 > 7 + 4
7 > 4 + 2
Подходит только реакция «б».
Ответ: б
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 2.6k
В результате ядерных реакций происходит выделение энергии в виде излучения. Для подсчёта энергии, выделяющейся в конкретной реакции, вводят понятие дефекта масс и логику уравнения Эйнштейна. Эйнштейн показал, что энергия и масса связаны друг с другом соотношением:
(1)
Показано, что в результате любой ядерной реакции суммарная масса элементов до реакции (мишеней) не равна суммарной массе элементов после реакции (продуктов). Разница между этими массами называется дефектом масс:
(2)
В случае, если — ядерная реакция идёт самопроизвольно (энергия выделяется),
— ядерная реакция не самопроизвольна, т.е. для неё нужно затратить энергию.
Тогда, чтобы посчитать энергию реакции, необходимо подставить (2) в (1):
(3)
Соотношение (3) позволяет посчитать энергию ядерной реакции, зная массы мишеней и продуктов реакции.
Частным видом таких задач является поиск энергии ядра и удельной энергии ядра.
Представим себе ситуацию, в которой ядро разделяется на составляющие (до протонов и нейтроном), в этом случае дефект масс можно найти как:
(4)
- где
Тогда, исходя из (3), мы получим исходную энергию, которую мы назовём энергией ядра.
Удельная энергия ядра — это энергия, приходящаяся на один нуклон:
(5)
- где
Вывод: вопросы данной части ядерной физики связаны с поиском дефекта масс (2) (обычно все массы даны) и использованием соотношений (3) — (5) для поиска соответствующих энергий.