Вопрос посетителя
Определить выход эфира в процентах от теоретически возможного , если из 300г уксусной кислоты и соответствующего количества спирта получено 400г этилацетата
Ответ эксперта
Решение :
1 Составим уравнение реакции
СН3СООН+ С2Н5ОН= СН3СООС2Н5 +Н2О
2 Найдем количество вещества уксусной кислоты, вступившей в реакцию:
υ(СН3СООН)= mМ
υ(СН3СООН)=30060=5 моль.
3 Найдем по уравнению, что количество вещества этилацетата равно количеству вещества уксусной кислоты, вступившей в реакцию:
υ(СН3СООС2Н5)=5моль.
4 Найдем теоретическую массу образовавшегося этилацетата
m = υ*М;
m(СН3СООС2Н5)=5*88=440г
5 Учитывая, что масса практическая этилацетата 400г, найдем массовую долю выхода продукта:
W= mпр mтеор *100% ;
W=400440*100=90%.
Ответ:90%.
Выход – эфир
Cтраница 1
Выход эфира определен весовым методом.
[1]
Выход эфиров при получении по этому методу в значительной степени зависит от катализатора.
[2]
Выход эфиров при этерификации ( в пересчете на эфиры двухосновных кислот) из кислот среднетемпературного пека составил 66 2 %; из кислот высокотемпературного пека – 67 4 % в пересчете на трехосновные.
[3]
Выход эфира определен весовым методом.
[4]
Выход эфира в реакции диметилперекиси с литий-арильными соединениями в большой степени зависит от природы последних.
[5]
Выход эфира ( в процентах) возрастает с уменьшением количества йода с двух до одного эквивалента.
[6]
Выход эфира зависит от соотношения воды и спирта в реакционной массе.
[7]
Выход эфира ( в процентах) возрастает с уменьшением количества йода с двух до одного эквивалента.
[8]
Выход эфира ( и процентах) возрастает с уменьшением количества йода с двух до одного эквивалента.
[9]
Выход эфиров повышается до 90 % при этерификации в газовой фазе, благоприятствующей удалению хлористого водорода из сферы реакции.
[10]
Выход эфиров повышается до 90 % при этерификации в газовой фазе, благоприятствующей удалению хлороводорода из сферы реакции.
[11]
Выход эфира ( 38 %) возрастает до 62 % при добавлении к жидкой фазе метакриловой кислоты. Метилакрилат с выходом 84 % синтезируют из аллена, СО и СН3ОН под действием Fe ( CO) 5 и а-пиколина. Взаимодействием аллена и PdCl2 в уксусной кислоте в присутствии CH3COONa при комнатной температуре образуется ди – ( г-хлор – мс – ( 2-ацетокси-п – аллил) дипалладиевый комплекс, который реагирует с СО при 100 С и 100 атм в этиловый эфир кетокислоты.
[12]
Выход эфира составляет 70 – 75 % от теории.
[13]
Выход эфира составляет 75 – 85 % теоретического. Непрореагировавший спирт после ректификации может быть возвращен в цикл. Полученный эфир имеет нейтральную реакцию.
[14]
Выход эфира составляет 70 – 75 % от теории.
[15]
Страницы:
1
2
3
Проведение практических работ
в форме количественного
химического эксперимента
Мы постоянно говорим, утверждаем и доказываем,
что химия – наука экспериментальная, точная
(количественная). Программой обучения химии
предусмотрено решение задач определенного
содержания, проведение лабораторных и
практических работ, демонстрационных
экспериментов (все это в идеале!).
Одна из разновидностей количественных задач
школьного уровня – расчет выхода продукта
реакции (исходные данные могут быть разными).
Обычно эти задачи являются комбинированными, т.е.
включают расчетные действия, предусмотренные в
более простых ситуациях [1, 2].
Есть прекрасная возможность оптимизировать
преподавание химии, соединив в единый процесс
количественное получение органического
вещества и осуществление необходимых расчетных
действий. При этом достигаются различные учебные
ц е л и: формирование у учащихся
представлений о лабораторном химическом
синтезе, умений и навыков в проведении
химического эксперимента; формирование
потребности в химических знаниях, ориентация на
химические профессии; и – реализация
программных требований – проведение конкретной
практической работы.
Проиллюстрируем сказанное на примере практической
работы «Получение сложного эфира».
Учащиеся заранее получают задание
подготовиться к практической работе (по учебнику
Л.А.Цветкова [3], учебникам Г.Е.Рудзитиса и
Ф.Г.Фельдмана или Н.Н.Буринской и Л.П.Величко) и
решить задачу.
Задача. Смешали 30 г этанола с 30 г
уксусной кислоты. Рассчитать массу
образовавшегося сложного эфира, если выход
продукта составил 85%.
Решение
Уравнение реакции:
![]()
Допустив, что кислота полностью вступила в
реакцию, рассчитываем по уравнению химической
реакции массу спирта:
![]()
Анализ показывает, что спирт взят в избытке.
По массе кислоты рассчитываем теоретический
выход продукта (эфира):
![]()
Подставив в формулу относительного выхода
продукта имеющиеся физические величины, находим
массу эфира, которая составляет практический
выход продукта:
![]()
откуда
![]()
При проверке тетрадей по химии [4] учитель
смотрит, как решена эта задача, сверяя ход
решения и результат со своими записями в
конспекте к уроку.
Практическая работа
В устойчивый штатив помещены (заблаговременно,
трудами лаборанта) три пробирки. Первая пробирка
– реактор с 2 мл ледяной уксусной кислоты –
закрыта пробкой с газоотводной
трубкой. Во вторую пробирку налито 2 мл
изоамилового спирта (использование этого спирта
объясняется тем, что он был доступен: в городе
функционировал молокозавод; кроме того,
упрощалась технология, и не менее важно –
получался продукт с очень приятным запахом).
Третья пробирка с 1 мл концентрированной серной
кислоты закрыта пробкой или плотным комком
технической ваты.
Изоамиловый спирт переливают в
пробирку-реактор, смесь перемешивают легкими
ударами большого или указательного пальца одной
руки, при этом другая рука держит у горла
пробирку тремя пальцами (учитель все показывает,
и только после этого учащиеся повторяют за ним
описанные действия – независимо от того, что у
учащихся имеется личный опыт, сформированы
умения и навыки при обращении с химическим
оборудованием).
Аккуратно, по стенке, в смесь приливают серную
кислоту, после чего к реактору присоединяют
газоотводную трубку (рис. 1). Она выполняет роль
воздушного холодильника и служит физическим
препятствием при маловероятном, но все же
возможном выбросе агрессивной реакционной
массы. Теперь уже смесь трех веществ, с еще
большей осторожностью, перемешивают, а
выделяющуюся теплоту отводят рукой,
охватывающей реактор в зоне протекания
химической реакции.
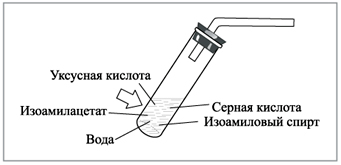 |
Рис. 1. Пробирка-реактор для получения
|
Далее реактор несколько секунд
нагревают в горячей зоне пламени, помешивают при
помощи руки и контролируют температуру (около 50
°С). Это прикидка, проверенная многолетней
практикой. Если горячо, плотным кольцевым
поглаживанием тепло отводится. Если рука
чувствует только тепло, нагревание продолжается.
Перемешивание – нагревание – охлаждение с
непостоянной периодичностью длится 5 мин. Весь
этот период пробку с газоотводной трубкой
придерживают указательным пальцем руки (если
этого не делать, она может отделиться).
В химический стакан вместимостью 100–150 мл на
1/3 объема наливают водопроводную (еще лучше
колодезную) воду. Осторожно выливают туда
реакционную массу. Для уменьшения потерь
продукта реакции в освобожденный реактор
наливают воду (не больше половины по высоте
пробирки), после чего содержимое пробирки также
выливают в химический стакан. (В пробирку из-под
серной кислоты наливают небольшое количество
дистиллированной воды и затем сливают в
специальную емкость – далее полученный раствор
находит применение для самых разных целей.)
Содержимое химического стакана перемешивают
стеклянной палочкой, после чего системе дают
возможность отстояться (рис. 2). Уже на этом этапе
ощущается специфический запах (груши) продукта
реакции.
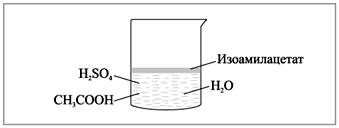 |
Рис. 2. Химический стакан
|
Для отделения эфирного слоя от
остальной части смеси используют делительную
воронку. Это очень ответственный этап
практической работы, т.к. можно потерять часть
продукта реакции этерификации.
Полученный эфир сливают в «мерник» (рис. 3).
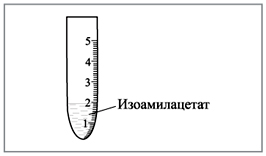 |
Рис. 3. Пробирка-мерник для
|
Учащиеся работают в па’рах, они
подходят к учителю и показывают, какой объем
эфира получен; учитель фиксирует их результат в
своем конспекте.
На демонстрационном столе стоит склянка с
чистым изоамилацетатом. Учитель обращает
внимание на цвет продукта синтеза
(слабокоричневый) и образца (бесцветный).
Различие в окрашивании объясняется осмолением;
для получения чистого продукта необходима
перегонка.
Результаты опытов учащиеся заносят в
информационную таблицу, которая нарисована на
доске (табл. 1).
Таблица 1
Данные по процессу получения
изоамилацетата
| Вещество | Плотность, г/мл |
Объем, мл |
Молярная масса, г/моль |
Выход продукта, % |
| 1. Изоамиловый спирт | 0,814 | 2 | 88 | – |
| 2. Уксусная кислота | 1,049 | 2 | 60 | – |
| 3. Изоамилацетат | 0,872 | ? опыт |
130 | ? расчет |
Для осуществления расчетных действий
учащиеся записывают уравнение реакции:
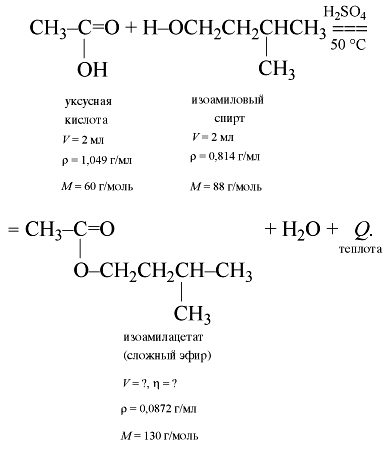
Учащимся разрешается пользоваться
округленными значениями плотностей. Они должны
определить массу исходных веществ и перевести
эти массы в количество вещества:
m(кислоты) = ![]() •V = 1,049•2 = 2,098 г,
•V = 1,049•2 = 2,098 г,
![]() (кислоты)
(кислоты)
= 2,098/60 = 0,035 моль;
m(спирта) = 0,814•2 = 1,628 г,
![]() (спирта)
(спирта)
= 1,628/88 = 0,0185 ![]() 0,02 моль.
0,02 моль.
Из анализа полученных данных и уравнения
реакции вытекает, что кислота дана в избытке.
Расчеты выхода продукта реакции ведем по спирту.
По уравнению химический реакции теоретически
должно получиться ![]() 0,02 моль
0,02 моль
эфира.
mтеор(эфира) = 0,02•130 ![]() 2,6 г,
2,6 г,
V(эфира) = 2,6/0,872 ![]() 3 мл.
3 мл.
А сколько получилось на самом деле эфира?
За каждым столом – свой результат,
который во многом зависит от
экспериментальных навыков юных химиков.
Практически учащиеся получают приблизительно
от 1 мл до 2 мл эфира и более.
По формуле выхода продукта рассчитывают
относительный выход продукта в процентах:
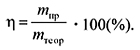
Чтобы облегчить себе работу при проверке
правильности расчетов, удобно пользоваться
таблицей (табл. 2).
Таблица 2
Определение относительного выхода
изоамилацетата по его объему
| Объем, мл | Выход, % | Объем, мл | Выход, % | Объем, мл | Выход, % |
| 0,1 | ~ 4 | 1,1 | ~ 44 | 2,1 | ~ 84 |
| 0,2 | ~ 8 | 1,2 | ~ 48 | 2,2 | ~ 88 |
| 0,3 | ~ 12 | 1,3 | ~ 52 | 2,3 | ~ 92 |
| 0,4 | ~ 16 | 1,4 | ~ 56 | 2,4 | ~ 96 |
| 0,5 | ~ 20 | 1,5 | ~ 60 | 2,5 | 100 |
| 0,6 | ~ 24 | 1,6 | ~ 64 | – | |
| 0,7 | ~ 28 | 1,7 | ~ 68 | – | |
| 0,8 | ~ 32 | 1,8 | ~ 72 | – | |
| 0,9 | ~ 36 | 1,9 | ~ 76 | – | |
| 1,0 | ~ 40 | 2,0 | ~ 80 | – |
За данную практическую работу учащиеся
получают две оценки: одна – за экспериментальную
часть, вторая – за знание теории. Во время
проведения практической работы соблюдаются все
правила поведения на уроке, и поскольку этот урок
обучающий, учащиеся не ограничены в
использовании информационного материала, в
общении с соседом, они могут полностью проявить
свою творческую самостоятельность. При проверке
тетрадей учитель (в силу своей педагогической
зоркости) учитывает все нюансы – все, что
позволяет сделать правильное умозаключение,
справедливое и объективное.
* * *
Автор знаком практически со всеми публикациями
в методической литературе, предназначенной
учителю химии, за последние 40 лет, но не
встречался с аналогом данного материала. Это
дает моральное право претендовать на новизну
идеи, которая десятилетиями «прокручивалась» в
личном опыте и начиналась с практической работы
по получению нитробензола и бромэтана.
Считаю своим долгом публично поделиться
опытом. Не исключаю, что этот опыт – не
единственное явление в реальном обучении химии.
Л и т е р а т у р а
1. Шмуклер Е.Г. Решение многоходовых
количественных задач. Химия (ИД «Первое
сентября»), 2004, № 42, с. 10–13.
2. Шмуклер Е.Г. Развитие у учащихся умений и
навыков в решении типовых задач в IХ и X классах.
Химия в школе, 1989, № 2, с. 64–74.
3. Цветков Л.А. Органическая химия. Учебник
для 10 класса средней школы. М.: Просвещение, 1988, с.
137–139, 231.
4. Шмуклер Е.Г. К вопросу об ученических
тетрадях по химии. Химия (ИД «Первое сентября»),
2006, № 5, с. 26–29.
Е.Г.ШМУКЛЕР,
заслуженный учитель Украины
(г. Славута, Украина)
Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
![]()
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
![]()
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| 1. Записываем краткое условие задачи |
Дано: m (Mg) = 1,2 г m практическая(MgSO4) = 5,5 г _____________________ Найти: |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль |
|
4. Находим количество вещества реагента по формулам
|
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим массовую (объёмную) долю выхода продукта по формуле
|
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m(CaO) = 16,8 г
___________________ Найти: m практ (CaC2) = ? |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
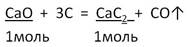 |
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64г/моль |
|
4. Находим количество вещества реагента по формулам
|
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль |
|
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле
|
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г Ответ: m практич (CaC2) = 15,36 г |
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л = 85% или 0,85 ____________________ Найти: m(Na2CO3) =? |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: |
Vтеоретич(CO2) = = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 5. Находим количество вещества реагента по УХР |
По УХР:
ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
6. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm |
m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
♥VnZ♥
Ученик
(144),
закрыт
12 лет назад
Определите выход эфира
Ирина Рудерфер
Высший разум
(120406)
12 лет назад
СН3ОН + СН3СООН <=> CH3COOCH3
12 г метанола – это 12/32 = 0,375 моля
10 г уксусной кислоты это 10/60= 0,16667 моля, то есть метанол взят в избытке, расчет ведем по уксусной кислоте
Теоретический выход эфира находим по пропорции:
Из 60 г кислоты – 74 г эфира
Из 10 г кислоты – Х г эфира
Х = 74*10/60 = 12,33 г эфира
Выход 10,5*100/12,33 = 85,2 %
