Загрузить PDF
Загрузить PDF
В химии теоретический выход – это максимальное количество продукта, которое получается в результате химической реакции. На самом деле большинство реакций не являются идеальными, то есть практический выход продукта всегда меньше теоретического. Чтобы вычислить эффективность реакции, необходимо найти процент выхода продукта по формуле: выход (%) = (практический выход/теоретический выход) x100. Если процент выхода равен 90%, это означает, что реакция эффективна на 90%, а 10% реагентов были потрачены впустую (они не вступили в реакцию или не соединились).
-

1
Начните со сбалансированного химического уравнения. Химическое уравнение включает реагенты (слева от знака равенства) и образующиеся продукты (справа от знака равенства). В некоторых задачах химическое уравнение дано, а в других его надо написать. Во время химической реакции атомы не создаются и не уничтожаются, поэтому у каждого элемента должно быть одинаковое число атомов слева и справа от знака равенства.[1]
-

2
Найдите молярную массу каждого исходного вещества. Определите молярную массу каждого атома вещества, а затем сложите молярные массы, чтобы вычислить молярную массу всего вещества. Сделайте это для одной молекулы реагента.
-

3
Преобразуйте массу каждого реагента из граммов в число молей. Теперь рассмотрите реакцию, которую вы собираетесь провести. Запишите массу каждого реагента в граммах. Полученное значение разделите на молярную массу вещества, чтобы преобразовать граммы в число молей.[2]
-

4
Найдите молярное соотношение реагентов. Помните, что моль – это величина, которая используется химиками для «подсчета» молекул. Вы определили количество молекул каждого исходного вещества. Разделите число молей одного реагента на число молей другого, чтобы найти молярное соотношение двух реагентов.
- Вы взяли 1,25 моль кислорода и 0,139 моль глюкозы. Молярное соотношение кислорода и глюкозы: 1,25/0,139 = 9. Это означает, что на 1 молекулу глюкозы приходятся 9 молекул кислорода.
-

5
Найдите оптимальное соотношение реагентов. Вернитесь к сбалансированному уравнению, которое вы записали ранее. С помощью этого уравнения можно определить оптимальное соотношение реагентов, то есть соотношение, при котором оба вещества будут израсходованы одновременно.
- Левая сторона уравнения:
. То есть на 1 одну молекулу глюкозы приходятся 6 молекул кислорода. Оптимальное соотношение реагентов: 6 кислород/ 1 глюкоза = 6.
- Не перепутайте вещества, которые находятся в числителе и в знаменателе дроби. Если поделить кислород на глюкозу, а потом глюкозу на кислород, вы получите неправильный результат.
- Левая сторона уравнения:
-

6
Сравните соотношения, чтобы найти ключевой компонент реакции. В химической реакции один реагент расходуется быстрее другого. Такой ключевой реагент определяет скорость химической реакции. Сравните два соотношения, которые вы вычислили, чтобы найти ключевой реагент:[3]
- Если молярное соотношение больше оптимального, вещества, которое находится в числителе дроби, слишком много. При этом вещество, которое находится в знаменателе дроби, является ключевым реагентом.
- Если молярное соотношение меньше оптимального, вещества, которое находится в числителе дроби, слишком мало и оно является ключевым реагентом.
- В нашем примере молярное соотношение (кислород/глюкоза = 9) больше оптимального соотношения (кислород/глюкоза = 6). Таким образом, вещество, которое находится в знаменателе дроби (глюкоза), является ключевым реагентом.
Реклама
-

1
Определите продукты реакции. В правой части химического уравнения перечислены продукты реакции. Каждый продукт имеет теоретический выход, то есть количество продукта, которое получится в случае идеальной реакции.
-

2
Запишите число молей ключевого реагента. Теоретический выход продукта равен количеству продукта, который получится при идеальных условиях. Чтобы вычислить теоретический выход, начните с числа молей ключевого реагента (читайте предыдущий раздел).
- В нашем примере вы выяснили, что ключевым реагентом является глюкоза. Также вы вычислили, что взяли 0,139 моль глюкозы.
-

3
Найдите соотношение молекул продукта и реагента. Вернитесь к сбалансированному уравнению. Разделите количество молекул продукта на количество молекул ключевого реагента.
-

4
Умножьте полученное соотношение на количество реагента в молях. Так вы получите теоретический выход продукта (в молях).
- Вы взяли 0,139 моль глюкозы, а отношение углекислого газа к глюкозе равно 6. Теоретический выход углекислого газа: (0,139 моль глюкозы) x (6 моль углекислого газа/1 моль глюкозы) = 0,834 моль углекислого газа.
-

5
Полученный результат преобразуйте в граммы. Полученное число молей умножьте на молярную массу продукта, чтобы найти теоретический выход в граммах. Эту единицу измерения можно использовать в большинстве экспериментов.
- Например, молярная масса CO2 приблизительно равна 44 г/моль (молярная масса углерода ≈ 12 г/моль, молярная масса кислорода ≈ 16 г/моль, поэтому 12 + 16 + 16 = 44).
- Перемножьте: 0,834 моль CO2 x 44 г/моль CO2 ≈ 36,7 г. Теоретический выход продукта равен 36,7 г CO2.
Реклама
-

1
Уясните, что такое процент выхода. Теоретический выход предполагает, что реакция прошла идеально. На самом деле, идеальных реакций не бывает: нежелательные примеси и другие непредсказуемые проблемы приводят к тому, что часть реагентов не преобразуется в продукт. Поэтому в химии используются три понятия, которые характеризуют выход продукта:
- Теоретический выход – это максимальное количество продукта, которое может получиться в результате реакции.
- Практический выход – это реальное количество продукта, масса которого измеряется на весах.
- Процент выхода = (практический выход/теоретический выход)*100%. Например, если процент выхода равен 50%, это означает, что количество продукта составляет 50% от теоретически возможного.
-

2
Запишите практический выход продукта. Если вы провели эксперимент самостоятельно, соберите продукт реакции и взвесьте его на весах, чтобы найти его массу. Если перед вами химическая задача или результаты чужого эксперимента, практический выход будет дан.
- Предположим, что в результате реакции вы получили 29 г CO2.
-

3
Разделите практический выход на теоретический. Убедитесь, что вы используете одну и ту же единицу измерения для обоих значений (обычно граммы). Результат запишите без единицы измерения.
- Практический выход равен 29 г, а теоретический выход равен 36,7 г:
- Практический выход равен 29 г, а теоретический выход равен 36,7 г:
-

4
Результат умножьте на 100, чтобы получить проценты. Так вы вычислите процент выхода продукта.
- 0,79 x 100 = 79, то есть процент выхода продукта равен 79%. Таким образом, в результате реакции получилось 79% от максимально возможного количества CO2.
Реклама
Советы
- Некоторые учащиеся путают процентный выход (количество практического выхода по отношению к теоретическому) с процентной погрешностью (как практический выход отличается от теоретического). Формула для вычисления процента выхода (процентного выхода): (практический выход/теоретический выход)*100%. Чтобы вычислить процентную погрешность, в знаменателе этой формулы нужно записать разность между практическим и теоретическим выходам.
- Если вы получили совершенно разные результаты, проверьте единицы измерения. Если практический выход отличается от теоретического на порядок или больше, скорее всего, на каком-то этапе вычислений вы использовали неправильные единицы измерения. Повторите вычисления и следите за единицами измерения.
- Если процент выхода больше 100%, и вы уверены в правильности вычислений, продукт имеет нежелательные примеси. Очистите продукт (например, высушите или отфильтруйте его), а затем снова взвесьте.
Реклама
Об этой статье
Эту страницу просматривали 51 406 раз.
Была ли эта статья полезной?
Задачи на выход продукта химической реакции. Как решать задачи на выход продукта реакции. Что такое выход продукта химической реакции. Теоретическое и практическое количество продукта химической реакции.
При решении задач на расчеты по уравнениям химических реакций мы принимаем, что в ходе реакции образуется точно рассчитанное количество продукта, исходя из мольного соотношения реагентов и продуктов. Количество продукта реакции, которое должно получится из реагентов согласно стехиометрическим расчетам — это теоретическое количество (масса, объем) или теоретический выход продукта реакции nтеор.
Однако на практике это соотношение не выполняется, и в большинстве случаев образуется меньшее количество продукта реакции, чем было рассчитано — практическое количество (масса, объем) или практический выход продукта реакции nпр.
Практический и теоретический выход не совпадают в силу разных причин — неэффективные соударения реагирующих частиц, побочные процессы, потери в ходе проведения реакции и т.д.
Обратите внимание! Понятия теоретического или практического количества реагента не существует. Ведь мы всегда берем определенное количество реагентов. А вот вступать в реакцию не полностью реагенты могут.
Массовая (мольная, объемная) доля выхода продукта реакции η или ω — это соотношение массы (количества вещества, объема) продукта, которая практически получена в ходе реакции, mпр., к массе (количеству, объему) продукта, которая рассчитана теоретически, mтеор.:
η = mпр./mтеор.
Массовую (мольную, объемную) долю выхода продукта реакции можно выражать в долях, а можно в процентах:
η = mпр./mтеор.·100%
Рассмотрим несколько задач на определение и использование выхода продукта реакции.
1. Какое количество вещества аммиака получится при действии избытка раствора гидроксида натрия на 500 г сульфата аммония, если выход в данной реакции 70%?
Решение.
2NaOH + (NH4)2SO4 = Na2SO4 + 2NH3 + 2H2O
Количество вещества сульфата аммония:
n((NH4)2SO4) = m/M = 500/132 = 3,79 моль
Теоретическое количество аммиака:
nтеор.(NH3) = 2·n((NH4)2SO4) = 2·3,79 = 7,58 моль
Зная мольную долю выхода продукта реакции, определим практический выход аммиака:
nпр.(NH3) = η·nтеор.(NH3) = 0,7·7,58 = 5,3 моль
Ответ: nпр.(NH3) = 5,3 моль
2. При хлорировании метана объемом 112 л (н. у.) получен дихлорметан массой 255 г. Определите долю выхода дихлорметана.
Решение.
CH4 + 2Cl2 = CH2Cl2 + 2HCl
Количество вещества метана:
n(CH4) = V/Vm = 112/22,4 = 5 моль
Теоретическое количество дихлорметана:
nтеор.(CH2Cl2) = n(CH4) = 5 моль
mтеор.(CH2Cl2) = M·nтеор.(CH2Cl2) = 85 г/моль·5 моль = 425 г
Масса дихлорметана, которая приведена в условии задачи — это практический выход дихлорметана.
Доля выхода дихлорметана:
η = mпр./mтеор. = 255/425 = 0,6 или 60%
Ответ: выход продукта реакции 60%
3. Определите массу оксида меди (II), которая потребуется для получения 500 г нитрата меди, если доля выхода в реакции взаимодействия оксида меди с HNO3 составляет 92%?
4. Определите объем (н.у., л) аммиака, который получится при действии избытка раствора гидроксида натрия на 48 г карбоната аммония, если выход в реакции составляет 70%?
5. Определите массу соли, г, которая образуется при растворении в избытке азотной кислоты 80 г оксида меди (II), если выход в реакции составляет 80%?
6. При термическом разложении 1700 г нитрата натрия было получено 174,4 л кислорода (н.у.). Определите массовую долю выхода в этой реакции.
7. Рассчитайте массу оксида магния, которая образуется при разложении гидроксида магния массой 50 г, если реакция разложений прошла с выходом 95,5%.
8. Какая масса бензола (кг) может получиться из 369,6 м3 (н.у.) ацетилена, если доля выхода бензола составила 65% от теоретически возможного?
9. Определите массу спирта, полученного при гидратации 40 л пропилена (н.у.), если доля выхода продукта реакции составляет 65% от теоретически возможного.
10. Определите долю выхода в реакции каталитического окисления аммиака кислородом, если при окислении 10 моль аммиака образуется 200 л оксида азота (II) при н.у.?
11. Пары брома объемом 20 л смешали с избытком водорода, в результате из смеси выделили 32 л бромоводорода. Определите долю выхода, %, если объемы газов измерялись при одинаковых условиях.
12. Оксид кальция массой 0,64 кг нагрели до 1200° С с достаточной массой оксида кремния (IV). Масса образовавшегося силиката кальция оказалась равной 1,024 кг. Определите выход (%) реакции соединения.
13. Из 36 г метанола было получено 24 г диметилового эфира. Рассчитайте выход реакции дегидратации
14. Углекислый газ объемом 6 л (н.у.) пропустили над раскалённым углем, продукт реакции пропустили через избыток известковой воды, после чего собрали 7,2 л (н.у.) газа. Определите степень превращения углекислого газа, %.
15. Определите массу, г нитрата аммония, которая содержалась в растворе, если при действии на этот раствор избытка гидроксида кальция выделилось 6 г аммиака. Реакция прошла с выходом 88,2 %.
16. При термическом разложении не загрязненного примесями карбоната кальция образовалось 20 г оксида кальция. Известно, что реакция прошла с выходом 85%. Вычислите массу карбоната кальция, взятого для проведения реакции разложений и объем (н.у.) образовавшегося углекислого газа.
17. Какой объем пропана (н.у.) потребуется для получения 42 г пропена, если доля выхода продуктов реакции составляет 60% от теоретически возможного?
18. При бромировании пентена-2 массой 8,4 г получен 2,3-дибромпентан массой 24,3 г. Определите долю выхода продукта реакции.
19. Из 69 г этанола получен бутадиен-1,3 массой 36,85 г. Определите массовую долю выхода продукта реакции.
20. При бромировании 5,4 г дивинила избытком брома образуется 28,2 г 1,2,3,4-тетрабромбутана. Определите выход продукта реакции.
21. Определите, какая масса 2-метилбутана необходима для получения 46,24 г изопрена, если доля выхода продукта реакции составляет 85%?
22. Определите объем метана, который потребуется для получения 63 л ацетилена (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
23. Определите, какую массу уксусного альдегида можно получить по реакции Кучерова из 11,2 л ацетилена (н. у.), если доля выхода продуктов реакции составляет 80% от теоретически возможного?
24. При действии избытка воды на 48 г технического карбида кальция, содержащего 10% примесей, образовался ацетилен объемом 10,08 л (н.у.). Определите долю выхода продукта реакции.
25. Определите массу технического карбида алюминия, содержащего 7% примесей, необходимого для получения 56 л метана (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
26. Из 179,2 л бутана (н.у.) с объемной долей примесей 25% двухстадийным синтезом получен бутанол-2 массой 159,84 г. Доли выхода продуктов на первой и второй стадиях одинаковы. Определите доли выхода продуктов реакций.
27. Циклогексан массой 16 г сожгли в избытке кислорода и полученный углекислый газ пропустили через избыток раствора гидроксида кальция, в результате чего выпал осадок массой 90 г. Определите массовую долю негорючих примесей в циклогексане, если доля выхода продуктов горения составляет 90% от теоретически возможного.
28. При нитровании 46,8 г бензола получен нитробензол массой 66,42 г. Определите выход продуктов реакции.
Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
![]()
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
![]()
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| 1. Записываем краткое условие задачи |
Дано: m (Mg) = 1,2 г m практическая(MgSO4) = 5,5 г _____________________ Найти: |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль |
|
4. Находим количество вещества реагента по формулам
|
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим массовую (объёмную) долю выхода продукта по формуле
|
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m(CaO) = 16,8 г
___________________ Найти: m практ (CaC2) = ? |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
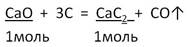 |
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64г/моль |
|
4. Находим количество вещества реагента по формулам
|
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль |
|
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле
|
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г Ответ: m практич (CaC2) = 15,36 г |
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л = 85% или 0,85 ____________________ Найти: m(Na2CO3) =? |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: |
Vтеоретич(CO2) = = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 5. Находим количество вещества реагента по УХР |
По УХР:
ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
6. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm |
m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Содержание
- Перерасчет массы сырья и полуфабрикатов на одну порцию с определенным выходом блюда
- Расчет выхода блюда
- Особенности составления калькуляции блюд для столовых общепита
- Что необходимо для калькуляции
- Технологическая карта
- Закупочные цены
- Как проводить подсчеты ручным способом
- Использование электронных таблиц и программ
- Основные этапы калькуляции
- Видео
- Расчет выхода блюда
- LiveInternetLiveInternet
- —Цитатник
- —Рубрики
- —Помощь новичкам
- —Приложения
- —Метки
- —Новости
- —Ссылки
- —Музыка
- —Фотоальбом
- —Стена
- —Поиск по дневнику
- —Подписка по e-mail
- —Интересы
- —Друзья
- —Постоянные читатели
- —Сообщества
- —Статистика
- Выход мясных и рыбных блюд
Перерасчет массы сырья и полуфабрикатов на одну порцию с определенным выходом блюда
Если в сборнике рецептур выход блюда дан на 1000 гр., то перерасчет на 1 порцию с определенным выходом производится по формуле:
 ((1)
((1)
где МН – масса сырья нетто на одну порцию с определенным выходом, г;
РН – масса нетто по рецептуре сборника, г;
ВВ – выход 1-й порции, г;
ВСР – выход готового блюда по рецептуре сборника (1000 г).
Пример расчета количества отходов при обработке
овощей по рецептуре (в г, %)
Пример: По рецептуре №144 III к., при приготовлении щей масса брутто моркови – 25 гр., масса нетто – 20 гр., (порция 500 гр.). Определяем количество отходов при обработке моркови. Для этого вычитаем массу нетто
из массы брутто: 25-20 = 5 гр. – количество отходов при обработке моркови в граммах.
Определяем количество отходов в %. Для этого принимаем массу брутто за 100 % и находим, сколько процентов приходится на массу нетто, разность между процентами и составит % отходов при обработке моркови.
 — приходится на массу нетто (в %).
— приходится на массу нетто (в %).
Определение производственных потерь при изготовлении блюда (изделия)
Определение производственных потерь производят в соответствии с ГОСТом Р 53106-2008 «Метод расчета отходов и потерь сырья и пищевой продукции при производстве продуктов общественного питания» по формулам:
 ·100% (3)
·100% (3)
где Пп – производственные потери, кг (1) или % (2).
Мн – суммарная масса сырья (нетто), входящего в состав п/ф, г.
Мп/ф – масса полученного полуфабриката, г.
Полученные при обработке данные сравнивают с расчетными по рецептуре.
Определение потерь при тепловой обработке
Рассчитывают в % к массе п/ф по формуле (4):
где Пm – потери при тепловой обработке с учетом потерь при остывании блюда (изделия), %.
Мп/ф – масса полуфабриката подготовленного к тепловой обработке, г.
Мг – масса готового блюда (изделия) после тепловой обработки, г.
Примечание: Готовое блюдо (изделие) взвешивают после остывания при температуре 40°С;
– блюда (изделия), отпускаемые в горячем виде (супы, вторые горячие блюда и т.п.), при температуре 14°С – блюда (изделия), отпускаемые в холодном виде (закуски, холодные блюда, сладкие блюда и т.п.).
Потери при порционировании рассчитывают к массе готового блюда (изделия) по формуле (5):
где ПП – потери при порционировании, %;
МГ – масса готового блюда (изделия) до порционирования, кг;
МП – масса готового блюда (изделия) после порционирования, кг.
Расчет массы брутто сырья
Расчет производится в случаях:
— необходимого увеличения или уменьшения массы нетто сырья;
— изменения массы сырья брутто при механической обработке овощей;
Расчет производят по формуле:
 (6)
(6)
где МБ – масса сырья брутто, г;
О – отходы при механической обработке сырья, %.
Примечание: Отходы при механической обработке сырья (0, %) – см. таблицу №27 сборник рецептур блюд и кулинарных изделий 2006 г. для ПОП.



Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Источник
Расчет выхода блюда



Выход блюда можно подсчитать теоретически. Расчет производят в таблице 2. Процент потерь при механической обработке определяется по таблицам Сборников рецептур [7,8,9,10,11,12]. Процент потерь при тепловой обработке определяется по приложению К. Процент потерь при тепловой обработке определяется только для готового блюда.
Таблица 2 – Расчет выхода блюда
Составление алгоритма приготовления блюда (технологической схемы)
Алгоритм приготовления блюда необходимо составить с учетом всех технологических операций, их последовательности, режимов кулинарной обработки, особенностей отпуска (отдельно от курсовой).
Расчет пищевой ценности сырьевого набора блюда
Для расчета пищевой ценности сырья на то или иное блюдо (изделие) необходимо знать: точную рецептуру блюда или изделия (по Мн), химический состав пищевого сырья, используемого при приготовлении блюда (изделия), в том числе количество добавляемой соли, выход готового блюда (изделия). Данные по химическому составу сырых пищевых продуктов приведены в табл. 1-9 справочника «Химический состав пищевых продуктов», книга 1, 1987, с. 12-105. Можно использовать другие аналогичные справочники.
В зависимости от нормы закладки продуктов рассчитывают состав сырьевого набора. Расчеты можно производить в программе Ехсеl. Данные расчетов переносятся в аналогичную таблицу 3.
| Наименование сырья | Масса нетто 1 порции, г | Белки, г | Жиры, г | Углеводы, г | |
| 100г | 1 пор | 100г | 1 пор | 100г | 1 пор |
| Итого в сырьевом наборе |
Разработка показателей качества
При определении показателей качества и безопасности авторского блюда необходимо остановиться на трех группах показателей:
В разделе «Показатели качества и безопасность» указываются органолептические показатели блюда (изделия): внешний вид, вкус, цвет, запах, консистенция, а также физико-химические и микробиологические показатели, влияющие на безопасность блюда (изделия), в соответствии с
СП 2.3.6. 1079-01 санитарно-эпидемиологические требования к организациям общественного питания, изготовлению и оборотоспособности в них пищевых продуктов и продовольственного сырья.
Органолептические показатели
Для определения органолептических показателей необходима экспериментальная отработка авторского блюда.
Источник
Особенности составления калькуляции блюд для столовых общепита
Точки общепита всегда были и остаются популярными. Это и понятно, ведь не у каждого есть время на приготовление кулинарных изысков. Тем не менее вкусно поесть хочется каждому. При этом стоит отметить, что иметь золотые руки для бизнеса недостаточно, так как конкуренция слишком высока. Многим вообще может показаться, что заработать с помощью столовой невозможно. Но большинство людей предпочитают классику в еде, и это многого стоит.
Для предприятий общепита важно составить калькуляции блюд так, чтобы не отпугивать клиентов слишком высокими ценами и в то же время не работать себе в ущерб. Рассмотрим, как же составить эту самую калькуляцию.
Что необходимо для калькуляции
Для того, чтобы корректно вывести калькуляцию, потребуется:
Рассмотрим каждый из этих пунктов.
Выбирая блюда для столовой, не стоит вдаваться в крайности. Здесь должны быть представлены простые кушанья. Кроме того, калькуляция блюд при сложных позициях станет еще более затруднительной.
Технологическая карта
Это документ, в котором содержится информация про все особенности приготовленной еды, такие, как сроки и условия хранения блюда, пищевая ценность, рецепт с составом и алгоритмом приготовления, требования к подаче и реализации готового изделия, внешний вид, вес порции.
Пренебрежение этим документом недопустимо. Технологическую карту можно приобрести уже готовую или составить самостоятельно. Первый вариант достаточно затратен, а второй не так сложен, как может показаться вначале.
Закупочные цены
Без этого пункта невозможно рассчитать калькуляцию. К ним желательно добавить расходы на транспорт.
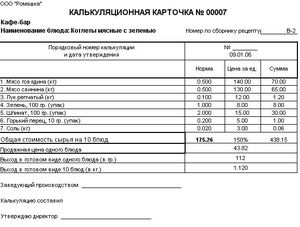
Как проводить подсчеты ручным способом
Имея все необходимые данные, описанные выше, необходимо составить список нужных продуктов для приготовления блюда, указать их количество, закупочную цену. Все данные можно внести в соответствующую калькуляционную карточку формы ОП-1 (образцы карточек, впрочем, как и саму форму, можно найти в Интернете). И все просуммировать. Таким образом можно подсчитать себестоимость блюда. Стоит отметить, что калькуляция составляется в расчете на 1, 100 порций.
Приведем пример калькуляции одной порции для котлеты по-киевски.
Для этого блюда необходимо:
Использование электронных таблиц и программ
Высчитывать себестоимость блюда каждый раз ручным способом нерационально. Поэтому очень удобно пользоваться электронными таблицами, например, Microsoft Excel. В этой программе можно создать шаблон, в котором будут присутствовать все необходимые для приготовления пищи продукты, прописать формулу подсчета и, при изменении закупочной цены, вносить необходимые корректировки.
Если планируется автоматизированный учет, например, использование программы «1С Общепит», то тут все еще проще. Практически во всех торговых программах есть функция «калькуляция блюд». В нее можно вносить не только актуальные закупочные цены, но и отслеживать перемещение, списание продуктов.
В 1С основным документом для расчета калькуляции является «Рецептура». В ней будут заполнены обычные реквизиты. В табличной части будет список необходимых ингредиентов для блюда в соответствии с номенклатурой. Необходимо будет внести данные в графу «Брутто», рассчитать процент потери при разных способах обработки и выход ингредиентов после нее. Можно также вводить аналоги, замены для компонентов.
В документ можно вносить информацию по технологии приготовления и химикоэнергетическим характеристикам.
Благодаря «1С Общепит» можно вести учет сложных яств, формировать «Рецептуру» из нескольких уровней. Для тех блюд, в которых возможно варьирование количественного содержания ингредиентов, есть документ «Акт переработки». В нем будут указываться количественные показатели компонентов несколько раз и рассчитываться среднее значение. На основе этих данных и будет сформирована «Рецептура», которая автоматически сформируется в стандартную карточку для калькуляции ОП-1.

Основные этапы калькуляции
Калькуляция производится в соответствии с таким порядком:
Калькуляционную карту необходимо заполнить в таком порядке:
Благодаря калькуляции можно отследить прибыльность тех или иных позиций, необходимость в новых блюдах или, наоборот, в сокращении тех, которые себя не окупают.
Видео
Это видео познакомит вас с программой учета питания и продуктов.
Источник
Расчет выхода блюда
Выход блюда можно подсчитать теоретически. Расчет производят в таблице 2. Процент потерь при механической обработке определяется по таблицам Сборников рецептур [7,8,9,10,11,13,14,15,17,18,19,20,21,22,23,24,25,28]. Процент потерь при тепловой обработке определяется по приложению К. Процент потерь при тепловой обработке определяется только для готового блюда.
Примерный образец
Таблица 2 – Расчет выхода блюда
Пример расчета
Также производится расчёт Массы готового продукта
М готового продукта Х г = 110 * 63 / 100 = 69 г
Составление алгоритма приготовления блюда (технологической схемы)
Алгоритм приготовления блюда необходимо составить с учетом всех технологических операций, их последовательности, режимов кулинарной обработки, особенностей отпуска (отдельно от курсовой).
Расчет пищевой ценности сырьевого набора блюда
Для расчета пищевой ценности сырья на то или иное блюдо (изделие) необходимо знать: точную рецептуру блюда или изделия (по Мн), химический состав пищевого сырья, используемого при приготовлении блюда (изделия), в том числе количество добавляемой соли, выход готового блюда (изделия). Данные по химическому составу сырых пищевых продуктов приведены в табл. 1-9 справочника «Химический состав пищевых продуктов», книга 1, 1987, с. 12-105. Можно использовать другие аналогичные справочники.
В зависимости от нормы закладки продуктов рассчитывают состав сырьевого набора. Расчеты можно производить в программе Ехсеl. Данные расчетов переносятся в аналогичную таблицу 3.
Примерный образец
Пример расчета
Белки (говядина) 18,6 * 110 / 100 = 20,46 г
Жиры (говядина) 16 * 110 / 100 = 17,6 г и т. д.
По всем компонентам, входящим в состав блюда, произвести расчет содержания белков, жиров, углеводов на 1 порцию.
Разработка показателей качества авторского блюда
При определении показателей качества и безопасности авторского блюда необходимо остановиться на двух группах показателей:
Источник
LiveInternetLiveInternet
—Цитатник
Панно «Рыбы». Опубликовала: westo4ka7. https://fotki.yandex.ru/next/users/swetakexel/album/2.
Жаккард крючком в технике Bricks Crochet. Автор: Александра https://www.instagram.com/alfekka_cro.
Детский цветной кардиган спицами с капюшоном Нежный и красивый детский кардиган спица.
МК пинетки для девочки 1. Пинетки с кучеряшками. Очень похожи на пирожное 🙂 2. Основ.
—Рубрики
—Помощь новичкам
—Приложения
—Метки
—Новости
—Ссылки
—Музыка
—Фотоальбом
—Стена
—Поиск по дневнику
—Подписка по e-mail
—Интересы
—Друзья
—Постоянные читатели
—Сообщества
—Статистика
Выход мясных и рыбных блюд
Выход мясных и рыбных блюд
Чтв, 09.10.2008 08:24 — Chef
Поясним, как определяется выход котлет, на примере. Согласно таблице I (приложение), отходы при холодной обработке мяса 1-й категории составляют 26 %, для мяса 2-й категории — 29,5 %. Это значит, что из 1 кг мяса 1-й категории выход мякоти составит (1000 — 260) = 740 г, а из мяса 2-й категории — (1000 — 295) = 705 г. Процент отходов дается в целом по туше. Однако детские учреждения получают в большинстве случаев отдельные части туши, поэтому практический выход мякоти будет несколько иной. Как же определить выход, если, например, из мяса по меню необходимо приготовить котлеты?
Разберем два варианта (с мясом 1-й и 2-й категории).
Получена котлетная часть говяжьего мяса 1-й категории, из которой фактический выход мякоти соответствует расчетному. Раскладкой намечено приготовить котлеты паровые для детей раннего возраста и жареные для детей дошкольного возраста.
Меню-раскладка продуктов для приготовления котлет
Котлеты паровые Котлеты жареные
Продукт Масса (г) Продукт Масса (г)
Брутто Нетто Брутто Нетто
Мясо говяжье 1-й категории 60 44,4 Мясо говяжье 1-й категории 80 59.2
Булка 10 10 Булка 12 12
Молоко или вода 13 13 Молоко или вода 17,3 17,3
Масло сливочное 3 3 Яйцо 5 4,3
Яйцо 2 1,7 Лук 5 4,2
Сухари или мука 3 3
Количество полуфабриката 72,1 г Количество полуфабриката 100 г
Из раскладки, приведенной выше, видим, что на котлету для ребенка дошкольного возраста расходуется 80 г говяжьего мяса 1-й категории (масса брутто). Вычисляем, сколько получится мякоти из 80 г мяса брутто, если отходы равны 26% (приложение, табл. I). Составляем пропорцию:
в 100 г (брутто) — 74 г мякоти.
80 г — x
В фарш по раскладке входит еще 12 г булки, 17,3 г молока, 4,3 г (нетто) яйца, 4,2 г (нетто) лука. Подсчитывают массу сырого фарша по нетто: на одну котлету она составит 97 г, с панировкой (3 г) — 100 г. Потери при тепловой обработке составляют 18—20 % исходной массы сырой котлеты, в среднем 19 %. При жарении и запекании только до образования мягкой нежной корки процент потерь уменьшается.
В итоге масса жареной котлеты должна быть:
100 г — 19 г = 81 г
С учетом естественных потерь выход жареной котлеты в среднем будет равен 80 г.
Чтобы приготовить такую же котлету (массой 80 г) из мяса 2-й категории, надо увеличить по раскладке количество мяса. Производим расчет требуемого количества мяса 2-й категории: если в 100 г мяса 2-й категории — 70,5 г, то сколько необходимо взять мяса (брутто), чтобы получить 59,2 г мякоти? Составляем пропорцию:
100 г (брутто) — 70,5 г мякоти
х — 59,2 г
Отходы составляют 33 %.
Таким же образом определяют отходы из любой партии полученного картофеля. Результаты пробной очистки картофеля записывают в бракеражную тетрадь. Чтобы избежать завышенного списания картофеля на блюда в детских учреждениях, необходимо пробные очистки проводить с определенной периодичностью. Например, нужно подсчитать, сколько картофеля с установленным отходом 33 % потребуется, чтобы приготовить картофельное пюре из расчета 130 г на одного ребенка дошкольного возраста и 100 г на одного ребенка раннего возраста. В картофельное пюре добавляют молоко (обычно 30 г на порцию), следовательно, картофельной массы для выхода 130 г пюре потребуется 100 г. Потери при варке очищенного картофеля составляют 3 % (приложение, табл. III). Поэтому для выхода 100 г вареного картофеля требуется 103 г сырого очищенного.
Расчет: если из 100 г картофеля (брутто) при отходе 33 % получается 67 г очищенного картофеля (нетто), то для получения 103 г необходимо:
Итак, для получения 103 г очищенного картофеля нужно взять 153 г картофеля неочищенного (брутто). В пюре добавляется 5 г сливочного масла, поэтому по расчету выход пюре должен быть не 130 г, а 135 г. Однако, учитывая такие потери, как остатки на кастрюлях, выход в итоге составит 130 г. Если вычислен расход картофеля на выходе пюре для детей дошкольного возраста, то расход картофеля на выход 100 г для детей раннего возраста можно установить по пропорции:
Для установления выхода более сложного блюда, например овощного рагу, по таблице определяют потери при холодной и тепловой обработке для каждого вида овощей в отдельности. Если качество овощей не соответствует необходимым кондициям, то потери при холодной обработке рассчитывают и регистрируют по тем же правилам, что и для картофеля.
Выход первых и третьих блюд. Закладка продуктов производится по рецептуре, а объем воды — по расчету. Для этого на всех котлах, кастрюлях наносят уровни, соответствующие объему готовой пищи. Устанавливают объем половников и другой мерной посуды для раздачи пищи. Жидкие блюда выдаются по объему, вторые и гарниры — по весу. Пища не должна готовиться в расчете на добавку, так как это ведет к разбавлению и снижению питательной ценности блюд.
Если все же выход определить трудно, кастрюлю с готовой пищей взвешивают и вычитают массу посуды. Вес пищи делят на количество детей. Однако главное для получения правильного выхода — это полное вложение продуктов по меню-раскладке.
Для приготовления блюд из яиц используют свежие куриные яйца, меланж или яичный порошок*. Использование утиных, гусиных и миражных куриных яиц в соответствии с Санитарными правилами запрещается.
Масса и качество куриных яиц должны соответствовать требованиям действующей технической документацииПеред употреблением яйца промывают сначала теплой водой с 1-2%-ным содержанием кальцинированной соды, затем 0,5%-ным раствором хлорамина, после чего ополаскивают чистой водой**.
Рецептуры Сборника составлены из расчета использования столовых куриных яиц II категории средней массой 46 г с отходом на скорлупу, стек и потери 12,5%.
Исходя из этого, в рецептурах масса сырых и вареных яиц (без скорлупы) предусмотрена 40 г при естественном соотношении желтка и белка 39% и 61% соответственно.
Так, выход готовой яичницы при использовании яиц массой брутто более или менее 46 г пересчитывается по формуле:
Масса нетто яиц без скорлупы = масса яиц в скорлупе х К;
Масса готовой яичницы = (масса нетто яиц без скорлупы + жир на жарку) х 88**
***При тепловой обработке яичницы размер потерь составляет 12%.
Источник
При обучении учащихся решению расчётных задач
по химии учителя сталкиваются с рядом проблем
- решая задачу, учащиеся не понимают сущности
задач и хода их решения; - не анализируют содержание задачи;
- не определяют последовательность действий;
- неправильно используют химический язык,
математические действия и обозначение
физических величин и др.;
Преодоление этих недостатков является одной из
главных целей, который ставит перед собой
учитель, приступая к обучению решению расчетных
задач.
Задача учителя состоит в том, чтобы научить
учащихся анализировать условия задач, через
составление логической схемы решения конкретной
задачи. Составление логической схемы задачи
предотвращает многие ошибки, которые допускают
учащиеся.
Цели урока:
- формирование умения анализировать условие
задачи; - формирование умения определять тип расчетной
задачи, порядок действий при ее решении; - развитие познавательных, интеллектуальных и
творческих способностей.
Задачи урока:
- овладеть способами решения химических задач с
использованием понятия “массовая доля выхода
продукта реакции от теоретического”; - отработать навыки решения расчетных задач;
- способствовать усвоению материала, имеющего
отношение к производственным процессам; - стимулировать углубленное изучение
теоретических вопросов, интерес к решению
творческих задач.
Ход урока
Определяем причину и сущность ситуации,
которые описываются в задачах “на выход
продукта от теоретического”.
В реальных химических реакциях масса продукта
всегда оказывается меньше расчетной. Почему?
- Многие химические реакции обратимы и не доходят
до конца. - При взаимодействии органических веществ часто
образуются побочные продукты. - При гетерогенных реакциях вещества плохо
перемешиваются, и часть веществ просто не
вступает в реакции. - Часть газообразных веществ может улетучиться.
- При получении осадков часть вещества может
остаться в растворе.
Вывод:
- масса теоретическая всегда больше
практической; - объём теоретический всегда больше объёма
практического.
Теоретический выход составляет 100%,
практический выход всегда меньше 100%.
Количество продукта, рассчитанное по уравнению
реакции, – теоретический выход, соответствует 100%.
Доля выхода продукта реакции (![]() – “этта”) – это отношение
– “этта”) – это отношение
массы полученного вещества к массе, которая
должна была бы получиться в соответствии с
расчетом по уравнению реакции.
Три типа задач с понятием “выход продукта”:
1. Даны массы исходного вещества и продукта
реакции. Определить выход продукта.
2. Даны массы исходного вещества и выход продукта
реакции. Определить массу продукта.
3. Даны массы продукта и выход продукта.
Определить массу исходного вещества.
Задачи.
1. При сжигании железа в сосуде, содержащем 21,3 г
хлора, было получено 24,3 г хлорида железа (III).
Рассчитайте выход продукта реакции.
2. Над 16 г серы пропустили водород при
нагревании. Определите объем (н.у.) полученного
сероводорода, если выход продукта реакции
составляет 85% от теоретически возможного.
3. Какой объём оксида углерода (II) был взят для
восстановления оксида железа (III), если получено
11,2г железа с выходом 80% от теоретически
возможного.
Анализ задач.
Каждая задача складывается из совокупности
данных (известные вещества) – условия задачи
(“выход” и т.п.) – и вопроса (вещества, параметры
которых требуется найти). Кроме этого, в ней есть
система зависимостей, которые связывают искомое
с данными и данные между собой.
Задачи анализа:
1) выявить все данные;
2) выявить зависимости между данными и
условиями;
3) выявить зависимости между данным и искомым.
Итак, выясняем:
1. О каких веществах идет речь?
2. Какие изменения произошли с веществами?
3. Какие величины названы в условии задачи?
4. Какие данные – практические или
теоретические, названы в условии задачи?
5. Какие из данных можно непосредственно
использовать для расчётов по уравнениям реакций,
а какие необходимо преобразовать, используя
массовую долю выхода?
Алгоритмы решения задач трёх типов:
Определение выхода продукта в % от теоретически
возможного.
1. Запишите уравнение химической реакции и
расставьте коэффициенты.
2. Под формулами веществ напишите количество
вещества согласно коэффициентам.
3. Практически полученная масса известна.
4. Определите теоретическую массу.
5. Определите выход продукта реакции (%), отнеся
практическую массу к теоретической и умножив на
100%.
6. Запишите ответ.
Расчет массы продукта реакции, если известен
выход продукта.
1. Запишите “дано” и “найти”, запишите
уравнение, расставьте коэффициенты.
2. Найдите теоретическое количество вещества
для исходных веществ. n =![]()
3. Найдите теоретическое количество вещества
продукта реакции, согласно коэффициентам.
4. Вычислите теоретические массу или объем
продукта реакции.
m = M * n или V = Vm * n
5. Вычислите практические массу или объем
продукта реакции (умножьте массу теоретическую
или объем теоретический на долю выхода).
Расчет массы исходного вещества, если известны
масса продукта реакции и выход продукта.
1. По известному практическому объёму или массе,
найдите теоретический объём или массу (используя
долю выхода продукта).
![]()
2. Найдите теоретическое количество вещества
для продукта.
3. Найдите теоретическое количество вещества
для исходного вещества, согласно коэффициентам.
4. С помощью теоретического количества вещества
найдите массу или объем исходных веществ в
реакции.
Домашнее задание.
Решите задачи:
1. Для окисления оксида серы (IV) взяли 112 л (н.у.)
кислорода и получили 760 г оксида серы (VI). Чему
равен выход продукта в процентах от теоретически
возможного?
2. При взаимодействии азота и водорода получили
95 г аммиака NH3 с выходом 35%. Какие объёмы
азота и водорода были взяты для реакции?
3. 64,8 г оксида цинка восстановили избытком
углерода. Определите массу образовавшегося
металла, если выход продукта реакции равен 65%.




