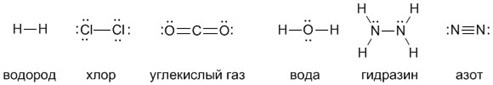Валентность — это способность атомов химических элементов образовывать определенное число химических связей с атомами других химических элементов.
Ковалентные связи могут образовываться по обменному и донорно-акцепторному механизмам.
Обменный механизм образования ковалентной связи — в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет по одному неспаренному электрону.
Донорно-акцепторный механизм — образование связи происходит за счет электронной пары одного из атомов (атом-донор) и вакантной орбитали другого атома (атом-акцептор):
Таким образом, атомы могут образовывать химическую связь не только за счет неспаренных электронов на внешнем энергетическом уровне, но и за счет неподеленных электронных пар, или свободных орбиталей на этом уровне.
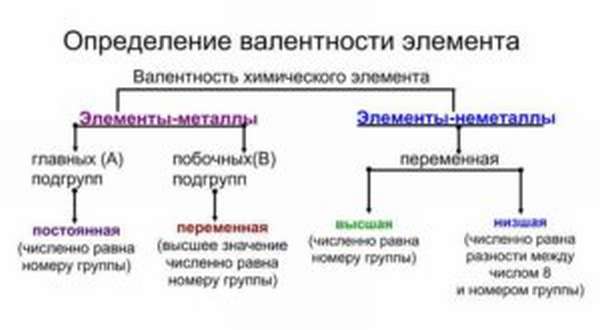
Большинство элементов характеризуются высшей, низшей или промежуточной валентностью в соединениях.
Для большинства элементов высшая валентность, как правило, равна номеру группы, низшая валентность определяется по формуле: 8 — № группы. Промежуточная валентность – это число между низшей и высшей валентностями.
Например, высшая валентность хлора равна VII, низшая валентность хлора равна I, промежуточные валентности — III, V.
Обратите внимание! Степень окисления и валентность — это не одно и то же. Хотя иногда степени окисления совпадают с валентностями. Стпень окисления — это условный заряд атома, он может быть и положительным и отрицательным. А вот образовать отрицательное число связей атом никак не может.
Например, валентность (число связей) атома кислорода в молекуле O2 равна II, а вот степень окисления атома кислорода равна 0.
Большинство элементов проявляют переменную валентность в соединениях, но некоторые элементы проявляют постоянную валентность. Их необходимо запомнить:
| Элемент | Валентность |
| Фтор F | I |
| Кислород О | II |
| Металлы IA группы (Li, Na, K, Rb, Cs, Fr) | I |
| Металлы IIA группы (Be, Mg, Ca, Sr, Ba, Ra) | II |
| Алюминий Al | III |
Как определить валентность атома в соединении?
Рассмотрим валентные возможности атомов второго периода. В силу некоторых ограничений они не соответствуют традиционным «школьным» представлениям.
Итак, не внешнем энергетическом уровне лития 1 неспаренный электрон: 1s22s1.
+3Li 1s2 2s1
Следовательно, литий может образовывать одну связь и валентность лития I.
У бериллия на внешнем энергетическом уровне 2 электрона: 1s22s2.
+4Be 1s2 2s2
В возбужденном состоянии возможен переход электронов внешнего энергетического уровня с одного подуровня на другой: 1s22s12p1.
+4Be* 1s2 2s1
2p1
Таким образом, на внешнем энергетическом уровне бериллия в возбужденном энергетическом состоянии есть 2 неспаренных электрона и две вакантные электронные орбитали. Следовательно, бериллий может образовать 2 связи по обменному механизму, т.е. валентность бериллия равна номеру группы и равна II.
Например, в хлориде бериллия валентность бериллия равна II:
Электронная конфигурация атома бора в основном состоянии +5B 1s22s22p1:
+5B 1s2 2s2
2p1
В возбужденном состоянии: +5B* 1s22s12p2.
+5B 1s2 2s1
2p2
Следовательно, бор может образовывать 3 связи по обменному механизму (за счет неспаренных электронов). Валентность бора в соединениях — III.
Например, в трихлориде бора BCl3 валентность бора равна III.
Однако, при этом у бора остается еще одна вакантная электронная орбиталь. Следовательно, бор может выступать, как акцептор электронной пары.
У атома углерода в возбужденном состоянии на внешнем энергетическом уровне 4 неспаренных электрона: 1s22s12p3, следовательно, максимальная валентность углерода равна IV (как правило, в органических соединениях у углерода именно такая валентность). В основном состоянии у атома углерода 2 неспаренных электрона, и валентность II. Однако посмотрим внимательно: у атома углерода в основном состоянии не внешнем энергетическом уровне есть незанятая (вакантная) электронная орбиталь. Следовательно, он может образовывать еще одну связь — по донорно-акцепторному механизму. Таким образом, в некоторых случаях углерод может образовывать три связи (например, молекула угарного газа CO, строение которой мы рассмотрим позднее).
Валентные возможности атома азота определяются также строением его внешнего энергетического уровня. В основном состоянии электронная формула азота: +7N 1s22s22p3.
За счет 3 неспаренных электронов на p-подуровне азот может образовывать 3 связи по обменному механизму (валентность III), и еще 1 связь азот может образовать по донорно-акцепторному механизму за счет неподеленной электронной пары. Таким образом, максимальная валентность азота в соединениях — IV. На примере азота можно убедиться, что высшая валентность атома и максимальная степень окисления — разные величины, которые далеко не всегда совпадают. Возбужденное состояние с 5 неспаренными электронами для атома азота не реализуется, т.к. на 2 энергетическом уровне есть только s и p орбитали.
Валентность
Слово «валентность» звучит красиво и одновременно загадочно. В этой статье вместе с экспертом разберемся, что скрывается за этим словом: что такое валентность, как ее определить и какова ее роль в химии
Термин «валентность» появился еще в Средние века, где в научных трудах он имел значение «препарат», «экстракт». И только в конце ХIХ столетия его стали использовать для обозначения связей между мельчайшими частицами вещества.
В 1852 году английский химик Э. Франкленд ввел в химию понятие «соединительная сила», которое положило начало учению о валентности. В 1857 году немецкий ученый Ф. А. Кекуле, изучая свойства углерода в метане, пришел к выводу о существовании «основности» атомов – таком же важном и постоянном свойстве, как атомный вес. Спустя три года российский химик А. М. Бутлеров усовершенствовал учение о валентности, распространив его на органические соединения.
Что такое валентность в химии
Валентность – это способность атома образовывать химические связи с другими атомами. Такие связи создаются за счет электронов, расположенных на внешнем электронном слое. Поэтому количественной мерой валентности становится число совместных связей между атомами.
Химические соединения предполагают формирование общих электронных пар. Этот процесс получил наименование «ковалентная химическая связь». В зависимости от числа общих электронных пар выделяют одинарную, двойную и тройную ковалентную связь.
Большим достижением в химии стало наглядное изображение молекул, с помощью которого легко представить себе понятие валентности и ковалентной связи. К примеру, водород имеет сокращенную химическую формулу H₂ и структурную формулу: Н – Н. Во втором случае видно, что водород обладает одновалентностью, поскольку связан в молекуле только с одним своим собратом.
Формула воды H₂O и Н – О – Н наглядно свидетельствует о двухвалентности кислорода, так как он способен создавать две ковалентные связи с атомами водорода.
Углекислый газ CO₂ и О = С = О состоит из двух атомов кислорода и атома углерода, у которого валентность равна четырем. Он может присоединять 2 двухвалентных атома кислорода либо 4 одновалентных атома водорода, как в метане СН₄.
Таблица Менделеева
Рассказываем, как пользоваться таблицей, а также даем советы, как ее быстро выучить
подробнее
Как определить валентность химических элементов
Существуют разные способы определения валентности химических элементов. Самый простой заключается в том, чтобы обратиться к специальной таблице валентности химических элементов.
Другой способ связан с расчетом валентности по химической формуле. За единицу валентности принимается валентность атома водорода, так как он способен образовывать с другими атомами только одну связь. Химические элементы, взаимодействуя с водородом, показывают собственную валентность. Например, в молекуле хлористого водорода (HCl) хлор имеет валентность I. В молекуле аммиака (NН₃) азот соединен с тремя атомами водорода, следовательно, его валентность – III.
Кроме водорода, валентность химических элементов можно определять по кислороду, который во всех своих соединениях двухвалентен. Так, в оксиде серы (IV) SO₂ валентность серы равна IV (валентность кислорода умножаем на 2). А в соединении SO₃ валентность серы уже VI (два умножаем на три).
Когда речь идет о сложных соединениях, где присутствует более двух химических элементов, определить валентность каждого из них становится сложнее. О молекуле HClO₄ можно только сказать, что остаток ClO₄ одновалентен, а в соединении H₂SO₄ остаток SO₄ двухвалентен.
Таблица валентности химических элементов
Приведем в качестве примера таблицу валентности наиболее распространенных химических элементов. Звездочкой отмечены элементы с постоянной валентностью.
| Элемент | Валентность | Элемент | Валентность |
|---|---|---|---|
| Водород (H)* | I | Барий (Ba)* | II |
| Натрий (Na)* | I | Кислород (O)* | II |
| Калий (K)* | I | Цинк (Zn) | II |
| Серебро (Ag)* | I | Олово (Sn) | II (IV) |
| Фтор (F)* | I | Свинец (Pb) | II (IV) |
| Хлор (Cl) | I (III, V, VII) | Железо (Fe) | II, III |
| Бром (Br) | I (III, V, VII) | Сера (S) | II, IV, VI |
| Йод (I) | I (III, V, VII) | Марганец (Mn) | II, IV, VII |
| Ртуть (Hg) | I, II | Хром (Cr) | III, VI |
| Медь (Cu) | I, II | Алюминий (Al)* | III |
| Бериллий (Be)* | II | Азот (N) | III (и другие) |
| Магний (Mg)* | II | Фосфор (P) | III, V |
| Кальций (Ca)* | II | Углерод (C) | IV |
| Кремний (Si) | IV (II) | Цирконий (Zr) | II, III, IV |
Популярные вопросы и ответы
Отвечает Анастасия Чистякова, старший методист по естественно-научному направлению Домашней школы «ИнтернетУрок».
Что такое постоянная валентность?
В таблице Менделеева существуют так называемые элементы с постоянной валентностью. Свое название они получили из-за способности образовывать строго определенное количество химических связей. Постоянная валентность чаще всего совпадает с номером группы, где находится элемент. Таких элементов сравнительно немного, поэтому их можно легко запомнить.
Постоянную валентность I (могут присоединять или замещать только один атом другого элемента) имеют щелочные металлы (Li, Na, K, Rb, Cs, Fr) и фтор (F).
Постоянную валентность II (способность присоединить или заместить только два атома других элементов) имеют металлы второй группы, главной подгруппы (Be, Mg, Ca, Sr, Ba, Ra) и кислород (O).
Постоянную валентность III имеет всего лишь один элемент – алюминий (Al), так как только он способен присоединить либо заместить три атома других химических элементов.
Как определить валентность по таблице Менделеева?
Большинство химических элементов обладают переменной валентностью, и ее можно определить по таблице Менделеева. В этой таблице номер группы соответствует высшей валентности элемента. Если от восьми отнять номер группы, где находится элемент, мы узнаем его низшую валентность. Например, высшая валентность серы (S) – 6, так как она находится в шестой группе, а низшая – 2 (8 — 6 = 2).
Правда, бывают и исключения, которые нужно запомнить. Кремний (Si) находится в IV группе, и можно сделать предположение, что его низшая валентность – IV. Однако это не так. Низшая валентность кремния – II. Азот (N) расположен в V группе, но его низшая валентность также II.
Чем валентность отличается от степени окисления?
Понятия «валентность» и «степень окисления» являются близкими по своему значению, но далеко не тождественными. Валентность определяет количество химических связей, которыми атом элемента связан с другими атомами в молекуле. Степень окисления используется для описания тех реакций, которые сопровождаются присоединением либо отдачей электронов.
Валентность нейтральна, а степень окисления может быть положительной, отрицательной или нулевой. Положительная степень окисления соответствует количеству отданных электронов, отрицательная – числу присоединенных. Нулевая степень окисления говорит о том, что данный элемент находится или в состоянии простого вещества, или был восстановлен до нуля после окисления, или окислен до нуля после предшествующего восстановления.
Чаще всего валентность и степень окисления количественно равны, однако бывают и исключения, которые необходимо запомнить. Например, в азотной кислоте (HNO₃) валентность атома N равна IV, а степень окисления +5. В молекуле CO углерод имеет валентность II, а степень окисления +2
На уроках химии вы уже познакомились с понятием валентности химических элементов. Мы собрали в одном месте всю полезную информацию по этому вопросу. Используйте ее, когда будете готовиться к ГИА и ЕГЭ.
Валентность и химический анализ
Валентность – способность атомов химических элементов вступать в химические соединения с атомами других элементов. Другими словами, это способность атома образовывать определенное число химических связей с другими атомами.
С латыни слово «валентность» переводится как «сила, способность». Очень верное название, правда?
Понятие «валентность» – одно из основных в химии. Было введено еще до того, как ученым стало известно строение атома (в далеком 1853 году). Поэтому по мере изучения строения атома пережило некоторые изменения.
Так, с точки зрения электронной теории валентность напрямую связана с числом внешних электронов атома элемента. Это значит, что под «валентностью» подразумевают число электронных пар, которыми атом связан с другими атомами.
Зная это, ученые смогли описать природу химической связи. Она заключается в том, что пара атомов вещества делит между собой пару валентных электронов.
Вы спросите, как же химики 19 века смогли описать валентность еще тогда, когда считали, что мельче атома частиц не бывает? Нельзя сказать, что это было так уж просто – они опирались на химический анализ.
Путем химического анализа ученые прошлого определяли состав химического соединения: сколько атомов различных элементов содержится в молекуле рассматриваемого вещества. Для этого нужно было определить, какова точная масса каждого элемента в образце чистого (без примесей) вещества.
Правда, метод этот не без изъянов. Потому что определить подобным образом валентность элемента можно только в его простом соединении со всегда одновалентным водородом (гидрид) или всегда двухвалентным кислородом (оксид). К примеру, валентность азота в NH3 – III, поскольку один атом водорода связан с тремя атомами азота. А валентность углерода в метане (СН4), по тому же принципу, – IV.
Этот метод для определения валентности годится только для простых веществ. А вот в кислотах таким образом мы можем только определить валентность соединений вроде кислотных остатков, но не всех элементов (кроме известной нам валентности водорода) по отдельности.
Как вы уже обратили внимание, обозначается валентность римскими цифрами.
Валентность и кислоты
Поскольку валентность водорода остается неизменной и хорошо вам известна, вы легко сможете определить и валентность кислотного остатка. Так, к примеру, в H2SO3 валентность SO3 – I, в HСlO3 валентность СlO3 – I.
Аналогчиным образом, если известна валентность кислотного остатка, несложно записать правильную формулу кислоты: NO2(I) – HNO2, S4O6 (II) – H2 S4O6.
Валентность и формулы
Понятие валентности имеет смысл только для веществ молекулярной природы и не слишком подходит для описания химических связей в соединениях кластерной, ионной, кристаллической природы и т.п.
Индексы в молекулярных формулах веществ отражают количество атомов элементов, которые входят в их состав. Правильно расставить индексы помогает знание валентности элементов. Таким же образом, глядя на молекулярную формулу и индексы, вы можете назвать валентности входящих в состав элементов.
Вы выполняете такие задания на уроках химии в школе. Например, имея химическую формулу вещества, в котором известна валентность одного из элементов, можно легко определить валентность другого элемента.
Для этого нужно только запомнить, что в веществе молекулярной природы число валентностей обоих элементов равны. Поэтому используйте наименьшее общее кратное (соответсвует числу свободных валентностей, необходимых для соединения), чтобы определить неизвестную вам валентность элемента.
Чтобы было понятно, возьмем формулу оксида железа Fe2O3. Здесь в образовании химической связи участвуют два атома железа с валентностью III и 3 атома кислорода с валентностью II. Наименьшим общим кратным для них является 6.
- Пример: у вас есть формулы Mn2O7. Вам известна валентность кислорода, легко вычислить, что наименьше общее кратное – 14, откуда валентность Mn – VII.
Аналогичным образом можно поступить и наоборот: записать правильную химическую формулу вещества, зная валентности входящих в него элементов.
- Пример: чтобы правильно записать формулу оксида фосфора, учтем валентность кислорода (II) и фосфора (V). Значит, наименьшее общее кратное для Р и О – 10. Следовательно, формула имеет следующий вид: Р2О5.
Хорошо зная свойства элементов, которые они проявляют в различных соединениях, можно определить их валентность даже по внешнему виду таких соединений.
Например: оксиды меди имеют красную (Cu2O) и черную (CuО) окраску. Гидроксиды меди окрашены в желтый (CuОН) и синий (Cu(ОН)2) цвета.
А чтобы ковалентные связи в веществах стали для вас более наглядными и понятными, напишите их структурные формулы. Черточки между элементами изображают возникающие между их атомами связи (валентности):
Характеристики валентности
Сегодня определение валентности элементов базируется на знаниях о строении внешних электронных оболочек их атомов.
Валентность может быть:
- постоянной (металлы главных подгрупп);
- переменной (неметаллы и металлы побочных групп):
- высшая валентность;
- низшая валентность.
Постоянной в различных химических соединениях остается:
- валентность водорода, натрия, калия, фтора (I);
- валентность кислорода, магния, кальция, цинка (II);
- валентность алюминия (III).
А вот валентность железа и меди, брома и хлора, а также многих других элементов изменяется, когда они образуют различные химические соедения.
Валентность и электронная теория
В рамках электронной теории валентность атома определеяется на основании числа непарных электронов, которые участвуют в образовании электронных пар с электронами других атомов.
В образовании химических связей участвуют только электроны, находящиеся на внешней оболочке атома. Поэтому максимальная валентность химического элемента – это число электронов во внешней электронной оболочке его атома.
Понятие валентности тесно связано с Периодическим законом, открытым Д. И. Менделеевым. Если вы внимательно посмотрите на таблицу Менделеева, легко сможете заметить: положение элемента в перодической системе и его валентность неравзрывно связаны. Высшая валентность элементов, которые относятся к одной и тоже группе, соответсвует порядковому номеру группы в периодичнеской системе.
Низшую валентность вы узнаете, когда от числа групп в таблице Менделеева (их восемь) отнимете номер группы элемента, который вас интересует.
Например, валентность многих металлов совпадает с номерами групп в таблице периодических элементов, к которым они относятся.
Таблица валентности химических элементов
|
Порядковый номер хим. элемента (атомный номер)
|
Наименование |
Химический символ |
Валентность |
| 1
2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 |
Водород / Hydrogen
Гелий / Helium Литий / Lithium Бериллий / Beryllium Бор / Boron Углерод / Carbon Азот / Nitrogen Кислород / Oxygen Фтор / Fluorine Неон / Neon Натрий / Sodium Магний / Magnesium Алюминий / Aluminum Кремний / Silicon Фосфор / Phosphorus Сера / Sulfur Хлор / Chlorine Аргон / Argon Калий / Potassium Кальций / Calcium Скандий / Scandium Титан / Titanium Ванадий / Vanadium Хром / Chromium Марганец / Manganese Железо / Iron Кобальт / Cobalt Никель / Nickel Медь / Copper Цинк / Zinc Галлий / Gallium Германий /Germanium Мышьяк / Arsenic Селен / Selenium Бром / Bromine Криптон / Krypton Рубидий / Rubidium Стронций / Strontium Иттрий / Yttrium Цирконий / Zirconium Ниобий / Niobium Молибден / Molybdenum Технеций / Technetium Рутений / Ruthenium Родий / Rhodium Палладий / Palladium Серебро / Silver Кадмий / Cadmium Индий / Indium Олово / Tin Сурьма / Antimony Теллур / Tellurium Иод / Iodine Ксенон / Xenon Цезий / Cesium Барий / Barium Лантан / Lanthanum Церий / Cerium Празеодим / Praseodymium Неодим / Neodymium Прометий / Promethium Самарий / Samarium Европий / Europium Гадолиний / Gadolinium Тербий / Terbium Диспрозий / Dysprosium Гольмий / Holmium Эрбий / Erbium Тулий / Thulium Иттербий / Ytterbium Лютеций / Lutetium Гафний / Hafnium Тантал / Tantalum Вольфрам / Tungsten Рений / Rhenium Осмий / Osmium Иридий / Iridium Платина / Platinum Золото / Gold Ртуть / Mercury Талий / Thallium Свинец / Lead Висмут / Bismuth Полоний / Polonium Астат / Astatine Радон / Radon Франций / Francium Радий / Radium Актиний / Actinium Торий / Thorium Проактиний / Protactinium Уран / Uranium |
H
He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Сu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Ac Th Pa U |
I
0 I II III (II), IV (I), II, III, IV, V II I 0 I II III (II), IV I, III, V II, IV, VI I, (II), III, (IV), V, VII 0 I II III II, III, IV II, III, IV, V II, III, VI II, (III), IV, VI, VII II, III, (IV), VI II, III, (IV) (I), II, (III), (IV) I, II, (III) II (II), III II, IV (II), III, V (II), IV, VI I, (III), (IV), V 0 I II III (II), (III), IV (II), III, (IV), V (II), III, (IV), (V), VI VI (II), III, IV, (VI), (VII), VIII (II), (III), IV, (VI) II, IV, (VI) I, (II), (III) (I), II (I), (II), III II, IV III, (IV), V (II), IV, VI I, (III), (IV), V, VII 0 I II III III, IV III III, IV III (II), III (II), III III III, IV III III III (II), III (II), III III IV (III), (IV), V (II), (III), (IV), (V), VI (I), II, (III), IV, (V), VI, VII (II), III, IV, VI, VIII (I), (II), III, IV, VI (I), II, (III), IV, VI I, (II), III I, II I, (II), III II, IV (II), III, (IV), (V) II, IV, (VI) нет данных 0 нет данных II III IV V (II), III, IV, (V), VI |
В скобках даны те валентности, которые обладающие ими элементы проявляют редко.
Валентность и степень окисления
Понятие валентности можно считать родственным такой характеристике, как степень окисления. Тем не менее, обе эти характеристики не тождественным друг другу.
Так, говоря о степени окисления, подразумевают, что атом в веществе ионной (что важно) природы имеет некий условный заряд. И если валентность – это нейтральная характеристика, то степень окисления может быть отрицательной, положительной или равной нулю.
Интересно, что для атома одного и того же элемента, в зависимости от элементов, с которыми он образует химическое соединение, валентность и степень окисления могут совпадать (Н2О, СН4 и др.) и различаться (Н2О2, HNO3).
Заключение
Углубляя свои знания о строении атомов, вы глубже и подробнее узнаете и валентность. Эта характеристика химических элементов не является исчерпывающей. Но у нее большое прикладное значение. В чем вы сами не раз убедились, решая задачи и проводя химические опыты на уроках.
Эта статья создана, чтобы помочь вам систематизировать свои знания о валентности. А также напомнить, как можно ее определить и где валентность находит применение.
Надеемся, этот материал окажется для вас полезным при подготовке домашних заданий и самоподготовке к контрольным и экзаменам.
Не забудьте поделиться ссылкой с друзьями в социальных сетях, чтобы они тоже могли воспользоваться этой полезной информацией.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Валентность – свойство атомов одного химического элемента присоединять определенное число атомов другого химического элемента.
Есть элементы, которые имеют постоянную валентность:
одновалентны (I) – H,Li, Na, K, Rb, Cs, F, I
двухвалентны (II) – O, Be, Mg, Ca, Sr, Ba, Zn, Cd
трехвалентны (III) – B, Al
Это нужно знать наизусть. Если не получается выучить, то сделай себе шпаргалку из моего письма.
Есть еще один способ: определять валентность можно по таблице Д. И. Менделеева.
Все элементы в таблице разделены на подгруппы а) и б) . Активные металлы занимают только три первые группы.
Металлы, которые стоят в первой а) группе имеют валентность I.
Металлы, которые стоят во второй а) группе имеют валентность II.
Есть металлы с переменной валентностью, тогда ее указывают в скобках, например, оксид железа (III). Это говорит нам о том, что железо – трехвалентно в данном соединении с кислородом.
Неметаллы имеют две валентности и более (тогда она указывается в скобках) : низшую – вычисляют по формуле (8-Ь группы) , в которой находится элемент;
высшую – равную номеру группы, в которой находится этот элемент.
Номер группы указан вверху таблицы.
Алгоритмы составления формул по валентности и определение валентности по формуле я посылаю как прикрепленный файл. Распечатай его и пользуйся пока не научишься.
КАК ОПРЕДЕЛИТЬ ВАЛЕНТНОСТЬ ЭЛЕМЕНТА ПО ФОРМУЛЕ
В молекулах водородных соединений валентность определяется легко: водород,
как мы уже знаем, всегда одновалентен, а валентность связанного с ним элемента
равна числу атомов водорода в этой молекуле. Попробуйте потренироваться сами:
BH3 H2Se CaH2 NaH AsH3 SiH4 HBr H2S HF
А теперь поработаем c формулами веществ, не содержащих атомов водорода.
Пусть
нам, к примеру, дано задание: определить валентность фосфора в его оксиде Р2О5.
Валентность кислорода узнать легко: он во всех соединениях двухвалентен. Обозначим
его валентность в формуле: над знаком фосфора пишем римскую цифру V, а над знаком
кислорода – II (в моем тексте сделать это затруднительно, а вот ты на листе
бумаги напишешь это без труда) . А теперь – главное правило определения валентности.
Помним, что произведения валентности элемента на число его атомов в этой молекуле
и для фосфора, и для кислорода должны быть одинаковыми. Для кислорода: 2 х 5
= 10, значит для фосфора Х х 2 = 10. Ясно, что Х = 5, т. е. фосфор в этом соединении
пятивалентен.
^5
А можно рассуждать так: Х х 2 = 2 х 5, и мы получим тот же результат: фосфор
пятивалентен. Попробуй определить валентность элементов в молекулах:
A12O3 CO2 K2O CuO Fe2O3 NO2 N2O5 C12O7
Подробнее здесь http://subscribe.ru/archive/economics.education.1181952/200409/27073542.html
Как опредилить валентность элемента
http://www.kakprosto.ru/kak-38106-kak-opredelit-valentnost-himicheskih-elementov
http://forum.xumuk.ru/index.php?showtopic=1216
http://www.kakprosto.ru/kak-19538-kak-opredelit-valentnost-elementa
http://www.kakprosto.ru/kak-7484-kak-opredelyat-valentnost
Похожие вопросы
http://otvet.mail.ru/question/9979922/
http://otvet.mail.ru/question/17974266
Различные химические элементы отличаются по своей способности создавать химические связи, то есть соединяться с другими атомами. Поэтому в сложных веществах они могут находиться только в определенных соотношениях. Разберемся, как определить валентность по таблице Менделеева.
Что такое валентность?
В качестве единицы используется эта характеристика для водорода, которая принята равной I. Это свойство показывает, с каким числом одновалентных атомов может соединиться данный элемент. Для кислорода эта величина всегда равна II.
Знать эту характеристику необходимо, чтобы верно записывать химические формулы веществ и уравнения реакций. Знание этой величины поможет установить соотношение между числом атомов различных типов в молекуле.
Чем поможет периодическая таблица?

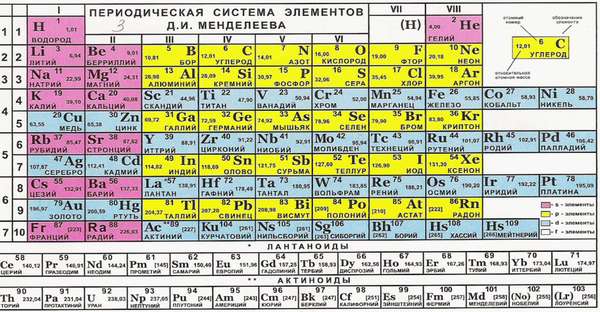
Такие свойства имеют металлы главных подгрупп. Почему? Номер группы соответствует числу электронов на внешней оболочке. Эти электроны называются валентными. Именно они отвечают за возможность соединяться с другими атомами.
Группу составляют элементы с похожим устройством электронной оболочки, а сверху вниз возрастает заряд ядра. В короткопериодной форме каждая группа делится на главную и побочную подгруппы. Представители главных подгрупп — это s и p-элементы, представители побочных подгрупп имеют электроны на d и f-орбиталях.
Как определить валентность химических элементов, если она меняется? Она может совпадать с номером группы или равняться номеру группы минус восемь, а также принимать другие значения.
Важно! Чем выше и правее элемент, тем его свойство образовывать взаимосвязи меньше. Чем он более смещен вниз и влево, тем она больше.

В основном (невозбужденном) состоянии у серы два неспаренных электрона находятся на подуровне 3р. В таком состоянии она может соединиться с двумя атомами водорода и образовать сероводород. Если сера перейдет в более возбужденное состояние, то один электрон перейдет на свободный 3d-подуровень, и неспаренных электронов станет 4.
Сера станет четырехвалентной. Если сообщить ей еще больше энергии, то еще один электрон перейдет с подуровня 3s на 3d. Сера перейдет в еще более возбужденное состояние и станет шестивалентной.
Постоянная и переменная
Иногда способность к образованию химических связей может меняться. Она зависит от того, в какое соединение входит элемент. Например, сера в составе H2S двухвалентна, в составе SO2 четырехвалентна, а в SO3 — шестивалентна. Наибольшее из этих значений называется высшим, а наименьшая — низшим. Высшую и низшую валентности по таблице Менделеева можно установить так: высшая совпадает с номером группы, а низшая равняется 8 минус номер группы.

- У металлов главных подгрупп способность к образованию химических взаимосвязей постоянная.
- У металлов побочных подгрупп — переменная.
- У неметаллов — также переменная. В большинстве случаев она принимает два значения — высшее и низшее, но иногда может быть и большее число вариантов. Примеры — сера, хлор, бром, йод, хром и другие.
Это интересно! Что такое алканы: строение и химические свойства
В соединениях низшую валентность проявляет тот элемент, который находится выше и правее в периодической таблице, соответственно, высшую — тот, который левее и ниже.
Часто способность образовывать химические связи принимает больше двух значений. Тогда по таблице узнать их не получится, а нужно будет выучить. Примеры таких веществ:
- углерод,
- сера,
- хлор,
- бром.
Как определить валентность элемента в формуле соединения? Если она известна для других составляющих вещества, это несложно. Например, требуется рассчитать это свойство для хлора в NaCl. Натрий — элемент главной подгруппы первой группы, поэтому он одновалентен. Следовательно, хлор в этом веществе тоже может создать только одну связь и тоже одновалентен.
Важно! Однако так не всегда можно узнать это свойство для всех атомов в сложном веществе. Для примера возьмем HClO4. Зная свойства водорода, можно только установить, что ClO4 — одновалентный остаток.
Как еще узнать эту величину?
Способность образовывать определенное количество связей не всегда совпадает с номером группы, и в некоторых случаях ее придется просто заучить. Здесь на помощь придет таблица валентности химических элементов, где приведены значения этой величины. В учебнике химии за 8 класс приведены значения способности соединяться с другими атомами наиболее распространенных видов атомов.
| Н, F, Li, Na, K | 1 |
| O, Mg, Ca, Ba, Sr, Zn | 2 |
| B, Al | 3 |
| C, Si | 4 |
| Cu | 1, 2 |
| Fe | 2, 3 |
| Cr | 2, 3, 6 |
| S | 2, 4, 6 |
| N | 3, 4 |
| P | 3, 5 |
| Sn, Pb | 2, 4 |
| Cl, Br, I | 1, 3, 5, 7 |
Применение

Однако рассматриваемое понятие применяют в методических целях. С его помощью легко объяснить, почему атомы разных видов соединяются в тех соотношениях, которые мы наблюдаем, и почему эти соотношения для разных соединений различны. Подарки от онлайн казино можно взять на этой странице — https://www.casinobonus-ruu.com и активировать их после регистрации.
На данный момент подход, согласно которому соединение элементов в новые вещества всегда объяснялось с помощью валентности по таблице Менделеева независимо от типа связи в соединении, устарел. Сейчас мы знаем, что для ионной, ковалентной, металлической связей существуют разные механизмы объединения атомов в молекулы.
Полезное видео
Подведем итоги
По таблице Менделеева определить способность к образованию химических связей возможно не для всех элементов. Для тех, которые проявляют одну валентность по таблице Менделеева, она в большинстве случаев равна номеру группы. Если есть два варианта этой величины, то она может быть равна номеру группы или восемь минус номер группы. Существуют также специальные таблицы, по которым можно узнать эту характеристику.