Среди огромного разнообразия оружия в Lineage II есть два, особо уникальных меча, Демонический Меч Зарич (Demonic Sword Zariche) и Акаманах (Blood Sword Akamanah)
Владельцем Зарича некогда был один из четырех древних королей демонов – Бреммон.
Меч можно выбить из любого монстра во время охоты или убив предыдущего обладателя меча, при этом все игровые локации содрогаются землетрясением, а небо игровой вселенной становиться кроваво-красным. Также игроки оповещаются системным сообщением, о местоположении выпавшего проклятого меча.
Шанс выпадения Зарича с монстров ничтожно мал, поэтому если вам выдалось стать счастливым его обладателем – постарайтесь извлечь из этого максимальную выгоду.
Персонаж, подобравший проклятый меч немедленно превращается в демона, в не зависимости от его пола или расы. Ник персонажа меняется на название проклятого меча, а игрок в свою очередь получает статус ПК (Player Killer), его ник становиться красным, карма повышается до максимума, понизить ее в этом состоянии никак нельзя. Также игрок лишается возможности находиться в группе с другими персонажами, в проклятом состоянии вы можете находиться только в одиночестве. Меч нельзя уничтожить, выкинуть или продать.
Демонический меч сам уничтожается через некоторый промежуток времени, если игрок не поддерживает свой ПК статус – это произойдет значительно быстрее. Даже если персонаж будет оффлайн, меч все равно исчезнет. При смерти персонажа проклятое оружие теряется.
Обладатель Зарича получает особые умения, а остальные игроки в свою очередь могут видеть его местонахождение на карте мира Аден. Если владелец демонического меча наносит удар по игроку (кроме физических и магических умений), то показатель его CP снижается до нуля, но когда персонаж атакует, то уже показатель CP обладателя меча падает до нуля. Если обладатели двух проклятых мечей столкнуться в битве – CP обоих снизится до нуля. Предположим, владелец Кровавого Меча Акаманаха подберет Зарич, то Акаманах пропадет, а уровень Демонического Меча Зарича возрастет на еденицу.
Помимо вышеперечисленных на обладателя проклятого меча распространяются следующие изменения:
-нельзя атаковать игроков не достигших 20 уровня;
-при нападении на владельца проклятого меча персонаж ниже 20 уровня будет уничтожен;
— бой между обладателем проклятого оружия и другими игроками не приводит к стандартным штрафам за убийство игрока (PK), единственное, что может выпасть с персонажа – проклятый меч;
-владелец меча не может быть вылечен или бафнут другими игроками, но собственные вспомогательные заклинания для него доступны;
-самоны или питомцы могут быть вызваны, но ездить верхом на питомце персонаж не может;
-обладатель проклятого меча не может принимать участие в играх великой олимпиады
-при убийстве других игроков – время жизни меча незначительно сокращается, но его атакующие параметры заметно возрастают;
-во время осады и битвы за земли обладатель меча является врагом как для обороняющихся, так и для атакующих в не зависимости от клановой принадлежности.
Способы получения Demonic Sword Zariche
Прокачка проклятого оружия Зарич
Уровень меча зарича можно поднимать, убивая персонажей, при этом характеристики меча с каждым новым уровнем растут, всего предусмотрено 10 уровней. Важно помнить, что при каждом новом убийстве время владения мечом уменьшается. Персонажи, которые умирают от руки проклятого меча — опыт не теряют. Если у вас есть друг, готовый помочь с прокачкой меча, попросите его помочь, убивая и воскрешая персонажа это сделать намного проще.
Главная → Lineage 2 → Статьи → Откуда берется проклятое оружие Lineage 2?
Появление в мире проклятого оружия Lineage 2 имеет мифологическую подоплеку. Демонический меч Зарич (Zarich) стал бичом Адены и, видя это, Грен Каин сделал из своей крови и крови богини Шилен демонические дуалы Акаманахи (Akamanah). На практике это означает, что в мире появилось два уникальных оружия, обладающих интересными для любителей PvP свойствами.
Что такое проклятое оружие Lineage 2?
На игроков, которые получили проклятое оружие в мире Lineage 2, действует ряд ограничений:
- карма ПК становится максимальной, ее невозможно снять;
- игроки не могут писать в некоторые чаты lineage 2;
- некоторые точки в ла2 становятся недоступными (вход в город перегородит охрана, на осаде для всех участников ПК – центр внимания).
Для чего оно нужно?
По сути, если к вам прилетело проклятое оружие – это повод отвлечься от фарма, прервать выполнение квестов и посвятить себя полному фану. В чат lineage 2 быстро разлетится инфа, где вы находитесь, и через какое-то время можно ждать к себе в гости посланцев. Впрочем, есть в ла2 точки, которые практически созданы для тех, кто владеет проклятым оружием lineage 2.
Например, в Башне Баюма собираются отличные фановые группы. Крикните в чат или тимспик lineage 2, что у вас заветные пушки, и пусть начнется веселье.
В элитных магазинах Lineage 2 есть услуга получения этого оружия. Стоит дорого, но как подарок на День Рождения сгодится.
Чего не нужно делать?
Некоторые игроки пытаются получше экипироваться, иные и вовсе ищут точки для зарича в базе знаний ла2. Их попросту нет, а такое поведение – потеря времени. Зарич и Акаманахи созданы для развлечения, они не несут прямой выгоды, но могут серьезно попортить кровь.
Можно попробовать забиться в богами забытую локацию, но бежать туда долго, а желающих отыскать классного ПК-противника много. Лучше просто выйдите из игры и дождитесь, пока мечи исчезнут.
Общие сведения о мечах
Со времен масштабного обновления – Interlude в мире Эльмореден появилось новое проклятое оружие, обладающие внушительными характеристиками, из-за чего по сегодняшний день охотятся на него многие игроки.
Проклятые мечи в Lineage 2 бывают только двух типов: Двуручный меч – Зарич и спаренные одноручные мечи – Акаманах. Эти два кровавых меча по своим свойствам полностью идентичны и обладают одинаковым временем респавна, хаотичной вариацией появления на карте мира, сроками использования, а также правилами системы пвп.
Каждый монстр, который находится в области появления проклятого меча, может уронить на пол только один из мечей и появляются два кровавых меча в разных локациях по очереди. В час появления одного из кровавых мечей на экране происходит землетрясение и все вокруг в игре становится в красных оттенках на пару секунд. Благодаря системному уведомлению можно увидеть, что меч упал.
Игрок, которому посчастливилось поднять один из мечей внешне перевоплощается в темного рыцаря, при этом пол не играет никакой роли на внешний вид, влияет только вид меча. После перерождения, ник игрока временно переименовывается в название подобранного меча, такое имя и отображается в чате. Также персонаж переходит в состояние PK, а все его параметры манны, уровня HP и CP максимально сразу регенерируются до 100%.
После поднятия кровавого меча, игрок автоматом берет его в руки и далее снять, передать, продать, уничтожить и выбросить уже не может. Персонаж, одевший один из мечей получает специальные умения и поднятие собственных статов. Кровавые мечи после их поднятия персонажем через некоторое время исчезают, независимо в игре персонаж или оффлайн. На продолжительность жизни демонических мечей влияет количество убитых других игроков. Каждый убитый этими мечами игрок сокращает продолжительность их существования и одновременно усиливает их характеристики, поднимая вверх уровень самого меча. Однако, чтобы отсрочить живучесть мечей, игроку необходимо 1 раз в 24 часа убить другого персонажа этими мечами, иначе в течении суток, меч исчезает. Хозяин меча может узнать о количестве оставшегося времени оружия благодаря системному сообщению, которое вдобавок и отображает время последнего убийства.
В момент, когда хозяин меча погибает, сам кровавый меч выпадает на землю, либо исчезает. После пропадания проклятого меча, персонаж возвращается к своему прежнему виду и все его характеристики возвращаются к первоначальным.
Роль карты
– обозначает локацию собственника Акаманах
– обозначает локацию собственника Зарича
– обозначает локацию обладателей обоих кровавых мечей.
Характеристики и ограничения
Если игрок поднял проклятые мечи с земли, он имеет возможность убивать других игроков без накопления очков кармы и PK. Также невозможно потерять после убийства опыт и предметы. Однако игрок не может атаковать кровавым мечем других персонажей 20 уровня и меньше. Также игрок, достигший 20 уровня и старше может уже атаковать хозяина Зарича и Акаманах. Во время осады все игроки, находящиеся на осадной территории могут быть атакованы владельцем мечей, который в свою очередь становится для всех целью.
Важное преимущество проклятых мечей – значительное увеличение количества единиц CP. Поэтому обладателя мечей убить одному игроку не просто. Хозяин мечей может одним простым ударом по другому игроку (в т.ч и Герою) опустить уровень СP до нуля. Также Герои могут одним простым ударом опустить уровень СP владельца мечей до нуля.
Игрок у которого в руках кровавый меч не может в ступить в группу. В момент поднятия меча, персонаж автоматом удаляется с группы. Если игрок имеющий в руках Акаманах поднимает с земли Зарич, то мечи Акаманах тут же исчезают, однако уровень нового оружия поднимается на 1. Эти правила работают и обратных обстоятельствах.
Игрок с проклятыми мечами не может получать бафф от других игроков и не может быть исцеленным и сам не имеет возможности хилить других персонажей. Но лечить и баффать себя хозяин клинков может, также у него есть возможность присумонивать слуг и вызывать питомцев, а ездить на них не может.
Принимать участие в олимпиадах владелец кровавых клинков также не может. Если игрок Герой и поднял двуручный меч Зарич либо спаренные клинки Акаманах, то пользоваться своими геройскими умениями уже не может. А использование данных скиллов возможно исключительно после утраты проклятого оружия.

Если у вас как у меня повисло задание Ярость Зарича: Демонический меч Бремнона (уничтожить слуг Демонического меча Зарича), то это для вас!
Редко в рандомном месте карты, отображается квест зарича. Возможно вы видели оранжевый кинжал на карте вам туда.
Присоединяйтесь к нашему клану META на сервере Барц 04
👇Вот как он выглядит!👇

Единственная возможность выполнить его это дождаться! Игра уведомляет что событие началось. Поэтому открывай карту и беги туда!
Кнопка «Наверх»
Степень окисления элемента
О чем эта статья:
Что такое степень окисления
Для начала давайте вспомним, как проходят химические связи в молекуле вещества. Взаимодействуя между собой, атомы могут притягивать или отдавать электроны для образования общей электронной пары. Атом с более высокой электроотрицательностью (ЭО) притягивает электроны и приобретает отрицательный заряд, а атом с меньшей ЭО, напротив, отдает электроны и обретает положительный заряд.
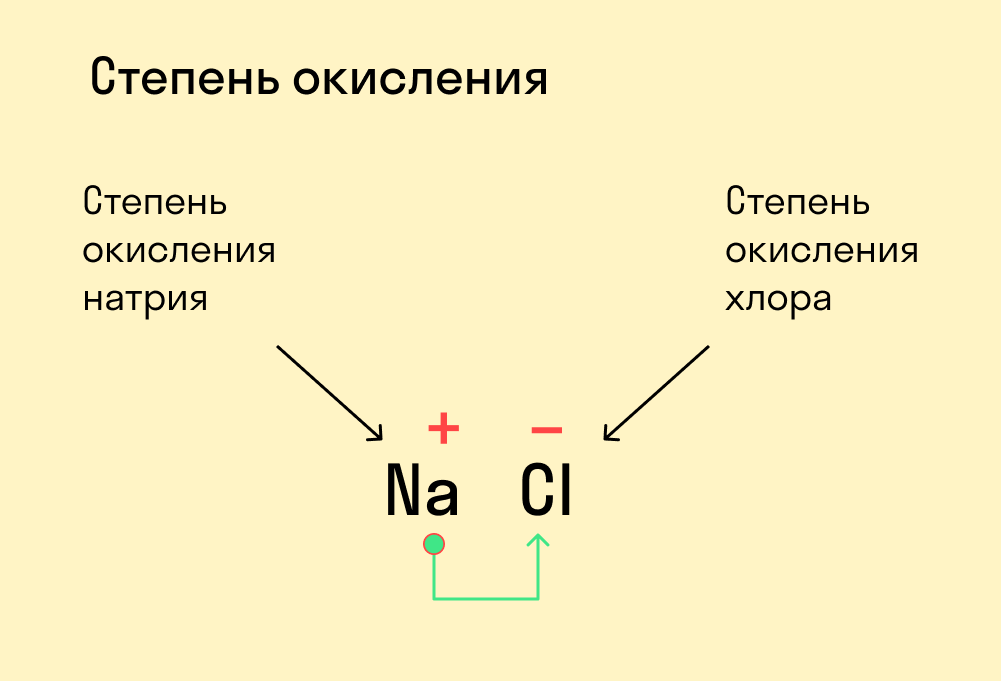
Степень окисления — это условный заряд, который предположительно обретет атом после перемещения электронов. Он вычисляется из предположения, что все свободные электроны полностью перемещаются от одного атома к другому и все образованные связи — ионные.
Почему в определении степени окисления мы говорим об условном заряде? Потому что в реальности он может быть другим, а химические связи атома в соединении не обязательно будут ионными. Но мы предполагаем, что все именно так, чтобы немного упростить расчеты. Это помогает в составлении формул и классификаций.
Запомните:
Численно степень окисления равна количеству электронов, которые перешли от одного атома к другому.
У атома с меньшей ЭО, который отдает электроны, — положительная степень окисления.
У атома с большей ЭО, который притягивает электроны, — отрицательная степень окисления.
Простые вещества, такие как Cl2, O2 и т. д., имеют степень окисления, равную 0, поскольку смещения электронов в данном случае не происходит.
Как рассчитать степень окисления
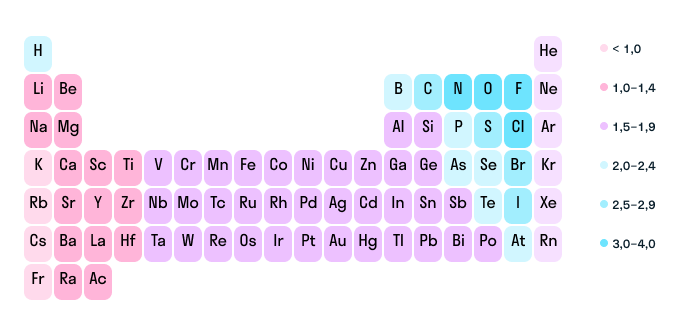
Как мы уже выяснили выше, определить степень окисления элемента (иначе говоря, окислительное число) помогает электроотрицательность. Значения ЭО легко узнать, пользуясь таблицей Менделеева или шкалой относительной электроотрицательности. Сравните, у какого химического элемента в соединении ЭО выше — этот элемент будет притягивать электроны и приобретет отрицательный заряд.
Шкала относительной электроотрицательности
Это правило поможет составить уравнение и посчитать степень окисления любого химического элемента в соединении, если известны данные по остальным элементам. Еще больше облегчат расчеты следующие закономерности:
у водорода в гидридах окислительное число −1, а во всех остальных веществах оно равно +1;
у кислорода степень окисления в оксидах равна −2, в пероксидах −1, в соединениях с фтором +2;
у неметаллов в соединениях с водородом и металлами окислительное число всегда отрицательное;
у металлов степень окисления всегда положительная.
Также есть элементы, которые во всех соединениях отдают или принимают одинаковое количество электронов, поэтому их окислительное число — постоянная величина.
Алгоритм действий
Итак, мы знаем основные закономерности. Давайте разберемся, как находить степени окисления на примерах. Предлагаем следующий алгоритм действий.
Посмотрите, является ли вещество элементарным. Если да — значит, оно находится в химически несвязанном состоянии и окислительное число равно 0. Это правило подходит как для веществ, образованных из отдельных атомов, так и для тех, что включают многоатомные молекулы одного и того же элемента.
Пример
Если это соединение, определите, состоит ли оно из ионов. В многоатомном ионе сумма всех степеней окисления равна его заряду. Узнайте эту сумму из таблицы растворимости и составьте уравнение с известными окислительными числами.
Пример
Допустим, нужно определить заряд азота в ионе аммония.
Согласно таблице растворимости заряд иона аммония NH4 + равен +1. Это значит, что сумма степеней окисления в этом соединении тоже будет равна +1.
Также известно, что водород всюду, кроме гидридов, имеет заряд +1. В данном случае есть 4 атома водорода, т. е. +1 × 4.
Составим формулу: х + (+1) × 4 = +1. Значит х = −3.
Окислительное число азота в ионе аммония равно −3, т. е. N -3 H4 +1 .
Если соединение — нейтральная молекула, составьте уравнение, учитывая, что все окислительные числа в сумме равны 0.
Пример
Допустим, нужно определить степень окисления серы в соединении Na2SO4.
Мы знаем, что у щелочного металла Na постоянное окислительное число +1. Кислород, согласно вышеизложенным правилам, в оксидах имеет заряд −2.
Составим уравнение: (+1) × 2 + х + (−2) × 4 = 0. Значит х = −6.
Степень окисления серы равна −6, т. е. Na2 +1 S -6 O4 -2 .
Как узнать степень окисления нескольких элементов
А как быть, если неизвестны окислительные числа двух и более элементов в соединении? В математике уравнения с двумя неизвестными не всегда имеют решение. Но в химии есть выход: можно разделить химическую формулу на несколько частей, которые имеют постоянные заряды.
Пример
Как вычислить степень окисления в сложном веществе (NH4)2SO4? Посмотрим на него как на соединение двух ионов с известными зарядами: NH4 + и SO4 2- .
Поскольку мы знаем окислительные числа водорода и кислорода, найти заряды азота и серы в каждом ионе не составит труда.
В ионе NH4 + формула для определения заряда азота будет следующей: х + (+1) × 4 = 1. Понятно, что х = −3, т. е. степень окисления азота −3.
В ионе SO4 2- формула для серы х + (−2) × 4 = −2. Следовательно, х = 6, т. е. заряд серы равен +6.
Как определить высшую и низшую степень окисления
Выделяют высшую (или максимально положительную) и низшую (максимально отрицательную) степени окисления. В диапазоне между ними располагаются окислительные числа, которые могут принадлежать данному химическому элементу в различных соединениях. Для четных групп характерны четные числа в диапазоне, а для нечетных групп — нечетные.
Высшая степень окисления совпадает с номером группы элемента (для элементов в главной подгруппе) в короткой форме периодической системы.
Низшая степень окисления равна числу, которое получится, если от номера группы элемента отнять 8.
Исключения: фтор, железо, кобальт, родий, подгруппа никеля, кислород, благородные газы (помимо ксенона).
Проиллюстрируем на примере, как найти высшую и низшую степень окисления.
Хлор (Cl), согласно короткой периодической таблице, принадлежит к группе VII. Значит, его максимальное окислительное число будет +7. Такой условный заряд элемент приобретает в оксиде хлора Cl2O7 и хлорной кислоте HClO4. Минимальное число получаем следующим образом: 7 − 8 = −1 (характерно для хлороводорода HCl).
По степени окисления можно понять, как поведет себя вещество в окислительно-восстановительных реакциях. Если в соединении главный действующий элемент имеет высшую степень окисления, оно является окислителем, а если он имеет низшую степень окисления — восстановителем.
Например, серная кислота является окислителем, поскольку у серы в данном случае заряд +6. А вот в сернистой кислоте у серы заряд всего +4, поэтому она может проявлять и окислительную способность, и восстановительную. В сероводороде заряд серы равен −2, и это минимальная степень окисления, а значит, данное вещество — восстановитель.
Как найти степень окисления в органическом соединении
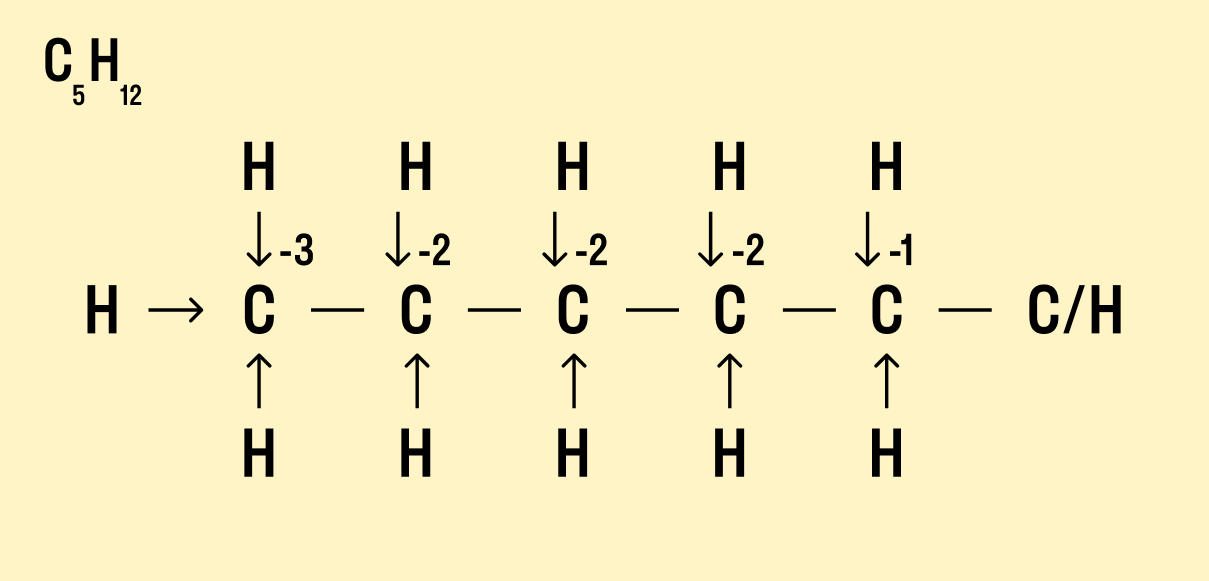
В органической химии определять окислительные числа элементов немного сложнее, поскольку все органические вещества включают углерод, известный большим количеством неполярных связей. Если у нас всего один атом углерода, можно использовать стандартный способ.
Пример
Рассчитайте степень окисления углерода в метаноле H3C−OH.
Мы знаем, что водород Н имеет окислительное число +1, а у кислорода в данном случае оно равно −2. Составим уравнение:
х + (+1) × 4 + (+2) × 1 = 0
Заряд углерода равен −2, т. е. C -2 H4 +1 O -2 .
Но что делать, если атомов углерода больше? Придется анализировать структурную формулу, чтобы понять, какие химические связи есть между элементами и сколько электронов они теряют/приобретают в результате. Такой вариант нахождения окислительного числа называют графическим.
Графический метод
Нарисуйте структурную формулу соединения.
Изобразите стрелками химические связи и смещение атомов (все связи между атомами углерода С−С считайте неполярными).
Посчитайте, сколько стрелок ведет к атому (это «−») и сколько от него (это «+»), а затем суммируйте «+» и «−», чтобы узнать степень окисления.
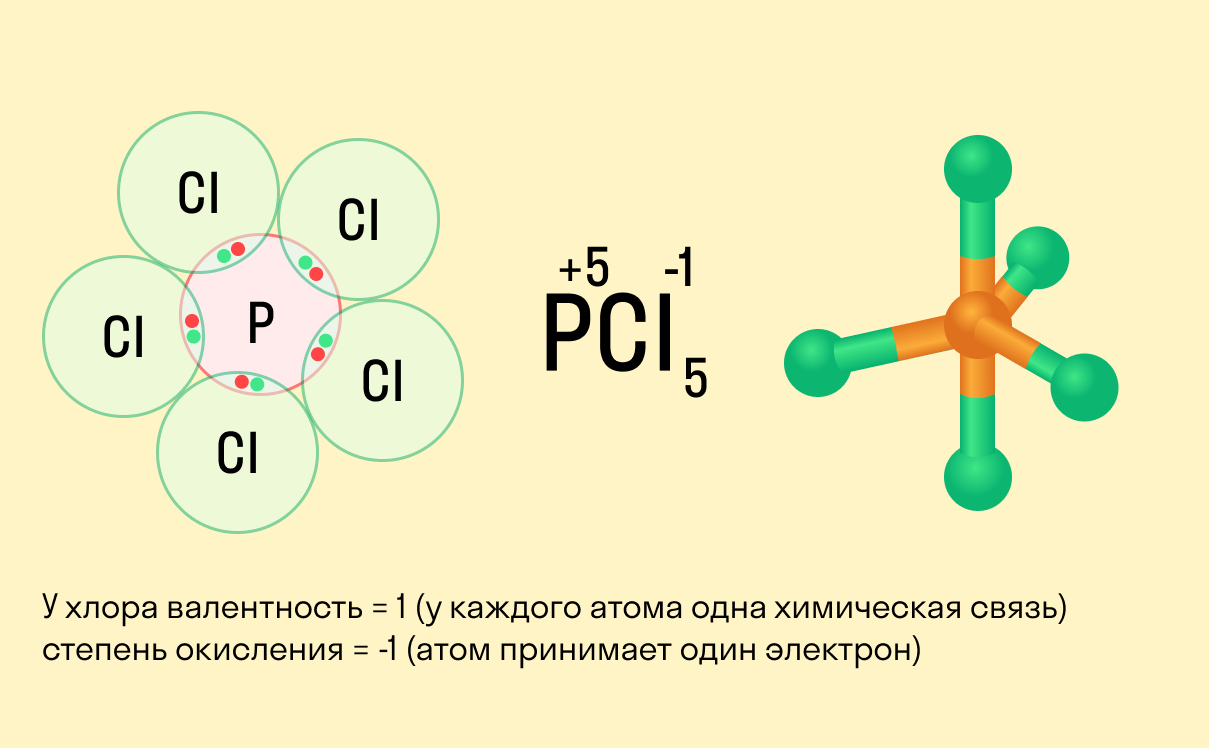
Валентность и степень окисления: в чем разница?
Школьники, которые только начали изучать данные разделы химии, нередко путают степень окисления и валентность. Численно эти показатели могут совпадать (но далеко не всегда), а вот по смыслу они в корне различаются.
Между этими двумя понятиями есть следующие отличия:
валентность не имеет знака, в то время как у окислительного числа он есть («+» или «−»);
валентность равна нулю только в том случае, если атом не имеет связей с другими частицами, а степень окисления может быть равна нулю и при наличии таких связей;
вычисляя степень окисления, мы предполагаем, что в соединении ионные связи, хотя на самым деле это может быть не так, а валентность всегда имеет реальный смысл.
Поэтому отождествлять эти два понятия ни в коем случае не стоит. Более того, не нужно ориентироваться на валентность, пытаясь определить окислительное число.
Вопросы для самопроверки
Почему степень окисления называют формальным зарядом, условным?
Что отражает численная величина степени окисления?
Чему равна сумма всех окислительных чисел в ионе?
Как определить низшую степень окисления?
Как найти две неизвестных степени окисления в одном веществе?
Как определять степени окисления в органических веществах?
Как определить степень окисления?
Степень окисления – это формальный заряд атома. Слово «формальный» означает, что этого заряда у атома в действительности может и не быть, вернее, он может оказаться немного другим. Однако по разным причинам эти условные заряды удобны и химики всего мира пользуются понятием «степень окисления».
Отметим, что степень окисления указывается в верхнем правом углу атома в формате или , где – целое число. Например:
Существуют определённые правила нахождения степени окисления.
- Степень окисления простых веществ равна нулю. Напомню, что простыми называют вещества, состоящие из одного вида атомов. Примеры:
- Некоторые атомы в сложных соединениях проявляют только одну степень окисления. Такие степени окисления называются постоянными.
– Исключения у водорода соединения , в которых у водорода степень окисления
– Исключения у кислорода
- Сумма степеней окисления всех атомов сложного соединения должна быть равна нулю. Пользуясь именно эти правилом, мы будем расставлять степени окисления в сложных соединениях.
Как именно?
Пример 1: расставьте степени окисления в соединении .
Мы знаем степень окисления тогда мы можем найти, что общее количество «плюсов» у четырех атомов . Чтобы в сумме был ноль, у трех атомов заряд должен быть , значит у каждого атома
Пример 2: Найдите степени окисления всех атомов в соединении
Сначала подпишем постоянные степени окисления
Посчитаем общее количество плюсов и минусов
Для того, чтобы плюсов и минусов было одинаковое количество у двух хромов в сумме должно быть , а значит, у каждого атома
Пример 3: Найдите степени окисления всех атомов в соединении
Для начала заметим, что для нахождения степени окисления удобно «раскрыть скобки» и представить соединение как и тогда задание выполняется аналогично заданию из примера 2.
Ответ:
- В некоторых устоявшихся группах атомов в составе веществ (кислотные остатки и ион аммония) степени окисления атомов неизменны и их тоже стоит запомнить.
Пользуясь этими правилами, можно расставить степени окисления практически во всех соединений, встречающихся на ЕГЭ по химии.
Как расставлять и как определить степень окисления элементов
В химических процессах главную роль играют атомы и молекулы, свойства которых определяют исход химических реакций. Одной из важных характеристик атома является окислительное число, которое упрощает метод учета переноса электронов в частице. Как определить степень окисления или формальный заряд частицы и какие правила необходимо знать для этого?
Определение

Термин окисление (оксидация) в химии означает реакцию, в ходе которой группа атомов или один из них теряют электроны или приобретают, в случае приобретения реакцию называют «восстановлением».
Степень окисления – это величина, которая измеряется количественно и характеризует перераспределяемые электроны в ходе реакции. Т.е. в процессе оксидации электроны в атоме уменьшаются или увеличиваются, перераспределяясь между другими взаимодействующими частицами, и уровень оксидации показывает, как именно они реорганизуются. Данное понятие тесно связано с электроотрицательностью частиц – их умением притягивать и отталкивать от себя свободные ионы.
Это интересно! Что такое алканы: строение и химические свойства
Определение уровня оксидации зависит от характеристик и свойств конкретного вещества, поэтому нельзя однозначно назвать процедуру вычисления легкой или сложной, но ее результаты помогают условно записать процессы окислительно-восстановительных реакций. Следует понимать, что полученный результат вычислений является результатом учета переноса электронов и не имеет физического смысла, а также не является истинным зарядом ядра.
Важно знать! Неорганическая химия часто использует термин валентности вместо степени окисления элементов, это не является ошибкой, но следует учитывать, что второе понятие более универсальное.
Понятия и правила вычислений движения электронов являются основой для классификации химических веществ (номенклатура), описания их свойств и составления формул связи. Но наиболее часто данное понятие используется для описания и работы с окислительно-восстановительными реакциями.
Правила определения степени окисления
Как узнать степень окисления? При работе с окислительно-восстановительными реакциями важно знать, что формальный заряд частицы всегда будет равен величине электрона, выраженного в числовом значении. Эта особенность связана с тем предположением, что электронные пары, образующие связь, всегда полностью смещаются в сторону более отрицательных частиц. Следует понимать, что речь идет об ионных связях, а в случае реакции при ковалентной связи электроны будут делиться поровну между одинаковыми частицами.
Окислительное число может иметь как положительные, так и отрицательные значения. Все дело в том, что в процессе реакции атом должен стать нейтральным, а для этого нужно либо присоединить к иону некое количество электронов, если он положительный, либо отнять их, если он отрицательный. Для обозначения данного понятия при записи формулы обычно прописывают над обозначением элемента арабскую цифру с соответствующим знаком. Например, 

Следует знать, что формальный заряд металлов всегда будет положительным, а в большинстве 
- У простых элементов всегда равна нулю:
или
.
- У фтора всегда будет равна -1.
- Как и у металлов, у элементов из групп IA, IIA и IIIA групп всегда одинаковая – это номер группы, в которой они расположены.
- У кислорода в любой связи равна -2, кроме связей с пероксидами (Н2О2), когда значение равно -1 и оксидом фтора (O+2F2-1, O2+1F2-1), когда она равна +2.
- У водорода всегда +1, кроме его взаимодействия с гидридами (Na+H- и связями по типу C+4H4-1).
- У простого вещества без связей с другими элементами всегда равна нулю.
- У простого иона с одним атомом равна числу его электрона (Na+, Ca+2).
- Если рассматривается связь двух веществ различной природы (металл и неметалл), то отрицательное окислительное число будет наблюдаться у вещества, которое обладает большей электроотрицательностью (H+F-, Cu+Br-), а положительное, соответственно, у элемента с электроотрицательностью больше нуля.
- У щелочных металлов, таких как литий, натрий, калий и прочих, всегда +1.
- У металлов из главной подгруппы II (магний, барий, кальций и стронций) равна +2.
- У алюминия всегда одинаковое значение — +3.
Запомнив эти особенности, достаточно просто будет определять окислительное число у элементов, независимо от сложности и количества уровней атомов.
Полезное видео: определение степени окисления
Как определить степень окисления
Периодическая таблица Менделеева содержит почти всю необходимую информацию для работы с химическими элементами. Например, школьники используют только ее для описания химических реакций. Так, чтобы определить максимальные положительные и отрицательные значения окислительного числа необходимо свериться с обозначением химического элемента в таблице:
- Максимально положительное – это номер группы, в которой находится элемент.
- Максимально отрицательная степень окисления – это разница между максимально положительной границей и числом 8.
Таким образом, достаточно просто узнать крайние границы формального заряда того или иного элемента. Такое действие можно совершить с помощью вычислений на основе таблицы Менделеева.
Важно знать! У одного элемента могут быть одновременно несколько различных показателей оксидации.
Различают два основных способа определения уровня оксидации, примеры которых представлены ниже. Первый из них – это способ, который требует знаний и умений применять законы химии. Как расставлять степени окисления с помощью этого способа?
Для этого необходимо:
- Определить, является ли данное вещество элементарным и находится ли оно вне связи. Если да, то его окислительное число будет равно 0, независимо от состава вещества (отдельные атомы или многоуровневые атомные соединения).
- Определить, состоит ли рассматриваемое вещество из ионов. Если да, то степень оксидации будет равна их заряду.
- Если рассматриваемое вещество металл, то посмотреть на показатели других веществ в формуле и вычислить показания металла путем арифметических действий.
- Если все соединение имеет один заряд (по сути это сумма всех частиц представленных элементов), то достаточно определить показатели простых веществ, затем вычесть их от общей суммы и получить данные металла.
- Если связь нейтральная, то общая сумма должна быть равна нулю.
Это интересно! Уроки химии: что это такое галогены
Для примера можно рассмотреть объединение 
Этот способ весьма хорош, поскольку правильность решения всегда можно проверить, если сложить все уровни оксидации вместе.
Второй метод можно применять без знания химических законов:
- Найти данные частиц, по отношению к которым нет строгих правил и точное количество их электронов неизвестно (можно путем исключения).
- Выяснить показатели всех прочих частиц и после из общей суммы путем вычитания найти нужную частицу.
Рассмотрим второй метод на примере вещества Na2SO4, в котором не определен атом серы S, известно лишь, что он отличен от нуля.
Это интересно! Уроки химии: катионы и анионы – что это такое
Чтобы найти, чему равны все степени окисления необходимо:
- Найти известные элементы, помня о традиционных правилах и исключениях.
- Ион Na = +1, а каждый кислород = -2.
- Умножить количество частиц каждого вещества на их электроны и получить степени оксидации всех атомов, кроме одного.
- В Na2SO4 состоят 2 натрия и 4 кислорода, при умножении получается: 2 X +1 = 2 – это окислительное число всех частиц натрия и 4 X -2 = -8 – кислородов.
- Сложить полученные результаты 2+(-8) =-6 – это общий заряд соединения без частицы серы.
- Представить химическую запись в виде уравнения: сумма известных данных + неизвестное число = общий заряд.
- Na2SO4 представлено следующим образом: -6 + S = 0, S = 0 + 6, S = 6.
Таким образом, чтобы использовать второй метод, достаточно знать простые законы арифметики.
Таблица оксидации
Для простоты работы и вычисления показателей оксидации для каждого химического вещества используют специальные таблицы, где прописаны все данные.
Она выглядит следующим образом:
Полезное видео: учимся определять степень окисления по формулам
Вывод
Нахождение степени окисления для химического вещества – это простое действие, которое требует лишь внимательности и знания основных правил и исключений. Зная исключения и пользуясь специальными таблицами, это действие не будет занимать много времени.
[spoiler title=”источники:”]
http://ege-study.ru/ru/ege/materialy/himiya/kak-opredelit-stepen-okisleniya/
http://znaniya.guru/himiya/kak-rasstavlyat-i-kak-opredelit-stepen-okisleniya-elementov.html
[/spoiler]
Gdhb asfsfa
Ученик
(86),
на голосовании
11 лет назад
Голосование за лучший ответ
впрфыарвар
Профи
(629)
11 лет назад
фокуса нету
фарми мобов и надейся на лучшее
Edich
Мыслитель
(6542)
11 лет назад
надо быть просто удачливым-вот весь фокус=)
Похожие вопросы
Собственно задаюсь вопросом.Уже с пол года как на серве не было Зарича.И вдруг его реализовали.Вопрос.Кому он нужен этот зарич.Заметил многих тупо раздражает его приход.Просьба отписаться всем излить душу.
Демонический Меч Zariche
Проклятый меч
Оружие убийцы, Демонический Меч Zariche, когда-то принадлежавший Демону Бреммнону, одному из четырёх королей демонов.
Шанс дропа и правила владения
• Все монстры в мире могут дропнуть его, хотя только один из них существует в целом мире.
• Невозможно выбросить, передать или уничтожить этот меч.
• Когда Zariche появляется в мире, весь мир ненадолго покрывается тьмой, твердь земная содрогается, и системное сообщение уведомляет игроков, что демонический меч найден.
• Персонаж, подобравший Zariche, мгновенно переходит в хаотическое состояние(красный ник) и его(её) HP, CP и MP полностью восстанавливаются(100%).
• Как только меч получен, карма персонажа становится максимальной. Пока Zariche не покинет персонажа, он всегда будет иметь карму.
• Когда персонаж получает Zariche, тот автоматически «одевается» и его невозможно «снять».
• Zariche автоматически исчезает через некоторый промежуток времени.
• Когда персонаж, владеющий Zariche, умирает, меч немедленно исчезает или выпадает на землю.
• Zariche автоматически покинет своего владельца в соответствующее время независимо от того, является ил игрок онлайн или нет.
• Персонаж, владеющий Zariche, будет уведомлён системным сообщением о том, сколько времени осталось до исчезновения Zariche.
Войны и партии
Следующие правила действую на персонажа, владеющего Zariche, в ПвП, клан-варах и партиях.
• Игрок, владеющий Zariche, не может атаковать игроков лвл20 и ниже. В свою очередь, игроки должны быть не ниже лвл21, чтобы атаковать персонажа, владеющего Zariche.
• Когда наносишь удар(не считая скиллов и магии) игрокам, включая Героев, их CP мгновенно становится равным 0.
• Когда Герой бьёт(не считая скиллов и магии) игрока, владеющего Zariche, CP этого игрока мгновенно становится равным 0.
• PK штрафы, такие как потеря опыта, дроп вещей, рост кармы и т.д., не будут применяться к обеим сторонам, если участвует игрок, владеющий Zariche.
• Игрок, владеющий Zariche, не может вступать в партию к другим игрокам.
• Если игрок получает Zariche, находясь в партии, то он автоматически из неё выходит.
• Игрок, владеющий Zariche, не может использовать систему поиска партии(party matching system) или командный канал(command channel).
• Игрок, владеющий Zariche, не может давать или получать баффы и не может лечить или быть вылеченным другими игроками. Однако он может использовать баффы или лечиться самостоятельно.
• Игрок, владеющий Zariche, может призывать животных/суммонов, но не может ездить на животных.
Олимпиада и Герои
• Игрок, владеющий Zariche, не может участвовать в Олимпиаде.
• Герой, получивший Zariche , всё равно может использовать скиллы Героя.
Возможности и время жизни
• Когда игрок, владеющий Zariche, убивает другого игрока, время жизни Zariche уменьшается, но способности меча растут.
• Zariche заставляет владельца считать всех, участвующих в осаде, врагами.
• Когда игрок, владеющий Zariche, умирает, меч выпадает, а его(меча) способности возвращаются к нормальным.