Как определить заряд химического элемента
Химический элемент состоит из одинаковых атомов, обладающих совокупностью свойств. Эти свойства зависят от многих факторов, прежде всего от строения атома. Сколько электронных уровней в атоме, сколько электронов находится на самом внешнем уровне, как далеко он расположен от ядра – все это напрямую влияет на поведение элемента при вступлении во взаимодействие с другими элементами. В целом атом любого элемента нейтрален, так как суммарный отрицательный заряд электронов уравновешен суммарным зарядом протонов.

Инструкция
Знаменитая таблица Менделеева, названная в честь великого русского ученого, первооткрывателя закона о периодичности свойств химических элементов, играет в химии роль своеобразного адресного и справочного бюро. Каждому химическому элементу отведена в ней особая ячейка – «квартира». По местоположению этой ячейки в таблице можно безошибочно предсказать «характер жильца», то есть какими свойствами обладает элемент. И как всякая настоящая квартира, каждая ячейка элемента имеет свой порядковый номер.
Для того чтобы определить, чему равен суммарный заряд атома ядра какого-либо элемента, посмотрите на его порядковый номер. Дело в том, что он численно совпадает с количеством протонов, находящихся в ядре его атома. А каждый протон, как уже говорилось, несет единичный положительный заряд. Правда в ядре помимо протонов есть еще частицы, которые называются нейтронами. Но они, как легко можно понять из их названия, вообще не несут никакого заряда.
Вот, например, один из самых активных элементов таблицы Менделеева – щелочной металл рубидий. Он находится в первой главной группе шестого периода таблицы. Его порядковый номер 37. Следовательно, суммарный положительный заряд ядра атома рубидия равен +37.
Проверьте это. Любой атом нейтрален, следовательно, в атоме рубидия должно быть 37 электронов, чтобы уравновесить заряд протонов ядра. В той ячейке таблицы, которую занимает рубидий, приведен состав электронов на каждом его уровне. Считаем, сколько всего электронов на всех уровнях: 2+8+18+8+1 = 37. Суммарный заряд электронов и протонов = 0.
Еще один пример. Самый тугоплавкий из всех существующих, металл вольфрам, находящийся в побочной шестой группе восьмого периода под номером 74. Сколько в его атоме электронов? Посчитайте: 2+8+18+32+12+2 = 74. Следовательно, для того чтобы атом вольфрама был нейтральным, общий положительный заряд его ядра должен быть равен +74. Счет сошелся, все правильно.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
![]()
![]()
Заряд ядра равен количеству протонов в нем. Количество протонов о можно определить по периодической таблице Менделеева. Он равен порядковому номеру элемента.
По формуле: q = e*Z
где e – заряд одного протона,
Z- число протонов( порядковый номер в таблице ).
автор вопроса выбрал этот ответ лучшим
![]()
ЧипИДейл
[36.5K]
2 года назад
Для того, чтобы узнать заряд ядра атома какого-либо химического элемента, необходимо будет заглянуть в периодическую таблицу Менделеева. В ней для каждого элемента определен порядковый номер. Этот номер равен количеству протонов в ядре элемента. А заряд ядра атома как раз и равен количеству протонов. Соответственно делаем вывод, что заряд ядра атома равен порядковому (зарядному) числу, который указывается для каждого вещества в периодической таблице Менделеева.
Самый маленький заряд ядра имеет Водород (обозначается буквой «H»), распололоженный в таблице под номером 1. А самый большой заряд у элемента, который называется Оганесон (обозначается, как «Og») с атомным номером 118.
![]()
владсандрович
[766K]
4 года назад
Заряд в ядре приравнивается к количеству того числа протонов которые содержатся в нем. Их количество определяется исходя из данных которые дает периодическая таблица Менделеева. И в ней что бы увидеть их число, нужно смотреть на порядковый номер элемента.
Вот формуле для расчета: q = e*Z
В которой “e” , является зарядом одного протона.
Литера “Z”- как раз таки является тем числом протонов, которое располагается порядковым номером в таблице.
![]()
Существует три вида элементарных частиц. Протоны и нейтроны находятся в ядре атома, а электроны движутся по орбиталям, поэтому их не учитываем. Нейтроны не имеют какого-либо заряда, его имеют только протоны. Каждый протон имеет заряд +1.
И чтобы определить, какой заряд имеет ядро некого атома, нужно умножить +1 на порядковый номер вещества в таблице Менделеева.
Ряд ядра всегда положительный.
![]()
Алекс98
[60K]
2 года назад
Ох уж эта физика. Еще со школы помню, что заряд ядра автора равен количеству в нем протонов.
Количество протонов определяется по периодической таблице Менделеева и равняется порядковому номеру элементов.
Знаете ответ?
Основной структурной единицей веществ атомного строения является атом.
Атом – мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Электронная оболочка – совокупность группирующихся вокруг ядра электронов.
Электрон – одна из элементарных частиц материи, обладающая массой покоя и элементарным отрицательным зарядом.
Когда говорят о массе покоя, то подразумевают, что частица может находиться в состоянии покоя и иметь массу. Существуют частицы, которые не могут находиться в состоянии покоя, например частицы света – фотоны. В этом случае говорят, что фотон не имеет массы покоя.
Заряд электрона называется элементарным, так как это наименьший отрицательный заряд в природе. По этой причине заряд электрона условно принимают равным -1.
Атомное ядро – центральная, положительно заряженная, сложно организованная часть атома, состоящая из нуклонов, связанных между собой ядерными силами.
Нуклоны – общее название двух типов частиц, протонов и нейтронов.
С точки зрения атомной физики протон и нейтрон являются двумя состояниями одной и той же частицы – нуклона.
Нуклон – структурная единица ядра атома, которая может находиться в двух состояниях, протона и нейтрона.
Нуклоны (протоны и нейтроны) состоят из кварков.
Заряд ядра атома соответствует атомному номеру (порядковому номеру) элемента в периодической системе (Z).
Заряд ядра определяется числом протонов, следовательно:
Так как атом – электронейтральная частица, то:
Массовое число (нуклонное число) – сумма числа протонов и нейтронов в ядре данного атома.
Если в условии задания не указано массовое число, то его можно взять из таблицы Д.И. Менделеева, округлив до целой величины относительную атомную массу.
О том, что такое относительная атомная масса мы поговорим чуть позже. Пока не заостряйте на этом внимание. Где её найти в таблице Д.И. Менделеева показано на рисунке ниже.
Для расчета числа нейтронов в ядре используется формула:
Для характеристик частицы (протона, нейтрона, атома) применяют следующую запись:
Определим состав атома хлора. Порядковый номер хлора в таблице Д. И. Менделеева равен 17, следовательно заряд ядра атома хлора равен +17. Если заряд ядра равен +17, то в ядре атома хлора 17 протонов, а в электронной оболочке 17 электронов.
Чтобы определить число нейтронов в ядре атома хлора, округлим до целой величины относительную атомную массу хлора, это значение равно 36. То есть, в ядре атома хлора 36 нуклонов, 17 из них являются протонами, тогда число нейтронов равно 36-17 = 19.
Кратко это можно записать следующим образом:
Атомы отличаются друг от друга радиусом, массой, зарядом ядра, количеством электронов и другими параметрами. Заряд ядра атома – это наиболее важная его характеристика. Поэтому все атомы можно условно разделить на группы (классифицировать) по заряду их ядер. Такие абстрактные группы принято называть химическими элементами.
Химический элемент – вид атомов, с определённым зарядом ядра.
Химический элемент – одно из центральных понятий науки химии.
По предложению шведского химика Й. Берцелиуса химические элементы обозначают начальной или начальной и одной из последующих букв латинского названия элемента (1813 г).
Водород на лат. Hydrogenium (H). Ртуть на лат. Hydrargyrum (Hg) Эти буквенные обозначения называются химическими знаками или химическими символами.
Символ отдельного атома совпадает с символом соответствующего ему химического элемента. К примеру, символ S обозначает химический элемент серу или же один атом этого элемента.
Если требуется обозначить не один, а несколько атомов, то перед символом элемента ставят соответствующую цифру – коэффициент. 5S – пять атомов элемента серы.
Символы и русские названия химических элементов можно найти в таблице Д. И. Менделеева.
Несмотря на то что у ядер атомов одного и того же химического элемента одинаковый заряд, они могут отличаться друг от друга массовым (нуклонным) числом по причине разного количества нейтронов. Такие разновидности ядер атомов одного химического элемента называют изотопами.
Изотопы – ядра с одинаковым зарядом, но разным массовым числом, т.е разным числом нейтронов.
Отметим, что термин изотопы следует употреблять только во множественном числе. В единственном числе следует говорить – нуклид. Что такое нуклиды Вы узнаете чуть позже.
К примеру, химический элемент водород (H) представляет из себя смесь атомов с массовыми числами равными 1 и 2, это изотопы водорода – протий (H) и дейтерий (D). Нуклид водорода с массовым числом 3 в природе не встречается, так как его ядро чрезвычайно нестабильно и очень быстро подвергается ядерному распаду, это так называемый тритий (T).
Запишем состав изотопов водорода, пользуясь описанными выше правилами.
Мы убедились, что изотопы отличаются массовыми числами, а также количеством нейтронов в ядре. Заряд ядер изотопов одинаковый, так как они принадлежат одному химическому элементу.
Содержание изотопов в земной коре разное ввиду их разной стабильности. Чем устойчивее изотоп, тем выше его содержание.
Содержание изотопов элемента Х может быть оценено в массовых или мольных долях.
Доля – отношение части к целому.
Массовая доля (w или w%) – отношение массы части системы к массе всей системы.
О мольной доле мы поговорим позднее в соответствующей теме.
Массовая доля – величина безразмерная, её выражают в долях единицы или процентах. Для вычисления массовой доли применяются формулы:
Изотопный состав элемента водорода может быть представлен следующей схемой:
Задания по теме “Основные сведения о строении атома”
- Ядро атома некоторого элемента содержит 16 нейтронов, а электронная оболочка этого атома – 15 электронов. Назвать элемент, изотопом которого является данный атом. Привести запись его символа с указанием заряда ядра и массового числа.
- Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Указать число протонов и нейтронов в ядре атома и название элемента.
- Укажите число протонов, нейтронов и электронов в атоме циркония.
- Укажите число протонов, нейтронов и электронов в атоме иттрия.
- Укажите число протонов, нейтронов и электронов в атоме индия.
- Укажите число протонов, нейтронов и электронов в атоме кадмия.
- Сколько нейтронов содержит ядро атома 37Cl?
- Сколько нейтронов содержит ядро атома 18O?
- Сколько нейтронов содержит ядро атома 30Si?
- Сколько нейтронов содержит ядро атома 19F?
Е.Н.ФРЕНКЕЛЬ
Самоучитель по химии
Пособие для тех, кто не знает, но хочет
узнать и понять химию
Продолжение. Начало см. в № 13, 18, 23/2007
Глава 3. Элементарные сведения о
строении атома.
Периодический закон Д.И.Менделеева
В с п о м н и т е, что такое атом, из чего состоит
атом, изменяется ли атом в химических
реакциях.
Атом – это электронейтральная частица,
состоящая из положительно заряженного ядра и
отрицательно заряженных электронов.
Число электронов в ходе химических процессов
может изменяться, но заряд ядра всегда остается
неизменным. Зная распределение электронов в
атоме (строение атома), можно предсказать многие
свойства данного атома, а также свойства простых
и сложных веществ, в состав которых он входит.
Строение атома, т.е. состав ядра и распределение
электронов вокруг ядра, несложно определить по
положению элемента в периодической системе.
В периодической системе Д.И.Менделеева
химические элементы располагаются в
определенной последовательности. Эта
последовательность тесно связана со строением
атомов этих элементов. Каждому химическому
элементу в системе присвоен порядковый номер,
кроме того, для него можно указать номер периода,
номер группы, вид подгруппы.
Спонсор публикации статьи интернет-магазин “Мегамех”. В магазине Вы найдёте изделия из меха на любой вкус – куртки, жилетки и шубы из лисы, нутрии, кролика, норки, чернобурки, песца. Компания также предлагает Вам приобрести элитные меховые изделия и воспользоваться услугами индивидуального пошива. Меховые изделия оптом и в розницу – от бюджетной категории до класса люкс, скидки до 50%, гарантия 1 год, доставка по Украине, России, СНГ и странам Евросоюза, самовывоз из шоу-рума в г.Кривой Рог, товары от ведущих производителей Украины, России, Турции и Китая. Посмотреть каталог товаров, цены, контакты и получить консультацию Вы сможете на сайте, который располагается по адресу: “megameh.com”.
Зная точный «адрес» химического элемента –
группу, подгруппу и номер периода, можно
однозначно определить строение его атома.
Период – это горизонтальный ряд химических
элементов. В современной периодической
системе семь периодов. Первые три периода – малые,
т.к. они содержат 2 или 8 элементов:
1-й период – Н, Не – 2 элемента;
2-й период – Li … Nе – 8 элементов;
3-й период – Na … Аr – 8 элементов.
Остальные периоды – большие. Каждый из них
содержит 2–3 ряда элементов:
4-й период (2 ряда) – K … Kr – 18 элементов;
6-й период (3 ряда) – Сs … Rn – 32 элемента. В этот
период входит ряд лантаноидов.
Группа – вертикальный ряд химических
элементов. Всего групп восемь. Каждая группа
состоит из двух подгрупп: главной подгруппы и
побочной подгруппы. Например:
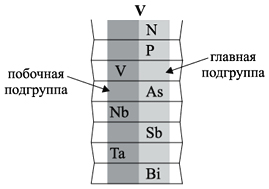
Главную подгруппу образуют химические
элементы малых периодов (например, N, P) и больших
периодов (например, As, Sb, Bi).
Побочную подгруппу образуют химические
элементы только больших периодов (например, V, Nb,
Ta).
Визуально эти подгруппы различить легко.
Главная подгруппа «высокая», она начинается с
1-го или 2-го периода. Побочная подгруппа –
«низкая», начинается с 4-го периода.
Итак, каждый химический элемент периодической
системы имеет свой адрес: период, группу,
подгруппу, порядковый номер.
Например, ванадий V – это химический элемент
4-го периода, V группы, побочной подгруппы,
порядковый номер 23.
Задание 3.1. Укажите период, группу и
подгруппу для химических элементов с
порядковыми номерами 8, 26, 31, 35, 54.
Задание 3.2. Укажите порядковый номер и
название химического элемента, если известно,
что он находится:
а) в 4-м периоде, VI группе, побочной подгруппе;
б) в 5-м периоде, IV группе, главной подгруппе.
Каким образом можно связать сведения о
положении элемента в периодической системе со
строением его атома?
Атом состоит из ядра (оно имеет положительный
заряд) и электронов (они имеют отрицательный
заряд). В целом атом электронейтрален.
Положительный заряд ядра атома равен
порядковому номеру химического элемента.
Ядро атома – сложная частица. В ядре
сосредоточена почти вся масса атома. Поскольку
химический элемент – совокупность атомов с
одинаковым зарядом ядра, то около символа
элемента указывают следующие его координаты:
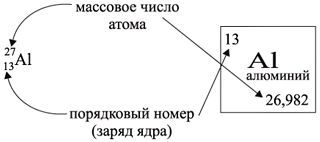
По этим данным можно определить состав ядра.
Ядро состоит из протонов и нейтронов.
Протон p имеет массу 1 (1,0073 а. е. м.) и заряд +1.
Нейтрон n заряда не имеет (нейтрален), а масса
его приблизительно равна массе протона (1,0087 а. е.
м.).
Заряд ядра определяют протоны. Причем число
протонов равно (по величине) заряду ядра
атома, т.е. порядковому номеру.
Число нейтронов N определяют по разности
между величинами: «масса ядра» А и
«порядковый номер» Z. Так, для атома алюминия:
N = А – Z = 27 –13 = 14n,
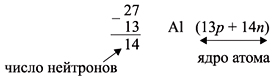
Задание 3.3. Определите состав ядер атомов,
если химический элемент находится в:
а) 3-м периоде, VII группе, главной подгруппе;
б) 4-м периоде, IV группе, побочной подгруппе;
в) 5-м периоде, I группе, главной подгруппе.
Внимание! При определении массового числа ядра
атома приходится округлять атомную массу,
указанную в периодической системе. Так поступают
потому, что массы протона и нейтрона практически
целочисленны, а массой электронов можно
пренебречь.
Определим, какие из приведенных ниже ядер
принадлежат одному и тому же химическому
элементу:
А (20р + 20n),
Б (19р + 20n),
В (20р + 19n).
Атомам одного химического элемента
принадлежат ядра А и В, поскольку они
содержат одинаковое число протонов, т. е. заряды
этих ядер одинаковые. Исследования показывают,
что масса атома не оказывает существенного
влияния на его химические свойства.
Изотопами называют атомы одного и того же
химического элемента (одинаковое число
протонов), различающиеся массой (разное число
нейтронов).
Изотопы и их химические соединения отличаются
друг от друга по физическим свойствам, но
химические свойства у изотопов одного
химического элемента одинаковы. Так, изотопы
углерода-14 (14С) имеют такие же химические
свойства, как и углерода-12 (12С), которые
входят в ткани любого живого организма. Отличие
проявляется только в радиоактивности (изотоп 14С).
Поэтому изотопы применяют для диагностики и
лечения различных заболеваний, для научных
исследований.
Вернемся к описанию строения атома.
Как известно, ядро атома в химических
процессах не изменяется. А что изменяется?
Переменным оказывается общее число электронов в
атоме и распределение электронов. Общее число
электронов в нейтральном атоме определить
несложно – оно равно порядковому номеру, т.е.
заряду ядра атома:
![]()
Электроны имеют отрицательный заряд –1, а масса
их ничтожна: 1/1840 от массы протона.
Отрицательно заряженные электроны
отталкиваются друг от друга и находятся на
разных расстояниях от ядра. При этом электроны,
имеющие приблизительно равный запас энергии,
находятся на приблизительно равном расстоянии
от ядра и образуют энергетический уровень.
Число энергетических уровней в атоме равно
номеру периода, в котором находится химический
элемент. Энергетические уровни условно
обозначают так (например, для Al):

Задание 3.4. Определите число энергетических
уровней в атомах кислорода, магния, кальция,
свинца.
На каждом энергетическом уровне может
находиться ограниченное число электронов:
• на первом – не более двух электронов;
• на втором – не более восьми электронов;
• на третьем – не более восемнадцати
электронов.
Эти числа показывают, что, например, на втором
энергетическом уровне может находиться 2, 5 или 7
электронов, но не может быть 9 или 12 электронов.
Важно знать, что независимо от номера
энергетического уровня на внешнем уровне
(последнем) не может быть больше восьми
электронов. Внешний восьмиэлектронный
энергетический уровень является наиболее
устойчивым и называется завершенным. Такие
энергетические уровни имеются у самых
неактивных элементов – благородных газов.
Как определить число электронов на внешнем
уровне остальных атомов? Для этого существует
простое правило: число внешних электронов
равно:
• для элементов главных подгрупп – номеру
группы;• для элементов побочных подгрупп оно не может
быть больше двух.
Например (рис. 5):
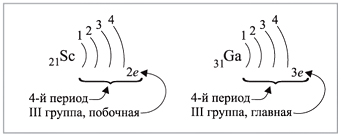 |
Рис. 5.
|
Задание 3.5. Укажите число внешних
электронов для химических элементов с
порядковыми номерами 15, 25, 30, 53.
Задание 3.6. Найдите в периодической системе
химические элементы, в атомах которых имеется
завершенный внешний уровень.
Очень важно правильно определять число внешних
электронов, т.к. именно с ними связаны важнейшие
свойства атома. Так, в химических реакциях атомы
стремятся приобрести устойчивый, завершенный
внешний уровень (8е). Поэтому атомы, на внешнем
уровне которых мало электронов, предпочитают их
отдать.
Химические элементы, атомы которых способны
только отдавать электроны, называют металлами.
Очевидно, что на внешнем уровне атома металла
должно быть мало электронов: 1, 2, 3.
Если на внешнем энергетическом уровне атома
много электронов, то такие атомы стремятся
принять электроны до завершения внешнего
энергетического уровня, т. е. до восьми
электронов. Такие элементы называют неметаллами.
В о п р о с. К металлам или неметаллам
относятся химические элементы побочных
подгрупп? Почему?
О т в е т. Металлы и неметаллы главных
подгрупп в таблице Менделеева отделяет линия,
которую можно провести от бора к астату. Выше
этой линии (и на линии) располагаются неметаллы,
ниже – металлы. Все элементы побочных подгрупп
оказываются ниже этой линии.
Задание 3.7. Определите, к металлам или
неметаллам относятся: фосфор, ванадий, кобальт,
селен, висмут. Используйте положение элемента в
периодической системе химических элементов и
число электронов на внешнем уровне.
Для того, чтобы составить распределение
электронов по остальным уровням и подуровням,
следует воспользоваться следующим а л г о р и т м
о м.
1. Определить общее число электронов в атоме (по
порядковому номеру).
2. Определить число энергетических уровней (по
номеру периода).
3. Определить число внешних электронов (по виду
подгруппы и номеру группы).
4. Указать число электронов на всех уровнях,
кроме предпоследнего.
5. Рассчитать число электронов на предпоследнем
уровне.
Например, согласно пунктам 1–4 для атома
марганца определено:
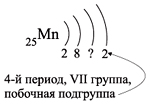
Всего 25е; распределили (2 + 8 + 2) = 12e;
значит, на третьем уровне находится: 25 – 12 = 13e.
Получили распределение электронов в атоме
марганца:

Задание 3.8. Отработайте алгоритм, составив
схемы строения атомов для элементов № 16, 26, 33, 37.
Укажите, металлы это или неметаллы. Ответ
поясните.
Составляя приведенные выше схемы строения
атома, мы не учитывали, что электроны в атоме
занимают не только уровни, но и определенные подуровни
каждого уровня. Виды подуровней обозначаются
латинскими буквами: s, p, d.
Число возможных подуровней равно номеру
уровня. Первый уровень состоит из одного
s-подуровня. Второй уровень состоит из двух
подуровней – s и р. Третий уровень – из
трех подуровней – s, p и d.
На каждом подуровне может находиться строго
ограниченное число электронов:
на s-подуровне – не больше 2е;
на р-подуровне – не больше 6е;
на d-подуровне – не больше 10е.
Подуровни одного уровня заполняются в строго
определенном порядке: s ![]() p
p ![]() d.
d.
Таким образом, р-подуровнь не может начать
заполняться, если не заполнен s-подуровень
данного энергетического уровня, и т.д. Исходя из
этого правила, несложно составить электронную
конфигурацию атома марганца:
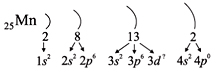
В целом электронная конфигурация атома марганца
записывается так:
25Мn 1s22s22p63s23p63d54s2.
Здесь и далее приняты следующие обозначения:
![]()
Задание 3.9. Составьте электронные
конфигурации атомов для химических элементов №
16, 26, 33, 37.
Для чего необходимо составлять электронные
конфигурации атомов? Для того, чтобы
определять свойства этих химических элементов.
Следует помнить, что в химических процессах
участвуют только валентные электроны.
Валентные электроны находятся на внешнем
энергетическом уровне и незавершенном
d-подуровне предвнешнего уровня.
Определим число валентных электронов для
марганца:
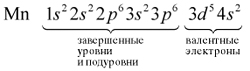
или сокращенно: Мn … 3d54s2.
Что можно определить по формуле электронной
конфигурации атома?
1. Какой это элемент – металл или неметалл?
Марганец – металл, т.к. на внешнем (четвертом)
уровне находится два электрона.
2. Какой процесс характерен для металла?
Атомы марганца в реакциях всегда только отдают
электроны.
3. Какие электроны и сколько будет отдавать атом
марганца?
В реакциях атом марганца отдает два внешних
электрона (они дальше всех от ядра и слабее
притягиваются им), а также пять предвнешних d-электронов.
Общее число валентных электронов – семь (2 + 5).
В этом случае на третьем уровне атома
останется восемь электронов, т.е. образуется
завершенный внешний уровень.
Все эти рассуждения и заключения можно
отразить при помощи схемы (рис. 6):
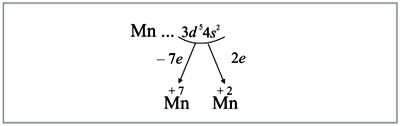 |
Рис. 6.
|
Полученные условные заряды атома
называют степенями окисления.
Рассматривая строение атома, аналогичным
способом можно показать, что типичными степенями
окисления для кислорода является –2, а для
водорода +1.
В о п р о с. С каким из химических
элементов может образовывать соединения
марганец, если учесть полученные выше степени
его окисления?
О т в е т. Только с кислородом, т.к. его атом
имеет противоположную по заряду степень
окисления. Формулы соответствующих оксидов
марганца (здесь степени окисления соответствуют
валентностям этих химических элементов):
![]()
Строение атома марганца подсказывает, что
большей степени окисления у марганца быть не
может, т.к. в этом случае пришлось бы
затрагивать устойчивый, теперь уже завершенный
предвнешний уровень. Поэтому степень окисления +7
является высшей, а соответствующий оксид Мn2О7
– высшим оксидом марганца.
Для закрепления всех этих понятий рассмотрим
строение атома теллура и некоторые его свойства:
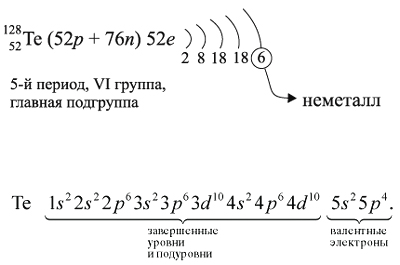
Как неметалл, атом Te может принять 2 электрона
до завершения внешнего уровня и отдать «лишние» 6
электронов:
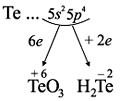
Задание 3.10. Изобразите электронные
конфигурации атомов Nа, Rb, Cl, I, Si, Sn. Определите
свойства этих химических элементов, формулы их
простейших соединений (с кислородом и водородом).
Практические выводы
1. В химических реакциях участвуют только
валентные электроны, которые могут находиться
только на двух последних уровнях.
2. Атомы металлов могут только отдавать
валентные электроны (все или несколько), принимая
положительные степени окисления.
3. Атомы неметаллов могут принимать электроны
(недостающие – до восьми), приобретая при этом
отрицательные степени окисления, и отдавать
валентные электроны (все или несколько), при этом
они приобретают положительные степени
окисления.
Сравним теперь свойства химических элементов
одной подгруппы, например натрия и рубидия:
Nа …3s1 и Rb …5s1.
Что общего в строении атомов этих элементов?
На внешнем уровне каждого атома по одному
электрону – это активные металлы. Металлическая
активность связана со способностью отдавать
электроны: чем легче атом отдает электроны, тем
сильнее выражены его металлические свойства.
Что удерживает электроны в атоме? Притяжение их
к ядру. Чем ближе электроны к ядру, тем сильнее
они притягиваются ядром атома, тем труднее их
«оторвать».
Исходя из этого, ответим на вопрос: какой
элемент – Nа или Rb – легче отдает внешний
электрон? Какой из элементов является более
активным металлом? Очевидно, рубидий, т.к. его
валентные электроны находятся дальше от ядра (и
слабее удерживаются ядром).
Вывод. В главных подгруппах сверху вниз
металлические свойства усиливаются, т.к.
возрастает радиус атома, и валентные электроны
слабее притягиваются к ядру.
Сравним свойства химических элементов VIIa
группы: Cl …3s23p5 и I …5s25p5.
Оба химических элемента – неметаллы, т.к. до
завершения внешнего уровня не хватает одного
электрона. Эти атомы будут активно притягивать
недостающий электрон. При этом чем сильнее
притягивает атом неметалла недостающий
электрон, тем сильнее проявляются его
неметаллические свойства (способность принимать
электроны).
За счет чего происходит притяжение электрона?
За счет положительного заряда ядра атома.
Кроме того, чем ближе электрон к ядру, тем сильнее
их взаимное притяжение, тем активнее неметалл.
В о п р о с. У какого элемента сильнее
выражены неметаллические свойства: у хлора или
йода?
О т в е т. Очевидно, у хлора, т.к. его валентные
электроны расположены ближе к ядру.
Вывод. Активность неметаллов в подгруппах
сверху вниз убывает, т.к. возрастает радиус
атома и ядру все труднее притянуть недостающие
электроны.
Сравним свойства кремния и олова: Si …3s23p2
и Sn …5s25p2.
На внешнем уровне обоих атомов по четыре
электрона. Тем не менее эти элементы в
периодической системе находятся по разные
стороны от линии, соединяющей бор и астат.
Поэтому у кремния, символ которого находится
выше линии В–At, сильнее проявляются
неметаллические свойства. Напротив, у олова,
символ которого находится ниже линии В–At,
сильнее проявляются металлические свойства. Это
объясняется тем, что в атоме олова четыре
валентных электрона удалены от ядра. Поэтому
присоединение недостающих четырех электронов
затруднено. В то же время отдача электронов
с пятого энергетического уровня происходит
достаточно легко. Для кремния возможны оба
процесса, причем первый (прием электронов)
преобладает.
Выводы по главе 3. Чем меньше внешних
электронов в атоме и чем дальше они от ядра, тем
сильнее проявляются металлические свойства.
Чем больше внешних электронов в атоме и чем
ближе они к ядру, тем сильнее проявляются
неметаллические свойства.
Основываясь на выводах, сформулированных в
этой главе, для любого химического элемента
периодической системы можно составить
«характеристику».
Алгоритм описания свойств
химического элемента по его положению
в периодической системе
1. Составить схему строения атома, т.е.
определить состав ядра и распределение
электронов по энергетическим уровням и
подуровням:
• определить общее число протонов, электронов
и нейтронов в атоме (по порядковому номеру и
относительной атомной массе);• определить число энергетических уровней (по
номеру периода);• определить число внешних электронов (по виду
подгруппы и номеру группы);• указать число электронов на всех
энергетических уровнях, кроме предпоследнего;• рассчитать число электронов на
предпоследнем уровне.
2. Определить число валентных электронов.
3. Определить, какие свойства – металла или
неметалла – сильнее проявляются у данного
химического элемента.
4. Определить число отдаваемых (принимаемых)
электронов.
5. Определить высшую и низшую степени окисления
химического элемента.
6. Составить для этих степеней окисления
химические формулы простейших соединений с
кислородом и водородом.
7. Определить характер оксида и составить
уравнение его реакции с водой.
8. Для указанных в пункте 6 веществ составить
уравнения характерных реакций (см. главу 2).
Задание 3.11. По приведенной выше схеме
составить описания атомов серы, селена, кальция и
стронция и свойства этих химических элементов.
Какие общие свойства проявляют их оксиды и
гидроксиды?
Если вы выполнили упражнения 3.10 и 3.11, то
легко заметить, что не только атомы элементов
одной подгруппы, но и их соединения имеют общие
свойства и похожий состав.
Периодический закон Д.И.Менделеева:
свойства химических элементов, а также свойства
простых и сложных веществ, образованных ими,
находятся в периодической зависимости от заряда
ядер их атомов.
Физический смысл периодического закона: свойства
химических элементов периодически повторяются
потому, что периодически повторяются
конфигурации валентных электронов
(распределение электронов внешнего и
предпоследнего уровней).
Так, у химических элементов одной и той же
подгруппы одинаковое распределение валентных
электронов и, значит, похожие свойства.
Например, у химических элементов пятой группы
пять валентных электронов. При этом в атомах
химических элементов главных подгрупп – все
валентные электроны находятся на внешнем уровне:
… ns2np3, где n – номер
периода.
У атомов элементов побочных подгрупп на
внешнем уровне находятся только 1 или 2 электрона,
остальные – на d-подуровне предвнешнего
уровня: … (n – 1)d3ns2, где n
– номер периода.
Задание 3.12. Составьте краткие электронные
формулы для атомов химических элементов № 35 и 42,
а затем составьте распределение электронов в
этих атомах по алгоритму. Убедитесь, что ваше
предсказание сбылось.
Упражнения к главе 3
1. Сформулируйте определения понятий
«период», «группа», «подгруппа». Что общего у
химических элементов, которые составляют: а)
период; б) группу; в) подгруппу?
2. Что такое изотопы? Какие свойства –
физические или химические – совпадают у
изотопов? Почему?
3. Сформулируйте периодический закон
Д.И.Менделеева. Поясните его физический смысл и
проиллюстрируйте примерами.
4. В чем проявляются металлические
свойства химических элементов? Как они
изменяются в группе и в периоде? Почему?
5. В чем проявляются неметаллические
свойства химических элементов? Как они
изменяются в группе и в периоде? Почему?
6. Составьте краткие электронные формулы
химических элементов № 43, 51, 38. Подтвердите свои
предположения описанием строения атомов этих
элементов по приведенному выше алгоритму.
Укажите свойства этих элементов.
7. По кратким электронным формулам
а) …4s24p1;
б) …4d15s2;
в) …3d54s1
определите положение соответствующих
химических элементов в периодической системе
Д.И.Менделеева. Назовите эти химические элементы.
Свои предположения подтвердите описанием
строения атомов этих химических элементов по
алгоритму. Укажите свойства этих химических
элементов.
Продолжение следует
for_efel
Гений
(58692)
15 лет назад
заряда у химического элемента обычно нет, но он бывает в виде иона, например,
Cl{-}
а в основном в виде нейтрального атома.
Если ты, Юля имеешь в виду заряд ядра атома химического элемента, то тогда ответ тебе дла Лана.
Да, Юля, я понял, что ты имела в виду. По номеру группы можно определить положительный или отрицательный заряд химического элемента. Но нужно помнить некоторые правила. Для металлов положительный заряlионов элементов совпадает с номером группы независимо от подгруппы. Для неметаллов чаще всего работает правило:
отрицательный заряд равен разности
“8 минус номер группы”
Сергей Трегубов
Мудрец
(12736)
15 лет назад
Так в ней же написано.
Julia MoiseenkoУченик (199)
15 лет назад
неа… я имею ввиду как определить по номеру группы? т.е по номеру столбца?
Сергей Трегубов
Мудрец
(12736)
Элементы в таблице отсортированы по порядку заряда ядра. Например, первый элемент – водород имеет заряд ядра +1, соответственно имеет один электрон с зарядом -1
for_efelГений (58692)
15 лет назад
И это в своё время (в 1913 г) открыл молодой гений Мозли! Но не успел получить Нобелевскую премию, потому что погиб в 1915 г. в возрасте 27 лет!
Alex
Мастер
(1529)
15 лет назад
Порядковый номер атома равен:
1 Заряду ядра атома
2 Числу электронов в атоме
3 Числу протонов в ядре
for_efelГений (58692)
15 лет назад
у атома нет порядкового номера. Порядковый номер есть только у химического элемента
Alex
Мастер
(1529)
Блин, ну да, сглупил.)
