Как определить заряд атома
Заряд атома, наряду с его квантовыми числами, является одной из важнейших числовых характеристик атома. Знание заряда атома необходимо для решения различных задач электростатики, электродинамики, атомной и ядерной физики.

Вам понадобится
- Знание структуры атома, атомный номер
Инструкция
Атом любого вещества состоит из электронной оболочки и ядра. Ядро состоит из двух типов частиц – нейтронов и протонов. Нейтроны не имеют электрического заряда, то есть электрический заряд нейтронов не равен нулю. Протоны являются положительно заряженными частицами и имеют электрический заряд, равный +1. Количество протонов характеризует атомный номер данного атома..
Электронная оболочка ядра состоит из электронных орбиталей, на которых расположено разное количество электронов. Электрон – отрицательно заряженная элементарная частица. Ее электрический заряд равен -1.
Для того чтобы определить заряд атома, необходимо знать его структуру – количество протонов в ядре и количество электронов в электронной оболочке. Суммарный заряд атома получается в результате алгебраического суммирования зарядов входящих в него протонов и электронов.
Как правило, атом является электронейтральным, то есть количество протонов в нем равно количеству электронов. Заряд такого атома, очевидно, равен нулю. Пример – атом водорода H состоит из одного протона и одного электрона. Q = 1+(-1) = 0 – заряд электронейтрального водорода.
В силу некоторых причин количество протонов и электронов в атоме может не совпадать. В этом случае атом является положительно или отрицательно заряженным ионом. Например, положительный ион натрия имеет 11 протонов и 10 электронов. Его заряд Q = 11+(-10) = 1.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Заряд атома равен нулю, так как в нейтральном атоме число протонов равно числу электронов. Когда атом теряет или приобретает электрон , он становится Ионом. Если атом теряет электрон, он становится положительно заряженным и называется катионом. В то время как при добавлении электрона к атому он становится отрицательно заряженным Ионом , называемым анионом. Энтальпия ионизации – это минимальная энергия, необходимая для удаления наиболее слабо связанного электрона из изолированного газового атома. Энтальпия усиления электронов – это энергия, высвобождаемая при добавлении электрона к атому. Размер аниона всегда будет больше родительского атома, в то время как катион будет меньше родительского атома из-за эффективного ядерного заряда.
Чтобы вычислить заряд Иона ,атомный номер Иона будет равен количеству протонов в нем. Если Ион теряет два электрона, то его заряд равен +2 .Если атом получает электрон, то его заряд равен -1.
Основной структурной единицей веществ атомного строения является атом.
Атом – мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Электронная оболочка – совокупность группирующихся вокруг ядра электронов.
Электрон – одна из элементарных частиц материи, обладающая массой покоя и элементарным отрицательным зарядом.
Когда говорят о массе покоя, то подразумевают, что частица может находиться в состоянии покоя и иметь массу. Существуют частицы, которые не могут находиться в состоянии покоя, например частицы света – фотоны. В этом случае говорят, что фотон не имеет массы покоя.
Заряд электрона называется элементарным, так как это наименьший отрицательный заряд в природе. По этой причине заряд электрона условно принимают равным -1.
Атомное ядро – центральная, положительно заряженная, сложно организованная часть атома, состоящая из нуклонов, связанных между собой ядерными силами.
Нуклоны – общее название двух типов частиц, протонов и нейтронов.
С точки зрения атомной физики протон и нейтрон являются двумя состояниями одной и той же частицы – нуклона.
Нуклон – структурная единица ядра атома, которая может находиться в двух состояниях, протона и нейтрона.
Нуклоны (протоны и нейтроны) состоят из кварков.
Заряд ядра атома соответствует атомному номеру (порядковому номеру) элемента в периодической системе (Z).
Заряд ядра определяется числом протонов, следовательно:
Так как атом – электронейтральная частица, то:
Массовое число (нуклонное число) – сумма числа протонов и нейтронов в ядре данного атома.
Если в условии задания не указано массовое число, то его можно взять из таблицы Д.И. Менделеева, округлив до целой величины относительную атомную массу.
О том, что такое относительная атомная масса мы поговорим чуть позже. Пока не заостряйте на этом внимание. Где её найти в таблице Д.И. Менделеева показано на рисунке ниже.
Для расчета числа нейтронов в ядре используется формула:
Для характеристик частицы (протона, нейтрона, атома) применяют следующую запись:
Определим состав атома хлора. Порядковый номер хлора в таблице Д. И. Менделеева равен 17, следовательно заряд ядра атома хлора равен +17. Если заряд ядра равен +17, то в ядре атома хлора 17 протонов, а в электронной оболочке 17 электронов.
Чтобы определить число нейтронов в ядре атома хлора, округлим до целой величины относительную атомную массу хлора, это значение равно 36. То есть, в ядре атома хлора 36 нуклонов, 17 из них являются протонами, тогда число нейтронов равно 36-17 = 19.
Кратко это можно записать следующим образом:
Атомы отличаются друг от друга радиусом, массой, зарядом ядра, количеством электронов и другими параметрами. Заряд ядра атома – это наиболее важная его характеристика. Поэтому все атомы можно условно разделить на группы (классифицировать) по заряду их ядер. Такие абстрактные группы принято называть химическими элементами.
Химический элемент – вид атомов, с определённым зарядом ядра.
Химический элемент – одно из центральных понятий науки химии.
По предложению шведского химика Й. Берцелиуса химические элементы обозначают начальной или начальной и одной из последующих букв латинского названия элемента (1813 г).
Водород на лат. Hydrogenium (H). Ртуть на лат. Hydrargyrum (Hg) Эти буквенные обозначения называются химическими знаками или химическими символами.
Символ отдельного атома совпадает с символом соответствующего ему химического элемента. К примеру, символ S обозначает химический элемент серу или же один атом этого элемента.
Если требуется обозначить не один, а несколько атомов, то перед символом элемента ставят соответствующую цифру – коэффициент. 5S – пять атомов элемента серы.
Символы и русские названия химических элементов можно найти в таблице Д. И. Менделеева.
Несмотря на то что у ядер атомов одного и того же химического элемента одинаковый заряд, они могут отличаться друг от друга массовым (нуклонным) числом по причине разного количества нейтронов. Такие разновидности ядер атомов одного химического элемента называют изотопами.
Изотопы – ядра с одинаковым зарядом, но разным массовым числом, т.е разным числом нейтронов.
Отметим, что термин изотопы следует употреблять только во множественном числе. В единственном числе следует говорить – нуклид. Что такое нуклиды Вы узнаете чуть позже.
К примеру, химический элемент водород (H) представляет из себя смесь атомов с массовыми числами равными 1 и 2, это изотопы водорода – протий (H) и дейтерий (D). Нуклид водорода с массовым числом 3 в природе не встречается, так как его ядро чрезвычайно нестабильно и очень быстро подвергается ядерному распаду, это так называемый тритий (T).
Запишем состав изотопов водорода, пользуясь описанными выше правилами.
Мы убедились, что изотопы отличаются массовыми числами, а также количеством нейтронов в ядре. Заряд ядер изотопов одинаковый, так как они принадлежат одному химическому элементу.
Содержание изотопов в земной коре разное ввиду их разной стабильности. Чем устойчивее изотоп, тем выше его содержание.
Содержание изотопов элемента Х может быть оценено в массовых или мольных долях.
Доля – отношение части к целому.
Массовая доля (w или w%) – отношение массы части системы к массе всей системы.
О мольной доле мы поговорим позднее в соответствующей теме.
Массовая доля – величина безразмерная, её выражают в долях единицы или процентах. Для вычисления массовой доли применяются формулы:
Изотопный состав элемента водорода может быть представлен следующей схемой:
Задания по теме “Основные сведения о строении атома”
- Ядро атома некоторого элемента содержит 16 нейтронов, а электронная оболочка этого атома – 15 электронов. Назвать элемент, изотопом которого является данный атом. Привести запись его символа с указанием заряда ядра и массового числа.
- Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Указать число протонов и нейтронов в ядре атома и название элемента.
- Укажите число протонов, нейтронов и электронов в атоме циркония.
- Укажите число протонов, нейтронов и электронов в атоме иттрия.
- Укажите число протонов, нейтронов и электронов в атоме индия.
- Укажите число протонов, нейтронов и электронов в атоме кадмия.
- Сколько нейтронов содержит ядро атома 37Cl?
- Сколько нейтронов содержит ядро атома 18O?
- Сколько нейтронов содержит ядро атома 30Si?
- Сколько нейтронов содержит ядро атома 19F?
Возьмём два одинаковых электрометра и один из них зарядим (рис. а). Его заряд соответствует (6) делениям шкалы.
Рис. (1). Электрометры
Если соединить эти электрометры стеклянной палочкой, то никаких изменений не произойдёт. Это подтверждает тот факт, что стекло является диэлектриком. Если же для соединения электрометров использовать металлический стержень А (рис. б), держа его за не проводящую электричество ручку В, то можно заметить, что первоначальный заряд разделится на две равные части: половина заряда перейдёт с первого шара на второй. Теперь заряд каждого электрометра соответствует (3) делениям шкалы. Продолжим опыт. Разъединим электрометры и коснёмся второго шара рукой. От этого он потеряет заряд — разрядится. Соединим его снова с первым шаром, на котором осталась половина первоначального заряда. Оставшийся заряд снова разделится на две равные части, и на первом шаре останется четвёртая часть первоначального заряда. Таким же образом можно получить одну восьмую часть, одну шестнадцатую часть первоначального заряда и т.д.
Возникает вопрос, до каких пор можно уменьшать заряд? Существует ли предел деления электрического заряда? Чтобы выяснить это, понадобилось выполнить более сложные и точные опыты, чем описанный выше, так как очень скоро оставшийся на шаре заряд оказывается столь малым, что обнаружить его при помощи школьного электрометра не удаётся. Более точные опыты показали, что электрический заряд нельзя уменьшать бесконечно: он имеет предел делимости.
Электрический заряд — это физическая величина, которую обозначают буквой (q).
За единицу электрического заряда принят кулон (Кл). Частицу, имеющую самый маленький заряд, назвали электроном. Этот заряд нельзя «снять» с электрона. Заряд электрона обозначают буквой е. Заряд электрона является отрицательным. (e = -0,00000000000000000016) Кл = (-)
1,6
·10
−19
()Кл. Этот заряд в миллиарды раз меньше того, что обычно получают в опытах по электризации тел трением.
Чтобы узнать заряд тела, необходимо заряд электрона умножить на количество зарядов n:
q=e
·n
.
Электрон — очень маленькая частица. Его масса (m =)9,1
·10
−31 кг. Крылышко мухи имеет массу примерно в (5·10²²) большую, чем масса электрона.
Если тело не заряжено и при электризации оно приобрело электроны, то оно зарядится отрицательно. Его заряд будет равен сумме зарядов полученных электронов.
Обрати внимание!
Если тело заряжено отрицательно и при электризации оно ещё приобретает электроны, то отрицательный заряд тела возрастает.
Пример:
Например, до электризации тело с зарядом (2е) в ходе электризации приобретает ещё (4) заряда электрона. Тогда после электризации заряд тела равен (2е + 4е = 6е).
Обрати внимание!
Если тело заряжено отрицательно и при электризации оно теряет электроны, то отрицательный заряд тела уменьшается.
Например, до электризации тело с зарядом (8е) в ходе электризации теряет (3) заряда электрона. Тогда после электризации заряд тела равен (8е – 3е = 5е).
Все вещества состоят из атомов.
Обрати внимание!
Атом состоит из ядра, а вокруг него движутся электроны.
Модель атома можно представить себе следующим образом:
Рис. (2). Модель атома
Обрати внимание!
Ядро тоже имеет свой состав: протоны и нейтроны.
Информация об этих частицах дана в таблице.
|
Частицы |
Обозначение |
Заряд |
Заряд, |
Масса, |
|
Протон |
p |
+1 |
1,6 |
1,7 |
|
Нейтрон |
n |
0 |
(0) |
1,7 |
|
Электрон |
e |
-1 |
(-1,6·10^{-19}) |
9,1 |
Рис. (3). Состав атома
Обрати внимание!
Атом не имеет заряда, т.к. количество электронов в атоме равно количеству протонов.
Количество нейтронов в атомах может быть отлично от количества протонов и электронов.
Атом, потерявший один или несколько электронов, не будет нейтральным, а будет иметь заряд «+». Его называют положительным ионом.
Атом, потерявший один или несколько электронов, называют положительным ионом.
Атом, к которому присоединился электрон, приобретает заряд «-» и становится отрицательным ионом.
Атом, к которому присоединился один или несколько электронов, называется отрицательным ионом.
|
Нейтральный атом |
Отрицательный ион |
Положительный ион |
|
|
|
|
|
Рис. (4). Число протонов и электронов одинаково |
Рис. (5). Число электронов больше числа протонов |
Рис. (6). Число электронов меньше числа протонов |
Узнать, сколько тех или иных частиц содержит нейтральный атом, поможет периодическая система химических элементов (таблица Менделеева). Любой элемент в таблице имеет порядковый номер и относительную атомную массу.
Рис. (7). Обозначение элемента в периодической таблице
Обрати внимание!
Количество протонов, а также электронов в нейтральном атоме всегда совпадает с порядковым номером.
Количество нейтронов равно разности относительной атомной массы (выраженной целым числом) и порядкового номера.
Например:
|
Элемент |
Порядковый номер |
Относительная атомная масса |
Число протонов |
Число электронов |
Число нейтронов |
|
Медь |
29 |
63,546 |
29 |
29 |
64 – 29=35 |
Зная строение атома, можно объяснить электризацию тел.
Обрати внимание!
При трении двух тел электроны переходят с одного тела (где силы притяжения к ядру меньше) на другое (в котором эти силы больше).
Зная строение атома, можно объяснить существование проводников и диэлектриков.
Проводник — это тело, внутри которого содержится достаточное количество свободных электрических зарядов.
Так, в металлах это — электроны, в растворах солей, кислот, щелочей — положительные и отрицательные ионы. Например, когда прикасаются металлической проволокой к отрицательно заряженному электрометру, свободные электроны передвигаются по проволоке, а электрометр разряжается.
Изолятор (или диэлектрик) — тело, не содержащее внутри свободные электрические заряды.
Поэтому прикосновение деревянной линейки к заряженному электрометру не вызывает никаких изменений.
Зная строение атома, можно объяснить явление притяжения ненаэлектризованных тел к наэлектризованным.
Рис. (8). Воздействие положительно заряженной палочки на гильзу
В металлической гильзе есть свободные электроны. Под действием электрического поля палочки они приходят в движение, так как начинают притягиваться к ней. В результате происходит перераспределение заряда. Электроны скапливаются на стороне, которая ближе к палочке, и она заряжается отрицательно. На противоположной стороне недостаток электронов, поэтому она заряжается положительно. Но в целом заряд гильзы равен нулю (в соответствии с законом сохранения заряда).
Рис. (9). Распределение заряда при воздействии на нейтральную гильзу положительно заряженной палочки
Если палочка будет заряжена отрицательно, то свободные электроны будут отталкиваться от неё и перемещаться в противоположную сторону.
Рис. (10). Распределение заряда при воздействии на нейтральную гильзу отрицательно заряженной палочки
По такому же принципу происходит отклонение листочков незаряженного электроскопа при поднесении к нему (не касаясь) заряженной палочки.
Рис. (11). Распределение заряда на электроскопе
Электрическое поле палочки вызывает перераспределение зарядов в металлическом стержне электроскопа. В верхней части будет избыток электронов, а в нижней — недостаток. Поэтому оба листочка зарядятся положительно и оттолкнутся друг от друга.
Источники:
Рис. 1. Электрометры. © ЯКласс.
Рис. 2. Модель атома. © ЯКласс.
Рис. 3. Состав атома. © ЯКласс.
Рис. 4. Число протонов и электронов одинаково. © ЯКласс.
Рис. 5. Число электронов больше числа протонов. © ЯКласс.
Рис. 6. Число электронов меньше числа протонов. © ЯКласс.
Рис. 7. Обозначение элемента в периодической таблице. © ЯКласс.
Рис. 8. Воздействие положительно заряженной палочки на гильзу. © ЯКласс.
Рис. 9. Распределение заряда при воздействии на нейтральную гильзу положительно заряженной палочки. © ЯКласс.
Рис. 10. Распределение заряда при воздействии на нейтральную гильзу отрицательно заряженной палочки. © ЯКласс.
Рис. 11. Распределение заряда на электроскопе. © ЯКласс.
Строение атома
Атом (от греческого atomos – неделимый) — одноядерная, неделимая химическим путем частица химического элемента, носитель свойств вещества. Вещества состоят из атомов. Сам атом состоит из положительно заряженного ядра и отрицательно заряженного электронного облака. В целом атом электронейтрален. Размер атома полностью определяется размером его электронного облака, поскольку размер ядра ничтожно мал по сравнению с размером электронного облака. Ядро состоит из Z положительно заряженных протонов (заряд протона соответствует +1 в условных единицах) и N нейтронов, которые не несут на себе заряда (количество нейтронов может быть равно или чуть больше или меньше, чем протонов). Протоны и нейтроны называют нуклонами, то есть частицами ядра. Таким образом, заряд ядра определятся только количеством протонов и равен порядковому номеру элемента в таблице Менделеева. Положительный заряд ядра компенсируется отрицательно заряженными электронами (заряд электрона -1 в условных единицах), которые формируют электронное облако. Количество электронов равно количеству протонов. Массы протонов и нейтронов равны (соответственно 1 и 1 а.е.м.). Масса атома в основном определяется массой его ядра, поскольку масса электрона примерно в 1836 раз меньше массы протона и нейтрона и в расчётах редко учитывается. Точное количество нейтронов можно узнать по разности между массой атома и количеством протонов (N=A–Z).
Вид атомов какого-либо химического элемента с ядром, состоящим из строго определённого числа протонов (Z) и нейтронов (N), называется нуклидом (это могут быть как разные элементы с одинаковым общим количеством нуклонов (изобары) или нейтронов (изотоны), так и один химический элемент – одно количество протонов, но разное количество нейтронов (изомеры)).
| элементарная частица | заряд (условные единицы) | заряд (Кл) | масса (а.е.м.) | масса (г) |
|---|---|---|---|---|
| протон | +1 | 1,6·10×10-19 | 1 | 1,7·10×10-24 |
| нейтрон | 0 | 0 | 1 | 1,7·10×10-24 |
| электрон | -1 | -1,6·10×10-19 | 0 | 9,1·10×10-28 |
Поскольку в ядре атома сосредоточена практически вся масса, но его размеры ничтожно малы по сравнению с общим объёмом атома, то ядро условно принимается материальной точкой, покоящейся в центре атома, а сам атом рассматривается как система электронов. При химической реакции ядро атома не затрагивается (кроме ядерных реакций), как и внутренние электронные уровни, а участвуют только электроны внешней электронной оболочки. По этой причине необходимо знать свойства электрона и правила формирования электронных оболочек атомов.
Свойства электрона
Перед изучением свойств электрона и правил формирования электронных уровней необходимо затронуть историю формирования представлений о строении атома. Мы не будем рассматривать полную историю становления атомарного строения, а остановимся лишь на самых актуальных и наиболее “верных” представлениях, способных наиболее наглядно показать как располагаются электроны в атоме. Первыми наличие атомов как элементарных составляющих вещества предположили еще древнегреческие философы (если какое-либо тело начать делить пополам, половинку ещё пополам и так далее, то этот процесс не сможет происходить до бесконечности; мы остановимся на частичке, которую уже не сможем поделить, – это и будет атом). После чего история строения атома прошла сложный путь и разные представления, такие как неделимость атома, Томсоновская модель атома и другие. Наиболее близкой оказалась модель атома, предложенная Эрнестом Резерфордом в 1911 году. Он сравнил атом с солнечной системой, где в роли солнца выступало ядро атома, а электроны двигались вокруг него подобно планетам. Размещение электронов на стационарных орбитах было очень важным шагом в понимании строения атома. Однако такая планетарная модель строения атома шла в противоречие с классической механикой. Дело в том, что при движении электрона по орбите он должен был терять потенциальную энергию и в конце концов “упасть” на ядро, и атом должен был прекратить свое существование. Такой парадокс был устранен введением постулатов Нильсом Бором. Согласно этим постулатам, электрон двигался по стационарным орбитам вокруг ядра и при нормальных условиях не поглощал и не испускал энергию. Постулаты показывают, что для описания атома законы классической механики не подходят. Такая модель атома называется моделью Бора-Резерфорда. Продолжением планетарного строения атома является квантово-механическая модель атома, согласно которой мы и будем рассматривать электрон.
Электрон является квазичастицей, проявляя корпускулярно-волновой дуализм: он одновременно является и частицей (корпускула), и волной. К свойствам частицы можно отнести массу электрона и его заряд, а к волновым свойствам – способность к дифракции и интерференции. Связь между волновыми и корпускулярными свойствами электрона отражены в уравнении де Бройля:
где 



Для электрона невозможно рассчитать траекторию его движения, можно говорить только о вероятности нахождения электрона в том или ином месте вокруг ядра. По этой причине говорят не об орбитах движения электрона вокруг ядра, а об орбиталях – пространстве вокруг ядра, в котором вероятность нахождения электрона превышает 95%. Для электрона невозможно одновременно точно измерить и координату, и скорость (принцип неопределённости Гейзенберга).
где 

Чем точнее мы измеряем координату электрона, тем больше погрешность в измерении его скорости, и наоборот: чем точнее мы знаем скорость электрона, тем больше неопределённость в его координате.
Наличие волновых свойств у электрона позволяет применить к нему волновое уравнение Шредингера.

где 


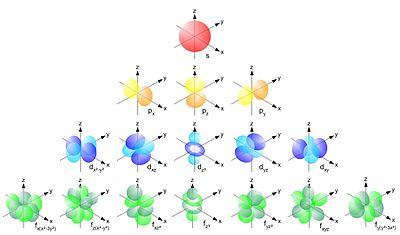
Представленное уравнение написано для одноэлектронной системы. Для систем, содержащих более одного электрона, принцип описания остаётся прежним, но уравнение принимает более сложный вид. Графическим решением уравнения Шредингера является геометрия атомных орбиталей. Так, s-орбиталь имеет форму шара, p-орбиталь – форму восьмерки с “узлом” в начале координат (на ядре, где вероятность обнаружения электрона стремится к нулю).
В рамках современной квантово-механической теории электрон описывается набором квантовых чисел: n, l, ml, s и ms. Согласно принципу Паули в одном атоме не может быть двух электронов с полностью идентичным набором всех квантовых чисел.
Главное квантовое число n определяет энергетический уровень электрона, то есть на каком электронном уровне расположен данный электрон. Главное квантовое число может принимать только целочисленные значения больше 0: n=1;2;3… Максимальное значение n для конкретного атома элемента соответствует номеру периода, в котором расположен элемент в периодической таблице Д. И. Менделеева.
Орбитальное (дополнительное) квантовое число l определяет геометрию электронного облака. Может принимать целочисленные значения от 0 до n-1. Для значений дополнительного квантового числа l применяют буквенное обозначение:
| значение l | 0 | 1 | 2 | 3 | 4 |
|---|---|---|---|---|---|
| буквенное обозначение | s | p | d | f | g |
S-орбиталь имеет форму шара, p-орбиталь – форму восьмерки. Остальные орбитали имеют очень сложную структуру, как, например, представленная на рисунке d-орбиталь.
-
s-орбиталь
-
p-орбиталь
-
d-орбиталь
-
вид орбиталей на разных энергетических уровнях (при разных n)
Электроны по уровням и орбиталям располагаются не хаотично, а по правилу Клечковского, согласно которому заполнение электронов происходит по принципу наименьшей энергии, то есть в порядке возрастания суммы главного и орбитального квантовых чисел n+l. В случае, когда сумма для двух вариантов заполнения одинакова, первоначально заполняется наименьший энергетический уровень (например: при n=3 а l=2 и n=4 а l=1 первоначально заполняться будет уровень 3).
Магнитное квантовое число ml определяет расположение орбитали в пространстве и может принимать целочисленное значение от -l до +l, включая 0. Для s-орбитали возможно только одно значение ml=0. Для p-орбитали – уже три значения -1, 0 и +1, то есть p-орбиталь может располагаться по трём осям координат x, y и z.
Электрон обладает собственным моментом импульса – спином, обозначающимся квантовым числом s. Спин электрона – величина постоянная и равная 1/2. Явление спина можно условно представить как движение вокруг собственной оси. Первоначально спин электрона приравнивали к движению планеты вокруг собственной оси, однако такое сравнение ошибочно. Спин – чисто квантовое явление, не имеющее аналогов в классической механике.