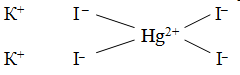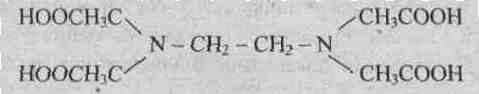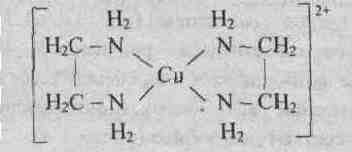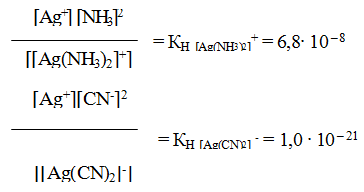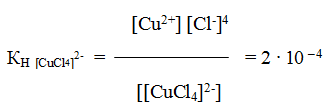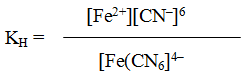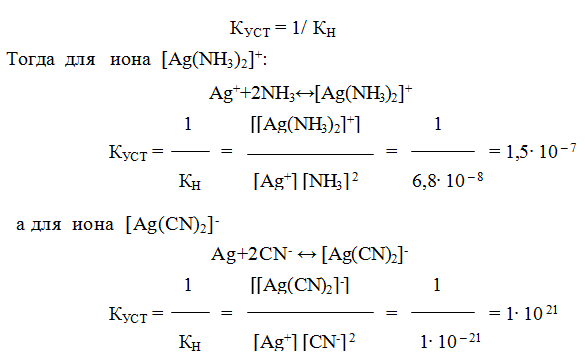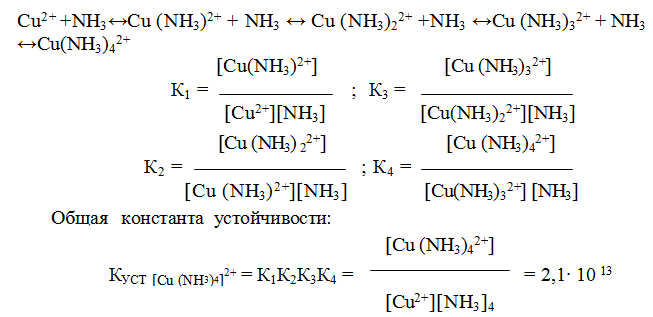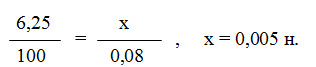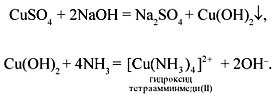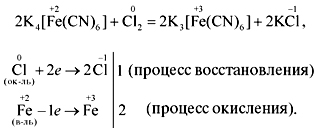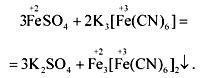Комплексные соединения
Общая химия. Учебное пособие — Таирова А.Р., Кузнецов А.И. — 2005
- 9.1. Определение комплексных соединений
- 9.2. Комплексообразователи
- 9.3.Лиганды
- 9.4. Номенклатура комплексных соединений
- 9.5. Диссоциация комплексных соединений
- 9.6. Константы устойчивости комплексов
- 9.7.Роль комплексных соединений
- 9.8. Комплексонометрия. Жесткость воды
9.1. Определение комплексных соединений. Такие соединения, как оксиды, кислоты, основания, соли образованы из атомов в результате возникновения между ними химической связи. Это соединения обычные, или соединения первого порядка.
Однако имеются вещества, которые образованы в результате соединения друг с другом нейтральных молекул без возникновения новых связующих электронных пар. Например:
K2S04 + A12 (S04)3 = K2S04·AI2 (SО4)3 = 2KA1 (SO4)2
CuSO4 + 5H2O = CuSO4 · 5H2O
CuS04 + 4NH3 = CuSО4·4NH3 = [Cu (NH3)4] SO4
Fe (CN)3 + 3KCN = Fe (CN)3·3KCN = K3 [Fe (CN)6]
HgI2 + 2KI = HgI2·2KI = K2[HgI4]
Это молекулярные соединения, или соединения высшего порядка. Одни из них диссоциируют в водном растворе на простые ноны, например:
КА1 (SО4)2 ↔ K+ + А13+ + 2 SО42 —
другие — на сложные (комплексные) ионы, состоящие, в свою очередь, из более простых ионов, как, например:
К3 [Fe (CN)6] ↔ЗК + + [Fe (CN)6]3-
Молекулярные соединения, образующие комплексные ионы, способные к существованию как в растворе, так и в кристалле, называют комплексными. Но такое определение применимо лишь в известных пределах. Оно не охватывает соединений типа неэлектролитов, например карбонилов металлов —Ni(CO)4 и др., а потому не является и полным.
Чтобы объяснить, почему происходит присоединение одних простых молекул к другим, швейцарский химик А. Вернер ввел понятие о главной и побочной валентности. Тогда образование, скажем, K2[HgI4] можho представить так: ион ртути за счет своей главной валентности (обозначается сплошной линией), равной двум, присоединяет два иодид-иона, а за счет побочной — (обозначается пунктиром) — дополнительно еще два иодид-иона. По Вернеру, это может быть изображено формулой
В настоящее время главную валентность надо объяснить ионной или ковалентной связью, а побочную – ковалентной связью, возникшей по донорно-акцепторному механизму (см. раздел 4.8.2.). Исходя из механизма образования комплексных соединений, им можно дать более точное, не имеющее исключений определение: комплексные соединения – это соединения, характеризующиеся наличием хотя бы одной ковалентной связи, возникшей по донорно-акцепторному механизму.
Комплексообразование происходит во всех случаях, когда из менее сложных систем образуются системы более сложные. Согласно координационной теории А. Вернера в структуре комплексного соединения различают координационную (внутреннюю) сферу, состоящую из центральной частицы – комплексообразователя (ион или атом) – и окружающих ее лигандов (ионы противоположного знака или молекулы). Ионы, находящиеся за пределами координационной сферы, образуют внешнюю сферу комплексного соединения. Число лигандов вокруг комплексообразователя называется его координационным числом. Внутренняя сфера (комплекс) может быть анионом, катионом и не иметь заряда. Например, в комплексном соединении K3[Fe(CN)6] внешняя сфера – 3К+, внутренняя сфера [Fe(CN)6]3-, где Fe3+ — комплексообразователь, a 6CN – лиганды, причем, 6 – координационное число. Таким образом, комплексное соединение (как правило) в узлах кристаллической решетки содержит комплекс, способный к самостоятельному существованию и в растворе.
9.2. Комплексообразователи. Комплексообразователями служат атомы или ионы, имеющие вакантные орбитали. Способность к комплексообразованию возрастает с увеличением заряда иона и уменьшением его размера. К наиболее распространенным комплексообразователям относятся ионы d-элементов VII, VIII, I и II групп периодической таблицы элементов.
9.3.Лиганды. К числу лигандов относятся простые анионы, такие как F— , СI—, Вr—, I—, S2-, сложные анионы, например CN– , NCS – , NO2—) , молекулы, например Н2О, NH3, C. Ионы или отдельные атомы ионов и молекул лигандов имеют неподеленные пары электронов. В зависимости от того, какое число вакантных орбиталей у комплексообразователя занимают лиганды, они подразделяются на монодентантные (одна орбиталь), например NН3, СI—, бидентантные, например N2H4или En, полидентантные, например этилендиаминтетрауксусная кислота (ЕДТА), являющаяся шестидентантным лигандом
Динатриевая соль ЕДТА и сама кислота относятся к классу соединений, называемых комплексонами. Би- и полидентантные лиганды при взаимодействии с комлексообразователями образуют замкнутые циклы, называемые хелатными, поэтому и комплексы с би- и полидентантными лигандами называют хелатными (или клешневидными), например
Пример 1. Определите заряд комплексного иона, координационное число (к.ч.) и степень окисления комплексообразователя в соединениях: a) K4[Fe(CN)6]; б) Na[Ag(NO2)2]; в) K2[MoF8]; г) [Сr(Н2O)2(NН3)3С1]С12.
Решение. Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него. Степень окисления комплексообразователя определяется так же, как степень окисления атома в любом соединении, исходя из того, что сумма степеней окисления всех атомов в молекуле равна нулю. Заряды нейтральных молекул (H2O, NН3) равны нулю. Заряды кислотных остатков определяют из формул соответствующих кислот. Отсюда:
| Заряд иона | К.ч. | Степень окисления | |
| а) | -4 | 6 | +2 |
| б) | -1 | 2 | +1 |
| в) | -2 | 8 | +6 |
| г) | +2 | 6 | +3 |
9.4. Номенклатура комплексных соединений. Название комплексного катиона записывается одним словом, начинающимся с названия отрицательного лиганда с прибавлением буквы «о», затем приводятся нейтральные молекулы и центральный атом с указанием римской цифрой его степени окисления для металлов переменной валентности. Для молекул Н2О (аква), NН3 (аммин), СО (карбонил), NO (нитрозил) даются особые названия, указанные в скобках.
Число лигандов обозначают греческими приставками (ди-, три-, тетра- и т.д.) или бис-, трис-, тетракис-, пентакис- и гексакис- для 2, 3, 4, 5 и 6 соответственно у сложных лигандов. Например, соединение [Zn(NH3)2Cl]CI называется хлорид хлородиамин цинка (II), а [Ni(En)2]Cl2 – хлорид бис(этилендиамин) никеля (II).
Комплексный анион записывается аналогично названию катиона, но с добавлением суффикса -«am» к названию комплексообразователя, например K2[Zn(CN)4] — тетрацианоцинкат (II) калия. Нейтральный комплекс записывается подобно катиону, например комплекс [Ni(CО)4] называется тетракарбонил никеля (II). Соответственно по типу лигандов комплексы называют аквакомплексы (лиганд Н2О), аминокомплексы (лиганд NH3), ацидокомплексы (лиганды анионы кислот), комплексонатные комплексы (лиганды-комплексоны) и т.д.
9.5. Диссоциация комплексных соединений. Комплексные соединения — неэлектролиты в водных растворах диссоциации не подвергаются. У них отсутствует внешняя сфера комплекса, например: [Zn(NH3)2Cl2], [Co(NH3)3(NO3)3], [Pt (NH3)2C12]. В водной среде такие молекулы гидратируются как единое образование.
Комплексные соединения — электролиты при диссоциации в водных растворах образуют комплексные ионы, например:
[Ag (NH3)2] CI ↔[Ag (NH3)2]+ +С1– ; К [Ag (CN)2 ↔K+ + [Ag (CN)2]—
Такая диссоциация протекает полностью, ионы гидратируются. Комплексные ионы в свою очередь подвергаются вторичной диссоциации:
[Ag(NH3)2]+ ↔Ag++2NH3 (a)
[Ag (CN)2] — ↔ Ag+ +2CN— (б)
Однако эта диссоциация обычно протекает в незначительной степени. Применяя закон действующих масс к обратимым процессам (а) и (б), получаем выражения констант нестойкости комплексных ионов:
Константа нестойкости комплексного иона характеризует прочность (устойчивость) внутренней сферы комплексного соединения. В приведенных примерах комплекс [Ag(CN)2]— более прочен, чем
комплекс [Ag(NH3)2]+, так как имеет меньшее значение КН.
Соединения с малоустойчивой внутренней сферой называют двойными солями. Обозначают их иначе, чем комплексные соединения, а именно — как соединения молекул, например K2SO4∙A12(SO4)3. Принципиальной же разницы между двойными солями и комплексными соединениями нет. В растворе двойной соли имеется некоторое количество комплексных ионов (например, [Al (SO4)2]—). Двойная соль отличается от комплексной соли лишь диссоциацией комплексного иона: у первой она практически полная, а у второй — незначительная.
Двойные соли — довольно распространенные соединения. К ним относятся соль Мора (NH4)2SO4∙FeSO4∙6H2O, двойной хлорид калия и меди 2КС1 ∙ СuС12 ∙ 2Н2О и многие другие. Если, например, растворить в воде двойной хлорид, то происходит диссоциация
2КС1∙СuС12∙2Н2О↔2К++Сu2+ + 4С1—+2Н2О
и все образовавшиеся в растворе ионы можно обнаружить с помощью соответствующих реакций. Но если это соединение рассматривать как комплексное, то его формулу надо изобразить как K2[CuС14]∙2H2О. Диссоциация K2[CuС14]∙2H2О протекает по уравнению:
К2 [CuCl4] ∙ 2H2O↔ 2К + + [CuC14]2 — + 2Н2О
и
[CuCl4]2-↔Cu2+ + 4Cl—
Образующийся комплексный ион устойчив только в концентрированных растворах, и его константа нестойкости при комнатной температуре
Сравним значение КН [CuCl4]2- со значением константы нестойкости одного из комплексных ионов меди, например КН[Cu(NH3)4]2+ = 4,6 ∙ 10 – 14. Тогда мы увидим, что КН [CuCl4]2- > КН[Cu(NH3)4]2+ на несколько порядков, а чем меньше константа нестойкости комплекса, тем больше его устойчивость.
Пример 1. Напишите выражение для константы нестойкости комплекса [Fе(СМ)6]4-.
Решение. Если комплексная соль гексацианоферрат (II) калия, являясь сильным электролитом, в водном растворе необратимо диссоциирует на ионы внешней и внутренней сфер
K4[Fe(CN)6] = 4K+ + [Fe(CN)6]4–
то комплексный ион диссоциирует обратимо и в незначительной степени на составляющие его частицы:
[Fe(CN)6]4– ↔ Fe2+ + 6CN–
Обратимый процесс характеризуется своей константой равновесия, которая в данном случае называется константой нестойкости (Кн) комплекса:
Чем меньше KH, тем более прочен данный комплекс.
9.6. Константы устойчивости комплексов. Для характеристики устойчивости (прочности) комплексного иона применяют также величину, обратную константе нестойкости. Ее называют константой устойчивости (КУСТ) или константой образования комплекса. Величины КН и КУСТ взаимосвязаны:
Очевидно, чем выше КУСТ, тем прочнее комплексный ион и тем больше его концентрация при равновесии.
Следует подчеркнуть, что как диссоциация комплексного иона, так и его образование являются процессами обратимыми и протекают ступенчато, как у слабых электролитов. Каждой ступени соответствует определенная величина константы устойчивости — К1, К2 …, Кn. Ион [Ag(NH3)2] + будет иметь две константы устойчивости — K1 и K2:
У иона [Cu(NH3)4]2+ будет четыре константы устойчивости, так как комплексообразователь в четыре стадии присоединяет лиганд NH3
Таким образом, при образовании комплексов в растворе происходит последовательное (стадийное) внедрение лигандов во внутреннюю сферу комплексообразователя с соответствующим отщеплением молекул воды, так как исходный ион Сu2+ был гидратирован (он имел состав [Cu(H2O)4]2+). При диссоциации комплекса [Cu(NH3)4]2+, наоборот, происходит соответствующая замена лигандов на молекулы воды. Поскольку концентрация воды при таких процессах не изменяется, ее не включают в выражение констант устойчивости или констант нестойкости.
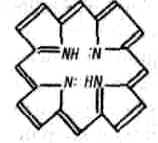
9.7.Роль комплексных соединений. Комплексные соединения широко распространены в природе. В состав многих растений и живых организмов входят соединения с макроциклическими лигандами. В упрощенном виде тетрадентантный макроцикл порфин представлен на рис. 3.3
Рис. 3.3. Структура молекул порфина
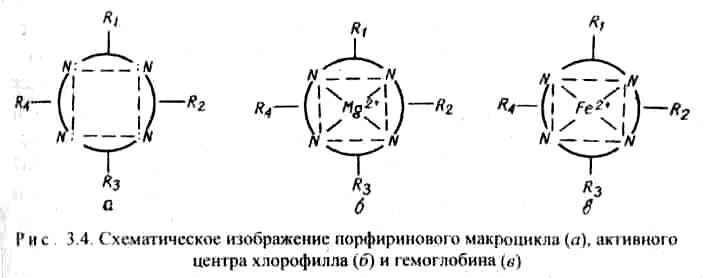
Комплексы с участием порфина называются порфи-ринами. Они отличаются друг от друга центральными ионами-комплексообразователями и заместителями, присоединенными к атомам углерода на периферии лиганда. В наиболее простом виде порфиновый цикл представлен четырьмя атомами азота, соединенными углеродными цепями (рис. 3.3). Кроме того, имеются четыре или более заместителей — радикалов R1, R2, R 3, R4. В зеленом катализаторе фотосинтеза — хлорофилле роль комплексообразователя выполняет магний (рис. 3.4). Макроциклический комплекс железа входит в состав гемоглобина (рис. 3.4).
Железо координирует кислород в комплексе гемоглобина и переносит его по организму с кровью. Связь кислорода с железом в комплексе не очень прочная и поэтому кислород в организме легко реагирует с восстановителями. Недостаток железа в организме приводит к болезни — анемии. Макроциклы крови могут взаимодействовать с каталитическими ядами, например, монооксидом углерода СО, что приводит к отравлению организма.
Сложные лиганды-комплексоны широко используются в энергетике для очистки парогенераторов от накипи, в медицине — для очистки почек от камней, для выведения ядов из организма, таких как Hg2+ Pb2+ Cd2+, в химии — как катализаторы некоторых реакций, например восстановления кислорода, в аналитической химии, в частности, при определении жесткости воды.
9.8. Комплексонометрия. Жесткость воды. Жесткость воды выражается суммой миллиэквивалентов ионов Са2+ и Mg2+, содержащихся в 1 л воды (ммоль/л). Один миллимоль жесткости отвечает содержанию 20,04 мг/л Са2+ или 12,16 мг/л Mg2+.
Пример 1. Вычислите жесткость воды, зная, что в 500 л ее содержится 202,5 г Са(НСО3)2.
Приведенные примеры решают, применяя формулу Ж = m / (mЭ ∙ V)
где: т – масса вещества, обусловливающего жесткость воды или применяемого для устранения жесткости, мг;
mэ, – молярная масса эквивалента этого вещества;
V – объем воды, л.
Решение. В 1 л воды содержится 202,5 : 500 = 0,405 г Са(НСО3)2, что составляет 0,405 : 81 = 0,005 ммоль/л. 81 г/моль — эквивалентная масса Са(НСО3)2. Следовательно, жесткость воды 5ммоль. (Ж = т / (mэV)= 202 500 / (81 • 500) = 5 ммоль. 81 – эквивалентная масса Са(НСО3)2, равная половине его молярной массы).
Пример 2. Сколько граммов CaSO4 содержится в 1 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 4 ммоль?
Решение. Молярная масса CaSO4 136,14 г/моль; молярная масса эквивалента равна 136,14:2 = 68,07 г/моль. В 1 м3 воды жесткостью 4 ммоль содержится 4 · 1000 = 4000 ммоль, или 4000 · 68,07 = 272 280 мг = 272,280 г CaSO4. Из формулы Ж = m / (mэV),m = 468,071000 = 272 280 мг = 272,280 г CaSO4).
Пример 3. Какую массу соды надо добавить к 500 л воды, чтобы устранить ее жесткость, равную 5 ммоль?
Решение. В 500 л воды содержится 500 · 5 = 2500 моль солей, обусловливающих жесткость воды. Для устранения жесткости следует прибавить 2500 · 53 = 132 500 мг = 132,5 г соды (53 г/моль — молярная масса эквивалента Na2CO3).
Пример 4. Вычислите карбонатную жесткость воды, зная, что на титрование 100 см3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см3 0,08 н. раствора НС1.
Решение. Вычисляем молярную концентрацию эквивалентов раствора гидрокарбоната кальция. Обозначив число эквивалентов растворенного вещества в 1 л раствора, через х, составляем пропорцию:
Таким образом, в 1 л исследуемой воды содержится 0,005·1000 = 5 ммоль гидрокарбоната кальция или 5 ммоль Са2+-ионов. Карбонатная жесткость воды 5 ммоль.
3аряд
внутренней сферы комплексного соединения
представляет собой алгебраическую
сумму зарядов образующих ее частиц.
Например,
величина и знак заряда комплекса [Fe
(C
2О4)2]
определяется следующим образом. Заряд
иона железа равен +3, суммарный заряд
двух оксалат ионов – (–4). Следовательно,
заряд комплекса =(+3)+(–4)=–1 и формула
комплекса [Fe(С2О4)2]
—.
Заряд комплексного иона численно равен
суммарному заряду внешней сферы и
противоположен ему по знаку. Например,
заряд внешней сферы К3[Fe(CN)
6]
равен +3. Следовательно, заряд комплексного
иона равен -3.
3аряд
комплексообразователя равен по
величине и противоположен по знаку
алгебраической сумме зарядов всех
остальных частиц комплексного соединения.
Отсюда,
в К3
[Fe(CN)
6]
заряд иона железа равен +3, т.к. суммарный
заряд всех остальных частиц комплексного
соединения равен (+3) + (–6) = –3.
Наиболее
устойчивые и разнообразные комплексы
по составу и выполняемым ими функциям
образуют d–элементы. Особенно большое
значение имеют комплексные соединения
переходных элементов: железа, марганца,
кобальта, меди, цинка и молибдена, которые
выступают в качестве комплексообразователя.
Биогенные s–элементы (Na, К, Mg, Са) образуют
комплексные соединения только с лигандами
определенной циклической структуры,
выступая также в качестве
комплексообразователя. Основная часть
р–элементов (N, Р, S, О) является активной
действующей частью комплексообразующих
частиц (лигандов) в том числе и биолигандов.
В этом состоит их биологическая
значимость.
Следовательно,
способность
к комплексообразованию –
это общее свойство химических элементов
периодической системы Д. И. Менделеева,
эта способность уменьшается в следующем
порядке: f>d>p>>s.
2. Химическая связь в комплексных соединениях и особенности их строения
В
образовании комплексных соединений
важную роль играют донорно – акцепторные
взаимодействия лиганда и центрального
атома. Донором электронной пары, как
правило, является лиганд. Акцептором –
центральный атом, который имеет свободные
орбитали. Связь эта прочна и не разрывается
при растворении комплекса (неионогенна)
и ее называют координационной.
Наряду
с s-связями образуются p-связи по
донорно-акцепторному механизму. При
этом донором служит ион металла отдающий
свои спаренные d-электроны
лиганду, имеющему энергетически выгодные
вакантные орбитами. Такие связи называют
дативными. Они образуются: а) за счет
перекрывания вакантных р-орбиталей
металла с d-орбиталью
металла на которой находятся электроны
не вступившие в s-связь (dp-pp
взаимодействие); б) при перекрывании
вакантных d-орбиталей
лиганда с заполненными d-орбиталями
металла (dp-dp
взаимодействие).
Ионы
d–элементов образуют с биосубстратами
(белками) прочные комплексы. А мягкие
кислоты Cd, Pb, Hg сильно токсичны. Они
образуют прочные комплексы с белками
содержащими R—SH группы,
2R—SH+Hg
2+
®R—S—Hg—S—R+2H+
Цианид–ион
токсичен. Мягкий лиганд активно
взаимодействует с d–металлами в
комплексах с биосубстратами, активируя
последние.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
ИЗ ОПЫТА РАБОТЫ
Для самых смелых
Комплексные соединения
Материал данной статьи
может быть с успехом использован при проведении
уроков как по обычной программе в 10–11-х классах
(повторение и обобщение знаний по неорганической
химии, амфотерность), так и по программе с
углубленным изучением химии для отдельного
тематического занятия.
Все познается в сравнении.
Приступая к изучению вопроса о комплексных
соединениях, вспомним строение атома азота и
молекулы аммиака.
Азот имеет на внешнем электронном слое пять
электронов – одну пару и три неспаренных (рис. 1).
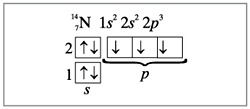 |
Рис. 1.
|
Аммиак: азот затрачивает эти три
неспаренных электрона на образование
ковалентных связей с атомами водорода –
образует с водородом три общие электронные пары.
Собственную неподеленную пару электронов азот
использует на образование донорно-акцепторной
связи, например, с протоном (рис. 2).
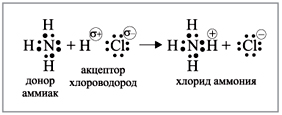 |
Рис. 2.
|
Соединения, образование которых не
связано с возникновением новых электронных пар
(общая электронная пара образовалась за счет
собственной электронной пары одного из
партнеров), называются комплексными.
Создатель теории комплексных соединений, она
называется еще координационной теорией, –
шведский ученый Альфред Вернер. В начале
прошлого столетия наибольший прогресс в этой
области химии достигнут в нашей стране благодаря
Льву Александровичу Чугаеву, который создал
уникальную школу химиков-комплексников.
Рассмотрим комплексное соединение на
конкретном примере: если, получив гидроксид меди,
добавить к осадку раствор аммиака в воде, то
осадок исчезнет, а раствор станет прозрачным и
темно-синим. Это образовалось комплексное
соединение. Запишем уравнения реакций:
Состав комплексного соединения (КС) [Cu(NH3)4](OH)2:
внешняя сфера – два иона ОН–;
внутренняя сфера – ион [Cu(NH3)4]2+;
комплексообразователь (центральный ион,
координатор) – Cu2+;
координационное число (КЧ) (число молекул или
ионов, соединенных непосредственно с
атомом-комплексообразователем) – 4;
лиганды (молекулы или ионы, расположенные около
комплексообразователя) – (NH3).
При написании формул комплексных солей
комплекс заключается в квадратные скобки.
Комплексы могут выполнять роль катионов, анионов
или быть нейтральными молекулами, например:
[Cu(NH3)4]2+ – катион;
[Fe(CN)6]4– – анион;
[Pt(NH3)2Cl4] – нейтральная
молекула.
Заряд комплексного иона равен сумме зарядов
комплексообразователя и лигандов.
Алгебраическая сумма зарядов внутренней и
внешней сферы равна нулю, например, в соединении
Na2[Zn(CN)4]: два иона 2Na+ – внешняя
сфера, ион [Zn(CN)4]2– – внутренняя
сфера, ее заряд складывается из двух
положительных зарядов иона Zn2+ и четырех
отрицательных зарядов четырех ионов CN–,
что в сумме дает минус два.
Образование внутренней сферы комплексов
происходит по донорно-акцепторному механизму.
Комплексообразователь – акцептор,
предоставляющий свободные орбитали. Лиганды –
доноры, предоставляющие свободные пары
электронов. Роль комплексообразователя обычно
выполняют положительно заряженные ионы, имеющие
небольшую величину ионного радиуса. Чаще всего
это катионы d-элементов, хотя известны и
комплексные соединения катионов s-, p- и f-элементов*.
Лигандами, как правило, являются ионы (анионы), к
названию которых прибавляется гласная «о»,
например: ионы F– – фторо, Cl– –
хлоро, I– – йодо, CN– – циано, OH–
– гидроксо, CNS– – роданидо; и нейтральные
молекулы: Н2O – аква, NH3 – амин и др.
Координационное число зависит от радиуса атома
комплексообразователя и его заряда (таблица).
Чем больше радиус комплексообразователя, тем
большее число лигандов может соединиться с ним.
Самостоятельная работа
Составьте комплексные соединения, обозначьте
составные части, заряды ионов.
2AgNO3
…………………….. .
(Ответ. Ag+[Ag+(NO3)2]–.)
Pt+4Cl4•2KCl (КЧ Pt = 6) …………………. . .
(Ответ. [Pt 4+(Cl–)6]2–.)
Таблица
Наиболее частые и возможные (в
скобках) координационные числа
в зависимости от заряда центрального иона
| Примеры соединений |
Заряд комплексообразователя |
КЧ (четное) |
| Na[Au(CN)2] | +1 | 2 |
| [Cu(NH3)4]SO4 | +2 | 4(6) |
| K3[Fe(CN)6] | +3 | 6(4) |
| K4[Mо(CN)8]?2H2O | +4 | 8(6) |
Названия комплексных
соединений
Формула комплексного соединения читается
справа налево. Сначала называется анион (если он
есть): Cl– – хлорид, ОН– – гидроксид,
SO4 – сульфат и т.д. Название комплексного
катиона записывают в одно слово, число лигандов
указывают греческими числительными: 1 – моно, 2
– ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса.
Отрицательные лиганды (анионы) внутренней сферы
в названии приобретают суффикс «о» (см. выше),
затем перечисляют нейтральные лиганды, называют
центральный атом и римской цифрой обозначают его
степень окисления.
В комплексных анионах добавляется суффикс «ат»
к названию комплексообразователя. После
обозначения состава внутренней сферы называют
внешнесферные катионы (если такие имеются).
Cамостоятельная работа
Дайте названия в каждом конкретном примере.
[Al(H2O) 6]Cl3.
(Ответ. Хлорид гексаакваалюминия.)
K2[Pt(Cl)6].
(Ответ. Гексахлороплатинат(IV) калия.)
Na2[Zn(OH)4].
(Ответ. Тетрагидроксоцинкат натрия.)
[Cu(NH3)4](OH).
(Ответ. Гидроксид тетраамминмеди(II).)
NH4Cl.
(Ответ. Хлорид аммония.)
[Ag(NH3)2]Cl.
(Ответ. Хлорид диамминсеребра(I).)
K4[Мо(CN)8]•2H2O.
(Ответ. Дигидрат
октацианомолибдата(IV) калия.)
Свойства комплексных соединений
Свойства КС определяются их составом и
строением. В воде они диссоциируют на внешнюю
сферу и комплексный ион:
K3[Fe(CN)6] 3K+ + [Fe(CN)6]–3.
Важнейшим свойством комплексов в растворах
является их устойчивость. Количественно она
характеризуется константой устойчивости.
Внутренняя сфера комплекса в незначительной
степени подвергается электролитической
диссоциации, распадаясь на
комплексообразователь и лиганды, например:
[Fe(CN)6]3– Fe3+ + 6CN–.
Отношение концентрации недиссоциированного
комплекса к произведению концентраций
комплексообразователя и лигандов называется
константой устойчивости, а обратная ей величина
– константой нестойкости:
Чем больше константа устойчивости и чем меньше
константа нестойкости, тем прочнее комплекс.
Комплексные соли могут вступать в реакции
обмена и в реакции замещения, например:
2CuSO4 + K4[Fe(CN)6] = Cu2[Fe(CN)6] + 2K2SO4,
Zn + 2Na[Au(CN)2] = Na2[Zn(CN)4] + 2Au,
а также в окислительно-восстановительные
реакции:
Таким образом, комплексные соли в растворах
ведут себя так же, как и соли простые.
Объяснение амфотерности гидроксидов
с точки зрения химии комплексных соединений
Согласно протолитической теории амфотерные
соединения способны быть как донорами, так и
акцепторами протона. Типичным примером
амфотерного соединения может служить вода:
Н2О + Н2О Н3О+ + ОН–.
Из гидроксидов наиболее ярко выражены
амфотерные свойства у гидроксида галлия Ga(OH)3,
для которого константы диссоциации в водном
растворе по кислотному и основному типу почти
равны.
Преобладание кислотных или осно’вных свойств у
гидроксидов различных элементов связано с
положением элемента в периодической системе.
Ослабление осно’вных и усиление кислотных
свойств гидроксидов R(OH)n наблюдается с
увеличением поляризующего действия иона Rn+,
т.е.
с уменьшением его радиуса и возрастанием заряда.
Поэтому к сильным основаниям относят гидроксиды
щелочных и щелочно-земельных металлов.
Амфотерные гидроксиды образуют во II группе
периодической системы бериллий и цинк – элемент
II группы, но побочной подгруппы, а в III группе –
алюминий, галлий и индий.
Исследование влияния концентрации ионов Н+
в растворе на свойства различных гидроксидов
показало, что амфотерность обусловлена
устойчивостью гидроксокомплекса данного
металла. Приведем пример – гидроксид цинка
растворяется в кислотах и щелочах:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O,
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4],
или в ионной форме:
Zn(OH)2 + 2H+ = Zn2+ + 2H2O,
Zn(OH)2 + 2ОH– = [Zn(OH)4]2–.
В водном растворе свободные ионы не могут
существовать, они находятся в виде гидратов.
Энергия гидратации велика, и при этом образуются
аквакомплексы постоянного состава. Число
молекул воды обычно равно координационному
числу. Аквакомплексы ведут себя как кислоты.
Например, в водном растворе какой-либо соли цинка
его аквакомплекс диссоциирует:
[Zn(Н2О)4]2+ [Zn(Н2О)3ОН]+ + Н+.
В ряду аква-, аквагидроксо- и гидрокомплексов
цинка (цинк проявляет координационное число 4, а
лигандами являются молекулы воды или ионы ОН–):
[Zn(Н2О)4]2+ [Zn(Н2О)3ОН]+
[Zn(Н2О)2(ОН)2]
L [Zn(Н2О)(ОН)3]–
[Zn(OH)4]2–
каждый последующий член ряда по составу
отличается от предыдущего на один протон. При
переходе каждого предыдущего члена в
последующий первый ведет себя как кислота.
Обратный переход связан с притяжением протона, а
следовательно, с проявлением соединением
основных свойств. Равновесие взаимоперехода
одних комплексов в другие в указанном ряду
смещено вправо в щелочной среде и влево – в
кислой.
Рассмотрим образование аналогичных комплексов
у алюминия. При растворении алюминия в кислоте (в
сильнокислой среде) получается катион в виде
аквакомплекса:
2Al + 6Н+ + 6Н2О = 2[Аl(Н2О)6]3+
+ 3Н2,
При постепенном прибавлении раствора щелочи
происходит замена молекул воды в комплексе на
гидроксильные группы (переход от аквакомплексов
к гидроксокомплексам):
[Al(Н2О)6]3+ + ОН– =
[Al(Н2О)5ОН]2+ + Н2О,
[Al(Н2О)5ОН]2+ + ОН–
= [Al(Н2О)4(ОН)2]+ + Н2О,
[Al(Н2О)4(ОН)2]+ + ОН–
= [Al(Н2О)3(ОН)3] + Н2О.
Нейтральный гидроксид не растворяется в воде и
выпадает в осадок.
При дальнейшем прибавлении раствора щелочи
снова образуются ионы, но уже не катионы, а
анионы, и осадок растворяется:
[Al(Н2О)3(ОН)3] + ОН– =
[Al(Н2О)2(ОН)4]– + Н2О,
[Al(Н2О)2(ОН)4]– +
ОН– = А1[(Н2О)(ОН)5]2– + Н2О,
[Al(Н2О)(ОН)5]2– + ОН–
= [Al(ОН)6]3– + Н2О.
Таким образом, амфотерность трехвалентного
алюминия проявляется в возможности его
существования в водном растворе как в составе
катионов, так и анионов. Состав этих ионов
зависит от кислотности среды. В школьном курсе
химии принято для аниона использовать формулу
[Al(ОН)4]–, где координационное число
алюминия не 6, а 4.
Получение комплексных солей
Комплексные соли получаются в результате
реакций соединения, обмена,
окислительно-восстановительных реакций, а также
при электролизе.
Например:
HgI2 + 2KI (изб.) = K2[HgI4],
CuSO4 + 4NH4OH = [Cu(NH3)4]SO4
+ 4H2O,
ZnCl2 + 4NaOH (изб.) = Na2[Zn(OH)4]
+ 2NaCl.
Применение комплексных соединений
• Гальванические покрытия – защита одного
металла другим. Например, медное покрытие крепко
соединяется с железом, если использовать в
процессе комплексные соединения.
• Электролитическое получение металлов.
Например, алюминий в расплаве криолита образует
комплекс Nа3[AlF6]. Из расплавов
соединений комплексных солей получают такие
металлы, как Nb, Tl, Th, Mg.
• Защита металлов от коррозии. Ингибиторы –
комплексные соли, где лигандами выступают и
органические вещества.
• Аналитическая химия. Многие индикаторы,
реактивы, которые помогают распознать вещества,
ионы и даже заряды ионов, – комплексные
соединения. Катион Fe2+ можно распознать в
реакции с гексацианоферратом(III) калия:
Образуется синий осадок (турнбулева синь).
Катион Fe3+ можно распознать
гексацианоферратом(II) калия:
Образуется темно-синий осадок (берлинская
лазурь).
• Получение металлов. Например золота: золотой
песок растворяется в растворе цианида натрия (NaCN)
в присутствии кислорода и воды, потому что
образуется очень устойчивое комплексное
соединение золота:
4Au + O2 + 2H2O + 8NaCN = 4Na[Au(CN)2]
+ 4NaOH.
Из полученного комплекса золото вытесняют
цинком:
Zn + 2Na[Au(CN)2] = Na2[Zn(CN)4] + 2Au.
Важнейшие органические соединения –
гемоглобин и хлорофилл – тоже соединения
комплексные (схему строения данных соединений
можно посмотреть в книге Л.А.Николаева «Металлы в
живых организмах» и др.) (рис. 3).
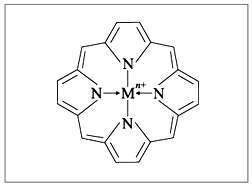 |
Рис. 3.
|
Синтез многих лекарственных
препаратов, витаминов, биодобавок и многих
других веществ связан с комплексными
соединениями.
Л и т е р а т у р а
Гузей Л.С., Суровцева Р.П. Учебник. Химия. 10
класс. М.: Дрофа, 2002; Николаев Л.А. Металлы в
живых организмах. М.: Просвещение, 1983; Глинка Н.Л.
Общая химия. Л.: Химия, Ленингр. отд-ние, 1987; Хомченко
Г.П. Неорганическая химия. М.: Высшая школа, 1978;
Гликина Ф.Б., Ключников Н.Г. Химия комплексных
соединений. М.: Просвещение, 1982; Кукушкин Ю.Н.
Соединения высшего порядка. Л.: Химия. Ленингр.
отд-ние, 1991.
* В химии очень много
исключений. Вот и в комплексных соединениях есть
исключение – ион аммония, в котором
«координатором» является отрицательно
заряженный атом азота. Кроме того, существует еще
целая интересная группа соединений – карбонилы
металлов, в которых и комплексообразователь, и
лиганды (молекулы СО) не заряжены. Например,
карбонил железа
[Fe0(CO)5]0. – Прим. ред.