![]()
Quote
qwertlina :
как определить суммарный заряд пентапептида при рН=7,>7.<7 Глу-Арг-Лиз-Вал-Асп
В нейтральной среде (рН = 7)
Глутаминовая кислота – аминодикарбоновая, значит, у нее появллется отрицательный заряд на группе COO-
Аргинин — диаминокарбоновая кислота, значит, у нее положительный заряд на группе NH3+
Лизин – диаминокарбоновая кислота ———————————————————— NH3+
Валин – моноаминомонокарбоновая кислота – заряда не будет
Аспарагиновая кислота – диаминокарбоновая кислота ———————————————— СОО-
Вывод: (-1) + 1 + 1 + 0 + (-1) = 0
В кислой среде (рН меньше 7) избыток ионов Н+. Он соединится с группами COO- и образуется карбоксильная группа -COOH. Она уже заряда не имеет. На аминогруппу ион водорода не действует. Соответсвенно в случае Глу и Асп будет не +1, а 0.
Вывод: 0 + 1 + 1+ 0 + 0 = 2+
В щелочной среде (рН больше 7) избыток ионов ОН-. Этот ион взаимодйествует с положительно заряженными группами -NH3+, отрывая от нее ион водорода Н+. Псоледний соединяется с ОН- в воду. И остается чистая аминогруппа -NH2. На ней уже заряда не будет. На СОО- группу ион ОН- действия не оказывает. Сооответственно, в случае Арг и Лиз будет не -1, а 0.
Вывод: (-1) + 0 + 0 + 0 + (-1) = 2-
Приглашаю к тесному общению на www.abk-78.lact.ru
Использование Интервального метода
при определении зарядов олигопептидов
на занятиях по биохимии
-
В формировании заряда принимают участие
радикалы следующих аминокислот:-
заряженных положительно (аргинин
(Арг), гистидин (Гис), лизин (Лиз)), -
заряженных отрицательно (аспарагиновая
(Асп) и глутаминовая (Глу)), -
незаряженных полярных (цистеин (Цис)
и тирозин (Тир)). -
концевых α-амино-
(-NH3+) и
карбоксильных (-COO–)
групп олигопептидов.
-
Для этих структур учитываются показатели
константы кислотности pKa
(Табл. 1).
Таблица
1
|
Примерные |
|||
|
положительный |
отрицательный |
||
|
Гис |
6,5 |
-COO– |
2,5 |
|
Асп |
3,9 |
||
|
Лиз |
10,5 |
Глу |
4,1 |
|
-NH3+ |
9,0 |
Цис |
8,2 |
|
Арг |
12,5 |
Тир |
10,1 |
Величины pKa
при этом играют роль критических точек
функции, так как при соответствующих
значениях pH происходит
изменение заряда.
NB: В сильнокислой
среде при pH <
2,5 формируется максимально возможный
положительный заряд, в сильнощелочной,
при pH > 12,5
пептид приобретает максимально возможный
отрицательный заряд.
-
Определение заряда пептида
при всех потенциально возможных
значениях pH.-
проанализируйте пептид, отмечая
структуры, которые могут нести заряд
(Табл. 1), -
Соответствующие величины
pKa расположите
на шкале pH (от 0 до
14). -
Отметьте интервалы и определите
величины зарядов пептида в этих
интервалах,
-
Пример
– пентапептид
глутамил-аргинил-пролил-триптофанил-цистеин
(Рис. 1).
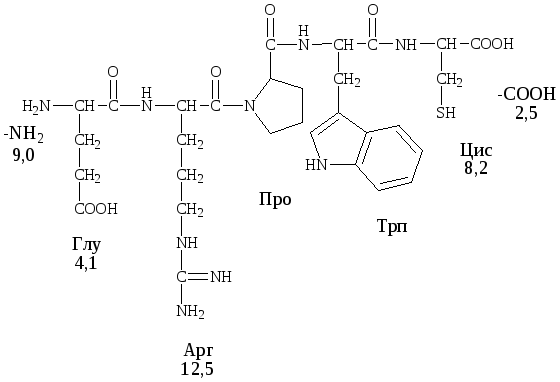
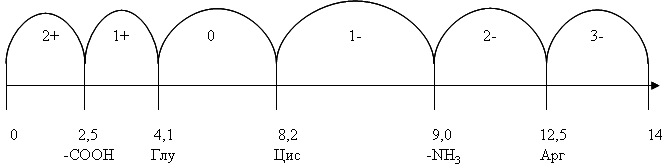
Рис.
1. Определение заряда пентапептида на
шкале pH
с использованием интервального метода
Применение: Различия в заряде
пептидов используется при разделении
смеси пептидов методом электрофореза,
определения направления и скорости
движения пептидов в электрическом поле,
оптимального значения рH
буфера для разделения смеси пептидов
и т.д.). В переваривании белков важна
роль градиента рН соков различных
отделов желудочно-кишечного тракта.
Вопросы:
-
Рассчитайте интервальным методом
заряды следующих пентапептидов:-
Гис-вал-про-тре-трп
-
Иле-лиз-фен-ала-глн
-
Тир-арг-лей-про-асп
-
Фен-глу-мет-трп-лиз
-
Тре-про-цис-тир-арг;
-
-
Белки какого аминокислотного состава
будут лучше набухать в кислом желудочном
соке? -
Почему гистоны прочно фиксируются на
ДНК?
Литература.
-
Кольман Я., Рём К.-Г. Наглядная
биохимия. – М.: Мир, 2000. – 469 с. -
Мецлер Д. Биохимия. Химические
реакции в живой клетке. Т. 1. – М.: Мир,
1980 – 407 с. -
Овчинников Ю. А. Биоорганическая
химия. М.: Просвещение, 1987. – 815 с. -
Тюкавкина Н. А., Бауков Ю. И. Биоорганическая
химия. – М.: Медицина, 1991. – 528 с.
Соседние файлы в предмете Биохимия
- #
- #
- #
- #
- #
- #
Котенька…
Высший разум
(575020)
1 год назад
Поскольку число кислотных групп больше числа основных групп, частица имеет отрицательный заряд и во внешнем поле движется к аноду. При рН>7 диссоциация кислотных групп усилится и пептид ещё быстрее двинется к аноду. При рН<7 диссоциация этих групп подавляется и частица двинется к катоду.
Витя ВарцовУченик (73)
1 год назад
То есть для ph<7 и > 7 нужно составить 2 трипептида?
Котенька…
Высший разум
(575020)
Витя Варцов, нет, во всех случаях речь об одном пептиде
Имея формулу пептида
АСН-АРГ-ЦИС-АСП-МЕТ-ГЛУ
Определите суммарный заряд пептида при Рн 7,0 обозначив заряды всех радикалов
Определите в какой среде лежит изоэлектрическая точка этого пептида (ИЭТ)
Аспарагин, метионин, цистеин не несут суммарного заряда (он равен 0)
Аргинин = +1, ааспаргиновая и глутаминовая в форме аспартата и глутамата несут -1 каждый
В Итоге получили, что суммарный заряд пептида составил -1
Не могу разобраться, правильно ли будет если на вопрос о ИЭТ написать слабокислая среда, исхода из общего суммарного заряда пептида?!!
 ))
))
Изменено 8 Сентября, 2012 в 14:35 пользователем mail-help
Эта тема входит в бесплатную часть моего курса по биохимии.
Белки — это полимерные молекулы, которые состоят из молекул поменьше — мономеров. Этими мономерами будут аминокислоты. Если упростить, то белок — это большой кирпичный дом. Где кирпичики — это аминокислоты. В этой статье мы посмотрим на эти кирпичики: какие они бывают, сколько их и какие у них свойства. Потом соединим аминокислоты вместе — синтезируем пептид. Подробно поговорим о пептидной связи, удерживающей аминокислоты вместе. А в конце небольшой подарок — торсионные углы.
Строение аминокислот
По названию понятно, что в аминокислоте должны быть две вещи: аминогруппа и карбоксильная группа. Аминокислот довольно много, но в белках встречаются только такие:
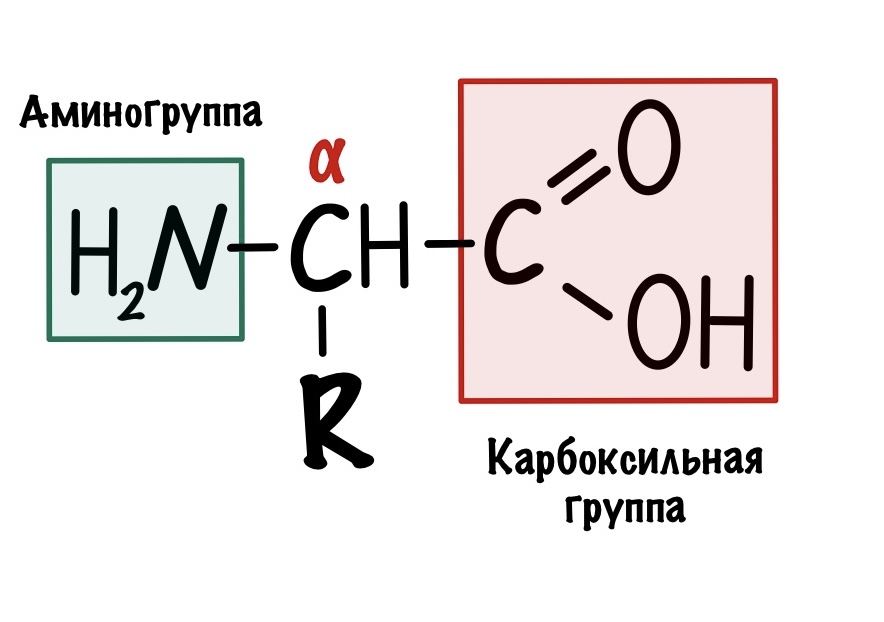
Это альфа-аминокислоты. В них есть центральный атом углерода, который связан с четырьмя заместителями: водородом, аминогруппой, карбоксильной группой и радикалом. Над этим атомом стоит греческая буква — альфа, почему? Это способ нумерации атомов углерода, входящих в органическое соединение. Для нумерации используют буквы греческого алфавита: альфа, бета, гамма, дельта и так далее. Нумерацию начинают с атома углерода, который следует после карбоксильной группы.
Альфа-углерод связан с четырьмя разными заместителями. Ещё разок повторим, что это — водород, аминогруппа, карбоксильная группа и радикал. Такие атомы называются хиральными центрами. Если в молекуле есть хиральный центр, то она хиральна. Что это значит? Это значит, что у молекулы есть изомер — он является её зеркальным отражением. Две этих молекулы будут несопоставимы в пространстве — они разные! Самый простой пример хиральности — левая и правая рука. Руки являются зеркальным отражением друг друга, но у нас не получится идеально сопоставить их в пространстве. Для этого пришлось бы превратить правую руку в левую. Или левую в правую.
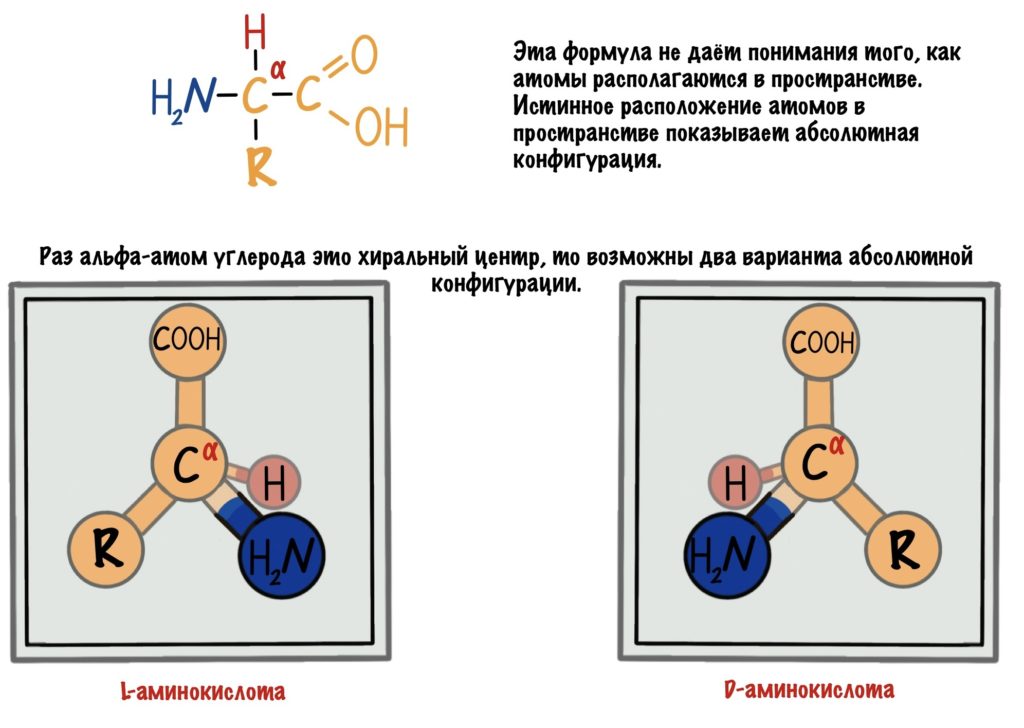
Живые организмы используют и синтезируют только L-аминокислоты.
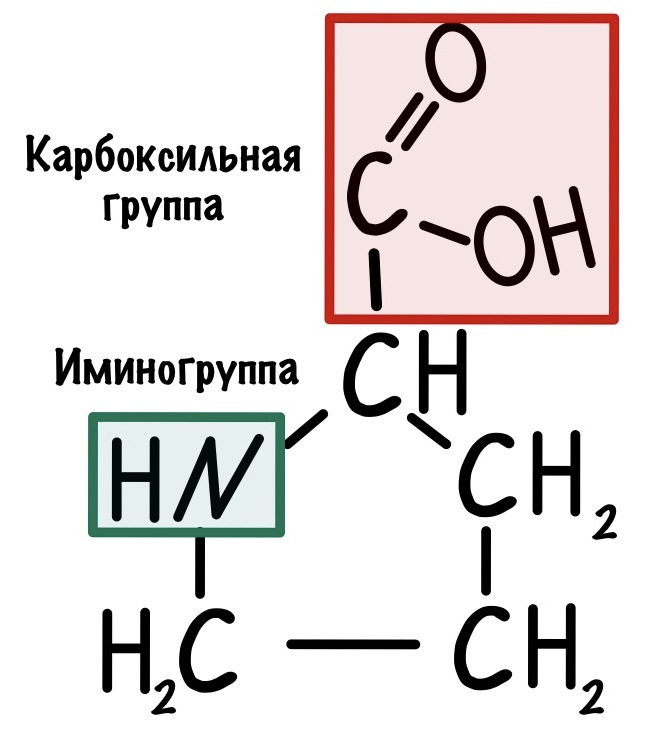
Альфа-аминокислоты будут различаться по своим радикалам. Всего нам нужно запомнить 20 аминокислот. Одна из них будет иметь особое строение — правильнее было бы назвать её иминокислотой. Вот наша легенда — пролин.
Вернемся к различиям между аминокислотами. Есть несколько классификаций радикалов, но мы возьмем самую полезную для нас — по полярности. А если говорить простыми словами, то по растворимости радикала в воде. Радикалы делятся на неполярные и полярные. Первые не растворимы в воде, а вторые растворимы. Когда будем говорить о строении белка, то поймем почему нас интересует именно эта классификация.
Неполярные радикалы аминокислот
У этих ребят нет групп, которые могут образовать водородные связи с водой, поэтому они нерастворимы. Вместо этого у них есть алифатические и ароматические группы. Радикалы выделены фиолетовым цветом.
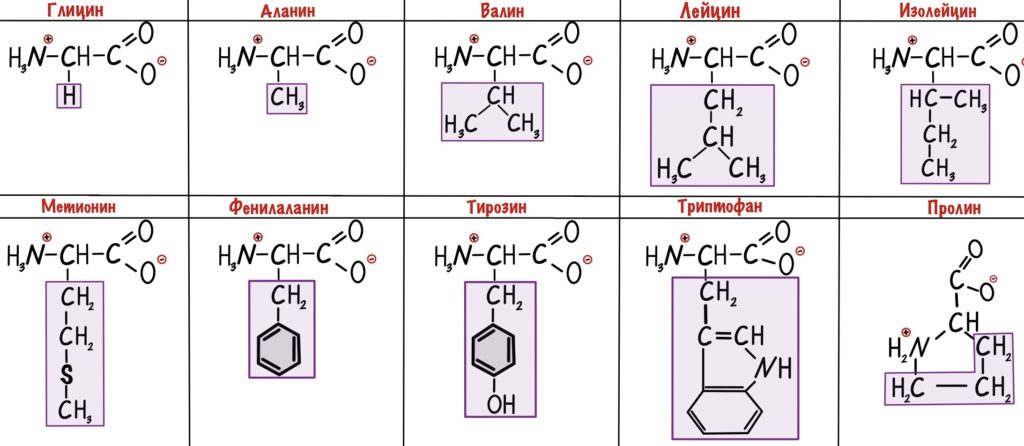
У глицина радикал — атом водорода. Выходит, что у его альфа-атома углерода два одинаковых заместителя — он не является хиральным атомом.
Полярные радикалы аминокислот
Перед этим остановимся на одной вещичке. Я писал формулы аминокислот так, как будто они не находятся в растворе. Но если мы заглянем в клетку, pH в цитоплазме которой 7 и 0, то увидим такую картину.
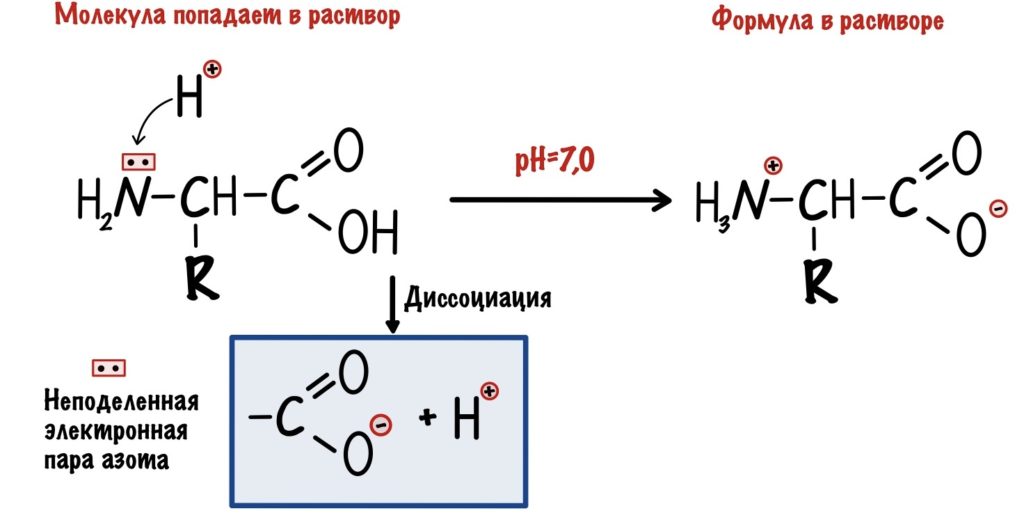
Еще разок, в цитоплазме клетки pH 7,0, то есть в в ней равное количество H+ и OH—. Так как у азота есть неподеленная электронная пара, то он может присоединить протон водорода по донорно-акцепторному механизму. А остаток кислоты диссоциирует с образованием протона. Понятное дело, что радикалы подчиняются таким же правилам.
Полярные радикалы можно разделить на две группы: полярные незаряженные и полярные заряженные.
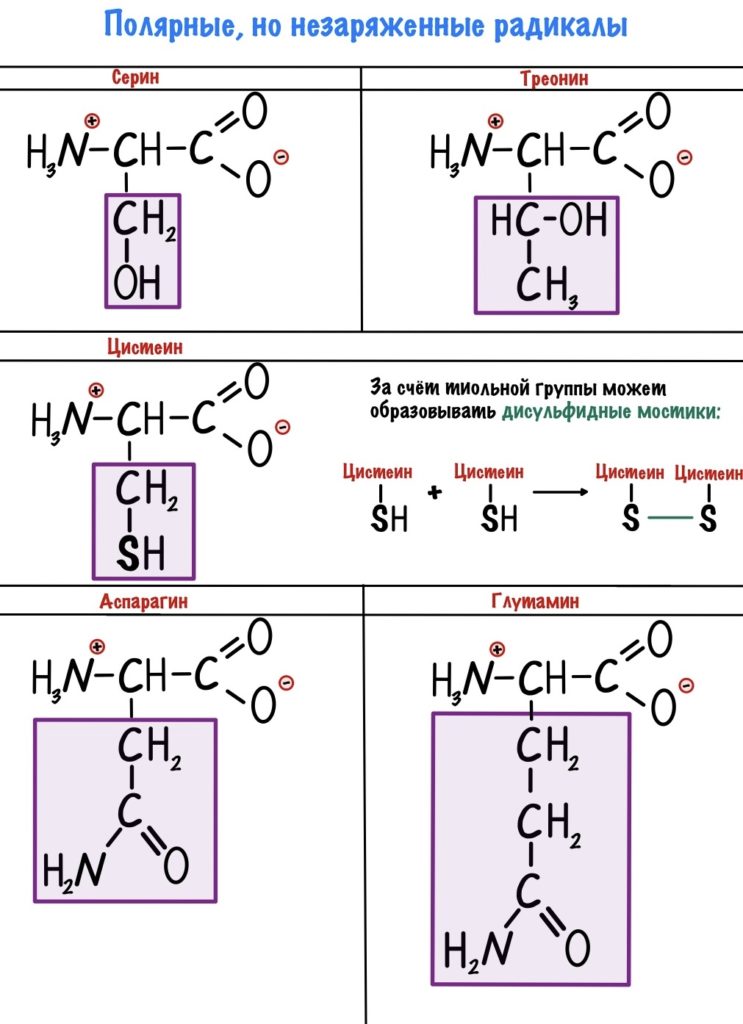
В этих аминокислотах есть сильно электроотрицательные атомы — азот, кислород и сера. С их помощью молекулы образуют водородные связи и растворяются в воде. Но заряда у них нет.
Заряд у радикала может быть положительным или отрицательным, поэтому здесь небольшое деление.
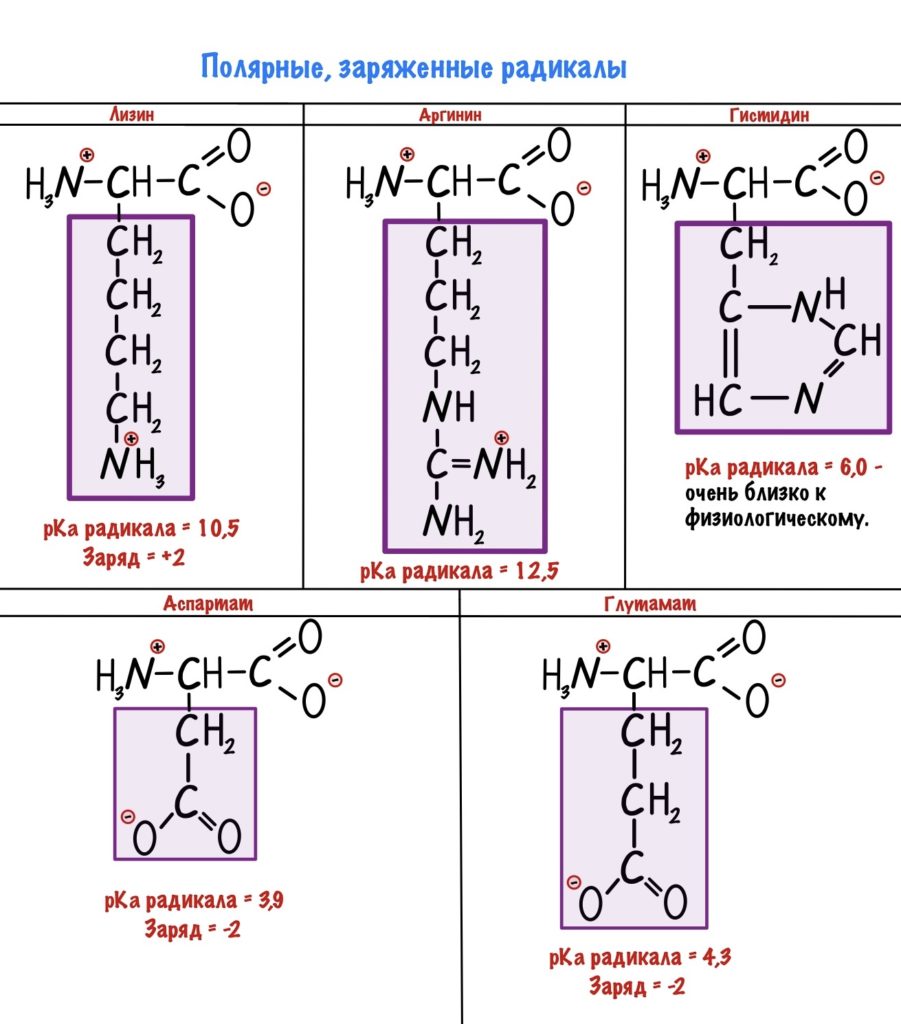
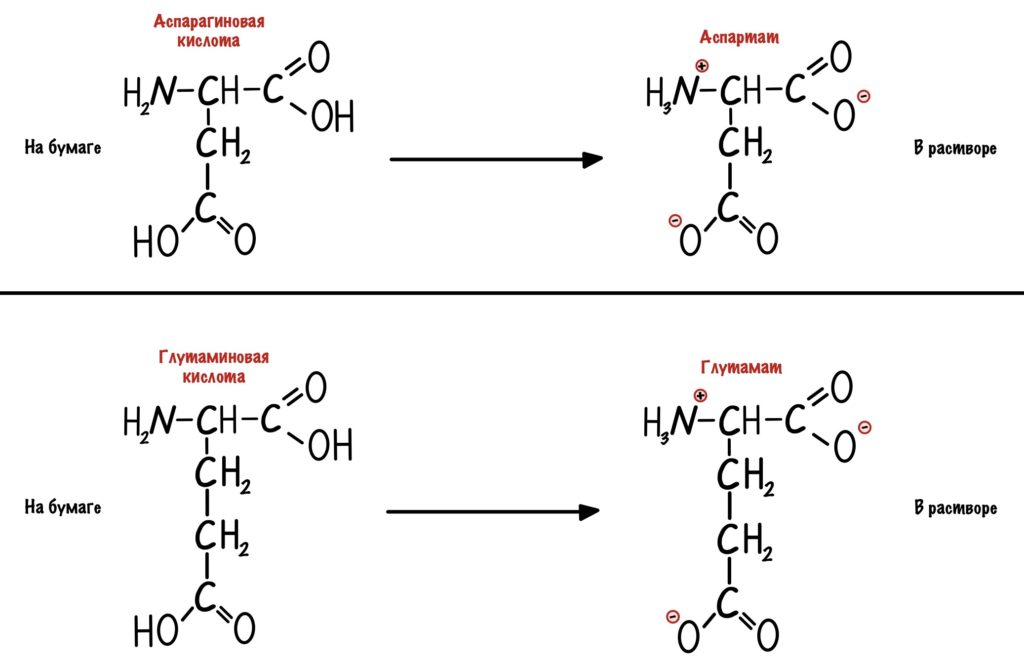
Кстати, лучше растворимы в воде заряженные радикалы. Но разница между полярными заряженными и незаряженными не слишком большая. И еще одно — аспартат и глутамат это название аспарагиновой и глутаминовой кислот в растворе.
Аминокислоты делятся на полярные и неполярные. Полярные аминокислоты могут быть заряженными или незаряженными.
Аминокислоты называли по месту их выделения или физическим свойствам, поэтому у них такие странные названия. Гликос с греческого — сладкий, вот и глицин сладковат. Так что придется зазубрить это.
Изоэлектрическая точка
Вы уже заметили, что у аминокислот есть положительная и отрицательная части. Не так много молекул имеют такую особенность. Так что аминокислоты — это такой гибрид, поэтому их так и назвали — гибридные ионы. Правда на немецком…. А звучит это так: «Цвиттер-ион». Но как всегда есть один нюанс — у гибридного иона общий заряд молекулы равен нулю.
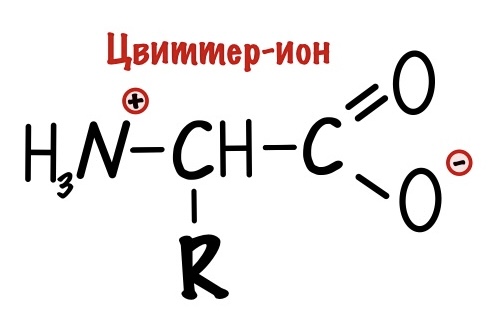
И вы уже смекнули, что не у всех аминокислот будет общий заряд равен нулю. Для неполярных и полярных незаряженных аминокислот это верно, но че делать с заряженными? До этого мы разбирали заряд аминокислот в клетке, то есть при нейтральном pH. Но что будет с ними, если поместить их в другие значения среды, например, в сильнощелочную или кислотную? Аминокислоты будут менять свой заряд и сейчас посмотрим как.
Для начала возьмем что-нибудь простенькое — пусть это будет глицин. Нужно понять, что мы берём раствор — у него будет определённая кислотность среды (pH) равная 7,0. В этом растворе будет множество молекул глицина. Добавляем в этот раствор кислоту. Прямо по капле. Сначала ничего не меняется, но при значении pH=2,34 половина карбоксильных групп глицина присоединит к себе протон водорода. Продолжим уменьшать pH (добавлять кислоту) — всё большее количество глицина присоединяет протон. Что же получается? При снижении pH менее 2,34 большая часть карбоксильных групп глицина присоединит к себе протон. Заряд молекул глицина изменится — теперь он равен +1. Начнем добавлять к этому же раствору щелочь по капле. Дойдем до pH равного 9,6 и от половины аминогрупп глицинов отлетит водород. Заряд молекулы будет -1. Чуть дальше будет хорошая картинка, на которой можно будет проследить за всеми изменениями.
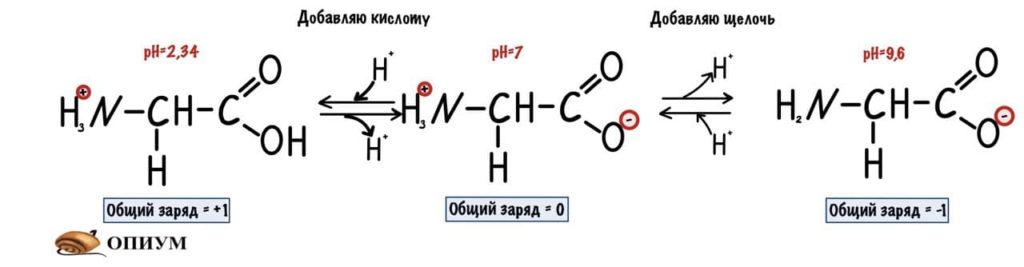
Как же назвать pH при котором происходит переход из одной формы в другую? Очень просто, показатель константы диссоциации или pKa. Константа диссоциации показывает при каком pH среды половина функциональных групп связана с протоном, а другая половина не связана. Получается, что в молекуле глицина pKa карбоксильной группы = 2,34, а pKa аминогруппы = 9,6. Я написал про молекулу глицина, потому что в остальных аминокислотах значения немного отличаются.
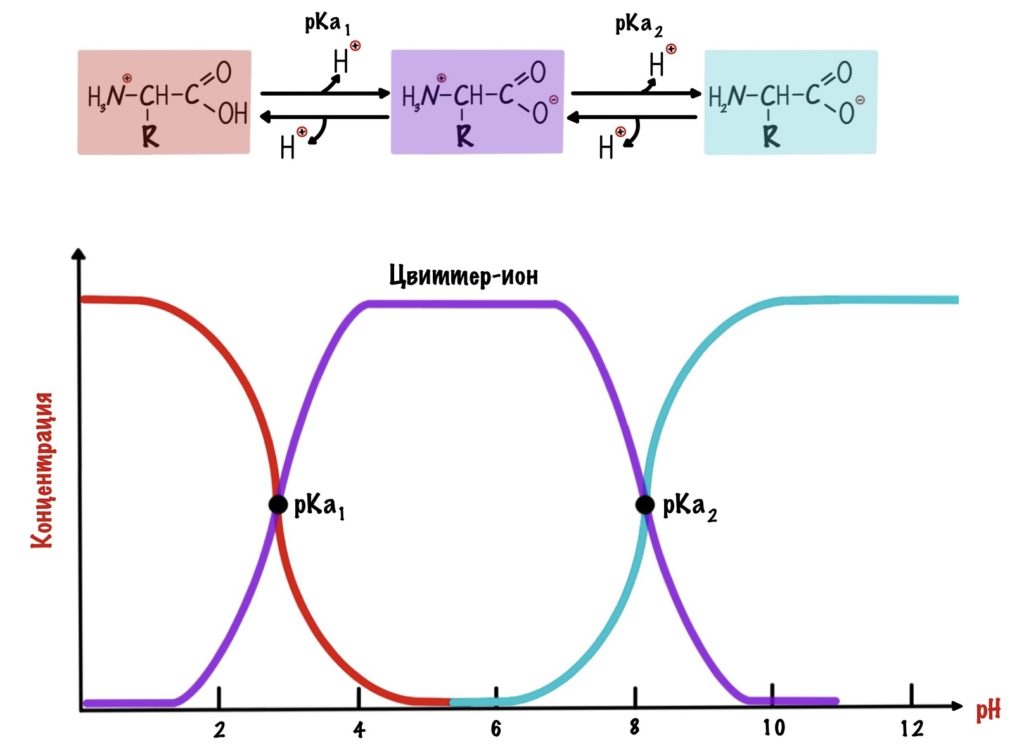
А теперь о том, ради чего все это затевалось — изоэлектрическая точка.
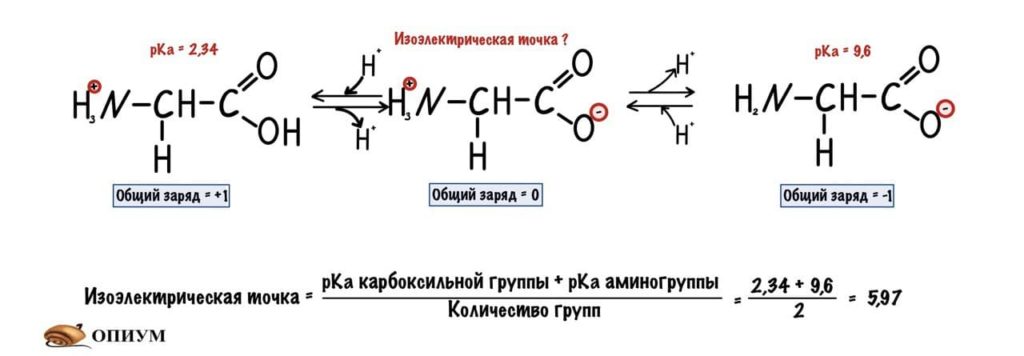
Изоэлектрическая точка — это pH среды, при которой заряд молекулы равен нулю. Да, вот так вот просто. Ее, кстати, можно посчитать — для этого нужно сложить pKa двух ближних функциональных групп и поделить на их количество. А их количество — две.
Сделаем тоже самое с молекулами посложнее, начнем с гистидина.
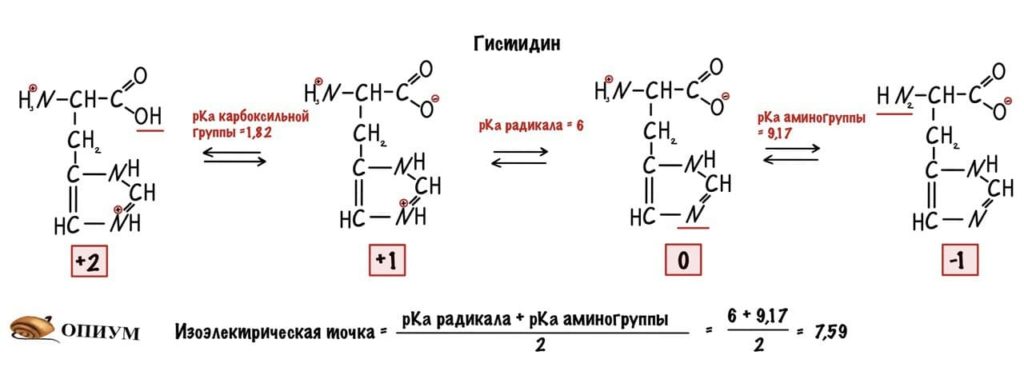
У гистидина есть заряженная группа, поэтому у него побольше вариантов заряда, чем у глицина. Мы видим, что у гистидина карбоксильная группа присоединяет водород при pH =1,82, а аминогруппа отдает протон водорода при pH=9,17. Вот про эти отличия я и говорил до этого, но так-то они не слишком большие. Радикал же отдает протон водорода при pH=6.
Сделаем тоже самое с глутаматом.
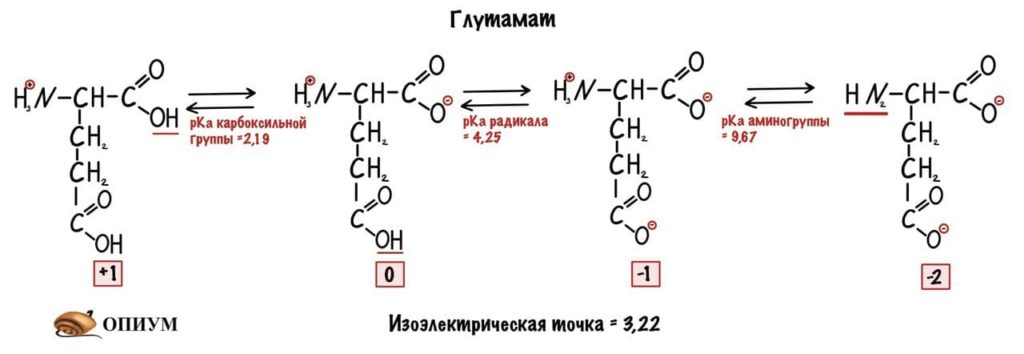
Думаю, что смысл понятен. У каждой аминокислоты своя собственная изоэлектрическая точка. Точки уже давно подсчитаны — достаточно найти их в интернете.
Сделаем красивый вывод:
Любая аминокислота цвиттер-ион, но только в изоэлектрической точке
Зачем это нужно? Ну давайте посмотрим. Мы знаем, что каждая аминокислота несет определенный заряд, но этот заряд меняется от pH среды. Если мы поместим аминокислоты в нейтральную среду и закинем туда катод и анод, то положительно заряженные аминокислоты направятся к аноду, а отрицательные к катоду. Остальные аминокислоты можно будет разделить с помощью изменения pH среды, ведь в изоэлектрической точке у аминокислоты не будет заряда. Нет заряда — нет движения к катоду или аноду, аминокислота стоит на месте. Вот мы и разделили аминокислоты в растворе, можно их изучить.
Образование пептидов
Теперь давайте соединим между собой парочку аминокислот, пусть это будет глицин и аланин. Соединяем их с помощью реакции дегидратации — отщепляем молекулу воды и получаем пептид.
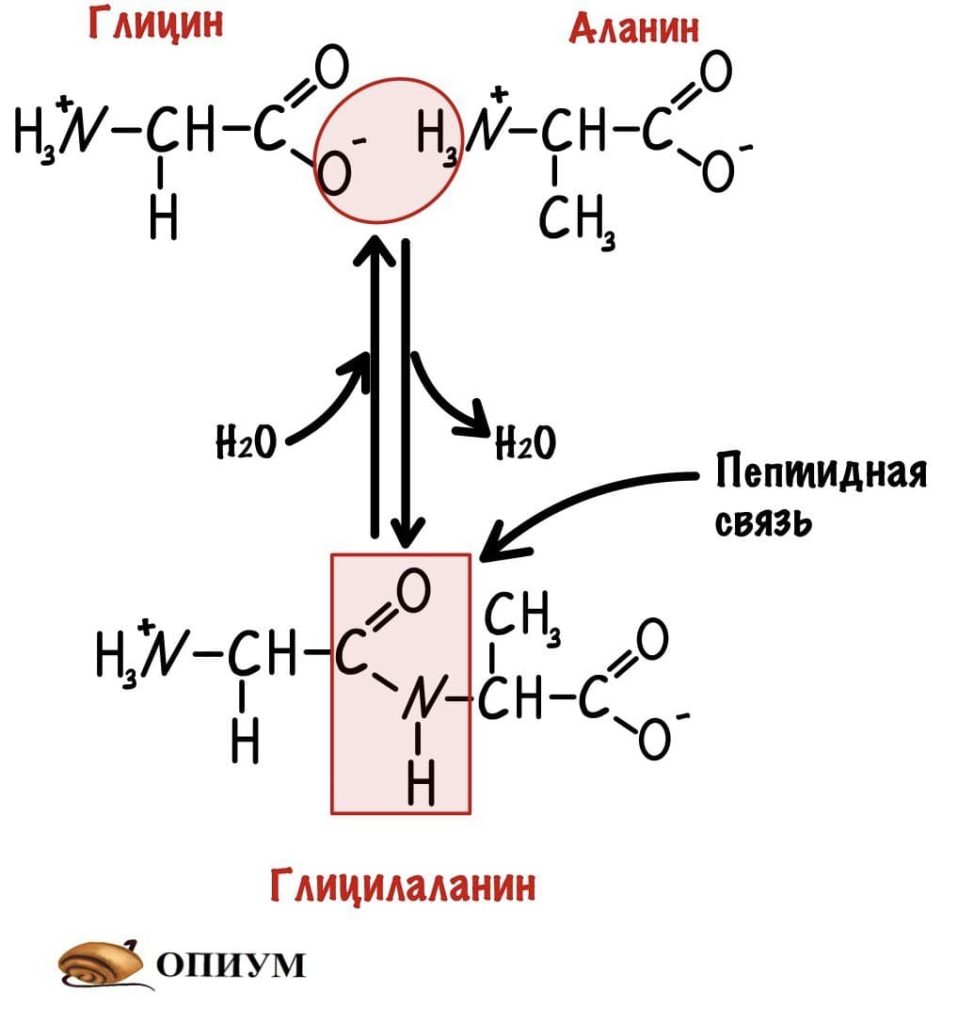
Какие группы вступали в реакцию? Да, аминогруппа и карбоксильная группа. Получается, что пептидная связь — это связь между аминогруппой одной аминокислоты с карбоксильной группой другой аминокислоты. Так как соединены две аминокислоты, то название молекулы — дипептид. Ничего не мешает мне присоединить еще одну.
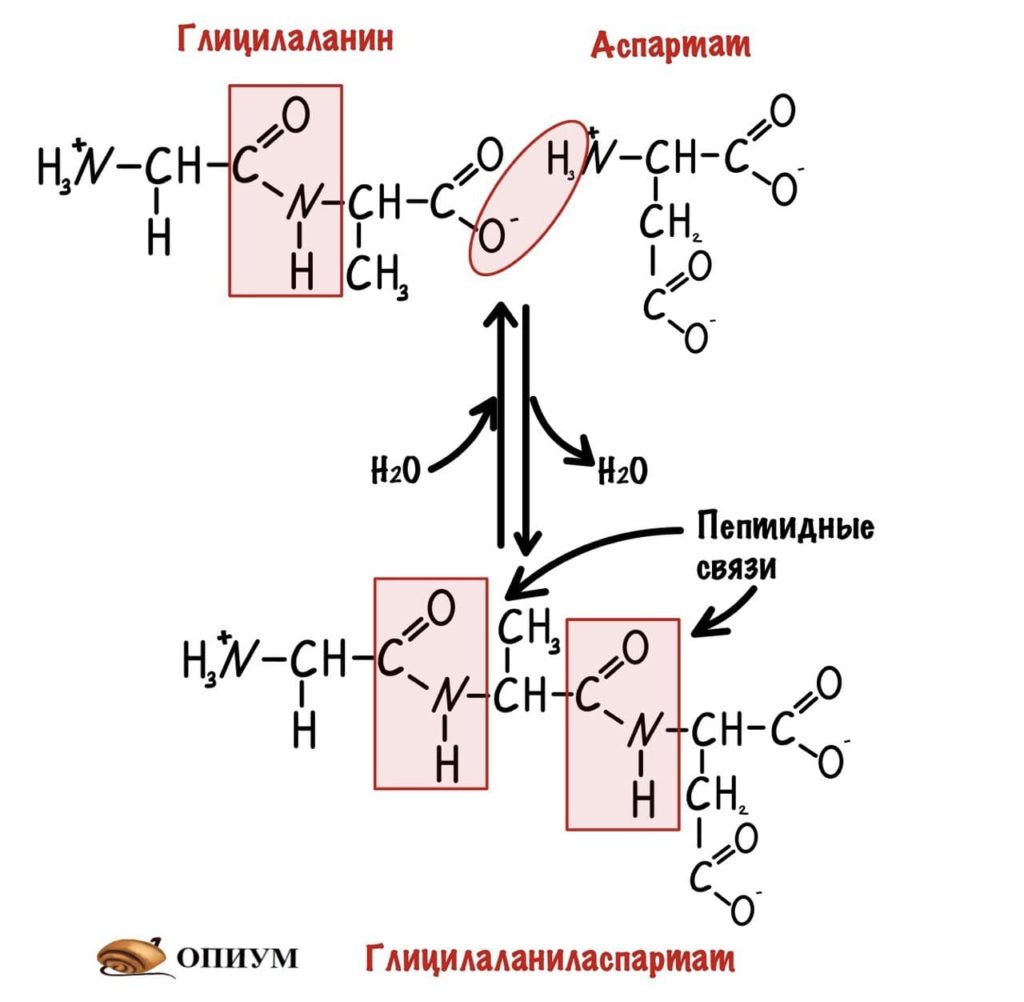
И это уже трипептид. Если соединены до 10 пептидов, то это олигопептид. От 10 до 50 — полипептид, ну а если больше 50, то это белок. Как видите реакция обратима, можно провести гидратацию по пептидной связи и пептид разрушится. На самом деле реакция гидратации идет намного лучше, а вот для дегидратации нужен источник энергии — АТФ, и рибосомальная РНК. Так что для синтеза пептидов/белков организм неплохо так тратится.
Ну и вы заметили, что я располагаю радикалы с разных сторон — то сверху, а то снизу. Это транс положение, оно более устойчиво, но можете писать как хотите.
Белок — это пептид, который содержит более 50 остатков аминокислот
Пептидная связь
У пептидной связи есть свои секретики, но мы не дадим ей хранить их просто так. Главный секрет в том, что двойная связь находится не у кислорода, а у азота… Хотя это не совсем двойная связь, но близка к ней. Как же это происходит? У азота есть неподеленная электронная пара, электроны могут перейти от азота к кислороду, а двойная связь перейдет от кислорода к азоту — неплохой такой обменчик. Это явление называется резонанс пептидной связи, именно из-за него во всех учебниках пишут про «частично-двойной характер пептидной связи».
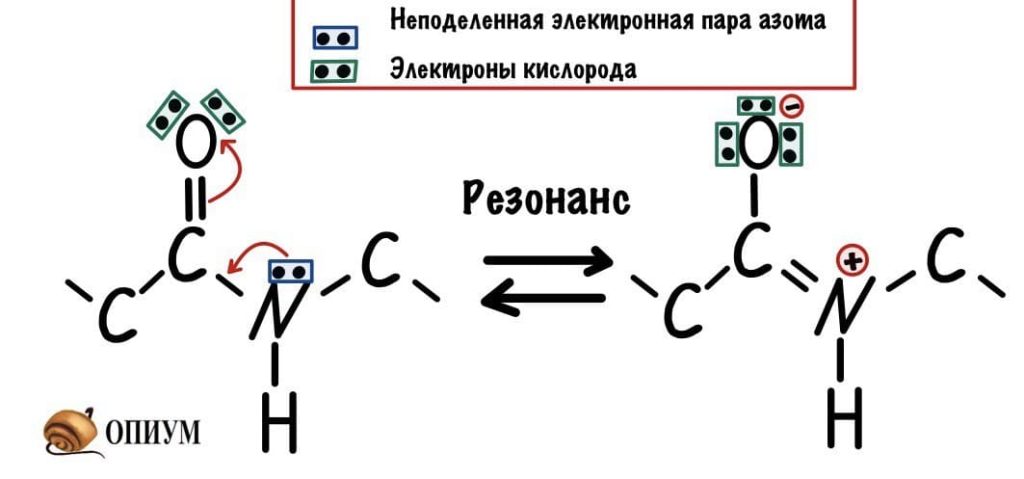
Пойдем еще немного дальше, о чем нам говорит двойная связь? Правильно, о гибридизации углерода — она здесь sp2. А значит угол между связями углерода 120 градусов, здесь они не прямо 120 градусов, но близки к этому. Идем дальше. Азот здесь тоже в sp2 гибридизации, понятно какие углы и у него. Но к чему я это все? Ах да, как будет выглядеть молекула?
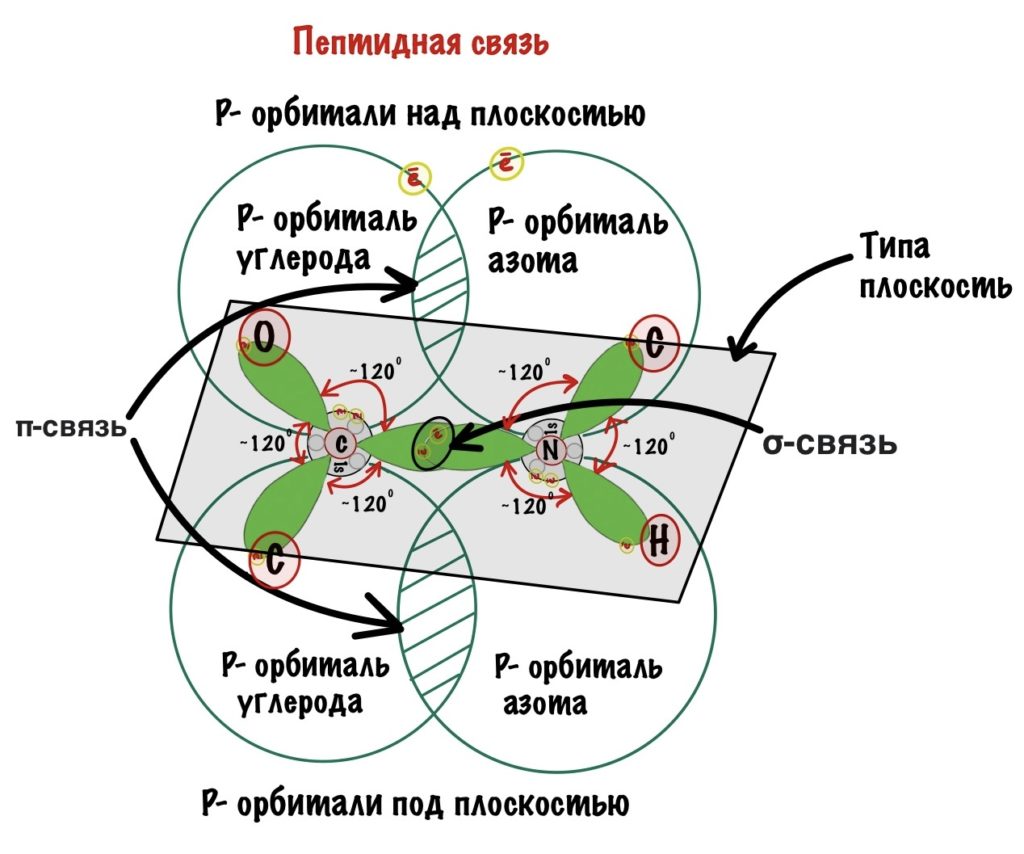
Так как все углы по 120 градусов, то все 6 атомов — 3 углерода, азот, водород и кислород, лежат в одной плоскости, как будто на ладошке. За счет того, что углерод и азот образуют две связи — одну пи и одну сигму, вращение вокруг этих связей практически невозможно. Но об этом чуть позже, сейчас давайте упростим эту схему.
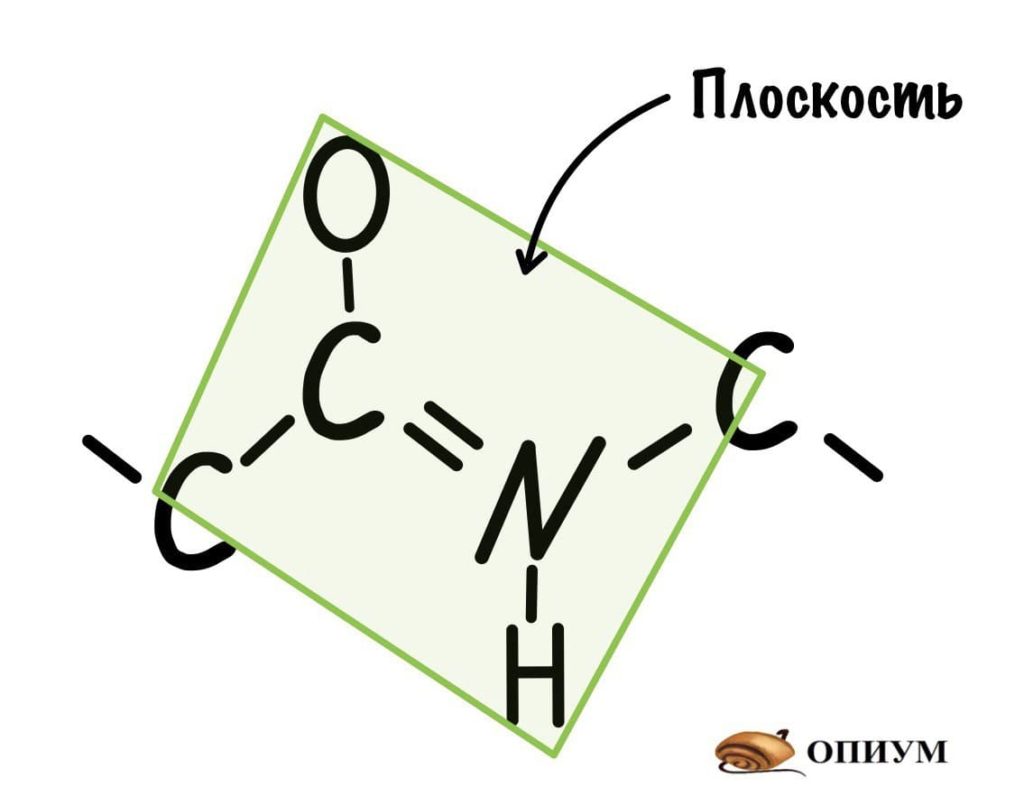
Это мы сделали только с одной пептидной связью, но что если добавить вторую? Получится кое что интересненькое…
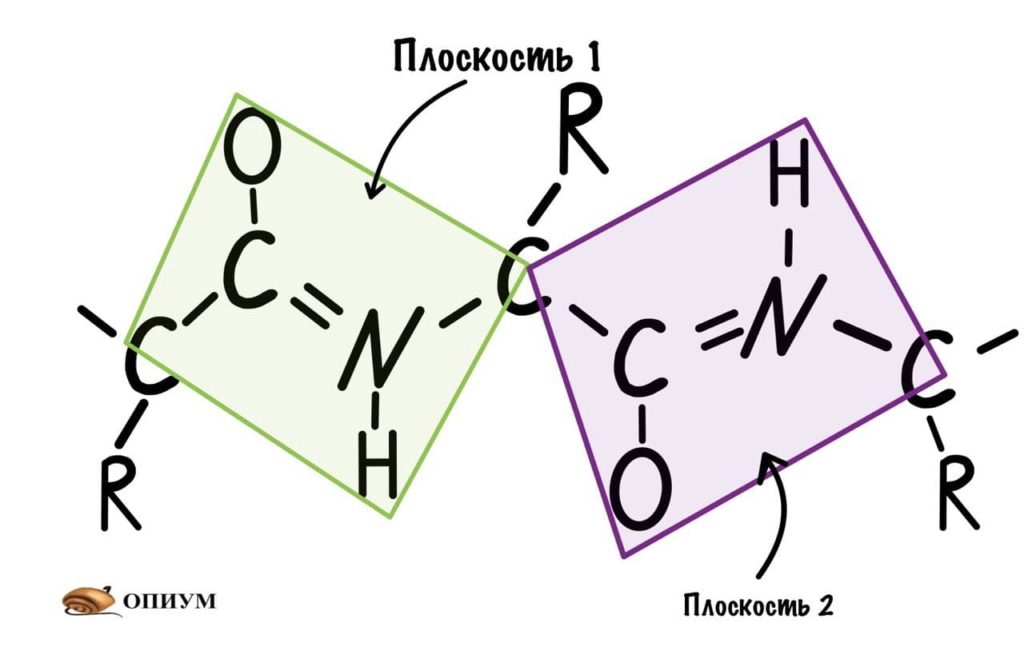
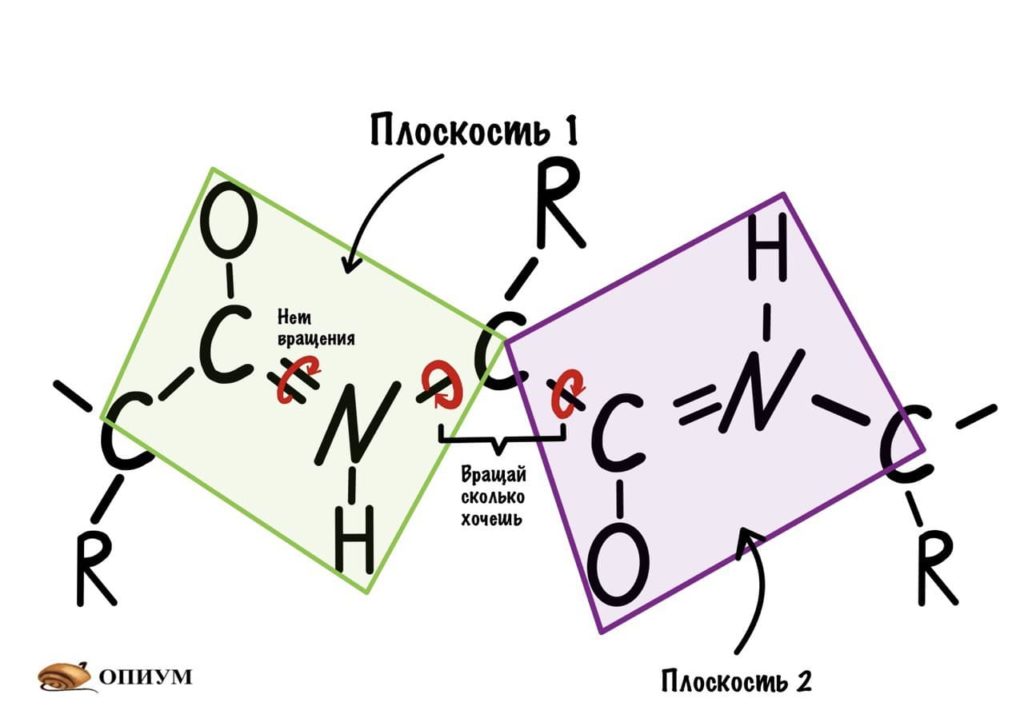
Следующая пептидная связь такая же, как и предыдущая. Получается, что опять 6 атомов лежат в одной плоскости, вы видите, что один атом углерода принадлежит сразу к двум плоскостям и это удивительно! Можно даже подумать, что все эти пептидные связи будут лежать в одной и той же плоскости, но это не так, а виной этому — вращение вокруг связей.
Диэдральные или торсионные углы
Название пугающее, но сейчас как устроим этим углам! Так, мы уже говорили о том, что вокруг пептидной связи не повращаться из-за того, что она частично двойная. Но ведь есть и другие связи, вокруг которых можно устроить веселуху.
Понимаю, что представить это не так уж и легко, но можно попробовать сделать! Получится конечно не совсем так, но принцип поймем. Возьмем ручку и два колпачка, засунем бумажку под каждый колпачок и начнем крутить. Условимся, что мои пальцы — альфа-углеродный атом, то есть место пересечения двух плоскостей.



Теперь мы поняли, как происходит вращение, но это еще не все. Существуют определенные углы между плоскостями и всего их два. Представьте, что нам захочется найти угол между углеродами, у которых карбоксильная группа, двух плоскостей. Или угол между двумя атомами азота, опять же, двух разных плоскостей. Задачка кажется сложной… Но перед этим, а зачем я вообще мучаю вас этим? Дело в том, что когда мы дойдем до конформации белковых молекул, то благодаря этим углам мы поймем: как и почему образуется альфа-спираль, тоже самое с бета-складчатостью. Так что потерпите немного!
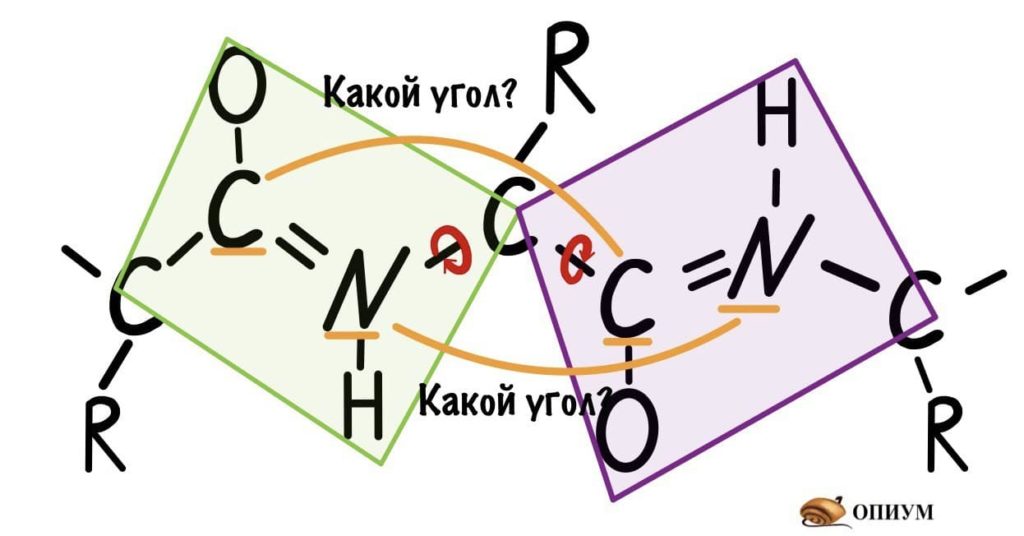
Если посмотреть на эту схему, то можно кое-что прикинуть: если мы будем вращать связь между N и C, то углерод с карбоксильной группой изменит положение относительно углерода другой плоскости, а вот азот останется на том же месте — угол между двумя азотами не изменится. А вот если начнем вращать связь между C и C, то все будет наоборот: угол между азотами изменится, но вот углероды с карбоксильной группой останутся на месте. Сложновато, но чуть дальше я дам пространственную картинку. Пока что мы пришли к выводу, что связь между N и C влияет на угол между углеродами — этот угол называется фи. А вот связь между C и C влияет на угол между атомами азота — угол пси.
Теперь можно и добавить атомы водорода в схему, они скоро нам понадобятся.
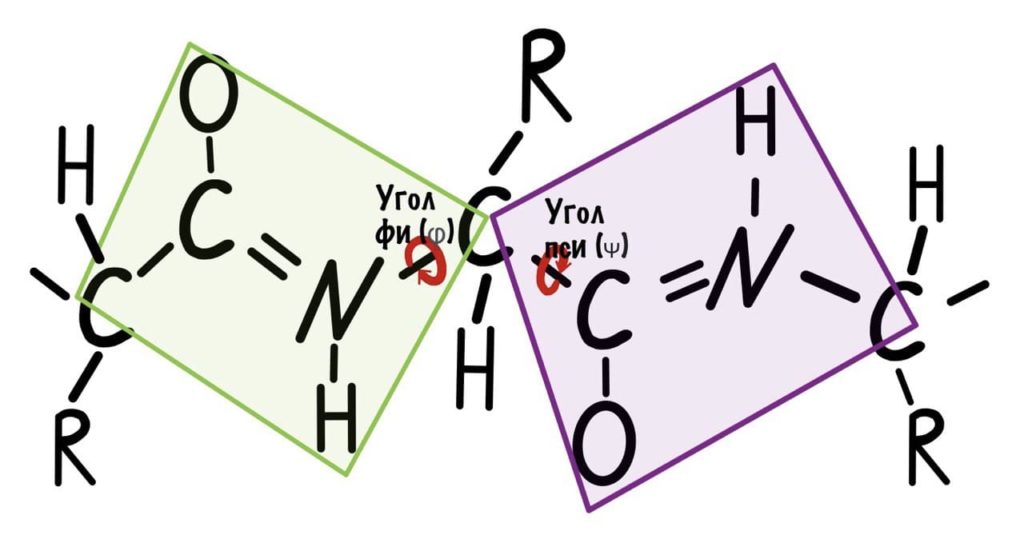
Добавим реалистичности, центральным радикалом у нас будет -CH3, а остальные радикалы уберем.
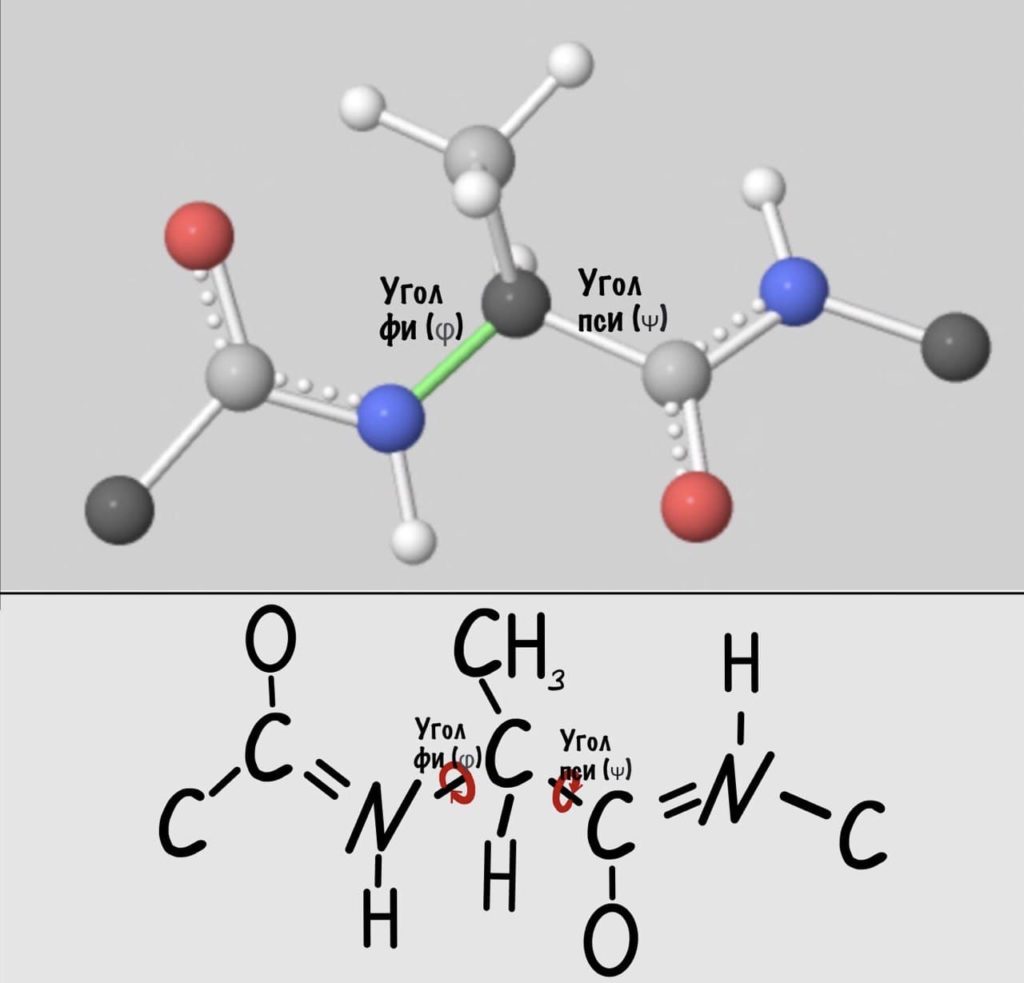
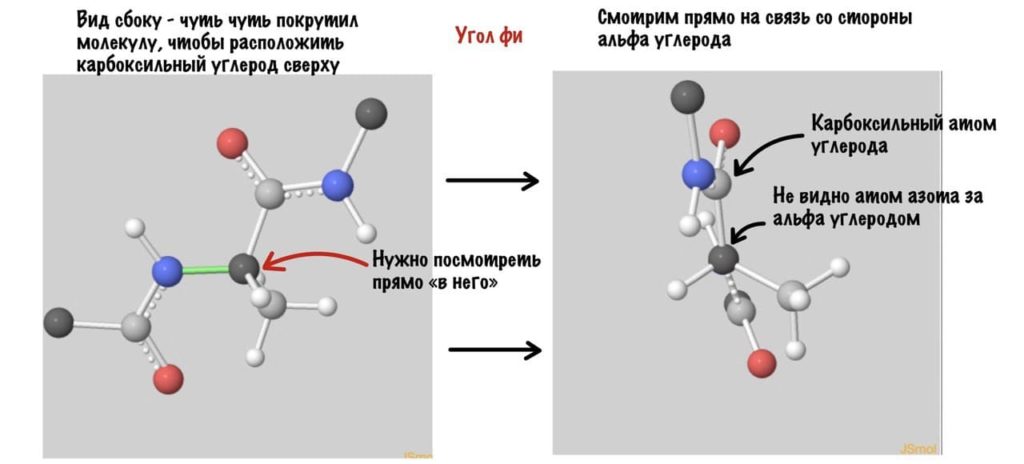
А теперь главный вопрос — как измерить эти углы? Хорошо, что уже это придумали… И мы можем сделать это вместе — заходите сюда и поехали! Первым делом нам нужно перевернуть молекулу так, чтобы расположить атом углерода с карбоксильной группой сверху. Зачем такие выкрутасы? Расскажу позже. А теперь посмотрим прямо в альфа атом углерода, да так что за ним спрятался азот. Как-то это странно звучит, но давайте попробуем.
Еще это можно посмотреть графически с помощью проекций Ньюмана.
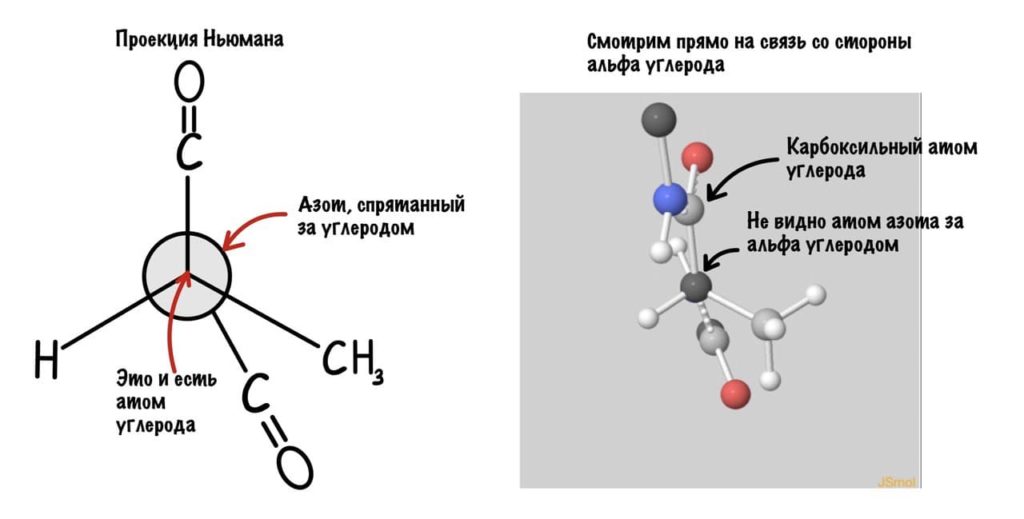
Так, повторим что такое угол фи — это угол между двумя карбоксильными атомами углерода. На рисунке уже их видно.
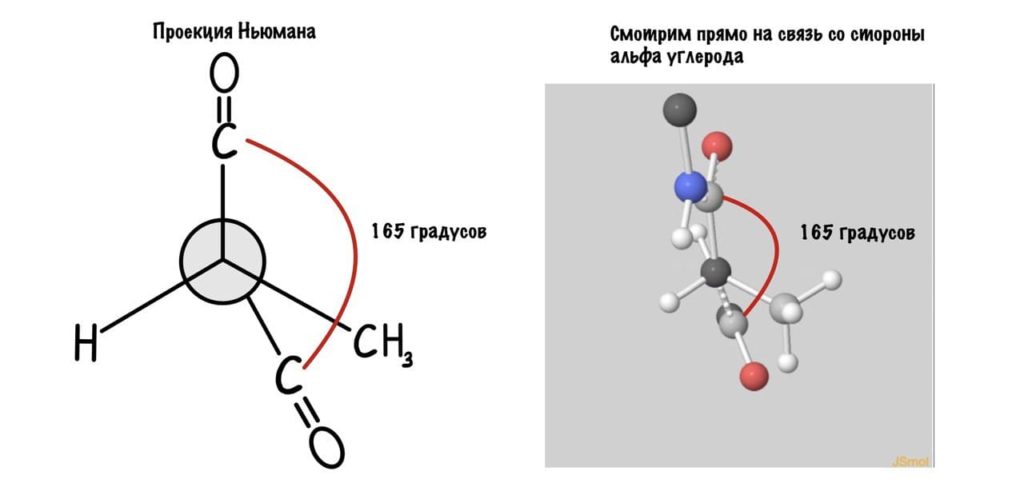
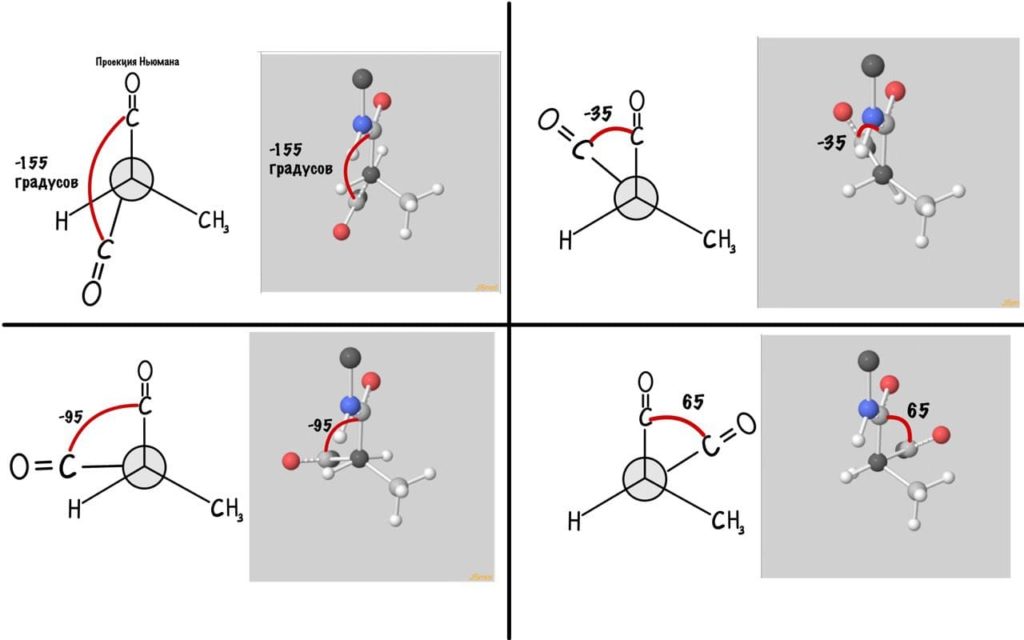
Поняли зачем так крутили молекулу? Да, просто так нам удобнее смотреть угол. А теперь начнем вращать и посмотрим как меняются углы.
Угол пси по такой же логике. Крутим молекулу, чтобы атом азота оказался сверху и смотрим прямо в альфа атом углерода.
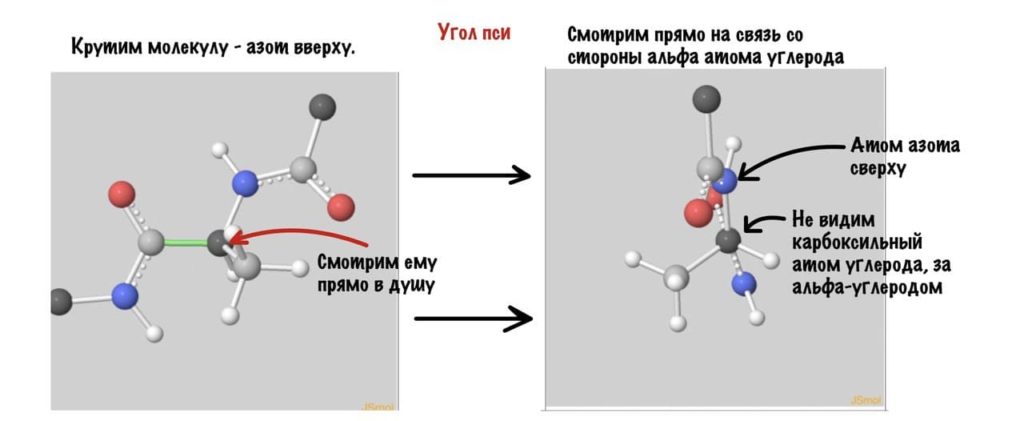
Еще разок построим проекцию Ньюмана, она немного отличается, и сразу же отметим углы.
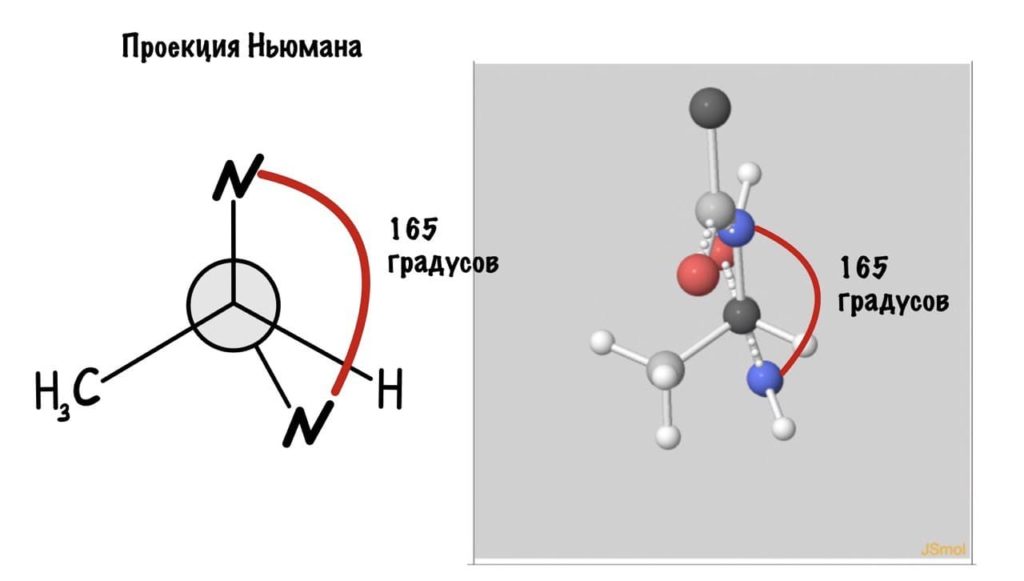
Думаю, что принцип понятен. Дальше можете покрутить сами, правильно? Я не сказал про одно большое «НО» — не каждый угол возможен, так как у атомов есть электронные оболочки, которые заряжены отрицательно. Если электронные оболочки подходят слишком близко, то они отталкиваются и угол меняется. Какие углы возможны? Для этого еще разок зайдите сюда и включите на панельке справа силы Ван-дер-Вальса и show clashes.
Подробнее о влиянии этих углов в следующей статье.
