Во всех ранее рассмотренных нами случаях перенос заряда не
сопровождался переносом вещества. Но существует класс проводников, прохождение
электрического тока в которых всегда сопровождается химическими изменениями и
переносом вещества. Такими проводниками являются растворы многих солей, кислот
и щелочей, а также расплавы солей и оксидов металлов. Эти вещества называют электролитами.
Чтобы понять природу электрического тока в электролитах, соберём
электрическую цепь, состоящую из источника тока, лампы накаливания и ванны с
дистиллированной водой, в которой находятся два угольных электрода. Замкнём
цепь. Лампочка не светится. Следовательно, дистиллированная вода является
диэлектриком.
Давайте повторим опыт, предварительно растворив в
дистиллированной воде сахар. Лампа не светится и в этом случае. Значит, раствор
сахара в воде тоже является диэлектриком.
А теперь растворим в дистиллированной воде небольшое количество
соли, например, хлорида меди и повторим опыт. Как видим, в цепи проходит
электрический ток, о чём наглядно свидетельствует свечение лампы. Вывод
напрашивается сам собой: раствор соли в воде является проводником
электрического тока.
При изучении химии вы узнали, что при растворении солей,
кислот и щелочей в воде происходит электролитическая диссоциация, то есть
распад молекул электролита на ионы.
В проведённом опыте хлорид меди в водном растворе
диссоциирует на положительно заряженные ионы меди и отрицательно заряженные
ионы хлора, которые при отсутствии электрического поля движутся хаотически:
Однако, стоит создать внешнее электрическое поле, как на
хаотическое движение частиц накладывается направленное движение положительно и
отрицательно заряженных ионов. При этом положительно заряженные ионы меди
движутся к электроду, подключённому к отрицательному полюсу источника тока (то
есть к катоду), а отрицательно заряженные ионы хлора — к положительному аноду.
На аноде будет происходить процесс окисления ионов хлора до атомов хлора: Cl– – e–
= Cl. А нейтральные атомы хлора будут образовывать
молекулы хлора, который выделяется на аноде: Cl + Cl = Cl2↑.
На катоде же будет происходить процесс восстановления ионов
меди до нейтральных атомов и осаждение металлической меди (о чём и
свидетельствует бурый налёт на катоде): Cu2+
+ 2e– = Cu.
Таким образом, свободными носителями электрического заряда в
электролитах являются положительно и отрицательно заряженные ионы, образующиеся
в результате электролитической диссоциации. Следовательно, проводимость
электролитов является ионной.
Давайте изучим сопротивление электролитов. Для этого соберём
простую электрическую цепь, состоящую из источника тока, электролитической
ванны и амперметра. Поддерживая постоянное напряжение между электродами,
приблизим их друг к другу. Нетрудно заметить, что амперметр показывает увеличение
силы тока в цепи.
Теперь установим один из электродов так, чтобы его часть
выступала над поверхностью раствора, — показания амперметра уменьшились.
Таким образом, при уменьшении расстояния между электродами и
площади перекрытия электродов, сопротивление электролита уменьшается.
А сейчас давайте нагреем электролит. Как видим, с ростом
температуры показания амперметра увеличиваться. Следовательно, увеличение
температуры электролита ведёт к уменьшению его сопротивления.
Теперь давайте будем увеличивать напряжение между электродами
в целое число раз. Не трудно заметить, что показания амперметра в этом случае
также увеличиваются в целое число раз, пропорционально напряжению. Это
свидетельствует о том, что для электролитов выполняется закон Ома:
Отметим также тот факт, что при прохождении электрического
тока через электролит проявляется тепловое действие тока, то есть выполняется
закон Джоуля—Ленца:
Идём дальше. При изучении химии вы узнали, что процесс
выделения на электроде вещества, связанный с окислительно-восстановительными
реакциями, протекающими при прохождении электрического тока через растворы
(расплавы) электролитов, называют электролизом.
Первый закон электролиза был экспериментально установлен
Фарадеем в 1833 году. Согласно ему, масса вещества, выделившегося на
электроде, прямо пропорциональна электрическому заряду, прошедшему через
электролит: m = kq.
Коэффициент пропорциональности k в формуле называют электрохимическим
эквивалентом данного вещества. Он численно равен массе вещества, выделившегося
на одном из электродов при прохождении через электролит единичного
электрического заряда.
В СИ электрохимический эквивалент измеряют в килограммах на
кулон: [k] = [Кл/кг].
Но вернёмся к первому закону электролиза и вспомним, что
заряд, прошедший через поперечное сечение проводника (в нашем случае, через
раствор электролита) за единицу времени, можно найти, как произведение силы
тока на время его прохождения: q = It.
Массу вещества, выделившегося на электроде при прохождении
через электролит электрического заряда, можно определить, зная массу одного иона
и число осевших на этом электроде ионов: m= m0N.
А массу одного иона легко найти, зная молярную массу вещества
и число Авогадро:
Выразим из последних двух формул число ионов:
Теперь вспомним, это же число ионов мы можем определить, как
отношение заряда, прошедшего через электролит, к заряду одного иона, который
кратен элементарному заряду:
В записанной формуле n — это
валентность иона.
Прировняв правые части последних двух равенств, найдём массу
выделившегося на катоде вещества.
Сравнивая полученное выражение с первым законом электролиза
легко получить формулу для определения электрохимического эквивалента вещества:
Произведение двух универсальных постоянных называют постоянной
Фарадея:
А отношение молярной массы вещества к валентности иона
называют химическим эквивалентом вещества:
Отсюда вытекает второй закон Фарадея для электролиза:
электрохимические эквиваленты веществ пропорциональны их химическим
эквивалентам:
А теперь давайте подставим выражение для электрохимического
эквивалента вещества в первый закон электролиза:
Полученное выражение называют объединённым законом Фарадея
для электролиза. Согласно этому закону масса вещества, выделившегося на
каждом из электродов, пропорциональна молярной массе ионов этого вещества, силе
тока и времени его прохождения через электролит и обратно пропорциональна
валентности ионов вещества.
Используя закон электролиза, можно определить значение заряда
электрона:
В 1874 году именно таким путём и было впервые получено значение
элементарного электрического заряда.
А теперь, для закрепления материала решим с вами такую задачу.
Хромирование тонкой прямоугольной пластинки размерами а = 5,0 см и b
= 8,0 см в большой гальванической ванне осуществляется в течение трёх часов при
силе тока 1,5 А. Определите толщину образовавшегося на пластинке слоя хрома.
В заключении урока отметим, что электролиз нашёл широкое
применения в технике. Так, например, английский химик и один из основателей
электрометаллургии сэр Гемфри Дэви разработал методику получения металлов с
наименьшим количеством примесей.
С помощью электролиза наносят защитные и декоративные покрытия
на металлические изделия (это называется гальваностегией).
В 1836 году русский академик Борис Семёнович Якоби разработал
метод для производства идеальных копий исходного предмета. Его назвали гальвванопластикой.
Первым изделием, полученным с помощью гальванотехники, стала
монета. Якоби сначала использовал монету для получения матрицы-негатива, а с
неё создал копию, находящейся в обороте, монеты. Осознав, что он открыл новый
метод фальшивомонетничества, учёный уничтожил полученное изделие. Технология
быстро распространилась в Российской империи. В частности, таким способом были
созданы скульптуры на нефах Исаакиевского собора в Санкт-Петербурге.
С помощью электролиза также получают электронные платы,
служащие основой всех электронных изделий. На диэлектрик наклеивают тонкую
медную пластину, на которую наносят особой краской сложную картину соединяющих
проводов. Затем пластину помещают в электролит, где вытравливаются не закрытые
краской участки медного слоя. После этого краска смывается, и на плате
появляются детали микросхемы.
Электрический ток в электролитах
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: носители свободных электрических зарядов в жидкостях.
Электролитом мы называем раствор (или расплав) вещества, через который может идти электрический ток; при этом исходное вещество проводником тока не является.
Например, кристаллы поваренной соли не проводят ток. Дистиллированная вода — тоже диэлектрик. Однако при растворении соли в воде получается среда, через которую ток отлично проходит! Следовательно, солёная вода будет электролитом (Вот почему запрещено купаться во время грозы — в водоёмах всегда растворено некоторое количество солей. При ударе молнии по воде пойдёт электрический ток).
Электролитами оказываются растворы солей, кислот и оснований. Прохождение тока через эти растворы означает, что в них имеются свободные заряды. Откуда же они там берутся, если ни в воде, ни в исходном веществе свободных зарядов не было?
Электролитическая диссоциация
Механизм, обеспечивающий появление свободных зарядов в электролите, называется электролитической диссоциацией. Мы ограничимся рассмотрением электролитической диссоциации в растворах.
Вообще, диссоциация — это распад молекулы на составные части под влиянием тех или иных факторов.В процессе электролитической диссоциации молекулы растворяемого вещества распадаются на положительные и отрицательные ионы в результате действия электрических сил со стороны молекул воды.
Многие свойства воды объясняются тем, что её молекулы являются полярными, то есть в электрическом отношении ведут себя как диполи (напомним, что диполь — это система двух одинаковых по модулю и противоположных по знаку зарядов, расположенных на небольшом расстоянии друг от друга). Полярность молекул обусловлена их геометрическим устройством (рис. 1 (изображение с сайта howyourbrainworks.net)).

Рис. 1. Молекулы воды
Угол, образованный линиями центров атома кислорода и двух атомов водорода, составляет примерно . Кроме того, электронные оболочки смещены в сторону кислорода. В результате центры положительных и отрицательных зарядов оказываются пространственно разделёнными: «минусы» преобладают в кислородной части молекулы воды, а «плюсы» — в водородной части.
Будучи диполями, молекулы воды создают вокруг себя электрическое поле и действуют электрическими силами как друг на друга, так и на молекулы примесей (притягиваясь друг к другу противоположно заряженными частями, молекулы воды создают весьма прочные связи. Вот почему столь велики удельная теплоёмкость и удельная теплота парообразования воды — на разрыв этих связей требуется значительная энергия).
Почему же соли, кислоты и основания распадаются в воде на ионы? Всё дело в том, что молекулы этих веществ также являются полярными. Давайте вернёмся к нашему примеру с растворением поваренной соли .
У атома натрия на внешнем электронном уровне находится один электрон. Он слабо связан с атомом и всегда готов покинуть место своего обитания. У атома хлора на внешнем электронном уровне семь электронов — одного как раз не хватает до полного комплекта. Атом хлора всегда готов захватить себе недостающий электрон.
Поэтому при образовании молекулы внешний электрон атома натрия уходит к атому хлора, и в результате молекула становится полярной — она состоит из положительного иона
и отрицательного иона
. Эта молекула схематически изображена на рис. 2 (атом хлора крупнее, чем атом натрия).

Рис. 2. Молекула
Иными словами, с электрической точки зрения молекула также оказывается диполем.
Взаимодействие двух сортов диполей — молекул и
— как раз и вызывает процесс растворения.
На рис. 3 мы видим, как протекает этот процесс (изображение с сайта intro.chem.okstate.edu). Более крупные зелёные шарики изображают ионы хлора, более мелкие серые — ионы натрия.

Рис. 3. Электролитическая диссоциация: растворение в воде
Левая часть рисунка показывает ситуацию до начала растворения. Крупица соли в виде небольшого кубического кристаллика (Кристаллическая решётка поваренной соли имеет кубическую структуру. В вершинах куба в шахматном порядке, крест-накрест расположены атомы натрия и хлора) только что оказалась в воде.
Сразу же начинается «электрическая атака» со стороны молекул воды. Отрицательно заряженные (кислородные) части молекул обращаются к положительным ионам натрия, а положительные (водородные) части молекулы воды — к отрицательным ионам хлора. Молекулы
начинают «растягиваться» разнонаправленными электрическими силами притяжения к молекулам-диполям воды, и связь между ионами натрия и хлора, скрепляющая молекулу соли, ослабевает.
В конце концов эта связь становится настолько слабой, что удары соседних частиц, совершающих тепловое движение, разрушают молекулу . Она распадается на положительный ион
и отрицательный ион
.
В правой части рис. 3 мы видим результат такого распада: вырванные из кристаллической решётки ион хлора и ион натрия отправляются «в свободное плавание», окружённые прицепившимися к ним молекулами воды. Обратите внимание, что молекулы воды прилипли к отрицательному иону хлора своими положительными водородными частями, а к положительному иону натрия, наоборот, повернулись их отрицательные кислородные части.
Таким образом, при растворении соли в воде появляются свободные заряды: положительные ионы
и отрицательные ионы
(рис. 4). Это и является необходимым условием прохождения тока через раствор.

Рис. 4. Раствор в воде
Описанный выше процесс растворения совершенно аналогично протекает и в случае других примесей.Так, щёлочь распадается в водном растворе на положительные ионы калия
и отрицательные ионы гидроксильной группы
. Молекула серной кислоты
при распаде даёт два положительных иона
и отрицательно заряженный ион кислотного остатка
В растворе медного купороса
появляются положительные ионы меди
и отрицательно заряженные ионы
Все ли молекулы растворяемого вещества распадутся на ионы? Это зависит от ряда условий.
Степенью диссоциации называется отношение числа распавшихся молекул к общему начальному числу молекул. При полном растворении вещества степень диссоциации равна .
Наряду с диссоциацией имеет место и обратный процесс: рекомбинация. А именно, две частицы противоположного знака могут встретиться и снова образовать нейтральную молекулу (рекомбинировать). С течением времени в растворе устанавливается состояние динамического равновесия: среднее число диссоциаций в единицу времени равно среднему числу рекомбинаций, в результате чего концентрация раствора остаётся неизменной (вспомните аналогичную ситуацию с насыщенным паром: при динамическом равновесии пара и жидкости среднее число вылетевших из жидкости молекул равно среднему числу молекул, вернувшихся обратно из пара в жидкость, так что концентрация насыщенного пара неизменна).
Процессы диссоциации-рекомбинации записываются в виде следующих уравнений, отражающих состояние динамического равновесия:
Изменение внешних условий может нарушить текущее динамическое равновесие и сместить его в ту или иную сторону. Например, при повышении температуры увеличивается скорость диссоциации, и концентрация положительных и отрицательных ионов в растворе возрастает.
Ионная проводимость
В металлах, как вы помните, имеется лишь один тип свободных зарядов — это свободные электроны. В электролитах ситуация иная: здесь возникают свободные заряды двух типов.
1. Положительные ионы, образовавшиеся из атомов металлов или водорода.
2. Отрицательные ионы — атомные или молекулярные кислотные остатки (например, или
), а также гидроксильная группа
.
Второе отличие от металлов заключается в том, что носители свободных зарядов в электролите могут иметь заряд, равный по модулю как элементарному заряду , так и целому числу элементарных зарядов
. Здесь
— валентность атома или группы атомов; например, при растворении медного купороса имеем
.
Если внешнего электрического поля нет, то свободные заряды электролита совершают лишь хаотическое тепловое движение наряду с окружающими молекулами. Но при наложении внешнего поля положительные и отрицательные ионы начинают упорядоченное движение.
Поместим в сосуд с электролитом два электрода; один из электродов присоединим к положительной клемме источника тока, а другой — к отрицательной (рис. 5). Когда речь идёт о прохождении тока через электролиты, положительный электрод называют анодом, а отрицательный — катодом (Имеется народная мудрость для запоминания знаков анода и катода: Андрей — парень положительный, Катька — девка отрицательная ;-)).

Рис. 5. Ионная проводимость электролита
В электрическом поле, возникшем между электродами, положительные ионы электролита устремляются к «минусу» катода, а отрицательные ионы — к «плюсу» анода. Таким образом, электрический ток в электролите образуется в результате встречного движения ионов: положительных — к катоду, отрицательных — к аноду. Поэтому проводимость электролитов называется ионной (в отличие от электронной проводимости металллов).
На положительном аноде имеется недостаток электронов. Отрицательные ионы, достигнув анода, отдают ему свои лишние электроны; эти электроны отправляются по цепи к «плюсу» источника.
Наоборот, на отрицательном катоде — избыток электронов. Положительные ионы, придя на катод, забирают у него электроны, и это количество ушедших электронов немедленно восполняется их доставкой на катод с «минуса» источника.
Таким образом, в той части цепи, которая состоит из источника тока и металлических проводников, возникает циркуляция электронов по маршруту «анод источник
катод».
Цепь замыкается электролитом, где электрический ток обеспечивается двусторонним движением ионов.
Электролиз
Положительные и отрицательные ионы, будучи носителями свободных зарядов, в то же время являются частицами вещества. Поэтому важнейшее отличие тока в электролитах от тока в металлах состоит в том, что электрический ток в электролите сопровождается переносом вещества.
Явление переноса вещества при прохождении электрического тока через электролит называется электролизом. Законы электролиза были экспериментально изучены Фарадеем.
В процессе электролиза происходит разложение растворённого вещества на составные части и выделение этих частей на электродах. Так, в растворе медного купороса положительные ионы меди
идут на катод, в результате чего катод покрывается медью. Кислотный остаток
выделяется на аноде.
Естественным образом возникает вопрос о нахождении массы вещества, выделяющегося на электроде за определённое время
. Эта масса, очевидно, совпадает с массой данного вещества, перенесённого током за время
через электролит.
Пусть — масса одного иона этого вещества,
— заряд иона (
— валентность вещества). Предположим, что за время
через электролит прошёл заряд
. Число ионов, пришедших на электрод, тогда равно
. Масса выделившегося на электроде вещества равна суммарной массе пришедших ионов:
(1)
Величина является характеристикой вещества и называется его электрохимическим эквивалентом. Значения электрохимических эквивалентов различных веществ приводятся в таблицах.
При протекании через электролит постоянного тока за время
проходит заряд
. Подставляя это в формулу (1), получим первую формулу Фарадея:
(2)
Первый закон Фарадея. Масса выделяющегося на электроде вещества пропорциональна силе тока, протекающего через электролит, и времени прохождения тока.
Теперь преобразуем выражение для электрохимического эквивалента, введя молярную массу вещества:
Подставляя это выражение в (2), получим вторую формулу Фарадея:
(3)
Второй закон Фарадея. Масса выделяющегося на электроде вещества прямо пропорциональна молярной массе этого вещества и обратно пропорциональна его валентности.
В формуле (3) мы видим произведение двух констант и
. Оно также является константой и называется постоянной Фарадея:
Кл/моль.
Формула (3) с постоянной Фарадея запишется так:
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Электрический ток в электролитах» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из разделов нашего сайта.
Публикация обновлена:
08.05.2023

Майкл Фарадей, портрет Томаса Филипса, 1841—1842
Зако́ны электро́лиза Фараде́я являются количественными соотношениями, основанными на электрохимических исследованиях, опубликованных Майклом Фарадеем в 1836 году.[1][2]
История и значение[править | править код]
Фарадей, стремясь установить количественные соотношения между различными проявлениями электричества, начал экспериментальные исследования по электролизу, в 1833-1834 годах открыл его законы (введя и сохранившуюся доныне терминологию в этой области). Эти законы явились серьёзным доводом в пользу дискретности вещества и электричества.[3]
Кроме того, открытие этих законов имело, конечно, большое практическое значения для электрохимии и техники.
Физический смысл[править | править код]
С современной точки зрения, установлению которой исторически открытие Фарадея и способствовало, смысл его законов электролиза сводится к тому, что вещество имеет атомную или молекулярную структуру, а атомы или молекулы определенного химического вещества одинаковы и имеют следовательно одинаковую массу, то же относится к ионам, играющим роль переносчиков тока в электролитах и разряжающимися (окисляющимися или восстанавливающимися) на электродах при электролизе. Кроме одинаковой массы ионы одинакового вида имеют и одинаковый заряд, который дискретен и всегда кратен заряду электрона (хотя для разных ионов может иметь разный знак).
Таким образом, при прохождении через электрод определенного количества электричества это означает прохождение и строго определенного количества электронов, и разрядку на нём строго определенного количество ионов определённого типа (равного количеству прошедших электронов, делённому на заряд данного типа иона). И, таким образом, зная массу данного типа атомов, молекул или ионов, и величину элементарного заряда (заряда электрона), прямо устанавливается пропорциональная зависимость между прошедшим через электрод количеством электричества и массой выделившегося на нем вещества.[4][5]
Говоря коротко, физический смысл законов Фарадея с современной точки зрения сводится к закону сохранения электрического заряда в сочетании с фактом дискретности («квантования») заряда и фактом физической одинаковости (в том числе всегда одинаковой массы). С учетом существования разных изотопов, это не совсем строгое утверждение; строгим оно является для каждого изотопа отдельно (или для моноизотопных элементов), а для «природной смеси изотопов» верно лишь в среднем, представляя собой скорее геологический факт, и в частных случаях за счет отличия изотопного состава по каким-то причинам от «обычного», атомные массы могут отклоняться от обычных средних (стандартных) значений; см. Атомная масса. То же, конечно, касается и молекулярных масс. Впрочем, за исключением самых лёгких элементов, колебания атомных масс при любых (в рамках ограничения изотопами с разумными временами жизни) колебаниях изотопного состава относительно невелики.
С точки зрения химии электролиз можно рассматривать как реакции (вблизи электродов), одним из участников которых является электрон (электроны), имеющий пренебрежимую (практически нулевую сравнительно с атомами) массу, в остальном же ведущий себя в реакциях почти так же, как остальные участники — атомы, молекулы, ионы. При этом количественно поступление электронов в одну область реакций через один электрод и уход их из второй области реакций через другой электрод можно измерить с помощью электроизмерительных приборов (зная заряд электрона). Это можно назвать основным смыслом (или, если угодно, способом вывода) законов Фарадея с точки зрения химии.
Формулировка законов[править | править код]
В учебниках и научной литературе можно найти несколько версий формулировки законов электролиза Фарадея. Например, они могут быть сформулированы таким образом:
- Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента или вещества[7], выделившегося на электроде, прямо пропорциональна эквивалентной массе элемента или вещества. Эквивалентной массой вещества вообще в химии называется его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество; в данном же случае эквивалентом называется молярная масса образующегося при разряде иона вещества, делённая на сумму зарядов ионов (измеренных в элементарных единицах), дающих в итоге молекулу или атом данного вещества. В случае выделения на электроде атомарного вещества эквивалент — это просто его атомная масса, делённая на заряд его иона (см. тж. Электрохимический эквивалент).
Математическая запись[править | править код]
Законы Фарадея можно записать в виде следующей формулы:
где:
Заметим, что 
Для первого закона Фарадея 



Для второго закона Фарадея 



В простейшем случае используется постоянный ток и полный электрический заряд (прошедший через систему) за время электролиза равен: 
, где при вычислениях в СИ размерность тока
амперы, а размерность заряда
— кулоны (иначе говоря ампер-секунды). В практических целях можно применять другие единицы заряда, например, ампер-час (равный 3600 Кл), но в этом случае нужно быть аккуратным, вводя соответствующий множитель (как и вообще при применении других систем физических единиц, например СГС, где численное значение постоянной Фарадея будет, конечно же, другим).
или для количества вещества:
где:
В более сложном случае переменного электрического тока полный заряд 


Здесь 



Нетрудно видеть, что формула для переменного тока представляет собой просто сумму величин, полученных по формуле для постоянного тока для маленьких промежутков времени 

- Здесь сразу же следует заметить, что формулировка выше и интерпретация входящих в неё величин сделаны для случая выделения на электроде одноатомного простого вещества (в частности, она хорошо и прямо подходит для случая осаждения на катоде восстанавливающегося при электролизе — из раствора или расплава его соли, основания или оксида — металла). Выделение других простых веществ (скажем, кислорода или хлора) может быть, по крайней мере, условно (независимо от того, каков реальный механизм такой реакции), интерпретироваться как первоначальное выделение атомарного вещества (атомарного кислорода или хлора), и лишь затем образования многоатомной (двухатомной) молекулы — но уже в этом случае нужно быть аккуратным при пересчёте, если мы хотим знать количество получившегося конечного молекулярного вещества (так, скажем, эквивалент молекулярного кислорода будет равен его молярной массе, деленной на 4, а хлора — молярной массе, делённой на два). Ещё более сложными являются реакции при электролизе в случае нахождения в растворе (или расплаве) некоторых сложных (многоатомных) ионов, когда выделяющееся вещество отличается от иона не только зарядом, но и атомным составом; кроме того, могут выделяться смеси веществ (как, скажем, при электролизе расплавов сульфатов), а при электролизе растворов часто происходит ещё и реакция с участием растворителя, и конечные вещества могут заметно отличаться по составу ещё и из-за этого. В любом случае, если нас интересует масса (или количество вещества) конечного продукта, мы должны использовать в формуле именно его молекулярную массу и суммарный заряд тех ионов, которые, разрядившись, были его предшественниками; тем не менее, понятие эквивалента и эквивалентной массы можно последовательно и достаточно строго определить и для этих случаев. Случай выделения нескольких веществ мы рассмотрим подробнее ниже.
- Сами по себе законы Фарадея и их формульная запись строги и фундаментальны. Что не означает всегда легкости их практического применения. Это означает, что на практике они могут выглядеть, как работающие неточно. Например, при недостаточно хорошем разделении пространств катода и анода продукты электролиза могут (вследствие диффузии через раствор или смешивания в газовой фазе) входить в соприкосновение и могут при определенных условиях реагировать друг с другом, в том числе и с образованием первоначального вещества, при этом практический выход реакции будет меньше, чем вычисленный по законам Фарадея, что, конечно же, не означает нестрогости самих законов, а лишь несовершенство разделения продуктов электролиза и допущение других, в том числе обратных, реакций.
- Тем не менее, точность законов Фарадея ограничивается, как говорилось уже выше или случаем чистых изотопов, или «в среднем», для обычной природной смеси изотопов, то есть, из-за колебаний изотопного состава могут наблюдаться небольшие видимые отклонения от законов Фарадея (впрочем, формально, при нестандартном изотопном составе надо просто использовать соответственно исправленную атомную (или, ниже, молекулярную массу; кроме того, на практике чаще всего — хотя и не всегда (!) — колебания атомной массы из-за отличий изотопного состава невелики — см. вообще Атомная масса.
- Кроме того, строго говоря, следовало бы говорить не об атомной массе иона, а об атомной массе уже восстановленного на катоде металла (или выделившегося окисленного на аноде атомарного газа). Но отличие масс в этом случае — всего лишь на массу одного или нескольких электронов, что практически пренебрежимо мало (порядка 1/1000 и менее) по сравнению с массой атома или иона. Правда, в случае разряда на электроде сложного (многоатомного) иона (см. ниже), конечный продукт, как правило, отличается и по химическому составу, а значит отличие по массе уже достаточно значительное, и тогда следует использовать в расчете молекулярную массу уже конечного продукта, если нас интересует именно его масса (а, скажем, не трудно наблюдаемая и не накапливающаяся — то есть не существующая реально одновременно ни в один конкретный момент — масса неустойчивых промежуточных продуктов; которую можно по сути лишь просуммировать формально, как некий прошедший поток массы, тем более что конкретный механизм реакции и конкретные реальные промежуточные продукты бывают достаточно трудно исследуемыми и даже неизвестны).
Случай выделения нескольких веществ[править | править код]
При электролизе на одном электроде может выделяться как одно, так и несколько разных веществ. Последнее иногда случается необходимо (когда реакция вообще не может идти иным путём, как только с выделением одновременно нескольких различных продуктов на одном электроде — что характерно, например, для электролиза расплавов солей кислородсодержащих кислот, или самих этих кислот), а нередко и в зависимости от конкретных условий протекания реакции (в том числе от состава смесей, если речь идет об их электролизе, в частном случае от растворителя и его количества, если речь идет об электролизе раствора). Кроме того, различные вещества могут выделяться в разной пропорции последовательно по времени, скажем, сначала может восстанавливаться (преимущественно) менее активный металл, а по его исчерпании в растворе — более активный металл; с формальной точки зрения — по отношению к законам Фарадея — этот случай не отличается по итоговому результату от случая одновременного выделения (отличаясь по скорости выделения в разные моменты времени, однако и в каждый момент времени законы Фарадея в формулировке, указанной здесь ниже, будут соблюдаться).
где, как нетрудно видеть, в левой части стоит просто сумма количества эквивалентов всех выделившихся веществ;
M1, M2 и т. д. — молярные (молекулярные или атомные, в зависимости от конкретных продуктов) массы всех выделившихся веществ, сколько бы их не выделялось, одновременно или последовательно, а z1, z2 и т. д. — суммарные заряды (в элементарных единицах заряда) ионов, которые должны разрядиться для образования каждого данного продукта (в частном случае выделения металлов, это просто атомные массы каждого металла и заряды иона данного металла в растворе; в случае наличия различных ионов одного и того же элемента каждый должен учитываться отдельно, в отдельном слагаемом).
Q, конечно же, вычисляется так же, как описано выше, для случая выделения на электроде одного вещества.
Случай переменного тока[править | править код]
Случай переменного тока, рассмотренный выше, практически более или менее хорошо относится к току переменной силы, но постоянного направления. Хотя и тут могут быть определённые усложнения, не затрагивающие, однако, законов Фарадея как таковых, в особенности учитывая их формулировку для случая нескольких продуктов электролиза. Дело в том, что одним из основных факторов изменения силы тока может быть изменение приложенной разности потенциалов, а её изменения могут сильно влиять на доли выделяющихся продуктов вплоть до прекращения выделения некоторых из них при малых потенциалов и наоборот. Однако суммарно для всех продуктов законы Фарадея всё равно будут выполняться.
В случае же тока, меняющего направление, дело может осложняться более сильно и принципиально. Хотя в некоторых случаях всё работает достаточно хорошо впрямую (просто в интеграле 
При достаточно быстро меняющемся переменном токе, к тому же, ток через один и другой электрод вообще говоря не совпадают друг с другом. Но тогда можно считать заряд прошедший через каждый электрод отдельно (а в итоге за большое время прошедшие через электроды заряды станут практически точно равными). Важными при достаточно быстро переменном токе являются и скорости протекания реакций, также и скорость отведения продуктов (это позволяет регулировать соотношение выхода разных реакций с помощью частоты переменного тока). Тем не менее, законы Фарадея в целом выполняются (хотя изотопный состав продуктов при этом может меняться, впрочем, как и при электролизе постоянного тока).
Примечания[править | править код]
- ↑ Faraday, Michael (1834). “On Electrical Decomposition”. Philosophical Transactions of the Royal Society. 124: 77—122. DOI:10.1098/rstl.1834.0008. Архивировано из оригинала 2018-09-11. Дата обращения 2020-10-13.
- ↑ Ehl, Rosemary Gene; Ihde, Aaron. Faraday’s Electrochemical Laws and the Determination of Equivalent Weights (англ.) // Journal of Chemical Education (англ.) (рус. : journal. — 1954. — Vol. 31, no. May. — P. 226—232. — doi:10.1021/ed031p226. — Bibcode: 1954JChEd..31..226E.
- ↑ БСЭ:
- Майкл Фарадей Архивная копия от 3 мая 2022 на Wayback Machine
- ФАРАДЕЯ ЗАКОНЫ
- ↑ Также и обратно, знание коэффициента пропорциональности – постоянной Фарадея – может быть использовано для экспериментального определения входящих в него констант – заряда электрона, и числа Авогадро, а также атомных и молекулярных масс конкретных веществ.
- ↑ В реальности нередко бывает, что на электродах при электролизе выделяется одновременно несколько разных веществ, также эти вещества могут вступать сразу в дальнейшие химические реакции. Однако сами по себе законы электролиза остаются верными, в частности, при выделении нескольких веществ закон Фарадея работает для них суммарно – суммарное количество эквивалентов всех выделившихся веществ будет выступать вместо количества эквивалентов одного выделившегося вещества. Дальнейшие превращения выделившихся веществ усложняют практическую картину, но не меняют ее принципиально. Кроме того, в ряде случаев подобные усложнения малы или вообще практически не возникают в пределах разумных погрешностей.
- ↑ Эта формулировка действительна для случая выделения на электроде одного вещества (а не нескольких, одновременно или последовательно). Для случая выделения нескольких веществ речь идет о том, сколько эквивалентов суммарно выделилось на электроде всех реально выделившихся при электролизе веществ.
- ↑ Выделяющееся на электроде вещество не обязательно простое, поскольку при электролизе могут разряжаться не только одноатомные, но и многоатомные (сложные) ионы, как например NH4+. В последнем случае, правда, реакция на электроде оказывается несколько более сложной, особенно при электролизе в растворе, но итоговое количество эквивалентов выделившихся веществ всё равно определяется этми же законом.
- ↑ For a similar treatment, see Strong, F. C. Faraday’s Laws in One Equation (англ.) // Journal of Chemical Education (англ.) (рус. : journal. — 1961. — Vol. 38, no. 2. — P. 98. — doi:10.1021/ed038p98.
Ссылки[править | править код]
- Serway, Moses, and Moyer, Modern Physics, third edition (2005).
См. также[править | править код]
- Электролиз
- Майкл Фарадей
- Постоянная Фарадея
- Закон электромагнитной индукции Фарадея
Закон электролиза Фарадея. Закон электролиза был экспериментально установлен Фарадеем в 1833 г.
Масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
В формуле (1) коэффициент пропорциональности k называют электрохимическим эквивалентом данного вещества. Он численно равен массе вещества, выделившегося на одном из электродов при прохождении через электролит единичного электрического заряда. В СИ электрохимический эквивалент измеряют в килограммах на кулон . Значения электрохимических эквивалентов некоторых веществ приведены в таблице.
| Вещество | k, 10-8 |
Вещество | k, 10-8 |
| Алюминий | 9,32 | Никель (двухвалентный) | 30,4 |
| Водород | 1,04 | Никель (трёхвалентный) | 20,3 |
| Кислород | 8,29 | Хлор | 36,7 |
| Медь (одновалентная) | 65,9 | Хлом | 18,0 |
| Медь (двухвалентная) | 32,9 | Цинк | 33,9 |
Поскольку q = It, где I — сила тока, t — промежуток времени прохождения тока через электролит, то
m = kIt.
От теории к практике
Никелирование изделия двухвалентным никелем осуществлялось в течение промежутка времени t = 20 мин при силе тока I = 15 А. Определите массу слоя никеля, осаждённого на изделии.
Массу m вещества, выделившегося на электроде при прохождении через электролит электрического заряда q, можно определить, зная массу m0 одного иона и число N осевших на этом электроде ионов:
,
,
где M — молярная масса выделившегося вещества, NА — постоянная Авогадро.
Тогда число ионов: .
С другой стороны, число ионов, нейтрализовавшихся на электроде:
где q0 — заряд одного иона. Так как заряд иона q0 кратен элементарному заряду e, то q0 = en, где n — валентность иона.
Значит, и
(2)
Сравнивая формулы (2) и (1), получим
(3)
Так как NА и е – универсальные постоянные, то физическую величину в честь М. Фарадея назвали постоянной Фарадея.
С учётом этого формулу (3) для определения электрохимического эквивалента вещества можно записать в виде:
Используя закон электролиза, можно определить значение заряда электрона в школьной лаборатории. Допустим, что I — сила тока, который проходил через электролит в течение промежутка времени t (можно измерить амперметром). При этом на электроде выделилось вещество, масса которого m (можно измерить, взвесив электрод до и после прохождения тока через электролит). Тогда модуль заряда электрона определяют по формуле.
Гипермаркет знаний>>Физика и астрономия>>Физика 10 класс>>Физика: Закон электролиза
При электролизе на электродах происходит выделение вещества. От чего зависит масса вещества, выделяющегося за определенное время? Это определяет закон электролиза.
Очевидно, что масса выделившегося вещества m равна произведению массы одного иона m0i на число ионов достигших электрода за время ![]() :
:
![]()
Масса иона m0i согласно формуле (8.4) равна:
![]()
где М – молярная (или атомная) масса вещества, а NA – постоянная Авогадро, т. е. число ионов в одном моле.
Число ионов, достигших электрода, равно:
![]()
где ![]() – заряд, прошедший через электролит за время
– заряд, прошедший через электролит за время ![]() ;
; ![]() – заряд иона, который определяется валентностью n атома:
– заряд иона, который определяется валентностью n атома: ![]() (е – элементарный заряд).
(е – элементарный заряд).
При диссоциации молекул, состоящих из одновалентных атомов (n = 1), возникают однозарядные ионы. Например, при диссоциации молекул КВr возникают ионы K+ и Вr. Диссоциация молекул медного купороса ведет к появлению двухзарядных ионов Cu2+ и SO42-, так как атомы меди в данном соединении двухвалентны (n = 2). Подставляя в формулу (16.3) выражения (16.4) и (16.5) и учитывая, что ![]() , получаем
, получаем
![]()
Закон Фарадея. Обозначим через k коэффициент пропорциональности между массой вещества m и зарядом ![]() :
:
![]()
Коэффициент k зависит от природы вещества (значений М и n). Согласно формуле (16.6) имеем:
![]()
Следовательно, масса вещества, выделившегося на электроде за время ![]() при прохождении электрического тока, пропорциональна силе тока и времени.
при прохождении электрического тока, пропорциональна силе тока и времени.
Это утверждение, полученное нами теоретически, впервые было установлено экспериментально Фарадеем и носит название закона электролиза Фарадея.
Из формулы (16.8) видно, что коэффициент k численно равен массе вещества, выделившегося на электродах, при переносе ионами заряда, равного 1 Кл. Величину k называют электрохимическим эквивалентом данного вещества и выражают в килограммах на кулон (кг/Кл).
Электрохимический эквивалент имеет простой физический смысл. Так как ![]() , то согласно формуле (16.7)
, то согласно формуле (16.7) ![]() , т. е. k – отношение массы иона к его заряду.
, т. е. k – отношение массы иона к его заряду.
Измеряя величины m и ![]() , можно определить электрохимические эквиваленты различных веществ.
, можно определить электрохимические эквиваленты различных веществ.
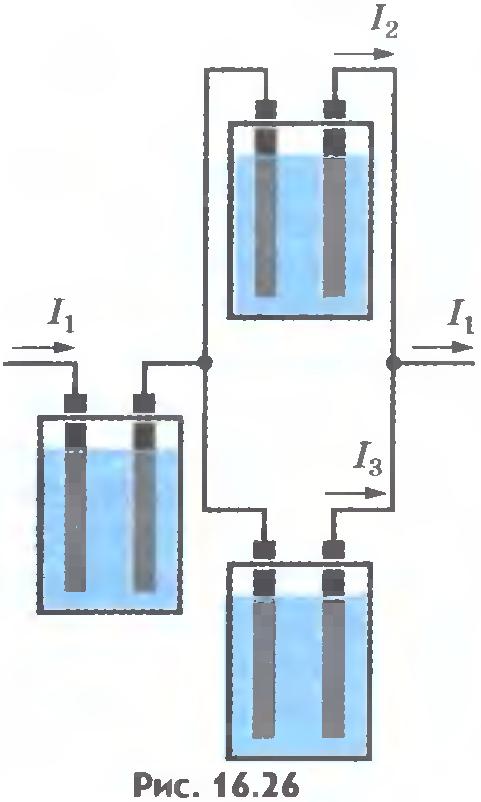
Убедиться в справедливости закона Фарадея можно на опыте. Соберем установку, показанную на рисунке 16.26. Все три электролитические ванны заполнены одним и тем же раствором электролита, но токи, проходящие через них, различны. Обозначим силы токов черезI1, I2, I3. Тогда I1 = I2 + I3. Измеряя массы m1, m2, m3 веществ, выделившихся на электродах в разных ваннах, можно убедиться, что они пропорциональны соответствующим силам токов I1, I2, I3.
Определение заряда электрона. Формулу (16.6) для массы выделившегося на электроде вещества можно использовать для определения заряда электрона. Из этой формулы вытекает, что модуль заряда электрона равен:
![]()
Зная массу m выделившегося вещества при прохождении заряда ![]() , молярную массу М, валентность атомов n и постояннуюАвогадро NA, можно найти значение модуля заряда электрона. Оно оказывается равным е = 1,6•10-19 Кл.
, молярную массу М, валентность атомов n и постояннуюАвогадро NA, можно найти значение модуля заряда электрона. Оно оказывается равным е = 1,6•10-19 Кл.
Именно таким путем и было впервые в 1874 г. получено значение элементарного электрического заряда.
Произведение силы тока на время определяет массу вещества, выделяемого при электролизе. Закон электролиза позволяет найти значение элементарного электрического заряда.
???
1. Сформулируйте закон электролиза Фарадея.
2. Почему отношение массы вещества, выделившегося при электролизе, к массе иона равно отношению прошедшего заряда к заряду иона?
Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, Физика 10 класс
Планирование уроков по физике, ответы на тесты, задания и ответы по классам, домашнее задание и работа по физике для 10 класса
Содержание урокаконспект урока
опорный каркас
презентация урока
акселеративные методы
интерактивные технологии Практика
задачи и упражнения
самопроверка
практикумы, тренинги, кейсы, квесты
домашние задания
дискуссионные вопросы
риторические вопросы от учеников Иллюстрации
аудио-, видеоклипы и мультимедиа
фотографии, картинки
графики, таблицы, схемы
юмор, анекдоты, приколы, комиксы
притчи, поговорки, кроссворды, цитаты Дополнения
рефераты
статьи
фишки для любознательных
шпаргалки
учебники основные и дополнительные
словарь терминов
прочие Совершенствование учебников и уроков
исправление ошибок в учебнике
обновление фрагмента в учебнике
элементы новаторства на уроке
замена устаревших знаний новыми Только для учителей
идеальные уроки
календарный план на год
методические рекомендации
программы
обсуждения Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь – Образовательный форум.
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний – Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов –
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других “взрослых” тем.
Разработка – Гипермаркет знаний 2008-
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: 




