Как определить заряд ядра атома
Строение атома – это одна из базовых тем курса химии, которая основана на умении пользоваться таблицей «Периодическая система химических элементов Д.И.Менделеева». Это не только систематизированные и расположенные по определенным законам химические элементы, но и кладезь информации, в том числе и о строении атома. Зная особенности чтения этого уникального справочного материала, можно дать полную качественную и количественную характеристику атому.
Вам понадобится
- Таблица Д.И.Менделеева
Инструкция
В таблице Д.И.Менделеева, как в многоэтажном многоквартирном доме «живут» химические элементы, каждый из которых занимает свою собственную квартиру. Таким образом, каждый из элементов имеет определенный порядковый номер, указанный в таблице. Нумерация химических элементов начинается слева направо, причем сверху. В таблице горизонтальные ряды называются периодами, а вертикальные столбцы – группами. Это немаловажно, потому что по номеру группы или периода можно также дать характеристику некоторым параметрам атома.
Атом представляет собой химически неделимую частицу, но при этом состоящую из более мелких составных частей, к которым можно отнести протоны (положительно заряженные частицы), электроны (заряжены отрицательно) и нейтроны (нейтральные частицы). Основная масса атома сосредоточена в ядре (за счет протонов и нейтронов), вокруг которого вращаются электроны. В целом атом электронейтрален, то есть в нем количество положительных зарядов совпадает с количеством отрицательных, следовательно, число протонов и электронов одинаково. Положительный заряд ядра атома имеет место быть как раз за счет протонов.
Необходимо запомнить, что порядковый номер химического элемента количественно совпадает с зарядом ядра атома. Поэтому, чтобы определить заряд ядра атома необходимо посмотреть, под каким номером находится данный химический элемент.
Пример № 1. Определить заряд ядра атома углерода (С). Начинаем анализировать химический элемент углерод, ориентируясь на таблицу Д.И.Менделеева. Углерод находится в «квартире» № 6. Следовательно, он имеет заряд ядра +6 за счет 6 протонов (положительно заряженных частиц), которые располагаются в ядре. Учитывая, что атом электронейтрален, значит, электронов тоже будет 6.
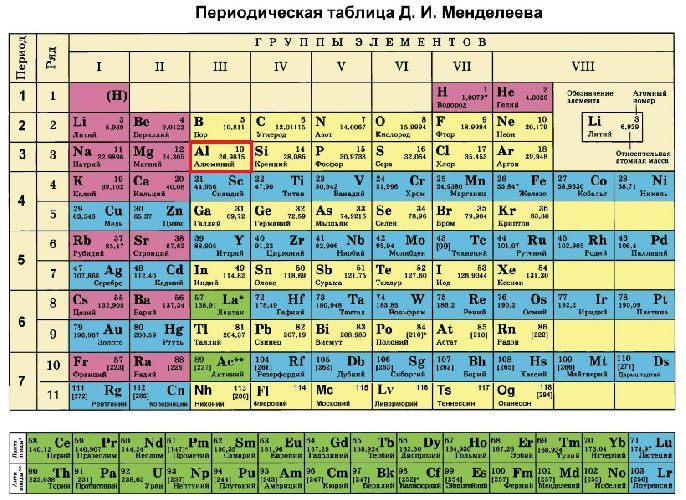
Пример № 2. Определить заряд ядра атома алюминия (Al). Алюминий имеет порядковый номер – № 13. Следовательно, заряд ядра атома алюминия +13 (за счет 13 протонов). Электронов также будет 13.
Пример № 3. Определить заряд ядра атома серебра (Ag). Серебро имеет порядковый номер – № 47. Значит, заряд ядра атома серебра + 47 (за счет 47 протонов). Электронов также 47.
Обратите внимание
В таблице Д.И.Менделеева в одной клетке для каждого химического элемента указаны два числовых значения. Не путайте порядковый номер и относительную атомную массу элемента
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Строение атома алюминия


4.6
Средняя оценка: 4.6
Всего получено оценок: 481.
4.6
Средняя оценка: 4.6
Всего получено оценок: 481.
Алюминий (Al) – лёгкий металл, занимающий третье место по распространённости в земной коре среди химических элементов. Строение атома алюминия позволяет легко обрабатывать металл: он поддаётся литью, формовке, механическому воздействию.
Строение
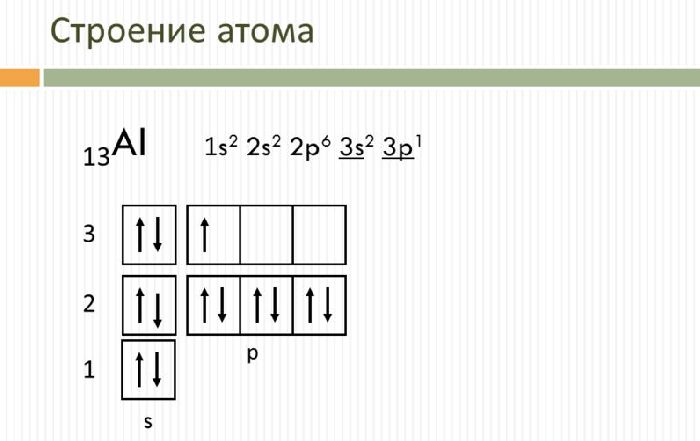
Электронное строение атома элемента алюминия связано с его положением в периодической таблице Менделеева. Алюминий имеет 13 порядковый номер и находится в третьем периоде, в IIIa группе. Относительная атомная масса алюминия – 27. Электронная конфигурация атома алюминия – 1s22s22p63s23p1, модель распределения электронов – +13Al)2)8)3.
Атом элемента состоит из положительно заряженного ядра +13 (13 протонов и 14 нейронов) и трёх электронных оболочек с 13 электронами. На внешнем энергетическом уровне находится всего три электрона. В возбуждённом состоянии атом способен отдавать все три электрона, проявляя степень окисления +3, или образовывать три ковалентные связи. Поэтому алюминий имеет третью валентность.
В природе алюминий встречается только в составе соединений – глины, слюды, корунда. Металл ценился дороже золота до открытия промышленного способа его получения.
Свойства
Алюминий – серебристый металл, обладающий высокой электропроводностью и пластичностью. Элемент при комнатной температуре легко соединяется с кислородом, образуя на поверхности оксидную плёнку, защищающую металл от коррозии. Образование плёнки препятствует реакции с водой, концентрированными азотной и серной кислотами, поэтому алюминиевая тара подходит для перевозки этих кислот.

Для снятия оксидной плёнки используют соли аммония, горячие щёлочи, сплавы ртути. После разрушения оксидной плёнки алюминий вступает в реакцию со многими неметаллами и соединениями. Основные химические свойства элемента описаны в таблице.
|
Взаимодействие |
Ход реакции |
Пример |
|
С водой |
Только в условиях отсутствия оксидной плёнки. Образуется гидроксид алюминия |
2Al + 6H2O → 2Al(OH)3 + 3H2 |
|
С кислородом |
Образуется оксид алюминия |
4Al + 3O2 → 2Al2O3 + Q |
|
С галогенами |
При комнатной температуре. С йодом – в присутствии катализатора |
2Al + 3Cl2 → 2AlCl3 |
|
С серой |
При температуре выше 200°С, образуется сульфид алюминия |
2Al + 3S → Al2S3 |
|
С фосфором |
При температуре 500°С, образуется фосфид алюминия |
Al + P → AlP |
|
С азотом |
При температуре 800°С, образуется нитрид алюминия |
2Al + N2 → 2AlN |
|
С углеродом |
При температуре 2000°С, образуется карбид алюминия |
4Al + 3C → Al4C3 |
|
С кислотами |
При комнатной температуре реагирует с разбавленными кислотами, при нагревании – с концентрированными. Образуются соли |
– 2Al + 3H2SO4 → Al2(SO4)3 + 3H2; – 2Al + 6HCl → 2AlCl3 + 3H2; – Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O |
|
Со щелочами |
Реагируют растворы и сплавы |
– 2Al + 2NaOH + 10H2O → 2Na[Al(H2O)2(OH)4] + 3H2; – 2Al + 6KOH → 2KAlO2 + 2K2O + 3H2 |
|
С оксидами |
Вытесняет металлы |
2Al + Cr2O3 = 2Cr + Al2O3 |
Алюминий не взаимодействует с водородом.

Что мы узнали?
Атом алюминия включает 13 электронов. Схема строения алюминия – 1s22s22p63s23p1. На внешнем уровне находится три электрона, определяющие третью валентность элемента. Алюминий – лёгкий, плавкий металл, легко вступающий в реакцию с кислородом и образующий на поверхности оксидную плёнку. Благодаря плёнке металл не подвержен коррозии и не вступает в реакцию с концентрированными кислотами. При комнатной температуре алюминий реагирует с галогенами, при нагревании – с серой, фосфором, азотом, углеродом.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

El’nore Christopher
5/5
-

Александр Котков
5/5
-

Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 481.
А какая ваша оценка?
Содержание
- Строение атома алюминия
- Общие сведения о строении атома алюминия
- Электронное строение атома алюминия
- Примеры решения задач
- Алюминий Al
- Электронная схема алюминия
- Степень окисления алюминия
- Ионы алюминия
- Валентность Al
- Квантовые числа Al
- Энергия ионизации
- Алюминий, свойства атома, химические и физические свойства
- Алюминий, свойства атома, химические и физические свойства.
- Атом и молекула алюминия. Формула алюминия. Строение алюминия:
- Изотопы и модификации алюминия:
- Свойства алюминия (таблица): температура, плотность, давление и пр.:
Строение атома алюминия
Общие сведения о строении атома алюминия
Металл. Обозначение – Al. Порядковый номер – 13. Относительная атомная масса – 26,981 а.е.м.
Электронное строение атома алюминия
Атом алюминия состоит из положительно заряженного ядра (+13), внутри которого находится 13 протонов и 14 нейтронов. Ядро окружено тремя оболочками, по которым движутся 13 электронов.
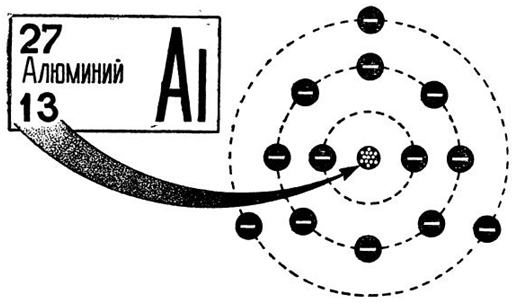
Рис. 1. Схематическое изображение строения атома алюминия.
Распределение электронов по орбиталям выглядит следующим образом:
На внешнем энергетическом уровне алюминия находится три электрона, все электроны 3-го подуровня. Энергетическая диаграмма принимает следующий вид:
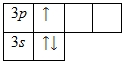
Теоретически возможно возбужденное состояние для атома алюминия за счет наличия вакантной 3d-орбитали. Однако распаривания электронов 3s-подуровня на деле не происходит.
Примеры решения задач
| Задание | Определите число элементарных частиц в атомах калия, магния, железа, цинка и аргона. |
| Ответ | Калий : Z=19, M=39. В атоме калия 19 протонов и 19 электронов. Количество нейтронов равно Z-M =39-19 = 10. |
Магний : Z=12, M=24. В атоме магния 12 протонов и 12 электронов. Количество нейтронов равно Z-M =24-12 = 12.
Железо : Z=26, M=56. В атоме железа 26 протонов и 26 электронов. Количество нейтронов равно Z-M =56-26 = 30.
Цинк : Z=30, M=65. В атоме цинка 30 протонов и 30 электронов. Количество нейтронов равно Z-M =65-30 = 25.
Аргон : Z=18, M=40. В атоме аргона 18 протонов и 18 электронов. Количество нейтронов равно Z-M =40-18 = 22.
Источник
Алюминий Al
Алюминий в таблице менделеева занимает 13 место, в 3 периоде.
| Символ | Al |
| Номер | 13 |
| Атомный вес | 26.9815385 |
| Латинское название | Aluminium |
| Русское название | Алюминий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема алюминия
Короткая запись:
Al: [Ne]3s 2 3p 1
Одинаковую электронную конфигурацию имеют атом алюминия и Si +1 , P +2 , S +3 , Cl +4
Порядок заполнения оболочек атома алюминия (Al) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Алюминий имеет 13 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
1 электрон на 3p-подуровне
Степень окисления алюминия
Атомы алюминия в соединениях имеют степени окисления 3, 1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы алюминия
Валентность Al
Атомы алюминия в соединениях проявляют валентность III, I.
Валентность алюминия характеризует способность атома Al к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Al
Квантовые числа определяются последним электроном в конфигурации, для атома Al эти числа имеют значение N = 3, L = 1, Ml = -1, Ms = ½
Видео заполнения электронной конфигурации (gif):
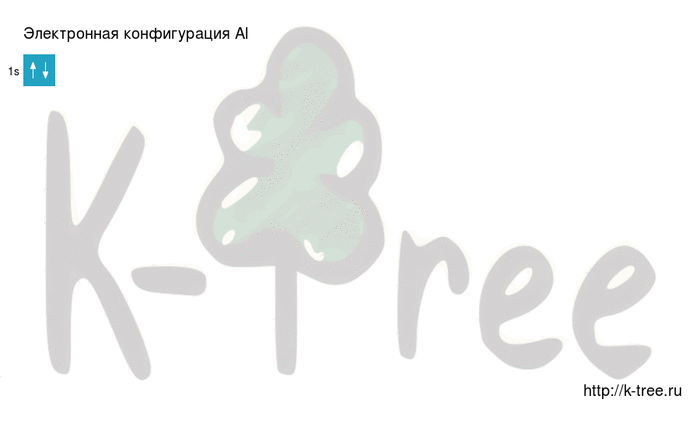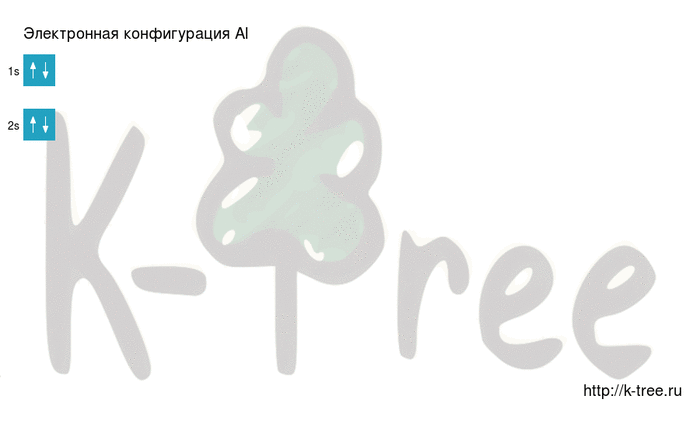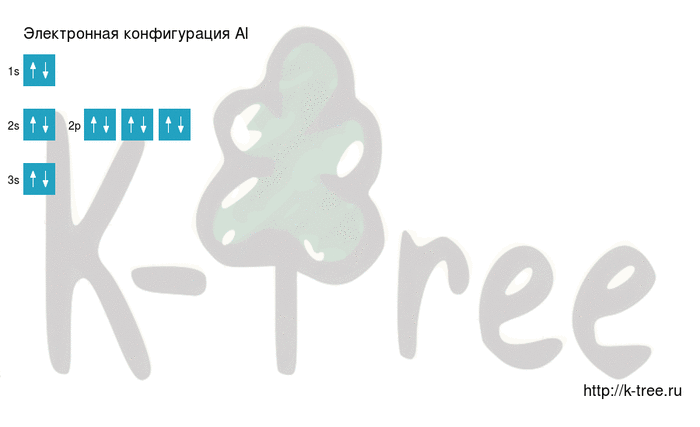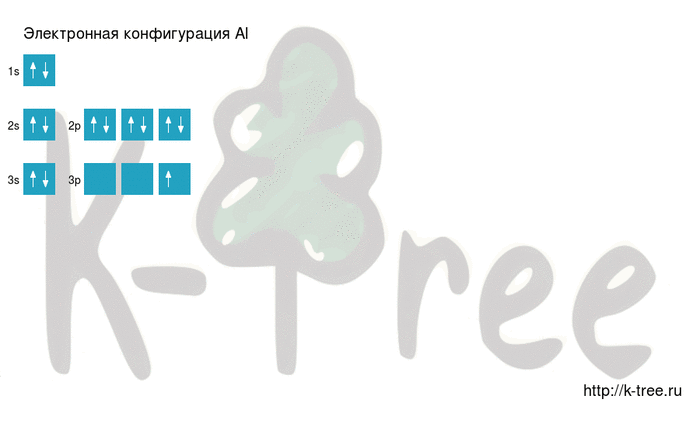
Результат: 
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Источник
Алюминий, свойства атома, химические и физические свойства
Алюминий, свойства атома, химические и физические свойства.










26,9815386(8) 1s 2 2s 2 2p 6 3s 2 3p 1
Алюминий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 13. Расположен в 13-й группе (по старой классификации — главной подгруппе третьей группы), третьем периоде периодической системы.
Физические свойства алюминия
Атом и молекула алюминия. Формула алюминия. Строение алюминия:
Алюминий (лат. Aluminium, от лат. alumen – «квасцы») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Al и атомным номером 13. Расположен в 13-й группе (по старой классификации – главной подгруппе третьей группы), третьем периоде периодической системы.
Алюминий – амфотерный металл. Относится к группе лёгких, цветных металлов.
Алюминий обозначается символом Al.
Как простое вещество алюминий при нормальных условиях представляет собой лёгкий металл серебристо-белого цвета.
Молекула алюминия одноатомна.
Химическая формула алюминия Al.
Электронная конфигурация атома алюминия 1s 2 2s 2 2p 6 3s 2 3p 1 . Потенциал ионизации (первый электрон) атома алюминия равен 577,54 кДж/моль (5,985769(3) эВ). прием алюминия
Строение атома алюминия. Атом алюминия состоит из положительно заряженного ядра (+13), вокруг которого по трем оболочкам движутся 13 электронов. При этом 10 электронов находятся на внутреннем уровне, а 3 электрона – на внешнем. Поскольку алюминий расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома алюминия находятся два спаренных – на s-орбитали и один неспаренный – на p-орбитали электроны. В свою очередь ядро атома алюминия состоит из 13 протонов и 14 нейтронов.
Радиус атома алюминия (вычисленный) составляет 118 пм.
Атомная масса атома алюминия составляет 26,9815386(8) а. е. м.
Алюминий – наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния). Концентрация алюминия в земной коре составляет 8,1 %.
Изотопы и модификации алюминия:
Свойства алюминия (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Алюминий |
| 102 | Прежнее название | |
| 103 | Латинское название | Aluminium |
| 104 | Английское название | Aluminium, Aluminum (в США и Канаде) |
| 105 | Символ | Al |
| 106 | Атомный номер (номер в таблице) | 13 |
| 107 | Тип | Металл |
| 108 | Группа | Амфотерный, лёгкий, цветной металл |
| 109 | Открыт | Ханс Кристиан Эрстед, Дания, 1825 г. |
| 110 | Год открытия | 1825 г. |
| 111 | Внешний вид и пр. | Мягкий, лёгкий и пластичный металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 8,1 % |
| 120 | Содержание в морях и океанах (по массе) | 5,0·10 -7 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,005 % |
| 122 | Содержание в Солнце (по массе) | 0,006 % |
| 123 | Содержание в метеоритах (по массе) | 0,91 % |
| 124 | Содержание в организме человека (по массе) | 0,00009 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 26,9815386(8) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 3p 1 |
| 203 | Электронная оболочка | K2 L8 M3 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 118 пм |
| 205 | Эмпирический радиус атома* | 125 пм |
| 206 | Ковалентный радиус* | 121 пм |
| 207 | Радиус иона (кристаллический) | Al 3+
(в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 184 пм |
| 209 | Электроны, Протоны, Нейтроны | 13 электронов, 13 протонов, 14 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 13-ая группа (по старой классификации – главная подгруппа 3-ей группы) |
| 213 | Эмиссионный спектр излучения |  |
| 300 | Химические свойства | |
| 301 | Степени окисления | 0, +1, +2, +3 |
| 302 | Валентность | III |
| 303 | Электроотрицательность | 1,61 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 577,54 кДж/моль (5,985769(3) эВ) |
| 305 | Электродный потенциал | Al 3+ + 3e – → Al, E o = -1,663 В |
| 306 | Энергия сродства атома к электрону | 41,762(5) кДж/моль (0,43283(5) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 2,70 г/см 3 (при 20 °C и иных стандартных условиях , состояние вещества – твердое тело),
2,375 г/см 3 (при температуре плавления 660,32 °C и иных стандартных условиях , состояние вещества – жидкость), 2,289 г/см 3 (при 1000 °C и иных стандартных условиях , состояние вещества –жидкость) |
| 402 | Температура плавления* | 660,32 °C (933,47 K, 1220,58 °F) |
| 403 | Температура кипения* | 2470 °C (2743 K, 4478 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 10,71 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 284 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,903 Дж/г·K (при 25 °C) |
| 410 | Молярная теплоёмкость* | 24,20 Дж/(K·моль) |
| 411 | Молярный объём | 10,0 см³/моль |
| 412 | Теплопроводность | 237 Вт/(м·К) (при стандартных условиях ),
237 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная
|
| 513 | Параметры решётки | 4,050 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 394 К |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7429-90-5 |
205* Эмпирический радиус атома алюминия согласно [1] и [3] составляет 143 пм.
206* Ковалентный радиус алюминия согласно [1] и [3] составляет 121±4 пм.
401* Плотность алюминия согласно [3] и [4] составляет 2,6989 г/см 3 (при 0 °C и иных стандартных условиях , состояние вещества – твердое тело) и 2,699 г/см 3 (при 20 °C и иных стандартных условиях , состояние вещества – твердое тело).
402* Температура плавления алюминия согласно [3] составляет 660 °C (933,15 K, 1220 °F).
403* Температура кипения алюминия согласно [3] составляет 2518,82 °C ( 2792 K, 4565,88 °F).
407 * Удельная теплота плавления (энтальпия плавления ΔHпл) алюминия согласно [3] и [4] составляет 10,75 кДж/моль и 10,8 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) алюминия согласно [3] и [4] составляет 284,1 кДж/моль и 293 кДж/моль соответственно.
410* Молярная теплоёмкость алюминия согласно [3] составляет 24,20 Дж/(K·моль) и 24,35 Дж/(K·моль).
Источник
Строение атома алюминия
Общие сведения о строении атома алюминия
Металл. Обозначение – Al. Порядковый номер – 13. Относительная атомная масса – 26,981 а.е.м.
Электронное строение атома алюминия
Атом алюминия состоит из положительно заряженного ядра (+13), внутри которого находится 13 протонов и 14 нейтронов. Ядро окружено тремя оболочками, по которым движутся 13 электронов.

Рис. 1. Схематическое изображение строения атома алюминия.
Распределение электронов по орбиталям выглядит следующим образом:
На внешнем энергетическом уровне алюминия находится три электрона, все электроны 3-го подуровня. Энергетическая диаграмма принимает следующий вид:

Теоретически возможно возбужденное состояние для атома алюминия за счет наличия вакантной 3d-орбитали. Однако распаривания электронов 3s-подуровня на деле не происходит.
Примеры решения задач
| Задание | Определите число элементарных частиц в атомах калия, магния, железа, цинка и аргона. |
| Ответ | Калий : Z=19, M=39. В атоме калия 19 протонов и 19 электронов. Количество нейтронов равно Z-M =39-19 = 10. |
Магний : Z=12, M=24. В атоме магния 12 протонов и 12 электронов. Количество нейтронов равно Z-M =24-12 = 12.
Железо : Z=26, M=56. В атоме железа 26 протонов и 26 электронов. Количество нейтронов равно Z-M =56-26 = 30.
Цинк : Z=30, M=65. В атоме цинка 30 протонов и 30 электронов. Количество нейтронов равно Z-M =65-30 = 25.
Аргон : Z=18, M=40. В атоме аргона 18 протонов и 18 электронов. Количество нейтронов равно Z-M =40-18 = 22.
Источник
Алюминий, свойства атома, химические и физические свойства
Алюминий, свойства атома, химические и физические свойства.










26,9815386(8) 1s 2 2s 2 2p 6 3s 2 3p 1
Алюминий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 13. Расположен в 13-й группе (по старой классификации — главной подгруппе третьей группы), третьем периоде периодической системы.
Физические свойства алюминия
Атом и молекула алюминия. Формула алюминия. Строение алюминия:
Алюминий – амфотерный металл. Относится к группе лёгких, цветных металлов.
Алюминий обозначается символом Al.
Как простое вещество алюминий при нормальных условиях представляет собой лёгкий металл серебристо-белого цвета.
Молекула алюминия одноатомна.
Химическая формула алюминия Al.
Строение атома алюминия. Атом алюминия состоит из положительно заряженного ядра (+13), вокруг которого по трем оболочкам движутся 13 электронов. При этом 10 электронов находятся на внутреннем уровне, а 3 электрона – на внешнем. Поскольку алюминий расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома алюминия находятся два спаренных – на s-орбитали и один неспаренный – на p-орбитали электроны. В свою очередь ядро атома алюминия состоит из 13 протонов и 14 нейтронов.
Радиус атома алюминия (вычисленный) составляет 118 пм.
Атомная масса атома алюминия составляет 26,9815386(8) а. е. м.
Алюминий – наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния). Концентрация алюминия в земной коре составляет 8,1 %.
Изотопы и модификации алюминия:
Свойства алюминия (таблица): температура, плотность, давление и пр.:
 204 Радиус атома (вычисленный) 118 пм 205 Эмпирический радиус атома* 125 пм 206 Ковалентный радиус* 121 пм 207 Радиус иона (кристаллический) Al 3+
204 Радиус атома (вычисленный) 118 пм 205 Эмпирический радиус атома* 125 пм 206 Ковалентный радиус* 121 пм 207 Радиус иона (кристаллический) Al 3+
2,375 г/см 3 (при температуре плавления 660,32 °C и иных стандартных условиях , состояние вещества – жидкость),
2,289 г/см 3 (при 1000 °C и иных стандартных условиях , состояние вещества –жидкость) 402 Температура плавления* 660,32 °C (933,47 K, 1220,58 °F) 403 Температура кипения* 2470 °C (2743 K, 4478 °F) 404 Температура сублимации 405 Температура разложения 406 Температура самовоспламенения смеси газа с воздухом 407 Удельная теплота плавления (энтальпия плавления ΔHпл)* 10,71 кДж/моль 408 Удельная теплота испарения (энтальпия кипения ΔHкип)* 284 кДж/моль 409 Удельная теплоемкость при постоянном давлении 0,903 Дж/г·K (при 25 °C) 410 Молярная теплоёмкость* 24,20 Дж/(K·моль) 411 Молярный объём 10,0 см³/моль 412 Теплопроводность 237 Вт/(м·К) (при стандартных условиях ),
237 Вт/(м·К) (при 300 K) 500 Кристаллическая решётка 511 Кристаллическая решётка #1 512 Структура решётки Кубическая гранецентрированная
 513 Параметры решётки 4,050 Å 514 Отношение c/a 515 Температура Дебая 394 К 516 Название пространственной группы симметрии Fm_ 3m 517 Номер пространственной группы симметрии 225 900 Дополнительные сведения 901 Номер CAS 7429-90-5
513 Параметры решётки 4,050 Å 514 Отношение c/a 515 Температура Дебая 394 К 516 Название пространственной группы симметрии Fm_ 3m 517 Номер пространственной группы симметрии 225 900 Дополнительные сведения 901 Номер CAS 7429-90-5
205* Эмпирический радиус атома алюминия согласно [1] и [3] составляет 143 пм.
206* Ковалентный радиус алюминия согласно [1] и [3] составляет 121±4 пм.
401* Плотность алюминия согласно [3] и [4] составляет 2,6989 г/см 3 (при 0 °C и иных стандартных условиях , состояние вещества – твердое тело) и 2,699 г/см 3 (при 20 °C и иных стандартных условиях , состояние вещества – твердое тело).
402* Температура плавления алюминия согласно [3] составляет 660 °C (933,15 K, 1220 °F).
403* Температура кипения алюминия согласно [3] составляет 2518,82 °C ( 2792 K, 4565,88 °F).
407 * Удельная теплота плавления (энтальпия плавления ΔHпл) алюминия согласно [3] и [4] составляет 10,75 кДж/моль и 10,8 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) алюминия согласно [3] и [4] составляет 284,1 кДж/моль и 293 кДж/моль соответственно.
410* Молярная теплоёмкость алюминия согласно [3] составляет 24,20 Дж/(K·моль) и 24,35 Дж/(K·моль).
Источник
Алюминий Al
Алюминий в таблице менделеева занимает 13 место, в 3 периоде.
| Символ | Al |
| Номер | 13 |
| Атомный вес | 26.9815385 |
| Латинское название | Aluminium |
| Русское название | Алюминий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема алюминия
Короткая запись:
Al: [Ne]3s 2 3p 1
Порядок заполнения оболочек атома алюминия (Al) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Алюминий имеет 13 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
1 электрон на 3p-подуровне
Степень окисления алюминия
Атомы алюминия в соединениях имеют степени окисления 3, 1.
Ионы алюминия
Валентность Al
Атомы алюминия в соединениях проявляют валентность III, I.
Валентность алюминия характеризует способность атома Al к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Al
Видео заполнения электронной конфигурации (gif):
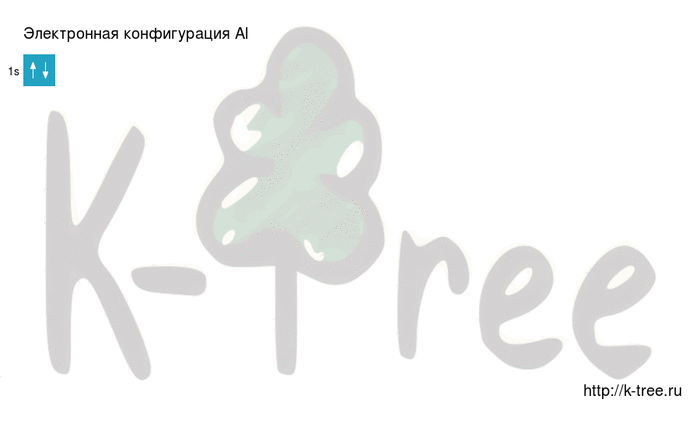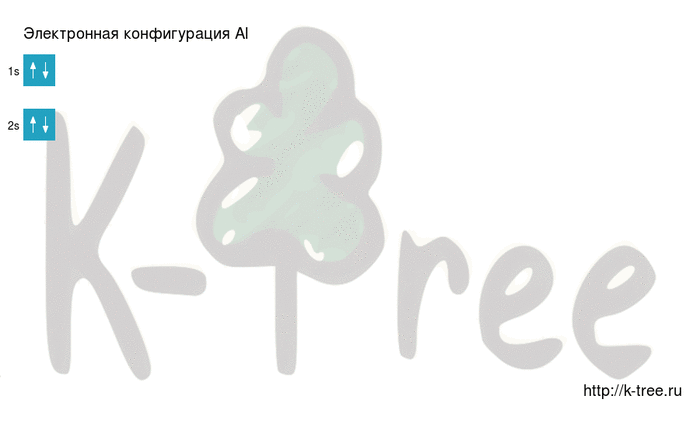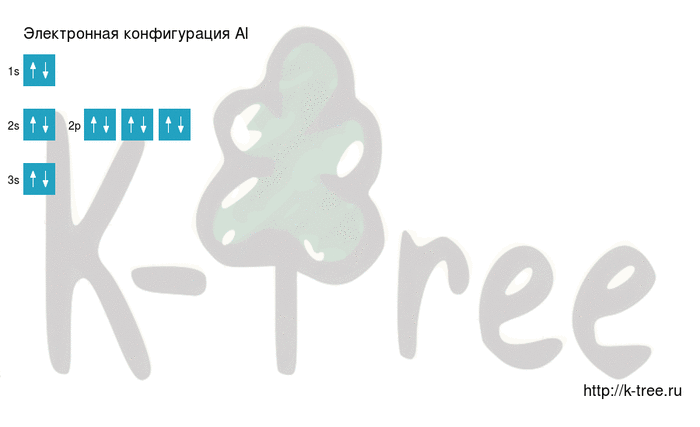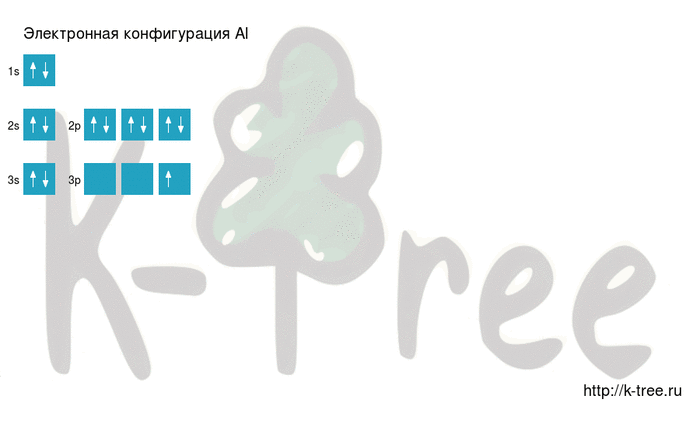
Результат: 
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Источник
Алюминий Al
Алюминий в таблице менделеева занимает 13 место, в 3 периоде.
| Символ | Al |
| Номер | 13 |
| Атомный вес | 26.9815385 |
| Латинское название | Aluminium |
| Русское название | Алюминий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема алюминия
Короткая запись:
Al: [Ne]3s 2 3p 1
Порядок заполнения оболочек атома алюминия (Al) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Алюминий имеет 13 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
1 электрон на 3p-подуровне
Степень окисления алюминия
Атомы алюминия в соединениях имеют степени окисления 3, 1.
Ионы алюминия
Валентность Al
Атомы алюминия в соединениях проявляют валентность III, I.
Валентность алюминия характеризует способность атома Al к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Al
Видео заполнения электронной конфигурации (gif):
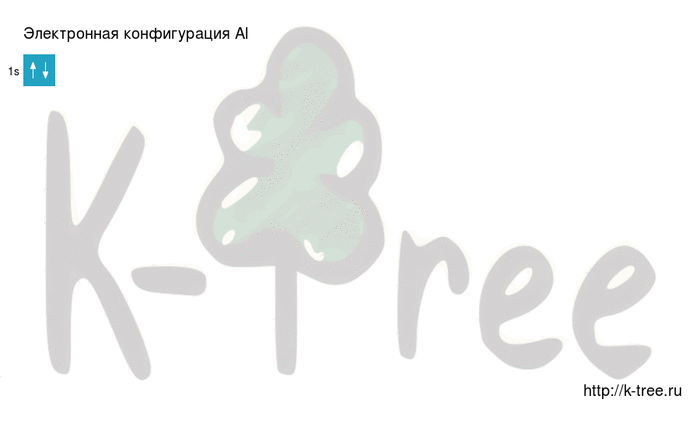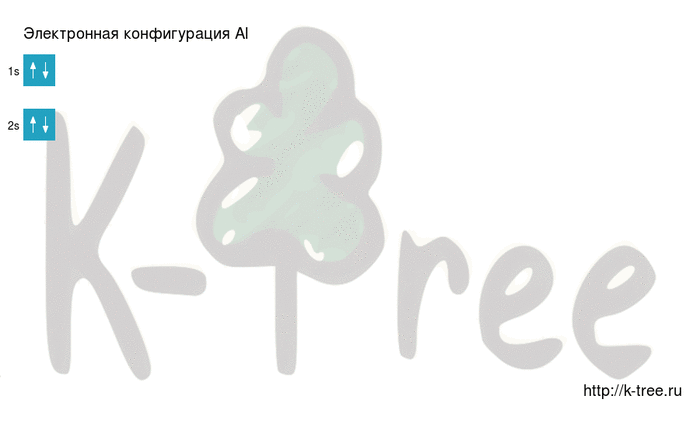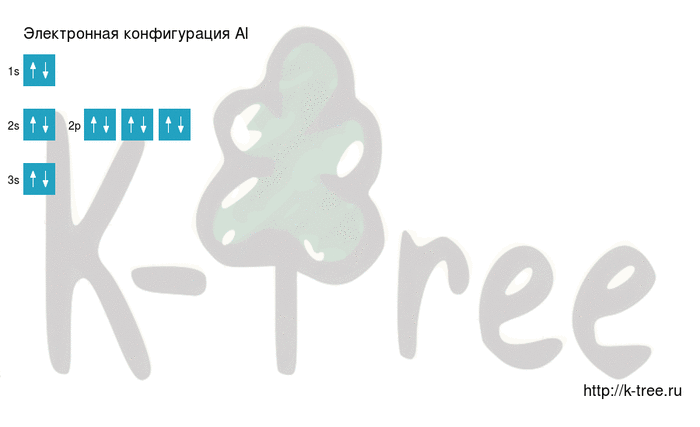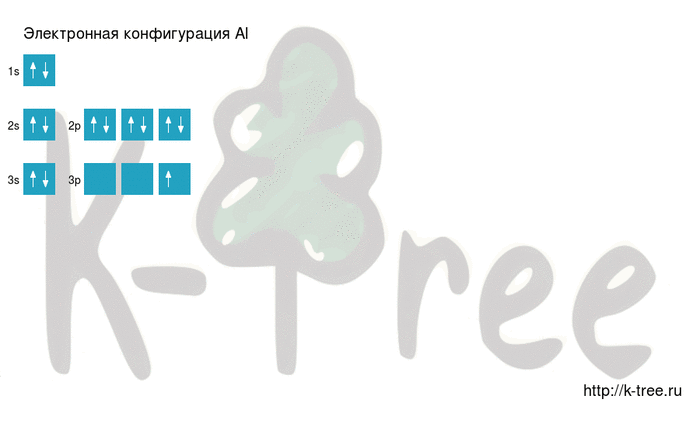
Результат: 
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Источник
Каков заряд ядра атома алюминия
Строение атома алюминия
Общие сведения о строении атома алюминия
Металл. Обозначение – Al. Порядковый номер – 13. Относительная атомная масса – 26,981 а.е.м.
Электронное строение атома алюминия
Атом алюминия состоит из положительно заряженного ядра (+13), внутри которого находится 13 протонов и 14 нейтронов. Ядро окружено тремя оболочками, по которым движутся 13 электронов.

Рис. 1. Схематическое изображение строения атома алюминия.
Распределение электронов по орбиталям выглядит следующим образом:
На внешнем энергетическом уровне алюминия находится три электрона, все электроны 3-го подуровня. Энергетическая диаграмма принимает следующий вид:

Теоретически возможно возбужденное состояние для атома алюминия за счет наличия вакантной 3d-орбитали. Однако распаривания электронов 3s-подуровня на деле не происходит.
Примеры решения задач
| Задание | Определите число элементарных частиц в атомах калия, магния, железа, цинка и аргона. |
| Ответ | Калий : Z=19, M=39. В атоме калия 19 протонов и 19 электронов. Количество нейтронов равно Z-M =39-19 = 10. |
Магний : Z=12, M=24. В атоме магния 12 протонов и 12 электронов. Количество нейтронов равно Z-M =24-12 = 12.
Железо : Z=26, M=56. В атоме железа 26 протонов и 26 электронов. Количество нейтронов равно Z-M =56-26 = 30.
Цинк : Z=30, M=65. В атоме цинка 30 протонов и 30 электронов. Количество нейтронов равно Z-M =65-30 = 25.
Аргон : Z=18, M=40. В атоме аргона 18 протонов и 18 электронов. Количество нейтронов равно Z-M =40-18 = 22.
Строение атома алюминия

Строение

Рис. 1. Алюминий в периодической таблице.
Атом элемента состоит из положительно заряженного ядра +13 (13 протонов и 14 нейронов) и трёх электронных оболочек с 13 электронами. На внешнем энергетическом уровне находится всего три электрона. В возбуждённом состоянии атом способен отдавать все три электрона, проявляя степень окисления +3, или образовывать три ковалентные связи. Поэтому алюминий имеет третью валентность.

Рис. 2. Строение атома алюминия.
В природе алюминий встречается только в составе соединений – глины, слюды, корунда. Металл ценился дороже золота до открытия промышленного способа его получения.
Свойства
Алюминий – серебристый металл, обладающий высокой электропроводностью и пластичностью. Элемент при комнатной температуре легко соединяется с кислородом, образуя на поверхности оксидную плёнку, защищающую металл от коррозии. Образование плёнки препятствует реакции с водой, концентрированными азотной и серной кислотами, поэтому алюминиевая тара подходит для перевозки этих кислот.

Для снятия оксидной плёнки используют соли аммония, горячие щёлочи, сплавы ртути. После разрушения оксидной плёнки алюминий вступает в реакцию со многими неметаллами и соединениями. Основные химические свойства элемента описаны в таблице.
Взаимодействие
Ход реакции
Только в условиях отсутствия оксидной плёнки. Образуется гидроксид алюминия
Образуется оксид алюминия
При комнатной температуре. С йодом – в присутствии катализатора
При температуре выше 200°С, образуется сульфид алюминия
При температуре 500°С, образуется фосфид алюминия
При температуре 800°С, образуется нитрид алюминия
При температуре 2000°С, образуется карбид алюминия
При комнатной температуре реагирует с разбавленными кислотами, при нагревании – с концентрированными. Образуются соли
Реагируют растворы и сплавы
Алюминий не взаимодействует с водородом.
Что мы узнали?
Каков заряд ядра атома алюминия
Протон (ядро атома водорода) движется со скоростью v = 7,7·10 8 м/с. На какое наименьшее расстояние r может приблизиться протон к ядру атома алюминия? Заряд ядра атома алюминия q = Ze, где Z — порядковый номер атома в таблице Менделеева и e — заряд протона, равный по модулю заряду электрона. Массу протона считать равной массе атома водорода. Протон и ядро атома алюминия считать точечными зарядами. Влиянием электронной оболочки атома алюминия пренебречь.

(Не рассматриваем релятивистские эффекты, систему отсчета выбираем так, чтобы существовало только электрическое поле и не существовало магнитного поля.)
Связываем систему отсчета с ядром атома алюминия, протон будет двигаться в ней со скоростью v относительно неподвижного ядра атома алюминия.
Кинетическая энергия движущегося протона

Потенциальная энергия покоящегося ядра атома алюминия

Из закона сохранения энергии

определим расстояние, на которое может приблизиться движущийся протон к покоящемуся ядру

Ответ: 
А 1 Заряд ядра атома алюминия равен1) +2;2) +13;3) +12;4) +20;
А 1 Заряд ядра атома алюминия равен
4) +20; А 2 В ряду Ca(OH)2 AI(OH)3 H2SO4свойства гидроксидов меняются от
А 3. Химическая связь в оксиде фосфора (Y)
А 4 Валентность азота в соединениях NO2 и N2O5 соответственно одинаково
А 5. К амфотерным оксидам относится вещество, формула которого
А 6. В уравнении реакции меж магнием и серной кислотой коэффициент перед формулой
А 7. Какое из указанных уравнений подходит реакции обмена
А 9. Из приведённого списка веществ: H2SO4, NaOH, CO2, H2О — с гидроксидом алюминия
А 10. Раствор серной кислоты реагирует с
А 11. Раствор гидроксида натрия реагирует с
А 12. Верны ли последующие суждения о правилах работы в химической лаборатории
А Простое вещество нельзя получить в итоге реакции соединения.
Б При физических явлениях меняется агрегатное состояние и форма
А 13. В соединении Na2SO3 окисления серы
А 14. Меньший радиус у атома
А 16. Формула хлорида меди (I)-это
А 17. 2 моль кислорода (O2) занимают объём л (н.у)
А 18. Рассредотачивание электронов по слоям 2, 8, 8.1 имеет атом
А 19. 24,5г фосфорной кислоты сочиняют моль
А 21. Ковалентная неполярная связь осуществляется в веществе
А 22. В веществе состава ЭO элемент Э это
А 23. Кислотные оксиды это
А 24. В уравнении реакции меж оксидом железа (III) и серной кислотой отношение
коэффициентов перед формулами реагирующих веществ соответственно равно
А 25. Число электронов во наружном электронном слое атома фосфора
А 26. В формуле сульфата алюминия индексы при знаке алюминия и кислотном остатке одинаковы соответственно
1) протонов, нейтронов и электронов
А 29. Массовая кислорода в воде одинакова
4) фосфат, нитрат, хлорид,
СРООЧНОООООО
Алюминий, свойства атома, химические и физические свойства
Алюминий, свойства атома, химические и физические свойства.










26,9815386(8) 1s 2 2s 2 2p 6 3s 2 3p 1
Алюминий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 13. Расположен в 13-й группе (по старой классификации — главной подгруппе третьей группы), третьем периоде периодической системы.
Физические свойства алюминия
Атом и молекула алюминия. Формула алюминия. Строение алюминия:
Алюминий (лат. Aluminium, от лат. alumen – «квасцы») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Al и атомным номером 13. Расположен в 13-й группе (по старой классификации – главной подгруппе третьей группы), третьем периоде периодической системы.
Алюминий – амфотерный металл. Относится к группе лёгких, цветных металлов.
Как простое вещество алюминий при нормальных условиях представляет собой лёгкий металл серебристо-белого цвета.
Молекула алюминия одноатомна.
Химическая формула алюминия Al.
Строение атома алюминия. Атом алюминия состоит из положительно заряженного ядра (+13), вокруг которого по трем оболочкам движутся 13 электронов. При этом 10 электронов находятся на внутреннем уровне, а 3 электрона – на внешнем. Поскольку алюминий расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома алюминия находятся два спаренных – на s-орбитали и один неспаренный – на p-орбитали электроны. В свою очередь ядро атома алюминия состоит из 13 протонов и 14 нейтронов.
Радиус атома алюминия (вычисленный) составляет 118 пм.
Атомная масса атома алюминия составляет 26,9815386(8) а. е. м.
Алюминий – наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния). Концентрация алюминия в земной коре составляет 8,1 %.
Изотопы и модификации алюминия:
Свойства алюминия (таблица): температура, плотность, давление и пр.:
 204 Радиус атома (вычисленный) 118 пм 205 Эмпирический радиус атома* 125 пм 206 Ковалентный радиус* 121 пм 207 Радиус иона (кристаллический) Al 3+
204 Радиус атома (вычисленный) 118 пм 205 Эмпирический радиус атома* 125 пм 206 Ковалентный радиус* 121 пм 207 Радиус иона (кристаллический) Al 3+
237 Вт/(м·К) (при 300 K) 500 Кристаллическая решётка 511 Кристаллическая решётка #1 512 Структура решётки Кубическая гранецентрированная
 513 Параметры решётки 4,050 Å 514 Отношение c/a 515 Температура Дебая 394 К 516 Название пространственной группы симметрии Fm_ 3m 517 Номер пространственной группы симметрии 225 900 Дополнительные сведения 901 Номер CAS 7429-90-5
513 Параметры решётки 4,050 Å 514 Отношение c/a 515 Температура Дебая 394 К 516 Название пространственной группы симметрии Fm_ 3m 517 Номер пространственной группы симметрии 225 900 Дополнительные сведения 901 Номер CAS 7429-90-5
205* Эмпирический радиус атома алюминия согласно [1] и [3] составляет 143 пм.
206* Ковалентный радиус алюминия согласно [1] и [3] составляет 121±4 пм.
402* Температура плавления алюминия согласно [3] составляет 660 °C (933,15 K, 1220 °F).
403* Температура кипения алюминия согласно [3] составляет 2518,82 °C ( 2792 K, 4565,88 °F).
407 * Удельная теплота плавления (энтальпия плавления ΔHпл) алюминия согласно [3] и [4] составляет 10,75 кДж/моль и 10,8 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) алюминия согласно [3] и [4] составляет 284,1 кДж/моль и 293 кДж/моль соответственно.
410* Молярная теплоёмкость алюминия согласно [3] составляет 24,20 Дж/(K·моль) и 24,35 Дж/(K·моль).
Источник
Размещено 3 года назад по предмету
Химия
от katena1910
чему равен заряд ядра атома алюминия?
-
Ответ на вопрос
Ответ на вопрос дан
maksimloktev92заряд ядра атома алюминия равен 13 …это написано в таблице Менделеева.
-
Ответ на вопрос
Ответ на вопрос дан
Senpoliyaзаряд ядра атома алюминия равен его порядковому номеру, т.е +13
Не тот ответ на вопрос, который вам нужен?
Найди верный ответ
Самые новые вопросы
![]()
Математика – 3 года назад
Сколько здесь прямоугольников
![]()
История – 3 года назад
Какое управление было в древнейшем риме? как звали первого и последнего из царей рима?
![]()
Литература – 3 года назад
Уроки французского ответе на вопрос : расскажите о герое по следующему примерному плану: 1.почему мальчик оказался в райцентре ? 2.как он чувствовал себя на новом месте? 3.почему он не убежал в деревню? 4.какие отношения сложились у него с товарищами? 5.почему он ввязался в игру за деньги? 6.как характеризуют его отношения с учительницей ? ответе на эти вопросы пожалуйста ! сочините сочинение пожалуйста
![]()
Русский язык – 3 года назад
Помогите решить тест по русскому языку тест по русскому языку «местоимение. разряды местоимений» для 6 класса
1. укажите личное местоимение:
1) некто
2) вас
3) ни с кем
4) собой
2. укажите относительное местоимение:
1) кто-либо
2) некоторый
3) кто
4) нам
3. укажите вопросительное местоимение:
1) кем-нибудь
2) кем
3) себе
4) никакой
4. укажите определительное местоимение:
1) наш
2) который
3) некий
4) каждый
5. укажите возвратное местоимение:
1) свой
2) чей
3) сам
4) себя
6. найдите указательное местоимение:
1) твой
2) какой
3) тот
4) их
7. найдите притяжательное местоимение:
1) самый
2) моего
3) иной
4) ничей
8. укажите неопределённое местоимение:
1) весь
2) какой-нибудь
3) любой
4) этот
9. укажите вопросительное местоимение:
1) сколько
2) кое-что
3) она
4) нами
10. в каком варианте ответа выделенное слово является притяжательным местоимением?
1) увидел их
2) её нет дома
3) её тетрадь
4) их не спросили
![]()
Русский язык – 3 года назад
Переделай союзное предложение в предложение с бессоюзной связью.
1. океан с гулом ходил за стеной чёрными горами, и вьюга крепко свистала в отяжелевших снастях, а пароход весь дрожал.
2. множество темноватых тучек, с неясно обрисованными краями, расползались по бледно-голубому небу, а довольно крепкий ветер мчался сухой непрерывной струёй, не разгоняя зноя
3. поезд ушёл быстро, и его огни скоро исчезли, а через минуту уже не было слышно шума
![]()
Русский язык – 3 года назад
помогите прошу!перепиши предложения, расставляя недостающие знаки препинания. объясни, что соединяет союз и. если в предложении один союз и, то во втором выпадающем списке отметь «прочерк».пример:«я шёл пешком и,/поражённый прелестью природы/, часто останавливался».союз и соединяет однородные члены.ночь уже ложилась на горы (1) и туман сырой (2) и холодный начал бродить по ущельям.союз и соединяет:1) части сложного предложенияоднородные члены,2) однородные членычасти сложного предложения—.поэт — трубач зовущий войско в битву (1) и прежде всех идущий в битву сам (ю. янонис).союз и соединяет:1) части сложного предложенияоднородные члены,2)
![]()
Физика – 3 года назад
Вокруг прямого проводника с током (смотри рисунок) существует магнитное поле. определи направление линий этого магнитного поля в точках a и b.обрати внимание, что точки a и b находятся с разных сторон от проводника (точка a — снизу, а точка b — сверху). рисунок ниже выбери и отметь правильный ответ среди предложенных.1. в точке a — «от нас», в точке b — «к нам» 2. в точке a — «к нам», в точке b — «от нас» 3. в обеих точках «от нас»4. в обеих точках «к нам»контрольная работа по физике.прошу,не наугад важно
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Что ты хочешь узнать?
Задай вопрос
Все науки
Русский яз.
Литература
Математика
Алгебра
Геометрия
Английский яз.
Немецкий яз.
Українська мова
Українська література
Беларуская мова
Қазақ тiлi
Французский яз.
Кыргыз тили
Оʻzbek tili
Биология
Химия
Физика
История
Окружающий мир
Обществознание
ОБЖ
География
Информатика
Экономика
Музыка
Право
МХК
Психология
Астрономия
Физкультура и спорт
Другие предметы
Сайт znanija.org не имеет отношения к другим сайтам и не является официальным сайтом компании.
- Сайт
- Главная страница
- Напиши свой вопрос
- Кабинет
- Вход в личный кабинет
- Регистрация на сайте
