Строение атома кремния


4.6
Средняя оценка: 4.6
Всего получено оценок: 216.
4.6
Средняя оценка: 4.6
Всего получено оценок: 216.
Кремний (Si) – второй по распространённости в земной коре неметалл после кислорода. В природе находится в составе соединений, в чистом виде встречается редко. Строение атома кремния определяет свойства элемента.
Строение
Кремний – 14 элемент периодической таблицы Менделеева, расположенный в третьем периоде, в IV группе. Относительная атомная масса – 28.
Ядро атома кремния содержит 14 протонов и 14 нейронов и имеет положительный заряд +14. Вокруг ядра располагается три электронные оболочки, на которых находится 14 электронов. Внешний энергетический уровень занимают четыре электрона, определяющие валентность элемента. Кремний проявляет степень окисления +2, потому что 3р-уровень имеет два неспаренных электрона. Элемент может переходить в возбуждённое состояние за счёт вакантной 3d-орбитали, проявляя степень окисления +4.
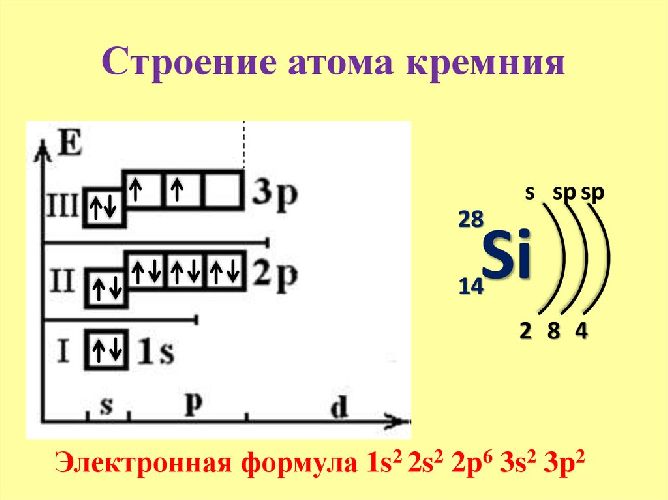
Схема строения атома кремния – 1s22s22p63s23p2 или +14 Si)2)8)4.
Физические свойства
Кремний – твёрдый тёмно-серый элемент с металлическим блеском. Является полупроводником. Имеет одну модификацию, схожую по структуре с аллотропной модификацией углерода – алмазом. Однако связи между атомами кремния не такие прочные, как между атомами углерода.

Кремний встречается в природе в составе песка, глины, кварца, силикатов. Диоксид кремния (SiO2) – песок. Получают кремний путём прокаливания песка с углеродом (углём) или металлами:
- 2C + SiO2 t˚→ Si + 2CO;
- 3SiO2 + 4Al → 3Si + 2Al2O3;
- 2Mg + SiO2 t˚→ Si + 2MgO.
Кремний используют для производства радиоэлементов, фотоэлементов, при производстве жароупорных материалов.
Химические свойства
Благодаря электронному строению кремний способен реагировать с другими элементами, принимая или отдавая электроны. В реакциях с металлами выступает в роли восстановителя, с неметаллами – окислителя. При оптимальных условиях кремний реагирует только с фтором:
Si + 2F2 → SiF4.
При нагревании реагирует:
- с кислородом (600°C) – Si + O2 → SiO2;
- с хлором (400°C) – Si + 2Cl2 → SiCl4;
- с углеродом (2000°C) – Si + C → SiC;
- с азотом (1000°C) – 3Si + 2N2 → Si3N4.
Является окислителем в реакциях с металлами:
Si + 2Mg → Mg2Si.
Может реагировать с концентрированными щелочами с выделением водорода:
Si + 2NaOH + H2O → Na2SiO3 + 2H2.
Кремний не реагирует непосредственно с водородом и кислотами, кроме плавиковой кислоты HF: Si + 6HF → H2[SiF6] + 2H2 или Si + 4HF → SiF4 + 2H2. Соединение с водородом – силан (SiH4) – получают разложением соли кислотой – Mg2Si + 2H2SO4 → SiH4 + 2MgSO4.

Что мы узнали?
Кремний – неметалл четвёртой группы периодической системы. На внешнем энергетическом уровне атома располагается четыре электрона. Имеет степень окисления +2. В природе находится в соединениях в виде глины, песка, кварца и других веществ. Существует только одна модификация кремния, схожая с алмазом. Получают кремний путём нагревания песка с углём или металлами. Реагирует элемент с неметаллами, металлами и щелочами. С водородом и кислотами (исключение – HF) не реагирует.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Александр Котков
5/5
-

Полина Шалаева
4/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 216.
А какая ваша оценка?
Лидеры категории
Лена-пена
Искусственный Интеллект
М.И.
Искусственный Интеллект
Y.Nine
Искусственный Интеллект
•••

















Тема 2 9 класс
Урок 43
Тема урока: Кремний.
Цели урока: обучающие: рассмотреть формы существования кремния как химического элемента: атомы, простые вещества и важнейшие соединения, сравнить их с соответствующими формами углерода, показать значение кремния, диоксида кремния и силикатов в природе и жизни человека.
развивающие: развивать умение анализировать данные, выявлять сущность наблюдаемых процессов, обобщать и делать выводы: уметь извлекать информацию из справочных таблиц,
наблюдаемых процессов совершенствовать навыки самооценки знаний и умений.
воспитательные: совершенствовать коммуникативные умения в ходе коллективного обсуждения, развивать умение формировать и аргументировать собственное мнение, развивать самостоятельность.
Задачи: знать особенности строения атомов кремния, их характерные свойства и свойства соединений кремния, уметь составлять уравнения реакций, решать расчётные задачи с использованием изученных понятий.
Оборудование: коллекция «Минеральные и горные породы», HCl, K2SiO3, пробирки.
Методы: словесный – беседа, рассказ
иллюстративный – демонстрация таблиц, презентация,
практический – демонстрация опытов.
Ход урока:
1. Организационная часть урока.
2.Проверка знаний учащихся.
Вопросы и задания:
-
Написать уравнение реакции устранения временной жесткости воды.
-
Написать уравнение реакции устранения постоянной жёсткости воды.
-
Качественная реакция на карбонаты и гидрокарбонаты. Записать уравнение реакции.
Фронтальный опрос.
-
Назовите тривиальное название оксида углерода(2) и оксида углерода(4).
-
В чём выражается токсическое действие угарного газа на организм человека?
-
Что такое «сухой лёд»? Как его получают и для чего используют? Как называется процесс перехода вещества из твёрдого в газообразное агрегатное состояние, минуя жидкое?
-
Что такое жёсткость воды? Перечислите виды жёсткости воды.
-
Как устранить разные виды жёсткости воды.
3. Изучение программного материала.
1. Положение атома кремния в Периодической системе химических элементов Д.И.Менделеева
и строение атома .
Кремний – это элемент жизни, как сказал академик Вернадский. Кремний, благодаря своим химическим свойствам, создаёт электрически заряженные системы. Они обладают свойством «приклеивать» на себя вирусы, болезнетворные микроорганизмы, т.е. под действием электрического притяжения все вирусы нейтрализуются. Отсюда можно сделать вывод, что все болезни возбудителей не смогли бы проявиться в организме человека,
если бы люди имели в организме достаточно кремния. Итак, кремний жизненно важный элемент.
Положение кремния в Периодической системе:
1. Химический знак – Si
2. Порядковый номер – 14
3. Атомная масса – 28,086
4. Кремний находится в IV группе, гл. подгруппе, 3 малый период.

Строение атома кремния
-
Заряд ядра атома +14
-
Состав ядра: 14 протонов и 14 нейтронов ,14 ;
-
Электронная оболочка: 2е,8е,4е
Электронная формула: +14 Si 2е; 8е;4е
+14 Si 1S2 2S22р63S23р2
Электронно-графическая формула:

Семейство – р-элемент
Важнейшие степени окисления: – 4; 0; +4.
Характер элемента – Кремний неметалл . У кремния слабее чем у углерода выражены неметаллические (окислительные ) и сильнее – металлические (восстановительные свойства).
+4 е Si0 – 4е
окислитель с Ме и Н2 восстановитель с НеМе
Mg2Si; SiH 4SiCl4
2. Кремний как простое вещество.
1) Химическая формула – Si
2) Молекулярная масса – 28,086
3) Тип химической связи – ковалентная неполярная
4) Тип структуры кристаллической решётки – атомная
Кремний может находиться в 2 -х аллотропных модификациях.
Аллотропные модификации кремния
Аморфный кремний
Кристаллический кремний
Представляет собой бурый порошок, с температурой плавления 1420 °С. , гораздо реакционно- способнее кристаллического кремния.
Твёрдое вещество, темно-серого цвета со слабым металлическим блеском, обладает тепло- и электропроводимостью, тетраэдрическая кристаллическая решётка сходство с алмазом. В отличие от углерода -хрупок и обладает полупродниковыми свойствами, так как радиус атома кремния больше радиуса атома углерода.
1) Химическая формула – Si
2) Молекулярная масса – 28,086
3) Тип хим. связи – ковалентная неполярная
4) Тип структуры кристаллической решётки – атомная
3.Физические свойства кремния.

Вывод:
Для кремния как и для углерода, характерно явление аллотропии.
4.Химические свойства кремния.
1. Реагирует с простыми веществами – неметаллами
а) с галогенами:
Si +2F2 = SiF4
Si + 2Cl2 = SiCl4
Si + 2Br2 = SiBr4
б) с кислородом (при t°)
Si + O2 = SiO2
2. Взаимодействует со сложными веществами
а) кислотами:
3Si + 12HF + 4HNO3 = 3SiF4 + 4NO + 8H2O
б) щелочами:
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Проявляет окислительные свойства:
а) с металлами:
Si + 2Mg = Mg2Si
Прямо не соединяется с водородом, как углерод и SiH4, получают косвенно, действуя на силициды кислотами или разлагая их водой.
-
Mg2Si +2H2SO4 =2MgSO4 + SiH4
Вывод: Окислительно-восстановительные свойства кремния:
1. Si0 по отношению к металлам окислитель – Si-4
2.Si0 по отношению к неметаллам восстановитель – Si+2, Si+4
5.Получение кремния.
Кремний получают как в промышленности, так и лаборатории.
Промышленный способ:
В электрических печах при высокой температуре происходит восстановление кремния из его оксида коксом (углём):
SiO2 + 2C = Si + 2CO
SiO2+ С=Si +CO2
В духовых печах при t =18000C
Лабораторный способ:
В качестве восстановителей используют магний или алюминий:
SiO2 + 2Mg = Si + 2MgO
3SiO2 + 4Al = 3Si + 2Al2O3
6.Кремний и его соединение в природе .
Кремний – это один из распространенных в земле элементов (25% массы). Главная часть находится в соединениях кремния с кислородом и др. металлами – силикатных породах.
Соединения, в состав которых входит оксид алюминия, называются алюмосиликатами. Таковы белая глина, слюда, полевой шпат. Значительная часть кремния представлена оксидом кремния (IV) – кремнезема. Окрашивание оксида кремния (IV) различными примесями образует драгоценные и полудрагоценные камни, например, изумруд, топаз, аквамарин.
Вообще в чистом виде кремний был выделен в 1811 году французским учёным Жозефом Луи Гей–Люссаком и Луи Жаком Тенаром. Название кремний произошло от латинского «silex» – кремень, но в 1834 году русский химик Герман Иванович Гесс ввел другое название – кремний.
Вывод:
-
Второй по распространенности после кислорода химический элемент
-
Земная кора на четверть состоит из соединений кремния

После кислорода это самый распространённый элемент на Земле. Однако в свободном состоянии кремний в природе не встречается. Наиболее распространённым соединением кремния является оксид кремния (IV) SiO2 – кремнезём. В природе он образует минерал кварц и многие разновидности, такие как горный хрусталь, аметист,агат, яшма, халцедон, сердолик, кварцевый песок.




Второй тип природных соединений кремния – это силикаты
( алюмосиликаты: гранит, глина, слюда.)

Оксид кремния (IV) SiO2 необходим для жизни растений и животных. Он придаёт прочность стеблям растений и защитным покровам животным.

Благодаря ему тростники, камыши и хвощи стоят крепко, как штыки, острые листья осоки режут, как ножи, стерня на скошенном поле колет, как иголки, а стебли злаков настолько крепки, что не позволяют ниве на полях ложиться от дождя и ветра. Чешуя рыб, панцири насекомых, крылья бабочек, перья птицы и шерсть животных, прочны, так как содержат кремнезём. Кремний придаёт гладкость и прочность костям человека. кремний входит и в состав низших организмов – диатомовых водорослей и радиолярий, нежнейших комочков живой материи, которые создают свои непревзойденные по красоте скелеты из кремнезёма.

7. Соединения кремния.
Кремний – (Si)
Оксид Водородное Кремниевая кислота Соли: Силикаты
кремния силан Силициды
SiO2 SiH4 H2SiO3 Na2SiO3,Mg2Si
8. Оксид кремния(IV) SiO2
Сравнение оксида углерода (IV) и оксида кремния (IV)
Признаки сравнения
CO2 – оксид углерода(4)
SiO2 – оксид кремния(4)
1) Строение
Молекулярная кристаллическая решётка
атомная кристаллическая решётка
2) физические свойства
Газ – при обычных условиях легко снижается и затвердевает. В воде растворим.
Твёрдое, тугоплавкое нелетучее вещество. В воде нерастворим.
3)Химические свойства
Оба кислотные оксиды.
1) Взаимодействуют со щелочами:
2KOH+ CO2= K2CO3+H2O 2KOH+SiO2=K2SiO3+H2O
2) Взаимодействуют основными оксидами:
CaO+CO2=CaCO3CaO+SiO2=CaSiO3
3)C водой реагирует обратимо С водой не реагирует
CO2+H2O H2CO3 SiO2+H2O=
4) Восстанавливаются магнием:
CO2+2Mg=2MgO+C SiO2+2Mg=2MgO+Si
Вывод: Взаимодействует при сплавлении со щелочами, с карбонатами, с оксидами металлов.
9. Кремниевая кислота и силикаты.
H2SiO3 – двухосновная, кислородосодержащая, слабая кислота, нерастворимая в воде.
Получение: SiO3+H2O =
Выделить в чистом виде нельзя т.к. при нагревании разлагается.
H2SiO3=SiO2+H2O.
Демонстрация опыта: (получение кремниевой кислоты)
Получают в виде студенистого осадка, действуя какой-либо кислотой на раствор силиката.
K2SiO3+2HCl=2KCl+H2SiO3
Соли кремниевой кислоты называются силикатами . Из силикатов растворимы в воде лишь соли натрия и калия (Na2SiO3 и K2SiO3). Они по внешнему виду представляют стекловидную массу и потому получили название растворимого стекла, а водные их растворы – жидкого стекла. Жидкое стекло применяется для приготовления канцелярского клея, замазок, в строительстве.
Качественная реакция на силикат-ион – взаимодействие растворов силикатов с кислотами.
10. Применение кремния.
Кремний применяется во многих отраслях промышленности:
– при производстве жаропрочных и кислотоупорных сталей
– электротехнике
– солнечных батареях.

4. Закрепление материала.
Тест:
1. Атомы кремния и углерода не различаются:
а) радиусом
б)числом электронов на внешнем уровне
в)зарядом ядра
г)электроотрицательностью
2. Наиболее распространён в земной коре.
а)кремний б)кислород в)железо г) алюминий
3. Какой из природных минералов не является соединением кремния:
а)известняк б) кварц в)гранит г)слюда.
4. Кремний вступает в реакцию с :
а) металлом, водородом, галогенами.
б) металлами, галогенами, легко растворяется в щелочах.
в)оксидами, кислотами, неметаллами.
5. Кремневую кислоту можно получить взаимодействием:
а) оксида кремния (IV) с водой
б) кремния с водой
в) силицида натрия с соляной кислотой
г) силиката калия с серной кислотой.
Верные ответы:
1) б 2)б 3)а 4)б 5)г
Ключ к оценке качества выполнения теста:
«5» – 0 ошибок
«4» – 1 ошибка
«3» – 2 ошибки.
5. Задание на дом: § 31, упр.4 (а, б)
Диоксид кремния SiO2 – кремнезем
-
Минерал кварц
-
Песок
-
Многие разновидности



Разновидности кремнезема






Силикаты
-
Алюмосиликаты: гранит, глина, слюда


Значение оксида SiO2 в природе
-
Придает прочность стеблям растений

Значение оксида SiO2 в природе
-
Придает прочность покровам животных

Значение оксида SiO2 в природе
-
Придает гладкость и прочность костям человека

Значение оксида SiO2 в природе
-
Скелеты низших живых организмов – диатомовых водорослей и радиолярий

Выразите состав минералов кремния в виде оксидов

Укажите заряд ядра атома кремния : 1) + 28 2) + 3 3) + 12 4) + 14.
Вы открыли страницу вопроса Укажите заряд ядра атома кремния : 1) + 28 2) + 3 3) + 12 4) + 14?. Он относится к категории
Химия. Уровень сложности вопроса – для учащихся 10 – 11 классов.
Удобный и простой интерфейс сайта поможет найти максимально исчерпывающие
ответы по интересующей теме. Чтобы получить наиболее развернутый ответ,
можно просмотреть другие, похожие вопросы в категории Химия,
воспользовавшись поисковой системой, или ознакомиться с ответами других
пользователей. Для расширения границ поиска создайте новый вопрос, используя
ключевые слова. Введите его в строку, нажав кнопку вверху.
Опубликовано 3 года назад по предмету
Химия
от nad4
Составьте электронную формулу атома кремния и определите заряд ядра и число электронов протонов нейтронов
-
Ответ
Ответ дан
BarankarankaSi
1s2 2s2 2p6 3s2 3p2
e- 14 2+2+6+2+2
p+ 14 ( атомный номер)
n 0 ( 28(масса) -14(число протонов) )=14
Самые новые вопросы
![]()
Математика – 3 года назад
Решите уравнения:
а) 15 4 ∕19 + x + 3 17∕19 = 21 2∕19;
б) 6,7x – 5,21 = 9,54
![]()
Информатика – 3 года назад
Помогите решить задачи на паскаль.1)
дан массив случайных чисел (количество элементов
вводите с клавиатуры). найти произведение всех элементов массива.2)
дан массив случайных чисел (количество элементов
вводите с клавиатуры). найти сумму четных элементов массива.3)
дан массив случайных чисел (количество элементов
вводите с клавиатуры). найти максимальный элемент массива.4)
дан массив случайных чисел (количество элементов
вводите с клавиатуры). найти максимальный элемент массива среди элементов,
кратных 3.
![]()
География – 3 года назад
Почему япония – лидер по выплавке стали?
![]()
Математика – 3 года назад
Чему равно: 1*(умножить)х? 0*х?
![]()
Русский язык – 3 года назад
В каком из предложений пропущена одна (только одна!) запятая?1.она снова умолкла, точно некий внутренний голос приказал ей замолчать и посмотрела в зал. 2.и он понял: вот что неожиданно пришло к нему, и теперь останется с ним, и уже никогда его не покинет. 3.и оба мы немножко удовлетворим свое любопытство.4.впрочем, он и сам только еле передвигал ноги, а тело его совсем застыло и было холодное, как камень. 5.по небу потянулись облака, и луна померкла.
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
