Согласно протонно-нейтронной модели строения атомного ядра, заряд ядра должен быть равен сумме зарядов всех протонов, которые входят в его состав. Так как заряд протона равен элементарному заряду, то можно считать, что:
(q) — заряд ядра,
(e) — элементарный заряд,
()
Z
() — количество протонов в ядре.
Количество протонов в ядре
Z
называется зарядовым числом атомного ядра.
Экспериментально было доказано, что число Z совпадает с порядковым номером химического элемента в Периодической системе Менделеева.
Обрати внимание!
Количество протонов в ядре атома совпадает с номером химического элемента в Периодической системе химических элементов и называется зарядовым числом (
Z
).
Массовое число
Количество нейтронов в ядре атома принято обозначать N. Тогда количество протонов и нейтронов в ядре атома можно вычислить как:
A=Z+N.
— количество нуклонов в атоме называется массовым числом.
Изотопы
Химические свойства атома определяются зарядовым числом, так как это число указывает на номер атома в периодической системе, т. е. определяет, какой именно это химический элемент. Физические свойства атома могут быть разными в зависимости от массового числа. Действительно, экспериментально было доказано, что ядра одного и того же химического элемента могут обладать разными массами. Например, в природе существует несколько видов атомов водорода: водород, дейтерий и тритий. Масса дейтерия приблизительно в два, а трития — в три раза больше массы водорода.
Атомы одного и того же химического элемента, но с разными массами, называются изотопами.
Так как изотопы — это атомы одного и того же химического элемента, то зарядовое число у изотопов одинаковое, а массовые числа различные. Это означает, что ядра изотопов содержат одинаковое число протонов и разное количество нейтронов.
Изотопы принято обозначать:
XZA, где
XZA — химический элемент,
A — массовое число,
Z — зарядовое число.
Пример:
— водород,
H12
— дейтерий,
H13
— тритий.

Значение верхних и нижних индексов в атомных номерах. Атомный номер химического элемента — это число протонов, и, соответственно, общий положительный заряд его атомного ядра.
Заря́довое число́ атомного ядра (синонимы: а́томный но́мер, а́томное число́, поря́дковый но́мер химического элемента) — количество протонов в атомном ядре. Зарядовое число равно заряду ядра в единицах элементарного заряда и одновременно равно порядковому номеру соответствующего ядра химического элемента в таблице Менделеева. Обычно обозначается буквой Z[⇨].
Термин «атомный» или «порядковый» номер обычно используется в атомной физике и в химии, тогда как эквивалентный термин «зарядовое число» — в ядерной физике. В неионизированном атоме количество электронов в электронных оболочках совпадает с зарядовым числом.
Ядра с одинаковым зарядовым числом, но различным массовым числом A (которое равно сумме числа протонов Z и числа нейтронов N) являются различными изотопами одного и того же химического элемента, поскольку именно заряд ядра определяет структуру электронной оболочки атома и, следовательно, его химические свойства. Более трёх четвертей химических элементов существует в природе в виде смеси изотопов (см. Моноизотопный элемент), и средняя изотопная масса изотопной смеси элемента (называемая относительной атомной массой) в определённой среде на Земле определяет стандартную атомную массу элемента (ранее использовалось название «атомный вес»). Исторически именно эти атомные веса элементов (по сравнению с водородом) были величинами, которые измеряли химики в XIX веке.
Поскольку протоны и нейтроны имеют приблизительно одинаковую массу (масса электронов пренебрежимо мала по сравнению с их массой), а дефект массы нуклонного связывания всегда мал по сравнению с массой нуклона, значение атомной массы любого атома, выраженной в атомных единицах массы, находится в пределах 1 % от целого числа А.
История[править | править код]
Периодическая таблица и порядковые номера для каждого элемента[править | править код]

Поиски основы естественной классификации и систематизации химических элементов, основанной на связи их физических и химических свойств с атомным весом, предпринимались на протяжении длительного времени. В 1860-х годах появился ряд работ, связывающих эти характеристики — спираль Шанкуртуа, таблица Ньюлендса, таблицы Одлинга и Мейера, но ни одна из них не давала однозначного исчерпывающего описания закономерности. Сделать это удалось русскому химику Д. И. Менделееву. 6 марта 1869 года (18 марта 1869 года) на заседании Русского химического общества было зачитано сообщение Менделеева об открытии им Периодического закона химических элементов[1], а вскоре его статья «Соотношение свойств с атомным весом элементов» была опубликована в «Журнале Русского физико-химического общества»[2]. В том же году вышло первое издание учебника Менделеева «Основы химии», где была приведена его периодическая таблица. В статье, датированной 29 ноября 1870 года (11 декабря 1870 года), опубликованной в «Журнале Русского химического общества» под названием «Естественная система элементов и применение её к указанию свойств неоткрытых элементов», Менделеев впервые употребил термин «периодический закон» и указал на существование нескольких не открытых ещё элементов[3].
В своих работах Менделеев расположил элементы в порядке их атомных весов, но при этом сознательно допустил отклонение от этого правила, поместив теллур (атомный вес 127,6) впереди иода (атомный вес 126,9)[4], объясняя это химическими свойствами элементов. Такое размещение элементов правомерно с учётом их зарядового числа Z, которое было неизвестно Менделееву. Последующее развитие атомной химии подтвердило правильность догадки учёного.
Модели атома Резерфорда-Бора и Ван ден Брука[править | править код]
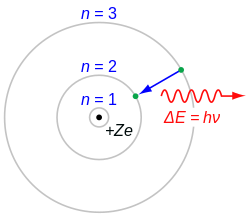
Модель Резерфорда — Бора для атома водорода (Z = 1) или водородоподобного иона (Z > 1). В этой модели энергия фотона (или частота электромагнитного излучения), испускаемого электроном при перемещении с одной орбиты на другую, пропорциональна квадрату величины атомного заряда (
Z2). Британский физик Генри Мозли экспериментально подтвердил, что закономерность, предсказанная Бором, выполняется для многих элементов (от Z = 13 до 92)
В 1911 году британский физик Эрнест Резерфорд предложил модель атома, согласно которой в центре атома расположено ядро, содержащее б́ольшую часть массы атома и положительный заряд, который в единицах заряда электрона должен был быть равен примерно половине атомного веса атома, выраженного в числе атомов водорода. Резерфорд сформулировал свою модель на основе данных об атоме золота (Z = 79, A = 197), и, таким образом, получалось, что у золота должен быть заряд ядра около 100 (в то время как порядковый номер золота в периодической таблице 79). Через месяц после выхода статьи Резерфорда голландский физик-любитель Антониус ван ден Брук впервые предположил, что заряд ядра и число электронов в атоме должны быть точно равны его порядковому номеру в периодической таблице (он же — атомный номер, обозначаемый Z). Эта гипотеза в конечном счёте подтвердилась.
Но с точки зрения классической электродинамики, в модели Резерфорда электрон, двигаясь вокруг ядра, должен был бы излучать энергию непрерывно и очень быстро и, потеряв её, упасть на ядро. Чтобы разрешить эту проблему, в 1913 году датский физик Нильс Бор предложил свою модель атома. Бор ввёл допущение, что электроны в атоме могут двигаться только по определённым (стационарным) орбитам, находясь на которых, они не излучают энергию, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. При этом стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка[5]: 
Эксперименты Мозли 1913 года и «пропавшие» химические элементы[править | править код]
В 1913 году британский химик Генри Мозли после дискуссии с Н.Бором решил проверить гипотезы Ван ден Брука и Бора на эксперименте[6]. Для этого Мозли измерил длины волн спектральных линий фотонных переходов (линии K и L) в атомах алюминия (Z = 13) и золота (Z = 79), использовавшихся в качестве серии мишеней внутри рентгеновской трубки[7]. Квадратный корень частоты этих фотонов (рентгеновских лучей) увеличивался от одной цели к другой в арифметической прогрессии. Это привело Мозли к заключению (закон Мозли), что значение атомного номера почти соответствует (в работе Мозли — со смещением на одну единицу для K-линий) вычисленному электрическому заряду ядра, то есть величине Z. Среди прочего эксперименты Мозли продемонстрировали, что ряд лантаноидов (от лантана до лютеция включительно) должен содержать ровно 15 элементов — не меньше и не больше, что было далеко не очевидно для химиков того времени.
После смерти Мозли в 1915 году его методом были исследованы атомные номера всех известных элементов от водорода до урана (Z = 92). Было обнаружено, что в периодической таблице отсутствуют семь химических элементов (с Z < 92), которые были идентифицированы как ещё не открытые, с атомными номерами 43, 61, 72, 75, 85, 87 и 91[8]. Все эти семь «пропавших» элементов были обнаружены в период с 1918 по 1947 год: технеций (Z = 43), прометий (Z = 61), гафний (Z = 72), рений (Z = 75), астат (Z = 85), франций (Z = 87) и протактиний (Z = 91)[8]. К этому времени также были обнаружены первые четыре трансурановых элемента, поэтому периодическая таблица была заполнена без пробелов до кюрия (Z = 96).
Протон и гипотеза «ядерных электронов»[править | править код]

К 1915 году в научном сообществе сложилось понимание того факта, что зарядовые числа Z, они же — порядковые номера элементов, должны быть кратны величине заряда ядра атома водорода, но не было объяснения причин этого. Сформулированная ещё в 1816 году гипотеза Праута предполагала, что водород является некоей первичной материей, из которой путём своего рода конденсации образовались атомы всех других элементов и, следовательно, атомные веса всех элементов, равно как и заряды их ядер, должны измеряться целыми числами. Но в 1907 году опыты Резерфорда и Ройдса[en] показали, что альфа-частицы с зарядом +2 являются ядрами атомов гелия, масса которых превышает массу водорода в четыре, а не в два раза. Если гипотеза Праута верна, то что-то должно было нейтрализовать заряды ядер водорода, присутствующие в ядрах более тяжёлых атомов.
В 1917 году (в экспериментах, результаты которых были опубликованы в 1919 и 1925 годах), Резерфорд доказал, что ядро водорода присутствует в других ядрах; этот результат обычно интерпретируют как открытие протонов[9]. Эти эксперименты начались после того, как Резерфорд заметил, что, когда альфа-частицы были выброшены в воздух (в основном состоящий из азота), детекторы зафиксировали следы типичных ядер водорода. После экспериментов Резерфорд проследил реакцию на азот в воздухе и обнаружил, что когда альфа-частицы вводятся в чистый газообразный азот, эффект оказывается больше. В 1919 году Резерфорд предположил, что альфа-частица выбила протон из азота, превратив его в углерод. После наблюдения изображений камеры Блэкетта в 1925 году Резерфорд понял, что произошло обратное: после захвата альфа-частицы протон выбрасывается, поэтому тяжёлый кислород, а не углерод, является конечным результатом, то есть Z не уменьшается, а увеличивается. Это была первая описанная ядерная реакция: 14N + α → 17O + p.
Резерфорд назвал новые тяжёлые ядерные частицы протонами в 1920 году (предлагались альтернативные названия — «прутоны» и «протилы»). Из работ Мозли следовало, что ядра тяжёлых атомов имеют более чем вдвое большую массу, чем можно было бы ожидать при условии, что они состоят только из ядер водорода, и поэтому требовалось объяснение для «нейтрализации» предполагаемых дополнительных протонов, присутствующих во всех тяжелых ядрах. В связи с этим была выдвинута гипотеза о так называемых «ядерных электронах». Так, предполагалось, что ядро гелия состоит из четырёх протонов и двух «ядерных электронов», нейтрализующих заряд двух протонов. В случае золота с атомной массой 197 и зарядом 79, ранее рассмотренном Резерфордом, предполагалось, что ядро атома золота содержит 118 этих «ядерных электронов».
Открытие нейтрона и его значение[править | править код]
Несостоятельность гипотезы «ядерных электронов» стала очевидной после открытия нейтрона[en] Джеймсом Чедвиком в 1932 году[10]. Наличие нейтронов в ядрах атомов легко объясняло расхождение между атомным весом и зарядным числом атома: так, в атоме золота содержится 118 нейтронов, а не 118 ядерных электронов, а положительный заряд ядра полностью состоит из 79 протонов. Таким образом, после 1932 года атомный номер элемента Z стал рассматриваться как число протонов в его ядре.
Символ Z[править | править код]
Зарядовое число обычно обозначается буквой Z, от нем. atomzahl — «атомное число», «атомный номер»[11]
Условный символ Z, вероятно, происходит от немецкого слова Atomzahl (атомный номер)[12], обозначающего число, которое ранее просто обозначало порядковое место элемента в периодической таблице и которое приблизительно (но не точно) соответствовало порядку элементов по возрастанию их атомных весов. Только после 1915 года, когда было доказано, что число Z является также величиной заряда ядра и физической характеристикой атома, немецкое слово Atomzahl (и его английский эквивалент англ. Atomic number) стали широко использоваться в этом контексте.
Химические свойства[править | править код]
Каждый элемент обладает определённым набором химических свойств как следствие количества электронов, присутствующих в нейтральном атоме, которое представляет собой Z (атомный номер). Конфигурация электронов в атоме следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим его химические связи. Следовательно, только атомный номер определяет химические свойства элемента, и именно поэтому элемент может быть определён как состоящий из любой смеси атомов с данным атомным номером.
Новые элементы[править | править код]
При поиске новых элементов исследователи руководствуются представлениями об зарядовых числах этих элементов. По состоянию на конец 2019 года были обнаружены все элементы с зарядовыми числами от 1 до 118. Синтез новых элементов осуществляется путем бомбардировки атомов-мишеней тяжёлых элементов ионами таким образом, что сумма зарядовых чисел атома-мишени и иона-«снаряда» равна зарядовому числу создаваемого элемента. Как правило, период полураспада элемента становится короче с увеличением атомного номера, хотя для неизученных изотопов с определённым числом протонов и нейтронов могут существовать так называемые «острова стабильности»[13].
См. также[править | править код]
- Атомная теория
- Гипотеза Праута
- Химический элемент
- Периодическая таблица химических элементов
- Список химических элементов
Примечания[править | править код]
- ↑ Трифонов Д. Н. Несостоявшееся выступление Менделеева (6 (18) марта 1869 г.) Архивная копия от 18 марта 2014 на Wayback Machine // Химия, № 04 (699), 16-28.02.2006
- ↑ Менделеев Д. И. Соотношение свойств с атомным весом элементов // Журнал Русского химического общества. — 1869. — Т. I. — С. 60—77. Архивировано 18 марта 2014 года.
- ↑ Менделеев Д. И. Естественная система элементов и применение её к указанию свойств неоткрытых элементов // Журнал Русского химического общества. — 1871. — Т. III. — С. 25—56. Архивировано 17 марта 2014 года.
- ↑ Периодический закон химических элементов // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 185. — ISBN 5-7155-0292-6.
- ↑ Планетарная модель атома. Постулаты Бора Архивная копия от 21 февраля 2009 на Wayback Machine на Портале Естественных Наук Архивная копия от 26 ноября 2009 на Wayback Machine
- ↑ Ordering the Elements in the Periodic Table Архивная копия от 4 марта 2016 на Wayback Machine, Royal Chemical Society
- ↑ Moseley H. G. J. XCIII. The high-frequency spectra of the elements (англ.) // Philosophical Magazine, Series 6. — 1913. — Vol. 26, no. 156. — P. 1024. — doi:10.1080/14786441308635052. Архивировано 22 января 2010 года.
- ↑ 1 2 Scerri E. A tale of seven elements (англ.). — Oxford University Press, 2013. — P. 47. — ISBN 978-0-19-539131-2.
- ↑ Petrucci R. H., Harwood W. S., Herring F. G. General Chemistry (англ.). — 8th ed.. — Upper Saddle River, N.J.: Prentice Hall, 2002. — P. 41.
- ↑ Chadwick J. Existence of a Neutron (англ.) // Proceedings of the Royal Society A. — 1932. — Vol. 136, no. 830. — P. 692—708. — doi:10.1098/rspa.1932.0112. — Bibcode: 1932RSPSA.136..692C.
- ↑ General Chemistry Online: FAQ: Atoms, elements, and ions: Why is atomic number called “Z”? Why is mass number called “A”? antoine.frostburg.edu. Дата обращения: 8 марта 2019. Архивировано 16 января 2000 года.
- ↑ Origin of symbol Z Архивная копия от 16 января 2000 на Wayback Machine. frostburg.edu
- ↑ Остров Стабильности за пределами таблицы Менделеева. Дата обращения: 29 ноября 2019. Архивировано 21 ноября 2018 года.
- Подробности
- Обновлено 18.06.2019 18:07
- Просмотров: 361
1. Как называются протоны и нейтроны вместе?
Протоны и нейтроны называются нуклонами.
То есть атомные ядра состоят из нуклонов.
В 1932 году Д.Д. Иваненко и В. Гейзенберг предложили протонно-нейтронную модель строения ядер.
2. Что называется массовым числом и какой буквой оно обозначается?
Массовым числом называется общее число нуклонов в ядре атома.
Массовое число численно равно массе ядра, выраженной в атомных единицах массы и округлённой до целых чисел.
Массовое число обозначается буквой А.
3. Что можно сказать о числовом значении массы атома (в а.е.м.) и его массовом числе?
Массовое число равно с точностью до целых (поскольку масса каждого нуклона примерно равна 1 а.е.м.) числу атомных единиц массы, содержащихся в массе атома.
2. Что называется зарядовым числом и какой буквой оно обозначается?
Зарядовым числом называется число протонов в ядре.
Зарядовое число численно равно заряду ядра, выраженному в элементарных электрических зарядах.
(Заряд каждого протона равен элементарному электрическому заряду. )
Зарядовое число обозначается буквой Z.
Для каждого химического элемента зарядовое число равно атомному (порядковому) номеру в таблице Д. И. Менделеева.
4. Как называется и какой буквой обозначается число протонов в ядре?
Число протонов в атоме обозначается буквой Z и называется зарядовым числом.
5. Что можно сказать о зарядовом числе, заряде ядра (выраженном в элементарных электрических зарядах) и порядковом номере в таблице Д. И. Менделеева для любого химического элемента?
Зарядовое число равно заряду ядра, выраженному в элементарных электрических зарядах.
Зарядовое число атома равно его порядковому номеру в таблице Менделеева.
6. Как в общем виде принято обозначать ядро любого химического элемента?
Ядро любого химического элемента в общем виде обозначается ![]() .
.
где Х – символ химического элемента.
7. Какой буквой обозначают число нейтронов в ядре?
Число нейтронов в ядре обозначают буквой N.
8. Какой формулой связаны между собой массовое число, зарядовое число и число нейтронов в ядре?
A = Z + N
где
A – массовое число или иначе общее число протонов и нейтронов в ядре,
Z – зарядовое число или иначе число протонов ядре,
N – число нейтронов в ядре.
9. Как с точки зрения протонно нейтронной модели ядра объясняется существование ядер с одинаковыми зарядами и различными массами?
У одного и того же химического элемента встречаются атомы с различными по массе ядрами.
Такие атомы
называются изотопами.
Атомы изотопов имеют одинаковый заряд и поэтому один и тот же порядковый номер в таблице Д. И. Менделеева.
Изотопы — это разновидности одного химического элемента, различающиеся по массе атомных ядер
Ядра изотопов содержат одинаковое число протонов, но различное число нейтронов.
Например:
Существует три изотопа водорода: протий, дейтерий и тритий.
Ядро протия вообще не имеет нейтронов – оно состоит из 1 протона.
Ядро дейтерия состоит из двух частицы: 1 протон и 1 нейтрон.
Ядро трития состоит из трёх частиц: 1 протон и 2 нейтрона.
Следующая страница – смотреть
Назад в “Оглавление” – смотреть
Атомная физика на ОГЭ. Вся теория и разбор заданий от преподавателя MAXIMUM
06.02.2021
19044
Атомная физика — один из труднейших разделов экзамена, а задания по этой теме кочуют из варианта в вариант каждый год. Не пугаемся! Для решения заданий ОГЭ на радиоактивность, распады и ядерные реакции нужно знать лишь самые базовые понятия. Из этой статьи вы узнаете все необходимое — атомная физика на ОГЭ обязательно вам покорится!
В этой статье:
Какие частицы необходимо помнить для сдачи ОГЭКакие ядерные распады нужно знатьАльфа-распадИзотопыБета-распадГамма-распадЯдерные реакцииАтомная физика на ОГЭ: что нужно запомнить

Какие частицы необходимо помнить для сдачи ОГЭ
Чтобы перейти к практике и научиться решать хитрые задания, сначала нужно вспомнить теорию, связанную с ними.
Вспомним, что химические элементы обозначаются в виде , где
- X – название химического элемента
- А – массовое число, равное сумме протонов и нейтронов
- Z – зарядовое число, равное числу протонов в ядре
Давайте раз и навсегда узнаем, что скрывается за числами рядом с названием каждого элемента. Рассмотрим пример углерода:
- 6 — это порядковый номер и зарядовое число Z. Таким образом, в ядре атома углерода 6 протонов. Z=6.
- 12,011 — это атомная масса. Мы будем его округлять до 12 и называть массовым числом A, то есть суммой протонов и нейтронов. A=12.
- Получается, в ядре атома углерода 6 протонов и 6 нейтронов.
Какие ядерные распады нужно знать
На ОГЭ часто встречаются три типа распадов: альфа, бета и гамма.
Альфа-распад
α-распад — испускание ядром альфа-частицы. Что это такое? Все просто — так называют ядро атома гелия, то есть частицу из двух протонов и двух нейтронов.
- У нас был элемент X с массовым числом A и с зарядовым числом Z
- Атом испускает альфа-частицу с массовым числом=4 и зарядовым числом=2
- Мы получаем новый элемент с массовым числом=A-4 и зарядовым числом=Z-2
В α-распаде заряд уменьшается на 2, а масса уменьшается на 4.
Самостоятельно подготовиться к ОГЭ непросто. На то, чтобы разобраться со всеми темами, понадобится много времени. Но и это не решит проблему! Например, если вы запомнили какое-то решение из интернета, а оно оказалось неправильным, можно на пустом месте потерять баллы. Если хотите научиться решать все задания ОГЭ по физике, обратите внимание на онлайн-курсы MAXIMUM! Наши специалисты уже проанализировали сотни вариантов ОГЭ и подготовили для вас вас максимально полезные занятия.
Приходите к нам на пробный урок! Вы узнаете всю структуру ОГЭ-2021, разберете сложные задания из первой части, получите полезные рекомендации и узнаете, как устроена подготовка к экзаменам в MAXIMUM. Все это абсолютно бесплатно!
Задача 1
Используя фрагмент Периодической системы элементов Д.И. Менделеева, представленный на рисунке, определите, какое ядро образуется в результате α-распада ядра нептуния-237.
Разбор
- Как мы говорили чуть выше, порядковый номер элемента — это, по совместительству, зарядовое число. То есть, количество протонов. Получается, в Нептунии 93 протона.
- У α-частицы количество протонов = 2.
- Посчитаем, чему равно зарядовое число нашего нового элемента: зарядовое число = 93-2 = 91. Взглянув на табличку, находим элемент под номером 91 — Протактиний.
Ответ: 1) Ядро протактиния
Изотопы
Теперь давай обратим внимание на массовые числа нептуния и протактиния. Отличаются ли они на массовое число альфа-частицы — на 4?
237-231=6
Время бить тревогу! Неужели мы что-то напутали и решили задачу неверно? Но нет, оказывается, мы все сделали правильно — ведь у протактиния более 15 изотопов.
Изотопы — это разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковое зарядовое число, но разные массовые числа.
Например, изотопы азота:
и
Задача 2
Ядро тория превратилось в ядро радия
. Какую частицу испустило при этом ядро тория?
- нейтрон
- протон
- альфа-частицу
- бета-частицу
Разбор
- Сверху находится массовое число — масса частицы. Вычтем из массы Тория массу Радия: 230-226=4. Получили массу неизвестной частицы.
- Снизу находится зарядовое число — это заряд неизвестной частицы. Вычтем из заряда Тория заряд Радия: 90-88=2. Получили заряд неизвестной частицы.
- Итого: массовое число = 4. Зарядовое число = 2
- Взглянем на табличку самых распространенных частиц.
Вуаля! Наша незнакомка — это альфа-частица — частица с двумя протонами и двумя нейтронами.
Ответ: 3) альфа-частица
https://blog.maximumtest.ru/post/oge-po-fizike-2021-struktura-i-izmeneniya.html
Бета-распад
β-распад — испускание ядром бета-частицы. Бета-частицей называют электрон. Посмотрим в списке основных частиц наверху, чему равны массовое и зарядовое число бета-частицы (электрона).
- У нас был элемент X с массовым числом A и с зарядовым числом Z
- Атом испускает бета-частицу с массовым числом=0 и зарядовым числом=-1
- Мы получаем новый элемент с прежним массовым числом=A и зарядовым числом=Z+1
В β-распаде заряд увеличивается на 1, а масса не меняется.
Задача 3
Изотоп криптона в результате серии распадов превратился изотоп молибдена . Сколько β-частиц было испущено в этой серии распадов?
Разбор
- Обозначим количество испущенных β-частиц за N
- Зарядовое число криптона до серии β-распадов равнялось 36
- Зарядовое число молибдена после серии β-распадов 42
- Тогда 42-36=6 β распадов
Ответ: было испущено 6 β распадов
Задача 4
Радиоактивный атом превратился в атом
в результате цепочки альфа- и бета-распадов. Чему было равно число альфа- и бета-распадов?
Разбор
Эта задача требует максимальной концентрации — многие школьники ее решают неверно. Давайте разберем правильный подход к этой задаче.
- Для начала рассмотрим альфа-распады
- Добьемся, чтобы массовое число изменилось с 232 до 208. Для этого производим альфа-распады, вычитая 4 из массового числа и 2 из зарядового числа.
- Получили элемент с массовым числом=208 и зарядовым числом=78. Для этого мы произвели 6 альфа распадов.
- Теперь перейдем к бета-распадам. Бета-распады влияют только на зарядовое число.
- Добьемся того, чтобы зарядовое число изменилось с 78 до 82.
- Получили элемент с массовым числом = 208 и зарядовым числом = 82. Для этого мы произвели 4 бета распада.
Ответ: 6 альфа распадов и 4 бета распада.
Гамма-распад
γ-частицы — это излучение, а γ-распад — испускание ядром гамма-излучения. Пожалуй, это самый простой распад, потому что он ничего не меняет.
Элемент X до распада и элемент Y после распада — это одно и то же.
На ОГЭ ученики часто попадают в ловушки экзамена, считая, что γ-излучение меняет элемент. Но это совсем не так! Какой элемент был до гамма-распада, такой и останется.
При γ-распаде заряд и масса не меняются.
Ядерные реакции
Атомная физика на ОГЭ включает в себя не только распады, но и ядерные реакции. Ядерные реакции происходят при столкновении ядер или элементарных частиц с другими ядрами. В результате изменяется массовое и зарядовое число элементов, появляются новые частицы.
Во всех ядерных реакциях работает очень простой лайфхак: при протекании ядерной реакции сохраняется суммарное массовое число и суммарный заряд.
Сумма масс слева равна сумме масс справа: A1+A2=A3+A4.
Сумма зарядов слева равна сумме зарядов справа: Z1+Z2=Z3+Z4.
Сразу же закрепим эти правила на практике.
Задача 5
В результате столкновения ядра урана с частицей X произошло деление урана, описываемое реакцией:
Определите зарядовое и массовое числа частицы X, с которой столкнулось ядро урана.
Разбор
- Сначала разберемся с массовым числом. Используем лайфхак: то, что слева, равно тому, что справа.
- Также заметим, что у нас 3 нейтрона. Получается, нам нужно умножить массовое число нейтрона на 3.
- С гамма-частицей разобраться легко — как мы показали ранее, она ни на что не влияет.
A+235 = 133+139+3*1
Отсюда A=133+139+3-235=40
- Теперь настал черед зарядового числа.
Z+92 = 36+56+3*0
Отсюда Z=36+56+0-92=0
Ответ: получили элемент X c массовым числом 40 и зарядовым числом 0.
Атомная физика на ОГЭ: что нужно запомнить
- В α-распаде заряд уменьшается на 2, а масса уменьшается на 4.
- α-частица — это ядро атома гелия. α-частица состоит из двух протонов и двух нейтронов.
- В β-распаде заряд увеличивается на 1, а масса не меняется.
- β-частица — это электрон.
- В γ-распаде заряд и масса не меняются.
- γ-частица — это порция электромагнитного излучения.
- Изотопы — это разновидности атомов (и ядер) какого либо химического элемента, которые имеют одинаковое зарядовое число, но разные массовые числа.
- В ядерных реакциях сохраняется суммарное массовое число и суммарный заряд.
Теперь вы знаете, как решать задания на ядерные распады и реакции! Надеюсь, атомная физика на ОГЭ стала для вас намного понятнее. Если хотите разобраться в остальных темах по физике и не только, обратите внимание на наши онлайн-курсы. Уже более 150 тысяч выпускников подготовились с нами к ОГЭ и ЕГЭ. Кстати, у меня на курсах MAXIMUM тоже можно поучиться! Приходите на бесплатный пробный урок, чтобы познакомиться с нашей образовательной системой и узнать массу полезного про ОГЭ.
`
Лайфхаки экзамена
К рубрике
407
атомного ядра
и элементарных
частиц
Глава 32
Элементы физики
атомного ядра
§251. Размер, состав и заряд атомного ядра. Массовое и зарядовое числа
Э.
Резерфорд, исследуя прохождение -частиц
с энергией в несколько мегаэлектрон-вольт
через тонкие пленки золота (см. §208),
пришел к выводу о том, что атом состоит
из положительно заряженного ядра и
окружающих его электронов. Проанализировав
эти опыты, Резерфорд также показал, что
атомные ядра имеют размеры примерно
10-14—10-15
м (линейные размеры атома примерно
10–10
м).
Атомное
ядро состоит из элементарных частиц
— протонов
и нейтронов (протонно-нейтронная
модель ядра была предложена советским
физиком Д. Д. Иваненко (р. 1904), а впоследствии
развита В. Гейзенбергом).
Протон
(р)
имеет
положительный заряд, равный заряду
электрона, и массу покоя mp=1,6726•10-27
кг
1836me,
где me
— масса
электрона. Нейтрон (n)
—
нейтральная частица с массой покоя
mn=1,6749•10-27кг
1839me,.
Протоны и нейтроны называются нуклонами
(от
лат. nucleus
—
ядро). Общее число нуклонов в атомном
ядре называется массовым
числом А.
Атомное
ядро характеризуется зарядом
Ze,
где
е
—
заряд протона, Z
—
зарядовое
число ядра,
равное числу протонов в ядре и
совпадающее с порядковым номером
химического элемента в Периодической
системе элементов Менделеева. Известные
в настоящее время 107 элементов таблицы
Менделеева имеют зарядовые числа ядер
от Z=1
до
Z=107.
Ядро
обозначается тем же символом, что и
нейтральный атом: AZХ,
где X
—
символ химического элемента, Z
—
атомный номер (число протонов в ядре),
А
— массовое
число (число нуклонов в ядре).
Сейчас
протонно-нейтронная модель ядра не
вызывает сомнений. Рассматривалась
также гипотеза о протонно-электронном
строении ядра, но она не выдержала
экспериментальной проверки. Так, если
придерживаться этой гипотезы, то
массовое число А
должно
представлять собой число протонов в
ядре, а разность между массовым числом
и числом электронов должна быть равна
заряду ядра. Эта модель согласовывалась
со значениями изотопных масс и зарядов,
но противоречила значениям спинов и
магнитных моментов ядер, энергии связи
ядра и т. д. Кроме того, она оказалась
несовместимой с соотношением
неопределенностей (см. §215). В результате
гипотеза о протонно-электронном строении
ядра была отвергнута.
Так как атом
нейтрален, то заряд ядра определяет и
число электронов в атоме. От числа же
электронов зависит их распределение
по состояниям в атоме, от которого, в
свою очередь, зависят химические
свойства атома. Следовательно, заряд
ядра определяет специфику данного
химического элемента, т. е. определяет
число электронов в атоме, конфигурацию
их электронных оболочек, величину и
характер внутриатомного электрического
поля.
Ядра
с одинаковыми Z,
но
разными А
(т.
е. с разными числами нейтронов N
=
408
А —
Z)
называются
изотопами,
а
ядра с одинаковыми A,
но разными Z
—
изобарами.
Например,
водород (Z=1)
имеет
три изотопа: 11Н
— протий (Z=1,
N=0),
21Н
— дейтерий (Z=1,
N=1),
31Н
— тритий (Z=
1,
N=
2), олово — десять, и т. д. В подавляющем
большинстве случаев изотопы одного и
того же химического элемента обладают
одинаковыми химическими и почти
одинаковыми физическими свойствами
(исключение составляют, например,
изотопы водорода), определяющимися
в основном структурой электронных
оболочек, которая является одинаковой
для всех изотопов данного элемента.
Примером ядер-изобар могут служить ядра
104Be,
105B,
106C.
В
настоящее время известно более 2000
ядер, отличающихся либо Z,
либо
A,
либо тем и другим.
Радиус
ядра задается
эмпирической формулой
R
=R0A1/3,
(251.1)
где
R0=(1,3—1,7)
10-15м.
Однако при употреблении этого термина
необходимо соблюдать осторожность
(из-за его неоднозначности, например
из-за размытости границы ядра). Из формулы
(251.1) вытекает, что объем ядра
пропорционален числу нуклонов в ядре.
Следовательно, плотность ядерного
вещества примерно одинакова для всех
ядер (1017
кг/м3).
Соседние файлы в папке Трофимова
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
