
Значение верхних и нижних индексов в атомных номерах. Атомный номер химического элемента — это число протонов, и, соответственно, общий положительный заряд его атомного ядра.
Заря́довое число́ атомного ядра (синонимы: а́томный но́мер, а́томное число́, поря́дковый но́мер химического элемента) — количество протонов в атомном ядре. Зарядовое число равно заряду ядра в единицах элементарного заряда и одновременно равно порядковому номеру соответствующего ядра химического элемента в таблице Менделеева. Обычно обозначается буквой Z[⇨].
Термин «атомный» или «порядковый» номер обычно используется в атомной физике и в химии, тогда как эквивалентный термин «зарядовое число» — в ядерной физике. В неионизированном атоме количество электронов в электронных оболочках совпадает с зарядовым числом.
Ядра с одинаковым зарядовым числом, но различным массовым числом A (которое равно сумме числа протонов Z и числа нейтронов N) являются различными изотопами одного и того же химического элемента, поскольку именно заряд ядра определяет структуру электронной оболочки атома и, следовательно, его химические свойства. Более трёх четвертей химических элементов существует в природе в виде смеси изотопов (см. Моноизотопный элемент), и средняя изотопная масса изотопной смеси элемента (называемая относительной атомной массой) в определённой среде на Земле определяет стандартную атомную массу элемента (ранее использовалось название «атомный вес»). Исторически именно эти атомные веса элементов (по сравнению с водородом) были величинами, которые измеряли химики в XIX веке.
Поскольку протоны и нейтроны имеют приблизительно одинаковую массу (масса электронов пренебрежимо мала по сравнению с их массой), а дефект массы нуклонного связывания всегда мал по сравнению с массой нуклона, значение атомной массы любого атома, выраженной в атомных единицах массы, находится в пределах 1 % от целого числа А.
История[править | править код]
Периодическая таблица и порядковые номера для каждого элемента[править | править код]

Поиски основы естественной классификации и систематизации химических элементов, основанной на связи их физических и химических свойств с атомным весом, предпринимались на протяжении длительного времени. В 1860-х годах появился ряд работ, связывающих эти характеристики — спираль Шанкуртуа, таблица Ньюлендса, таблицы Одлинга и Мейера, но ни одна из них не давала однозначного исчерпывающего описания закономерности. Сделать это удалось русскому химику Д. И. Менделееву. 6 марта 1869 года (18 марта 1869 года) на заседании Русского химического общества было зачитано сообщение Менделеева об открытии им Периодического закона химических элементов[1], а вскоре его статья «Соотношение свойств с атомным весом элементов» была опубликована в «Журнале Русского физико-химического общества»[2]. В том же году вышло первое издание учебника Менделеева «Основы химии», где была приведена его периодическая таблица. В статье, датированной 29 ноября 1870 года (11 декабря 1870 года), опубликованной в «Журнале Русского химического общества» под названием «Естественная система элементов и применение её к указанию свойств неоткрытых элементов», Менделеев впервые употребил термин «периодический закон» и указал на существование нескольких не открытых ещё элементов[3].
В своих работах Менделеев расположил элементы в порядке их атомных весов, но при этом сознательно допустил отклонение от этого правила, поместив теллур (атомный вес 127,6) впереди иода (атомный вес 126,9)[4], объясняя это химическими свойствами элементов. Такое размещение элементов правомерно с учётом их зарядового числа Z, которое было неизвестно Менделееву. Последующее развитие атомной химии подтвердило правильность догадки учёного.
Модели атома Резерфорда-Бора и Ван ден Брука[править | править код]

Модель Резерфорда — Бора для атома водорода (Z = 1) или водородоподобного иона (Z > 1). В этой модели энергия фотона (или частота электромагнитного излучения), испускаемого электроном при перемещении с одной орбиты на другую, пропорциональна квадрату величины атомного заряда (
Z2). Британский физик Генри Мозли экспериментально подтвердил, что закономерность, предсказанная Бором, выполняется для многих элементов (от Z = 13 до 92)
В 1911 году британский физик Эрнест Резерфорд предложил модель атома, согласно которой в центре атома расположено ядро, содержащее б́ольшую часть массы атома и положительный заряд, который в единицах заряда электрона должен был быть равен примерно половине атомного веса атома, выраженного в числе атомов водорода. Резерфорд сформулировал свою модель на основе данных об атоме золота (Z = 79, A = 197), и, таким образом, получалось, что у золота должен быть заряд ядра около 100 (в то время как порядковый номер золота в периодической таблице 79). Через месяц после выхода статьи Резерфорда голландский физик-любитель Антониус ван ден Брук впервые предположил, что заряд ядра и число электронов в атоме должны быть точно равны его порядковому номеру в периодической таблице (он же — атомный номер, обозначаемый Z). Эта гипотеза в конечном счёте подтвердилась.
Но с точки зрения классической электродинамики, в модели Резерфорда электрон, двигаясь вокруг ядра, должен был бы излучать энергию непрерывно и очень быстро и, потеряв её, упасть на ядро. Чтобы разрешить эту проблему, в 1913 году датский физик Нильс Бор предложил свою модель атома. Бор ввёл допущение, что электроны в атоме могут двигаться только по определённым (стационарным) орбитам, находясь на которых, они не излучают энергию, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. При этом стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка[5]: 
Эксперименты Мозли 1913 года и «пропавшие» химические элементы[править | править код]
В 1913 году британский химик Генри Мозли после дискуссии с Н.Бором решил проверить гипотезы Ван ден Брука и Бора на эксперименте[6]. Для этого Мозли измерил длины волн спектральных линий фотонных переходов (линии K и L) в атомах алюминия (Z = 13) и золота (Z = 79), использовавшихся в качестве серии мишеней внутри рентгеновской трубки[7]. Квадратный корень частоты этих фотонов (рентгеновских лучей) увеличивался от одной цели к другой в арифметической прогрессии. Это привело Мозли к заключению (закон Мозли), что значение атомного номера почти соответствует (в работе Мозли — со смещением на одну единицу для K-линий) вычисленному электрическому заряду ядра, то есть величине Z. Среди прочего эксперименты Мозли продемонстрировали, что ряд лантаноидов (от лантана до лютеция включительно) должен содержать ровно 15 элементов — не меньше и не больше, что было далеко не очевидно для химиков того времени.
После смерти Мозли в 1915 году его методом были исследованы атомные номера всех известных элементов от водорода до урана (Z = 92). Было обнаружено, что в периодической таблице отсутствуют семь химических элементов (с Z < 92), которые были идентифицированы как ещё не открытые, с атомными номерами 43, 61, 72, 75, 85, 87 и 91[8]. Все эти семь «пропавших» элементов были обнаружены в период с 1918 по 1947 год: технеций (Z = 43), прометий (Z = 61), гафний (Z = 72), рений (Z = 75), астат (Z = 85), франций (Z = 87) и протактиний (Z = 91)[8]. К этому времени также были обнаружены первые четыре трансурановых элемента, поэтому периодическая таблица была заполнена без пробелов до кюрия (Z = 96).
Протон и гипотеза «ядерных электронов»[править | править код]

К 1915 году в научном сообществе сложилось понимание того факта, что зарядовые числа Z, они же — порядковые номера элементов, должны быть кратны величине заряда ядра атома водорода, но не было объяснения причин этого. Сформулированная ещё в 1816 году гипотеза Праута предполагала, что водород является некоей первичной материей, из которой путём своего рода конденсации образовались атомы всех других элементов и, следовательно, атомные веса всех элементов, равно как и заряды их ядер, должны измеряться целыми числами. Но в 1907 году опыты Резерфорда и Ройдса[en] показали, что альфа-частицы с зарядом +2 являются ядрами атомов гелия, масса которых превышает массу водорода в четыре, а не в два раза. Если гипотеза Праута верна, то что-то должно было нейтрализовать заряды ядер водорода, присутствующие в ядрах более тяжёлых атомов.
В 1917 году (в экспериментах, результаты которых были опубликованы в 1919 и 1925 годах), Резерфорд доказал, что ядро водорода присутствует в других ядрах; этот результат обычно интерпретируют как открытие протонов[9]. Эти эксперименты начались после того, как Резерфорд заметил, что, когда альфа-частицы были выброшены в воздух (в основном состоящий из азота), детекторы зафиксировали следы типичных ядер водорода. После экспериментов Резерфорд проследил реакцию на азот в воздухе и обнаружил, что когда альфа-частицы вводятся в чистый газообразный азот, эффект оказывается больше. В 1919 году Резерфорд предположил, что альфа-частица выбила протон из азота, превратив его в углерод. После наблюдения изображений камеры Блэкетта в 1925 году Резерфорд понял, что произошло обратное: после захвата альфа-частицы протон выбрасывается, поэтому тяжёлый кислород, а не углерод, является конечным результатом, то есть Z не уменьшается, а увеличивается. Это была первая описанная ядерная реакция: 14N + α → 17O + p.
Резерфорд назвал новые тяжёлые ядерные частицы протонами в 1920 году (предлагались альтернативные названия — «прутоны» и «протилы»). Из работ Мозли следовало, что ядра тяжёлых атомов имеют более чем вдвое большую массу, чем можно было бы ожидать при условии, что они состоят только из ядер водорода, и поэтому требовалось объяснение для «нейтрализации» предполагаемых дополнительных протонов, присутствующих во всех тяжелых ядрах. В связи с этим была выдвинута гипотеза о так называемых «ядерных электронах». Так, предполагалось, что ядро гелия состоит из четырёх протонов и двух «ядерных электронов», нейтрализующих заряд двух протонов. В случае золота с атомной массой 197 и зарядом 79, ранее рассмотренном Резерфордом, предполагалось, что ядро атома золота содержит 118 этих «ядерных электронов».
Открытие нейтрона и его значение[править | править код]
Несостоятельность гипотезы «ядерных электронов» стала очевидной после открытия нейтрона[en] Джеймсом Чедвиком в 1932 году[10]. Наличие нейтронов в ядрах атомов легко объясняло расхождение между атомным весом и зарядным числом атома: так, в атоме золота содержится 118 нейтронов, а не 118 ядерных электронов, а положительный заряд ядра полностью состоит из 79 протонов. Таким образом, после 1932 года атомный номер элемента Z стал рассматриваться как число протонов в его ядре.
Символ Z[править | править код]
Зарядовое число обычно обозначается буквой Z, от нем. atomzahl — «атомное число», «атомный номер»[11]
Условный символ Z, вероятно, происходит от немецкого слова Atomzahl (атомный номер)[12], обозначающего число, которое ранее просто обозначало порядковое место элемента в периодической таблице и которое приблизительно (но не точно) соответствовало порядку элементов по возрастанию их атомных весов. Только после 1915 года, когда было доказано, что число Z является также величиной заряда ядра и физической характеристикой атома, немецкое слово Atomzahl (и его английский эквивалент англ. Atomic number) стали широко использоваться в этом контексте.
Химические свойства[править | править код]
Каждый элемент обладает определённым набором химических свойств как следствие количества электронов, присутствующих в нейтральном атоме, которое представляет собой Z (атомный номер). Конфигурация электронов в атоме следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим его химические связи. Следовательно, только атомный номер определяет химические свойства элемента, и именно поэтому элемент может быть определён как состоящий из любой смеси атомов с данным атомным номером.
Новые элементы[править | править код]
При поиске новых элементов исследователи руководствуются представлениями об зарядовых числах этих элементов. По состоянию на конец 2019 года были обнаружены все элементы с зарядовыми числами от 1 до 118. Синтез новых элементов осуществляется путем бомбардировки атомов-мишеней тяжёлых элементов ионами таким образом, что сумма зарядовых чисел атома-мишени и иона-«снаряда» равна зарядовому числу создаваемого элемента. Как правило, период полураспада элемента становится короче с увеличением атомного номера, хотя для неизученных изотопов с определённым числом протонов и нейтронов могут существовать так называемые «острова стабильности»[13].
См. также[править | править код]
- Атомная теория
- Гипотеза Праута
- Химический элемент
- Периодическая таблица химических элементов
- Список химических элементов
Примечания[править | править код]
- ↑ Трифонов Д. Н. Несостоявшееся выступление Менделеева (6 (18) марта 1869 г.) Архивная копия от 18 марта 2014 на Wayback Machine // Химия, № 04 (699), 16-28.02.2006
- ↑ Менделеев Д. И. Соотношение свойств с атомным весом элементов // Журнал Русского химического общества. — 1869. — Т. I. — С. 60—77. Архивировано 18 марта 2014 года.
- ↑ Менделеев Д. И. Естественная система элементов и применение её к указанию свойств неоткрытых элементов // Журнал Русского химического общества. — 1871. — Т. III. — С. 25—56. Архивировано 17 марта 2014 года.
- ↑ Периодический закон химических элементов // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 185. — ISBN 5-7155-0292-6.
- ↑ Планетарная модель атома. Постулаты Бора Архивная копия от 21 февраля 2009 на Wayback Machine на Портале Естественных Наук Архивная копия от 26 ноября 2009 на Wayback Machine
- ↑ Ordering the Elements in the Periodic Table Архивная копия от 4 марта 2016 на Wayback Machine, Royal Chemical Society
- ↑ Moseley H. G. J. XCIII. The high-frequency spectra of the elements (англ.) // Philosophical Magazine, Series 6. — 1913. — Vol. 26, no. 156. — P. 1024. — doi:10.1080/14786441308635052. Архивировано 22 января 2010 года.
- ↑ 1 2 Scerri E. A tale of seven elements (англ.). — Oxford University Press, 2013. — P. 47. — ISBN 978-0-19-539131-2.
- ↑ Petrucci R. H., Harwood W. S., Herring F. G. General Chemistry (англ.). — 8th ed.. — Upper Saddle River, N.J.: Prentice Hall, 2002. — P. 41.
- ↑ Chadwick J. Existence of a Neutron (англ.) // Proceedings of the Royal Society A. — 1932. — Vol. 136, no. 830. — P. 692—708. — doi:10.1098/rspa.1932.0112. — Bibcode: 1932RSPSA.136..692C.
- ↑ General Chemistry Online: FAQ: Atoms, elements, and ions: Why is atomic number called “Z”? Why is mass number called “A”? antoine.frostburg.edu. Дата обращения: 8 марта 2019. Архивировано 16 января 2000 года.
- ↑ Origin of symbol Z Архивная копия от 16 января 2000 на Wayback Machine. frostburg.edu
- ↑ Остров Стабильности за пределами таблицы Менделеева. Дата обращения: 29 ноября 2019. Архивировано 21 ноября 2018 года.
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,655 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,944 -
разное
16,904
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Когда Резерфорд опровергнул модель Томсона о строении атома, возник другой вопрос: из чего состоит ядро? Ответ на этот вопрос был получен спустя пару десятков лет. До этого в качестве элементарного ядра принимали протон — положительную частицу, которая имеет заряд, по модулю равный заряду электрона: е = 1,6*10-19 Кл. Масса же частицы равна 1,6726 · 10−27 кг.
Изотопы
В результате наблюдения огромного числа радиоактивных превращений было обнаружено, что существуют вещества, идентичные по химическим свойствам, но имеющие совершенно различные радиоактивные свойства — в одних и тех же условиях их распад происходил по-разному. Эти вещества не удавалось разделить ни одним из известных химических способов. Поэтому английский радиохимик Содди в 1911 г. высказал предположение о возможности существования элементов с одинаковыми химическими свойствами, но разной радиоактивностью. Эти элементы, по его мнению, нужно было помещать в одну и ту же клетку периодической системы Д. И. Менделеева. Содди назвал такие элементами изотопами (т. е. занимающими одинаковые места).
Предположение Содди о существовании веществ с разной радиоактивностью, но одинаковыми химическими свойствами, было подтверждено экспериментально. Когда английский физик Томсон проводил точные измерения массы ионов неона методом отклонения их в электрическом и магнитном полях, он установил, что неон есть смесь двух видов атомов. Большая часть атомов имела относительную массу 20, но некоторая часть атомов имела массу, равную 22 а. е. м. В результате относительная атомная масса смеси атомов неона была принята равной 20,2. Причем атомы обладали одинаковыми химическими свойствами, но масса их была различна.
С тех пор изотопы были обнаружены у разных химических элементов. Так, они есть у самого тяжелого из существующих в природе элементов — урана (относительные атомные массы 238, 235 и др.) и у самого легкого — водорода (относительные атомные массы 1, 2, 3).
Было установлено, что:
- Изотопы имеют разную массу.
- Заряды ядер изотопов одинаковы;
- Количество электронов у атомов изотопов одинаково.
- Химические свойства изотопов тоже одинаковые.
- Радиоактивность у изотопов разная — ядра одних атомов радиоактивны, в то время как другие могли быть стабильными или менее радиоактивными.
Эти обобщения помогли сделать вывод, что свойства радиоактивности изотопов зависят от их массы. Причем некоторые элементы могут иметь только нестабильные, или радиоактивные изотопы.
Особый интерес для физиков того времени представлял атом водорода, изотопы которого могли отличаться по массе в 2 и 3 раза:
- Дейтерий — изотоп водорода с атомной массой 2. Это стабильный химический элемент, который можно обнаружить в качестве примеси в обычном водороде. На 4500 атомов обычного водорода приходится 1 атом дейтерия. Совместно с кислородом дейтерий образует тяжелую воду. Ее свойства несколько отличаются от обычной воды. Так, при нормальном атмосферном давлении ее температура кипения составляет 101,2 °С, а температура кристаллизации — 3,8 °С.
- Тритий — изотоп водорода с атомной массой 3. Это нестабильный химический элемент. Он претерпевает β-распад. Период полураспада этого вещества составляет 12 лет.
Существование изотопов доказывает, что заряд атомного ядра определяет не все свойства атома, а лишь его химические свойства и те физические свойства, которые зависят от периферии электронной оболочки, например размеры атома. Масса же атома и его радиоактивные свойства не определяются порядковым номером в таблице Д. И. Менделеева.
Открытие нейтрона
При бомбардировке бериллия α-частицами, испускаемыми нестабильным полонием, возникает сильное проникающее излучение, которое легко преодолевает преграду в виде слоя свинца толщиной до 10–20 см. Это излучение изучали английский физик Чедвик и супруги Жолио-Кюри Ирен и Фредерик из Франции независимо друг от друга примерно в одно и то же время. Ученые предположили, что это излучение создано γ-лучами большой энергии. Но затем выяснилось, что если на пути излучения бериллия поставить пластинку из парафина, то ионизирующая способность излучения резко возрастает.
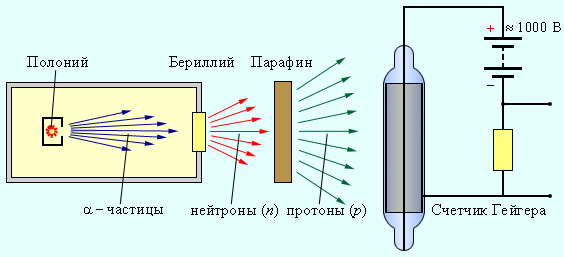
Было установлено, что излучение бериллия выбивает из парафиновой пластинки протоны, которые в большом количестве имеются в этом веществе. Ученые рассчитали длину свободного пробега протонов в воздухе они оценили энергию γ-квантов, которые сообщают при столкновении с протонами необходимую скорость. Расчеты показали слишком большое значение — 50 МэВ. протонам необходимую скорость. Она оказалась огромной – порядка 50 МэВ. Из-за малой массы γ-кванты не могли обладать такой энергией. Поэтому Чедвик сделал вывод, что из бериллия под действием α-частиц вылетают не безмассовые γ-кванты, а довольно тяжелые частицы. Эти частицы обладали большой проникающей способностью и не ионизировали газ в счетчике Гейгера. Это значит, что такие частицы были электрически нейтральными. Этой частице дали название — нейтрон.
Нуклонная модель атома
Сразу после открытия нейтрона несколько физиков одновременно высказали идею протонно-нейтронной, или нуклонной, модели ядра. Согласно этой модели ядро состоит из протонов и нейтронов. Будучи «кирпичиками», из которых строится ядро, протоны и нейтроны получили общее название — нуклоны.
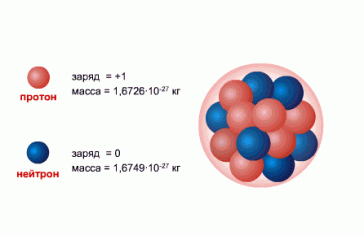
Нуклоны — общее название для составляющих атомное ядро протонов и нейтронов.
В рамках нуклонной теории о строении ядра атома ему было дано следующее определение:
Атомное ядро — центральная часть атома, состоящая из протонов и нейтронов.
Виды нуклонов:
- Протон (от protos — первый, обозначается как p или p+) — стабильная элементарная частица, ядро атома водорода. Заряд протона положительный, по модулю он равен заряду электрона: ep = 1.6∙10−19 Кл. Масса протона: mp = 1.6726231∙10−27 кг = 1.007276470 а. е. м. При расчетах часто используют округленное до целых значение: 1 а. е. м.
- Нейтрон (от лат. neuter — ни тот, ни другой, обозначается как n) — элементарная частица, не имеющая заряда, т. е. нейтральная. Масса нейтрона почти равна (незначительно больше) массе протона: mn = 1.6749286∙10−27 кг=1.0008664902 а. е. м. При расчетах также используют округленное до целых значение: 1 а. е. м.
Массовое число — общее число нуклонов в ядре. Обозначается как A.
Зарядовое число — число протонов в ядре. Обозначается как Z. Зарядовое число всегда соответствует порядковому номеру элемента в периодической таблице Менделеева.
Ядро любого химического в общем виде обозначается так:
AZX
где X — символ химического элемента, Z — число протонов в ядре (порядковый номер элемента в периодической таблице Менделеева), A — массовое число.
Массовое число определяется как сумму протонов и нейтронов, содержащихся в ядре атома:
A=Z+N
N – число нейтронов в ядре.
Пример №1. Пользуясь периодической системой элементов Д.И. Менделеева, определите число протонов и число нейтронов в ядрах атомов серы.
Взглянем на периодическую систему Менделеева и найдем серу:

Порядковый номер серы — 16. Следовательно, зарядовое число, или количество протонов в ядре атома серы — 16. Массовое число составляет 32,066 а. е. м. Округлим до целых и получим 32. Количество нейтронов найдем как разность массового и зарядового чисел:
N=A−Z=32−16=16
Ядерные силы
Ядра атомов обладают устойчивостью, несмотря на то, что между протонами действуют колоссальные силы кулоновского отталкивания. Чем же объясняется это явление? Видимо, между ними существует и другая сила, которая не дает протонам отталкиваться друг от друга. Такие силы назвали ядерными.
Ядерные силы — силы, действующие между протонами и нейтронами.
Ученые установили, что ядерные силы обладают следующими свойствами:
- Ядерные силы заметно проявляются только на расстояниях, сравнимых с размером атомных ядер (10–12–10–13 см). То есть, эти силы являются короткодействующими.
- Ядерные силы примерно в 100 раз превосходят силы электрического взаимодействия. На сегодня это самые мощные силы из всех сил, известных в природе. Именно благодаря им ядра атомов химических элементов сохраняются в устойчивом состоянии.
Энергия связи атомных ядер
Нуклоны в ядре прочно удерживаются ядерными силами. Если совершить работу по их преодолению, придется совершить некоторую работу. Энергию, которую нужно затратить для совершения работы по разделению на отдельные нуклоны, называют энергией связи ядра.
Энергия связи ядра атома — энергия, которая необходима для полного расщепления ядра на отдельные протоны и нейтроны.
На основании закона сохранения энергии можно сделать вывод, что энергия связи равна той энергии, которая выделяется при образовании ядра из отдельных частиц.
В настоящее время рассчитать энергию связи теоретически, подобно тому, как это можно сделать для электронов в атоме, не удается. Выполнить соответствующие расчеты можно, лишь применяя соотношение Эйнштейна между массой и энергией:
Е = mс2
Измерения масс ядер показали, что масса покоя ядра всегда меньше суммы масс входящих в его состав протонов и нейтронов:
Mя< Zmp + Nmn
Mя — масса покоя ядра, Z — число протонов, N — число нейтронов, mp — масса протона, mn — масса нейтрона.
На основании этого был сделан вывод о существовании дефекта (разности масс). Дефект масс определяется разностью суммы масс протонов и нейтронов, входящих в состав ядра, и массы покоя ядра атома:
ΔM=Zmp + Nmn−Mя
ΔM — дефект масс.
Это интересно! Масса ядра атома гелия на 0,75% меньше суммы масс двух протонов и двух нейтронов. Соответственно для гелия в количестве вещества один моль ΔM = 0,03 г.
Уменьшение массы при образовании ядра из нуклонов означает, что при этом уменьшается энергия этой системы нуклонов на значение энергии связи Есв.
Энергия связи — это энергия, которая выделяется при образовании ядра из отдельных частиц, и соответственно это та энергия, которая необходима для расщепления ядра на составляющие его частицы.
Энергия связи определяется формулой:
Eсв=ΔMс2=(Zmp + Nmn−Mя)с2
Это интересно! Энергия связи настолько велика, что образование 4 г гелия сопровождается выделением такой же энергии, что и при сгорании 1,5—2 вагонов каменного угля.
Важную информацию о свойствах ядер содержит зависимость удельной энергии связи от массового числа А.
Удельная энергия связи — энергия связи, приходящаяся на один нуклон ядра.
Удельную энергию связи устанавливают опытным путем. Из рисунка ниже видно, что, не считая самых легких ядер, удельная энергия связи примерно постоянна и равна 8 МэВ/нуклон. Примечательно, что энергия связи электрона и ядра в атоме водорода, равная энергии ионизации, почти в миллион раз меньше этого значения. Кривая на имеет слабо выраженный максимум. Максимальную удельную энергию связи (8,6 МэВ/нуклон) имеют элементы с массовыми числами от 50 до 60, т. е. железо и близкие к нему по порядковому номеру элементы. Ядра этих элементов наиболее устойчивы.
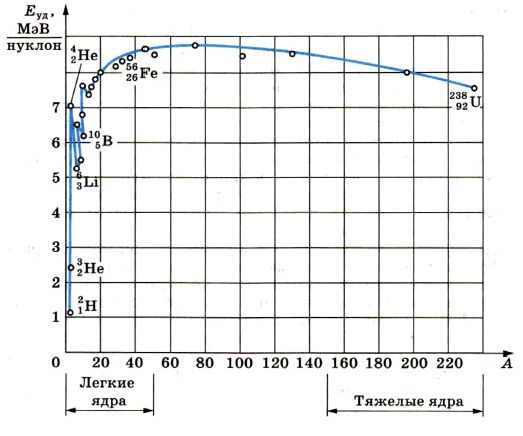
У тяжелых ядер удельная энергия связи уменьшается за счет возрастающей с увеличением Z кулоновской энергии отталкивания протонов. Кулоновские силы стремятся разорвать ядро.
Пример №2. Чему равна энергия связи ядра тяжелого водорода — дейтрона? Атомная масса ядра дейтрона mD = 2,01355 а. е. м, протона mр = 1,00728 а. е. м, нейтрона mn = 1,00866 а. е. м; масса атома углерода mс = 1,995 ∙ 10-26 кг.
Eсв=(Zmp + Nmn−Mя)с2
Зарядовое число водорода — 1. Количество нейтронов — 1. Чтобы найти суммарную массу всех частиц и ядра, нужно их массу в а. е. м. умножить на массу атома углерода в кг и поделить на 12. Это необходимо потому, что 1 а. е. м. равна 1/12 массы атома углерода. Получим:
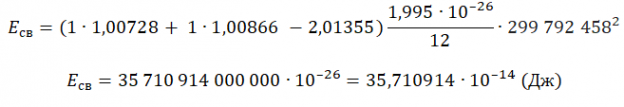
Переведем в МэВ, учитывая, что 1 МэВ = 1,6∙10–13 Дж:
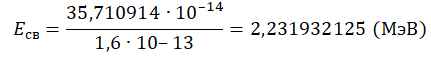
Задание EF17709
Какая из строчек таблицы правильно отражает структуру ядра 49115 In?

Алгоритм решения
- Установить, чем определяются количество протонов и нейтронов.
- Определить, сколько содержится в атоме протонов.
- Определить, сколько содержится в атоме нейтронов.
Решение
Протоны и нейтроны — нуклоны. Общее их количество является массовым числом A, которое указывается слева от обозначения химического элемента в верхнем индексе. В данном случае A = 115.
Зарядовое число — порядковый номер химического элемента в периодической системе Менделеева. Оно обозначается Z и равно количеству протонов в ядре. В нашем случае Z = 49. Значит, протонов 49.
Чтобы посчитать количество нейтронов, нужно из массового числа вычесть зарядовое число: 115 – 49 = 66. Значит, нейтронов 66. Строка 1 подходит.
Ответ: 1
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17974
Связанная система элементарных частиц содержит 14 нейтронов, 13 протонов и 10 электронов. Эта система частиц является
Ответ:
а) ионом алюминия 1327Al
б) нейтральным атомом кремния 1427Si
в) ионом кремния 1427Si
г) нейтральным атомом алюминия 1327Al
Алгоритм решения
- Определить, перед нами ион или нейтральный атом.
- Установить зарядовое число.
- Установить массовое число.
- Выбрать подходящий ответ.
Решение
Согласно условию задачи, в связанной системе элементарных частиц содержится 14 нейтронов, 13 протонов и 10 электронов. В нейтральном атоме количество электронов равно количеству протонов. В нашем случае электронов на 3 меньше. Значит, перед нами ион.
Зарядовое число соответствует количеству протонов. Их 13.
Массовое число равно сумме количества протонов и электронов: 14 + 13 = 27.
Выходит, перед нами ион алюминия.
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18942
На рисунке представлен фрагмент Периодической системы элементов Д.И. Менделеева. Под названием каждого элемента приведены массовые числа его основных стабильных изотопов. При этом нижний индекс около массового числа указывает (в процентах) распространённость изотопа в природе.
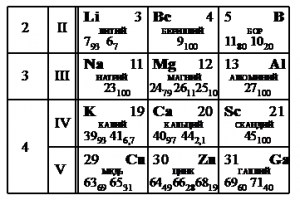
Укажите число протонов и число нейтронов в ядре наименее распространённого из указанных стабильных изотопов меди.

Алгоритм решения
- Найти наименее распространенный изотоп меди.
- Выписать для него массовые и зарядовые числа.
- Найти число протонов и нейтронов.
Решения
Наименее распространен изотоп меди Cu-65, поскольку возле его массового числа стоит меньший индекс — 31.
Массовое число этого изотопа — 65. Зарядовое число соответствует порядковому номеру — 29.
Количество протонов соответствует зарядовому числу. Их 29.
Количество нейтронов есть разность массового и зарядовых чисел: 65 – 29 = 36.
Эти числа запишем последовательно: 2936.
Ответ: 2936
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 1.8k
![]()
![]()
Заряд ядра равен количеству протонов в нем. Количество протонов о можно определить по периодической таблице Менделеева. Он равен порядковому номеру элемента.
По формуле: q = e*Z
где e – заряд одного протона,
Z- число протонов( порядковый номер в таблице ).
автор вопроса выбрал этот ответ лучшим
![]()
ЧипИДейл
[36.5K]
2 года назад
Для того, чтобы узнать заряд ядра атома какого-либо химического элемента, необходимо будет заглянуть в периодическую таблицу Менделеева. В ней для каждого элемента определен порядковый номер. Этот номер равен количеству протонов в ядре элемента. А заряд ядра атома как раз и равен количеству протонов. Соответственно делаем вывод, что заряд ядра атома равен порядковому (зарядному) числу, который указывается для каждого вещества в периодической таблице Менделеева.
Самый маленький заряд ядра имеет Водород (обозначается буквой «H»), распололоженный в таблице под номером 1. А самый большой заряд у элемента, который называется Оганесон (обозначается, как «Og») с атомным номером 118.
![]()
владсандрович
[766K]
4 года назад
Заряд в ядре приравнивается к количеству того числа протонов которые содержатся в нем. Их количество определяется исходя из данных которые дает периодическая таблица Менделеева. И в ней что бы увидеть их число, нужно смотреть на порядковый номер элемента.
Вот формуле для расчета: q = e*Z
В которой “e” , является зарядом одного протона.
Литера “Z”- как раз таки является тем числом протонов, которое располагается порядковым номером в таблице.
![]()
Существует три вида элементарных частиц. Протоны и нейтроны находятся в ядре атома, а электроны движутся по орбиталям, поэтому их не учитываем. Нейтроны не имеют какого-либо заряда, его имеют только протоны. Каждый протон имеет заряд +1.
И чтобы определить, какой заряд имеет ядро некого атома, нужно умножить +1 на порядковый номер вещества в таблице Менделеева.
Ряд ядра всегда положительный.
![]()
Алекс98
[60K]
2 года назад
Ох уж эта физика. Еще со школы помню, что заряд ядра автора равен количеству в нем протонов.
Количество протонов определяется по периодической таблице Менделеева и равняется порядковому номеру элементов.
Знаете ответ?
Согласно протонно-нейтронной модели строения атомного ядра, заряд ядра должен быть равен сумме зарядов всех протонов, которые входят в его состав. Так как заряд протона равен элементарному заряду, то можно считать, что:
(q) — заряд ядра,
(e) — элементарный заряд,
()
Z
() — количество протонов в ядре.
Количество протонов в ядре
Z
называется зарядовым числом атомного ядра.
Экспериментально было доказано, что число Z совпадает с порядковым номером химического элемента в Периодической системе Менделеева.
Обрати внимание!
Количество протонов в ядре атома совпадает с номером химического элемента в Периодической системе химических элементов и называется зарядовым числом (
Z
).
Массовое число
Количество нейтронов в ядре атома принято обозначать N. Тогда количество протонов и нейтронов в ядре атома можно вычислить как:
A=Z+N.
— количество нуклонов в атоме называется массовым числом.
Изотопы
Химические свойства атома определяются зарядовым числом, так как это число указывает на номер атома в периодической системе, т. е. определяет, какой именно это химический элемент. Физические свойства атома могут быть разными в зависимости от массового числа. Действительно, экспериментально было доказано, что ядра одного и того же химического элемента могут обладать разными массами. Например, в природе существует несколько видов атомов водорода: водород, дейтерий и тритий. Масса дейтерия приблизительно в два, а трития — в три раза больше массы водорода.
Атомы одного и того же химического элемента, но с разными массами, называются изотопами.
Так как изотопы — это атомы одного и того же химического элемента, то зарядовое число у изотопов одинаковое, а массовые числа различные. Это означает, что ядра изотопов содержат одинаковое число протонов и разное количество нейтронов.
Изотопы принято обозначать:
XZA, где
XZA — химический элемент,
A — массовое число,
Z — зарядовое число.
Пример:
— водород,
H12
— дейтерий,
H13
— тритий.
