3аряд
внутренней сферы комплексного соединения
представляет собой алгебраическую
сумму зарядов образующих ее частиц.
Например,
величина и знак заряда комплекса [Fe
(C
2О4)2]
определяется следующим образом. Заряд
иона железа равен +3, суммарный заряд
двух оксалат ионов – (–4). Следовательно,
заряд комплекса =(+3)+(–4)=–1 и формула
комплекса [Fe(С2О4)2]
—.
Заряд комплексного иона численно равен
суммарному заряду внешней сферы и
противоположен ему по знаку. Например,
заряд внешней сферы К3[Fe(CN)
6]
равен +3. Следовательно, заряд комплексного
иона равен -3.
3аряд
комплексообразователя равен по
величине и противоположен по знаку
алгебраической сумме зарядов всех
остальных частиц комплексного соединения.
Отсюда,
в К3
[Fe(CN)
6]
заряд иона железа равен +3, т.к. суммарный
заряд всех остальных частиц комплексного
соединения равен (+3) + (–6) = –3.
Наиболее
устойчивые и разнообразные комплексы
по составу и выполняемым ими функциям
образуют d–элементы. Особенно большое
значение имеют комплексные соединения
переходных элементов: железа, марганца,
кобальта, меди, цинка и молибдена, которые
выступают в качестве комплексообразователя.
Биогенные s–элементы (Na, К, Mg, Са) образуют
комплексные соединения только с лигандами
определенной циклической структуры,
выступая также в качестве
комплексообразователя. Основная часть
р–элементов (N, Р, S, О) является активной
действующей частью комплексообразующих
частиц (лигандов) в том числе и биолигандов.
В этом состоит их биологическая
значимость.
Следовательно,
способность
к комплексообразованию –
это общее свойство химических элементов
периодической системы Д. И. Менделеева,
эта способность уменьшается в следующем
порядке: f>d>p>>s.
2. Химическая связь в комплексных соединениях и особенности их строения
В
образовании комплексных соединений
важную роль играют донорно – акцепторные
взаимодействия лиганда и центрального
атома. Донором электронной пары, как
правило, является лиганд. Акцептором –
центральный атом, который имеет свободные
орбитали. Связь эта прочна и не разрывается
при растворении комплекса (неионогенна)
и ее называют координационной.
Наряду
с s-связями образуются p-связи по
донорно-акцепторному механизму. При
этом донором служит ион металла отдающий
свои спаренные d-электроны
лиганду, имеющему энергетически выгодные
вакантные орбитами. Такие связи называют
дативными. Они образуются: а) за счет
перекрывания вакантных р-орбиталей
металла с d-орбиталью
металла на которой находятся электроны
не вступившие в s-связь (dp-pp
взаимодействие); б) при перекрывании
вакантных d-орбиталей
лиганда с заполненными d-орбиталями
металла (dp-dp
взаимодействие).
Ионы
d–элементов образуют с биосубстратами
(белками) прочные комплексы. А мягкие
кислоты Cd, Pb, Hg сильно токсичны. Они
образуют прочные комплексы с белками
содержащими R—SH группы,
2R—SH+Hg
2+
®R—S—Hg—S—R+2H+
Цианид–ион
токсичен. Мягкий лиганд активно
взаимодействует с d–металлами в
комплексах с биосубстратами, активируя
последние.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Заряд – комплексная частица
Cтраница 1
Заряд комплексных частиц зависит от значения / г, заряда металла М и значения рН раствора; для простоты заряды комплексов здесь опущены.
[1]
Заряд комплексной частицы находится как сумма заряда комплексообразователя и зарядов всех лигандов. Очевидно, что лиганды, являющиеся молекулами, вносят нулевой вклад в общий заряд комплексной частицы.
[2]
Заряд комплексной частицы определяется как сумма заряда комплексообразователя и зарядов всех лигандов.
[3]
Заряд комплексной частицы определяется как сумма заряда комплексообразователя и зарядов для всех лигандов. Лиганды, являющиеся молекулами, вносят нулевой вклад в общий заряд комплексной частицы.
[4]
Чем определяется заряд комплексной частицы, содержащей молекулярные лиганды.
[5]
В продукте одноэлектронного восстановления неспаренный электрон может занимать одну из вакантных d – орбиталей металла, так что состояние окисления последнего определится зарядом промежуточной комплексной частицы.
[6]
Комплексообразователь вместе с лигандами образуют так называемую внутреннюю сферу комплекса, ее принято заключать при написании формулы в квадратные скобки, а заряд частицы указывать за скобкой, относя его ко всей частице. Ионы, нейтрализующие заряд комплексной частицы, образуют внешнюю сферу. Естественно, если комплексная частица нейтральна, внешней сферы нет. В этом случае вся формула, описывающая состав комплексной частицы, заключается в квадратные скобки.
[7]
Таким образом, графическое решение уравнений ( 11) и ( 12) позволяет установить, какие именно ионы металла и реактива взаимодействуют при образовании комплексного соединения, а затем вычислить и ПР или Кя последнего. Для проверки ( при работе с растворимыми комплексами) необходимо определить заряд комплексной частицы, что обычно легко выполняется методом переноса ионов. Если реактив содержит сильные кислотные группы, остающиеся незакомплексованными и в образовавшемся соединении, то определение заряда комплекса может дать искаженное представление о течении реакции, и поэтому необходимо произвести параллельное исследование с реактивом-аналогом, не содержащим сильных кислотных групп.
[8]
На потенциометре проверяют рН водной фазы. Рассчитывают коэффициент распределения ванадия и строят график в координатах lg D – рН ( см. стр. Таким образом определяют заряд комплексной частицы, участвующей в комплексообразовании.
[9]
Страницы:
1
Вычисления при обменных реакциях комплексных соединений. Заряды комплексных ионов
Задача 719.
Эмпирическая формула соли CrCl3 . 5H2O. Исходя из того, что координационное число хрома равно б, вычислить, какой объем 0,1 н. раствора AgNO3 понадобится для осаждения внешнесферно связанного хлора, содержащегося в 200 мл 0,01 М раствора комплексной соли; считать, что вся вода, входящая в состав соли, связана внутрисферно.
Решение:
Так как пять молекул воды, входящие в состав соли, связаны внутрисферно, и координационное число центрального атома хрома равно 6, то координационная формула соли будет иметь вид: [Cr(H2O)5Cl]Cl2. Во внешней сфере соли будет находиться два хлорид-иона, т.е. СЭ(Cl) = 2CM = 0,01 . 2 = 0,02н.
Для расчета объёма раствора AgNO3 используем математическое выражение следствия из закона эквивалентов (так называемое правило пропорциональности):
CH(A) . V(A) = CH(B) . V(B)
где Сн(A) и Cн(В) – молярные концентрации эквивалентов веществ А и В, моль; V(A) и V(B) – объёмы растворов веществ А и В.
Подставив данные задачи, вычислим объём раствора нитрата серебра, получим:
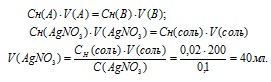
Ответ: 40 мл.
Задача 720.
Написать в молекулярной и ионно-молекулярной форме уравнения обменных реакций, происходящих между:
а) K4[Fe(CN)6] и CuSO4; б) Na3[Co(CN)6] и FeSO4; в) K3[Fe(CN)6] и AgNO3, имея в виду, что образующиеся комплексные соли нерастворимы в воде.
Решение:
а) Молекулярная форма:
K4[Fe(CN)6] + 2CuSO4 = Cu2[Fe(CN)6]↓ + 2K2SO4
Ионно-молекулярная форма (полная форма):
4K+ + [Fe(CN)6]4- + 2Cu2+ + 2SO42- = Cu2[Fe(CN)6]↓ + 4K+ + 2SO42-
После приведения членов в обеих частях равенства, получим:
[Fe(CN)6]4- + 2Cu2+ = Cu2[Fe(CN)6]↓
б) Молекулярная форма:
2Na3[Co(CN)6] +3FeSO4 = Fe3[Co(CN)6]2↓ + 3Na2SO4
Ионно-молекулярная форма (полная форма):
6Na+ + 2[Co(CN)6]3- + 3Fe2+ + 3SO42- = Fe3[Co(CN)6]2↓ + 6Na+ + 3SO42-
После приведения членов в обеих частях равенства, получим:
2[Co(CN)6]3- + 3Fe2+ = Fe3[Co(CN)6]2↓
в) Молекулярная форма:
K3[Fe(CN)6] + 3AgNO3 = Ag3[Fe(CN)6]↓ + 3KNO3
Ионно-молекулярная форма (полная форма):
3K+ + [Fe(CN)6]3- + 3Ag+ + 3NO3– = Ag3[Fe(CN)6]↓ + 3K+ + 3NO3-
После приведения членов в обеих частях равенства, получим:
[Fe(CN)6]3- + 3Ag+ = Ag3[Fe(CN)6]↓.
Задача 721.
Найти заряды комплексных частиц и указать среди них катионы, анионы и неэлектролиты: а) [Co(NH3)5Cl];
б) [Cr(NH3)4PO4]; в) [Ag(NH3)2]; г) [Cr(OH)6]; д) [Co(NH3)3(NO2)3]; е) [Cu(H2O)4].
Решение:
а) [Co(NH3)5Cl]. Заряды нона кобальта (III) +3, хрома (III), меди (II) и серебра принимаем равными соответственно +3, +3, +2, и +1; заряд молекулы аммиака и молекулы воды равен нулю, заряды хлорид-, нитрит-, гидроксид- и фосфат-ионов соответственно равны -1, -1, -1 и -3.
Составляем алгебраические суммы зарядов для каждого из указанных соединений, получим:
а) +3 + (-1) = +2 (катион); б) +3 + (-3) = 0 (неэлектролит); в) +1 = +1 (катион); г) +3+ 6(-1) = -3 (анион); +3 + 3(-1) = 0 (неэлектролит); е) +2 = +2 (катион).
Задача 722.
Определить степень окисленности комплексообразователя в следующих комплексных ионах: а) [Fe(CN)6]4-, б) [Ni(NH3)5Cl]+, в) [Co(NH3)2(NO2)4]–, г) [Co(H2O)4Br2]+, д) [AuCl4]–, е) [Hg(CN)4]2-, ж) [Cd(CN)4]2-.
Решение:
а) Определение степени окисленности комплексообразователя в [Fe(CN)6]4–.
Определяем степень окисленности железа, учитывая, что сумма зарядов частиц равна -4. Заряд CN равен -1. Тогда получим: х + 6(-1) = -4; х = -4 + 6; х = +2.
б) Определение степени окисленности комплексообразователя в [Ni(NH3)5Cl]+
Определяем степень окисленности никеля, учитывая, что сумма зарядов частиц равна +1. Заряд NH3 равен 0, а Cl равен -1.
Тогда получим: х + 5(0) + (-1) = +1; х = +1 + 1; х = +2.
в) Определение степени окисленности комплексообразователя в [Co(NH3)2(NO2)4]–
Заряд Со равен (х), NH3 – (0), NO2 – (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд кобальта: х + 4(-1) + 2(0) = -1; х = +3. Степень окисленности равна +3.
г) Определение степени окисленности комплексообразователя в [Co(H2O)4Br2]+
Заряд Сr равен (х), H2O – (0), Br – (-1). Отсюда, учитывая, что сумма зарядов частиц равна (+1), найдём заряд хрома: х + 4(0) + 2(-1) = +1; х = +3. Степень окисленности равна +3.
д) Определение степени окисленности комплексообразователя в [AuCl4]–. Заряд Au равен (х), Cl – (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд золота: х + 4(-1) = -1; х = +3. Степень окисленности равна +3.
е) Определение степени окисленности комплексообразователя в [Hg(CN)4]2-
Заряд Hg равен (х), CN – (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд ртути: х + 4(-1) = -2; х = +2. Степень окисленности ртути равна +2.
ж)Определение степени окисленности комплексообразователя в [Cd(CN)4]2-
Заряд Сd равен (х), CN – (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд кадмия: х + 4(-1) = -2; х = +2. Степень окисленности кадмия равна +2.
Комплексные соединения
Занятие, представленное на конкурс «Я иду на
урок», я провожу в 11-м биолого-химическом классе,
где на изучение химии отводится 4 часа в неделю.
Тему «Комплексные соединения» я взяла,
во-первых, потому что эта группа веществ имеет
исключительно большое значение в природе;
во-вторых, многие задания ЕГЭ включают понятие о
комплексных соединениях; в-третьих, учащиеся из
этого класса выбирают профессии, связанные с
химией, и будут встречаться с группой
комплексных соединений в будущем.
Цель. Сформировать понятие о составе,
классификации, строении и основах номенклатуры
комплексных соединений; рассмотреть их
химические свойства и показать значение;
расширить представления учащихся о многообразии
веществ.
Оборудование. Образцы комплексных
соединений.
План урока
I. Организационный момент.
II. Изучение нового материала (лекция).
III. Подведение итогов и постановка домашнего
задания.
План лекции
1. Многообразие веществ.
2. Координационная теория А.Вернера.
3. Строение комплексных соединений.
4. Классификация комплексных соединений.
5. Природа химической связи в комплексных
соединениях.
6. Номенклатура комплексных соединений.
7. Химические свойства комплексных соединений.
8. Значение комплексных соединений.
ХОД УРОКА
I. Организационный момент
II. Изучение нового материала
Многообразие веществ
Мир веществ многообразен, и мы уже знакомы с
группой веществ, которые принадлежат к
комплексным соединениям. Данными веществами
стали заниматься с XIX в., но понять их строение с
позиций существовавших представлений о
валентности было трудно.
Координационная теория А.Вернера
В 1893 г. швейцарским химиком-неоргаником
Альфредом Вернером (1866–1919) была сформулирована
теория, позволившая понять строение и некоторые
свойства комплексных соединений и названная координационной
теорией*. Поэтому
комплексные соединения часто называют
координационными соединениями.
Соединения, в состав которых входят сложные
ионы, существующие как в кристалле, так и в
растворе, называются комплексными, или
координационными.
Строение комплексных соединений
Согласно теории Вернера центральное положение
в комплексных соединениях занимает, как правило,
ион металла, который называют центральным ионом,
или комплексообразователем.
Комплексообразователь – частица (атом,
ион или молекула), координирующая (располагающая)
вокруг себя другие ионы или молекулы.
Комплексообразователь обычно имеет
положительный заряд, является d-элементом,
проявляет амфотерные свойства, имеет
координационное число 4 или 6. Вокруг
комплексообразователя располагаются
(координируются) молекулы или кислотные
остатки – лиганды (адденды).
Лиганды – частицы (молекулы и ионы),
координируемые комплексообразователем и
имеющие с ним непосредственно химические связи
(например, ионы: Cl–, I–, NO3–,
OH–; нейтральные молекулы: NH3, H2O,
CO).
Лиганды не связаны друг с другом, так как между
ними действуют силы отталкивания. Когда
лигандами являются молекулы, между ними возможно
молекулярное взаимодействие. Координация
лигандов около комплексообразователя является
характерной чертой комплексных соединений (рис.
1).
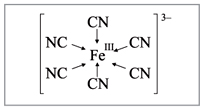 |
Рис. 1. Координация цианид-ионов
|
Координационное число – это
число химических связей, которые
комплексообразователь образует с лигандами.
![Рис. 2. Тетраэдрическая структура иона [AlBr4]–](https://him.1sept.ru/2009/08/28-3.jpg) |
Рис. 2. Тетраэдрическая структура иона
|
Значение координационного числа
комплексообразователя зависит от его природы,
степени окисления, природы лигандов и условий
(температура, концентрация), при которых
протекает реакция комплексообразования.
Координационное число может иметь значения от 2
до 12. Наиболее распространенными являются
координационные числа 4 и 6. Для координационного
числа 4 структура комплексных частиц может быть
тетраэдрической [AlBr4]– (рис. 2) и в виде
плоского квадрата [Pt(NH3)2Cl2] (рис.
3). Комплексные соединения с координационным
числом 6 имеют октаэдрическое строение [AlF6]3–
(рис. 4).
![Рис. 3. Соединение [Pt(NH3)2Cl2] со структурой плоского квадрата](https://him.1sept.ru/2009/08/28-2.jpg) |
Рис. 3. Соединение [Pt(NH3)2Cl2]
|
![Рис. 4. Ион [AlF6]3– октаэдрического строения](https://him.1sept.ru/2009/08/28-4.jpg) |
Рис. 4. Ион [AlF6]3–
|
Комплексообразователь и окружающие
его лиганды составляют внутреннюю сферу
комплекса. Частица, состоящая из
комплексообразователя и окружающих лигандов,
называется комплексным ионом. При изображении
комплексных соединений внутреннюю сферу
(комплексный ион) ограничивают квадратными
скобками. Остальные составляющие комплексного
соединения расположены во внешней сфере (рис.
5).
Суммарный заряд ионов внешней сферы должен
быть равен по значению и противоположен по знаку
заряду комплексного иона:
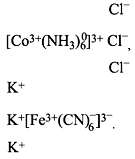
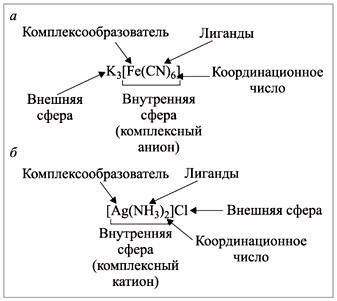 |
Рис. 5. Пояснения к изображению формул
|
Заряд комплексного иона легко
подсчитать, зная степень окисления составляющих
его частей.
Классификация комплексных
соединений
Большое многообразие комплексных соединений и
их свойств не позволяет создать единую
классификацию. Однако можно группировать
вещества по некоторым отдельным признакам.
1) По составу.
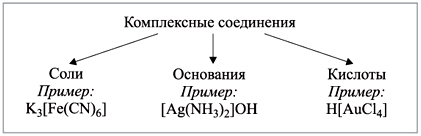
2) По типу координируемых лигандов.
а) Аквакомплексы – это комплексные
катионы, в которых лигандами являются молекулы H2O.
Их образуют катионы металлов со степенью
окисления +2 и больше, причем способность к
образованию аквакомплексов у металлов одной
группы периодической системы уменьшается сверху
вниз.
Примеры аквакомплексов:
[Al(H2O)6]Cl3, [Cr(H2O)6](NO3)3.
б)Гидроксокомплексы – это комплексные
анионы, в которых лигандами являются
гидроксид-ионы OH–.
Комплексообразователями являются металлы,
склонные к проявлению амфотерных свойств – Be,
Zn, Al, Cr.
Например: Na[Al(OH)4], Ba[Zn(OH)4].
в) Аммиакаты – это комплексные катионы, в
которых лигандами являются молекулы NH3.
Комплексообразователями являются d-элементы.
Например: [Cu(NH3)4]SO4, [Ag(NH3)2]Cl.
г) Ацидокомплексы – это комплексные
анионы, в которых лигандами являются анионы
неорганических и органических кислот.
Например: K3[Al(C2O4)3], Na2[Zn(CN)4],
K4[Fe(CN)6].
3) По заряду внутренней сферы.
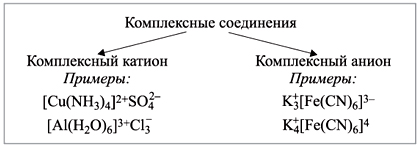
Природа химической связи в
комплексных соединениях
Во внутренней сфере между
комплексообразователем и лигандами существуют
ковалентные связи, образованные в том числе и по
донорно-акцепторному механизму. Для образования
таких связей необходимо наличие свободных
орбиталей у одних частиц (имеются у
комплексообразователя) и неподеленных
электронных пар у других частиц (лиганды). Роль
донора (поставщика электронов) играет лиганд, а
акцептором, принимающим электроны, является
комплексообразователь. Донорно-акцепторная
связь возникает как результат перекрывания
свободных валентных орбиталей
комплексообразователя с заполненными
орбиталями донора.
Между внешней и внутренней сферой существует
ионная связь. Приведем пример.
Электронное строение атома бериллия:
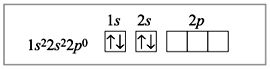
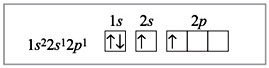
Электронное строение атома бериллия в
возбужденном состоянии:
Электронное строение атома бериллия в
комплексном ионе [BeF4]2–:
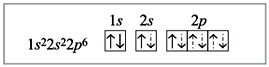
Пунктирными стрелками показаны электроны
фтора; две связи из четырех образованы по
донорно-акцепторному механизму. В данном случае
атом Be является акцептором, а ионы фтора –
донорами, их свободные электронные пары
заполняют гибридизованные орбитали (sp3-гибридизация).
Номенклатура комплексных
соединений
Наибольшее распространение имеет
номенклатура, рекомендованная IUPAC. Название комплексного
аниона начинается с обозначения состава
внутренней сферы: число лигандов обозначается
греческими числительными: 2–ди, 3–три, 4–тетра,
5–пента, 6–гекса и т.д., далее следуют названия
лигандов, к которым прибавляют соединительную
гласную «о»: Cl– – хлоро-, CN– –
циано-, OH– – гидроксо- и т.п. Если у
комплексообразователя переменная степень
окисления, то в скобках римскими цифрами
указывают его степень окисления, а его название с
суффиксом -ат: Zn – цинкат, Fe – феррат(III),
Au – аурат(III). Последним называют катион
внешней сферы в родительном падеже.
Примеры:
K3[Fe(CN)6] – гексацианоферрат(III)
калия,
K4[Fe(CN)6] – гексацианоферрат(II)
калия,
K2[Zn(OH)4] – тетрагидроксоцинкат
калия.
Названия соединений, содержащих комплексный
катион, строятся из названий анионов внешней
среды, после которых указывается число лигандов,
дается латинское название лиганда (молекула
аммиака NH3 – аммин, молекула воды H2O –
аква от латинского названия воды) и русское
название элемента-комплексообразователя;
римской цифрой в скобках указывается степень
окисления элемента-комплексообразователя, если
она переменная. Например:
[Cu(NH3)4]SO4 – сульфат
тетраамминмеди(II),
[Al(H2O)6]Cl3 – хлорид
гексаакваалюминия.
Химические свойства комплексных
соединений
1. В растворе комплексные соединения ведут
себя как сильные электролиты, т.е. полностью
диссоциируют на катионы и анионы:
[Pt(NH3)4]Cl2 = Pt(NH3)4]2+
+ 2Cl–,
K2[PtCl4] = 2K+ + [PtCl4]2–.
Диссоциация по такому типу называется
первичной.
Вторичная диссоциация связана с удалением
лигандов из внутренней сферы комплексного иона:
[PtCl4]2– ![]() PtCl3– + Cl–.
PtCl3– + Cl–.
Вторичная диссоциация происходит ступенчато:
комплексные ионы ([PtCl4]2–) являются
слабыми электролитами.
2. При действии сильных кислот происходит
разрушение гидроксокомплексов, например:
а) при недостатке кислоты
Na3[Al(OH)6] + 3HCl = 3NaCl + Al(OH)3![]() + 3H2O;
+ 3H2O;
б) при избытке кислоты
Na3[Al(OH)6] + 6HCl = 3NaCl + AlCl3 +
6H2O.
3. Нагревание (термолиз) всех аммиакатов
приводит к их разложению, например:
[Cu(NH3)4]SO4 ![]() CuSO4 + 4NH3
CuSO4 + 4NH3![]() .
.
Значение комплексных соединений
Координационные соединения имеют
исключительно большое значение в природе.
Достаточно сказать, что почти все ферменты,
многие гормоны, лекарства, биологически активные
вещества представляют собой комплексные
соединения. Например, гемоглобин крови,
благодаря которому осуществляется перенос
кислорода от легких к клеткам ткани, является
комплексным соединением, содержащим железо (рис.
6), а хлорофилл, ответственный за фотосинтез в
растениях, – комплексным соединением магния
(рис. 7).
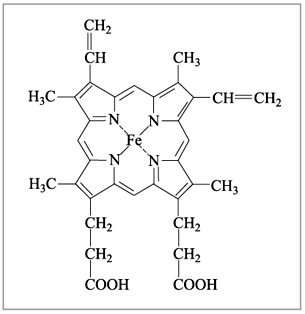 |
Рис. 6. Гем-группа в молекуле
|
Значительную часть природных
минералов, в том числе полиметаллических руд и
силикатов, также составляют координационные
соединения. Более того, химические методы
извлечения металлов из руд, в частности меди,
вольфрама, серебра, алюминия, платины, железа,
золота и других, также связаны с образованием
легкорастворимых, легкоплавких или летучих
комплексов. Например: Na3[AlF6] –
криолит, KNa3[AlSiO4]4 – нефелин
(минералы, комплексные соединения, содержащие
алюминий).
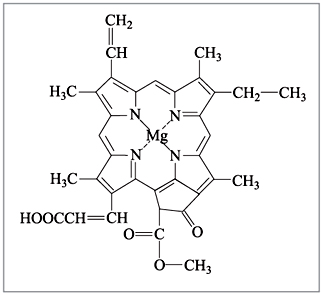 |
Рис. 7. Хлорофилл c1 |
Современная химическая отрасль
промышленности широко использует
координационные соединения как катализаторы при
синтезе высокомолекулярных соединений, при
химической переработке нефти, в производстве
кислот.
III. Подведение итогов и постановка
домашнего задания
Домашнее задание.
1) Приготовиться по лекции к уроку-практикуму по
теме: «Комплексные соединения».
2) Письменно дать характеристику следующим
комплексным соединениям по строению и
классифицировать по признакам:
K3[Cr(OH)6], [Cr(H2O)6](NO3)3,
Na2[Zn(CN)4], [Ag(NH3)2]OH.
3) Написать уравнения реакций, при помощи
которых можно осуществить превращения:
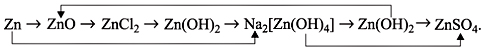
* За открытие этой
новой области науки А.Вернер в 1913 г. был
удостоен Нобелевской премии.
Н.Н.ТОПОЕВА,
учитель химии
Аскизского лицея-интерната
(с. Аскиз, Республика Хакасия)
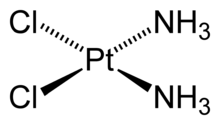
Цис-платин — одно из многих координационных соединений
Ко́мплексные соедине́ния (лат. complexus — сочетание, обхват) или координацио́нные соедине́ния (лат. co — «вместе» и ordinatio — «упорядочение») — это соединения (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером.
Комплексные соединения, имеющие внешнюю сферу, в водном растворе полностью диссоциируют на комплексный малодиссоциирующий катион или анион. Комплексные соединения без внешней сферы в воде нерастворимы (например, карбонилы металлов).
Комплексные соединения разнообразны и многочисленны.
Основные термины[править | править код]
Комплексное соединение — химическое вещество, в состав которого входят комплексные частицы. В настоящее время строгого определения понятия «комплексная частица» нет. Обычно используется следующее определение.
Комплексная частица, координационная частица — сложная частица, способная к самостоятельному существованию в кристалле или растворе, образованная из других, более простых частиц, также способных к самостоятельному существованию. Иногда комплексными частицами называют сложные химические частицы, все или часть связей в которых образованы по донорно-акцепторному механизму.
Комплексообразователь — центральный атом комплексной частицы. Обычно комплексообразователь — атом элемента, образующего металл, но это может быть и атом кислорода, азота, серы, иода и других элементов, образующих неметаллы. Комплексообразователь обычно положительно заряжен и в таком случае именуется в современной научной литературе металлоцентром; заряд комплексообразователя может быть также отрицательным или равным нулю.
Лиганды (Адденды) — атомы или изолированные группы атомов, располагающиеся вокруг комплексообразователя. Лигандами могут быть частицы, до образования комплексного соединения представлявшие собой молекулы (H2O, CO, NH3 и др.), анионы (OH−, Cl−, PO43− и др.), а также катион водорода H+.
Внутренняя сфера комплексного соединения — центральный атом со связанными с ним лигандами, то есть, комплексная частица.
Внешняя сфера комплексного соединения — остальные частицы, связанные с комплексной частицей ионной или межмолекулярными связями, включая водородные.
Дентатность лиганда определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя. Различают монодентатные (унидентатные) лиганды, связанные с центральным атомом через один из своих атомов, то есть одной ковалентной связью, бидентатные (связанные с центральным атомом через два своих атома, то есть, двумя связями), три- , тетрадентатные и т. д.
Координационный полиэдр — воображаемый молекулярный многогранник, в центре которого расположен атом-комплексообразователь, а в вершинах — частицы лигандов, непосредственно связанные с центральным атомом.
Координационное число (КЧ) — число связей, образуемых центральным атомом с лигандами.
Для комплексных соединений с монодентантными лигандами КЧ равно числу лигандов, а в случае полидентантных лигандов — числу таких лигандов, умноженному на дентатность.
Типы комплексных соединений[править | править код]
Существует несколько типов комплексных соединений, в основу которых положены различные принципы.
По заряду комплекса[править | править код]
1) Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др.).
[Zn(NH3)4]Cl2 — хлорид тетраамминцинка(II)
[Co(NH3)6]Cl2 — хлорид гексаамминкобальта(II)
2) Анионные комплексы: в роли комплексообразователя выступает ион с положительной степенью окисления, а лигандами являются простые или сложные анионы.
K2[BeF4] — тетрафторобериллат(II) калия
Li[AlH4] — тетрагидридоалюминат(III) лития
K3[Fe(CN)6] — гексацианоферрат(III) калия
3) Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а также при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул.
[Ni(CO)4] — тетракарбонилникель
[Pt(NH3)2Cl2] — дихлородиамминплатина(II)
По числу мест, занимаемых лигандами в координационной сфере[править | править код]

1) Монодентатные лиганды. Такие лиганды бывают нейтральными (молекулы Н2О, NH3, CO, NO и др.) и заряженными (ионы CN−, F−, Cl−, OH−, SCN−, и др.).
2) Бидентатные лиганды. Примерами служат лиганды: ион аминоуксусной кислоты H2N — CH2 — COO−, оксалатный ион −O — CO — CO — O−, карбонат-ион СО32−, сульфат-ион SO42−, тиосульфат-ион S2O32−.
3) Полидентатные лиганды. Например, комплексоны — органические лиганды, содержащие в своём составе несколько групп −С≡N или −COOH (этилендиаминтетрауксусная кислота — ЭДТА). Циклические комплексы, образуемые некоторыми полидентатными лигандами, относят к хелатным (гемоглобин и др.).
По природе лиганда[править | править код]
1) Аммиакаты — соединения, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 и др.
2) Аквакомплексы — в которых лигандом выступает вода: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др.
3) Карбонилы — комплексные соединения, в которых лигандами являются молекулы оксида углерода(II): [Fe(CO)5], [Ni(CO)4].
4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. К ним относятся комплексные соли: K2[PtCl4], комплексные кислоты: H2[CoCl4], H2[SiF6].
5) Гидроксокомплексы — комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
Номенклатура[править | править код]
1) В названии комплексного соединения первым указывают отрицательно заряженную часть — анион, затем положительную часть — катион.
2) Название комплексной части начинают с указания состава внутренней сферы. Во внутренней сфере прежде всего называют лиганды — анионы, прибавляя к их латинскому названию окончание «о». Например: Cl− — хлоро, CN− — циано, SCN− — тиоцианато, NO3− — нитрато, SO32− — сульфито, OH− — гидроксо и т. д. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква, для оксида углерода(II) — карбонил.
3) Число монодентатных лигандов указывают греческими числительными: 1 — моно (часто не приводится), 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Для полидентатных лигандов (например, этилендиамин, оксалат) используют бис-, трис-, тетракис- и т. д.
4) Затем называют комплексообразователь, используя корень его латинского названия и окончание -ат, после чего римскими цифрами указывают (в скобках) степень окисления комплексообразователя.
5) После обозначения состава внутренней сферы называют внешнюю сферу.
6) В названии нейтральных комплексных частиц комплексообразователь указывается в именительном падеже, а степень его не указывается, так как она однозначно определяется, исходя из электронейтральности комплекса.
Примеры:
K3[Fe(CN)6] — гексацианоферрат(III) калия
(NH4)2[PtCl4(OH)2] — дигидроксотетрахлороплатинат(IV) аммония
[Сr(H2O)3F3] — трифторотриаквахром
[Co(NH3)3Cl(NO2)2] — динитритохлоротриамминкобальт
[Pt(NH3)4Cl2]Cl2 — хлорид дихлоротетраамминплатины(IV)
[Li(H2O)4]NO3 — нитрат тетрааквалития
История[править | править код]
Основателем координационной теории комплексных соединений является швейцарский химик Альфред Вернер (1866—1919). Координационная теория Вернера 1893 года была первой попыткой объяснить структуру комплексных соединений. Эта теория была предложена до открытия электрона Томсоном в 1896 году, и до разработки электронной теории валентности. Вернер не имел в своём распоряжении никаких инструментальных методов исследований, а все его исследования были сделаны интерпретацией простых химических реакций.

Представления о возможности существования «дополнительных валентностей», зародившиеся при изучении четвертичных аминов, Вернер применяет и к «комплексным соединениям». В статье «К теории сродства и валентности», опубликованной в 1891 г., Вернер определяет сродство как «силу, исходящую из центра атома и равномерно распространяющуюся во всех направлениях, геометрическое выражение которой, таким образом, представляет собой не определённое число основных направлений, а сферическую поверхность».
Два года спустя в статье «О строении неорганических соединений» Вернер выдвинул координационную теорию, согласно которой в неорганических молекулярных соединениях центральное ядро составляют комплексообразующие атомы. Вокруг этих центральных атомов расположено в форме простого геометрического полиэдра определённое число других атомов или молекул. Число атомов, сгруппированных вокруг центрального ядра, Вернер назвал координационным числом. Он считал, что при координационной связи существует общая пара электронов, которую одна молекула или атом отдает другой. Поскольку Вернер предположил существование соединений, которые никто никогда не наблюдал и не синтезировал, его теория вызвала недоверие со стороны многих известных химиков, считавших, что она без всякой необходимости усложняет представление о химической структуре и связях. Поэтому в течение следующих двух десятилетий Вернер и его сотрудники создавали новые координационные соединения, существование которых предсказывалось его теорией. В числе созданных ими соединений были молекулы, обнаруживающие оптическую активность, то есть способность отклонять поляризованный свет, но не содержащие атомов углерода, которые, как полагали, были необходимы для оптической активности молекул.
В 1911 г. осуществление Вернером синтеза более чем 40 оптически активных молекул, не содержащих атомов углерода, убедило химическое сообщество в справедливости его теории.
В 1913 г. Вернеру была присуждена Нобелевская премия по химии «в знак признания его работ о природе связей атомов в молекулах, которые позволяли по-новому взглянуть на результаты ранее проведённых исследований и открывали новые возможности для научно-исследовательской работы, особенно в области неорганической химии». По словам Теодора Нордстрема, который представлял его от имени Шведской королевской академии наук, работа Вернера «дала импульс развитию неорганической химии», стимулировав возрождение интереса к этой области после того, как она какое-то время пребывала в забвении.
Структура и стереохимия[править | править код]
Строение комплексных соединений рассматривают на основе координационной теории, предложенной в 1893 г. швейцарским химиком Альфредом Вернером, лауреатом Нобелевской премии. Его научная деятельность проходила в Цюрихском университете. Ученый синтезировал много новых комплексных соединений, систематизировал ранее известные и вновь полученные комплексные соединения и разработал экспериментальные методы доказательства их строения.
В соответствии с этой теорией в комплексных соединениях различают комплексообразователь, внешнюю и внутреннюю сферы. Комплексообразователем обычно является катион или нейтральный атом. Внутреннюю сферу составляет определённое число ионов или нейтральных молекул, которые прочно связаны с комплексообразователем. Их называют лигандами. Число лигандов определяет координационное число (КЧ) комплексообразователя. Внутренняя сфера может иметь положительный, отрицательный или нулевой заряд.
Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешнюю координационную сферу.
Если заряд лигандов компенсирует заряд комплексообразователя, то такие комплексные соединения называют нейтральными или комплексами-неэлектролитами: они состоят только из комплексообразователя и лигандов внутренней сферы. Таким нейтральным комплексом является, например, [Pt(NH3)2Cl2].
Природа связи между центральным ионом (атомом) и лигандами может быть двоякой. С одной стороны, связь обусловлена силами электростатического притяжения. С другой — между центральным атомом и лигандами может образоваться связь по донорно-акцепторному механизму по аналогии с ионом аммония. Во многих комплексных соединениях связь между центральным ионом (атомом) и лигандами обусловлена как силами электростатического притяжения, так и связью, образующейся за счёт неподеленных электронных пар лигандов и свободных орбиталей комплексообразователя.
Комплексные соединения, имеющие внешнюю сферу, являются сильными электролитами и в водных растворах диссоциируют практически нацело на комплексный ион и ионы внешней сферы.
При обменных реакциях комплексные ионы переходят из одних соединений в другие, не изменяя своего состава.
Наиболее типичными комплексообразователями являются катионы d-элементов. Лигандами могут быть:
а) полярные молекулы — NH3, Н2О, CO, NO;
б) простые ионы — F−, Cl−, Br−, I−, H+;
в) сложные ионы — CN−, SCN−, NO2−, OH−.
Для описания взаимосвязи пространственного строения комплексных соединений и их физико-химических свойства используются представления стереохимии. Стереохимический подход — удобный прием представления свойств вещества в части влияния того или иного фрагмента структуры вещества на свойство.
Объекты стереохимии — комплексные соединения, органические вещества, высокомолекулярные синтетические и природные соединения. А. Вернер, один из основоположников координационной химии, приложил большие усилия к развитию неорганической стереохимии. Именно стереохимия является центральной в этой теории, до сих пор остающийся ориентиром в координационной химии.
Изомерия координационных соединений[править | править код]
В статистическом аспекте стереохимии центральным оказывается явление изомерии координационных соединений.
Свойство изомерии химических соединений было известно ещё при разработке классической теории химического строения.
Изомерия молекул открыта в 1823 г. Ю.Либихом, обнаружившим, что серебряная соль гремучей кислоты и изоцианат серебра имеют один и тот же элементный состав, но разные физические и химические свойства.
Под изомерией понимают способность к разному взаимному расположению атомов и атомных фрагментов в соединениях одинакового общего состава, диктующую отличия в химических и физических свойствах соответствующих соединений — изомеров. В случае координационных соединений указанные различия могут быть связаны как со спецификой расположения лигандов во внутренней координационной сфере, так и с распределением лигандов между внутренней и внешними сферами.
Изомерия прямо связана с наличием или отсутствием в соединении тех или иных элементов симметрии: поворотных осей, зеркально-поворотных осей, центра и плоскостей симметрии.
Стереохимическая конфигурация характеризует относительное пространственное расположение атомов или групп атомов в молекуле химического соединения. Смысл этого термина зависит от конкретного пространственного расположения атомов в структуре комплекса. Его используют для описания фигуры или многогранника вместе с дополнительным определением, характеризующим специфику пространственного расположения атомов. Так, можно говорить о цис- или транс-конфигурации; D (d), L(l), DL (dl) — соответственно право-, левовращающая конфигурация, рацемат.
Существуют изомеры двух типов:
1) соединения, в которых состав внутренней сферы и строение координированных лигандов идентичны (геометрические, оптические, конформационные, координационного положения);
2) соединения, для которых возможны различия в составе внутренней сферы и строении лигандов (ионизационные, гидратные, координационные, лигандные).
Пространственная (геометрическая) изомерия[править | править код]
Этот вид изомерии вызван неодинаковым размещением лигандов во внутренней сфере относительно друг друга. Необходимым условием геометрической изомерии является наличие во внутренней координационной сфере не менее двух различных лигандов. Геометрическая изомерия проявляется преимущественно у комплексных соединений, имеющих октаэдрическое строение, строение плоского квадрата или квадратной пирамиды. С увеличением числа различных лигандов во внутренней сфере растет число геометрических изомеров.
-
![цис-[CoCl2(NH3)4]+](https://upload.wikimedia.org/wikipedia/commons/thumb/b/be/Cis-dichlorotetraamminecobalt%28III%29.png/132px-Cis-dichlorotetraamminecobalt%28III%29.png)
цис-[CoCl2(NH3)4]+
-
![транс-[CoCl2(NH3)4]+](https://upload.wikimedia.org/wikipedia/commons/thumb/5/56/Trans-dichlorotetraamminecobalt%28III%29.png/150px-Trans-dichlorotetraamminecobalt%28III%29.png)
транс-[CoCl2(NH3)4]+
-
![Гран- (fac-) граневой-[CoCl3(NH3)3]](https://upload.wikimedia.org/wikipedia/commons/thumb/6/69/Fac-trichlorotriamminecobalt%28III%29.png/109px-Fac-trichlorotriamminecobalt%28III%29.png)
Гран- (fac-) граневой-[CoCl3(NH3)3]
-
![Ос- (mer-) реберный-[CoCl3(NH3)3]](https://upload.wikimedia.org/wikipedia/commons/thumb/5/54/Mer-trichlorotriamminecobalt%28III%29.png/136px-Mer-trichlorotriamminecobalt%28III%29.png)
Ос- (mer-) реберный-[CoCl3(NH3)3]
Оптическая изомерия[править | править код]
Оптическая изомерия связана со способностью некоторых комплексных соединений существовать в виде двух форм, не совмещаемых в трехмерном пространстве и являющихся зеркальным отображением друг друга, как левая рука и правая. Поэтому оптическую изомерию называют иногда ещё зеркальной изомерией.
-
![Λ-[Fe(ox)3]3−](https://upload.wikimedia.org/wikipedia/commons/thumb/d/df/Delta-tris%28oxalato%29ferrate%28III%29-3D-balls.png/110px-Delta-tris%28oxalato%29ferrate%28III%29-3D-balls.png)
Λ-[Fe(ox)3]3−
-
![Δ-[Fe(ox)3]3−](https://upload.wikimedia.org/wikipedia/commons/thumb/6/6e/Lambda-tris%28oxalato%29ferrate%28III%29-3D-balls.png/111px-Lambda-tris%28oxalato%29ferrate%28III%29-3D-balls.png)
Δ-[Fe(ox)3]3−
-
![Λ-цис-[CoCl2(en)2]+](https://upload.wikimedia.org/wikipedia/commons/thumb/1/12/Delta-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png/78px-Delta-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png)
Λ-цис-[CoCl2(en)2]+
-
![Δ-цис-[CoCl2(en)2]+](https://upload.wikimedia.org/wikipedia/commons/thumb/8/81/Lambda-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png/78px-Lambda-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png)
Δ-цис-[CoCl2(en)2]+
Структурная изомерия
Гидратная (сольватная) изомерия заключается в различном распределении молекул растворителя между внутренней и внешней сферами комплексного соединения, в различном характере химической связи молекул воды с комплексообразователем. Например: [Cr(H2O)6]Cl3 (фиолетовый), [Cr(H2O)5Cl]Cl2 ∙ H2O (светло-зелёный), [Cr(H2O)4Cl2]Cl ∙ 2H2O (темно-зелёный).
Ионизационная изомерия определяется различным распределением заряженных лигандов между внутренней и внешней сферами комплекса и характеризует способность координационных соединений с одним и тем же элементным составом давать в растворе разные ионы. Примеры соединений: [Co(NH3)5Br]SO4 (красно-фиолетовый), [Co(NH3)5SO4]Br (красный).
Координационная изомерия связана с переходом лигандов от одного комплексообразователя к другому: [Co(NH3)6][Cr(CN)6] и [Cr(NH3)6][Co(CN)6].
Электронные свойства[править | править код]
Окраска[править | править код]
Окраска комплексных соединений зависит от типа лигандов и комплексообразователя. Из-за расщепления энергии d-орбиталей появляется возможность перехода электронов с подуровней dxy,
dzy, dxz на вакантные подуровни с более высокой энергией dz2,dz2-y2 под действием поглощаемых квантов света. Эти явления можно наблюдать с помощью электронной спектроскопии. В зависимости от разности расщепленных уровней комплексы поглощают кванты света определённых диапазонов длин волн, поэтому имеют соответствующую окраску.
| FeII | FeIII | CoII | CuII | AlIII | CrIII | |
|---|---|---|---|---|---|---|
| Гидратированный ион | [Fe(H2O)6]2+ Бледно-зелёный |
[Fe(H2O)5(ОН)]2+ Жёлто-коричневый |
[Co(H2O)6]2+ Розовый |
[Cu(H2O)6]2+ Серо-голубой |
[Al(H2O)6]3+ Бесцветный |
[Cr(H2O)6]3+ Бледно-зелёный |
| OH–, разбавленный раствор | [Fe(H2O)4(OH)2] Светло-зелёный |
[Fe(H2O)3(OH)3] Коричневый |
[Co(H2O)4(OH)2] Голубой |
[Cu(H2O)4(OH)2] Синий |
[Al(H2O)3(OH)3] Белый |
[Cr(H2O)3(OH)3] Зелёный |
| OH–, концентрированный раствор | [Fe(H2O)4(OH)2] Светло-зелёный |
[Fe(H2O)3(OH)3] Коричневый |
|[Co(H2O)4(OH)2] Голубой |
[Cu(H2O)4(OH)2] Синий |
[Al(OH)4]– Бесцветный |
[Cr(OH)6]3- Бледно-зелёный |
| NH3, разбавленный раствор | [Fe(H2O)4(OH)2] Светло-зелёный |
[Fe(H2O)3(OH)3] Коричневый |
[Co(H2O)4(OH)2] Голубой |
[Cu(H2O)4(OH)2] Синий |
[Al(H2O)3(OH)3] Белый |
[Cr(H2O)3(OH)3] Зелёный |
| NH3, концентрированный раствор | [Fe(H2O)4(OH)2] Светло-зелёный |
[Fe(H2O)3(OH)3] Коричневый |
[Co(NH3)6]2+ Жёлтый |
[Cu(NH3)4(H2O)2]2+| Темно-синий |
[Al(H2O)3(OH)3] Белый |
[Cr(NH3)6]3+ Бледно-зелёный |
| CO32- | FeCO3 Светло-зелёный |
[Fe(H2O)3(OH)3] Коричневый |
CoCO3 Розовый |
CuCO3 Голубой |
Магнитные свойства[править | править код]
Среди химических соединений, в том числе комплексных, различают парамагнитные и диамагнитные, по-разному взаимодействующие с внешним магнитным полем. Парамагнитные комплексы обладают моментом µ и поэтому при взаимодействии с внешним магнитным полем втягиваются в него. Напротив, диамагнитные комплексы, не имея собственного магнитного момента, выталкиваются из внешнего магнитного поля. Парамагнитные свойства веществ обусловлены наличием в их структуре неспаренных электронов и в случае комплексов объясняются специфическим заполнением электронами энергетических уровней.
Существуют два принципа, определяющих заполнение электронами d-орбиталей, расщепленных на dε и dγ -подуровни.
1. Электроны заполняют орбитали так, чтобы число неспаренных электронов было максимальным (правило Хунда).
2. Сначала заполняются орбитали, имеющие меньшую энергию.
С учетом этих правил при числе d-электронов в комплексообразователе от 1 до 3 или 8, 9, 10 их можно расположить по d-орбиталям только одним способом (в соответствии с правилом Хунда). При числе электронов от 4 до 7 в октаэдрическом комплексе возможно либо занятие орбиталей, уже заполненных одним электроном, либо заполнение свободных dγ -орбиталей более высокой энергии. В первом случае потребуется энергия на преодоление отталкивания между электронами, находящимися на одной и той же орбитали, во втором — для перехода на орбиталь более высокой энергии. Распределение электронов по орбиталям зависит от соотношения между величинами энергий расщепления (Δ) и спаривания электронов (Р). При низких значениях Δ («слабое поле»), величина Δ может быть < Р, тогда электроны займут разные орбитали, а спины их будут параллельны. При этом образуются внешнеорбитальные (высокоспиновые) комплексы, характеризующиеся определённым магнитным моментом µ. Если энергия межэлектронного отталкивания меньше, чем Δ («сильное поле»), то есть Δ > Р, происходит спаривание электронов на dε -орбиталях и образование внутриорбитальных (низкоспиновых) комплексов, магнитный момент которых µ = 0. Величину магнитного момента комплекса можно определить путем измерения зависимости его магнитной восприимчивости от температуры. При более точном анализе магнитной восприимчивости комплекса необходимо также учесть диамагнитные поправки, которые образуются от всех атомов, входящих в состав его молекулы. Эти поправочные коэффициенты называются константами Паскаля.
Применение[править | править код]
- Гальванические покрытия — защита одного металла другим. Комплексные соединения цианидов имеют важное значение в гальванопластике, так как из обычной соли бывает невозможно получить настолько прочное покрытие, как при использовании комплексных соединений.
- Электролитическое получение металлов. Например, алюминий в расплаве криолита образует комплекс Nа3[AlF6]. Из расплавов соединений комплексных солей получают такие металлы, как Nb, Tl, Th, Mg.
- Защита металлов от коррозии. Ингибиторы — комплексные соли, где лигандами выступают и органические вещества.
- Аналитическая химия. Многие индикаторы, реактивы, которые помогают распознать вещества, ионы и даже заряды ионов, — комплексные соединения.
- Многие комплексные соединения обладают каталитической активностью существенно более высокой, чем соответствующие металлы в чистом виде, а их растворимость обеспечивает необходимую доступность атома катализатора в совершенно иных температурных условиях, нежели металл в твёрдой фазе. Поэтому их широко используют в неорганическом и органическом синтезах. Таким образом, с использованием комплексных соединений связана возможность получения многообразных химических продуктов: лаков, красок, фотоматериалов и т. д.
- Получение и очистка металлов.
- Химические методы извлечения металлов из руд связаны с образованием КС. Например, для отделения золота от породы руду обрабатывают раствором цианида натрия в присутствии кислорода.
- Для получения чистых железа, никеля, кобальта используют термическое разложение карбонилов металлов. Эти соединения — летучие жидкости, легко разлагающиеся с выделением соответствующих металлов.
- Важнейшие органические соединения — гемоглобин и хлорофилл — тоже соединения комплексные, они представляют собой порфириновое кольцо с ионом металла в центре.
- Синтез многих лекарственных препаратов, витаминов, биодобавок и многих других веществ связан с комплексными соединениями.
Ссылки[править | править код]
- Комплексные соединения — статья из Большой советской энциклопедии.
- Комплексообразование
Литература[править | править код]
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2003. — 743 с.
- Глинка Н. Л. Общая химия. — М.: Высшая школа, 2003. — 743 с.
- Киселев Ю. М. Химия координационных соединений. — М.: Интеграл-Пресс, 2008. — 728 с.
- Ершов. Общая химия. — Издание восьмое,стериотипное. — Москва: Высшая школа, 2010. — 560 с.
См. также[править | править код]
- Внутрикомплексные соединения
- Альфред Вернер
- Лиганд
- Изомерия
- Координационное число
