Как расставлять заряды ионов и Степень Окисления в Веществах?
По химии я очень мало чего понимаю, она мне просто не даётся. У нас контрольная работа скоро и я хотел бы узнать как расставлять заряды ионов и степень окисления в веществах. Для примера нам дали такие вещества – Al2(SO4)3 , Ba(NO3)2 , Na2SiO3 , Ni3(PO4)2.
Vatman
19 декабря 2018 · 124,0 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · 22 февр 2019 ·
Что такое ион? 👻
Это частица, которая образуется из атома, если ему подарят электроны🙂ну или отберут их🙄
Есть элементы, которые имеют всегда один и тот же заряд иона) у других надо смотреть по обстоятельствам😊
Они находятся в 1А,2А и 3А группах в таблице Менлелеева😊
🔹Если 1 группа А подгруппа, то всегда +1 (у них достаточно забрать всего один электрон😊)
🔹Если 2А, то +2 (отбирают уже 2 электрона)
🔹Если 3А,то +3
👻Что такое степень окисления? 👻
Это условная величина, которая показывает заряд атома в соединении)
Максимальная степень окисления равна номеру группы, минимальная N группы-8🤯😱
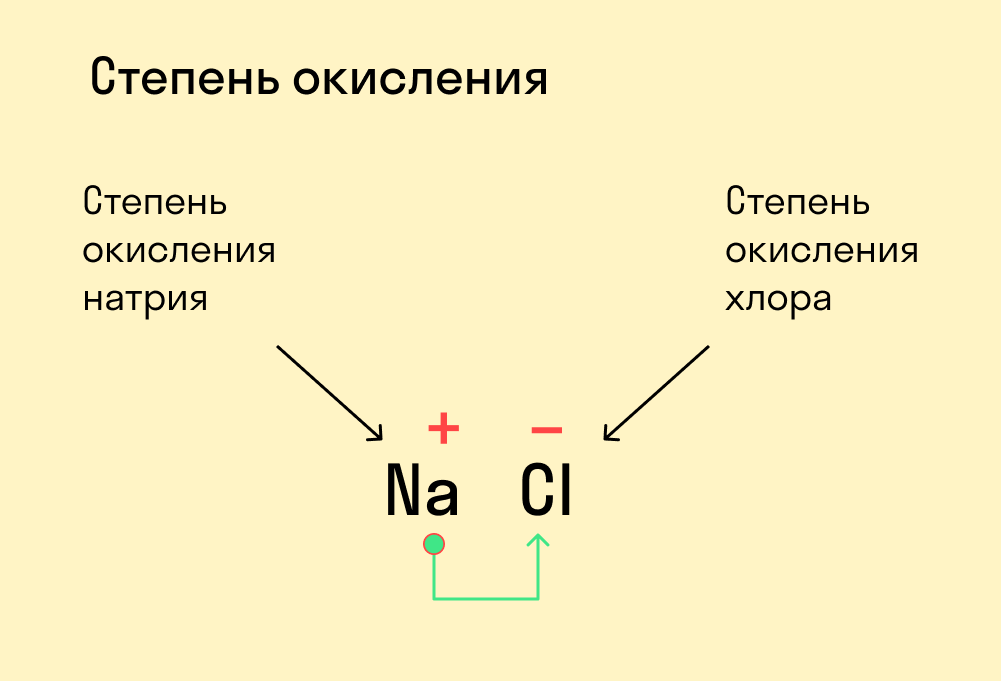
Возьмём для примера Na2SiO3😊
Na имеет степень окисления +1, он лежит в 1А группе
О имеет всегда – 2,хотя и находится в 6А🤯 Это нужно запомнить
У Si +4, он лежит в 4А группе
А теперь с зарядами ионов разберемся)
У Na +1, но в Na2SiO3 таких ионов 2🙂
Значит, получаем SiO3 2-
55,0 K
Спасибо, всё по полаочкам разложила.
Комментировать ответ…Комментировать…
Специальность — аграрное хозяйство. В кругу интересов, хобби и изучения: арт, психология… · 22 янв 2020
Возьми таблицу растворимости, и выписывай из нее то, что есть в правом вернем углу; остальное просто посчитай по индексам, валентности. Например Fr2SO4; SO4 по таблице 2-, а так как после франция стоит индекс два от валентности SO4, степень окисления франция выходит 1+.
11,1 K
Комментировать ответ…Комментировать…
Степень окисления элемента
О чем эта статья:
Что такое степень окисления
Для начала давайте вспомним, как проходят химические связи в молекуле вещества. Взаимодействуя между собой, атомы могут притягивать или отдавать электроны для образования общей электронной пары. Атом с более высокой электроотрицательностью (ЭО) притягивает электроны и приобретает отрицательный заряд, а атом с меньшей ЭО, напротив, отдает электроны и обретает положительный заряд.
Степень окисления — это условный заряд, который предположительно обретет атом после перемещения электронов. Он вычисляется из предположения, что все свободные электроны полностью перемещаются от одного атома к другому и все образованные связи — ионные.
Почему в определении степени окисления мы говорим об условном заряде? Потому что в реальности он может быть другим, а химические связи атома в соединении не обязательно будут ионными. Но мы предполагаем, что все именно так, чтобы немного упростить расчеты. Это помогает в составлении формул и классификаций.
Запомните:
Численно степень окисления равна количеству электронов, которые перешли от одного атома к другому.
У атома с меньшей ЭО, который отдает электроны, — положительная степень окисления.
У атома с большей ЭО, который притягивает электроны, — отрицательная степень окисления.
Простые вещества, такие как Cl2, O2 и т. д., имеют степень окисления, равную 0, поскольку смещения электронов в данном случае не происходит.
Как рассчитать степень окисления
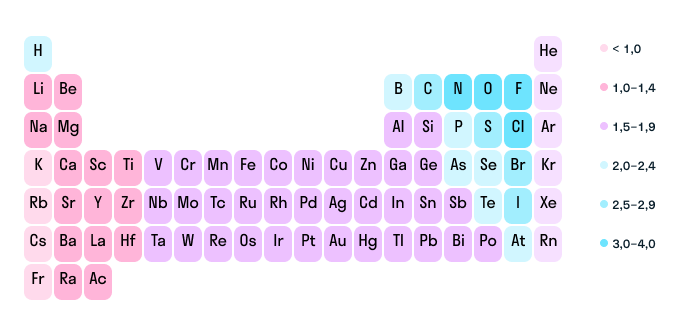
Как мы уже выяснили выше, определить степень окисления элемента (иначе говоря, окислительное число) помогает электроотрицательность. Значения ЭО легко узнать, пользуясь таблицей Менделеева или шкалой относительной электроотрицательности. Сравните, у какого химического элемента в соединении ЭО выше — этот элемент будет притягивать электроны и приобретет отрицательный заряд.
Шкала относительной электроотрицательности
Это правило поможет составить уравнение и посчитать степень окисления любого химического элемента в соединении, если известны данные по остальным элементам. Еще больше облегчат расчеты следующие закономерности:
у водорода в гидридах окислительное число −1, а во всех остальных веществах оно равно +1;
у кислорода степень окисления в оксидах равна −2, в пероксидах −1, в соединениях с фтором +2;
у неметаллов в соединениях с водородом и металлами окислительное число всегда отрицательное;
у металлов степень окисления всегда положительная.
Также есть элементы, которые во всех соединениях отдают или принимают одинаковое количество электронов, поэтому их окислительное число — постоянная величина.
Алгоритм действий
Итак, мы знаем основные закономерности. Давайте разберемся, как находить степени окисления на примерах. Предлагаем следующий алгоритм действий.
Посмотрите, является ли вещество элементарным. Если да — значит, оно находится в химически несвязанном состоянии и окислительное число равно 0. Это правило подходит как для веществ, образованных из отдельных атомов, так и для тех, что включают многоатомные молекулы одного и того же элемента.
Пример
Если это соединение, определите, состоит ли оно из ионов. В многоатомном ионе сумма всех степеней окисления равна его заряду. Узнайте эту сумму из таблицы растворимости и составьте уравнение с известными окислительными числами.
Пример
Допустим, нужно определить заряд азота в ионе аммония.
Согласно таблице растворимости заряд иона аммония NH4 + равен +1. Это значит, что сумма степеней окисления в этом соединении тоже будет равна +1.
Также известно, что водород всюду, кроме гидридов, имеет заряд +1. В данном случае есть 4 атома водорода, т. е. +1 × 4.
Составим формулу: х + (+1) × 4 = +1. Значит х = −3.
Окислительное число азота в ионе аммония равно −3, т. е. N -3 H4 +1 .
Если соединение — нейтральная молекула, составьте уравнение, учитывая, что все окислительные числа в сумме равны 0.
Пример
Допустим, нужно определить степень окисления серы в соединении Na2SO4.
Мы знаем, что у щелочного металла Na постоянное окислительное число +1. Кислород, согласно вышеизложенным правилам, в оксидах имеет заряд −2.
Составим уравнение: (+1) × 2 + х + (−2) × 4 = 0. Значит х = −6.
Степень окисления серы равна −6, т. е. Na2 +1 S -6 O4 -2 .
Как узнать степень окисления нескольких элементов
А как быть, если неизвестны окислительные числа двух и более элементов в соединении? В математике уравнения с двумя неизвестными не всегда имеют решение. Но в химии есть выход: можно разделить химическую формулу на несколько частей, которые имеют постоянные заряды.
Пример
Как вычислить степень окисления в сложном веществе (NH4)2SO4? Посмотрим на него как на соединение двух ионов с известными зарядами: NH4 + и SO4 2- .
Поскольку мы знаем окислительные числа водорода и кислорода, найти заряды азота и серы в каждом ионе не составит труда.
В ионе NH4 + формула для определения заряда азота будет следующей: х + (+1) × 4 = 1. Понятно, что х = −3, т. е. степень окисления азота −3.
В ионе SO4 2- формула для серы х + (−2) × 4 = −2. Следовательно, х = 6, т. е. заряд серы равен +6.
Как определить высшую и низшую степень окисления
Выделяют высшую (или максимально положительную) и низшую (максимально отрицательную) степени окисления. В диапазоне между ними располагаются окислительные числа, которые могут принадлежать данному химическому элементу в различных соединениях. Для четных групп характерны четные числа в диапазоне, а для нечетных групп — нечетные.
Высшая степень окисления совпадает с номером группы элемента (для элементов в главной подгруппе) в короткой форме периодической системы.
Низшая степень окисления равна числу, которое получится, если от номера группы элемента отнять 8.
Исключения: фтор, железо, кобальт, родий, подгруппа никеля, кислород, благородные газы (помимо ксенона).
Проиллюстрируем на примере, как найти высшую и низшую степень окисления.
Хлор (Cl), согласно короткой периодической таблице, принадлежит к группе VII. Значит, его максимальное окислительное число будет +7. Такой условный заряд элемент приобретает в оксиде хлора Cl2O7 и хлорной кислоте HClO4. Минимальное число получаем следующим образом: 7 − 8 = −1 (характерно для хлороводорода HCl).
По степени окисления можно понять, как поведет себя вещество в окислительно-восстановительных реакциях. Если в соединении главный действующий элемент имеет высшую степень окисления, оно является окислителем, а если он имеет низшую степень окисления — восстановителем.
Например, серная кислота является окислителем, поскольку у серы в данном случае заряд +6. А вот в сернистой кислоте у серы заряд всего +4, поэтому она может проявлять и окислительную способность, и восстановительную. В сероводороде заряд серы равен −2, и это минимальная степень окисления, а значит, данное вещество — восстановитель.
Как найти степень окисления в органическом соединении
В органической химии определять окислительные числа элементов немного сложнее, поскольку все органические вещества включают углерод, известный большим количеством неполярных связей. Если у нас всего один атом углерода, можно использовать стандартный способ.
Пример
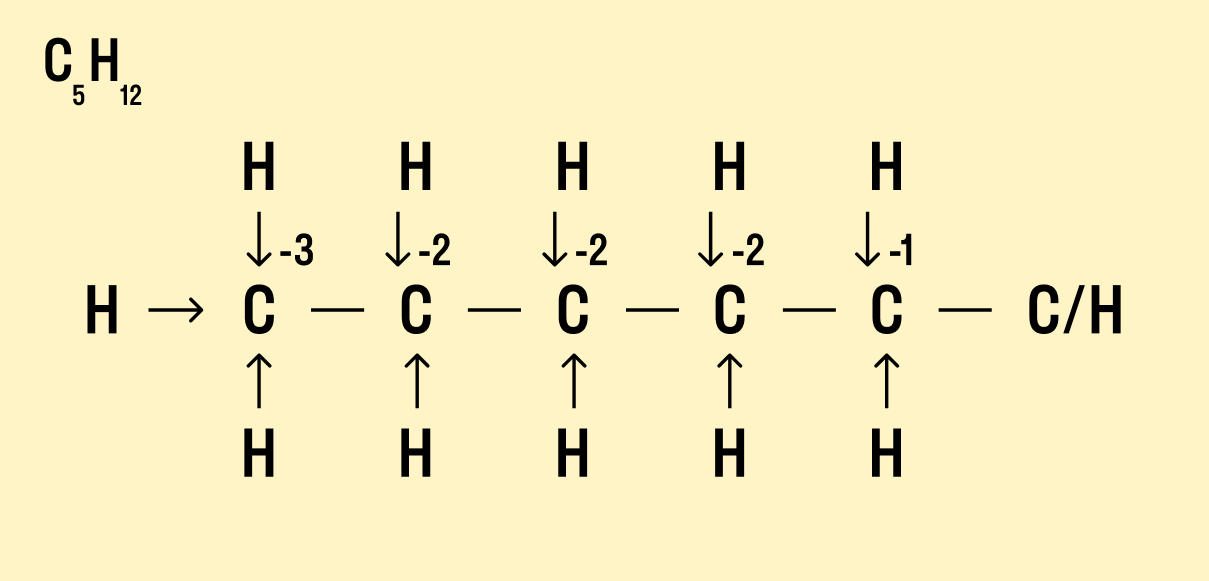
Рассчитайте степень окисления углерода в метаноле H3C−OH.
Мы знаем, что водород Н имеет окислительное число +1, а у кислорода в данном случае оно равно −2. Составим уравнение:
х + (+1) × 4 + (+2) × 1 = 0
Заряд углерода равен −2, т. е. C -2 H4 +1 O -2 .
Но что делать, если атомов углерода больше? Придется анализировать структурную формулу, чтобы понять, какие химические связи есть между элементами и сколько электронов они теряют/приобретают в результате. Такой вариант нахождения окислительного числа называют графическим.
Графический метод
Нарисуйте структурную формулу соединения.
Изобразите стрелками химические связи и смещение атомов (все связи между атомами углерода С−С считайте неполярными).
Посчитайте, сколько стрелок ведет к атому (это «−») и сколько от него (это «+»), а затем суммируйте «+» и «−», чтобы узнать степень окисления.
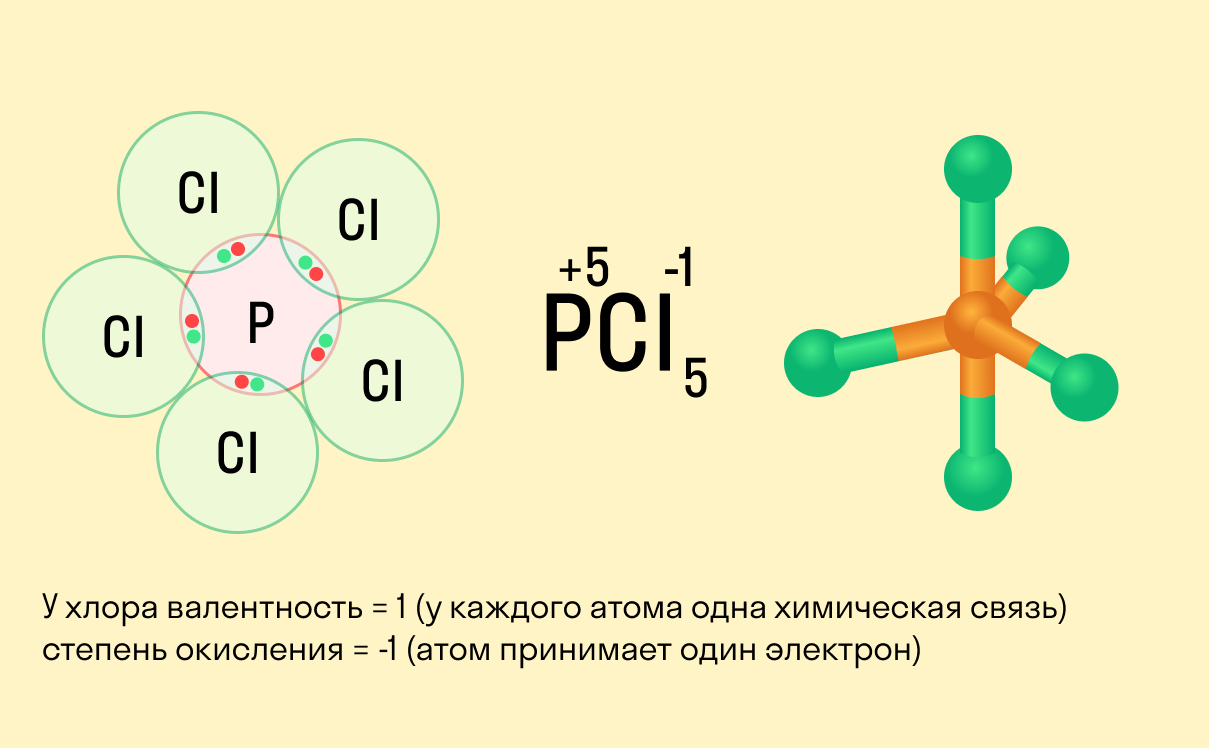
Валентность и степень окисления: в чем разница?
Школьники, которые только начали изучать данные разделы химии, нередко путают степень окисления и валентность. Численно эти показатели могут совпадать (но далеко не всегда), а вот по смыслу они в корне различаются.
Между этими двумя понятиями есть следующие отличия:
валентность не имеет знака, в то время как у окислительного числа он есть («+» или «−»);
валентность равна нулю только в том случае, если атом не имеет связей с другими частицами, а степень окисления может быть равна нулю и при наличии таких связей;
вычисляя степень окисления, мы предполагаем, что в соединении ионные связи, хотя на самым деле это может быть не так, а валентность всегда имеет реальный смысл.
Поэтому отождествлять эти два понятия ни в коем случае не стоит. Более того, не нужно ориентироваться на валентность, пытаясь определить окислительное число.
Вопросы для самопроверки
Почему степень окисления называют формальным зарядом, условным?
Что отражает численная величина степени окисления?
Чему равна сумма всех окислительных чисел в ионе?
Как определить низшую степень окисления?
Как найти две неизвестных степени окисления в одном веществе?
Как определять степени окисления в органических веществах?
Как определить степень окисления?
Степень окисления – это формальный заряд атома. Слово «формальный» означает, что этого заряда у атома в действительности может и не быть, вернее, он может оказаться немного другим. Однако по разным причинам эти условные заряды удобны и химики всего мира пользуются понятием «степень окисления».
Отметим, что степень окисления указывается в верхнем правом углу атома в формате или , где – целое число. Например:
Существуют определённые правила нахождения степени окисления.
- Степень окисления простых веществ равна нулю. Напомню, что простыми называют вещества, состоящие из одного вида атомов. Примеры:
- Некоторые атомы в сложных соединениях проявляют только одну степень окисления. Такие степени окисления называются постоянными.
– Исключения у водорода соединения , в которых у водорода степень окисления
– Исключения у кислорода
- Сумма степеней окисления всех атомов сложного соединения должна быть равна нулю. Пользуясь именно эти правилом, мы будем расставлять степени окисления в сложных соединениях.
Как именно?
Пример 1: расставьте степени окисления в соединении .
Мы знаем степень окисления тогда мы можем найти, что общее количество «плюсов» у четырех атомов . Чтобы в сумме был ноль, у трех атомов заряд должен быть , значит у каждого атома
Пример 2: Найдите степени окисления всех атомов в соединении
Сначала подпишем постоянные степени окисления
Посчитаем общее количество плюсов и минусов
Для того, чтобы плюсов и минусов было одинаковое количество у двух хромов в сумме должно быть , а значит, у каждого атома
Пример 3: Найдите степени окисления всех атомов в соединении
Для начала заметим, что для нахождения степени окисления удобно «раскрыть скобки» и представить соединение как и тогда задание выполняется аналогично заданию из примера 2.
Ответ:
- В некоторых устоявшихся группах атомов в составе веществ (кислотные остатки и ион аммония) степени окисления атомов неизменны и их тоже стоит запомнить.
Пользуясь этими правилами, можно расставить степени окисления практически во всех соединений, встречающихся на ЕГЭ по химии.
Как расставлять и как определить степень окисления элементов
В химических процессах главную роль играют атомы и молекулы, свойства которых определяют исход химических реакций. Одной из важных характеристик атома является окислительное число, которое упрощает метод учета переноса электронов в частице. Как определить степень окисления или формальный заряд частицы и какие правила необходимо знать для этого?
Определение

Термин окисление (оксидация) в химии означает реакцию, в ходе которой группа атомов или один из них теряют электроны или приобретают, в случае приобретения реакцию называют «восстановлением».
Степень окисления – это величина, которая измеряется количественно и характеризует перераспределяемые электроны в ходе реакции. Т.е. в процессе оксидации электроны в атоме уменьшаются или увеличиваются, перераспределяясь между другими взаимодействующими частицами, и уровень оксидации показывает, как именно они реорганизуются. Данное понятие тесно связано с электроотрицательностью частиц – их умением притягивать и отталкивать от себя свободные ионы.
Это интересно! Что такое алканы: строение и химические свойства
Определение уровня оксидации зависит от характеристик и свойств конкретного вещества, поэтому нельзя однозначно назвать процедуру вычисления легкой или сложной, но ее результаты помогают условно записать процессы окислительно-восстановительных реакций. Следует понимать, что полученный результат вычислений является результатом учета переноса электронов и не имеет физического смысла, а также не является истинным зарядом ядра.
Важно знать! Неорганическая химия часто использует термин валентности вместо степени окисления элементов, это не является ошибкой, но следует учитывать, что второе понятие более универсальное.
Понятия и правила вычислений движения электронов являются основой для классификации химических веществ (номенклатура), описания их свойств и составления формул связи. Но наиболее часто данное понятие используется для описания и работы с окислительно-восстановительными реакциями.
Правила определения степени окисления
Как узнать степень окисления? При работе с окислительно-восстановительными реакциями важно знать, что формальный заряд частицы всегда будет равен величине электрона, выраженного в числовом значении. Эта особенность связана с тем предположением, что электронные пары, образующие связь, всегда полностью смещаются в сторону более отрицательных частиц. Следует понимать, что речь идет об ионных связях, а в случае реакции при ковалентной связи электроны будут делиться поровну между одинаковыми частицами.
Окислительное число может иметь как положительные, так и отрицательные значения. Все дело в том, что в процессе реакции атом должен стать нейтральным, а для этого нужно либо присоединить к иону некое количество электронов, если он положительный, либо отнять их, если он отрицательный. Для обозначения данного понятия при записи формулы обычно прописывают над обозначением элемента арабскую цифру с соответствующим знаком. Например, 

Следует знать, что формальный заряд металлов всегда будет положительным, а в большинстве 
- У простых элементов всегда равна нулю:
или
.
- У фтора всегда будет равна -1.
- Как и у металлов, у элементов из групп IA, IIA и IIIA групп всегда одинаковая – это номер группы, в которой они расположены.
- У кислорода в любой связи равна -2, кроме связей с пероксидами (Н2О2), когда значение равно -1 и оксидом фтора (O+2F2-1, O2+1F2-1), когда она равна +2.
- У водорода всегда +1, кроме его взаимодействия с гидридами (Na+H- и связями по типу C+4H4-1).
- У простого вещества без связей с другими элементами всегда равна нулю.
- У простого иона с одним атомом равна числу его электрона (Na+, Ca+2).
- Если рассматривается связь двух веществ различной природы (металл и неметалл), то отрицательное окислительное число будет наблюдаться у вещества, которое обладает большей электроотрицательностью (H+F-, Cu+Br-), а положительное, соответственно, у элемента с электроотрицательностью больше нуля.
- У щелочных металлов, таких как литий, натрий, калий и прочих, всегда +1.
- У металлов из главной подгруппы II (магний, барий, кальций и стронций) равна +2.
- У алюминия всегда одинаковое значение — +3.
Запомнив эти особенности, достаточно просто будет определять окислительное число у элементов, независимо от сложности и количества уровней атомов.
Полезное видео: определение степени окисления
Как определить степень окисления
Периодическая таблица Менделеева содержит почти всю необходимую информацию для работы с химическими элементами. Например, школьники используют только ее для описания химических реакций. Так, чтобы определить максимальные положительные и отрицательные значения окислительного числа необходимо свериться с обозначением химического элемента в таблице:
- Максимально положительное – это номер группы, в которой находится элемент.
- Максимально отрицательная степень окисления – это разница между максимально положительной границей и числом 8.
Таким образом, достаточно просто узнать крайние границы формального заряда того или иного элемента. Такое действие можно совершить с помощью вычислений на основе таблицы Менделеева.
Важно знать! У одного элемента могут быть одновременно несколько различных показателей оксидации.
Различают два основных способа определения уровня оксидации, примеры которых представлены ниже. Первый из них – это способ, который требует знаний и умений применять законы химии. Как расставлять степени окисления с помощью этого способа?
Для этого необходимо:
- Определить, является ли данное вещество элементарным и находится ли оно вне связи. Если да, то его окислительное число будет равно 0, независимо от состава вещества (отдельные атомы или многоуровневые атомные соединения).
- Определить, состоит ли рассматриваемое вещество из ионов. Если да, то степень оксидации будет равна их заряду.
- Если рассматриваемое вещество металл, то посмотреть на показатели других веществ в формуле и вычислить показания металла путем арифметических действий.
- Если все соединение имеет один заряд (по сути это сумма всех частиц представленных элементов), то достаточно определить показатели простых веществ, затем вычесть их от общей суммы и получить данные металла.
- Если связь нейтральная, то общая сумма должна быть равна нулю.
Это интересно! Уроки химии: что это такое галогены
Для примера можно рассмотреть объединение 
Этот способ весьма хорош, поскольку правильность решения всегда можно проверить, если сложить все уровни оксидации вместе.
Второй метод можно применять без знания химических законов:
- Найти данные частиц, по отношению к которым нет строгих правил и точное количество их электронов неизвестно (можно путем исключения).
- Выяснить показатели всех прочих частиц и после из общей суммы путем вычитания найти нужную частицу.
Рассмотрим второй метод на примере вещества Na2SO4, в котором не определен атом серы S, известно лишь, что он отличен от нуля.
Это интересно! Уроки химии: катионы и анионы – что это такое
Чтобы найти, чему равны все степени окисления необходимо:
- Найти известные элементы, помня о традиционных правилах и исключениях.
- Ион Na = +1, а каждый кислород = -2.
- Умножить количество частиц каждого вещества на их электроны и получить степени оксидации всех атомов, кроме одного.
- В Na2SO4 состоят 2 натрия и 4 кислорода, при умножении получается: 2 X +1 = 2 – это окислительное число всех частиц натрия и 4 X -2 = -8 – кислородов.
- Сложить полученные результаты 2+(-8) =-6 – это общий заряд соединения без частицы серы.
- Представить химическую запись в виде уравнения: сумма известных данных + неизвестное число = общий заряд.
- Na2SO4 представлено следующим образом: -6 + S = 0, S = 0 + 6, S = 6.
Таким образом, чтобы использовать второй метод, достаточно знать простые законы арифметики.
Таблица оксидации
Для простоты работы и вычисления показателей оксидации для каждого химического вещества используют специальные таблицы, где прописаны все данные.
Она выглядит следующим образом:
Полезное видео: учимся определять степень окисления по формулам
Вывод
Нахождение степени окисления для химического вещества – это простое действие, которое требует лишь внимательности и знания основных правил и исключений. Зная исключения и пользуясь специальными таблицами, это действие не будет занимать много времени.
[spoiler title=”источники:”]
http://ege-study.ru/ru/ege/materialy/himiya/kak-opredelit-stepen-okisleniya/
http://znaniya.guru/himiya/kak-rasstavlyat-i-kak-opredelit-stepen-okisleniya-elementov.html
[/spoiler]
Как определить заряд комплексного иона
Существует целый класс сложных химических веществ – комплексных соединений. В их состав входят: центральный атом – комплексообразователь, внутренняя и внешняя сфера. Внутренняя сфера может состоять как из ионов, так и из молекул, а также из сочетания ионов и молекул. Внешней сферой может быть как положительно заряженный катион, так и отрицательно заряженный анион. Комплексообразователь вместе с внутренней сферой образуют так называемый комплексный ион.

Инструкция
Первым делом напишите точную формулу комплексного соединения. Вот, например, желтая кровяная соль – гексацианоферрат калия. Ее формула: К4[Fe(CN)6].
Определите состав комплексного иона. В данном случае это ион [Fe(CN)6], величину и знак заряда которого вам надо определить. А четыре иона калия составляют внешнюю сферу этого соединения.
Теперь вам поможет одно из основных правил химии, гласящее: любая молекула электрически нейтральна. То есть в данном конкретном случае суммарный заряд молекулы гексацианоферрата калия также равен нулю. А это может быть только тогда, когда заряд комплексного иона [Fe(CN)6] уравновешен суммарным зарядом четырех ионов калия, находящихся во внешней сфере. То есть заряд комплексного иона такой же по размерности, но с противоположным знаком.
Посмотрите в таблицу Менделеева. Калий – один из самых активных металлов, он уступает только своим собратьям по первой главной группе таблицы – рубидию, цезию и францию. Следовательно, по сравнению с другими элементами, входящими в состав этого соединения, – железом (Fe), углеродом (С) и азотом (N), калий, безусловно, самый электроположительный. То есть он будет не притягивать к себе общую электронную плотность молекулы, а отталкивать ее от себя. Это вполне объяснимо, ведь у калия на внешнем электронном уровне всего один электрон, и ему гораздо легче отдать его (чтобы предыдущий уровень, на котором восемь электронов, стал устойчивым), нежели притянуть еще целых семь.
Таким образом, каждый атом калия, образуя химическую связь в этой молекуле, отдал по одному электрону и превратится, соответственно, в ион с положительным зарядом +1. Таких ионов четыре, следовательно, суммарный заряд внешней сферы равен +4. А чтобы молекула была нейтральной, его должен уравновесить заряд -4. Вот и ответ на поставленный вопрос.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Заряд иона определяется следующим образом:
Атом любого вещества состоит из электронной оболочки и ядра. Ядро состоит из двух типов частиц – нейтронов и протонов. Нейтроны не имеют электрического заряда, то есть электрический заряд нейтронов равен нулю. Протоны являются положительно заряженными частицами и имеют электрический заряд, равный +1. Количество протонов характеризует атомный номер данного атома.
2
Электронная оболочка атома состоит из электронных орбиталей, на которых расположено разное количество электронов. Электрон – отрицательно заряженная элементарная частица. Ее электрический заряд равен -1.
При помощи связей атомы могут также соединяться в молекулы.
3
В нейтральном атоме количество протонов равно количеству электронов. Поэтому его заряд равен нулю.
Чтобы определить заряд иона, необходимо знать его структуру, а именно количество протонов в ядре и количество электронов на электронных орбиталях.
4
Суммарный заряд иона получается в результате алгебраического суммирования зарядов входящих в него протонов и электронов. Число электронов в ионе может превышать число протонов, и тогда ион будет отрицательным. Если число электронов меньше числа протонов, то ион будет положительным.
5
Зная химический элемент, по таблице Менделеева мы можем определить его атомный номер, который равен количеству протонов в ядре атома этого элемента (например 11 у натрия) . Если один из электронов покинул атом натрия, то у атома натрия будет уже не 11, а 10 электронов. Атом натрия станет положительно заряженным ионом с зарядом зарядовое число равно = 11+(-10) = +1.
Обозначаться такой ион будет символом натрий с плюсом сверху, в случае заряда +2 – двумя плюсами и. т. д. Соответственно для отрицательного иона используется знак «минус» .
3аряд
внутренней сферы комплексного соединения
представляет собой алгебраическую
сумму зарядов образующих ее частиц.
Например,
величина и знак заряда комплекса [Fe
(C
2О4)2]
определяется следующим образом. Заряд
иона железа равен +3, суммарный заряд
двух оксалат ионов – (–4). Следовательно,
заряд комплекса =(+3)+(–4)=–1 и формула
комплекса [Fe(С2О4)2]
—.
Заряд комплексного иона численно равен
суммарному заряду внешней сферы и
противоположен ему по знаку. Например,
заряд внешней сферы К3[Fe(CN)
6]
равен +3. Следовательно, заряд комплексного
иона равен -3.
3аряд
комплексообразователя равен по
величине и противоположен по знаку
алгебраической сумме зарядов всех
остальных частиц комплексного соединения.
Отсюда,
в К3
[Fe(CN)
6]
заряд иона железа равен +3, т.к. суммарный
заряд всех остальных частиц комплексного
соединения равен (+3) + (–6) = –3.
Наиболее
устойчивые и разнообразные комплексы
по составу и выполняемым ими функциям
образуют d–элементы. Особенно большое
значение имеют комплексные соединения
переходных элементов: железа, марганца,
кобальта, меди, цинка и молибдена, которые
выступают в качестве комплексообразователя.
Биогенные s–элементы (Na, К, Mg, Са) образуют
комплексные соединения только с лигандами
определенной циклической структуры,
выступая также в качестве
комплексообразователя. Основная часть
р–элементов (N, Р, S, О) является активной
действующей частью комплексообразующих
частиц (лигандов) в том числе и биолигандов.
В этом состоит их биологическая
значимость.
Следовательно,
способность
к комплексообразованию –
это общее свойство химических элементов
периодической системы Д. И. Менделеева,
эта способность уменьшается в следующем
порядке: f>d>p>>s.
2. Химическая связь в комплексных соединениях и особенности их строения
В
образовании комплексных соединений
важную роль играют донорно – акцепторные
взаимодействия лиганда и центрального
атома. Донором электронной пары, как
правило, является лиганд. Акцептором –
центральный атом, который имеет свободные
орбитали. Связь эта прочна и не разрывается
при растворении комплекса (неионогенна)
и ее называют координационной.
Наряду
с s-связями образуются p-связи по
донорно-акцепторному механизму. При
этом донором служит ион металла отдающий
свои спаренные d-электроны
лиганду, имеющему энергетически выгодные
вакантные орбитами. Такие связи называют
дативными. Они образуются: а) за счет
перекрывания вакантных р-орбиталей
металла с d-орбиталью
металла на которой находятся электроны
не вступившие в s-связь (dp-pp
взаимодействие); б) при перекрывании
вакантных d-орбиталей
лиганда с заполненными d-орбиталями
металла (dp-dp
взаимодействие).
Ионы
d–элементов образуют с биосубстратами
(белками) прочные комплексы. А мягкие
кислоты Cd, Pb, Hg сильно токсичны. Они
образуют прочные комплексы с белками
содержащими R—SH группы,
2R—SH+Hg
2+
®R—S—Hg—S—R+2H+
Цианид–ион
токсичен. Мягкий лиганд активно
взаимодействует с d–металлами в
комплексах с биосубстратами, активируя
последние.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #