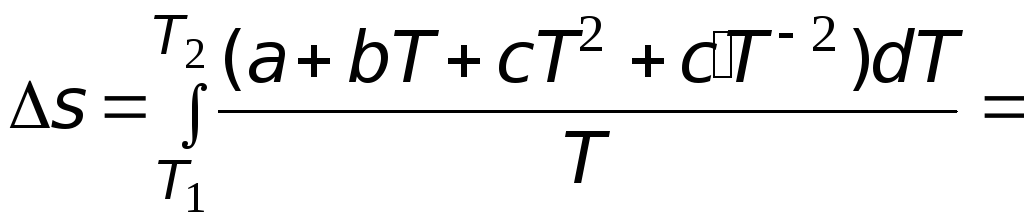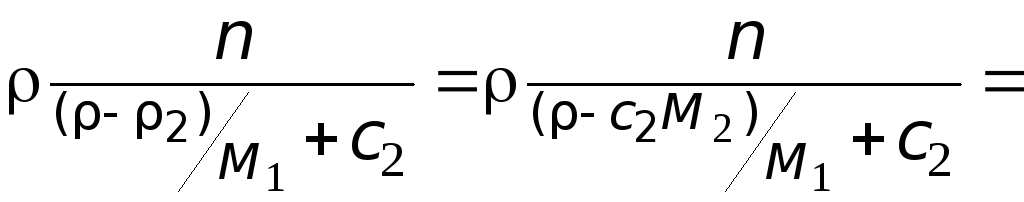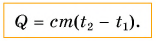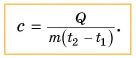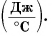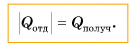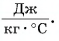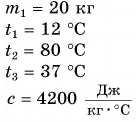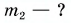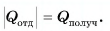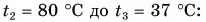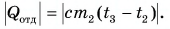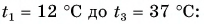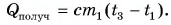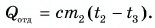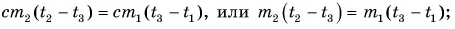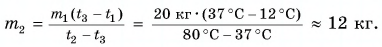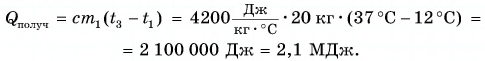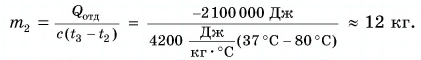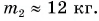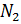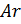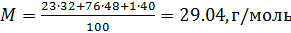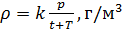…
Здесь вы найдете примеры задач на вычисление таких термодинамических параметров как энтальпия, энтропия, энергия Гиббса. Определение возможности самопроизвольного протекания процесса, а также составление термохимических уравнений.
Задачи к разделу Основы термодинамики с решениями
Задача 1. Рассчитайте стандартную энтальпию и стандартную энтропию химической реакции. Определите в каком направлении при 298 °К (прямом или обратном) будет протекать реакция. Рассчитайте температуру, при которой равновероятны оба направления реакции.
Fe2O3 (к) + 3H2 = 2Fe(к) + 3H2O(г)
Показать решение »
Решение.
ΔHр-ции = ΣH0кон – ΣH0исх кДж/моль
Используя справочные данные стандартных энтальпий веществ, находим:
ΔHр-ции = 2·ΔH0Fe+3·ΔH0H2O— ΔH0Fe2O3 — 3·ΔH0H2= 2·0 + 3·(- 241,82) – (-822,16) — 3·0 = 96,7 кДж/моль
ΔSр-ции=ΣS0кон – ΣS0исх Дж/(моль·K)
Используя справочные данные стандартных энтропий веществ, находим:
ΔSр-ции = 2·ΔS0Fe + 3·ΔS0H2O — ΔS0Fe2O3 — 3·ΔS0H2= 2·27,15 + 3·188,7 – 89,96 — 3·131 = 137,44 Дж/(моль·K)
ΔG = ΔH – TΔS= 96,7 – 298 ·137,44 /1000 = 55,75 кДж/моль
При Т=298°К, ΔG > 0 – реакция не идет самопроизвольно, т.е. реакция будет протекать в обратном направлении.
Чтобы рассчитать температуру, при которой равновероятны оба направления реакции, надо ΔG приравнять к нулю:
ΔG = ΔH – TΔS = 0, тогда
T= — (ΔG – ΔH) / ΔS= — (0-96,7)/0,137 = 705,83 K
При Т = 705,83 К реакция будет идти равновероятно как в прямом так и в обратном направлении.
Задача 2. Вычислите энергию Гиббса и определите возможность протекания реакции при температурах 1000 и 3000 К.
| Cr2O3 (т) + 3C (т) = 2Cr (т) + 3CO (г) | |||||
| ΔH298, кДж/моль | — 1141 | 0 | 0 | — 110,6 | |
| ΔS298, Дж/(моль×К) | 81,2 | 5,7 | 23,6 | 197,7 |
Показать решение »
Решение.
Вычисления энергии Гиббса проводим согласно выражению:
ΔGр-ции = ΔHр-ции – TΔSр-ции
Необходимо рассчитать энтальпию и энтропию химической реакции.
ΔHр-ции = ΣH0кон – ΣH0исх кДж/моль
Используя справочные данные стандартных энтальпий веществ, находим:
ΔHр-ции= 2·ΔH0Cr + 3·ΔH0CO — ΔH0Cr2O3 — 3·ΔH0C= 2·0 + 3·(- 110,6) – (-1141) — 3·0 = 809,2 кДж/моль
ΔSр-ции=ΣS0кон – ΣS0исх Дж/моль·K
Аналогично, используя справочные данные стандартных энтропий веществ, находим:
ΔSр-ции= 2·ΔS0Cr + 3·ΔS0CO — ΔS0Cr2O3 — 3·ΔS0C= 2·23,6 + 3·197,7 – 81,2 — 3·5,7 = 542 Дж/(моль·K)
Найдем энергию Гиббса при 1000 К
ΔG1000 = ΔH – TΔS= 809,2 – 1000 ·542 /1000 = 267,2 кДж/моль
ΔG1000 > 0, следовательно, реакция самопроизвольно не идет.
Найдем энергию Гиббса при 3000 К
ΔG3000= ΔH – TΔS = 809,2 – 3000 ·542 /1000 = — 816,8 кДж/моль
ΔG3000 ˂ 0, следовательно, реакция протекает самопроизвольно.
Задача 3. Определите тепловой эффект сгорания жидкого CS2(ж) до образования газообразных СО2 и SO2. Сколько молей CS2 вступят в реакцию, если выделится 700 кДж тепла?
Показать решение »
Решение.
Уравнение реакции сгорания жидкого сероуглерода следующее:
CS2(ж) + 3O2 = СО2 + 2SO2
Тепловой эффект реакции вычислим подставляя справочные данные стандартных энтальпий веществ в выражение:
ΔHр-ции = ΣH0кон – ΣH0исх кДж/моль
ΔHр-ции= 2·ΔH0SO2 + ΔH0CO2 — ΔH0CS2 — 3·ΔH0O2 = 2·(-296,9) + 3·(- 393,5) – 87 — 3·0 = -1075,1 кДж/моль
Т.е. при сгорании 1 моля сероуглерода выделяется 1075,1 кДж тепла
а при сгорании x молей сероуглерода выделяется 700 кДж тепла
Найдем х:
x = 700·1/1075,1 = 0,65 моль
Итак, если в результате реакции выделится 700 кДж тепла, то в реакцию вступят 0,65 моль CS2
Задача 4. Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
1. FeO (к) + CO (г) = Fe (к) + CО2 (г); ΔH1 = -18,20 кДж;
2. СO (г) + 1/2O2 (г) = СO2 (г) ΔН2 = -283,0 кДж;
3. H2 (г) + ½ O2 (г) = H2O (г) ΔН3 = -241,83 кДж.
Показать решение »
Решение.
Реакция восстановления оксида железа (II) водородом имеет следующий вид:
4. FeO (к) + H2 (г) = Fe (к) + H2O (г)
Чтобы вычислить тепловой эффект реакции необходимо применить закон Гесса, т.е. реакцию 4. можно получить, если сложить реакции 1. и 2. и вычесть реакцию 1.:
ΔHр-ции = ΔH1 + ΔH3 – ΔH2 = -18,2 – 241,3 + 283 = 23 кДж
Таким образом, тепловой эффект реакции восстановления оксида железа (II) водородом равен
ΔHр-ции = 23 кДж
Задача 5. Реакция горения бензола выражается термохимическим уравнением:
С6Н6(ж) + 7½ О2(г) = 6СО2(г) + 3Н2О(г) – 3135,6 кДж.
Вычислите теплоту образования жидкого бензола. Определите теплотворную способность жидкого бензола при условии, что стандартные условия совпадают с нормальными.
Показать решение »
Решение.
Тепловой эффект реакции равен:
ΔHр-ции = ΣH0кон – ΣH0исх кДж/моль
В нашем случае ΔHр-ции = – 3135,6 кДж, найдем теплоту образования жидкого бензола:
ΔHр-ции= 6·ΔH0СO2 + 3·ΔH0H2O — ΔH0C6H6 – 7,5·ΔH0O2
-ΔH0C6H6 = ΔHр-ции — 3·(-241,84) + 6·(- 393,51) – 7,5·0 = — 3135,6 — 3·(-241,84) + 6·(- 393,51) – 7,5·0 = — 49,02 кДж/моль
ΔH0C6H6 = 49,02 кДж/моль
Теплотворная способность жидкого бензола вычисляется по формуле:
QТ = ΔHр-ции · 1000 / М
М(бензола) = 78 г/моль
QТ = – 3135,6· 1000 / 78 = — 4,02·104 кДж/кг
Теплотворная способность жидкого бензола QТ = — 4,02·104 кДж/кг
Задача 6. Реакция окисления этилового спирта выражается уравнением:
С2Н5ОН(ж) + 3,0 О2(г) = 2СО2(г) + 3Н2О(ж).
Определить теплоту образования С2Н5ОН(ж), зная ΔН х.р. = — 1366,87 кДж. Напишите термохимическое уравнение. Определите мольную теплоту парообразования С2Н5ОН(ж) → С2Н5ОН(г), если известна теплота образования С2Н5ОН(г), равная –235,31 кДж·моль-1.
Показать решение »
Решение.
Исходя из приведенных данных, запишем термохимическое уравнение:
С2Н5ОН(ж) + 3О2(г) = 2СО2(г) + 3Н2О(ж) + 1366,87 кДж
Тепловой эффект реакции равен:
ΔHр-ции = ΣH0кон – ΣH0исх кДж/моль
В нашем случае ΔHр-ции = – 1366,87 кДж.
Используя справочные данные теплот образования веществ, найдем теплоту образования С2Н5ОН(ж):
ΔHр-ции= 2·ΔH0СO2 + 3·ΔH0H2O — ΔH0C2H5OH(ж) – 3·ΔH0O2
– 1366,87 =2·(-393,51)+ 3·(-285,84) — ΔH0C2H5OH – 3·0
ΔH0C2H5OH(ж) = -277,36 кДж/моль
ΔH0C2H5OH(г) = ΔH0C2H5OH(ж) + ΔH0парообразования
ΔH0парообразования = ΔH0C2H5OH(г) — ΔH0C2H5OH(ж)
ΔH0парообразования = — 235,31 + 277,36 = 42,36 кДж/моль
Мы определили, что теплота образования С2Н5ОН(ж) равна
ΔH0C2H5OH(ж) = -277,36 кДж/моль
и мольная теплота парообразования С2Н5ОН(ж) → С2Н5ОН(г) равна
ΔH0парообразования = 42,36 кДж/моль
Задача 7. Чем можно объяснить, что при стандартных условиях, невозможна экзотермическая реакция:
СО2 (г)+Н2 (г) ↔ СО (г)+Н2О (ж)?
Рассчитайте ΔG данной реакции. При каких температурах данная реакция становится самопроизвольной?
Показать решение »
Решение.
Рассчитаем ΔG данной реакции:
ΔG = ΔH – TΔS
Для этого сначала определим ΔH и ΔS реакции:
ΔHр-ции = ΣH0кон – ΣH0исх кДж/моль
Используя справочные данные стандартных энтальпий веществ, находим:
ΔHр-ции= ΔH0H2O(ж) + ΔH0CO — ΔH0CО2 — ΔH0Н2 = -110,5 + (-285,8) – (393,5) — 0 = -2,8 кДж/моль
ΔSр-ции=ΣS0кон – ΣS0исх Дж/(моль·K)
Аналогично, используя справочные данные стандартных энтропий веществ, находим:
ΔSр-ции= ΔS0H2O(ж) + ΔS0CO — ΔS0CО2 — ΔS0Н2 = 197,5 + 70,1 — 213,7 — 130,52 = -76,6 Дж/(моль·K)
Найдем энергию Гиббса при стандартных условиях
ΔGр-ции= ΔH – TΔS= -2,8 + 298 · 76,6 /1000 = 20 кДж/моль> 0,
следовательно, реакция самопроизвольно не идет.
Найдем при каких температурах данная реакция становится самопроизвольной.
В состоянии равновесия ΔGр-ции= 0, тогда
T = ΔH/ΔS = -2,8/(-76,6·1000) = 36,6 К
Задача 8. Рассчитав на основании табличных данных ΔG и ΔS, определите тепловой эффект реакции:
2 NO (г) + Cl2 (г) ↔ 2 NOCl(г).
Показать решение »
Решение.
При постоянных температуре и давлении, изменение энергии Гиббса связано с энтальпией и энтропией выражением:
ΔG = ΔH – TΔS
На основании табличных данных рассчитаем ΔG и ΔS
ΔG0р-ции = Σ ΔG0прод — Σ ΔG0исх
ΔGр-ции = 2·ΔG0NOCl(г) — 2·ΔG0NO(г) — ΔG0Cl2(г)
ΔGр-ции = 2· 66,37 — 2· 89,69 – 0 = — 40,64 кДж/моль
ΔGр-ции < 0, значит реакция самопроизвольна.
ΔSр-ции=ΣS0кон – ΣS0исх Дж/(моль·K)
ΔSр-ции = 2·ΔS0NOCl(г) — 2·ΔS0NO(г) — ΔS0Cl2(г)
ΔSр-ции = 2· 261,6 — 2· 210,62 – 223,0 = -121,04 Дж/(моль·K)
Найдем ΔH:
ΔH = ΔG + TΔS
ΔH = — 40,64 + 298 · (-121,04/1000) = — 76,7 кДж/моль
Тепловой эффект реакции ΔH = — 76,7 кДж/моль
Задача 9. С чем будет более интенсивно взаимодействовать газообразный хлористый водород (в расчете на 1 моль): с алюминием или с оловом? Ответ дайте, рассчитав ΔG0 обеих реакций. Продуктами реакций являются твердая соль и газообразный водород.
Показать решение »
Решение.
Рассчитаем ΔG0 для реакции взаимодействия газообразного хлористого водорода (в расчете на 1 моль) с алюминием
2Al(т) + 6HCl (г) = 2AlCl3 (т) + 3H2
ΔG0р-ции = Σ ΔG0прод — Σ ΔG0исх кДж/моль
ΔG0р-ции1 = 2·ΔG0AlCl3 (т) + 3·ΔG0H2 — 2·ΔG0Al (т) — 6·ΔG0HCl(г)
ΔG0р-ции1 = 2· (-636,8) + 3·0— 2·0— 6·(-95,27) = -701,98 кДж/моль
В реакции принимает участие 2 моль Al(т), тогда ΔGр-ции1 1 моля Al(т) равно
ΔG0р-ции 1 = -701,98 / 2 = -350,99 кДж/моль
Рассчитаем ΔG0 для реакции взаимодействия газообразного хлористого водорода (в расчете на 1 моль) с оловом:
Sn(т) + 2HCl (г) = SnCl2(т) + H2
ΔG0р-ции2 =ΔG0SnCl2 (т) + ΔG0H2 — ΔG0Sn (т) — 2·ΔG0HCl(г)
ΔG0р-ции 2 = -288,4 + 0- 0- 2·(-95,27) = -97,86 кДж/моль
Обе реакции имеют ΔG0<0, поэтому они протекают самопроизвольно в прямом направлении, но более интенсивно взаимодействовать газообразный хлористый водород будет с алюминием, т.к
ΔG0р-ции 1 ˂ ΔG0р-ции 2
Задача 10. Не прибегая к вычислениям, определите, какие знаки (>0, <0, ≅0) имеют ΔG, ΔH и ΔS для протекающей в прямом направлении реакции:
4 НBr (г) + O2(г) ↔ 2 H2O(г) + 2 Br2(г)
Как повлияет повышение температуры на направленность химической реакции?
Показать решение »
Решение.
При постоянных температуре и давлении изменение энергии Гиббса связано с энтальпией и энтропией выражением:
ΔG = ΔH – TΔS
Энтропия – мера беспорядочности системы. Значение энтропии тем больше, чем больше беспорядок в системе (больше газообразных веществ). В данной реакции количество молей газов в правой части равно – 5, а в левой – 4, значит энтропия системы уменьшается ΔS˂0.
По условию задачи реакция протекает в прямом направлении, следовательно ΔG˂0.
В обычных условиях TΔS ˂˂ ΔH, поэтому в данном случае ΔH˂0 – реакция экзотермическая.
При повышении температуры может настать момент, когда значения TΔS и ΔH станут одинаковыми, тогда система придет в равновесие ΔG=0. Если температуру повысить значительно, то будет преобладать энтропийный фактор TΔS, тогда реакция самопроизвольно протекать уже не будет ΔG>0.
Расчеты изменений
энтропии в различных процессах основаны
на использовании неравенства Клаузиуса,
которое связывает изменение энтропии
с количеством теплоты
,
которым система обменивается с окружающей
средой при температуре
.
(3.1)
В данном случае
знак равенства имеет место при обратимых,
а неравенства – при необратимых
процессах.
Величину энтропии
данной системы нельзя измерить
непосредственно на опыте, но ее можно
вычислить, пользуясь формулой
.
(3.2)
Эта формула
позволяет найти не абсолютную величину
энтропии, а разности энтропий в двух
состояниях системы, т.е. изменение
энтропии при переходе системы из
состояния 1 в состояние 2.
Изменение энтропии
при постоянном давлении можно найти
интегрированием частной производной
энтропии по температуре при постоянном
давлении
,
(3.3)
где
изобарная теплоемкость системы, Дж/К.

(3.4)
При решении
уравнения (3.4) возможно два случая.
Случай 1.
Теплоемкость вещества в интервале
температур
−
не зависит от температуры. Тогда после
интегрирования (3.4) имеем:

(3.5)
Случай 2.
Теплоемкость является некоторой
функцией температуры, например для
мольной изобарной теплоемкости известны
так называемые температурные ряды
,
(3.6)
где
эмпирически найденные коэффициенты.
Их значения приводятся в справочной
литературе.
Подстановка
выражения (3.6) в (3.4) позволяет после
интегрирования получить следующее
выражение
.
(3.7)
Разность энтропий
в двух состояниях вычисляется просто,
если обратимый переход из одного
состояния в другое происходит при
постоянной температуре. Это имеет
место, например, при переходах из одного
агрегатного состояния в другое, при
фазовых переходах. Равновесные фазовые
превращения (испарение, плавление,
возгонка и т.д.) происходят в условиях
постоянства температуры и давления.
Они возможны только при подведении
(или отводе) теплоты, затрачиваемой на
проведения фазового превращения. Тогда
формула (3.4) принимает вид
,
(3.8)
где
скрытая теплота фазового превращения.
При постоянном
давлении скрытая теплота превращения
равна изменению энтальпии, т.е. например,
для фазового превращения
испарения − формула (3.8) примет вид
,
(3.9)
где
энтальпия испарения, Дж;
температура
кипения, К.
Если вещество в
указанном диапазоне температур
претерпевает фазовое превращение, то
общее изменение энтропии будет
складываться из нескольких слагаемых.
Например, пусть некое условное вещество
А
переходит из твердого состояния при
температуре
в жидкое состояние при температуре
.
Из условия задачи видно, что при
определенной температуре имеет место
фазовое превращение (фазовый переход)
плавление. Находим в справочнике эту
температуру, обозначим ее в общем виде
.
Общее изменение энтропии будет равно
сумме трех слагаемых (так называемых
вкладов).
.
(3.10)
Первый вклад в
общее изменение энтропии
это изменение энтропии при нагреве
твердого вещества от температуры
до температуры плавления

(3.11)
При температуре
плавления твердое состояние переходит
в жидкое, при этом наблюдается изменение
энтропии. Изменение энтропии при
фазовом превращении:
.
(3.12)
И, наконец,
последний вклад в общее изменение
энтропии внесет изменение энтропии
при дальнейшем нагреве уже образовавшейся
жидкости от температуры плавления до
температуры

(3.13)
Абсолютная мольная
энтропия газообразного вещества в
стандартном
состоянии при температуре Т
может быть найдена как сумма изменений
мольной энтропии в следующих процессах:
нагрев исследуемого вещества в твердом
состоянии от нуля до температуры
плавления; процесс плавления; нагрев
жидкого вещества до температуры кипения;
испарение жидкости; нагрев полученного
газообразного вещества до нужной
температуры.
+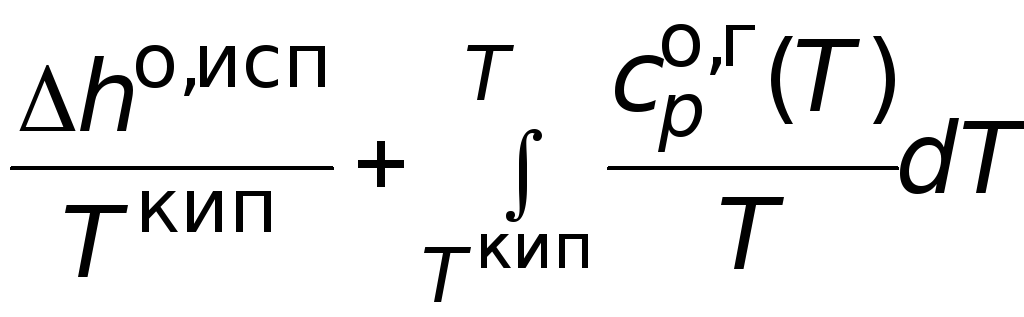
(3.14)
В справочных
термодинамических таблицах обычно
приводят значения абсолютной энтропии
в стандартном состоянии при температуре
298 К
.
Тогда расчет абсолютного значения
энтропии при какой-либо другой температуре
можно произвести исходя из значения
энтропии при 298 К, используя формулу
(3.14) и учитывая агрегатное состояние
исследуемого вещества при 298 К.
Для расчета
изменения энтальпии системы, в которой
нет химической реакции, а только
происходит изменение температуры,
например, при постоянном давлении,
воспользуемся определительным
выражением изобарной теплоемкости
,
отсюда
.
(3.15)
Так же как и при
расчете энтропии, тут возможно два
случая.
Случай 1.
Теплоемкость
вещества в интервале температур
−
не
зависит от температуры. Тогда после
интегрирования (3.15) имеем:

(3.16)
Случай 2.
Теплоемкость является некоторой
функцией температуры. Подстановка
выражения (3.6) в (3.16) позволяет после
интегрирования получить следующее
выражение
.
(3.17)
Если в указанном
диапазоне температур возможно фазовое
превращение, как это было рассмотрено
в вышеприведенном примере с нагревом
твердого вещества А,
то все изменение энтальпии
будет равно сумме
,
(3.18)
где
вклад в общее изменение энтальпии за
счет процесса нагрева
твердого вещества от температуры
до температуры плавления

(3.19)
изменение
энтальпии за счет фазового превращения,
это энтальпия фазового перехода,
находится в справочниках;
изменение энтальпии
за счет дальнейшего нагрева системы
от температуры фазового перехода до
нужной температуры. Очевидно, что форма
уравнения для расчета
будет аналогичной (3.19), только
коэффициенты температурного ряда
теплоемкости нужно брать для жидкого
вещества А.

Для расчета
изменения энергии Гиббса чистого
вещества при переходе его из состояния
I
в состояние II
удобно использовать расчетную формулу:
.
(3.20)
Более подробно
расчет изменения энергии Гиббса будет
рассмотрен при решении задачи.
Примеры задач
Пример 1.
Вычислите
изменение энтропии 1 кг этиленгликоля
при его нагреве от температуры 100 до
300 оС.
Решение. Используя
справочную литературу,
определим
коэффициенты температурных зависимостей
теплоемкостей жидкого и газообразного
этиленгликоля, температуру фазового
превращения
и величину мольной энтропии фазового
превращения.

151,0 Дж/(мольК).
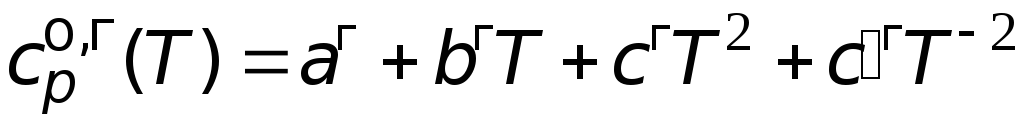
=
46,26 + 0,2005T
77,90106
T
2
Дж/(мольК).
=
479,4 К.
Мольная энтропии
испарения
= 103,4 Дж/(моль·К).
Производим расчеты.
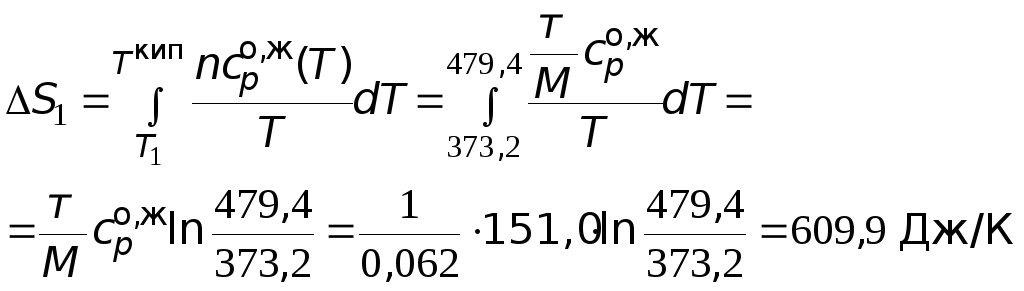
=
1667,7Дж/К.
=
= 2652,2 Дж/К = 2,65
кДж/К.
Пример
2.
Чему
равна мольная энтропия этиленгликоля
при температуре 350 К?
Решение.
Формула
(3.14) для расчета абсолютного значения
энтропии при определенной температуре
в рассматриваемом примере упрощается.
В качестве
нижнего уровня отсчета можно использовать
абсолютное значение энтропии при 298 К
и давлении 1 атм. Это справочная величина,
она равна
= 167,32 Дж/(мольК).
Выражение для расчета абсолютного
значения мольной энтропии этиленгликоля
при 350 К будет иметь вид
.
И при 298 К, и при
350 К этиленгликоль находится в одинаковом
фазовом состоянии − жидком − т.е. в
температурном интервале 298−350 К нет
фазовых превращений. Мольная изобарная
теплоемкость жидкого этиленгликоля в
исследуемом температурном интервале
постоянна и равна
=
151,0 Дж/(мольК).
191,6
Дж/(мольК).
Пример
3. Чему
равно изменение энтальпии при нагреве
1 моля этиленгликоля от 350 К до 500 К?
Решение.
В
указанный в условии диапазон температур
попадает температура фазового превращения
479,4 К, следовательно, до этой температуры
изменение энтальпии происходит за счет
нагревания жидкости, затем следует
изменение энтальпии при фазовом
превращении, а далее изменение энтальпии
связано с нагреванием газа. Расчет
проводим по формуле (3.18), перейдя к
мольным величинам, температурные
зависимости теплоемкости нам известны.
Мольную энтальпию фазового перехода
находим в справочной литературе, она
равна
48,6103
Дж/моль.
;

= 19 539,4 Дж/моль;
48,6103
Дж/моль;
=
70
702,2 Дж/моль = 70,7 кДж/моль.
Пример 4.
Вывести уравнение зависимости мольной
энтропии от температуры для газообразного
бензола при давлении 1 атм. Определить
величину стандартной мольной изобарной
теплоемкости бензола при 500 К двумя
способами.
Решение.
Зависимость мольной энтропии вещества
от температуры можно найти после
интегрирования выражений

(3.21)
Слева в уравнении
(3.21) стоит разность
.
Если в качестве первого состояния
вещества выбрать его состояние при 298
К и 1 атм, то величину мольной энтропии
()
этого вещества легко найти в справочнике.
Тогда из уравнения
(3.21) имеем
.
(3.22)
Уравнения (3.22) −
это уже зависимость мольной энтропии
от температуры, но её нужно обязательно
преобразовать, учитывая, что известно
числовое значение
,
а также значениеТ1
= 298 К.
Необходимо учитывать, что уравнение
(3.22) написано в общем виде, поэтому
включает и эмпирический коэффициент
,
и эмпирический коэффициент .
Когда уравнение будет записано для
конкретного вещества, тогда в зависимости
от природы этого вещества в уравнении
будет слагаемое или с коэффициентом
(для органических веществ), или с
коэффициентом
(для
неорганических веществ).
В рамках данной
задачи имеем следующие данные:
|
Вещество |
кДж / моль |
Дж/(моль∙К) |
Коэффициенты уравнения
|
|||
|
а |
|
|
|
|||
|
C6H6 |
82,93 |
269,2 |
21,09 |
400,12 |
169,87 |
|
Следовательно,
энтропия газообразного бензола при
любой произвольной температуре Т
.
После подстановки
числовых значений и преобразований
имеем выражение температурной зависимости
мольной энтропии газообразного бензола
.
(3.23)
Используя уравнение
(3.23), можно графически изобразить
зависимость мольной энтропии газообразного
бензола от температуры (рис. 3.1), а далее
по этой зависимости определить величину
изобарной теплоемкости бензола при
температуре 500 К. Мольная изобарная
теплоемкость связана с частной
производной энтропии по температуре
.
С
1

для того чтобы графически найти
теплоемкость, нужно определить частную
производную
энтропии от температуры в точке,
соответствующей 500 К. Графически
производную находят, проводя к
интересующей нас точке на кривой
касательную, а затем определяя угловой
коэффициента
этой касательной. Чтобы
найти угловой коэффициент касательной,
нужно взять на прямой две достаточно
удаленные друг от друга точки и определить
их координаты. Угловой коэффициент
численно равен тангенсу угла наклона
прямой (для рассматриваемого случая):
.
Затем находим
изобарную теплоемкость
.
Из анализа рис.
3.1 видно, что зависимость энтропии от
температуры имеет слабо выраженную
кривизну, и если точек для построения
кривой мало, то кажется, что такую
зависимость можно описать прямой
линией. Однако зависимость мольной
энтропии от температуры − это все-таки
кривая линия, и к ней можно провести
касательную. Рекомендованный шаг по
температуре для построения зависимости
составляет 50 К. В случае если какой-то
участок зависимости носит явно линейный
характер, угловой коэффициент касательной
будет совпадать с угловым коэффициентом
самой линии.
Следующий способ
определения мольной изобарной
теплоемкости газообразного бензола
расчетный, по формуле температурной
зависимости изобарной теплоемкости,
которая имеет вид:
= −21,09 +
0,4T
− 0,000 169Т
2
.
По этому способу
мольная изобарная теплоемкость бензола
при 500 К равна 136,66 Дж/(моль∙К). Значения
теплоемкости,
вычисленные разными способами, должны
быть близки.
Пример 5.
Углекислый
газ массой 200 г находится в состоянии
1 при температуре 600 К и давлении 2,5 атм.
Его перевели в состояние 2, при котором
температура равна 298 К, а давление 1 атм.
Принимая
свойства углекислого газа близкими к
свойствам идеального газа, найти
изменения мольных и полных 1) объема;
2) энтропии; 3) энтальпии; 4) внутренней
энергии и 5) энергии Гиббса системы
при этом переходе.
Решение.
Из
справочных таблиц определяем форму
уравнения и значения коэффициентов
температурной зависимости мольной
изобарной теплоемкости углекислого
газа
|
Вещество |
кДж / моль |
Дж/(моль∙К) |
Коэффициенты
|
|||
|
а |
|
|
|
|||
|
CО2 |
−393,51 |
213,66 |
44,14 |
9,04 |
− |
−8,54 |
= a
+ bT
+ c’T
−2
= 44,14 + 9,04∙10−3
T
8,54∙105
T
−2
.
1. Используя
уравнение состояния идеального газа,
находим изменение мольного объема
следующим образом:
=
= 4,74 ∙10−3
м3/моль.
Полное изменение
объёма углекислого газа при рассматриваемом
переходе составит
.
Число молей находим
по формуле
4,55
моль.
4,55∙4,74∙10−3
= 2,16∙10−2
м3.
2. Расчет мольного
изменения энтропии углекислого газа
при переходе из состояния 1 в состояние
2 производится по формуле

=
=
−46,89 Дж/(мольК).
Полное изменение
энтропии равно
−213,32 Дж/К.
3. Для идеального
газа изменение энтальпии не зависит
от давления, поэтому формула для расчета
мольного изменения энтальпии имеет
вид:
=
Дж/моль.
Полное изменение
энтальпии равно
=
4,55∙(−15998,5) = −72793,18 Дж.
4. Для идеального
газа мольное изменение внутренней
энергии связано с мольным изменением
энтальпии
Следовательно,
= −15998,5−8,314(298−600)=
−13487,7 Дж/моль.
Полное изменение
внутренней энергии найдем как
=4,55(−13487,7)
= − 61369 Дж.
5. Мольное изменение
энергии Гиббса при переходе углекислого
газа из состояния 1 в состояние 2 определим
как
.
Но известно, что
,
а.
Кроме того,.
Тогда
=
=
=
.
Мольные изменения
энтальпии и энтропии определены ранее,
значение мольной энтропии в состоянии
2 можно найти по справочнику, т.к. это
состояние 298 К и 1 атм:
213,66
Дж/(моль∙К).
−15998,5
−213,66(298−600)−600∙(−46,89) =76660,8 Дж/моль.
4.
ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
Для характеристики
раствора применяют следующие виды
концентраций.
−мольная
доля компонента k
(часто – молярная доля),

−массовая
доля компонента,

−молярная
концентрация (c),
другое название − плотность числа
молей,
. [c
] = моль/м3
.
−массовая
концентрация, другое название –
плотность массы компонента k,
.
[]
= кг/м3.
−моляльная
концентрация раствора, или мольно-массовая
концентрация, другое название –
мольно-массовое отношение,
. [ d
] = моль/кг.
Состояние компонента
k
в растворе нельзя описать функциями,
отвечающими чистому компоненту k.
Для описания свойств компонента в
растворе вводится понятие
парциальных
мольных свойств
компонента.
Если обозначить полное экстенсивное
свойство раствора, образованного
компонентами в общем виде, как
,
то мольное экстенсивное свойство
раствора, состоящего из компонентовk,
будет
обозначаться как
,
причем.
Вклад компонентаk
в любое экстенсивное свойство E
раствора определяется его парциальной
мольной (ПМ) величиной
,
которая равна
.
(4.1)
Следует отметить,
что парциальные мольные величины
отражают изменение
свойств и их нельзя уподоблять
соответствующим мольным величинам.
Парциальные мольные величины могут
принимать значения, которые немыслимы
для мольных величин; например, парциальный
мольный объем может быть отрицательным.
Парциальные мольные величины могут
быть образованы от любой экстенсивной
величины. В общем случае экстенсивное
свойство Е
однородной системы, состоящей из k
компонентов,
можно представить в виде функции
температуры, давления и чисел молей
компонентов, т.е.
.
Если зафиксировать постоянными давление
и температуру, то получим.
Образуем полный
дифференциал этого выражения:
.
(4.2)
С учетом (4.1) из
уравнения (4.2) можно получить
или
.
(4.3)
Учитывая, что E
− однородная
функция первой степени от независимых
аргументов nk,
и
привлекая теорему Эйлера об однородных
функциях, получаем из (4.3) выражение
.
(4.4)
Если раствор
двухкомпонентный, или как еще говорят,
бинарный, т.е. число компонентов k
= 2, то соотношения, получающиеся в этом
случае, имеют вид:
.
(4.5)
При делении
выражения (4.5) на общее число молей
получим
,
(4.6)
с учетом
определительного выражения для мольной
доли компонента k
(4.6) можно записать как
.
(4.7)
Используем эти
же выражения для объема
.
,
,
где V
– полный объем раствора;
1
и
2
парциальные мольные объемы 1 и 2
компонентов раствора; n1
и n2
– числа молей компонентов 1 и 2; N1
и N2
– мольные доли компонентов 1 и 2 в
растворе;
– мольный объем раствора.
Способы определения
парциальных мольных величин рассмотрим
на примере определения парциальных
мольных объемов в бинарном растворе.
Первый способ.
Определение парциального мольного
объема по зависимости полного объема
раствора от числа молей одного из
компонентов.
С
определительному выражению для
парциальной мольной величины (4.1),
парциальный мольный (ПМ) объем второго
компонента − это величина2
=,
а ПМ объем первого компонента − это
1
=.
Если известно уравнение зависимости,
например
,
то для получения2
=
нужно продифференцировать его.
Если
зависимость дана в форме таблицы или
в виде графика, то нужно определить
угловой коэффициент касательной к
кривой зависимости
в той точке, в которой нам требуется
определить ПМ объем. При графическом
определении частной производной нужно
найти угловой коэффициент касательной,
проведенной к кривой зависимости в
определенной точке (рис. 4.1).
Рис. 4.1. Зависимость
полного
объема раствора
от числа молей
второго компонента
(p,T,
n1
– const)
Частная производная
полного объема по числу молей второго
компонента в условиях постоянства
давления, температуры и остального
состава равна
.
Угловой коэффициент
касательной находится
Второй способ.
Определение
ПМ объемов по зависимости мольного
объема раствора от состава.
Парциальные
мольные объемы компонентов бинарной
смеси следующим образом связаны с
мольным объемом смеси
1
=
N2
.
(4.8)
2
=
+ (1 N2).
(4.9)
Из данных выражений
следует, что для вычисления парциальных
мольных объемов по этому методу
необходимо по зависимости мольного
объема от мольной доли второго компонента
определить частную производную мольного
объема раствора по мольной доле второго
компонента при постоянных давлении и
температуре
в
интересующем нас растворе. Для
определения производной, например,
графическим способом, нужно к зависимости
мольного объема раствора от состава
(см. рис. 4.2, линия ВАС)
в соответствующей точке провести
касательную и определить угловой
коэффициент этой касательной по
координатам двух достаточно удаленных
друг от друга точек, лежащих на
касательной

Далее по уравнениям
(4.8) и (4.9) вычислить парциальные мольные
объемы обоих компонентов.
Рис. 4.2. Зависимость
мольного объема раствора от состава
раствора
Третий способ.
Определение
ПМ объемов по методу Розебома
(метод отрезков).
Из анализа рис.
4.2 и уравнений (4.8−4.9) видно, что
касательная к зависимости
=f
(N2)
отсекает на левой оси ординат отрезок,
равный парциальному мольному объему
первого компонента в растворе концентрации
N2,
а на правой оси
отрезок, равный парциальному мольному
объему второго компонента в растворе
той же концентрации.
Примеры
задач
Пример 1
Жидкий бензол
массой 500 г занимает объем 568,8 см3
(293 К, 1 атм). Вычислить его мольный и
удельный объемы и плотность массы.
Дано:
Чистое вещество
– бензол
M
= 0,078 кг/моль
m
= 500 г = 0,5 кг
V
= 568,8 см3 =
5,688∙10−4
м3.
Найти:
.
Решение
= 8,887∙10−5
м3/моль
=
1,138∙10-4
м3/кг
=
=8,787∙102
кг/м3.
Пример
2.
Общее
число молей в водно-ацетоновом растворе
составляет 12,58 моль. Плотность массы
раствора и плотность числа молей ацетона
в нем равны соответственно 916 кг/м3
и 7897 моль/м3
при 298 К и 1 атм. Определить массу и объем
раствора, его мольную массу и удельное
число молей.
Дано:
двухкомпонентный раствор. Компонент
1 – вода, H2O.
Компонент 2 – ацетон, (CH3)2CO.
M1 = 0,018
кг/моль; M2 = 0,058
кг/моль; n2
=
12,58 моль; ρ = 918 кг/м3;
c2 = 7897
моль/м3.
Найти:
m,
V,
M,
nуд.
Решение. Решение
основано на взаимосвязи между
концентрационными шкалами.
Масса раствора:

=.
Объем раствора:
=
=м3.
Мольная масса
раствора:

=
кг/моль.
Удельное число
молей раствора:
=
=
моль/кг.
Пример 3. Для
двухкомпонентного водно-аммиачного
раствора приведена в табличной форме
зависимость объема раствора от числа
молей аммиака при постоянных параметрах:
температуре 293 К, давлении 1 атм и числе
молей воды 5,556 моль.
|
|
0 |
0,392 |
0,682 |
1,498 |
2,521 |
|
|
1,00 |
1,10 |
1,17 |
1,34 |
1,48 |
Вычислите
парциальные мольные объемы обоих
компонентов при мольной доле аммиака,
равной 0,15.
Дано: двухкомпонентный
раствор. Компонент 1 − вода, H2O.
M1
= 0,018 кг/моль.
Компонент 2 – аммиак, NH3.
M2
= 0,017 кг/моль. n1=
5,556 моль. N2
= 0,15. Найти:
.
Решение. Изобразим
графически данную в условии задачи
зависимость объема системы от числа
молей второго компонента.
П
определению парциальный мольный объем
компонента 2 – это частная производная
полного объема по числу молей второго
компонента в условиях постоянства
температуры, давления и числа молей
первого компонента, т.е.=
.
Полный объем
бинарного раствора может быть найден
как
.
По рис. 4.3 найдем
частную производную объема по числу
молей второго компонента
.
Для этого определим угловой коэффициент
касательной, проведенной к нашей
зависимости в определенной точке.
Данная точка должна показывать число
молей второго компонента в растворе
при мольной доле его, равной 0,15. Найдем
значение
n2
из
соотношения
.
=
моль.
При числе молей
второго компонента 0,98 восстанавливаем
перпендикуляр к кривой и проводим к
точке пересечения перпендикуляра с
кривой касательную. Затем находим
угловой коэффициент касательной
м3/моль,
= 2,210
−5 м3/моль.
Примечание.
Если зависимость полного объема от
числа молей второго компонента
представляет собой прямую линию, то
касательная будет совпадать с ходом
этой прямой.
Чтобы найти
,
воспользуемся соотношением,
причем значение полного объема системы
при числе молей второго компонента,
которое соответствует мольной доле
его 0,15, определим по графику.V
= 1,2510
−4
м3.
=
= 1,8610−5
м3/моль.
|
N2 |
0,0 |
0,255 |
0,424 |
0,617 |
0,870 |
1,000 |
|
|
7,600 |
7,982 |
8,359 |
8,790 |
9,378 |
9,800 |
Пример
4.
Для
двухкомпонентного жидкого раствора
ацетон (1-й компонент)
трихлорметан (2-й компонент) представлена
в табличной форме (Т
= 298 К, р
= 1 атм) зависимость мольного объема
раствора
от мольной доли второго компонента
N2
.
Определите
для обоих компонентов парциальные
мольные объемы
1
и
2
при мольной доле второго компонента
N2
= 0,6.
Решение.
Изображаем
данные, приведенные в условии задачи,
в виде графической зависимости мольного
объема от состава (мольная доля второго
компонента). Проводим касательную к
точке на кривой, при к
мольная доля трихлорметана (компонент
2) равна 0,6. Касательную проводим до
пересечения с осями ординат и по
величине, отсекаемой на каждой из осей,
находим значения парциальных мольных
объемов.
1
= 7,3∙10−5
м3/моль;
2
= 9,6∙10−5
м3/моль.
Пример
5.
Для
двухкомпонентного жидкого раствора
вода Н2О
(1-й компонент)
уксусная кислота С2Н4О2
(2-й компонент) имеется полученная на
опыте в табличной форме зависимость
изобарной теплоемкости Ср
от массы кислоты m2
(Т
= 298 К, р
= 1 атм) при постоянной массе воды m1
=
0,5 кг:
|
m2 |
0,0 |
0,057 |
0,088 |
0, 103 |
0,161 |
0,260 |
|
Сp, |
2090 |
2238 |
2314 |
2352 |
2476 |
2682 |
Удельные
изобарные теплоемкости чистых компонентов
1 и 2 ()равны
4180 и 2056 Дж/(Кмоль).
Требуется
1) построить график зависимости изобарной
теплоемкости смешения раствора Срm
от числа молей кислоты n2;
2) определить для обоих компонентов их
парциальные мольные изобарные
теплоемкости смешения ср1m
и
ср2m
при мольной доле второго компонента
N2
= 0,05; 3) вычислить для тех же компонентов
при той же N2
парциальные мольные изобарные
теплоемкости ср1
и ср2.
Решение
1. Для
получения зависимости изобарной
теплоемкости смешения раствора Срm
от числа молей кислоты n2
(Срm
= f(n2))
в табличной и графической формах
необходимо преобразовать
табличные данные по зависимости
изобарной
теплоемкости Ср
от массы второго компонента
(Ср=
f
(m2))
. Используя определительные выражения
для понятий число молей и функция
смешения, получим:
;
.
Пример расчета:
моль;
2238
− (4180∙0,5 +
2056∙0,057)
= 30,81 Дж/К.
|
n2 |
0 |
0,95 |
1,47 |
1,72 |
2,68 |
4,33 |
|
Срm, |
0 |
30,81 |
43,07 |
50,23 |
54,98 |
57,44 |
Данные расчетов
приведены ниже
Г
образ зависимостиСрm
= f
(n2)
приведен на рис.4.5.
Рис.
4.5. Зависимость изобарной теплоемкости
смешения раствора Срm
от числа молей кислоты n2
2. В
основе определения
и
лежит система вида
,

По
заданной мольной доле найдем координаты
точки на кривой Срm
=f(n2)
(рис.4.5),
к которой нужно проводить касательную):
и
(А)
в точке А
на кривой :
=
=1,46
моль.
(А)
= 43 Дж/К (определили по графику при n2
=1,46 моль).
Примечание.
Следует отметить, что числовые значения,
которые в этой задаче определяются по
графику, при приближенном построении
графика, конечно, не являются точными.
При графических решениях нужно
использовать миллиметровую бумагу и
достаточно крупный масштаб, тогда
значения получатся более точными.
Определим по
угловому коэффициенту касательной
тангенсу угла наклона касательной tg
2
в точке А величину парциальной мольной
изобарной теплоемкости смешения второго
компонента

Дж/(моль∙К).
Затем
можно найти
:
=
=0,496Дж/(моль∙К).
3).
Каждую из величин ср1
и ср2
находим
с помощью выражения для
:
;
= 0,496 +4180∙ 0,018
=75,736 Дж/(моль∙К).
= 20+ 2056∙ 0,060= 143,36Дж/(моль∙К).
Как правильно рассчитывать тепловой эффект реакции, изменение энтропии реакции, костанту равновесия реакции
Вычисление теплового эффекта реакции
Задача 67.
Вычислить тепловой эффект реакции: Al2O3(тв.) + 3SO3 = Al2(SO4)3(тв.) при условии, что она протекает в калориметрической бомбе при постоянном объеме и Т = 298 К.
Решение:
ΔН°Al2O3 = -1675,7 кДж/моль;
ΔН°Al2(SO4)3 = -3441,8 кДж/моль;
ΔН°SO3 = -395,8 кДж/моль
ΔН = ?
Рассчитаем энтальпию реакции при стандартных условиях, используя следствие из закона Гесса:
ΔНх.р. = ΔНобр.прод. – ΔНобр.исх.
Тогда
ΔН°298 = ΔH°Al2(SO4)3 – (ΔH°Al2O3 – 3ΔH°SO3) =
= -3441,8 – [-1675,7 + 3(-395,8)] = -578,7 кДж/моль.
Знак минус перед тепловым эффектом означает, что теплота выделяется в результате реакции.
Определение темпрературы начала протекания реакции
Задача 68.
Возможна ли реакция диссоциации углекислого газа при Т = 500 градусов цельсия? И при какой температуре эта реакция может начать протекать?
Уравнение реакции: 2CO2 = 2CO + O2.
ΔH°CO2 = -393,51 кДж/моль;
ΔH°CO = -110,53 кДж/моль;
S°СО2 = 213,66 Дж/(моль·К);
S°СО = 197,55 Дж/(моль·К);
S°О2 = 205,04 Дж/(моль·К);
T = 500 °C = 773 K;
∆G°773 = ?
Решение:
Рассчитаем энтальпию реакции при стандартных условиях, используя следствие из закона Гесса, при этом учитываем, что для простых веществ стандартная теплота образования равна нулю.
Уравнение Гесса:
ΔНх.р. = ΔНобр.прод. – ΔНобр.исх.
Тогда
ΔН°298 = 2ΔH°СО – 2ΔH°CО2) =
= 2(-110,53) – 2(-393,51) = 565,96 кДж/моль.
Знак плюс перед тепловым эффектом означает, что теплота поглощается в результате реакции.
Расчет энтропии будем вести по формуле Гесса:
∆S°х.р. = ∑S°(обр.прод.) – ∑S°(обр.исх.).
Подставив найденные значения энтропий в искомое уравнение, и произведя расчеты, получим:
∆S°х.р. = (2S°СО + S°O2) – 2S°CO2 =
= [(2 . 197,55) + 205,04] – (2 . 213,66) = 172,82 Дж/(моль . К).
Теперь находим ∆G°773х.р., выражая ∆S°х.р. в кДж/(моль·К):
∆G°773 = ΔН°298 – Т∆S°х.р.;
∆G°773х.р. = [565,96 – 773(172,82 . 10-3)] = 432.37014 кДж/моль.
Т.к. ∆G°773х.р. > 0, то реакция при 773 К не может протекать самостоятельно.
Рассчитаем температуру начала реакции, т.е. состояние равновесия её, получим.
В состоянии равновесия:
∆G = 0 и ∆H = T∆S.
Тогда
Т = ∆H/∆S;
Т = (565,96 кДж/моль)/(172,82 .10-3 кДж/моль·К) = 3274,85 K или приблизительно 3000 °С.
Причины изменения энтропии в ходе реакции
Задача 69.
Сколько тепла выделится при сгорании 50 г бензола в стандартных условиях? Подробно объясните причины изменения энтропии в ходе прямой реакции.
Решение:
m(С6Н6) = 50 г;
M(С6Н6) = 78,11 г/моль;
∆H°С6Н6(ж) = 49,03 кДж/моль;
∆H°СO2(г) = -393,51 кДж/моль;
∆H°Н2О(ж) = -285,83 кДж/моль;
S°С6Н6(ж) = 172,8 Дж/(моль . K);
S°СO2(г) = 213,67 Дж/(моль . K);
S°Н2О(ж) = 70,08 Дж/(моль . K);
S°O2(г) = 205,04 Дж/(моль . K);
Qp = ?
∆S° = ?
Уравнение реакции горения бензолы имеет вид:
С6Н6(ж) + 3,5О2 = 2СО2 + 3Н2О(ж), Q.
Рассчитаем энтальпию реакции при стандартных условиях, используя следствие из закона Гесса, при этом учитываем, что для простых веществ стандартная теплота образования равна нулю.
Уравнение Гесса:
ΔНх.р. = ΔНобр.прод. – ΔНобр.исх.
Тогда
ΔН°298 = 3ΔH°Н2О(ж) + 2∆H°СO2 – ∆H°С6Н6(ж) =
= 3(-285,83) + 2(-393,51) – 49,03 = -1595,01 кДж/моль;
Q = -ΔНх.р. = 1595,01 кДж.
Знак минус перед тепловым эффектом означает, что теплота выделяется в результате реакции.
Тогда
Qp = [m(С6Н6) . (-ΔНх.р.)]/M(С6Н6) = (50 . 1595,01)/78,11 = 1021 кДж.
Изменение энтропии химического процесса (ΔS°) определяется как разность сумм энтропий продуктов реакции и реагентов с учетом их стехиометрических коэффициентов в уравнении реакции. Расчет энтропии будем вести по формуле Гесса:
∆S°х.р. = ∑S°(обр.прод.) – ∑S°(обр.исх.).
Подставив найденные значения энтропий в искомое уравнение, и произведя расчеты, получим:
∆S°х.р. = [3S°Н2О(ж) + 2S°CO2(г)] – [S°С6Н6(ж) + 3,5S°O2(г)] =
= [(3 .70,08) + (2 . 213,67)] – [172,8 + (3,5 . 205,04] = -254.12 Дж/(моль . К).
Так как общее число молей газообразных веществ уменьшается (3,5VО2) исходных газообразных веществ и (2VСО2) газообразных продуктов), то система переходит из менее упорядоченного состояния в более упорядоченное, поэтому ∆S° < 0.
Если энтальпия ΔН° < 0 и энтропия ∆S° < 0, то процесс возможен при условии, что член (ΔН°) в уравнении для энергии Гиббса (∆G = ∆H – T∆S) больше по абсолютному значению, чем член (T∆S°); поскольку абсолютное значение члена(T∆S°) с ростом множителя (Т) увеличивается, то указанное условие будет осуществляться при достаточно низких температурах, возможно и в стандартных условиях.
Расчет стандартной энтальпии образования оксида фосфора (V)
Задача 70.
При окислении 12,4 г фосфора выделилось 306 кДж теплоты. Рассчитайте стандартную энтальпию образования оксида фосфора (V).
Решение:
m(P) = 12,4 г;
Q = 306 кДж;
∆H = ?
Уравнение реакции имеет вид:
2Р + 5/2О2 = Р2О5, Q
Из уравнения реакции вытекает, что при окислении 2 моль Р образуется 1 моль Р2О5, т.е. 2n(P) = n(Р2О5).
Рассчитаем количество окислившегося фосфора, получим:
n(P) = m(P)/M(P) = 12,4/31 = 0,4 моль.
Рассчитаем стандартную энтальпию образования оксида фосфора (V), получим:
0,4 моль : 306 кДж = 2 моль : х;
х = (306 кДж . 2 моль)/0,4 моль = 1530 кДж;
Qр = 1530 кДж;
∆H = -Qр = 11530 кДж/моль.
Расчет константы равновесия реакции (н.у.), зная значение энергии Гиббса
Задача 71.
Определите возможность протекания реакции при стандартных условиях. Если реакция возможна, то рассчитайте константу её равновесия. Как нужно изменить температуру проведения реакции, чтобы увеличить выход продуктов реакции. Дайте обоснованный ответ. Уравнение реакции имеет вид:
4HCl(г) + O2(г) = 2H2O(ж) + 2Cl2(г).
Решение:
∆H°HCl(г) = -92,31 кДж/моль;
∆H°H2O(ж) = -285,83 кДж/моль;
S°HCl(г) = 186,79 Дж/(моль . К);
S°H2O(ж) = 70,08;
S°O2(г) = 205,04 Дж/(моль . К);
S°Cl2(г) = 222,98 Дж/(моль . К);
Кр = ?
Рассчитаем энтальпию реакции при стандартных условиях, используя следствие из закона Гесса, при этом учитываем, что для простых веществ стандартная теплота образования равна нулю.
Уравнение Гесса:
ΔНх.р. = ΔНобр.прод. – ΔНобр.исх.
Тогда
ΔН°298 = 2ΔH°Н2О(ж) – 4∆H°HCl(г) =
= 2(-285,83) – 4(-92,31) = -202,42 кДж/моль.
Знак минус перед тепловым эффектом означает, что теплота выделяется в результате реакции.
Согласно 3-му следствию из закона Гесса, изменение энтропии химического процесса (ΔS°) определяется как разность сумм энтропий продуктов реакции и реагентов с учетом их стехиометрических коэффициентов в уравнении реакции. Расчет энтропии будем вести по формуле Гесса:
∆S°х.р. = ∑S°(обр.прод.) – ∑S°(обр.исх.).
Подставив найденные значения энтропий в искомое уравнение, и произведя расчеты, получим:
∆S°х.р. = [2S°Н2О(ж) + 2S°Cl2(г)] – [4S°HCl(г) + S°O2(г)] =
= [(2 . 70,08) + (2 . 222,98)] – [(4. 186,79) + 205,04] = -366,08 Дж/(моль . К).
Отрицательное значение изменения энтропии (уменьшение энтропии) свидетельствует о невозможности осуществления указанного процесса самопроизвольно в стандартных условиях.
Теперь находим ∆G°298, выражая ∆S°х.р. в кДж/(моль·К):
∆G°298 = ΔН°298 – Т∆S°х.р.;
∆G°298 = [-202,42 – 298(-366,08 . 10-3)] кДж/моль = -93,38816 кДж/моль.
Т.к. ∆G°250х.р. < 0, то реакция при 298 К может протекать самостоятельно.
Рассчитаем константу равновесия реакции (н.у.) по формуле:
lgK = ∆G°298/-5,69.
Тогда
lgK = ∆G°298/-5,69 = -202,42/-5,69 = 35,57;
К = 3,7 . 10^35.
Так как процесс идес с выделением температуры, то для увеличения выхода продукта нужно понизить температуру в системе, т.е. отводить тепло.
Расчет количества теплоты при нагревании и охлаждении:
Вы уже знаете, что изменить внутреннюю энергию тела можно передачей ему количества теплоты. Как связано изменение внутренней энергии тела, т. е. количество теплоты, с характеристиками самого тела?
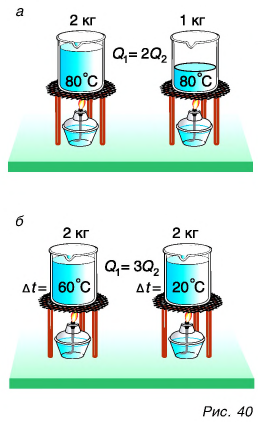
Внутренняя энергия тела есть суммарная энергия всех его частиц. Значит, если массу данного тела увеличить в два или три раза, то и количество теплоты, необходимое для его нагревания на одно и то же число градусов, увеличится в два или три раза. Например, на нагревание двух килограммов воды от 20 °C до 80 °C потребуется в два раза больше теплоты, чем на нагревание одного килограмма воды (рис. 40, а).
Очевидно также, что для нагревания воды на
Из этих рассуждений следует подтвержденный опытами вывод. Количество теплоты, необходимое для нагревания тела, прямо пропорционально его массе и изменению температуры.
А зависит ли количество теплоты, идущее на нагревание, от рода вещества, которое нагревается?
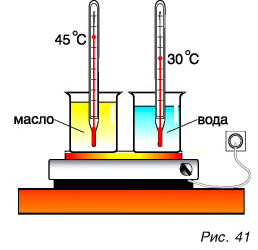
Для ответа на этот вопрос проведем опыт. В два одинаковых стакана нальем по 150 г подсолнечного масла и воды. Поместим в них термометры и поставим на нагреватель (рис. 41).
Получив за одинаковое время от нагревателя равное с водой количество теплоты, масло нагрелось больше, чем вода. Значит, для изменения температуры масла на одну и ту же величину требуется меньше теплоты, чем для изменения температуры такой же массы воды.
Поэтому для всех веществ вводят специальную величину — удельную теплоемкость вещества. Эту величину обозначают буквой с (от лат. capacite — емкость, вместимость). Теперь мы можем записать строгую формулу для количества теплоты, необходимого для нагревания:
Выразим из этой формулы с:
Удельная теплоемкость есть физическая величина, численно равная количеству теплоты, которое необходимо передать 1 кг данного вещества, чтобы изменить его температуру на 1 °C. Удельная теплоемкость измеряется в джоулях на килограмм-градус Цельсия
Для любознательных:
Часто формулу 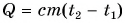
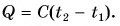
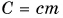
В таблице 1 представлены значения удельной теплоемкости различных веществ (в различных состояниях). Как следует из этой таблицы, среди жидкостей максимальное значение удельной теплоемкости имеет вода: для нагревания 1 кг воды на 1 °C требуется 4200 Дж теплоты — это почти в 2,5 раза больше, чем для нагревания 1 кг подсолнечного масла, и в 35 раз больше, чем для нагревания 1 кг ртути.
Формула 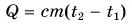
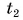
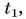
В заключение заметим, что при теплообмене двух или нескольких тел абсолютное значение количества теплоты, которое отдано более нагретым телом (телами), равно количеству теплоты, которое получено более холодным телом (телами):
Это равенство называется уравнением теплового баланса и выражает, по сути, закон сохранения энергии. Оно справедливо при отсутствии потерь теплоты.
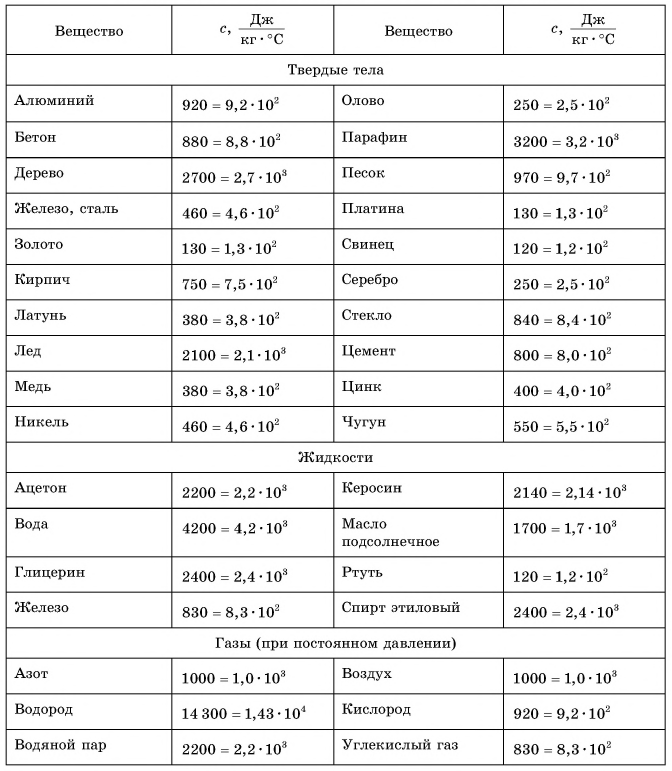
Таблица 1. Удельная теплоемкость некоторых веществ
Главные выводы:
- Количество теплоты, необходимое для нагревания тела (выделившееся при охлаждении), прямо пропорционально его массе, изменению температуры тела и зависит от вещества тела.
- Удельная теплоемкость вещества численно равна количеству теплоты, которое надо передать 1 кг данного вещества, чтобы изменить его температуру на 1 °C.
- При теплообмене количество теплоты, отданное более горячим телом, равно по модулю количеству теплоты, полученному более холодным телом, если нет потерь теплоты.
- Заказать решение задач по физике
Пример решения задачи:
Для купания ребенка в ванночку влили холодную воду массой 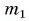
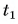
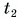
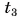
Дано:
Решение
По закону сохранения энергии
Отдавала теплоту горячая вода, изменяя свою температуру от
Холодная вода получила эту теплоту и нагрелась от
Так как нас интересует только модуль 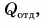
Тогда
При решении мы пренебрегали потерями теплоты на нагревание ванночки, окружающего воздуха и т. д.
Возможен и другой вариант решения.
Рассчитаем сначала количество теплоты, которое было получено холодной водой:
Полагая, что эта теплота отдана горячей водой, запишем: 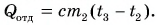
Ответ:
- Удельная теплота сгорания топлива
- Плавление и кристаллизация в физике
- Испарение жидкостей в физике
- Поверхностное натяжение жидкости
- Излучение тепла в физике
- Виды излучений в физике
- Инфракрасные излучения
- Количество теплоты в физике
Комбинированный газовый закон — это формула, которая связывает основные параметры идеального газа и позволяет вычислять неизвестные в случаях, если заданы пять остальных величин.
Идеальный газ
Идеальный газ — это математическая модель с определенными допущениями, которая позволяет исследовать свойства газообразных веществ с достаточной точностью. К допущениям, которые используются в модели идеального газа, относятся:
- пренебрежение размерами молекул;
- силы молекулярного взаимодействия не учитываются;
- соударение атомов и молекул абсолютно упруго;
- газ находится в термодинамическом равновесии.
Благодаря этим допущениям ученые изучили основные свойства газообразных веществ и вывели основные законы, которым подчиняются любые газы. Комбинированный закон объединяет все перечисленные ниже зависимости.
Газовые законы
Любое газообразное вещество характеризуется тремя простыми параметрами: объемом, давлением и температурой. Газ тем и хорош, что он заполняет весь предоставленный объем или может сжиматься до минимальных объемов, иногда переходя в состояние жидкости. Сжимать газ можно двумя способами:
- при постоянном давлении уменьшить температуру;
- при постоянной температуре увеличить давление.
Эти две простые формулировки отражают в себе два известных газовых закона: изобару и изотерму. В изобарном процессе изменение температуры приводит к прямо пропорциональному изменению объема. Вспомните жидкий азот: он занимает минимум места, при этом его температура составляет 63,29 К, что соответствует –209 градусам Цельсия. Если температуру азота поднять до 20 градусов Цельсия, то 1 литр жидкого азота превратится в 700 литров газа. Увеличивается температура, увеличивается объем и наоборот. Эти изменения обусловлены тем, что соотношение объема к температуре газа остается статичным.
В изотермическом процессе температура не изменяется и для сжатия газа придется увеличить давление. Это процесс проще для понимания, так как сдавливая газ мы уменьшаем его объем подобно тому, как утрамбовывание грунта или снега позволяет уложить их более плотно и с меньшим объемом. В этом изотермическом процессе изменение давления приводит к обратно пропорциональному изменению объема. Больше давление, меньше объем и наоборот. Такая динамика обусловлена тем, что произведение давления на объем — это всегда постоянная величина.
Если же объем газа не изменяется, то процесс называется изохорным и в этом процессе отображается взаимосвязь давления и температуры. Согласно закону, изменение одного параметра вызывает прямо пропорциональное изменение другого. Это означает, что увеличение давления в сосуде вызывает рост температуры находящегося там газа. Верно и обратное утверждение.
Комбинированный закон
Все перечисленные законы подчиняются общей формулировке: при постоянстве одного параметра, отношение двух других также постоянно. Обобщая эти законы в динамике получаем комбинированный газовый закон, который описывается формулой:
где P1, V1 и T1 — соответственно начальные давление, объем и температура, а P2, V2 и T2 — конечные.
Используя данную формулу легко определить динамику параметров во время нагрева газа или его сжатия.
Наша программа позволяет рассчитать соотношение параметров идеального газа при их изменении. Для использования калькулятора требуется задать пять известных величин, после чего программа определит последнее неизвестное. Рассмотрим небольшой пример.
Пример использования калькулятора
Представим баллон газа объемом 15 л под давлением 120 кПа и при температуре –20 градусов Цельсия. Определим температуру газа, если баллон будет заменен на емкость объемом 10 л и давлением 150 кПа. На первый взгляд у нас есть все параметры, однако в газовых законах температура обязательно указывается в кельвинах, а не градусах. Для перевода температуры в систему Си достаточно прибавить к значению величину 273. Получаем, что температура газа составляет 253 К. Теперь вводим данные в соответствующие ячейки и смотрим на результат: конечная температура теперь равна 210 К или –63 градуса Цельсия. Очевидно, что газ подчинился приведенным выше законам и при уменьшении объема его температура также уменьшилась.
Заключение
Газовые законы — серьезная тема школьного курса физики, которую более подробно разбирают на первом году обучения в вузах. Комбинированный закон газа прост на первый взгляд, но обилие параметров может запутать школьника, а выведение пропорций и вовсе способно превратить задачу в ад. Для упрощения расчетов используйте наш онлайн-калькулятор, не забывая переводить все заданные параметры в систему СИ.
Уравнение Клапейрона-Менделеева. Связь между числом молей газа, его температурой, объемом и давлением.
Калькулятор ниже предназначен для решения задач на использование уравнения Клапейрона-Менделеева, или уравнение состояния идеального газа. Некоторая теория изложена под калькулятором, ну а чтобы было понятно, о чем идет речь — пара примеров задач:
Примеры задач на уравнение Менделеева-Клапейрона
В колбе объемом 2,6 литра находится кислород при давлении 2,3 атмосфер и температуре 26 градусов Цельсия .
Вопрос: сколько молей кислорода содержится в колбе?
Вопрос: Каков объем этого газа при нормальных условиях? (Напомню, что нормальными условиями для газов считается давление в 1 атмосферу и температура 0 градусов Цельсия)
В калькулятор вводим начальные условия, выбираем, что считать (число моль, новые объем, температуру или давление), заполняем при необходимости оставшиеся условия, и получаем результат.
Уравнение Клапейрона-Менделеева. Связь между числом молей газа, его температурой, объемом и давлением.
Теперь немного формул.
где
P — давление газа (например, в атмосферах)
V — объем газа (в литрах);
T — температура газа (в кельвинах);
R — газовая постоянная (0,0821 л·атм/моль·K).
Если используется СИ, то газовая постоянная равна 8,314 Дж/K·моль
Так как m-масса газа в (кг) и M-молярная масса газа кг/моль, то m/M — число молей газа, и уравнение можно записать также
где n — число молей газа
И как нетрудно заметить, соотношение
есть величина постоянная для одного и того же количества моль газа.
И эту закономерность опытным путем установили еще до вывода уравнения. Это так называемые газовые законы — законы Бойля-Мариотта, Гей-Люссака, Шарля.
Так, закон Бойля-Мариотта гласит (это два человека):
Для данной массы газа m при неизменной температуре Т произведение давления на объем есть величина постоянная.
Закон Гей-Люссака (а вот это один человек):
Для данной массы m при постоянном давлении P объем газа линейно зависит от температуры
Закон Шарля:
Для данной массы m при постоянном объеме V давление газа линейно зависит от температуры
Посмотрев на уравнение, нетрудно убедиться в справедливости этих законов.
Уравнение Менделеева-Клапейрона, также как и опытные законы Бойля-Мариотта, Гей-Люссака и Шарля справедливы для широкого интервала давлений, объемов и температур. То есть во многих случаях эти законы удобны для практического применения. Однако не стоит забывать, что когда давления превышают атмосферное в 300-400 раз, или температуры очень высоки, наблюдаются отклонения от этих законов.
Собственно, идеальный газ потому и называют идеальным, что по определению это и есть газ, для которого не существует отклонений от этих законов.
Введение
Задача измерения параметров газовой смеси широко распространена в промышленности и торговле. Проблема получения достоверной информации при измерении параметров состояния газовой среды и её характеристик с помощью технических средств разрешается принятыми в стандартах методиками выполнения измерений (МВИ), например, при измерении расхода и количества газов с помощью стандартных сужающих устройств [1], или с помощью турбинных, ротационных и вихревых расходомеров и счётчиков [2].
Периодический газовый анализ позволяет установить соответствие между реальной анализируемой смесью и её моделью, по которой в МВИ учитываются физико-химические параметры газа: состав газовой смеси и плотность газа при стандартных условиях.
Также в МВИ учитываются теплофизические характеристики газа: плотность при рабочих условиях (давление и температура газа, при которых выполняют измерение его расхода или объёма), вязкость, фактор и коэффициент сжимаемости.
К измеряемым в реальном режиме времени параметрам состояния газа относятся: давление (перепад давлений), температура, плотность. Для измерения этих параметров применяются соответственно средства измерительной техники: манометры (дифманометры), термометры, плотномеры. Измерение плотности газовой среды допускается измерять прямым или косвенным методами измерения. Результаты как прямых, так и косвенных методов измерения зависят от погрешности средств измерения и методической погрешности. В рабочих условиях, сигналы измерительной информации могут быть подвержены влиянию значительного шума, среднее квадратичное отклонение которого может превышать инструментальную погрешность. В этом случае, актуальной задачей является эффективная фильтрация сигналов измерительной информации.
В данной статье рассматривается методика косвенного измерения плотности газа при рабочих и стандартных условиях c применением фильтра Калмана.
Математическая модель определения плотности газа
Обратимся к классике и вспомним уравнение состояния идеального газа [3]. Имеем:
1. Уравнение Менделеева-Клапейрона:
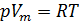
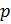
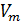
R — универсальная газовая постоянная,
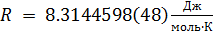
T — абсолютная температура, T=273.16 К.
2. Два измеряемых параметра:
p – давление газа, Па
t – температура газа, °С.
Известно, что молярный объём 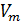
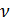
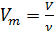
Также известно, что
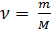
где: m – масса газа, M – молярная масса газа.
Учитывая (2) и (3) перепишем (1) в виде:
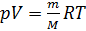
Как известно, плотность вещества

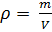
Из (4) и (5) выведем уравнение для плотности газа

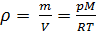
и введём обозначение параметра
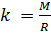
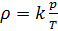
Если состав газовой смеси не меняется, то параметр k является константой.
Итак, для расчёта плотности газа необходимо рассчитать молярную массу газовой смеси.
Молярную массу смеси веществ определяем, как среднее арифметическое взвешенное молярной массы массовых долей, входящих в смесь индивидуальных веществ.
Примем известным состав веществ в газовой смеси – в воздухе, который состоит из:
- 23 % по весу из молекул кислорода
- 76 % по весу из молекул азота
- 1 % по весу из атомов аргона
Молярные массы этих веществ воздуха будут соответственно равны:
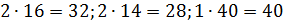
Вычисляем молярную массу воздуха, как среднее арифметическое взвешенное:
Теперь, зная значение константы
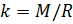
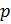
Приведение плотности газа к нормальным, стандартным условиям
Практически, измерения свойств газов проводят в различных физических условиях, и для обеспечения сопоставления между различными наборами данных должны быть установлены стандартные наборы условий [4].
Стандартные условия для температуры и давления – это установленные стандартом физические условия, с которыми соотносят свойства веществ, зависящие от этих условий.
Различные организации устанавливают свои стандартные условия, например: Международный союз чистой и прикладной химии (IUPAC), установил в области химии определение стандартной температуры и давления (STP): температура 0 °C (273.15 K), абсолютное давление 1 бар ( Па); Национальный институт стандартов и технологий (NIST) устанавливает температуру 20 °C (293,15 K) и абсолютное давление 1 атм (101.325 кПа), и этот стандарт называют нормальной температурой и давлением (NTP); Международная организация по стандартизации (ISO) устанавливает стандартные условия для природного газа (ISO 13443: 1996, подтверждённый в 2013 году): температура 15.00 °С и абсолютное давление 101.325 кПа.
Поэтому, в промышленности и торговле необходимо указывать стандартные условия для температуры и давления, относительно которых и проводить необходимые расчёты.
Плотность воздуха мы рассчитываем по уравнению (8) в рабочих условиях температуры и давления. В соответствии с (6) запишем уравнение для плотности воздуха в стандартных условиях: температура 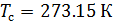
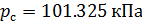
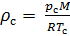
Делаем расчёт плотности воздуха, приведенной к стандартным условиям. Разделим уравнение (9) на уравнение (6) и запишем это отношение для 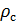
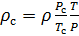
Подобным образом, получим уравнение для расчёта плотности воздуха, приведенной к нормальным условиям: температура 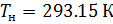
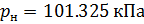

В уравнениях (10) и (11) используем значения параметров воздуха 
Реализация измерительного канала давления и температуры
Для решения многих задач получения информации, в зависимости от их сложности, удобно создавать прототип будущей системы на базе одной из микроконтроллерных платформ типа Arduino, Nucleo, Teensy, и др.
Что может быть проще? Давайте сделаем микроконтроллерную платформу для решения конкретной задачи – создание системы измерения давления и температуры, затрачивая меньше, возможно, средств, и используя все преимущества разработки программного обеспечения в среде Arduino Software (IDE).
Для этого, на аппаратном уровне, нам понадобятся компоненты:
- Arduino (Uno, …) – используем как программатор;
- микроконтроллер ATmega328P-PU – микроконтроллер будущей платформы;
- кварцевый резонатор на 16 МГц и пара керамических конденсаторов на 12-22 пФ каждый (по рекомендациям фирмы-изготовителя);
- тактовая кнопка на перезагрузку микроконтроллера и подтягивающий плюс питания к выводу RESET микроконтроллера резистор на 1 кОм;
- BMP180 — измерительный преобразователь температуры и давления с интерфейсом I2C;
- преобразователь интерфейсов TTL/USB;
- расходные материалы – провода, припой, монтажная плата, и др.
Принципиальная схема платформы, с учетом необходимых интерфейсов: стандартного последовательного интерфейса, I2C, и ничего более, представлена на рис. 1.
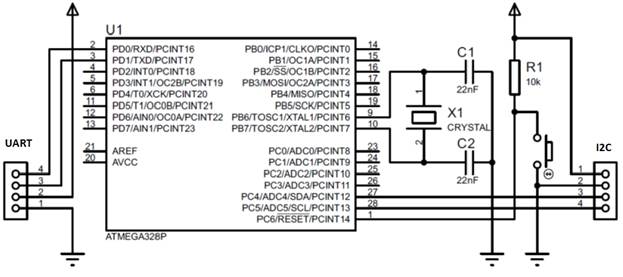
Рис. 1 — Принципиальная схема микроконтроллерной платформы для реализации системы измерения давления и температуры
Теперь рассмотрим этапы осуществления нашей задачи.
1. Прежде, нам нужен программатор. Подключаем Arduino (Uno, …) к компьютеру. В среде Arduno Software из меню по пути Файл->Примеры->11. ArdunoISP добираемся до программы программатора ArduinoISP, которую зашиваем в Arduino. Предварительно из меню Инструменты выбираем соответственно Плату, Процессор, Загрузчик, Порт. После Загрузки программы ArduinoISP в плату, наша Arduino превращается в программатор и готова к использованию по назначению. Для этого в среде Arduno Software в меню Инструменты выбираем пункт Программатор: “Arduino as ISP”.
2. Подключаем по интерфейсу SPI ведомый микроконтроллер ATmega328P к ведущему программатору Arduino (Uno, …), рис. 2. Следует заметить, что предварительно биты регистра Low Fuse Byte микроконтроллера ATmega328P были установлены в незапрограммированное состояние. Переходим в среду Arduno Software и из меню Инструменты выбираем пункт Записать Загрузчик. Прошиваем микроконтроллер ATmega328P.
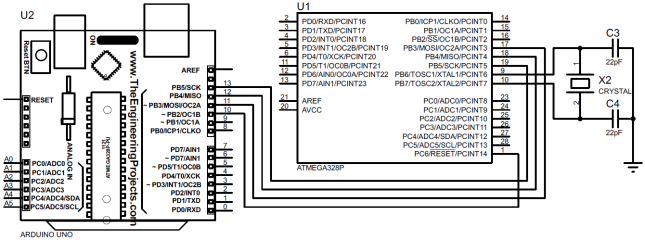
Рис. 2 – Схема подключения микроконтроллера к программатору
3. После успешной прошивки, микроконтроллер ATmega328P готов к установке на разработанную микроконтроллерную платформу (рис. 3), которую программируем также, как и полноценную Arduino (Uno, …). Программа опроса измерительного преобразователя давления и температуры представлена на листинге 1.

Рис. 3 Система измерения давления и температуры
Программа Python для фильтрации по каналам температуры и давления, и получение результатов
Программа Python методики определения плотности газа по результатам измерений давления и температуры представлена на листинге 2. Информация из измерительной системы выводится в реальном режиме времени.
Результаты расчёта представлены листингом и рис. 4, 5, 6.
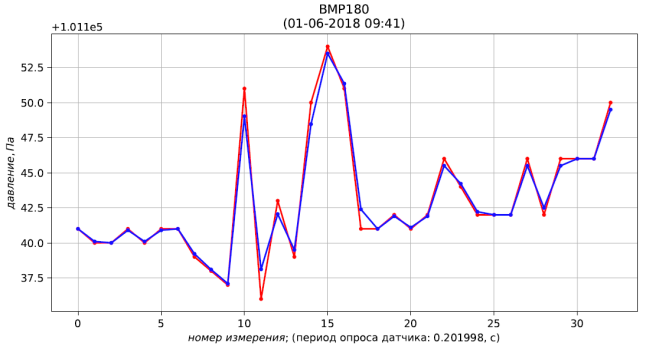
Рис. 4 – результаты измерения (красный) и фильтрации (синий) давления
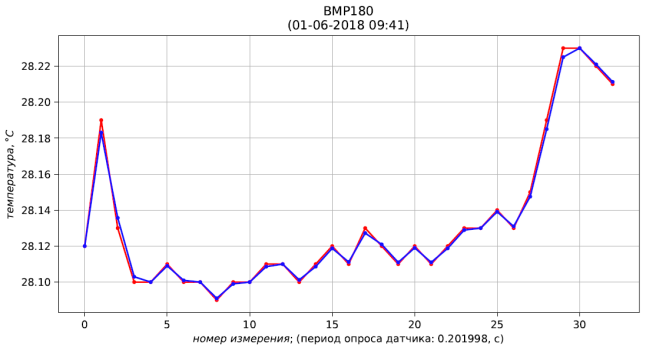
Рис. 5 – результаты измерения (красный) и фильтрации (синий) температуры
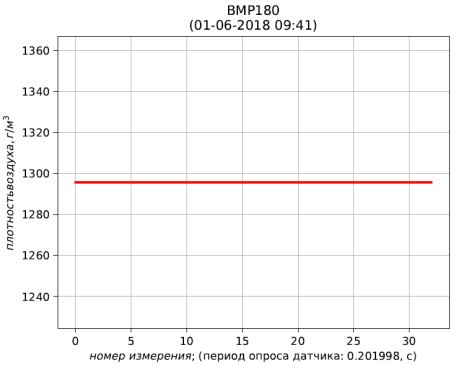
Рис. 6 – результаты расчёта плотности воздуха, приведенной к стандартным условиям (температура 273.15 К; абсолютное давление 101.325 кПа)
Выводы
Разработана методика определения плотности газа по результатам измерения давления и температуры с применением датчиков Arduino и программных средств Python.