Download Article
Download Article
Atomic mass is the sum of all the protons, neutrons, and electrons in a single atom or molecule. However, the mass of an electron is so small, it is considered negligible and not included in the calculation.[1]
Though technically incorrect, the term is also often used to refer to the average atomic mass of all of the isotopes of one element. This second definition is actually the relative atomic mass, also known as the atomic weight, of an element.[2]
The atomic weight takes into account the average of the masses of naturally occurring isotopes of the same element. Chemists need to distinguish between these two types of atomic mass to guide their work – an incorrect value for atomic mass can, for instance, lead to an incorrect calculation of an experiment’s yield.
-

1
Understand how atomic mass is represented. Atomic mass, the mass of a given atom or molecule, can be expressed in standard SI mass units – grams, kilograms, etc. However, because atomic masses, when expressed in these terms, are incredibly small, atomic mass is often expressed in unified atomic mass units (usually shortened to “u” or “amu”) or in Dalton’s (Da). The standard for one atomic mass unit is equal to 1/12th of the mass of a standard carbon-12 isotope.[3]
- The atomic mass is the number of grams of the element in one mole of atoms of the element. This is a very useful property when it comes to practical calculations, as it allows easy conversion between the mass and moles of a given quantity of atoms or molecules of the same type.
-

2
Locate atomic mass on the periodic table. Most standard periodic tables list the relative atomic masses (atomic weights) of each element. This is almost always written as a number at the bottom of the element’s square on the table, under its one or two letter chemical symbol. This number is usually expressed as a decimal rather than as a whole number.
- Note that the relative atomic masses listed on the periodic table are average values for the associated element. Chemical elements have different isotopes – chemical forms that differ in mass because of the addition or subtraction of one or more neutrons to the atom’s nucleus.[4]
Thus, the relative atomic mass listed on the periodic table is suitable as an average value for atoms of a certain element, but not as the mass of a single atom of that element. - Relative atomic masses, as listed on the periodic table, are used to calculate molar masses for atoms and molecules. Atomic masses, when expressed in amu, as on the periodic table, are technically unitless. However, by simply multiplying an atomic mass by 1 g/mol, a workable quantity is obtained for an element’s molar mass – the mass (in grams) of one mole of an element’s atoms.
- For example, the atomic mass of iron is 55.847 amu, which means one mole of iron atoms would weigh 55.847 grams.
Advertisement
- Note that the relative atomic masses listed on the periodic table are average values for the associated element. Chemical elements have different isotopes – chemical forms that differ in mass because of the addition or subtraction of one or more neutrons to the atom’s nucleus.[4]
-

3
Understand that periodic table values are an average atomic mass for an element. As has been noted, the relative atomic masses listed for each element on the periodic table are average values of all of an atom’s isotopes. This average value is valuable for many practical calculations – like, for instance, calculating the molar mass of a molecule comprised of several atoms. However, when dealing with individual atoms, this number is sometimes insufficient.
- Because it’s an average of several different types of isotopes, the value on the periodic table isn’t the exact value for any single atom’s atomic mass.
- The atomic masses for individual atoms must be calculated by taking into account the exact number of protons and neutrons in a single atom.
Advertisement
-

1
Find the atomic number of the element or isotope. The atomic number is the number of protons in an element, and never varies.[5]
For example, all hydrogen atoms, and only hydrogen atoms, have 1 proton. Sodium has an atomic number of 11 because its nucleus has 11 protons, while oxygen has an atomic number of 8 because its nucleus has 8 protons. You can find the atomic number of any element on the periodic table – in nearly all standard periodic tables: it’s the number above an element’s 1 or 2-letter chemical symbol. This number will always be a positive whole number.- Let’s say that we’re working with the carbon atom. Carbon always has 6 protons, so we know its atomic number is 6. We can also see on the periodic table that the square for carbon (C) has a “6” at the top, signifying that carbon’s atomic number is 6.
- Note that an element’s atomic number doesn’t have any direct bearing on its relative atomic mass as listed on the periodic table. Though, especially among elements at the top of the periodic table, it may seem that an atoms’ atomic mass is about twice its atomic number, atomic mass isn’t ever calculated by doubling an element’s atomic number.
-

2
Find the number of neutrons in the nucleus. The number of neutrons can vary among atoms of a certain element. While 2 atoms with the same number of protons and differing numbers of neutrons are both the same element, they are different isotopes of that element. Unlike the number of protons in an element, which never changes, the number of neutrons in atoms of a certain element can vary often enough that the average atomic mass of the element must be expressed as a decimal value between two whole numbers.
- The number of neutrons can be determined by the isotope designation of the element. For example, carbon-14 is a naturally occurring radioactive isotope of carbon-12. You will often see an isotope designated with the number as a superscript before the element symbol: 14C. The number of neutrons is calculated by subtracting the number of protons from the isotope number: 14 – 6 = 8 neutrons.
- Let’s say the carbon atom we’re working with has six neutrons (12C). This is by far the most common isotope of carbon, accounting for nearly 99% of all carbon atoms.[6]
However, about 1% of carbon atoms have 7 neutrons (13C). Other types of carbon atoms with more or less than 6 or 7 neutrons exist in very small amounts.
-

3
Add the proton and neutron count. This is the atomic mass of that atom. Don’t worry about the number of electrons orbiting the nucleus – their combined mass is very, very small, so, in most practical cases, it won’t significantly affect your answer.[7]
- Our carbon atom has 6 protons + 6 neutrons = 12. The atomic mass of this specific carbon atom is 12. If it was a carbon-13 isotope, on the other hand, we would know that it has 6 protons + 7 neutrons = an atomic weight of 13.
- The actual atomic weight of carbon-13 is 13.003355[8]
, and is more precise because it was determined experimentally. - Atomic mass is very close to the isotope number of an element. For basic calculation purposes, isotope number is equal to atomic mass. When determined experimentally, the atomic mass is slightly higher than the isotope number due to the very small mass contribution from electrons.
Advertisement
-

1
Determine which isotopes are in the sample. Chemists often determine the relative proportions of isotopes in a given sample by using a special tool called a mass spectrometer. However, at student-level chemistry, this information is often provided for you on school tests, etc., in the form of established values from scientific literature.
- For our purposes, let’s say we’re working with the isotopes carbon-12 and carbon-13.
-

2
Determine the relative abundance of each isotope in the sample. Within a given element, different isotopes appear in different proportions. These proportions are almost always expressed as percentages. Some isotopes will be very common, while others will be very rare – at times, so rare that they can barely be detected. This information can be determined through mass spectrometry or from a reference book.
- Let’s say that the abundance of carbon-12 is 99% and the abundance of carbon-13 is 1%. Other carbon isotopes do exist, but they exist in quantities so small that, for this example problem, they can be ignored.
-

3
Multiply the atomic mass of each isotope by its proportion in the sample. Multiply the atomic mass of each isotope by its percent abundance (written as a decimal). To convert a percentage to a decimal, simply divide it by 100. The converted percentages should always add up to 1.
- Our sample contains carbon-12 and carbon-13. If carbon-12 makes up 99% of the sample and carbon-13 makes up 1% of the sample, multiply 12 (the atomic mass of carbon-12) by 0.99 and 13 (the atomic mass of carbon-13) by 0.01.
- A reference book will give percent proportions based on all the known amounts of an element’s isotopes. Most chemistry textbooks include this information in a table at the end of the book. A mass spectrometer can also yield the proportions for the sample being tested.
-

4
Add the results. Sum the products of the multiplications you performed in the previous step. The result of this addition is the relative atomic mass of your element – the average value of the atomic masses of your element’s isotopes. When discussing an element in general, and not specific isotopes of that element, this value is used.
- In our example, 12 x 0.99 = 11.88 for carbon-12, while 13 x 0.01 = 0.13 for carbon-13. The relative atomic mass of our example is 11.88 + 0.13 = 12.01.
Advertisement
Add New Question
-
Question
How do I find the mass number of an atom?

Add the protons and neutrons together to find the mass, or add the masses of the isotopes multiplied by the atom’s natural abundance.
-
Question
If 1 amu is 1/12 of a carbon 12 atom, why is it that when I add the masses of the individual parts of a carbon 12 atom, I get more than 12 amu?

1 u = 1/12 the mass of carbon 12 by definition. You’re adding the masses of uncombined protons and neutrons, 1.0073 u and 1.0087 u respectively. But when those particles fuse together to form an atom, some of the mass is converted into energy according to E=mc^2. The lost mass is called the “mass defect”, and the equivalent amount of energy is the “binding energy.”
-
Question
How can I find the mass of any atom to convert it in a.m.u.?

We can find the mass of any atom by adding the electrons, protons and neutrons.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Things You’ll Need
- Chemistry reference book
- Calculator
References
About This Article
Article SummaryX
To calculate atomic mass, start by finding the atomic number of the element, which is the number above the element on the periodic table. Next, find the number of neutrons in the nucleus by subtracting the atomic number from the isotope number. Finally, add the atomic number and the number of neutrons to get the atomic mass. To learn how to locate an element’s atomic mass on the periodic table, keep reading!
Did this summary help you?
Thanks to all authors for creating a page that has been read 953,348 times.
Reader Success Stories
-

“I couldn’t do my homework for my science teacher without this article, it has helped me understand the topic…” more
Did this article help you?
А́томная ма́сса — масса атома. Единица измерения в СИ — килограмм, обычно применяется внесистемная единица — атомная единица массы.
Общие сведения[править | править код]
Одним из фундаментальных свойств атома является его масса. Абсолютная масса атома — величина чрезвычайно малая. Так, атом водорода имеет массу около 1,67⋅10−24 г[1]. Поэтому в химии (преимущественно для практических целей) значительно удобнее пользоваться относительной (условной) величиной, которую называют относительной атомной массой или просто атомной массой и которая показывает, во сколько раз масса атома данного элемента больше массы атома другого элемента, принятой за единицу измерения массы.
В качестве единицы измерения атомных и молекулярных масс принята 1⁄12 часть массы нейтрального атома наиболее распространённого изотопа углерода 12C[2]. Эта внесистемная единица измерения массы получила название атомная единица массы (а. е. м.) или дальтон (обозначение: Да; единица названа в честь Дж. Дальтона).
Разность между атомной массой изотопа и его массовым числом называется избытком массы (обычно его выражают в МэВ). Он может быть как положительным, так и отрицательным; причина его возникновения — нелинейная зависимость энергии связи ядер от числа протонов и нейтронов, а также различие в массах протона и нейтрона.
Зависимость атомной массы изотопа от массового числа такова: избыток массы положителен у водорода-1, с ростом массового числа он уменьшается и становится отрицательным, пока не достигается минимум у железа-56, потом начинает расти и возрастает до положительных значений у тяжёлых нуклидов. Это соответствует тому, что деление ядер, более тяжёлых, чем железо, высвобождает энергию, тогда как деление лёгких ядер требует энергии. Напротив, слияние ядер легче железа высвобождает энергию, слияние же элементов тяжелее железа требует дополнительной энергии.
Атомная масса химического элемента (также «средняя атомная масса», «стандартная атомная масса») является средневзвешенной атомной массой всех существующих в природе стабильных и нестабильных изотопов данного химического элемента с учётом их природной (процентной) распространённости в земной коре и атмосфере. Именно эта атомная масса представлена в периодической таблице Д. И. Менделеева, её используют в стехиометрических расчётах. Атомная масса элемента с нарушенным изотопным соотношением (например, обогащённого каким-либо изотопом) отличается от стандартной. Для моноизотопных элементов (таких как иод, золото и т. п.) атомная масса элемента совпадает с атомной массой его единственного представленного в природной смеси изотопа. Для химических элементов, отсутствующих в природе (синтетических химических элементов), таких как технеций, кюрий и т. п., в качестве атомной массы элемента условно указывают массовое число наиболее стабильного из известных изотопов этого элемента; такие значения в таблице Менделеева традиционно указываются в квадратных скобках.
Наиболее точные значения атомных масс, измеренные на текущий момент, можно найти в регулярно, раз в несколько лет выходящей под эгидой ИЮПАК публикации Atomic Mass Evaluation (AME)[3]. На 2022 год последней публикацией является AME2020[4].
Относительная атомная масса[править | править код]
Относи́тельная а́томная ма́сса (устаревшее название — атомный вес) — значение массы атома, выраженное в атомных единицах массы, определяется как отношение массы атома данного элемента к 1⁄12 массы нейтрального атома изотопа углерода 12C. Из определения следует, что относительная атомная масса является безразмерной величиной[5].
Молекулярная (молярная) масса[править | править код]
Молекулярной массой химического соединения называется сумма атомных масс элементов, составляющих его, умноженных на стехиометрические коэффициенты элементов по химической формуле соединения. Строго говоря, масса молекулы меньше массы составляющих её атомов на величину, равную энергии связи молекулы (см. выше). Однако этот дефект массы на 9—10 порядков меньше массы молекулы, и им можно пренебречь.
Определение моля (и числа Авогадро) выбирается таким образом, чтобы масса одного моля вещества (молярная масса), выраженная в граммах (на моль), была численно равна атомной (или молекулярной) массе этого вещества. Например, атомная масса железа равна 55,847 а. е. м. Следовательно, один моль железа (то есть количество атомов железа, равное числу Авогадро, ≈6,022⋅1023) имеет массу 55,847 г.
Прямое сравнение и измерение масс атомов и молекул выполняется с помощью масс-спектрометрических методов.
История[править | править код]
При вычислениях атомных масс изначально (с начала XIX века, по предложению Дж. Дальтона; см. Атомистическая теория Дальтона) за единицу массы [относительную] принимали массу атома водорода как самого лёгкого элемента и по отношению к нему вычисляли массы атомов других элементов. Но так как атомные массы большинства элементов определяются, исходя из состава их кислородных соединений, то фактически вычисления производились по отношению к атомной массе кислорода, которая принималась равной 16; отношение между атомными массами кислорода и водорода считали равным 16 : 1. Впоследствии более точные измерения показали, что это отношение равно 15,874 : 1 или, что то же самое, 16 : 1,0079, — в зависимости от того, к какому атому — кислорода или водорода — относить целочисленное значение. Изменение атомной массы кислорода повлекло бы за собой изменение атомных масс большинства элементов. Поэтому было решено оставить для кислорода атомную массу 16, приняв атомную массу водорода равной 1,0079.
Таким образом, за единицу атомной массы принималась 1⁄16 часть массы атома кислорода, получившая название кислородной единицы. В дальнейшем было установлено, что природный кислород представляет собой смесь изотопов, так что кислородная единица массы характеризует среднее значение массы атомов природных изотопов кислорода (кислорода-16, кислорода-17 и кислорода-18), которое оказалось непостоянным из-за природных вариаций изотопного состава кислорода. Для атомной физики такая единица оказалась неприемлемой, и в этой отрасли науки за единицу атомной массы была принята 1⁄16 часть массы атома кислорода 16O. В результате оформились две шкалы атомных масс — химическая и физическая. Наличие двух шкал атомных масс создавало большие неудобства. Величины многих констант, рассчитанных по физической и химической шкалам, оказывались различными[6]. Это неприемлемое положение привело к введению углеродной шкалы атомных масс вместо кислородной.
Единая шкала относительных атомных масс и новая единица атомной массы принята Международным съездом физиков (1960) и унифицирована Международным съездом химиков (1961; спустя 100 лет после 1-го Международного съезда химиков), вместо предыдущих двух кислородных единиц атомной массы — физической и химической. Кислородная химическая единица равна 0,999957 новой углеродной единицы атомной массы. В современной шкале относительные атомные массы кислорода и водорода равны соответственно 15,9994 : 1,0079… Поскольку новая единица атомной массы привязана к конкретному изотопу, а не к среднему значению атомной массы химического элемента, природные изотопные вариации не сказываются на воспроизводимости этой единицы.
Примечания[править | править код]
- ↑ См. Фундаментальные физические постоянные#Некоторые другие физические постоянные.
- ↑ Поэтому атомная масса этого изотопа по определению равна 12 (а. е. м.) точно
- ↑ Atomic Mass Evaluation (AME) Архивная копия от 11 января 2019 на Wayback Machine
- ↑ Huang W. J., Meng Wang, Kondev F. G., Audi G., Naimi S. The Ame2020 atomic mass evaluation (I). Evaluation of input data, and adjustment procedures (англ.) // Chinese Physics C. — 2021. — Vol. 43, iss. 3. — P. 030002-1—030002-342. — doi:10.1088/1674-1137/abddb0.
Meng Wang, Huang W. J., Kondev F. G., Audi G., Naimi S. The Ame2020 atomic mass evaluation (II). Tables, graphs and references (англ.) // Chinese Physics C. — 2021. — Vol. 43, iss. 3. — P. 030003-1—030003-512. — doi:10.1088/1674-1137/abddaf. - ↑ Чертов А. Г. Единицы физических величин. — М.: «Высшая школа», 1977. — 287 с.
- ↑ Некрасов Б. В. Основы общей химии. — 3-е изд. — М.: Химия, 1973. — Т. I. — С. 22—27.‘
Литература[править | править код]
- Meija J. et al. Atomic weights of the elements 2013 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2016. — Vol. 88, no. 3. — P. 265—291. — doi:10.1515/pac-2015-0305.
- Вес атомов // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Атом (Размеры и масса атомов). Атомный вес // Физический энциклопедический словарь (в 5 т.) / Б. А. Введенский. — М.: Сов. энциклопедия, 1960. — Т. 1. — С. 107, 119–121. — 664 с.
- Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии: В 2 томах / Пер. с англ.. — М.: Мир, 1982. — Т. 1. — С. 13—65, 114, 267—295. — 652 с.
- Атомная масса // Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Советская энциклопедия, 1988. — Т. 1: Ааронова — Бома эффект — Длинные линии. — С. 152. — 707 с. — 100 000 экз.
- Атомная масса // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: А — Дарзана. — С. 216. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
Ссылки[править | править код]
- Атомная масса / Справочник химика (дополнительная информация )
- Публикации атомных масс 1969—2013 — в журнале «Pure and Applied Chemistry», на сайте ИЮПАК
- Атомные массы всех изотопов
- AME2020 atomic mass evaluation Архивная копия от 11 января 2019 на Wayback Machine
- Atomic Mass Data Center
Бронштейн М.П. Как был взвешен атом //Квант. — 1970. — № 2. — С. 26-35.
По специальной договоренности с редколлегией и редакцией журнала “Квант”
Предисловие
К концу прошлого века в физике и химии утвердилась, как тогда говорили, гипотеза об атомах и молекулах — мельчайших частицах, из которых составлены все тела окружающего нас мира. В химии атомная гипотеза позволила понять и очень удобно описывать химические реакции: всякая реакция — это просто соединение атомов в молекулы или, наоборот, разложение молекул на атомы или группы атомов. Из анализа состава различных молекул химики сумели выяснить, что атомы разных элементов обладают различными массами. Им даже удалось узнать, во сколько раз один атом тяжелее или легче другого; уже к началу второй половины XIX столетия были известны так называемые атомные веса всех открытых к тому времени химических элементов, то есть числа, показывающие, во сколько раз атом данного химического элемента тяжелее самого легкого из атомов – водорода. Знаменитый русский химик Д. И. Менделеев, расположив химические элементы в порядке возрастания атомных весов, показал в 1869 году, что они образуют определенную систему, в которой свойства элементов периодически повторяются (периодическая система). В физике гипотеза об атомах и молекулах играла не менее важную роль. Она позволила физикам составить себе ясное представление о множестве самых различных явлений. Она помогла понять, что такое тепло и холод, почему тела при нагревании расширяются, почему всякое вещество может быть твердым, жидким и газообразным и многое другое. Чтобы все это понять, нужно было только дополнительно предположить, что атомы и молекулы непрерывно и беспорядочно движутся и что между ними действуют силы притяжения и отталкивания. Но при всем этом атомы оставались только некоторым представлением в головах людей. Их не только никто не видел, потому что они очень малы, но никто не знал, насколько они малы, каковы массы атомов, сколько атомов в том или ином теле. Нельзя сказать, чтобы не делались попытки все это как-то узнать. Но эти попытки не приводили к убедительным результатам. У некоторых ученых появилась даже уверенность в том, что об атомах и молекулах ничего и нельзя будет узнать, потому что их на самом деле не существует. Эти ученые полагали, что атомы — это нечто вроде меридианов и параллелей на географической карте: ими удобно пользоваться, но реально в природе их нет. Физики, однако, не теряли надежду доказать реальность атомов и молекул, взвесить их, сосчитать их число, определить их размеры.
В предлагаемом отрывке из книги выдающегося советского физика-теоретика Матвея Петровича Бронштейна «Атомы, электроны, ядра» рассказывается о том, как впервые удалось измерить массу атомов и даже сосчитать их. Эта книга, изданная в 1935 году небольшим тиражом (всего 10 000 экземпляров), давно уже стала библиографической редкостью.
Публикацию подготовил профессор А.К. Кикоин. Сделанные им добавления взяты в прямые скобки.
Как был взвешен атом
… И в конце концов атом действительно удалось взвесить. Этому помогло одно очень странное явление, открытое еще в первой половине XIX века и на которое физики в свое время не обратили должного внимания. Это явление называется брауновским движением.
В 1828 году знаменитый английский ботаник Роберт Браун проделал одно в высшей степени интересное наблюдение. Испытывая только что присланный ему новый усовершенствованный микроскоп с ахроматическим объективом, Роберт Браун вздумал рассмотреть с помощью этого микроскопа ничтожную каплю жидкости, содержащуюся в крохотных зернышках пыльцы растений. В такой жидкости всегда имеется большее количество микроскопических твердых частиц. Как удивлен был Браун, когда увидел, что эти частицы не остаются на месте, а движутся, движутся непрерывно, точно исполняя какой-то фантастический танец! Когда в поле зрения микроскопа было видно много таких частиц, то получалось такое же впечатление, как от тучи каких-то мельчайших мошек. Твердые частицы микроскопических размеров, находящиеся в жидкости, движутся, как если бы они были живыми… Но уже Роберт Браун, который первым наблюдал это хаотическое движение микроскопических частиц, получившее свое название от его имени, пришел к другому заключению: частицы движутся не потому, что они живые… Так утверждал Браун, и это было подтверждено многочисленными последующими наблюдениями.
Можно было бы думать, что брауновское движение микроскопических частиц вызывается какими-то потоками в самой жидкости, связанными с разностью давлений в различных точках жидкости. Всякому приходилось наблюдать движение пылинок в воздухе, освещенном падающими сбоку солнечными лучами. Это движение действительно связано с такими токами воздуха, но брауновское движение имеет совершенно другой характер. В самом деле, если внимательно наблюдать за движением пылинок в солнечном луче, то легко заметить, что соседние пылинки, попавшие в одну и ту же небольшую струю воздуха, движутся в одну и ту же сторону. А если наблюдать за брауновским движением микроскопических частиц, то оказывается, что между направлением движения соседних частиц нет решительно ничего общего: частицы движутся совершенно независимо друг от друга, даже если им случается подойти друг к другу на самое крохотное расстояние, равное диаметру отдельной частички. Значит, совсем не от токов жидкости происходит это непостижимое и фантастическое движение микроскопических твердых частичек.
Во второй половине XIX века брауновское движение подробно исследовал французский физик Гуи. Он проделал целый ряд опытов, которые убедили его в том, что причина брауновского движения скрыта в самой жидкости. Не от внутренних токов жидкости, вызванных ничтожными разностями температур, и не от внешних толчков и сотрясений происходит брауновское движение. Гуи пробовал сравнивать брауновское движение в лаборатории, расположенной на шумной улице, цо которой проезжают тяжелые экипажи, с тем же брауновским движением, наблюдаемым ночью в глухом подвале в деревне. Разницы не получалось никакой. Толчки от экипажей заметны, но они сказываются не на хаотическом движении брауновских частиц, а на движении всей капельки, жидкости в целом: двигаясь, как целое, капелька увлекает за собой все частицы в одном и том же направлении, и это движение очень легко отличить от накладывающегося на него хаотического движения брауновских частиц, происходящего по всем возможным направлениям.
Гуи убедительно доказал, что брауновское движение, как уже предполагал и сам Браун, нисколько не связано с тем, что жидкость, в которой оно наблюдается, взята из живого существа — из растения: искусственно приготовленные жидкости с взвешенными в них микроскопическими частицами, в которых нет ничего живого, тоже обнаруживают брауновское движение. В 1881 году польский физик Бодашевский показал, что брауновское движение происходит и в газах, а не только в жидкостях.
Для того чтобы наблюдать брауновское движение, он рассматривал при боковом освещении микроскопические частички, образующие табачный дым. Крохотные частички угля, из которых состоит дым, плясали во все стороны совершенно таким же образом, как плясали твердые частички, наблюдавшиеся Робертом Брауном в жидкости.
Настоящую причину брауновского движения угадал в 70-х годах прошлого столетия бельгиец Карбонель. Его объяснение, гениальное по своей простоте, состоит в следующем: микроскопические частицы движутся потому, что они испытывают толчки со стороны невидимых молекул и атомов окружающей их жидкости. Рассматривая движение брауновских частичек, мы получаем некоторое представление о том, как движутся невидимые молекулы жидкости, совершенно таким же образом, как мы угадываем о волнении на море, когда, стоя далеко от берега, видим качание лодки, швыряемой волнами во все стороны. Брауновское движение является поэтому мостом, соединяющим невидимый мир атомов и молекул с миром, доступным восприятию при помощи наших органов чувств.
Почему брауновское движение можно наблюдать только в том случае, когда частички очень малы? Очень просто, отвечает на этот вопрос Карбонель; если поверхность частицы велика, то количество толчков, получаемых ею справа, всегда окажется приблизительно равным количеству толчков, получаемых ею же слева, и ничтожное различие в количестве толчков будет совершенно недостаточно для того, чтобы сдвинуть с места большую и тяжелую частицу. Если же частица имеет ничтожную массу и ничтожные размеры, то в хаосе молекулярных движений жидкости всегда может случиться, что с одной стороны частицы будет в данный момент случайно больше толчков, чем с другой, а поэтому легкоподвижная частица двинется в ту сторону, куда ее толкнут молекулы. Через какой-то очень короткий промежуток времени избыток молекулярных толчков будет сдвигать брауновскую частицу уже по другому направлению, еще через какой-то короткий промежуток времени — по третьему и т. д.
Если это предложенное Карбонелем объяснение правильно, то чем частицы легче и мельче, тем брауновское движение должно быть интенсивнее. Так и есть в действительности — уже Браун сумел это заметить. Кроме того, ведь мы знаем, что движение молекул жидкости происходит тем быстрее, чем выше температура; и в самом деле, Гуи нашел, что при повышении температуры брауновское движение делается все интенсивнее и интенсивнее. Когда Жигмонди изобрел ультрамикроскоп и смог наблюдать ничтожнейшие частицы золота в коллоидном растворе (диаметр частиц меньше миллионной доли сантиметра), то брауновское движение этих частиц оказалось таким быстрым, что получилось какое-то сплошное мелькание. Жигмонди описывает свое первое впечатление так: «Это какое-то непрерывное прыганье, пляска, скакание, столкновения и разлетания, так что трудно разобраться в этой путанице»…

Распределение зернышек по высоте в гуммигутовой эмульсии
Мы переходим теперь к рассказу о классических работах, которые сделал французский физик Жан Перрен (1908 г.). В этих работах было окончательно проверено и установлено,что брауновское движение в жидкостях вызвано движением молекул и тем самым дано решающее доказательство действительного существования молекул и атомов.
Перрен брал кусочки резиновой смолы «гуммигута» и растирал их рукой в воде, пока она не становилась ярко-желтого цвета. После этого Перрен брал немножко такой жидкости под микроскоп. Под микроскопом оказывалась, что гуммигут на самом деле не растворился в воде, а распался на множество шаровидных мелких зернышек, которые разбрелись по всему объему воды. Зернышки эти очень различны по размерам. А Перрену хотелось иметь такую жидкость, в которой были бы совершенно одинаковые по размерам частицы гуммигута. Для этого он воспользовался «центрифугой» (центробежной машиной), такой же самой, какой пользуются на крупных молочных фермах для отделения сливок от молока или же в медицинских лабораториях для удаления кровяных шариков из крови, после чего остается однородная жидкость — кровяная плазма. Центрифуга Перрена делала 2500 оборотов в минуту, и возникающая при этом центробежная сила выбрасывала из жидкости зернышки гуммигута. Перпендикулярно к оси центрифуги были расположены стеклянные пробирки, в которых содержалась эмульсия гуммигута (так называется вода с взвешенными в ней частичками гуммигута).
Первыми выпадали тяжелые частицы, а вслед за ними и легкие. Это давало возможность отделить частицы друг от друга по весу (а значит, и по размерам, потому что все частицы сделаны из одного и того же материала, и поэтому, чем больше их масса, тем больше и размеры).
Это очень кропотливая и тяжелая работа: приходится работать целый месяц для того, чтобы из одного килограмма гуммигута получить несколько десятых или даже сотых долей грамма круглых зерен нужной величины. Таким образом, Перрен сумел получить несколько порций эмульсии с диаметром зерен в 0,5, 0,46, 0,37, 0,21 и 0,14 микрона (микрон — это тысячная доля миллиметра).
С помощью таких эмульсий Жан Перрен произвел множество замечательных опытов, о которых мы здесь и расскажем. Он поместил каплю эмульсии с определенным диаметром зерен в плоскую ванночку (кюветку) с глубиной 0,1 мм. Кюветка была затем покрыта тонким покровным стеклышком, края которого были залиты парафином: таким образом, капля оказалась размазанной в сосуде, в котором она герметически заперта, так что никакое испарение уже невозможно.
Перрен сперва поставил свою кюветку набок и стал смотреть на нее в микроскоп. В поле зрения микроскопа оказалась тонкая вертикальная водяная стенка, внутри которой распределялись участвующие в брауновском движении зернышки гуммигута. Распределение зернышек сперва было однородным, но потом, с течением времени, распределение изменилось и в конце концов стало таким: очень много зернышек внизу, а по мере продвижения вверх их становится все меньше и меньше (см. рисунок). Число зернышек в одном кубическом микроне уменьшается с увеличением высоты и притом по некоторому вполне определенному закону.
Этот закон уменьшения плотности эмульсии с высотой Перрен захотел исследовать. Для этого он положил кюветку на дно, и после того как частицы расположились по высоте подобно тому, как в кювете, стоящей вертикально, стал смотреть на кюветку сверху в микроскоп, имевший очень маленькую глубину поля зрения: в микроскоп было видно все, что происходит в тонком слое глубиной в один микрон. Передвигая микроскоп вверх и вниз, можно было помещать этот слой то выше, то ниже. Перрен стал работать так: поставил микроскоп на какой-то высоте и начал считать, сколько зернышек виднеется в поле зрения на этой высоте, затем передвинул микроскоп на новую высоту и снова сосчитал число зернышек и т. д. Заметим, что при этом числом зернышек считается среднее из нескольких наблюдений, потому что зернышки движутся совершенно хаотически и, следовательно, их число в поле зрения микроскопа бывает то больше, то меньше в зависимости от случая. Поэтому на одной и той же высоте Перрен производил подсчет зернышек много раз и затем уже вычислял значение, характерное для каждой такой высоты.
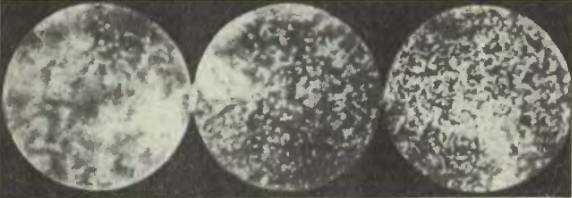
Фотографии гуммигутовой эмульсии, сделанные Ж. Перреном через микроскоп
Приведем результаты одного из опытов Перрена. Глубина кюветки была, как мы уже говорили, 100 микрон (то есть 0,1 мм). Отсчеты производились на высотах 5, 35, 65 и 95 микрон над уровнем донышка кюветки. Оказалось, что среднее число частиц на высоте 35 микрон составляет половину того, которое было на высоте 5 микрон, число частиц на высоте 65 микрон было равно половине числа частиц на высоте 35 микрон, а число частиц на высоте 95 микрон равнялось половине числа частиц на высоте 65 микрон. Иными словами, при поднятии вверх на каждые 30 микрон число частиц в данном объеме (соответствующем глубине и ширине выбранного поля зрения) уменьшалось вдвое. Поэтому математический закон убывания плотности (числа частиц в данном объеме, а значит, и в каждой единице объема) с высотой может быть словами выражен так: если высоты образуют арифметическую прогрессию, то числа зерен образуют геометрическую прогрессию.
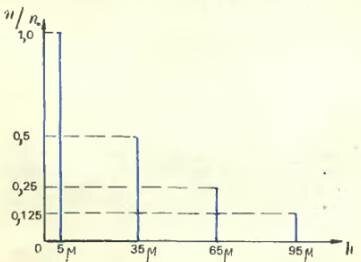
Результаты опытов Перрена
Такой закон убывания плотности зерен с высотой должен был сильно поразить и заинтересовать Перрена: ведь по такому же самому закону спадает плотность при поднятии в нашей атмосфере. Блэз Паскаль, знаменитый французский ученый, живший в XVII столетии и впервые применивший к изучению атмосферы барометр, изобретенный итальянцем Торричелли, обнаружил закон, по которому спадает с увеличением высоты плотность атмосферного воздуха. Этот закон, получивший название барометрической формулы, гласит то же самое: плотность каждого из газов, составляющих атмосферу, убывает вместе с увеличением высоты в геометрической прогрессии.
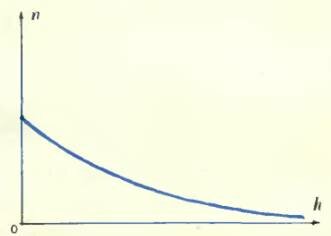
Так изменяется количество молекул воздуха с высотой
[Закон этот можно выразить и математически, в виде формулы.
Предположим, что на какой-то высоте h0 над Землей в каждом кубическом сантиметре содержится n0 молекул какого-то газа. На какой-то другой, большей высоте h таких же молекул в одном кубическом сантиметре будет, конечно, меньше, например n. Тогда барометрическая формула может быть записана в таком виде:
(~lg frac{n_0}{n} = Amg (h – h_0)) [1]. (1)
Здесь А — это некоторая постоянная величина, одинаковая для всех газов (при данной температуре), а m — масса молекулы того газа, о котором идет речь, g — ускорение силы тяжести.
Сразу видно, что в левой части равенства стоит отношение чисел частиц в единице объема (правда, под знаком логарифма), а в правой — разность высот. Это и означает, что если высоты образуют арифметическую прогрессию, то числа частиц образуют прогрессию геометрическую.
Выберем такую разность высот h – h0, чтобы число частиц n на высоте h было вдвое меньше числа частиц n0 на высоте h0. Тогда формула (1) примет вид
(~lg 2 = Amg (h – h_0)) . (2)
В таблице логарифмов легко найти, что lg 2 = 0,30103, так что
(~0,30103 = Amg (h – h_0)) . (3)
Если бы было известно численное значение постоянной А, то, подсчитав число частиц в единице объема n и n0 на высотах h и h0, легко было бы вычислить и массу молекулы m, то есть взвесить ее. Правда, сосчитать молекулы мы тоже не можем, но ведь нам и не надо знать каждое из чисел n и n0 в отдельности. Нужно знать только их отношение. А его легко найти, если измерить барометром давления на высотах h и h0: отношение давлений как раз и равно отношению чисел частиц в единице объема. Но дело в том, что величина А во времена Перрена не была известна (именно опыты Перрена и позволили определить ее). Поэтому Перрен мог рассуждать так: известно, например, что] при поднятии на 5 км количество кислорода, находящегося в кубическом сантиметре, уменьшается вдвое; при поднятии на следующие 5 км оно уменьшается еще вдвое и т. д. и т. д. Это — тот же закон, по которому уменьшается с высотой число зернышек гуммигута в кубическом сантиметре эмульсии, но только здесь иные масштабы — вместо 30 микрон здесь мы имеем 5 км. Отчего же здесь получаются другие масштабы?
Слой гуммигутовой эмульсии в 100 микрон — это, в сущности, такая .же атмосфера, но только состоящая не из молекул кислорода или азота, а из зернышек гуммигута, которые уже достаточно велики, чтобы их можно было видеть в микроскоп. Вследствие большей массы этих зернышек (по сравнению с молекулами газа) уменьшение плотности с высотой происходит быстрее, чем в обыкновенной атмосфере, окружающей нашу Землю, а именно (в случае гуммигутовых зернышек диаметром 0,21 микрона) плотность уменьшается вдвое при поднятии на 30 микрон. «Эмульсия,— говорит Перрен, — это атмосфера в миниатюре, тяготеющая к Земле. В масштабе такой атмосферы высота Альп представилась бы несколькими микронами, а отдельные холмы стали бы равны молекулам». Для нас всего важнее, что молекулы этой миниатюрной «атмосферы» — зернышки гуммигута — могут быть взвешены, а это . позволяет вычислить и массу молекул обыкновенного газа. Так Перрен сумел сделать то, что казалось совершенно невозможным, — взвесить молекулы и атомы.
[Из формулы (3) видно, что произведение массы молекулы m на разность высот, между которыми число молекул в единице объема изменяется вдвое, во всех случаях (то есть для любых частиц) равно одной и той же величине (~frac{0,30103}{A}).
Поэтому, если для гуммигутовых зерен разность высот меньше, чем для кислорода в атмосфере, то это потому, что масса гуммигутового зернышка больше массы молекулы кислорода и как раз во столько раз, во сколько раз 5 км больше, чем 30 микрон.]
Проделаем нехитрый расчет… 5 км в 166 миллионов раз больше, чем 30 микрон. Значит, масса гуммигутового зернышка с диаметром 0,21 микрона превышает массу кислородной молекулы в 166 миллионов раз.
Сколько же весит такой гуммигутовый шарик? Это нетрудно рассчитать, если измерить предварительно массу кубического сантиметра гуммигута. При этом расчете не следует забывать, что в опытах Перрена зернышки гуммигута находились в воде, а значит, по закону Архимеда каждый кубический сантиметр гуммигута терял в весе ровно столько, сколько весит кубический сантиметр воды, то есть 1 г. Значит, каждый кубический сантиметр гуммигута был в воде на один грамм легче, чем в воздухе. В результате всех расчетов (которые мы пропускаем) получается, что масса зернышка (с поправкой на закон Архимеда) была равна 8,5·10-15 г. И она в 166 миллионов раз больше массы молекулы кислорода. Значит, масса молекулы кислорода равна 5,1·10-23 г. А так как молекула кислорода в 32 раза тяжелее атома водорода (молекулярный вес кислорода равен 32), то масса атома водорода — этого самого легкого из всех атомов — равна 1,6·10-24 г. В грамме водорода содержится, следовательно, 6·1023 атомов.
[Так атомы и молекулы были не только взвешены, но и сосчитаны!]
Эти цифры, найденные Перреном, позволили связать употреблявшуюся в то время единицу атомного веса — массу атома водорода — с граммом. Масса атома водорода, выраженная в граммах, получилась настолько ничтожной, что ее никак невозможно себе представить, тем не менее она получилась вполне определенной. Атом был взвешен. Важнейшая задача атомной физики была решена.
[Заметим здесь, что цифры, полученные Перреном, конечно, не очень точны. Впоследствии были найдены другие способы определения масс атомов и молекул, и теперь мы располагаем более правильными значениями масс. По современным данным масса атома водорода, например, равна 1,673·10-24 г, а молекулы кислорода — 5,314·10-23 г. Как видите, эти цифры не так уж сильно отличаются от тех, что впервые были получены Перреном.]
Вот какой результат получил Перрен, изучая распределение зернышек гуммигута в гуммигутовой эмульсии в зависимости от высоты. Но всего любопытнее то обстоятельство, что точно такой же результат был выведен с помощью тех же гуммигутовых шариков, но совершенно иным путем, о котором мы также скажем несколько слов.

Брауновское движение
Брауновское движение в гуммигутовой эмульсии совершается необыкновенно быстро. Нет никакой возможности проследить за движением отдельного гуммигутового зернышка. Поэтому Перрен и не пытался этого делать, а поступал следующим образом: он отмечал на чертеже положение гуммигутового зернышка через определенные промежутки времени, например через каждые 30 секунд, и полученные точки соединял прямыми линиями (хотя на самом деле гуммигутовое зернышко за это время двигалось не по прямой, а по причудливой ломаной линии). Полученные рисунки дают возможность судить о беспорядочности, хаотичности брауновского движения вообще. Но Перрен делал эти рисунки не только для того, чтобы получить наглядную иллюстрацию к брауновскому движению. Его интересовала количественная сторона дела. Знаменитый Альберт Эйнштейн, который был тогда еще молодым человеком, написал (в 1905 — 1906 годах) замечательные работы, где он вывел формулу, определяющую для заданного промежутка времени среднее смещение гуммигутового зернышка относительно его первоначального положения в жидкости. Мы не станем здесь приводить эту замечательную формулу, заметим только, что в эту формулу входит величина, равная числу атомов водорода в одном грамме. Поэтому, сравнивая формулу Эйнштейна с рисунками Перрена, определяющими перемещение частицы за 30 секунд, можно вычислить эту величину. Так и сделал Перрен, и у него получилось, что число атомов водорода в одном грамме равно 6·1023, то есть получилось такое же число, как и раньше.
Совпадение двух чисел, которые были получены совершенно различными способами, является лучшим доказательством правильности всех сделанных предположений. Значит; молекулы и атомы действительно существуют, а не только являются удобной для химиков выдумкой. Такое заключение вынуждены были сделать даже те, которые долго и упорно не хотели признавать существования атомов.
… Вековой спор между сторонниками и противниками атомов закончился, таким образом, победой сторонников атомной теории. И в настоящее время мы можем с уверенностью утверждать, что все вещи на свете — и вода, и камни, и растения, и животные, и воздух, и железо и т. д. и т. д.— все это состоит из мельчайших невидимых глазу атомов.
Задачи к статье
- Пользуясь приведенными в статье данными, найдите, на какой высоте давление уменьшается вдвое. Воздух легче кислорода в отношении 28,8 : 32.
- P0 — давление воздуха на уровне моря, P1 — на высоте h. Каково давление воздуха на высотах: 2h, 3h, nh? Считать, что температура воздуха и ускорение свободного падения не меняются с высотой, и поэтому постоянная А не зависит от высоты.
- Найдите высоту над поверхностью Земли, где давление воздуха равно 0,25 и 0,125 атмосферного. Постройте кривую зависимости давления воздуха от высоты.
Ответы
- 5,55 км.
-
(~P_2 = P_1 left( frac{P_1}{P_0} right)) ,
-
(~P_3 = P_2 left( frac{P_1}{P_0} right) P_1 left( frac{P_1}{P_0} right)^2) ,
-
(~P_n = P_1 left( frac{P_1}{P_0} right)^{n – 1}) .
-
- 11,1 км; 16,65 км. Удобно воспользоваться результатом задачи 1. Давление пропорционально плотности воздуха.
Примечания
-
↑ Если k — это число «шагов», за которое мы поднимаемся на высоту h, а Δh — высота «шага», то (~h = h_0 + (k – 1) Delta h), а (~n = n_0 left( frac 1q right)^{k – 1}), где (~frac 1q) — знаменатель прогрессии, которую составляет плотность газа (q > 1). Из этих двух формул, исключив k, мы найдем, что
(~lg frac{n_0}{n} = frac{lg q}{Delta h} (h – h_0)) . (*)
Аналогичную формулу можно записать и для другого газа; величины, относящиеся к нему, мы снабдим штрихом:
(~lg frac{n’_0}{n’} = frac{lg q’}{Delta h’} (h’ – h’_0)) . (**)
Очень важным оказывается то обстоятельство, что, если плотности первого и второго газов уменьшились в одно и то же число раз, то есть (~frac{n_0}{n} = frac{n’_0}{n’}), то отношение разностей высот, при которых это произошло, (~frac{h – h_0}{h’ – h’_0}) в точности равно обратному отношению масс молекул этих газов:
(~frac{h – h_0}{h’ – h’_0} = frac{m’}{m}) .
Разделим почленно уравнение (*) на уравнение (**):
(~1 = frac{lg q (h – h_0)Delta h’}{lg q’ (h’ – h’_0)Delta h} ) , или
(~frac{lg q}{lg q’} = frac{Delta h m}{Delta h’ m’} ) .
Таким образом, (~lg q sim Delta h m). Это дает возможность записать, что
(~lg q = A_1 Delta h m) .
где A1 — это некоторая постоянная величина, не зависящая от величины шага и одинаковая для всех газов (при данной температуре).
Теперь барометрическую формулу (*) мы можем записать в таком виде:
(~lg frac{n_0}{n} = A_1mg (h – h_0)) .
Исторически сначала был открыт закон Дальтона (закон кратных отношений) – что элементы вступают в реакции всегда в строго определённом весовом соотношении. Это позволило составить таблицу относительных атомных масс. Было найдено, что наименьшая атомная масса – у водорода, а массы всех прочих кратны ей, поэтому массы атомов всех остальных элементов стали выражать через массу атома водорода. Собсно, именно это утверждение и составляет суть упомянутого метода Конницаро.
Но это ещё никак не говорило о том, чему же равна масса атома водорода “в граммах”. То есть не существовало абсолютной единицы атомной массы.
Способ к определению этой единицы появился с открытием закона Авогадро (это произошло вскоре после открытия Дальтона): в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул. Вскоре этот закон был распространён и на остальные вещества. Так появилось понятие моля и молярной массы, поэтому всё, что осталось, – это определить точное значение числа Авогадро (сущий пустяк…).
Путь к численному определению яисла Авогадро, а значит, и к определению “истинной массы” атома, открыл закон Фарадея для электролиза: на выделение 1 моля вещества при электролизе требуется заряд, пропорциональный “постоянной Фарадея” (коэффициент пропорциональности – валентность элемента, выделяемого при электролизе). Как только в конце 19 века Милликену удалось непосредственно измерить заряд электрона, по величине этого заряда и по значению постоянной Фарадея удалось вычислить значение числа Авогадро, а значит – вычислить и “атомную единицу массы”, массу одного атома водорода (сейчас у 1 а.е.м несколько другое определение, но оно связано чисто с методологией измерения, обеспечивающей максимальную точность и воспроизводимость, а не с природой оной массы).
Справедливости ради стоит отметить, что ещё до определения заряда электрона значение числа Авогадро определил австрийский физик Й. Лошмидт (“число Лошмидта” иногда используется и по сей день). Он, на основе газокинетической теории газов, сумел определить число молекул газа в 1 см³, откуда враз вычисляется число Авогадро. Но определение через заряд электрона и постоянную Фарадея оказалось более точным.
А масс-спектрометры – это уже совсем другая история…
В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.

Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
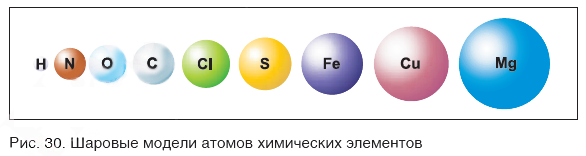
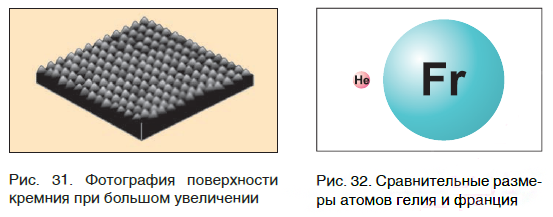
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10−27 кг и 9,8·10−10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10−27 кг, а атома кислорода — ma(О) = 26,56·10−27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.

В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
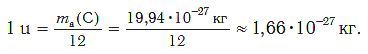
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10−27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar (А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
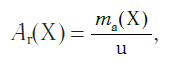
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
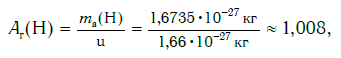
а кислорода:
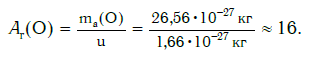
Как видите, относительная атомная масса показывает, во сколько раз масса атома данного элемента больше атомной единицы массы u.
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах (ma(O) = 26,56·10−27 кг) или атомных единицах массы (ma(O) = 16·u).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
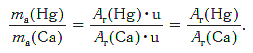
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
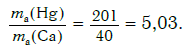
Ответ: в 5,03 раза.
Краткие выводы урока:
- Атомная единица массы представляет собой 1/12 часть массы атома углерода.
- Относительная атомная масса химического элемента равна отношению массы его атома к 1/12 части массы атома углерода.
- Относительная атомная масса химического элемента является величиной безразмерной и показывает, во сколько раз масса атома данного элемента больше атомной единицы массы.
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
