Запрос «Йод» перенаправляется сюда; см. также другие значения.
| Иод | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ← Теллур | Ксенон → | ||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
| Внешний вид простого вещества | ||||||||||||||||||||||||||||||||||||||||

Кристалл иода |
||||||||||||||||||||||||||||||||||||||||
| Свойства атома | ||||||||||||||||||||||||||||||||||||||||
| Название, символ, номер | Иод / Iodum (I), 53 | |||||||||||||||||||||||||||||||||||||||
| Группа, период, блок |
17 (устар. 7), 5, p-элемент |
|||||||||||||||||||||||||||||||||||||||
| Атомная масса (молярная масса) |
126,90447(3)[1] а. е. м. (г/моль) | |||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [Kr] 4d105s25p5 | |||||||||||||||||||||||||||||||||||||||
| Радиус атома | 136 пм | |||||||||||||||||||||||||||||||||||||||
| Химические свойства | ||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 133 пм | |||||||||||||||||||||||||||||||||||||||
| Радиус иона | (+7e) 50 (-1e) 220 пм | |||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | 2,66 (шкала Полинга) | |||||||||||||||||||||||||||||||||||||||
| Электродный потенциал | +0,535 В | |||||||||||||||||||||||||||||||||||||||
| Степени окисления | -1, 0, +1, +3, +5, +7 | |||||||||||||||||||||||||||||||||||||||
| Энергия ионизации (первый электрон) |
1008,3 (10,45) кДж/моль (эВ) | |||||||||||||||||||||||||||||||||||||||
| Термодинамические свойства простого вещества | ||||||||||||||||||||||||||||||||||||||||
| Плотность (при н. у.) | 4,93 г/см³ | |||||||||||||||||||||||||||||||||||||||
| Температура плавления | 113,5 °C | |||||||||||||||||||||||||||||||||||||||
| Температура кипения | 184,35 °C | |||||||||||||||||||||||||||||||||||||||
| Уд. теплота плавления | 15,52 (I—I) кДж/моль | |||||||||||||||||||||||||||||||||||||||
| Уд. теплота испарения | 41,95 (I—I) кДж/моль | |||||||||||||||||||||||||||||||||||||||
| Молярная теплоёмкость | 54,44[2] Дж/(K·моль) | |||||||||||||||||||||||||||||||||||||||
| Молярный объём | 25,7 см³/моль | |||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
| Кристаллическая решётка простого вещества | ||||||||||||||||||||||||||||||||||||||||
| Структура решётки | Орторомбическая | |||||||||||||||||||||||||||||||||||||||
| Параметры решётки | a=7,18 b=4,71 c=9,81[3] | |||||||||||||||||||||||||||||||||||||||
| Отношение c/a | – | |||||||||||||||||||||||||||||||||||||||
| Прочие характеристики | ||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | (300 K) (0,45) Вт/(м·К) | |||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7553-56-2 | |||||||||||||||||||||||||||||||||||||||
| Наиболее долгоживущие изотопы | ||||||||||||||||||||||||||||||||||||||||
|
Основная статья: Изотопы иода
|
Ио́д[4] (общеупотребительное название — йо́д[5]; от греч. ἰώδης — «фиалковый (фиолетовый)», также от лат. Iodum) — химический элемент 17-й группы (по устаревшей классификации — главной подгруппы седьмой группы, VIIA), пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 53.

Фазовая диаграмма иода: тройная точка 386,65 К (113,5 °С), 12,1 кПа (0,12 атм); критическая точка 819 К (546 °С), 11,7 МПа (115 атм)
Ниже температуры тройной точки на диаграмме фазового равновесия имеется только линия сублимации. Поэтому при относительно медленном (квазистатическом) нагреве в открытой системе, когда подавляющая часть подводимой от нагревателя энергии расходуется на фазовый переход (возгонку), а не на повышение температуры твёрдой фазы, иод, не плавясь, возгоняется и превращается сразу в пары. Наоборот, при охлаждении иод десублимируется и образует кристаллы, минуя жидкое состояние. Для превращения в жидкость твёрдый иод нагревают в закрытом сосуде. При очень быстром (нестатическом) нагреве иод плавится даже в открытом сосуде
Простое вещество иод (при нормальных условиях) — это кристаллы (формула — I2) чёрно-серого цвета с фиолетовым металлическим блеском, проявляющие неметаллические свойства и издающие характерный запах. Легко образует фиолетовые пары, обладающие резким запахом. Элементарный иод высокотоксичен.
Название и обозначение[править | править код]
Название элемента предложено Гей-Люссаком и происходит от др.-греч. ἰο-ειδής (букв. «фиалкоподобный»), что связано с цветом пара, который наблюдал французский химик Бернар Куртуа, нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой. В медицине и биологии данный элемент и простое вещество обычно называют йодом, например, «раствор йода», в соответствии со старым вариантом названия, существовавшим в химической номенклатуре до середины XX века.
В современной химической номенклатуре используется наименование иод. Такое же положение существует в некоторых других языках, например в немецком: общеупотребительное Jod и терминологически корректное Iod. Одновременно с изменением названия элемента в 1950-х годах Международным союзом общей и прикладной химии символ элемента J был заменён на I[6][нет в источнике].
История[править | править код]
Иод был открыт в 1811 году Куртуа. При кипячении серной кислоты с рассолом золы морских водорослей он наблюдал выделение фиолетового пара, при охлаждении превращающегося в тёмные кристаллы с ярким блеском.
Элементная природа иода установлена в 1811—1813 годах Л. Ж. Гей-Люссаком (а чуть позже — и Х. Дэви). Гей-Люссак получил также многие производные (HI, HIO3, I2O5, ICl и др.). Важнейшим природным источником иода служат буровые воды нефтяных и газовых скважин.
В начале XX века основными мировыми поставщиками иода были держатели чилийских селитренных фабрик «Йодное объединение» и
«Международный синдикат», которые ограничивали добычу иода, задействуя лишь 30 из 160 фабрик (700 тонн в год из потенциальных 4000) для поддержания на мировом рынке высоких цен. В Великобритании, Японии и Норвегии иод производился из морских водорослей. В 1914 году английские фирмы скупили и закрыли норвежские иодные заводы. Россия импортировала чилийский иод через германских и американских посредников вплоть до 1917 года, когда специальная царская комиссия одобрила основание завода в Архангельске по добыче иода из водорослей Белого моря для нужд фронта. К 1923 году из-за сложности со сбором сырья завод стал убыточным и был распущен. Его сотрудники открыли новый Жижгинский завод при поддержке йодного отделения Архангельского института промышленных изысканий и привлекая к сбору сырья поморов. Начав с 50 кг иода в 1923 году, в 1929 году заводчане получили первую тонну иода. При ежегодной потребности СССР в 115 тоннах Госплан РСФСР выделил дополнительные средства на устройство ещё 20 заводов на Беломорье, а также рассмотрел возможность добычи иода из нефтяных источников Апшеронского полуострова[7]. В 1964 году на базе Славянско-Троицкого месторождения (единственного в России промышленного месторождения йодобромных вод) заработал Троицкий йодный завод с мощностью эксплуатационных запасов 200 тонн иода в год. С распадом СССР и появлением на внутреннем рынке дешёвого иода из Чили к середине 1990-х годов предприятие стало убыточным, в 2015 году в связи с износом инфраструктуры добыча сырья прекратилась, в июне 2019 года завод признан банкротом, а в 2020 году куплен фармацевтическим предприятием «ЮжФарм»[8].
Нахождение в природе[править | править код]

Иод — редкий элемент. Его кларк — всего 0,5 мг/кг. Однако он чрезвычайно сильно рассеян в природе и, будучи далеко не самым распространённым элементом, присутствует практически везде. Иод находится в виде иодидов в морской воде (20—30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях (до 3 г на тонну высушенной морской капусты[9] — водоросли ламинарии). Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на острове Вулькано (Италия). Запасы природных иодидов оцениваются в 15 млн тонн, 99 % запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча иода, например, чилийская Atacama Minerals производит свыше 720 тонн иода в год. Наиболее известный из минералов иода — лаутарит Ca(IO3)2. Некоторые другие минералы иода — иодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br), майерсит CuI·4AgI.
Сырьём для промышленного получения иода в России служат нефтяные буровые воды[10], тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, щёлок калийных и селитряных производств, что намного удорожает производство иода из такого сырья[11].
Типичная концентрация иода в подземных рассолах (где он существует обычно в форме иодида натрия) составляет 30…150 ppm. Оценённые запасы иода в рассолах составляют 5 млн тонн в Японии, 0,25 млн тонн в США, 0,1 млн тонн в Индонезии и 0,36 млн тонн суммарно в Туркменистане, Азербайджане и России. Запасы иода в чилийских залежах каличе (известковых вторичных отложений с примесями нитратов, хлоридов, иодатов и других растворимых солей в пустыне Атакама, где он присутствует в виде иодата кальция Ca(IO3)2) составляют 1,8 млн тонн. Кроме того, отмечается возможность добычи иода из морских водорослей (запасы около 4 тыс. тонн в Японии). Суммарная оценка запасов иода составляет 7,5 млн тонн, не считая морской воды (34,5 млн тонн), прямая добыча иода из которой экономически невыгодна ввиду низкой концентрации — менее 0,05 ppm[12].
Физические свойства[править | править код]

Жидкий иод на дне химического стакана
Полная электронная конфигурация атома иода: 1s22s22p63s23p63d104s24p64d105s25p5
Природный иод является моноизотопным элементом, в его состав входит только один изотоп — иод-127 (см. Изотопы иода). Конфигурация внешнего электронного слоя — 5s2p5. В соединениях проявляет степени окисления −1, 0, +1, +3, +5 и +7 (валентности I, III, V и VII).
Радиус нейтрального атома иода 0,136 нм, ионные радиусы I−, I5+ и I7+ равны, соответственно, 0,206; 0,058—0,109; 0,056—0,067 нм. Энергии последовательной ионизации нейтрального атома иода равны, соответственно: 10,45; 19,10; 33 эВ. Сродство к электрону −3,08 эВ. По шкале Полинга электроотрицательность иода равна 2,66, иод принадлежит к числу неметаллов.
Иод при обычных условиях — твёрдое вещество, чёрно-серые или тёмно-фиолетовые кристаллы со слабым металлическим блеском и специфическим запахом.
Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например в бензоле — в отличие от бурого раствора в полярном этиловом спирте. Слабо растворяется в воде (0,28 г/л), лучше растворяется в водных растворах иодидов щелочных металлов с образованием трииодидов (например, трииодида калия KI3).
При нагревании при атмосферном давлении иод сублимирует (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении при атмосферном давлении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей.
Жидкий иод можно получить, нагревая его под давлением.
Изотопы[править | править код]
Известны 37 изотопов иода с массовыми числами от 108 до 144. Из них только 127I является стабильным, период полураспада остальных изотопов иода составляет от 103 мкс до 1,57⋅107 лет[13]; отдельные изотопы используются в терапевтических и диагностических целях.
Радиоактивный нуклид 131I распадается с испусканием β-частиц (наиболее вероятные максимальные энергии — 0,248, 0,334 и 0,606 МэВ), а также с излучением γ-квантов с энергиями от 0,08 до 0,723 МэВ[14].
Химические свойства[править | править код]

Пробирка с раствором элементарного иода в хлориде серы (I) — раствор малинового цвета
Иод относится к группе галогенов.
Электронная формула (Электронная конфигурация) иода: 1s22s22p63s23p63d104s24p64d105s25p5.
Образует ряд кислот: иодоводородную (HI), иодноватистую (HIO), иодистую (HIO2), иодноватую (HIO3), иодную (HIO4).
Химически иод довольно активен, хотя и в меньшей степени, чем хлор и бром.
- Последняя реакция также используется в аналитической химии для определения иода.
- Это вещество почти не имеет практического значения и известно лишь своей способностью разлагаться со взрывом от малейшего прикосновения.
Применение[править | править код]
В медицине[править | править код]

5%-й спиртовой раствор иода
5-процентный спиртовой раствор иода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците иода в организме. Продукты присоединения иода к крахмалу (т. н. «Синий йод» — Йодинол, Йокс, Бетадин и др.) являются более мягкими антисептиками.
При большом количестве внутримышечных инъекций на их месте пациенту делается йодная сетка — йодом рисуется сетка на площади, в которую делаются инъекции (например, на ягодицах). Это нужно для того, чтобы быстро рассасывались «шишки», образовавшиеся в местах внутримышечных инъекций.
В рентгенологических и томографических исследованиях широко применяются йодсодержащие контрастные препараты.
Иод-131, как и некоторые радиоактивные изотопы иода (125I, 132I), применяется в медицине для диагностики и лечения заболеваний щитовидной железы[2]. Изотоп широко применяется при лечении диффузно-токсического зоба (болезни Грейвса), некоторых опухолей. Согласно нормам радиационной безопасности НРБ-99/2009, принятым в России, выписка из клиники пациента, лечившегося с использованием иода-131, разрешается при снижении общей активности этого нуклида в теле пациента до уровня 0,4 ГБк[19].
В криминалистике[править | править код]
В криминалистике пары иода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например на купюрах.
В технике: рафинирование металлов[править | править код]
Источники света[править | править код]
Иод используется в источниках света:
- галогеновых лампах — в качестве компонента газового наполнителя колбы для осаждения испарившегося вольфрама нити накаливания обратно на неё.
- металлогалогеновых дуговых лампах — в качестве газовой среды разряда используются галогениды ряда металлов, использование различных смесей которых позволяет получать лампы с большим разнообразием спектральных характеристик.
Производство аккумуляторов[править | править код]
Иод используется в качестве компонента положительного электрода (окислителя) в литиево-ионных аккумуляторах для автомобилей.
Лазерный термоядерный синтез[править | править код]
Некоторые иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбуждённых атомах иода (исследования в области лазерного термоядерного синтеза).
Динамика производства и потребления иода[править | править код]
Мировое потребление иода в 2016 году составило ок. 33 тыс. тонн. Около 18 % (6 тыс. тонн) поступает от вторичной переработки. Более 95 % от мирового производства иода добывается в 6 странах: Япония, США, Туркмения, Азербайджан, Индонезия (во всех перечисленных — из подземных рассолов) и Чили (из природных залежей иодатов в Атакаме). Большинство иода США добывается из рассолов, откачиваемых из глубоких скважин в северной Оклахоме. В Японии иод добывается как побочный продукт из иодоносных рассолов газовых скважин. В Азербайджане и Туркменистане добыча рассолов осуществляется из специально пробурённых скважин, не ассоциированных с добычей нефти или газа. В Индонезии месторождения иодоносных рассолов эксплуатируются в Моджокерто (Восточная Ява), производство идёт главным образом на внутреннее потребление[12].
22 % мирового производства иода идёт на производство рентгеноконтрастных веществ, используемых в медицинской диагностике. 20 % идёт в фармацевтику (7 % на обеззараживающие ПАВ, такие как иодная настойка, 13 % — на другие фармпрепараты). Около 8 % расходуется на пищевые добавки для животных, около 3 % идёт для пищевых потребностей человека как микроэлемент (добавка в поваренную соль и отдельные пищевые добавки), а ещё около 3 % — для производства поливинилпиролидона-иода, стабилизирующей добавки к пиву и осветлителя для вина. 12 % иода используется для производства поляризационных плёнок жидкокристаллических дисплеев (в форме полииодидов I−
3 и I−
5). 7 % мирового производства иода идёт на производство его соединений со фтором, в том числе чрезвычайно токсичных и используемых в органическом синтезе. 4 % — на биоциды, добавляемые в краски для подавления роста плесневых грибков на окрашиваемой поверхности. 4 % расходуется в форме иодида меди (I) и других иодидов в качестве добавок к полиамидам (капрон, нейлон и другие) для их стабилизации по отношению к воздействию тепла, света и кислорода. Остальные 17 % производства идут на прочие нужды, перечисленные выше[12].
Биологическая роль[править | править код]
Иод относится к микроэлементам[20][21][22] и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, ламинария, фукус и другие) накапливают до 1 % иода. Богаты иодом водные растения семейства рясковых. Иод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.[источник не указан 1469 дней]
Иод и щитовидная железа[править | править код]
У животных и человека иод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой, — тироксина и трийодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг) содержится 12—200 мг иода; содержание иода в организме человека (общее) — порядка 0,0001 %. Суточная потребность человека в иоде определяется возрастом, физиологическим состоянием и массой тела. Для человека среднего возраста нормальной комплекции (нормостеник) суточная доза иода составляет 0,15 мг[23].
Отсутствие или недостаток иода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом иода, с профилактической целью добавляют иодид калия, иодид натрия или иодат калия (иодированная соль).
Недостаток иода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму).
Также при небольшом недостатке иода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Избыток иода в пище обычно легко переносится организмом, однако в отдельных случаях у людей с повышенной чувствительностью этот избыток может также привести к расстройствам щитовидной железы[24].
Токсичность[править | править код]
![]()

Иод в виде свободного вещества ядовит. Полулетальная доза (LD50) — 3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров иода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, повышение температуры, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день появляется кровь в моче. Через 2 дня появляются почечная недостаточность и миокардит. Без лечения наступает летальный исход[25].
ПДК иода в воде 0,125 мг/дм³, в воздухе 1 мг/м³. Иод относится ко II классу токсичности (высокоопасен) согласно ГОСТ 12.1.007-76[26].
Радиоактивный иод-131 (радиойод), являющийся бета- и гамма-излучателем, особенно опасен для организма человека, так как радиоактивные изотопы биохимически не отличаются от стабильных. Поэтому почти весь радиоактивный иод, как и обычный, концентрируется в щитовидной железе, что приводит к её облучению и дисфункции. Основным источником загрязнения атмосферы радиоактивным иодом являются атомные станции и фармакологическое производство[27]. В то же время это свойство радиоиода позволяет использовать его для борьбы с опухолями щитовидной железы и диагностики её заболеваний (см. выше).
См. также[править | править код]
- Тиреоидит
- Иодная яма
Примечания[править | править код]
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi Awer. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02. Архивировано 5 февраля 2014 года.
- ↑ 1 2 Ксензенко В. И., Стасиневич Д. С. Иод // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1990. — Т. 2: Даффа — Меди. — С. 251—252. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.
- ↑ WebElements Periodic Table of the Elements | Iodine | crystal structures. Дата обращения: 10 августа 2010. Архивировано 1 февраля 2011 года.
- ↑ Такое написание термина зафиксировано в химической номенклатуре, Иод — статья из Большой советской энциклопедии. и БРЭ.
- ↑ Такое написание зафиксировано в нормативных Архивная копия от 26 февраля 2021 на Wayback Machine словарях русского языка — «Орфографическом словаре русского языка» Б. З. Букчиной, И. К. Сазоновой, Л. К. Чельцовой (6-е издание, 2010; ISBN 978-5-462-00736-1) и «Грамматическом словаре русского языка» А. А. Зализняка (6-е издание, 2009; ISBN 978-5-462-00766-8).
- ↑ Леенсон И. А. Иод или йод? // Химия и жизнь — XXI век. — 2008. — № 12. — С. 58—59. — ISSN 1727-5903. Архивировано 29 октября 2021 года.
- ↑ М. Максимов «Советский иод» // Журнал «Химия и жизнь», № 11, 1987, с. 59—60.
- ↑ Троицкий йодный завод за 2 млн рублей купило ООО «ЮжФарм» Архивная копия от 1 августа 2021 на Wayback Machine // Коммерсантъ, 16.12.2020.
- ↑ Продукты, богатые йодом : [арх. 26 сентября 2021] // Медицинский Центр Консилиум.
- ↑ Пятьдесят третий элемент. Прилив и отлив Архивная копия от 24 апреля 2018 на Wayback Machine.
- ↑ http://chls.web-box.ru/novosti/pochemu-roshal-protiv-joda (недоступная ссылка).
- ↑ 1 2 3 Hora K. Iodine production and industrial applications (англ.) // IDD Newsletter. — 2016. — Iss. August. Архивировано 2 августа 2021 года.

- ↑ Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — doi:10.1016/j.nuclphysa.2003.11.001. — Bibcode: 2003NuPhA.729….3A.

- ↑ WWW Table of Radioactive Isotopes (англ.). — Энергетические уровни 131I. Дата обращения: 27 марта 2011. Архивировано 22 августа 2011 года.
- ↑ Качественная реакция на йод (Архивная копия от 28 июля 2014 на Wayback Machine) — видеоопыт в Единой коллекции цифровых образовательных ресурсов.
- ↑ См. с. 92 следующей статьи: Colin, Gaultier de Claubry. Mémoire sur les combinaisons de l’iode avec les substances végétales et animales (фр.) // Annales de chimie (англ.) (рус. : magazine. — 1814. — Vol. 90. — P. 87—100.
- ↑ Воробьёв А. Ф. Общая и неорганическая химия. — Академкнига, 2006. — Т. 2. — С. 346. — 544 с. — ISBN 5-94628-256-5.
- ↑ Silberrad, O. The Constitution of Nitrogen Triiodide (англ.) // Journal of the Chemical Society (англ.) (рус.. — Chemical Society, 1905. — Vol. 87. — P. 55—66. — doi:10.1039/CT9058700055.
- ↑ «Нормы радиационной безопасности (НРБ-99/2009). Санитарные правила и нормативы СанПин 2.6.1.2523-09» Архивная копия от 24 марта 2012 на Wayback Machine.
- ↑ Ермаков В. В., Иод в организме (БРЭ), 2008.
- ↑ Микроэлементы, 1986.
- ↑ Ковальский В. В., Иод (раздел «Иод в организме») (БСЭ), 1972.
- ↑ Дефицит йода и йоддефицитные заболевания
- ↑ Angela M. Leung and Lewis E. Braverman. Consequences of excess iodine Архивная копия от 20 декабря 2018 на Wayback Machine // Nat Rev Endocrinol. 2014 Mar; 10(3): 136—142. (англ.)
- ↑ Вредные химические вещества. Неорганические соединения элементов V-VIII групп / под ред. Владимира Филова. — М.: Химия. — С. 400. — 592 с. — 33 000 экз. — ISBN 5-7245-0264-X. Архивировано 19 января 2012 года.
- ↑ ГОСТ 12.1.007-76. Дата обращения: 10 февраля 2020. Архивировано 14 мая 2006 года.
- ↑ В воздухе над Германией обнаружен радиоактивный йод, Germania.one. Архивировано 2 марта 2017 года. Дата обращения: 1 марта 2017.
Литература[править | править код]
- Ермаков В. В. Иод в организме // Большая российская энциклопедия. — Большая Российская энциклопедия, 2008. — Т. 11. — С. 540.
- Ковальский В. В. Иод (раздел: в организме) // Большая советская энциклопедия, 3-е изд. — Советская энциклопедия, 1972. — Т. 10. — С. 367.
- Микроэлементы // Биологический энциклопедический словарь. — Советская энциклопедия, 1986. — С. 361—362.
Ссылки[править | править код]
- Иод / В. П. Зломанов // Излучение плазмы — Исламский фронт спасения. — М. : Большая российская энциклопедия, 2008. — С. 539. — (Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов ; 2004—2017, т. 11). — ISBN 978-5-85270-342-2.
- Иод // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- Иод на Webelements
- Иод в Популярной библиотеке химических элементов
- Из истории йода
Йод – интересный и загадочный химический элемент, который играет важную роль в человечестве. Без него многие сферы деятельности не смогли бы нормально функционировать.
История открытия йода
Йод был открыт в 1811 г. французским химиком Бернаром Картуа. При кипячении серной кислоты с рассолом золы морских водорослей, он наблюдал выделение фиолетового пара, при охлаждении превращающегося в тёмные кристаллы с ярким блеском.
Нахождение в природе
Йод достаточно редкий элемент. Однако он чрезвычайно сильно рассеян в природе и, будучи далеко не самым распространённым элементом, присутствует практически везде. Йод находится в виде иодидов в морской воде (20—30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях (2,5 г на тонну высушенной морской капусты, ламинарии). Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны. Запасы природных иодидов оцениваются в 15 млн тонн, 99 % запасов находятся в Чили и Японии. Наиболее известный из минералов йода — лаутарит Ca(IO3)2.
Применение йода
- В медицине
- 5-процентный спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения, но не для приёма внутрь при дефиците йода в организме.
- При большом количестве внутримышечных инъекций, на их месте пациенту делается йодная сетка — йодом рисуется сетка на площади, в которую делаются инъекции. Это нужно для того, чтобы быстро рассасывались «шишки», образовавшиеся в местах внутримышечных инъекций.
- В рентгенологических и томографических исследованиях широко применяются йодсодержащие контрастные препараты.
- Иод-131, как и некоторые радиоактивные изотопы йода (125I, 132I) применяются в медицине для диагностики и лечения заболеваний щитовидной железы. Изотоп широко применяется при лечении диффузно-токсического зоба (болезни Грейвса), некоторых опухолей.
- В криминалистике
В криминалистике пары йода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например, на купюрах.
- В технике
- в галогеновых лампах, металлогалогеновых дуговых лампах
- в качестве компонента положительного электрода в литиево-ионных аккумуляторах для автомобилей
- для производства сверхмощных газовых лазеров на возбуждённых атомах йода;
- для производства жидкокристаллических дисплеев.
Биологическая роль
У животных и человека йод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой – тироксина и трииодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека, масса тела 70 кг, содержится 12—20 мг йода. Суточная потребность человека в йоде определяется возрастом, физиологическим состоянием и массой тела. Для человека среднего возраста нормальной комплекции суточная доза йода составляет 0,15 мг.
Отсутствие или недостаток йода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом йода, с профилактической целью добавляют иодид калия, иодид натрия или иодат калия.
Недостаток йода приводит к заболеваниям. Также при небольшом недостатке йода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Избыток йода в пище обычно легко переносится организмом, однако в отдельных случаях в людях с повышенной чувствительностью этот избыток может также привести к расстройствам щитовидной железы.
Радиоактивность
Йод в виде свободного вещества токсичен. Смертельная доза — 3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров йода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, повышение температуры, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день появляется кровь в моче. Через 2 дня появляются почечная недостаточность и миокардит. Без лечения наступает летальный исход. Йод относится ко II классу опасности.
Радиоактивный иод-131, являющийся бета- и гамма-излучателем, особенно опасен для организма человека, так как радиоактивные изотопы биохимически не отличаются от стабильных. Поэтому почти весь радиоактивный йод, как и обычный, концентрируется в щитовидной железе, что приводит к её облучению и дисфункции. Основным источником загрязнения атмосферы радиоактивным йодом являются атомные станции и фармакологическое производство. В то же время — это свойство радио-йода позволяет использовать его для борьбы с опухолями щитовидной железы и диагностики её заболеваний.
Йод

Йод (тривиальное (общеупотребительное) название — йод; от греч. ἰώδης — «фиалковый (фиолетовый)») — химический элемент с атомным номером 53. Принадлежит к 17-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA), находится в пятом периоде таблицы. Атомная масса элемента 126,90447 а. е. м.. Обозначается символом I (от лат. Iodum). Химически активный неметалл, относится к группе галогенов.
Простое вещество йод при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Элементарный йод высокотоксичен. Молекула простого вещества двухатомна (формула I2).
|
|
|
| Название, символ, номер | Йод / Iodum (I), 53 |
|---|---|
| Атомная масса (молярная масса) |
126,90447(3) а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d10 5s2 5p5 |
| Радиус атома | 136 пм |
| Ковалентный радиус | 133 пм |
| Радиус иона | (+7e) 50 (-1e) 220 пм |
| Электроотрицательность | 2,66 (шкала Полинга) |
| Электродный потенциал | +0,535 В |
| Степени окисления | +7, +5, +3, +1, 0, −1 |
| Энергия ионизации (первый электрон) |
1008,3 (10,45) кДж/моль (эВ) |
| Плотность (при н. у.) | 4,93 г/см³ |
| Температура плавления | 113,5 °C |
| Температура кипения | 184,35 °C |
| Уд. теплота плавления | 15,52 (I—I) кДж/моль |
| Уд. теплота испарения | 41,95 (I—I) кДж/моль |
| Молярная теплоёмкость | 54,44 Дж/(K·моль) |
| Молярный объём | 25,7 см³/моль |
| Структура решётки | орторомбическая |
| Параметры решётки | a=7,18 b=4,71 c=9,81 |
| Отношение c/a | – |
| Теплопроводность | (300 K) (0,45) Вт/(м·К) |
| ГОСТ | ГОСТ 4159-79 ГОСТ 545-76 |
| Номер CAS | 7553-56-2 |

Содержание
- 1 Название и обозначение
- 2 История
- 3 Нахождение в природе
- 4 Физические свойства
- 4.1 Изотопы
- 5 Химические свойства
- 6 Применение
- 6.1 В медицине
- 6.2 В криминалистике
- 6.3 В технике: рафинирование металлов
- 6.3.1 Источники света
- 6.3.2 Производство аккумуляторов
- 6.3.3 Лазерный термоядерный синтез
- 6.3.4 Радиоэлектронная промышленность
- 6.4 Динамика потребления йода
- 7 Биологическая роль
- 7.1 Йод и щитовидная железа
- 7.2 Токсичность

Название и обозначение
Название элемента предложено Гей-Люссаком и происходит от др.-греч. ἰο-ειδής (букв. «фиалкоподобный»), что связано с цветом пара, который наблюдал французский химик Бернар Куртуа, нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой. В медицине и биологии данный элемент и простое вещество обычно называют йодом, например, «раствор йода», в соответствии со старым вариантом названия, существовавшим в химической номенклатуре до середины XX века.
В современной химической номенклатуре используется наименование йод. Такое же положение существует в некоторых других языках, например, в немецком: общеупотребительное Jod и терминологически корректное Iod. Одновременно с изменением названия элемента в 1950-х годах Международным союзом общей и прикладной химии символ элемента J был заменен на I.
История
Йод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент.
Нахождение в природе

Йод — редкий элемент. Его кларк — всего 400 мг/т. Однако он чрезвычайно сильно рассеян в природе и, будучи далеко не самым распространенным элементом, присутствует практически везде. Йод находится в виде йодидов в морской воде (20—30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях (2,5 г на тонну высушенной морской капусты, ламинарии). Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на острове Вулькано (Италия). Запасы природных йодидов оцениваются в 15 млн тонн, 99 % запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча йода, например, чилийская Atacama Minerals производит свыше 720 тонн йода в год. Наиболее известный из минералов йода — лаутарит Ca(IO3)2. Некоторые другие минералы йода — йодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br), майерсит CuI·4AgI.
Сырьём для промышленного получения йода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, щёлок калийных и селитряных производств, что намного удорожает производство йода из такого сырья.
Физические свойства

Жидкий йод на дне химического стакана
Природный йод состоит только из одного изотопа — йода-127 (см. Изотопы йода). Конфигурация внешнего электронного слоя — 5s2p5. В соединениях проявляет степени окисления −1, 0, +1, +3, +5 и +7 (валентности I, III, V и VII).
Радиус нейтрального атома йода 0,136 нм, ионные радиусы I−, I5+ и I7+ равны, соответственно, 0,206; 0,058-0,109; 0,056-0,067 нм. Энергии последовательной ионизации нейтрального атома йода равны, соответственно: 10,45; 19,10; 33 эВ. Сродство к электрону −3,08 эВ. По шкале Полинга электроотрицательность йода — 2,66, йод принадлежит к числу неметаллов.
Йод при обычных условиях — твёрдое вещество, чёрно-серые или тёмно-фиолетовые кристаллы со слабым металлическим блеском и специфическим запахом.
Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например, в бензоле — в отличие от бурого раствора в полярном этиловом спирте. Слабо растворяется в воде (0,28 г/л), лучше растворяется в водных растворах йодидов щелочных металлов с образованием трийодидов (например трийодида калия KI3).
При нагревании при атмосферном давлении йод сублимирует (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении при атмосферном давлении пары йода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки йода от нелетучих примесей.
Жидкий йод можно получить, нагревая его под давлением.

Изотопы
Известны 37 изотопов йода с массовыми числами от 108 до 144. Из них только 127I является стабильным, период полураспада остальных изотопов йода составляет от 103 мкс до 1,57⋅107 лет; отдельные изотопы используются в терапевтических и диагностических целях.
Радиоактивный нуклид 131I распадается с испусканием β-частиц (наиболее вероятные максимальные энергии — 0,248, 0,334 и 0,606 МэВ), а также с излучением γ-квантов с энергиями от 0,08 до 0,723 МэВ.

Химические свойства
Йод относится к группе галогенов.
Электронная формула (Электронная конфигурация) йода: 1s22s22p63s23p63d104s24p64d105s25p5.
Образует ряд кислот: йодоводородную (HI), йодноватистую (HIO), йодистую (HIO2), йодноватую (HIO3), йодную (HIO4).
Химически йод довольно активен, хотя и в меньшей степени, чем хлор и бром.
- Довольно известной качественной реакцией на йод является его взаимодействие с крахмалом, при котором наблюдается синее окрашивание в результате образования соединения включения. Эту реакцию открыли в 1814 году Жан-Жак Колен (Jean-Jacques Colin) и Анри-Франсуа Готье де Клобри (Henri-François Gaultier de Claubry).
- С металлами йод при легком нагревании энергично взаимодействует, образуя йодиды:
-
- Hg + I2 → HgI2
- С водородом йод реагирует только при нагревании и не полностью, образуя йодоводород:
-
- H2 + I2 → 2HI
- Йод является окислителем, менее сильным, чем фтор, хлор и бром. Сероводород H2S, Na2S2O3 и другие восстановители восстанавливают его до иона I−:
-
- I2 + H2S → S + 2HI
-
- I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Последняя реакция также используется в аналитической химии для определения йода.
- При растворении в воде йод частично реагирует с ней (По “Началам Химии” Кузьменко: реакция не идёт даже при нагревании, текст нуждается в проверке)
-
- I2 + H2O → HI + HIO , pKc=15,99
- Реакция образования нитрида трийода:
-
- 3I2 + 5NH3 → 3NH4I + NH3 ⋅ NI3↓
Нитрид трийода в сухом кристаллическом состоянии разлагается с выделением фиолетовых паров йода, что демонстрируется как эффектная химическая реакция.
- Йодиды щелочных металлов очень склонны в растворах присоединять (растворять) молекулы галогенов с образованием полийодидов (перйодидов) — трийодид калия, дихлоройодат I калия:
-
- KI + I2 → KI3
Применение
В медицине

5 % спиртовой раствор йода
«Раствор йода» ссылается сюда. На эту тему нужна отдельная статья.
Основная статья: Раствор Люголя
5-процентный спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците йода в организме. Продукты присоединения йода к крахмалу, другим ВМС (т. н. «Синий йод» — Йодинол, Йокс, Бетадин и др.) являются более мягкими антисептиками.
При большом количестве внутримышечных инъекций, на их месте пациенту делается йодная сетка, — йодом рисуется сетка на площади, в которую делаются инъекции (напр., на ягодицах). Это нужно для того, чтобы быстро рассасывались «шишки», образовавшиеся в местах внутримышечных инъекций.
Широко рекламируется в альтернативной (неофициальной) медицине, однако его использование без назначения врача в целом мало обосновано и нередко сопровождается различными рекламными заявлениями.
В качестве антисептика применяется всё реже и реже, наряду со спиртовым раствором йода используется зелёнка, фукорцин, пиоктанин, растворы перекиси водорода и др.
В рентгенологических и томографических исследованиях широко применяются йодсодержащие контрастные препараты.
Йод-131, как и некоторые радиоактивные изотопы йода (125I, 132I) применяются в медицине для диагностики и лечения заболеваний щитовидной железы. Изотоп широко применяется при лечении диффузно-токсического зоба (болезни Грейвса), некоторых опухолей. Согласно нормам радиационной безопасности НРБ-99/2009, принятым в России, выписка из клиники пациента, лечившегося с использованием йода-131, разрешается при снижении общей активности этого нуклида в теле пациента до уровня 0,4 ГБк.
В криминалистике
В криминалистике пары йода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например, на купюрах.
В технике: рафинирование металлов
Источники света
Йод используется в источниках света:
- галогеновых лампах — в качестве компонента газового наполнителя колбы для осаждения испарившегося вольфрама нити накаливания обратно на неё.
- металлогалогеновых дуговых лампах — в качестве газовой среды разряда используются галогениды ряда металлов, использование различных смесей которых позволяет получать лампы с большим разнообразием спектральных характеристик.
Производство аккумуляторов
Йод используется в качестве компонента положительного электрода (окислителя) в литиево-ионных аккумуляторах для автомобилей.
Лазерный термоядерный синтез
Некоторые йодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах йода (исследования в области лазерного термоядерного синтеза).
Радиоэлектронная промышленность]
В последние годы резко повысился спрос на йод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления йода
Мировое потребление йода в 2005 году составило 25,8 тыс. тонн

Биологическая роль
Йод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, ламинария, фукус и другие) накапливают до 1 % йода. Богаты йодом водные растения семейства рясковых. Йод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
Йод и щитовидная железа
У животных и человека йод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трийодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг) содержится 12—20 мг йода. Суточная потребность человека в йоде определяется возрастом, физиологическим состоянием и массой тела. Для человека среднего возраста нормальной комплекции (нормостеник) суточная доза йода составляет 0,15 мг.
Отсутствие или недостаток йода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом йода, с профилактической целью добавляют йодид калия, йодид натрия или йодат калия (йодированная соль).
Недостаток йода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму). Также при небольшом недостатке йода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Избыток йода в пище обычно легко переносится организмом, однако в отдельных случаях в людях с повышенной чувствительностью этот избыток может также привести к расстройствам щитовидной железы.
Токсичность

Йод токсичен. Смертельная доза (LD50) — 3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров йода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, повышение температуры, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день появляется кровь в моче. Через 2 дня появляются почечная недостаточность и миокардит. Без лечения наступает летальный исход.
ПДК йода в воде 0,125 мг/дм³, в воздухе 1 мг/м³.
Радиоактивный йод-131 (радиойод), являющийся бета- и гамма-излучателем, особенно опасен для организма человека, так как радиоактивные изотопы биохимически не отличаются от стабильных. Поэтому почти весь радиоактивный йод, как и обычный, концентрируется в щитовидной железе, что приводит к её облучению и дисфункции. Основным источником загрязнения атмосферы радиоактивным йодом являются атомные станции и фармакологическое производство. В то же время это свойство радиойода позволяет использовать его для борьбы с опухолями щитовидной железы и диагностики её заболеваний (см. выше).
|
Соединения йода |
|
|---|---|
| Оксиды |
|
| Галогениды и оксигалогениды |
|
| Кислоты |
|
| Прочие |
|

История открытия

Йод был открыт в 1811 году французским химиком Бернаром Куртуа (1777—1838). Одна из первых его работ в начале 1800-х годов состояла в том, чтобы помочь своему отцу в изготовлении соединений натрия и калия (нитрат калия, KNO3) из морских водорослей.
Куртуа и его отец собирали водоросли на побережьях Нормандии и Бретани во Франции. Затем они жгли их и смачивали пепел водорослей в воде, чтобы растворить соединения натрия и калия. Однажды в 1811 году Бернар добавил серную кислоту и увидел фиолетовые пары, которые конденсировались, образуя кристаллы с металлическим блеском. Куртуа догадался, что это был новый элемент, который он назвал в честь его цвета (на греческом языке слово «иодес» означает «фиолетовый»).
Куртуа дал небольшое количество этого вещества Шарлю-Бернару Десормесу и Николя Клеману, которые провели систематическое расследование. В ноябре 1813 года они выставили йод в Императорском институте в Париже. То, что это действительно новый элемент, было доказано Джозефом Гей-Люссаком и подтверждено Хамфри Дэви, который отправил отчёт в Королевское учреждение в Лондоне, где ошибочно предположили, что он был первооткрывателем, и это убеждение сохранялось более 50 лет.
Основная информация
Йод является важным элементом, необходимым для жизни. Он наиболее известен своей ролью в выработке гормонов щитовидной железы у людей, а также у всех позвоночных. Дефицит йода может привести к серьёзным проблемам со здоровьем, включая зоб (увеличение щитовидной железы), умственную отсталость и кретинизм.
В качестве чистого элемента он представляет собой блестящий пурпурно-чёрный неметалл, твёрдый при стандартных условиях. Он легко переходит из твёрдого в газообразное состояние, минуя жидкую форму, и выделяет пурпурный пар. Хотя это технически неметалл, он обладает некоторыми металлическими качествами. Основными характеристиками элемента являются:

- Название: Йод.
- Символ: I.
- Атомный номер: 53.
- Атомная масса: 126,90447 а. е. м.
- Температура плавления: 113,5 °C.
- Температура кипения: 184,0 °C.
- Электронная формула йода (Электронная конфигурация): 1s22s22p63s23p63d104s24p64d105s25p5.
- Строение атома: количество протонов — 53, электронов — 53, нейтронов — 74.
- Валентность переменная: -1, +1, (+3), (+4), +5, +7.
- Классификация: галоген.
- Кристаллическая структура: ромбическая.
- Плотность при 20°C: 4,93 г / см3.
- Цвет: чёрно-серый.
Физические свойства
Йод является одним из самых ярких и красивых элементов. Как твёрдое вещество, это тяжёлый, серовато-черный, металлический материал. Среди его основных физических свойств можно выделить:

- При нагревании не плавится. Вместо этого он испаряется. Сублимация — это процесс, при котором твёрдое вещество превращается непосредственно в газ без предварительного плавления. Образующийся пар йода имеет фиолетовый цвет и резкий запах. Если в эти пары помещается холодный объект, йод снова превращается в твёрдое вещество. Образует привлекательные, нежные металлические кристаллы.
- Растворяется в воде лишь незначительно. Но он растворяется во многих других жидкостях, образуя характерные пурпурные растворы.
- При нагревании в надлежащих условиях его можно заставить испаряться при 113,5°C и закипеть при 184 °C. Плотность элемента составляет 4,93 грамма на кубический сантиметр.
- Имеет умеренное давление паров при комнатной температуре, и в открытом сосуде медленно сгущается до глубоких фиолетовых паров, которые раздражают глаза, нос и горло (высококонцентрированный йод является ядовитым и может нанести серьёзный ущерб коже и тканям.) По этой причине йод лучше всего взвешивать в закупоренной бутылке. Для приготовления водного раствора флакон может содержать раствор йодида калия, что значительно снижает давление паров йода.
Химические свойства
Как и другие галогены, йод является активным элементом. Однако он менее активен, чем три галогена, стоящие над ним в периодической таблице. Основные химические свойства йода:


- Его наиболее распространёнными соединениями являются щелочные металлы, натрий и калий. Но он также образует соединения с другими элементами, в том числе с галогенами. Некоторыми примерами являются монобромид йода (IBr), монохлорид йода (ICl) и пентафторид йода (IF 5).
- Молекулярная решётка йода содержит дискретные двухатомные молекулы, которые также присутствуют в расплавленном и газообразном состояниях. Выше 700 °C диссоциация на атомы йода становится заметной.
- Молекула элемента может действовать, как кислота Льюиса в том смысле, что она сочетается с различными основаниями Льюиса. Взаимодействие, однако, слабое, и лишь немногие твёрдые комплексные соединения были выделены. Они легко обнаруживаются в растворе и называются комплексами с переносом заряда. Например, йод слабо растворяется в воде и даёт желтовато-коричневый раствор. Коричневые растворы также образуются со спиртом, эфиром, кетонами и другими соединениями, действующими, как основания Льюиса через атом кислорода.
- Даёт красный раствор в бензоле, который рассматривается, как результат другого типа комплекса с переносом заряда. В инертных растворителях, таких как четырёххлористый углерод или сероуглерод, получаются растворы фиолетового цвета, которые содержат несогласованные молекулы йода.
- Реагирует также с йодид-ионами, поскольку последние могут действовать, как основания Льюиса, и по этой причине растворимость элемента в воде значительно повышается в присутствии йодида. При добавлении йодида цезия кристаллический трийодид цезия может быть выделен из красновато-коричневого водного раствора.
- Образует синий комплекс с крахмалом, и этот цветовой тест используется для обнаружения небольших количеств йода.
- Это более слабый окислитель, чем бром, хлор или фтор.
- Легко соединяется с большинством металлов и некоторыми неметаллами с образованием йодидов. Например, серебро и алюминий легко превращаются в их соответствующие йодиды, а белый фосфор легко объединяется с йодом.
- Водный раствор йодистого водорода (HI), известный как йодистоводородная кислота, является сильной кислотой, которая используется для приготовления йодидов путём реакции с металлами или их оксидами, гидроксидами и карбонатами.
- Проявляет степень окисления +5 в умеренно сильной йодной кислоте (HIO 3), которая может быть легко обезвожена с образованием белого твёрдого пентоксида йода (I 2 O 5).
Наличие в природе
Йода не очень много в земной коре. По оценкам, его количество составляет от 0,3 до 0,5 частей на миллион. Он находится в нижней трети элементов, с точки зрения изобилия. Но, тем не менее, он более распространён, чем кадмий, серебро, ртуть и золото. Его содержание в морской воде ещё меньше — около 0,0003 частей на миллион.
Этот элемент, как правило, концентрируется в земной коре лишь в нескольких местах, когда-то покрытых океанами. За миллионы лет океаны испарились и оставили химические соединения, которые были растворены в них и сегодня существуют под землёй, как соляные копи.

Существует возможность собирать этот элемент из морской воды, солоноватой воды, рассола или морских водорослей. Морская вода имеет разные названия, в зависимости от количества растворенных в ней твёрдых веществ. Водоросли являются популярным источником йода, так как поглощают элементы из морской воды. Со временем они начинают иметь гораздо более высокую концентрацию йода, чем морская вода. Морскую водоросль собирают, сушат и сжигают для сбора вещества. Процесс мало чем отличается от того, который использовал Куртуа в 1811 году.
Изотопы элемента

Известен только один природный изотоп элемента — йод-127. Изотопы — это две или более формы элемента. Они отличаются друг от друга по их массовому числу. Число, написанное справа от названия элемента, является массовым числом. Оно представляет количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого одного элемента может варьироваться. Каждая вариация является изотопом.
Примерно 30 радиоактивных изотопов йода были изготовлены искусственно. Это такие изотопы, которые распадаются на части и выделяют некоторую форму радиации. Они образуются, когда очень маленькие частицы обжигают атомы. Эти частицы прилипают к атомам и делают их радиоактивными.
Применение изотопов
Ряд изотопов йода имеет коммерческое использование. В медицинских целях они вводятся в организм пациента через рот, а затем проходят через тело в кровотоке. Когда они путешествуют, то излучают радиацию. Это излучение обнаруживается с помощью рентгеновской плёнки. Медицинский специалист может сказать, насколько хорошо организм функционирует, наблюдая диаграмму направленности. Изотопы йода используются и в следующих целях:

- Йод-123 — в исследованиях мозга, почек и щитовидной железы.
- Йод-125 — для исследования поджелудочной железы, кровотока, печени, поглощения минеральных веществ в костях и потери белков в организме.
- А йод-131 — при исследованиях печени, почек, кровотока, лёгких, мозга, поджелудочной железы.
Наиболее распространённым изотопом является йод-131. При попадании в организм он имеет тенденцию поступать непосредственно в щитовидную железу, а затем используется для выработки гормонов щитовидной железы.
Получение и нахождение

Этот элемент коммерчески производится из йодсодержащих рассолов. Природные рассолы или рассолы, извлечённые из нефтяных скважин, содержащие до 150 мг на литр (0,02 унции на галлон), обнаружены в Яве, Калифорнии и северной Италии. В число ведущих мировых производителей входят Чили, Япония, Китай, Россия и Азербайджан.
Примеси, такие как глина, песок и масло, удаляются фильтрацией, а раствор пропускается через поток диоксида серы, а затем через несколько контейнеров, в которых содержатся пучки медной проволоки. Образующийся йодид меди удаляют фильтрацией, промывают водой, сушат и тонко измельчают. Продукт нагревают с карбонатом калия, получая йодид калия, который затем окисляют до свободного элемента дихроматом и серной кислотой.
Использование и применение

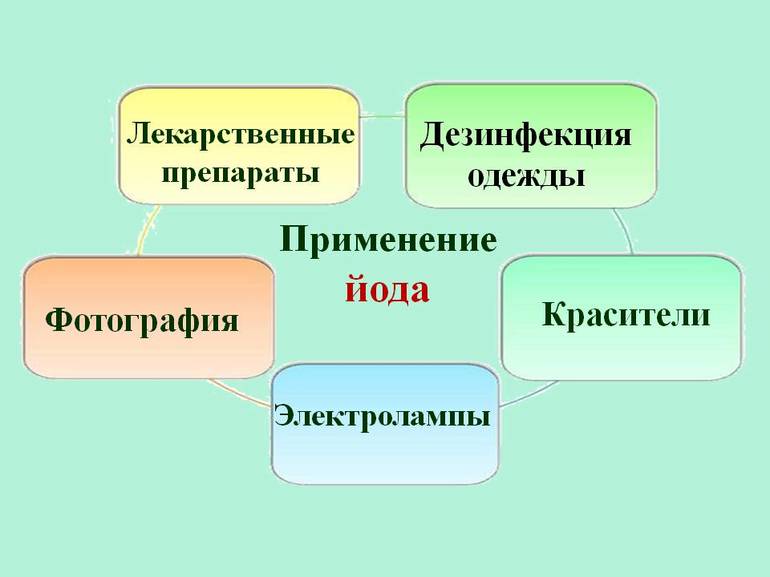
Около 2/3 всего йода и его соединений используется в системах санитарии или в производстве различных антисептиков и лекарств. Вещество также используется для изготовления красителей, фотоплёнки и специального мыла. Он применяется в некоторых отраслях промышленности в качестве катализатора — вещества, используемого для ускорения или замедления химической реакции. Он не претерпевает никаких изменений во время реакции.
Элемент может оказывать как благоприятное, так и неблагоприятное воздействие на живые организмы. Он имеет тенденцию убивать бактерии и другие болезнетворные организмы. Это свойство вещества вызывает его использование в системах санитарии и в качестве антисептика — химического вещества, останавливающего рост микробов.
Настойка йода всегда была одним из самых популярных антисептических препаратов Её наносили на порезы и раны, чтобы предотвратить заражение. Сегодня она часто заменяется другими антисептиками.
Одной из причин того, что сегодня настойка используется реже, является то, что она также может вызвать проблемы. В более высоких дозах йод может раздражать или сжигать кожу. Он также может быть довольно ядовитым, если принимать его внутрь, поэтому важно использовать его согласно инструкции.
Другими важными областями применения йода являются:
- Поскольку он преобразуется в тироксин в щитовидной железе, небольшое его количество имеет важное значение для организма, который содержит в среднем 14 мг (0,00049 унции) элемента. Тироксин — это гормон, необходимый для поддержания нормального обмена веществ во всех клетках организма. Он способен возбудить нервную систему, в особенности кору головного мозга и промежуточный мозг. Во многих местах питьевая вода содержит достаточно йода для этой цели.
- Элемент и его соединения широко используются в аналитической химии. Многие процедуры основаны на выделении или поглощении йода и его последующем титровании с тиосульфатом натрия (йодометрия). Ненасыщенность жиров (то есть количество двойных или тройных связей между атомами углерода) определяется добавлением свободного йода (йодного числа).
- Используется в фотографии, как йодид серебра и йодид калия.
- Йодид серебра также применяется для посадки облаков, чтобы вызвать дождь.
- Используется в производстве красителей.
Биологическая роль
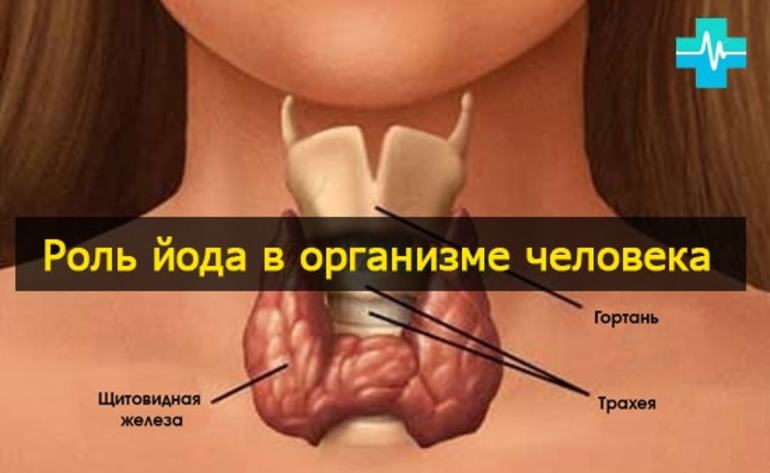
Йод является важным элементом для людей, которым требуется суточное его потребление в количестве около 0,1 мг. Максимальная безопасная для здоровья доза единовременного потребления — 0.5 г (500 мкг). Тело человека содержит до 20 миллиграмм этого элемента, главным образом в щитовидной железе, которая помогает регулировать рост и температуру тела.
Обычно люди получают достаточно йода из пищи, которую они едят. Дефицит же этого микроэлемента может вызвать опухоль щитовидной железы (известный, как зоб). Зоб вызывает большой комок в шее, поскольку щитовидная железа выходит из-под контроля. (Он может вырасти до размера виноградного плода.) Зоб пытается производить гормоны щитовидной железы, но он не получает достаточного количества йода из рациона человека, поэтому продолжает расширяться, пытаясь сделать свою работу.
Недостаток йода может вызвать и другие проблемы. Например, гормоны щитовидной железы необходимы для нормального развития мозга у нерожденного ребёнка и продолжения этого развития после рождения. Люди, которые не включают в свой рацион достаточного количества микроэлемента, не развиваются нормально.
Сегодня эксперты говорят, что низкий уровень йода является основной причиной умственной отсталости, глухоты, мутизма (неспособности говорить) и паралича. К менее серьёзным проблемам относятся сонливость, неуклюжесть и неспособность к обучению.

Количество йода в организме человека очень мало. Для определения его количества вес человека делится на 2 500 000. Полученное число и есть вес элемента в организме. Для нормальных людей эта сумма примерно равна размеру головки булавки, но эта крошечная точка может иметь большое значение для здоровья.

Низкий уровень микроэлемента может быть легко исправлен. Сегодня в большинстве развитых стран компании, производящие поваренную соль, добавляют небольшое количество йодида калия (KI) в соль, которая обозначается «йодированная соль». Люди, которые её используют, получают необходимое количество для нормальной работы щитовидной железы.
Но те, кто живет в развивающихся странах, могут не получать йодированной соли. Всемирная организация здравоохранения (ВОЗ) пытается найти способы обеспечения микроэлементом этих людей. По оценкам ВОЗ, 1,5 млрд человек живут в районах с низким уровнем йода. До 20 млн из этих людей могут иметь психические расстройства из-за его недостатка. ВОЗ начала программу по обеспечению будущего поколения в таких регионах этим микроэлементом, необходимым для нормального развития и функционирования.
Жизнь замечательных идей
Пятьдесят третий элемент периодической таблицы – йод – был открыт ровно двести лет назад. Одни считают, что пальма первенства в его открытии принадлежит французу Бернару Куртуа. Другие говорят: нет, Куртуа всего лишь случайно обнаружил новый элемент, а вот исследовал йод другой французский ученый – Жозеф-Луи Гей-Люссак. Да что вы, возмущаются третьи, исследованием йода занимался не француз, а англичанин, Хэмфри Дэви…
Настоящий же первооткрыватель пятьдесят третьего элемента никогда не вступал ни в какие споры за приоритет. Йод ему был, что называется, до лампочки. Его интересовали… только мыши!
ФИАЛКОПОДОБНЫЙ
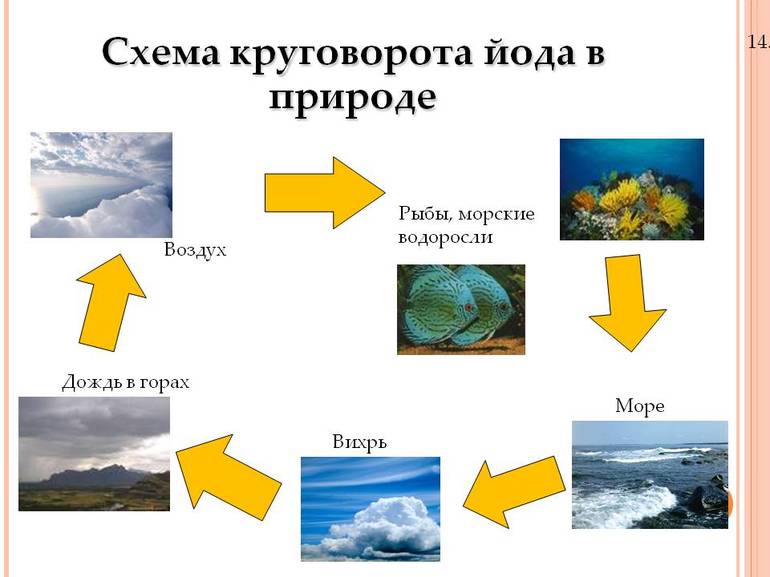
На нашей планете основным источником и «поставщиком» йода является Мировой океан. В одном литре морской воды содержится примерно пятьдесят микрограммов этого вещества. В почву, а значит и в растения, йод попадает благодаря круговороту воды в природе. Днём под лучами солнца морская вода испаряется, попадает в атмосферу и выпадает потом вместе с осадками. Чем ближе к океану, тем больше йода в почве.
Много йода также в йодобромных водах, сопутствующих нефтяным месторождениям. Один литр такой буровой воды может содержать до ста миллиграммов йода.
Кстати, йод как раз из буровых вод и добывают. А ещё – из морских водорослей и селитры. Водоросли накапливают йод из морской воды. А в селитру он попадает, благодаря очень сложной пищевой цепочке. Ведь селитра – это многовековые залежи помёта морских птиц, которые питались морской рыбой, которая в свою очередь ела морские водоросли, богатые йодом.
Первый в России йодный завод был построен в Екатеринославе – нынешнем Днепропетровске – в 1915 году. Йод получали из золы черноморской водоросли филлофлоры. Не тоннами, конечно. Всего лишь по пятьдесят-шестьдесят килограммов в год.
Истории про йод
В организме человека содержится примерно 25 мг йода. Большая часть его находится в щитовидной железе. Деятельность щитовидной железы долгое время была непознанной, ей отводилась роль почти мистическая. В древности щитовидную железу считали местом, куда поселяется душа. Быть может, поэтому признаком женской привлекательности считалась округлость, некая припухлость шеи там, где находится щитовидка. Греческие скульпторы, например, изображали богиню плодородия Геру с плавным изгибом шеи. Сегодня же медики ставят ей диагноз – начальная стадия зоба. Такой же изображена и Мария Медичи на полотнах Рубенса.
СИНХРОН:
Йод – жизненно-важный для человека элемент. Он является строительным материалом для гормонов щитовидной железы, которые управляют расходом белков, жиров и углеводов, то есть, обменом веществ в организме. А также регулируют деятельность мозга. Нехватка йода сказывается на росте и развитии организма. Но, прежде всего, влияет на коэффициент интеллекта…
Франция, 1812 год
Девятнадцатый век во Франции начался приходом к власти Наполеона первого. Наполеоновские войны требовали огромного количества селитры для производства пороха. Индийской селитры, которую традиционно ввозили во Францию, не хватало. Тогда правительство стало закупать селитру в Южной Америке. Но чилийская селитра, в отличие от индийской, была не калиевой, а натриевой. Она слишком быстро отсыревала и становилась непригодной для производства пороха.
Способ превращения натриевой селитры в калиевую был найден в Испании в 1908 году. Для этого химического процесса использовалась зола, получаемая при сжигании морских водорослей. Франция немедленно взяла этот способ на вооружение. И по всей стране стали возникать предприятия по производству калиевой селитры.
Один из таких небольших заводов находился в городе Дижоне – бывшей столице герцогства Бургундского. Владельца завода звали Бернар Куртуа.
Куртуа родился в 1777 году в семье владельца химической фабрики. Он закончил Политехническую школу в Париже. Работал фармацевтом в военных госпиталях. После смерти отца Куртуа унаследовал завод по переработке селитры.
Бернар был не просто заводчиком, но еще и исследователем. В своей заводской лаборатории он ставил химические опыты. Наблюдал, как селитра взаимодействует с разными веществами. Помимо всего прочего Куртуа пытался решить одну техническую проблему, которая очень осложняла жизнь его предприятию.
Дело было в том, что при сжигании морских водорослей выделялось какое-то вещество, которое разъедало железные и медные сосуды. Куртуа никак не мог определить, что это за вещество.
Истории про йод
О целебных свойствах веществ, содержащих йод, было известно ещё в глубокой древности. Китайские целители третьего тысячелетия до нашей эры умели выделять йод из морских губок и водорослей и делать настойку для заживления ран.
В современной истории первым врачом, применившим в 1865 году настой йода, был русский хирург Николай Пирогов. Но понадобилось ещё сорок лет, прежде чем растворы йода стали применяться в хирургии, как антисептические жидкости.
Однажды Бернар Куртуа готовил очередной химический опыт. На его лабораторном столе стояли две колбы: в одной находилась серная кислота, в другой – зола морских водорослей в этиловом спирте. А на плечах у химика сидел… кот. Да-да, самый обычный кот. Его любимиц. Кот повсюду следовал за своим хозяином. Ему разрешалось входить даже в святая святых – лабораторию.
В тот самый день кот внимательно наблюдал за действиями хозяина и вдруг прыгнул прямо на стол, столкнув колбы на пол. Возможно, ему померещилась мышь…
Колбы упали, разбились, их содержимое перемешалось, и в воздух поднялись клубы фиолетового дыма. А потом дым осел на окружающие предметы в виде черных кристалликов с металлическим блеском.
Справка: С точки зрения современной химии этот инцидент можно было бы записать как простую реакцию соединения серной кислоты и йодистой соли щелочного металла, в результате которой происходит выделение свободного иода. Н2SО4 + 2НI = 2Н2О + SО2 + I2
Куртуа предположил, что это неизвестное вещество и есть тот самый искомый вредитель металлических сосудов. Он назвал его «йодэс», что в переводе с греческого означало «фиолетовый» – дословно «фиалкоподобный». Дальше Куртуа занялся исследованием этого вещества и выяснил, что оно вступает в реакции с водородом, фосфором и металлами. А с аммиаком образует опасное соединение – йодистый азот – легко взрывающееся при легком встряхивании и даже просто прикосновении.
О своих наблюдениях и выводах Бернар Куртуа сообщил двум своим дижонским друзьям – химикам Николя Клеману и Шарлю Дезорму. Он попросил их перепроверить его собственные опыты, а также продолжить исследования. И, если речь идет о научном открытии, опубликовать сообщение в каком-нибудь научном журнале.
Куртуа не претендовал на приоритет. Он не считал себя серьезным учёным. Но ему казалось важным сообщить о новом веществе миру.
Истории про йод
Выдающийся богослов, философ и ученый, священник Павел Флоренский начал заниматься исследованием йода в 1934 году в лагере на Соловецких островах. Он добывал йод из морских водорослей с помощью изобретенных им самим аппаратов. Флоренский считал йод очень действенным лекарством, способным излечить многие болезни. Он же первым разработал органическое соединение йода и молочного белка. Проще говоря, добавлял три-четыре капли спиртового раствора йода в молоко. Много позже учёные обнаружили, что подобное сочетание позволяет восполнить дефицит йода в организме, но при этом не приводит к его переизбытку.
СИНХРОН
Содержание йода в крови человека зависит от времени года: с сентября по январь концентрация йода в крови снижается, с февраля начинается новый подъем, а в мае – июне йодное зеркало достигает наивысшего уровня. Эти колебания имеют сравнительно небольшую амплитуду, и их причины до сих пор остаются загадкой.
Франция, 1813 год
Клеман и Дезорм проводили контрольные эксперименты и занимались исследованием нового вещества больше года. Они полностью подтвердили выводы Куртуа.
Первое сообщение о новом загадочном веществе «йодесе» Николя Клеман сделал в Париже в январе 1813 года. В ноябре того же года он вторично выступил перед учёными Парижа. Однако ни одно из его сообщений опубликовано не было.
Тем не менее, в журнале «Анналы химии» за 1813 год сохранилось краткое описание опытов Куртуа. И были приведены совместные выводы Клемана-Дезорма:
Цитата:
«Новое вещество по внешнему виду металл. Его удельный вес около четырех. Металл очень летуч; запах его паров аналогичен запаху хлора. Он сообщает краснобурую окраску бумаге и рукам. Это вещество – не кислота, не щелочь. При нагревании его в закрытой реторте, оно спокойно испаряется, при температуре около 75 градусов по Цельсию кипит под водой, образуя великолепные фиолетовые пары…»
Осенью 1813 года в Париж приехал всемирно известный учёный, знаменитый химик Хэмфри Дэви. Англичанин. То есть, представитель страны, с которой Франция в тот момент находилась в состоянии войны.
С точки зрения современной истории такое даже представить себе невозможно.
Хэмфри Дэви родился в 1778 году в небольшом городке на юго-западе Англии. Его отец был резчиком по дереву. Когда Хэмфри исполнилось шестнадцать лет, он пошёл в ученики к аптекарю. И здесь увлёкся химией.
Профессором химии Лондонского Королевского института Дэви стал в двадцать четыре года. А спустя десять лет был удостоен титула лорда за свои научные работы.
В том же 1812 году сэр Хэмфри Дэви женился на дальней родственнице Вальтера Скотта – Джейн Эйприс, богатой вдове-аристократке.
Путешествие в Европу задумывалось, как свадебное, но из-за войны отложилось почти на год.
В 1813 году сам Наполеон дал особое разрешение на въезд во Францию сэру Хэмфри Дэви и его жене леди Джейн. В поездке Дэви сопровождал его ассистент и личный секретарь Майкл Фарадей.
Фарадей был моложе своего профессора на тринадцать лет. В науку он пришёл очень трудным путем. Сыну лондонского кузнеца «не светили» ни хорошая школа, ни университет. Но и продолжить дело отца он тоже не мог по причине слабого здоровья. Однако Майклу повезло, в тринадцать лет он устроился работать учеником переплётчика. Его хозяин и наставник – французский эмигрант Жорж Рибо – позволял ученику после работы читать переплетённые книги. Поначалу Фарадей читал все подряд, буквально глотал словари и энциклопедии, поэзию и прозу. А потом пристрастился к физике и химии.
Однажды один из клиентов мсье Рибо – член Королевского института в Лондоне мистер Дэне с удивлением обнаружил, что переплётчик с увлечением читает серьезный научный журнал «Химическое обозрение». Мистер Дэне посоветовал юноше послушать несколько публичных лекций знаменитого тогда уже профессора химии Хэмфри Дэви.
Четыре лекции Дэви совершенно перевернули жизнь молодого Фарадея.
Цитата: «Я желаю совершенно оставить ремесло и поступить на службу науке, которая делает своих поборников настолько же добрыми, насколько ремесло – злыми и себялюбивыми».
Из письма Фарадея профессору Дэви.
В своём письме Фарадей попросил также дать ему какую-нибудь, хоть самую ничтожную работу в институте.
Дэви рассказал о просьбе юноши одному своему приятелю. Тот посоветовал: «Вели ему полоскать бутылки. Если он согласится, то из него что-нибудь выйдет, если нет – он ничего не стоит».
Научная карьера бывшего переплётчика и будущего великого английского ученого Майкла Фарадея в самом деле началась с мытья лабораторной посуды. Дэви взял его на работу сначала служителем в лабораторию, потом ассистентом. Но вскоре Фарадей стал личным секретарем профессора Дэви, а в поездке в Европу исполнял ещё и обязанности помощника леди Джейн, жены Дэви.
Дэви планировал пожить в Париже пару месяцев, затем отправиться дальше – в Италию, посетить Сицилию и через Германию вернуться на родину.
Цитата: «Мы сейчас отправляемся на континент в путешествие с научной целью; оно, я надеюсь, будет приятным для нас и полезным для мира».
Из письма Хэмфри Дэви матери
У Дэви и Фарадея была с собой передвижная химическая лаборатория: портативные аппараты, реактивы, лабораторная посуда, образцы некоторых химических веществ, минеральные пробы.
В Париже Дэви и Фарадей встречались с видными французскими учёными: Жоржем Кювье, Александром фон Гумбольдтом, Андре Ампером, Пьером-Симоном Лапласом, Жозефом-Луи Гей-Люссаком. О каждом из них Дэви потом написал в своем дневнике. Это были очень ёмкие и точные характеристики. Про Гей-Люссака он, например, сказал:
Цитата: «Гей-Люссак – подвижный, быстрый, изобретательный человек с очень активным умом. Я бы поставил его во главе ныне живущих французских химиков».
Николя Клеман, узнав о приезде великого английского химика, попросил своего знакомого Андре Ампера передать Дэви для анализа в его передвижной лаборатории небольшое количество загадочного вещества, выделенного Бернаром Куртуа.
По одной из версий эта передача была тайной, потому что открытие держалось в секрете.
По другой версии, академик Ампер во время застолья на дружеской профессорской вечеринке рассказал всем присутствующим о новом веществе, разъедающем металлическую посуду, как о курьёзе. Пробирку с этим едким фиолетовым порошком он подарил Дэви в качестве сувенира.
Как только за гостями закрылась дверь, Дэви в нетерпении крикнул: «Фарадей, немедленно готовьте нашу походную лабораторию, я чувствую: нас ждут великие дела!»
Таинственное вещество английские ученые исследовали несколько дней. Одним из самых удивительных свойств кристаллического порошка было то, что при нагревании он превращался в газ без перехода в жидкое состояние. И взаимодействуя с водородом и кислородом, образовывал кислоту, по свойствам схожую с соляной.
Дэви сразу понял, что они имеют дело с новым химическим элементом. Простым веществом, аналогичным хлору.
О своих выводах Дэви сообщил французским коллегам, назвав новое вещество «йодином», по аналогии с «хлорином».
В январе нового 1814 года Париж, наконец, заговорил о загадочном фиолетовом порошке и об открытии в химии. Вот тут-то и начался скандал.
На Андре Ампера обиделся известный французский химик и физик Гей-Люссак. При этом профессора волновала не столько накипь с котлов завода Куртуа, сколько непатриотичный поступок академика Ампера: отдать французское открытие в руки учёного из враждующей страны!
Гей-Люссак потребовал выделить ему образец порошка для исследований и для опровержения выводов англичанина.
Дэви об этом скандале не знал. Еще двадцать третьего декабря он вместе с женой и своим ассистентом Фарадеем покинул Париж и направился в Италию.
Истории про йод
В 1940 году в одном из Магаданских лагерей заключённый Владимир Мохнач – бывший директор Дальневосточного филиала Института химии Академии Наук СССР – создал из подручных средств уникальное лекарство, которое спасло жизнь десяткам тысяч узников ГУЛАГа во время эпидемии дизентерии. Смесь из картофельных очистков и спиртового раствора йода он назвал «йодно-крахмальным комплексом», а заключённые – «чёрной кашей». Йод здесь выступал как сильное антибактериальное средство, а крахмал снижал его агрессивное и токсичное действие. Смесь крахмала и йода – «синий йод» – широко применяли в медицинской практике во время Великой Отечественной войны как антибактериальное и противовирусное средство.
Париж, 1814 год
Жозеф-Луи Гей-Люссак был ровесником Хэмфри Дэви, он тоже родился в 1778 году, но принадлежал к другому социальному слою. Его отец был медиком, дед – королевским прокурором. Во время великой французской революции его отец был заключен в тюрьму, мать и дед умерли. Жозеф-Луи очутился в пансионе, где рос в условиях крайней нищеты. Тем не менее, он смог, благодаря выдающимся способностям и необыкновенной усидчивости, самостоятельно подготовиться к вступительным экзаменам в Политехническую школу Парижа и блестяще их сдать.
Возможно, он учился в Политехнической школе в одно время с Бернаром Куртуа.
На одаренного студента очень скоро обратил внимание великий французский химик Клод-Луи Бертолле. Он стал наставником Гей-Люссака, его научным руководителем. А в конце жизни завещал своему любимому ученику шпагу пэра Франции. Бертолле не сомневался, что рано или поздно Гей-Люссак войдет в палату пэров.
Своё самое значительное открытие Гей-Люссак сделал в 1808 году, он получил калий и натрий химическим путем. Это открытие стоило ему зрения. Во время одного из опытов с калием произошел взрыв, и учёный получил ожоги обоих глаз. Последствия этой травмы Гей-Люссак продолжал ощущать спустя годы.
В январе 1814-го учёный, наконец, получил образец нового вещества и сразу же приступил к его исследованию. В работе ему помогала его жена Жозефина. Гей-Люссак посвятил изучению нового элемента почти два года. Ему, конечно же, очень хотелось доказать, что Хэмфри Дэви был не прав по всем пунктам. Но каждый новый опыт подтверждал выводы англичанина. Йод и в самом деле оказался простым веществом, аналогичным хлору. А кислота, которая образовывалась при соединении йода с кислородом и водородом, в самом деле, не была соляной.
В итоге профессор Гей-Люссак публично признал свои ошибки. Кстати, по воспоминанию большинства современников, Гей-Люссак всегда считал своей обязанностью публиковать признания в собственные заблуждениях. Он был чрезвычайно принципиальным человеком и честным учёным.
В 1815 году в журнале «Annales de chimie et de physique» была опубликована обширная работа Гей-Люссака о йоде, в которой, в частности, была обоснована теория водородных кислот.
Гей-Люссак также описал важнейшие соединения йода и установил, что он слабее хлора, хотя они и относятся к одной группе активных металлоидов.
Справка: К группе активных металлоидов или галогенов относятся фтор, хлор, бром, йод и астат. Все они ядовиты и реагируют почти со всеми простыми веществами. Галогены – активные окислители, в природе встречаются только в виде соединений.
Название нового элемента «йод» впервые появилось именно в этой статье Гея-Люссака. И прижилось повсеместно, кроме Англии и США. Там его называют «йодин», отдавая таким образом приоритет открытия своему соотечественнику Хэмфри Дэви.
Синхрон: Применение йода. Периодаты -составная часть протонных проводников в водородной энергетике. Иодид серебра – яркий пример не только фоточувствительного материала для черно-белой фотографии, но и суперионный проводник. Кристаллики солей йода используют при изготовлении специального поляроидного стекла или пластмассы. Они играют роль своеобразного фильтра, не пропускающего световые лучи. Поляроидные стекла, которые отводят встречный слепящий поток света, используют в автомобилях. А комбинацию нескольких поляроидных пластин, наложенных друг на друга, используют в фото и кинотехнике. Такие фильтры позволяют добиваться исключительно красочных визуальных эффектов.
В обиходе мы называем это вещество Йодом. Этот старый вариант названия как самого вещества, так и его водных или спиртовых растворов, до сих пор используют в медицине и в биологии. В химической номенклатуре с 1950 года используется наименование Иод. Символ этого элемента в периодической системе был также изменён с J на I.
Сегодня в большинстве стран название йод считается общеупотребительным, иод – терминологически корректным.
Но если по поводу названия этого фиалкоподобного вещества учёным, в конце концов, удалось договориться, то в вопросе о приоритете открытия до сих пор никакой ясности.
Итак, Бернар Куртуа только выделил новое вещество. Хэмфри Дэви первым исследовал, а Гей-Люссак, повторивший эксперименты Дэви, первым опубликовал результаты этих исследований. Так кого же считать первооткрывателем? Не кота же, в самом деле…




