Глубокая древность[править | править код]
- Медь
- Серебро
- Золото
- Свинец
- Олово
- Железо
- Углерод
До нашей эры[править | править код]
- Сурьма — ранее 3000 до н. э.
- Ртуть — ранее 1500 до н. э.
- Цинк — 1300—1000 до н. э.
- Сера — примерно VI век до н. э.
Средние века/Начало Нового времени[править | править код]
| Элемент | Год | Кто открыл | Страна |
| Мышьяк | ~1250 год | Альберт Великий | Германия |
| Висмут | не позже 1546 года | Георгий Агрикола | |
| Фосфор | 1669 | Хенниг Бранд |
XVIII век[править | править код]
| Элемент | Год | Кто открыл | Страна |
| Кобальт | 1735 | Г. Брандт | Швеция |
| Платина | А. де Ульоа | Испания | |
| Никель | 1751 | А. Кронштедт | Швеция |
| Водород | 1766 | Г. Кавендиш | Великобритания |
| Азот | 1772 | Д. Резерфорд | |
| Кислород | 1774 | Дж. Пристли | |
| Марганец | К. Шееле, Ю. Ган | Швеция | |
| Хлор | К. Шееле | ||
| Барий | К. Шееле, Ю. Ган | ||
| Молибден | 1778 | К. Шееле | |
| Вольфрам | 1781 | ||
| Теллур | 1782 | Ф. Мюллер | Габсбургская монархия |
| Уран | 1789 | М. Г. Клапрот | Германия |
| Цирконий | |||
| Стронций | 1790 | А. Кроуфорд, М. Г. Клапрот | Великобритания |
| Иттрий | 1794 | Ю. Гадолин | Финляндия (в составе Шведского королевства) |
| Титан | 1795 | М. Г. Клапрот | Германия |
| Хром | 1797 | Л. Воклен | Франция |
| Бериллий | 1798 |
XIX век[править | править код]
| Элемент | Год | Кто открыл | Страна |
| Ниобий | 1801 | Ч. Хэтчетт | Великобритания |
| Тантал | 1802 | А. Экеберг | Швеция |
| Палладий | 1803 | У. Волластон | Великобритания |
| Церий | Й. Берцелиус, В. Хизингер и М. Г. Клапрот | Швеция и Германия | |
| Иридий | 1804 | C. Теннант | Великобритания |
| Осмий | |||
| Родий | У. Волластон | ||
| Натрий | 1807 | Г. Дэви | |
| Калий | |||
| Бор | 1808 | Ж. Гей-Люссак, Л. Тенар | Франция |
| Кальций | Г. Дэви | Великобритания | |
| Магний | |||
| Иод | 1811 | Б. Куртуа | Франция |
| Кадмий | 1817 | Ф. Штромейер | Германия |
| Селен | Й. Берцелиус | Швеция | |
| Литий | И. Арфведсон | ||
| Кремний | 1823 | Й. Берцелиус | |
| Алюминий | 1825 | X. Эрстед | Дания |
| Бром | 1826 | А. Балар | Франция |
| Торий | 1828 | Й. Берцелиус | Швеция |
| Ванадий | 1830 | Н. Сефстрём | |
| Лантан | 1839 | К. Мосандер | |
| Эрбий | 1843 | ||
| Тербий | |||
| Рутений | 1844 | К. К. Клаус | Россия (Казань) |
| Рубидий | 1861 | Р. Бунзен, Г. Кирхгоф | Германия |
| Цезий | |||
| Таллий | У. Крукс | Великобритания | |
| Индий | 1863 | Ф. Райх, Т. Рихтер | Германия |
| Галлий | 1875 | П. Лекок де Буабодран | Франция |
| Иттербий | 1878 | Ж. Мариньяк | Швейцария |
| Тулий | 1879 | П. Клеве | Швеция |
| Самарий | П. Лекок де Буабодран | Франция | |
| Гольмий | П. Клеве | Швеция | |
| Скандий | Л. Нильсон | ||
| Празеодим | 1885 | К. Ауэр фон Вельсбах | Австро-Венгрия |
| Неодим | К. Ауэр фон Вельсбах | ||
| Фтор | 1886 | А. Муассан | Франция |
| Германий | К. Винклер | Германия | |
| Гадолиний | П. Лекок де Буабодран | Франция | |
| Диспрозий | |||
| Аргон | 1894 | У. Рамзай, Дж. Рэлей | Великобритания |
| Гелий | 1895 | У. Рамзай, У. Крукс | |
| Неон | 1898 | У. Рамзай, М. Траверс | |
| Ксенон | |||
| Криптон | |||
| Полоний | П. Кюри, М. Склодовская-Кюри | Франция | |
| Радий | П. Кюри, М. Склодовская-Кюри, Г. Бемон | ||
| Радон | 1899 | Р. Оуэнс, Э. Резерфорд | Великобритания |
| Актиний | А. Дебьерн | Франция |
XX век[править | править код]
| Элемент | Год | Кто открыл | Страна |
| Европий | 1901 | Э. Демарсе | Франция |
| Лютеций | 1907 | Ж. Урбен | |
| Протактиний | 1918 | О. Ган, Л. Мейтнер; Ф. Содди, Дж. Кранстон | Германия |
| Гафний | 1923 | Д. Костер, Д. Хевеши | Дания |
| Рений | 1927 | И. Ноддак (Такке), В. Ноддак | Германия |
| Технеций | 1937 | К. Перье, Э. Сегре | США и Италия |
| Франций | 1939 | М. Перей | Франция |
| Астат | 1940 | Д. Корсон, К. Р. Маккензи, Э. Сегре | США |
| Нептуний | Э. Макмиллан, Ф. Х. Эйблсон, Калифорнийский университет | ||
| Плутоний | 1941 | Г. Сиборг, А. Валь, Дж. В. Кеннеди[en], Э. Сегре | |
| Америций | 1944 | Г. Сиборг | |
| Кюрий | |||
| Прометий | 1945 | Дж. А. Маринский | |
| Берклий | 1949 | А. Гиорсо, Г. Сиборг, Stanley G. Thompson, Kenneth Street Jr. | |
| Калифорний | 1950 | ||
| Эйнштейний | 1952 | Аргоннская национальная лаборатория, Лос-Аламосская национальная лаборатория и Калифорнийский университет | |
| Фермий | 1953 | ||
| Менделевий | 1955 | А. Гиорсо, Evans G. Valens | |
| Нобелий | 1965 | Объединённый институт ядерных исследований (ОИЯИ) | СССР (Дубна) |
| Лоуренсий | LBNL и ОИЯИ | США и СССР (Дубна) | |
| Резерфордий | 1964 | ||
| Дубний | 1968 | ||
| Сиборгий | 1974 | LBNL, LLNL | США |
| Борий | 1981 | GSI и ОИЯИ | Германия и СССР (Дубна) |
| Мейтнерий | 1982 | П. Амбрустер и Г. Мюнценберг, GSI | Германия |
| Хассий | 1984 | П. Амбрустер и Г. Мюнценберг, GSI | |
| Дармштадтий | 1994 | С. Хофманн, В. Нинов, Ф. П. Хессбергер, П. Армбрустер, Х. Фолгер, Г. Мюнценберг, Х. Шотт | |
| Рентгений | S. Hofmann, V. Ninov и др., GSI | ||
| Коперниций | 1996 | ||
| Флеровий | 1999 | ОИЯИ | Россия (Дубна) |
| Ливерморий | 2000 |
XXI век[править | править код]
| Элемент | Год | Кто открыл | Страна |
| Оганесон | 2002 | ОИЯИ | Россия (Дубна) |
| Нихоний | 2003 | ОИЯИ и RIKEN | Россия (Дубна) и Япония |
| Московий | ОИЯИ | Россия (Дубна) | |
| Теннессин | 2010 |
График[править | править код]
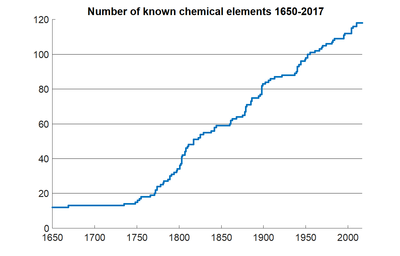
Количество известных человечеству химических элементов в период с 1650 по 2017 год.
Таблица[править | править код]
| Химические элементы по времени открытия | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
|
Значение цветов: |
См. также[править | править код]
- Синтезированные химические элементы
- История химии
- Хронология химии
Литература[править | править код]
- Трифонов Д. Н., Трифонов В. Д. Как были открыты химические элементы: Пособие для учащихся. — М.: Просвещение, 1980. — 224 с.
- Фигуровский Н. А. Открытие элементов и происхождение их названий. — М.: Наука, 1970. — 207 с.
The discovery of the 118 chemical elements known to exist as of 2023 is presented in chronological order. The elements are listed generally in the order in which each was first defined as the pure element, as the exact date of discovery of most elements cannot be accurately determined. There are plans to synthesize more elements, and it is not known how many elements are possible.
Each element’s name, atomic number, year of first report, name of the discoverer, and notes related to the discovery are listed.
For 18th-century discoveries, around the time that Antoine Lavoisier first questioned the phlogiston theory, the recognition of a new “earth” has been regarded as being equivalent to the discovery of a new element (as was the general practice then).[5]
2 from other gases,[52] although Paracelsus around 1500, Robert Boyle,[53][54] and Joseph Priestley had observed its production by reacting strong acids with metals. Lavoisier named it in 1783.[55][56] It was the first elemental gas known.
Химикам известно более ста миллионов веществ, но все они состоят из атомов всего 118 химических элементов. Naked Science объясняет, как из простого и скучного водорода появилась вся таблица Менделеева. Спойлер: дело отнюдь не только в звездах!
Как возникли химические элементы, из которых состоит все вокруг, в том числе и мы сами? «В звездах!» — воскликнет читатель, который что-то об этом слышал. «Что-то еще такое было сразу после Большого взрыва, и еще сверхновые…» — задумается тот, кто слышал чуть больше. Да, да, и еще раз да, но не только. К химическому многообразию Вселенной приложили руку и первые минуты после Большого взрыва, и звезды, и сверхновые, и нейтронные звезды, и даже космические лучи. Не пугайтесь, сейчас все разложим по полочкам.
Космическое лего
Число атомов подавляет воображение: в стакане воды их больше, чем стаканов воды в Мировом океане. Будь все они индивидуальными и неповторимыми, никто не смог бы разобраться в этом хаосе. К счастью, все атомы устроены одинаково: они состоят из ядра и кружащих вокруг него электронов. Ядро же состоит из положительно заряженных протонов и не имеющих заряда нейтронов.
Самое простое ядро у атома водорода: в нем всего один протон. Следующий по простоте элемент — гелий, в его ядре два протона. Число протонов легко узнать: это просто номер элемента в таблице Менделеева.
А что с нейтронами? Более чем 99,9% ядер водорода вообще не имеют нейтронов, они представляют собой просто одиночный протон. Это простейшая разновидность (как говорят ученые, изотоп) водорода — протий. Но бывает еще водород, в ядре которого компанию протону составляет нейтрон (это дейтерий) и даже два нейтрона (это тритий, но он радиоактивен и быстро распадается). Вообще, изотопы одного элемента отличаются друг от друга числом нейтронов. Изотопы есть у всех элементов, но в дальнейшем рассказе нам пригодятся только изотопы водорода и гелия. У гелия два стабильных (не радиоактивных) изотопа: гелий-4 и более редкий гелий-3. Эти цифры означают суммарное число протонов и нейтронов в ядре.
Островок разнообразия
Сегодня в таблице Менделеева 118 элементов, но некоторые из них были получены искусственно (и работы по созданию новых элементов продолжаются). Сколько же из них встречается в природе? Справочники дают различные ответы, от 90 до 98. Тут важно, как считать: некоторые радиоактивные элементы сначала были созданы в лаборатории, а уж потом было обнаружено, что они на короткое время и в ничтожных количествах образуются в горных породах.
Хотя на Земле присутствует не менее 90 элементов, 98% ее массы приходится всего на шесть: кислород, кремний, алюминий, магний, кальций и железо. Это, так сказать, геохимическая шестерка. Есть и другая шестерка — биохимическая. В нее входят элементы, преобладающие в составе живой клетки: водород, углерод, азот, кислород, фосфор и сера. Впрочем, живые организмы нуждаются и во многих других элементах.
Наша планета — кладезь химического разнообразия по сравнению с космосом. Вселенная в целом очень скучна: 91% атомных ядер приходится на простейший химический элемент — водород. Еще почти 9% — на второй по простоте, гелий. И менее 1% — на все остальные элементы. Если считать не по числу ядер, а по массе, картина будет чуть менее унылой, потому что водород и гелий очень легкие. Но именно чуть-чуть.
Если вас удивило и опечалило химическое однообразие Вселенной, подождите: сейчас мы разберемся, как так вышло.
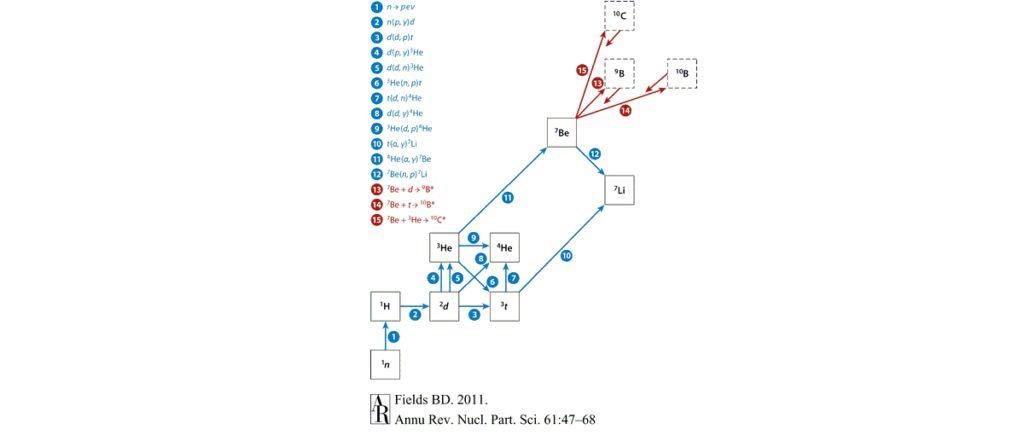
Жар творения
Сразу после Большого взрыва температура была слишком велика для существования протонов и нейтронов. Но Вселенная быстро расширялась, энергия распределялась по все большему пространству, и материя остывала. Еще до конца первой секунды возникли протоны и нейтроны.
Протоны — это, как мы помним, ядра водорода (точнее, его самого распространенного изотопа протия). То есть одна ячейка в таблице Менделеева худо-бедно заполнилась.
Примерно через минуту после Большого взрыва космос остыл до нескольких миллиардов градусов, и нейтроны начали объединяться с протонами в ядра дейтерия. А дальше начались первые во Вселенной термоядерные реакции: ядра сталкивались и сливались друг с другом. Это время называется эпохой первичного нуклеосинтеза. Она продолжалась двадцать минут или около того. После этого Вселенная остыла до миллионов градусов. Это уже слишком прохладно для термоядерного синтеза.
Вот важнейшие из происходивших тогда реакций (все они воспроизведены в лабораториях):
Дейтерий + дейтерий = тритий + протон
Дейтерий + дейтерий = гелий-3 + нейтрон
Дейтерий + тритий = гелий-4 + нейтрон
Дейтерий + гелий-3 = гелий-4 + протон
Так образовался почти весь современный гелий. Даже звезды, неутомимые генераторы гелия, произвели его совсем немного по сравнению с первичным нуклеосинтезом. Дело в том, что около 80% атомных ядер во Вселенной не входит даже в состав галактик, а уж тем более звезд.
На этом процесс создания элементов застопорился. Концентрация гелия была слишком мала, чтобы он стал материалом для создания новых элементов, как это происходит в звездах.
Правда, из гелия все-таки образовались литий, бериллий и бор, но в ничтожных количествах. Увы, эти ядра разрушаются в термоядерных реакциях так же легко, как и создаются. Недаром их во Вселенной и поныне меньше, чем любых других элементов легче железа. Да и наблюдаемое-то содержание членов этой злосчастной троицы не так легко объяснить. Вероятно, они возникали, когда частицы космических лучей врезались в межзвездный водород. А еще к их синтезу могли приложить руку сверхновые, о которых мы еще поговорим.
Мы — звездный пепел
Так бы и быть космосу скучной смесью водорода и гелия, если бы не новые термоядерные реакторы — звезды. Первые из них озарили космос через сотни миллионов лет после Большого взрыва.
Большую часть жизни звезда занимается тем же, чем и Вселенная в эпоху первичного нуклеосинтеза: превращает водород в гелий. Правда, цепочка реакций при этом совсем иная и довольно сложная. Ведь в звезде, в отличие от раннего космоса, нет изобилия свободных нейтронов. Нейтрон вне атомного ядра и живет-то лишь несколько минут.
Что происходит, когда водород исчерпывается? Это зависит от массы светила. Звезды массой менее 0,5 солнечной на этом и заканчивают свою жизнь. Их недра недостаточно горячи и плотны для того, чтобы в термоядерные реакции вступил уже гелий. Солнце, к нашей гордости, пойдет дальше: оно создаст углерод, азот и кислород. А еще более массивные светила синтезируют элементы вплоть до железа, в ядре которого 26 протонов.
Дальше бессильны и термоядерные топки звезд. Столь тяжелые ядра трудно столкнуть друг с другом: мешает электрическое отталкивание многочисленных протонов.
К слову, большая часть звездных термоядерных реакций пока не воспроизведена на Земле. Создать нужные условия слишком сложно. Но они просчитаны теоретически, и результаты расчетов хорошо совпадают с наблюдаемым составом Вселенной.
Хэви-метал для Вселенной
Но первые 26 элементов — это даже не треть от встречающихся в природе 90. Как же образовались остальные?
На этот случай физика припасла трюк. Помните, мы сетовали, что в звездах не так уж много свободных нейтронов? Но все-таки нейтроны там возникают в некоторых ядерных реакциях. А дальше нейтрон врезается в атомное ядро и прилипает к нему. Нейтрону, в отличие от протона, это легко сделать: он ведь не заряжен и не отталкивается от ядра.
И вот, когда частицы ядра уже приняли его в свою тесную компанию, нейтрон выкидывает фокус. Он испускает электрон и превращается в протон! В ядре становится на протон больше, а значит, это уже следующий химический элемент. При обычном небольшом потоке нейтронов такой процесс протекает медленно, поэтому называется s-процессом, от английского slow — «медленный».
S-процесс идет в звездах — красных гигантах и может производить элементы вплоть до висмута (83 протона). Но он действительно нетороплив: требуется тысяча лет, чтобы превратить ядро железа в ядро свинца (82 протона). Вместе с тем элементы под номерами 84—89 (от полония до актиния) радиоактивны. Такое ядро распадается быстрее, чем s-процесс успевает прилепить к нему новый протон!
Как же объяснить существование в природе тория (90 протонов) и урана (92)? На помощь спешит r-процесс, от английского rapid — «быстрый». Он включается при взрывах сверхновых и столкновениях нейтронных звезд. Эти космические катаклизмы создают кратковременные, но мощные потоки нейтронов. Благодаря им могут образовываться даже самые тяжелые ядра.
Сверхновые, кстати, бывают двух типов. Тип Ia связан с термоядерным взрывом белого карлика, а все остальные — с коллапсом массивных звезд (если вам нужны подробности, у Naked Science они есть). Как те, так и другие катастрофы запускают r-процесс.
Это не просто теория. Астрономы знают предостаточно остатков сверхновых и давно изучают их состав. А три года назад тяжелые элементы были обнаружены и на месте столкновения нейтронных звезд.
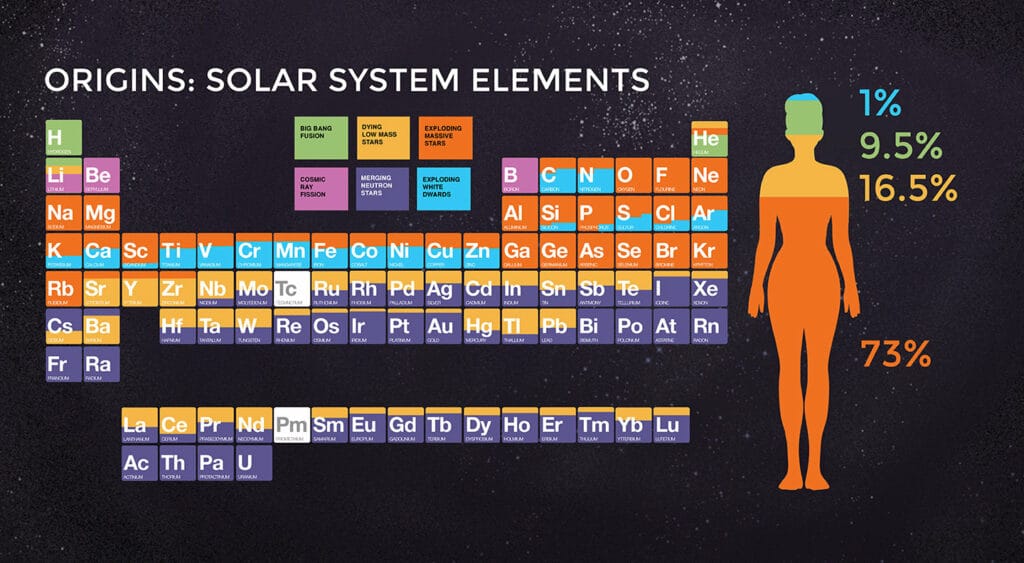
Доставка готовых смесей
У вещества отгоревшего светила есть два пути. Часть его рассеется по межзвездному пространству и может стать материалом для будущих звезд и планет. Остальное будет навеки законсервировано в остатке звезды (белом карлике, нейтронной звезде или черной дыре). Правда, белые карлики иногда взрываются как сверхновые Ia, превращаясь в межзвездную пыль. Да и нейтронные звезды изредка сталкиваются и сливаются в одну, теряя при этом небольшую часть вещества на «разлет осколков». Но такие катастрофы — исключение, а не правило. Чаще же всего что в звездный остаток попало, то для остальной Вселенной пропало.
Чем массивнее звезда, тем большую долю своего вещества она возвращает в оборот. Почти вся масса Солнца будет, увы, без толку законсервирована в белом карлике. А вот массивные звезды еще до того, как вспыхнуть в качестве сверхновой, могут рассеять в космосе половину или даже две трети своей массы. Поэтому за кислород воздуха и натрий нашей соленой крови мы должны благодарить расточительные тяжелые светила, а не бережливые легкие.
Удивительно, сколько усилий потребовалось Вселенной, чтобы создать строительный материал для скалистых планет и их обитателей. Но лишь благодаря неутомимой работе этого химического комбината есть те, кто может удивляться.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl + Enter.
Немецкий учёный, академик Лотар Кольдиц так истолковывает особенности открытия Д.И. Менделеева, сопоставляя в высшей степени убедительные результаты его труда с работами других исследователей, искавших подобные закономерности:
«Никто из учёных, занимавшихся до Менделеева или одновременно с ним исследованиями соотношений между атомными весами и свойствами элементов, не смог сформулировать эту закономерность так ясно, как это сделал он. В частности, это относится к Дж. Ньюлендсу и Л. Мейеру. Предсказание ещё неизвестных элементов, их свойств и свойств их соединений является исключительно заслугой Д. И. Менделеева. <…>Наилучшим образом он смог применить свой метод горизонтальной, вертикальной и диагональной интерполяции в открытой им периодической системе для предсказания свойств…»
Развивая в 1869—1871 годах идеи периодичности, Д.И. Менделеев ввёл понятие о месте элемента в периодической системе как совокупности его свойств в сопоставлении со свойствами других элементов. На этой основе, в частности, опираясь на результаты изучения последовательности изменения стеклообразующих оксидов, исправил значения атомных масс 9 элементов (бериллия, индия, урана и др.).
В статье, датированной 29 ноября 1870 года предсказал существование, вычислил атомные массы и описал свойства трёх ещё не открытых тогда элементов — «экаалюминия», «экабора» и «экасилиция». Затем предсказал существование ещё восьми элементов, в том числе «двителлура» — полония, «экаиода» — астата , «экамарганца» — технеция , «двимарганца» — , «экацезия» — франция.
Элементы, предсказанные Менделеевым
- Галлий («экаалюминий»), открыт в 1875 г. П.Э. Лекок де Буободраном
- Скандий («экабор»), открыт в 1879 г. Л.Нильсоном
- Германий («экасилиций») открыт в 1886 г. К.Винклером
- Полоний («двителлур»), открыт Пьером и Марией Кюри в 1898 г.
- Радий («экабарий»), открыт Пьером и Марией Кюри в 1898 г.
- Протактиний, открыт О. Ганом и Л. Мейтнер в 1918 г.
- Гафний, открыт Д. Хевеши и Д.Костером в 1923 г.
- Рений («двимарганец»), открыт В. Ноддак, И. Такке и О. Бергом в 1925 г.
- Технеций («экамарганец»), открыт Э. Сегре и К. Перье в 1937 г.
- Франций («экацезий»), открыт М. Перей в 1939 г.
 Галлий. В 1875 г. французский ученый П. Лекок де Буабодран, исследуя цинковую обманку обнаружил в ней с помощью спектроскопического метода новый элемент и определил некоторые его свойства. Он назвал новый элемент галлием (Gallium) в честь своей родины – Франции (лат. Gallia).
Галлий. В 1875 г. французский ученый П. Лекок де Буабодран, исследуя цинковую обманку обнаружил в ней с помощью спектроскопического метода новый элемент и определил некоторые его свойства. Он назвал новый элемент галлием (Gallium) в честь своей родины – Франции (лат. Gallia).
 Скандий. В 1879 г. шведский химик Л. Нильсон выделил 69 г. эрбиевой земли с примесью других редких земель. Разделив эту пробу, он получил окись иттербия и неизвестную землю, оказавшуюся новым элементом. Нильсон назвал его скандием в честь Скандинавского полуострова, на котором находится Швеция. Л.Нильсон пишет: «…не остается никакого сомнения, что в скандии открыт экабор<…> Так подтверждаются самым наглядным образом мысли русского химика, позволившие не только предвидеть существование найденного простого тела, но и наперед дать его важнейшие свойства».
Скандий. В 1879 г. шведский химик Л. Нильсон выделил 69 г. эрбиевой земли с примесью других редких земель. Разделив эту пробу, он получил окись иттербия и неизвестную землю, оказавшуюся новым элементом. Нильсон назвал его скандием в честь Скандинавского полуострова, на котором находится Швеция. Л.Нильсон пишет: «…не остается никакого сомнения, что в скандии открыт экабор<…> Так подтверждаются самым наглядным образом мысли русского химика, позволившие не только предвидеть существование найденного простого тела, но и наперед дать его важнейшие свойства».
 Германий .В 1886 г. немецкий химик К. Винклер в обнаруживает в серебряном минерале аргиродите новый элемент, который впоследствии назвал в честь своей родины германием. Новый элемент оказался предсказанным Менделеевым экасилицием.
Германий .В 1886 г. немецкий химик К. Винклер в обнаруживает в серебряном минерале аргиродите новый элемент, который впоследствии назвал в честь своей родины германием. Новый элемент оказался предсказанным Менделеевым экасилицием.
Винклер пишет: «Вряд ли может существовать более ошеломляющее доказательство правильности учения о периодичности элементов, чем то, которое заключается в материализации до сих пор гипотетического «экасилиция». Это, поистине говоря, нечто больше, чем простое подтверждение смело выдвинутой теории; оно означает вдохновенное расширение химического кругозора, решительный шаг в области познания».
Л. де Буабодрана, Л.Нильсона и К.Винклера, открывших галлий, скандий и германий, предсказанных и описанных Менделевым, ученый считал укрепителями периодического закона.
Прекрасным подтверждением менделеевского закона явилась и открытая Рамзаем группа инертных газов, давшая возможность включить в систему «нулевую» группу — пограничную между щелочными металлами и металлоидами.
История открытия элементов
Названия элементов
Часто названия новые элементы получают по месту расположения лаборатории, где они были открыты, и по имени ученого, проводившего исследование.
Имя Д.И. Менделеева носит 101 элемент периодической системы, синтезированный в 1955 году в Беркли (США) – Менделевий (Md). Первым человеком, чье имя занесли в периодическую таблицу при жизни, стал химик Глен Сиборг. В честь него назван 106 элемент таблицы – сиборгий (Sg).

В 2016 году 118-й элемент получил название оганесон (Og) в честь российского ученого Юрия Цолаковича Оганесяна, внесшего вклад в исследования сверхтяжелых элементов.

Россия в периодической таблице
На настоящий момент 6 элементов периодической системы носят названия, связанные с Россией.
 Рутений (Ru) – 44-й элемент, открыт в 1844 г. в Казани К. Клаусом, назван в честь России (лат. – Ruthenia).
Рутений (Ru) – 44-й элемент, открыт в 1844 г. в Казани К. Клаусом, назван в честь России (лат. – Ruthenia).
 Менделевий (Md) – 101-й элемент, синтезирован в 1955 г. в Беркли (США), назван в честь Дмитрия Ивановича Менделеева.
Менделевий (Md) – 101-й элемент, синтезирован в 1955 г. в Беркли (США), назван в честь Дмитрия Ивановича Менделеева.
 Дубний (Db) – 105-й элемент, синтезирован в 1970 г. в Дубне и независимо в Беркли (США), назван в честь г. Дубны.
Дубний (Db) – 105-й элемент, синтезирован в 1970 г. в Дубне и независимо в Беркли (США), назван в честь г. Дубны.
 Флеровий (Fl) – 114- й элемент, открыт в 1998 г. в Дубне, назван в честь Лаборатории ядерных реакций им. Г. Н. Флёрова ОИЯИ.
Флеровий (Fl) – 114- й элемент, открыт в 1998 г. в Дубне, назван в честь Лаборатории ядерных реакций им. Г. Н. Флёрова ОИЯИ.
 Московий (Mc)– 115- й элемент, открыт в 2004 г. в Дубне, назван в честь Московской области, где находится ОИЯИ.
Московий (Mc)– 115- й элемент, открыт в 2004 г. в Дубне, назван в честь Московской области, где находится ОИЯИ.
 Оганессон (Og) – 118- й элемент, открыт в 2006 г., назван в честь российского ученого Ю.Ц. Оганесяна, руководителя лаборатории ядерных реакций им. Г.Н. Флерова ОИЯИ.
Оганессон (Og) – 118- й элемент, открыт в 2006 г., назван в честь российского ученого Ю.Ц. Оганесяна, руководителя лаборатории ядерных реакций им. Г.Н. Флерова ОИЯИ.
Если мы посмотрим на историю нашей Вселенной, то обнаружим, что в самом начале не было ни Менделеева, ни его периодической таблицы, ни элементов входящих в нее. Наша Вселенная в момент своего рождения была очень плотной и очень горячей. А при таких условиях сложные структуры просто не могут существовать.
Например, при высоких температурах мы можем плавить металлы, то есть можем рушить молекулярную структуру. Повышая температуру, будут разрушаться молекулы на атомы. Атомы также являются составными частицами. Следовательно, повышая температуру дальше мы можем достичь разрушения атомов на отдельные протоны и нейтроны. Повышая температуру еще сильнее, мы продолжим эту матрешку, пока нейтроны и протоны не распадутся на кварки, которые являются фундаментальными частицами и распасться дальше не могут. Поэтому в очень ранней Вселенной не существовало привычного нам вещества.
По мере расширения, Вселенная остывала, что давало возможность образовываться более сложным структурам. Естественно, первым появившимся элементом, судя из таблицы Менделеева, стал водород, поскольку водород — это всего-лишь протон. Это произошло в первые секунды после Большого взрыва.
Поскольку нейтрон немного тяжелее протона, то он появился немного позднее и немного в меньшем количестве. За первые минуты Вселенная расширилась и остыла настолько, что начали происходить термоядерные реакции, в ходе которых стали появляться элементы от водорода до лития включительно. Однако, лития образовалось настолько мало, что его практически не учитывают.
Данный процесс образования первых химических элементов называется первичным нуклеосинтезом. Стоит заметить, что в ходе этого нуклеосинтеза образуется настолько мало лития, что его практически не учитывают, а подсчеты и наблюдения показывают, что Вселенная спустя несколько минут от Большого взрыва на 75% состояла из водорода и почти на 25% из гелия.
В таком составе Вселенная будет пребывать еще долгое время, пока спустя 550 млн лет не образуются первые звезды. В звездах происходит постоянный процесс ядерного синтеза. Большую часть времени звезды преобразуют водород в гелий. Поэтому, по причине процессов в звездах, водорода во Вселенной становится все меньше, а гелия все больше.
Если плотность и температура звезды имеет достаточное значение, то образовавшийся или имеющийся изначально гелий начинает преобразовываться в более тяжелые элементы. Однако, с продвижением по таблице Менделеева требуются все более экстремальные условия.
Экстремальные условия звезда создает сама по себе. Чем тяжелее звезда, тем сильнее она давит сама на себя, тем больше плотность и температура в ее недрах. Следовательно, чем массивнее звезда, тем более тяжелые химические элементы она может производить
Наше Солнце является относительно небольшой звездой, поэтому она может производить элементы только до кислорода. К концу своей жизни Солнце станет красным гигантом, а потом станет белым карликом, сбросив красную оболочку, насыщенную тяжелыми элементами, в космос. Это вещество вместе с таким же сброшенным веществом от других звезд скучкуется и впоследствии образует новое поколение звезд со своими планетами с уже конкретным набором химических элементов.
Первые поколения звезд состояли только из водорода и гелия. Последующие же поколения, как например наша Солнечная система, уже образуются из насыщенного тяжелыми элементами звездного вещества. Все химические элементы на нашей планете, даже те из которых состоит наше тело, когда-то были образованы в звездах. С каждым новым поколением звезды имеют в своем составе все больше и больше тяжелых элементов.
В конце своей жизни многие звезды взрываются и от них остается только белый карлик. Этот белый карлик также может взорваться. Поскольку в недрах таких звезд имеется очень много железа, то при взрыве атомы железа разлетаются по всей космической округе. Все железо, которое мы имеем на Земле, попало к нам именно от таких взорвавшихся карликов.
Многие элементы тяжелее металла образуются непосредственно в момент взрыва остатка от бывшей массивной звезды. Но это далеко не единственное место, где могут рождаться настолько тяжелые элементы.
Около 90% массивных звезд рождаются в парах. Остатками от таких массивных звезд зачастую бывают нейтронные звезды. Если две нейтронные звезды вращаются вокруг общего центра масс, то они постепенно начинают сближаться за счет излучения гравитационных волн. В конечном счете эти два объекта столкнутся со скоростью сравнимой со скоростью света. В таком процессе выделяется колоссальное количество энергии, часть из которых уходит на синтез новых тяжелых элементов. Расчеты показывают, что в ходе слияния нейтронных звезд преимущественно образуются атомы золота. То есть большая часть атомов золота на нашей планете образовалась именно в таких экзотических процессах. Такой процесс действительно является экзотическим, поскольку в нашей галактике такое происходит раз в 20-30 тысяч лет.
Когда мы продвигаемся в по таблице Менделеева, то чем дальше, тем реже встречается элемент в природе. Все потому что для более тяжелых элементов требуются более экстремальные условия, которые встречаются гораздо реже, нежели банальный синтез гелия из водорода в недрах самых обычных звезд.
Делитесь этой статьей в своих социальных сетях, а также не забывайте поставить палец вверх, подписаться на наш канал и оставить комментарий, если вам понравилась данная публикация!
Telegram: https://t.me/different_angle
Яндекс.Дзен: https://zen.yandex.ru/different_angle
Канал не позиционирует себя, как источник стопроцентно правдивой информации, а лишь претендует быть таковым.
