Запросы «ВИЧ» и «Вич» перенаправляются сюда, см. также: Вич (значения)
| Вирус иммунодефицита человека | |||||
|---|---|---|---|---|---|
![Стилизованное изображение сечения ВИЧ[1]](https://upload.wikimedia.org/wikipedia/commons/thumb/e/ea/Human_Immunodeficency_Virus_-_stylized_rendering.jpg/275px-Human_Immunodeficency_Virus_-_stylized_rendering.jpg) Стилизованное изображение сечения ВИЧ[1] |
|||||
| Научная классификация | |||||
|
Группа: Вирусы[2] Реалм: Riboviria Царство: Pararnavirae Тип: Artverviricota Класс: Revtraviricetes Порядок: Ortervirales Семейство: Ретровирусы Подсемейство: Orthoretrovirinae Род: Лентивирусы Группа: Primate lentivirus group |
|||||
| Международное научное название | |||||
| Primate lentivirus group | |||||
| Виды | |||||
|
|||||
| Группа по Балтимору | |||||
| VI: оцРНК-ОТ-вирусы | |||||
|
Ви́рус иммунодефици́та челове́ка (ВИЧ) — ретровирус из рода лентивирусов, вызывающий медленно прогрессирующее[3] заболевание — ВИЧ-инфекцию[4][5].
Вирус поражает клетки иммунной системы, имеющие на своей поверхности рецепторы CD4: Т-хелперы, моноциты, макрофаги, клетки Лангерганса[6], дендритные клетки, клетки микроглии[7]. В результате работа иммунной системы угнетается и развивается синдром приобретённого иммунного дефицита (СПИД), организм больного теряет возможность защищаться от инфекций и опухолей, возникают вторичные оппортунистические заболевания, которые не характерны для людей с нормальным иммунным статусом[8][9][10][11][12][13].
Лечение ВИЧ-инфекции заключается в приёме антиретровирусной терапии, которая позволяет ВИЧ-положительным людям вести нормальный образ жизни, а её качество и продолжительность не отличается от таковых у ВИЧ-отрицательных людей[14][15]. При приёме указанной терапии человек достигает нулевой вирусной нагрузки, вследствие чего не способен передать инфекцию другим людям, в том числе при незащищённом половом акте[16][17][18][19], также терапия позволяет ВИЧ-положительным родителям естественным путём зачать и родить здорового ребёнка[20]. В отсутствие приёма терапии прогрессирующая ВИЧ-инфекция способна привести к оппортунистическим заболеваниям.
Открытие ВИЧ[править | править код]


В 1981 году появились первые три научные статьи о необычных случаях развития пневмоцистной пневмонии и саркомы Капоши у гомосексуальных мужчин[23][24]. До этого оба заболевания встречались редко и были характерны для совершенно разных групп пациентов: саркомой Капоши в основном болели пожилые мужчины средиземноморского происхождения, а пневмоцистной пневмонией — пациенты с лейкозом после интенсивной химиотерапии. Появление этих заболеваний, свидетельствующих о тяжёлом иммунодефицитном состоянии, у молодых людей, не входящих в соответствующие группы риска, наблюдалось впервые[24]. Затем обнаружили такие же симптомы среди наркопотребителей, больных гемофилией A[25], и гаитян[26][27]. Наиболее значимым было обнаружение снижения соотношения CD4+/CD8+-клеток в результате относительного и/или абсолютного уменьшения количества CD4+-лимфоцитов в сочетании с увеличением количества CD8+-лимфоцитов[24][28][29].
В июле 1982 года для обозначения этого состояния был предложен термин синдром приобретённого иммунного дефицита (СПИД, AIDS)[30]. В сентябре 1982 года СПИДу было дано полноценное определение как нозологической форме на основании наблюдения ряда оппортунистических инфекций у четырёх групп пациентов, указанных выше[24][31].
В период с 1981 по 1984 год вышло несколько работ, связывающих вероятность развития СПИДа с анальным сексом или с влиянием наркотиков[32][33][34][35][36][37]. Параллельно велись работы над гипотезой о возможной инфекционной природе СПИДа.
Вирус иммунодефицита человека был открыт в 1983 году в двух лабораториях, работавших независимо друг от друга: в Институте Пастера во Франции под руководством Люка Монтанье и в Национальном институте рака в США под руководством Роберта Галло. Результаты исследований, в которых из тканей пациентов с симптомами СПИДа впервые удалось выделить новый ретровирус, были опубликованы 20 мая 1983 года в журнале Science[38][39]. В этих же работах выделенный из больных СПИДом вирус был впервые успешно размножен в культивируемых Т-лимфоцитах. Французская группа исследователей показала, что серологически этот вирус отличается от HTLV-I, и назвала его LAV («вирус, ассоциированный с лимфаденопатией»), а американская группа назвала его HTLV-III, ошибочно отнеся к группе HTLV-вирусов. Исследователи выдвинули предположение, что вирус может вызывать синдром приобретённого иммунного дефицита[24].
В 1986 году было доказано, что вирусы, открытые в 1983 французскими и американскими исследователями, генетически идентичны. Первоначальные названия вирусов были упразднены и предложено одно общее название — вирус иммунодефицита человека[40]. В 2008 году Люк Монтанье и Франсуаза Барр-Синусси были удостоены Нобелевской премии в области физиологии или медицины «за открытие вируса иммунодефицита человека»[41].
ВИЧ-инфекция[править | править код]
Инфицирование[править | править код]
Вирус может передаваться через прямой контакт повреждённой или неповреждённой слизистой оболочки или повреждённой кожи здорового человека с биологическими жидкостями заражённого человека: кровью, предсеменной жидкостью (выделяющейся на протяжении всего полового акта), спермой, секретом влагалища, грудным молоком. Передача вируса может происходить при незащищённом анальном, вагинальном или оральном сексе[42][43].
Интактная, неповреждённая кожа является эффективным барьером для инфекции, так как в коже отсутствуют клетки, которые могут быть заражены ВИЧ. Для успешной инфекции требуется прямой контакт с кровеносной системой или с мембранами клеток слизистых оболочек. Слизистые оболочки половых органов и прямой кишки часто получают незначительные повреждения при половом акте, через которые вирус может проникать в кровь. Такие повреждения чаще возникают при наличии заболеваний, передающихся половым путём, например, в случае герпеса. Поэтому особенно опасной формой полового акта для принимающего партнёра является незащищённый анальный секс, так как при этой форме возникает наибольшее число мелких и крупных повреждений[44][45]. С другой стороны, заражение возможно и в случае неповреждённой слизистой оболочки, так как слизистая содержит значительное количество дендритных клеток (в том числе, клеток Лангерганса), которые могут играть роль «переносчиков» вирусных частиц в лимфатические узлы.
Передача вируса происходит с большей вероятностью при использовании заражённых игл и шприцев (особенно потребителями инъекционных наркотиков), а также при переливании крови (в случае нарушения медицинским персоналом установленных процедур проверки донорской крови)[46]. Также передача вируса может произойти между матерью и ребёнком во время беременности, родов (заражение через кровь матери)[47][48] и при грудном вскармливании (причём как от заражённой матери к здоровому ребёнку через грудное молоко, так и от заражённого ребёнка к здоровой матери через покусывание груди во время кормления)[49].
Вирус не передаётся воздушно-капельным путём, бытовым путём, при соприкосновении с неповреждённой кожей, через укусы большинства кровососущих насекомых[50] (исключение составляют мухи-жигалки), слёзы[51] и слюну (из-за того, что концентрация вирионов ВИЧ в этих жидкостях ниже инфицирующей дозы, а также из-за того, что слюна — агрессивная среда, разрушающая своими ферментами вирионы ВИЧ)[51].
Вирус не стоек во внешней среде, быстро погибает под прямыми солнечными лучами; при температуре выше 57⁰C, и практически моментально при 100⁰C; так же вирус очень чувствителен к кислотности (он может выжить только при pH от 7 до 8), щелочным и солёным средам[52].
Болезнь[править | править код]
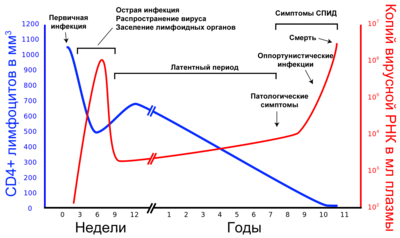
Динамика количества CD4+-лимфоцитов и копий РНК вируса за период от момента инфицирования до терминальной стадии[53] количество CD4+лимфоцитов в 1 мкл крови количество копий РНК вируса в 1 мл плазмы крови
В течение болезни выделяют три стадии: острую инфекцию, латентный период и терминальную стадию (СПИД) (см. иллюстрацию). В ходе развития ВИЧ-инфекции у одного и того же человека в результате мутаций возникают новые штаммы вируса, которые различаются по скорости воспроизведения и способности инфицировать[8][9]. Размножившись, вирусные частицы высвобождаются из поражённых клеток и внедряются в новые — цикл развития повторяется. Инфицированные вирусом Т-хелперы постепенно гибнут из-за разрушения вирусом, апоптоза или уничтожения Т-киллерами. В процессе развития ВИЧ-инфекции количество CD3-CD4 лимфоцитов снижается настолько, что организм уже не может противостоять возбудителям оппортунистических инфекций, которые неопасны или мало опасны для здоровых людей с нормально функционирующей иммунной системой. Причины снижения могут быть различными:
1 — перераспределение пролимфоцитов в сторону CD3-CD8 или естественных киллеров, вызываемое, например, герпесом 4го типа
2 — комплиментарность gp120 и рецептора CD4 — вызывает аутоимунную реакцию, выработку антител, разрушающих CD3-CD4 лимфоцит (наличие данного белка необходимо определять с учётом погрешности тест систем)
3 — сопутствующими заболеваниями, угнетающими костный мозг или органы кроветворения (тимус, лимфатическую систему).
Согласно сведениям об исследованиях данной проблемы, только около 4 % CD3-CD4 лимфоцитов поражается вирусом.
Причем необходимо понимать, что CD3-CD4 и CD3-CD8 лимфоциты это постоянно вырабатываемые организмом клетки из пролимфоцитов, организм сам регулирует какой пролимфоцит станет CD4, CD8 или естественным киллером.
На терминальной стадии (СПИД) ослабленный организм поражают бактериальные, грибковые, вирусные и протозойные инфекции, а также опухоли[11][12][13]. В отсутствие антиретровирусной терапии смерть пациента наступает не в результате размножения вируса в CD4+-клетках, а по причине развития оппортунистических заболеваний (вторичных по отношению к ВИЧ-инфекции).
Эпидемиология[править | править код]
По данным на 2011 год, в мире за всё время ВИЧ-инфекцией заболели 60 миллионов человек, из них: 25 миллионов умерли, а 35 миллионов живут с ВИЧ-инфекцией[54]. Более двух третей из них проживают в Африке к югу от пустыни Сахара[55]. Эпидемия началась здесь в конце 1970-х — начале 1980-х. Затем эпидемия перекинулась в США, Западную Европу и страны Южной Африки. Сегодня, за исключением стран Африки, быстрее всего вирус распространяется в Центральной Азии и Восточной Европе (в том числе в России). Эпидемическая ситуация в этих регионах сдерживалась до конца 1990-х, затем с 1999 по 2002 годы количество инфицированных почти утроилось — в основном за счёт инъекционных наркоманов. Значительно ниже среднего ВИЧ-инфекция распространена в Восточной Азии, Северной Африке и на Ближнем Востоке. В масштабе планеты эпидемическая ситуация стабилизировалась, количество новых случаев ВИЧ-инфекции снизилось с 3,5 миллионов в 1997 году до 2,7 миллионов в 2007 году[55]. По данным на конец 2016 года, в России 848 тысяч человек живут с ВИЧ-инфекцией, за период с 1986 по 2016 год умерло от разных причин 220 тысяч ВИЧ-инфицированных граждан России[56] (подробнее см. Статистика заболеваемости и смертности по России).
Диагностика[править | править код]
Анализ крови позволяет обнаружить антитела к белкам вируса (ИФА), реакцию антител на белки вируса (вестерн-блот), РНК вируса (ОТ-ПЦР)[57]. Определение вирусной нагрузки (подсчёт количества копий РНК вируса в миллилитре плазмы крови) позволяет судить о стадии заболевания и эффективности лечения[58][59].
Обязательная проверка донорской крови в развитых странах в значительной степени сократила возможность передачи вируса при её использовании. Тестирование на ВИЧ беременных женщин позволяет своевременно начать приём лекарств и родить здорового ребёнка.
Существует мнение, что принудительное тестирование населения бесперспективно с точки зрения сдерживания эпидемии[60] и нарушает права человека[61]. В России проведение теста без согласия человека является незаконным[62], однако существуют ситуации, в которых предоставление результатов тестирования на ВИЧ является обязательным, но не насильственным (донорство, трудоустройство медицинских работников, для иностранных граждан, получающих разрешение на пребывание в РФ, в местах лишения свободы при наличии клинических показаний)[63].
Лечение[править | править код]
На 2022 год известно о четырёх случаях излечения от вируса. Три из них в медицинской литературе фигурируют под прозвищами «Берлинский», «Лондонский» и «Сан-Паулский» пациенты, эффект в их случаях был достигнут при помощи пересадки костного мозга (донорские клетки содержали мутацию CCR5-Δ32, делающую их невосприимчивыми к ВИЧ)[64][65][66]. В начале 2022 года стало известно[67] о четвёртом человеке, который излечился от ВИЧ, на этот раз с помощью трансплантации клеток пуповинной крови, содержащих мутацию CCR5-Δ32[67]. В марте 2023 года в журнале Cell вышла статья, описывающая данный случай[68].
Из 35 миллионов человек, живущих с ВИЧ-инфекцией, часть остаётся в живых благодаря антиретровирусной терапии. В случае отсутствия антиретровирусной терапии ВИЧ-инфекции, смерть наступает в среднем через 9—11 лет после заражения[8][10]. При проведении антиретровирусной терапии продолжительность жизни пациента составляет 70—80 лет[69][70][71]. Антиретровирусные препараты мешают ВИЧ размножаться в клетках иммунной системы человека, блокируя внедрение вирионов в клетки и нарушая на разных этапах процесс сборки новых вирионов. Своевременно начатое лечение антиретровирусными препаратами в сотни раз снижает риск развития СПИДа и последующей смерти[72][73][74]. Антиретровирусные препараты у части пациентов вызывают побочные эффекты, в некоторых случаях даже требующие сменить схему лечения (набор принимаемых лекарств).
Терапию назначают при снижении иммунитета и/или высокой вирусной нагрузке. Если число CD4+-лимфоцитов велико и вирусная нагрузка низкая, терапию не назначают. После назначения терапии лекарства нужно принимать ежедневно в одно и то же время и пожизненно, что создаёт неудобства для пациентов. Кроме того, следует учитывать высокую стоимость месячного курса лекарств. В 2014 году необходимые лекарства получали менее половины из 9,5 млн человек, нуждающихся в противовирусной терапии[75].
Также все беременные женщины с ВИЧ-инфекцией должны начинать незамедлительную ВААРТ для предотвращения передачи ВИЧ плоду[76].
Согласно рекомендациям ВОЗ, ВААРТ следует незамедлительно начинать всем ВИЧ-инфицированным детям до полутора лет[77]. Начало терапии у детей, получивших ВИЧ от матери, в течение 3 месяцев после родов снижает смертность на 75 %[78]. В отсутствие лечения треть ВИЧ-инфицированных детей умирает в течение первого года жизни и 50 % — в течение второго года. Если диагностика ВИЧ невозможна, лечение следует начинать в возрасте 9 месяцев, либо ранее, в случае появления симптомов[79].
По состоянию на февраль 2016 года было объявлено, что группе немецких учёных удалось полностью удалить тип ВИЧ-1 из живых клеток. Испытания проводились на клетках человека, вживлённых подопытным мышам. Испытания на людях должны проводиться в ближайшее время[80][81][82].
В 2018 году Администрацией по контролю над продуктами и лекарствами (FDA) был одобрен ибализумаб (ibalizumab-uiyk) для применения в терапии пациентов с мультирезистентным ВИЧ-1. Препарат представляет собой моноклональное антитело, которое связывается с CD4 рецепторами T-клеток и подавляет процесс проникновения вируса в клетку человека. Ибализумаб может применяться в терапии с другими антиретровирусными лекарствами. По результатам клинических исследований с участием 40 пациентов, ранее прошедших лечение более чем 10 различными антиретровирусными агентами, вирусная нагрузка снизилась у большинства испытуемых через одну неделю после введения первой дозы препарата. Через 24 недели терапии вирусологическая супрессия была достигнута у 43 % участников клинических испытаний[83].
ВИЧ в 2019 году вносили в список десяти основных проблем здравоохранения, которые требуют особого внимания ВОЗ[84].
Классификация[править | править код]
Вирус иммунодефицита человека относят к семейству ретровирусов (Retroviridae), роду лентивирусов (Lentivirus). Название Lentivirus происходит от латинского слова lente — медленный. Такое название отражает одну из особенностей вирусов этой группы, а именно — медленную и неодинаковую скорость развития инфекционного процесса в макроорганизме. Для лентивирусов также характерен длительный инкубационный период.
Для вируса иммунодефицита человека характерна высокая частота генетических изменений, возникающих в процессе самовоспроизведения. Частота возникновения ошибок у ВИЧ составляет 10−3 — 10−4 ошибок на геном на цикл репликации, что на несколько порядков больше аналогичной величины у эукариот. Размер генома ВИЧ составляет примерно 104 нуклеотидов. Из этого следует, что практически каждый дочерний геном хотя бы на один нуклеотид отличается от своего предшественника. В современной классификации различают два основных вида ВИЧ — ВИЧ-1 и ВИЧ-2. Предполагается, что эти вирусы возникли в результате независимой передачи людям SIV (вируса иммунодефицита обезьян) от шимпанзе и мангабеев соответственно[86].
И ВИЧ-1, и ВИЧ-2 способны вызывать серьёзный иммунодефицит, однако клиническое течение болезни несколько различается. Известно, что ВИЧ-2 менее патогенен и передаётся с меньшей вероятностью, чем ВИЧ-1. Вероятно, это связано с тем, что ВИЧ-2-инфекция характеризуется более низким числом вирусных частиц на миллилитр крови. Отмечено, что инфекция ВИЧ-2 обеспечивает носителю небольшую защиту от заражения ВИЧ-1. Однако описаны случаи двойной инфекции, причём заражение может происходить в любом порядке. Инфекция ВИЧ-2 реже заканчивается развитием СПИДа. Есть сведения о несколько большей частоте развития саркомы Капоши, кандидоза ротовой полости и хронической лихорадки при ВИЧ-1/СПИДе. При ВИЧ-2/СПИДе чаще развивается энцефалит, хроническая или бактериальная диарея, серьёзные цитомегаловирусные инфекции и холангит[86]. К роду Lentivirus также относят виды, вызывающие схожие заболевания у обезьян, кошек, лошадей, овец и т. д.[8][87][88]
ВИЧ-1[править | править код]
ВИЧ-1 описан в 1983 году и является наиболее распространённым и патогенным видом ВИЧ[89]. Глобальная эпидемия ВИЧ-инфекции главным образом обусловлена распространением ВИЧ-1. В подавляющем большинстве случаев, если не оговорено иначе, под ВИЧ подразумевают ВИЧ-1[90].
Вид ВИЧ-1 классифицируют на главную группу М и несколько побочных групп. Считается, что группы M, N, O, P образовались в результате независимых случаев передачи SIV от обезьяны к человеку, и последующей мутации вируса до ВИЧ[91].
- Вирусы группы М (англ. main — основная) являются причиной более 90 % случаев ВИЧ-инфекции. Группу М классифицируют на несколько клад, называемых подтипами, также обозначаемых буквами:
- подтип A широко распространён, например, в Западной Африке и России[92];
- подтип B доминирует в Европе, Северной Америке, Южной Америке, Японии, Таиланде, Австралии[93];
- подтип C преобладает в Южной и Восточной Африке, Индии, Непале, некоторых частях Китая[93];
- подтип D обнаружен только в Восточной и Центральной Африке[93];
- подтип E не был выявлен в нерекомбинантном виде, лишь совместно с подтипом А как CRF01_AE в Юго-Восточной Азии[93];
- подтип F выявлен в Центральной Африке, Южной Америке и Восточной Европе[94];
- подтип G и рекомбинантная форма CRF02_AG выявлены в Африке и Центральной Европе[94];
- подтип H обнаружен только в Центральной Африке[94];
- подтип I был предложен для описания штамма-продукта множественной рекомбинации CRF04_cpx нескольких подтипов[95];
- подтип J распространён в Северной, Центральной и Западной Африке и странах Карибского бассейна[96];
- подтип K обнаружен только в Конго и Камеруне[94].
- подтип L обнаружен в Конго[97].
- Группа O (англ. outlier — непохожий) обнаружена в Центральной Африке и Западной Африке. Наиболее распространена в Камеруне, где в 1997 году более 2 % пациентов были заражены вирусом группы О[98] (около 100 000 человек, по данным на 2013 год)[99]. Вирусы этой группы не определялись ранними версиями тест-систем на ВИЧ-1; современные тесты определяют вирусы и группы О, и группы N[100].
- Группа N (англ. non-M, non-O — ни M, ни O) обозначает штаммы не М и не О, описана в 1998 году и обнаружена только в Камеруне. С 2006 года выявлены лишь 10 заражений вирусами группы N[101].
- Группа P — в 2009 году была определена нуклеотидная последовательность РНК ВИЧ, значительно сходная с вирусом иммунодефицита обезьян, описанным у горилл (SIVgor), но не с SIV, характерным для шимпанзе (SIVcpz). Вирус был выделен из образцов, полученных от женщины камерунского происхождения, проживающей во Франции[102][103][104].
ВИЧ-2[править | править код]
ВИЧ-2 идентифицирован в 1986 году[105], генетически очень близок к T-лимфотропному вирусу SIV, и в меньшей степени к вирусу ВИЧ-1. Геномы ВИЧ-1 и ВИЧ-2 имеют гомологию консервативных генов gag и pol около 60 %, и до 45 % для генов белков оболочки[106]. По состоянию на 2010 год, описано 8 групп ВИЧ-2, лишь группы A и B являются эпидемическими. Вирусы группы А распространены в Западной Африке, Анголе, Мозамбик, Бразилии, Индии и мало распространены в США и Европе[107][108]. Вирусы группы В распространены в Западной Африке[109][110].
Строение вириона[править | править код]

Строение вируса иммунодефицита человека
Вирионы ВИЧ имеют вид сферических частиц, диаметр которых составляет около 100—120 нанометров[111]. Это приблизительно в 60 раз меньше диаметра эритроцита[112]. В состав зрелых вирионов входит несколько тысяч белковых молекул различных типов.
Капсид зрелого вириона, состоящий из примерно 2000 молекул белка р24, имеет форму усечённого конуса[113].
Внутри капсида находится белково-нуклеиновый комплекс: две нити вирусной РНК, прочно связанные с белком нуклеокапсида p7, ферменты (обратная транскриптаза, протеаза, интеграза)[113]. С капсидом также ассоциированы белки Nef и Vif (7—20 молекул Vif на вирион). Внутри вириона (и, вероятнее всего, за пределами капсида) обнаружен белок Vpr[42]:8-11. Кроме того, с капсидом ВИЧ-1 (но не ВИЧ-2) связаны около 200 копий клеточного фермента пептидилпролилизомеразы A[en] (циклофилин А), необходимого для сборки вириона[114].
Капсид окружён оболочкой, образованной примерно 2000 молекул матриксного белка p17[113]. Матриксная оболочка, в свою очередь, окружена двуслойной липидной мембраной, являющейся наружной оболочкой вируса. Она образована молекулами фосфолипидов, захваченными вирусом во время его отпочковывания от клетки, в которой он сформировался[115]. В липидную мембрану встроены 72 гликопротеиновых комплекса Env, каждый из которых образован тремя молекулами трансмембранного гликопротеина gp41 (TM), служащего «якорем» комплекса, и тремя молекулами поверхностного гликопротеина gp120 (SU)[114]. С помощью белка gp120 вирус присоединяется к рецептору CD4 и корецептору, находящимся на поверхности Т-лимфоцитов человека. Стехиометрическое соотношение p24:gp120 в вирионе составляет 60—100:1[42]:11. При формировании наружной оболочки вируса также происходит захват некоторого количества мембранных белков клетки, в том числе человеческих лейкоцитарных антигенов (HLA) классов I и II и молекул адгезии[113][116].
Белки вириона интенсивно изучаются, поскольку являются мишенями разрабатываемых лекарств и вакцины против ВИЧ.
Функции важных структурных белков ВИЧ-1[113][116]
| Сокращение | Описание | Функции |
|---|---|---|
| gp41 (TM, transmembrane) | Трансмембранный гликопротеин массой 41 кДа | Располагается во внешнем слое липидной мембраны, играет роль «якоря», удерживающего молекулы белка gp120 |
| gp120 (SU, surface) | Гликопротеин массой 120 кДа | Наружный белок вириона. Нековалентно связан с трансмембранным белком gp41. С одной молекулой gp41 связаны 3—5 молекул gp120. Способен связывать рецептор CD4. Играет важную роль в процессе проникновения вируса в клетку. |
| p24 (CA, capsid) | Белок массой 24 кДа | Образует капсид вируса |
| p17 (MA, matrix) | Матриксный белок массой 17 кДа | Около двух тысяч молекул этого белка образуют слой толщиной 5—7 нм, располагающийся между внешней оболочкой и капсидом вируса. |
| p7 (NC, nucleocapsid) | Нуклеокапсидный белок массой 7 кДа | Входит в состав капсида вируса. Образует комплекс с вирусной РНК. |
Геном и кодируемые белки[править | править код]
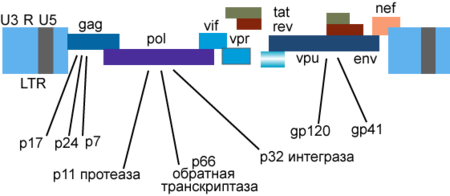
Генетический материал ВИЧ представлен двумя копиями положительно-смысловой (+)РНК[114]. Геном ВИЧ-1 имеет длину 9000 нуклеотидов. Концы генома представлены длинными концевыми повторами, которые управляют продукцией новых вирусов и могут активироваться и белками вируса, и белками инфицированной клетки.
9 генов ВИЧ-1 кодируют, по крайней мере, 15 белков[117]. Ген pol кодирует ферменты: обратную транскриптазу (RT), интегразу (IN) и протеазу (PR). Ген gag кодирует полипротеин Gag/p55, расщепляемый вирусной протеазой до структурных белков p6, p7, p17, p24. Ген env кодирует белок gp160, расщепляемый клеточной эндопротеазой фурином на структурные белки gp41 и gp120[42]:8-12. Другие шесть генов — tat, rev, nef, vif, vpr, vpu (vpx у ВИЧ-2) — кодируют белки, отвечающие за способность ВИЧ-1 инфицировать клетки и производить новые копии вируса. Репликация ВИЧ-1 in vitro возможна без генов nef, vif, vpr, vpu, однако их продукты необходимы для полноценной инфекции in vivo[118][119][120].
Gag[править | править код]
Полипротеин-предшественник Gag/p55 синтезируется с полноразмерной геномной РНК (которая в данном случае служит в качестве мРНК) в процессе стандартной кэп-зависимой трансляции, но возможна и IRES-зависимая трансляция. Предшественники функциональных белков располагаются в составе полипротеина Gag/p55 в следующем порядке: p17…p24…p2…p7…p1…p6[42]:8 (р1 и р2 — соединительные пептиды; другие продукты расщепления Gag/p55 описаны выше). Нерасщеплённый протеазой Gag/p55 содержит три основных домена: домен мембранной локализации (М, membrane targeting), домен взаимодействия (I, interaction) и «поздний» домен (L, late). Домен М, расположенный внутри области p17/МА, миристилируется (присоединяются остатки миристиновой кислоты) и направляет Gag/p55 к плазматической мембране. Домен I, находящийся внутри области p7NC (NC, nucleocapsid), отвечает за межмолекулярные взаимодействия отдельных мономеров Gag/p55. Домен L, также локализованный в области p7NC, опосредует отпочковывание вирионов от плазматической мембраны; в этом процессе участвует также р6 область полипротеина Gag/p55[42]:8[121].
Vpu[править | править код]
Двумя важными функциями белка Vpu являются: 1) разрушение клеточного рецептора CD4 в эндоплазматическом ретикулуме путём привлечения убиквитинлигазных комплексов и 2) стимуляция выделения дочерних вирионов из клетки путём инактивации интерферон-индуцируемого трансмембранного белка CD317/BST-2, получившего также название «tetherin» за его способность подавлять выделение вновь образовавшихся дочерних вирионов посредством их удержания на поверхности клетки[118][119][122][123][124][125].
Vpr[править | править код]
Белок Vpr необходим для репликации вируса в неделящихся клетках, в том числе макрофагах. Этот белок, наряду с другими клеточными и вирусными белками, активирует транскрипцию с использованием длинных концевых повторов генома ВИЧ в качестве промоторов. Белок Vpr играет важную роль в переносе вирусной ДНК в ядро и вызывает задержку деления клетки в периоде G2[126].
Vif[править | править код]
Белок Vif играет важную роль в поддержке репликации вируса. Vif индуцирует убиквитинилирование и деградацию клеточного антивирусного белка APOBEC3G, который вызывает деаминирование ДНК, приводящее к мутационным заменам G на A в вирусной ДНК, синтезируемой в ходе обратной транскрипции. Штаммы, лишённые Vif, не реплицируются в CD4+-лимфоцитах, некоторых линиях T-лимфоцитов и макрофагах. Эти штаммы способны проникать в клетки-мишени и начинать обратную транскрипцию, однако синтез вирусной ДНК остаётся незавершённым[126].
Nef[править | править код]
Белок Nef выполняет несколько функций. Он подавляет экспрессию молекул CD4 и HLA классов I и II на поверхности инфицированных клеток, и тем самым позволяет вирусу ускользать от атаки цитотоксических T-лимфоцитов и от распознавания CD4+-лимфоцитами. Белок Nef может также угнетать активацию T-лимфоцитов, связывая различные белки-компоненты систем внутриклеточной передачи сигнала[126].
У инфицированных вирусом иммунодефицита макак-резусов активная репликация вируса и прогрессирование болезни возможны только при интактном гене nef. Делеции гена nef были обнаружены в штаммах ВИЧ, выделенных у группы австралийцев с длительным непрогрессирующим течением инфекции[127]. Однако у части из них со временем появились признаки прогрессирования инфекции, в том числе снижение числа CD4+-лимфоцитов. Таким образом, хотя делеции гена nef и могут замедлять репликацию вируса, это не гарантирует полной невозможности прогрессирования заболевания[128].
Tat и Rev[править | править код]
Регуляторные белки Tat (транс-активатор) и Rev накапливаются в ядре клетки и связывают определённые участки вирусной РНК. Белок Tat имеет молекулярную массу около 14-15 кДа, связывает вторичную структуру геномной РНК вблизи 5′-нетранслируемой области[126][129], активирует обратную транскрипцию геномной РНК ВИЧ, синтез вирусных мРНК, необходим для репликации вируса почти во всех культурах клеток, регулирует выход вирионов из заражённых клеток[126][129], нуждается в клеточном кофакторе — циклине T1. Белок Rev регулирует экспрессию белков вириона, связывает мРНК гена env в области RRE (англ. Rev response element) интрона, разделяющего экзоны генов Tat и Rev[126][129].
Белки Tat и Rev стимулируют транскрипцию провирусной ДНК и транспорт РНК из ядра в цитоплазму, а также необходимы для трансляции. Белок Rev обеспечивает также транспорт компонентов вируса из ядра и переключение синтеза регуляторных белков вируса на синтез структурных[126].
Жизненный цикл[править | править код]
До проникновения в клетку-мишень[править | править код]
После попадания вирионов ВИЧ на поверхность и внутрь организма, вирусные частицы оказываются в различных по своей агрессивности биологических жидкостях. Слюна и желудочный сок содержат ферменты, которые в бо́льшей степени разрушают вирионы ВИЧ, чем другие биологические жидкости (это не относится к младенцам первых месяцев жизни, у которых ещё не вырабатываются соответствующие ферменты пищеварения, из-за чего младенцы могут быть заражены через грудное молоко). Вирионы ВИЧ проникают в кровеносную и лимфатическую систему организма и перемещаются по организму в потоке крови и лимфы. Оказавшись рядом с CD4-клеткой, вирионы ВИЧ присоединяются к рецептору CD4 на её плазматической мембране[130].
Проникновение в клетку и обратная транскрипция[править | править код]
и плазматической мембраны
Т-лимфоцита человека
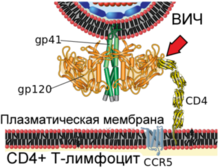
1. Взаимодействие вирусного белка gp120 с клеточным рецептором CD4 (указано красной стрелкой)

2. Конформационные изменения вирусного белка gp120 обеспечивают связывание с клеточным рецептором CCR5 (указано красной стрелкой)

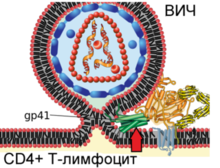
4. Вирусный белок gp41 подвергается значительным конформационным изменениям (указано красной стрелкой), что приводит к сближению и слиянию мембран вириона и клетки
Вирусный гликопротеин gp120 прочно связывает рецептор CD4. В результате такого взаимодействия gp120 претерпевает конформационные изменения, которые позволяют ему также связать молекулу корецептора CXCR4 или CCR5 (экспрессируемых на поверхности Т-лимфоцитов, макрофагов, дендритных клеток и микроглии)[131][132]. В зависимости от способности связывать эти корецепторы, ВИЧ классифицируют на R5-тропные (связывают только корецептор CCR5), X4-тропные (связывают только корецептор CXCR4) и R5X4-тропные (могут взаимодействовать с обоими корецепторами) варианты[131]. При заражении, в основном, передаются R5-тропные и R5X4-тропные варианты[133]. Препараты, блокирующие корецепторы, могут быть эффективны против ВИЧ[134].
После описанных событий вирусный белок gp41 проникает в мембрану клетки и подвергается значительным конформационным изменениям, вследствие которых мембрана клетки и мембрана вириона ВИЧ сближаются друг с другом и затем сливаются. Вирусный белок gp41 очень важен для слияния мембран, поэтому его рассматривают в качестве мишени для разработки противовирусных препаратов.
После слияния мембран содержимое вириона проникает внутрь клетки. Внутри клетки вирусная РНК высвобождается из капсида. Затем под действием обратной транскриптазы происходит обратная транскрипция — процесс синтеза ДНК на основании информации в одноцепочечной геномной РНК вируса[135]. Большая часть лекарственных препаратов, одобренных для применения при ВИЧ-инфекции, направлена на нарушение работы обратной транскриптазы[8].
Транспорт вирусной ДНК в ядро и интеграция в геном[править | править код]
После завершения обратной транскрипции в CD4+-лимфоците вирусный геном представлен невстроенной ДНК. Для встраивания вирусной ДНК в геном клетки-хозяина и для образования новых вирусов необходима активация T-лимфоцитов. Активация CD4+-лимфоцитов происходит при их контакте с антигенпредставляющими клетками в лимфоидной ткани. Наличие вирусов на поверхности фолликулярных дендритных клеток и присутствие провоспалительных цитокинов (ИЛ-1, ИЛ-6 и ФНОα) способствуют размножению ВИЧ в инфицированных клетках. Именно поэтому лимфоидная ткань служит самой благоприятной средой для репликации ВИЧ[136].
Синтезированная вирусная ДНК транспортируется внутрь ядра клетки в составе пре-интеграционного комплекса, в который также входят белки ВИЧ p17/MA, Nef и интеграза[137]. Далее вирусная ДНК встраивается в хромосому активированного T-лимфоцита под действием интегразы. Несколько препаратов, ингибирующих интегразу, широко используются в современной комплексной антиретровирусной терапии. Вирусная ДНК, встроившаяся в хромосому клетки, называется провирусом[8].
Транскрипция, сплайсинг, транспорт РНК из ядра в цитоплазму и трансляция[править | править код]
В ядре клеточная РНК-полимераза синтезирует предшественник вирусных информационных РНК (мРНК), длина которого равна длине геномной РНК ВИЧ-1. Этот предшественник мРНК подвергается 5′-концевому кэпированию и 3′-концевому полиаденилированию. Кроме того, предшественник мРНК подвергается сплайсингу, в результате которого образуются более 40 разных мРНК, которые можно разделить на 3 класса[138]:
- несплайсированная РНК длиной около 9.3 kb — далее используется в качестве мРНК для синтеза белков Gag и Gag-Pol, а также в качестве геномной РНК;
- не полностью сплайсированные РНК размером около 4 kb — используются как мРНК для синтеза белков Vif, Vpr, Tat, Vpu и Env;
- полностью сплайсированные РНК размером около 2 kb — используются как мРНК для синтеза белков Vpr, Tat, Rev и Nef.
На ранней стадии экспрессии генов, в отсутствие белка Rev, несплайсированная и не полностью сплайсированные РНК ВИЧ-1 нестабильны и быстро разрушаются в ядре. В то же время полностью сплайсированные мРНК ВИЧ-1 являются стабильными и транспортируются из ядра в цитоплазму[138]. В цитоплазме с помощью рибосом происходит процесс трансляции — биосинтез белка из аминокислот по заданной матрице на основе генетической информации, содержащейся в мРНК. Синтезированный в цитоплазме белок Rev транспортируется в ядро, где связывается с областью RRE несплайсированной и не полностью сплайсированных РНК, что стабилизирует эти РНК. Кроме того, Rev взаимодействует с клеточным белком CRM1 (экспортин 1), и это взаимодействие стимулирует транспорт несплайсированной и не полностью сплайсированных РНК из ядра в цитоплазму, где происходит синтез закодированных в них белков[138].
Сборка и отпочковывание вирионов[править | править код]
Геномная РНК вируса, а также вирусные белки транспортируются к местам сборки вирионов — к мембране. Вирионы первоначально формируются из полипротеинов-предшественников структурных белков и ферментов и на этой стадии не являются инфекционными. В ходе созревания вирусной частицы вирусная протеаза расщепляет белки-предшественники до функциональных компонентов[8]. Несколько одобренных противовирусных препаратов ингибируют работу протеазы и препятствуют формированию зрелых вирионов[8].
Новые вирусные частицы отпочковываются от поверхности клетки, захватывая часть её мембраны, и выходят в кровяное русло, а клетка хозяина, несущая рецептор CD4, погибает[139][140]. Недавние исследования показали, что процесс отпочковывания вирионов может быть более сложным, чем считалось ранее. Так было обнаружено, что благодаря взаимодействию белка Gag с компонентами клетки вирионы накапливаются в особых внутриклеточных мультивезикулярных тельцах, которые обычно служат для экспорта белков. Таким образом вирусные частицы высвобождаются из клетки, эксплуатируя её собственную систему транспорта макромолекул[8].
Распространение по организму[править | править код]
Только что выделившийся из заражённого лимфоцита вирион ВИЧ в плазме крови живёт в среднем около 8 часов[130]. Продолжительность полужизни (время, за которое погибает 50 % вирионов ВИЧ) в плазме крови составляет примерно 6 часов[130]. В остальных средах продолжительность полужизни вирионов ВИЧ на порядки меньше[141].
В период острой фазы ВИЧ-инфекции отсутствие специфического иммунного ответа позволяет вирусу активно реплицироваться и достигать высоких концентраций в крови. Вирус заселяет органы лимфатической системы, CD4+-лимфоциты, макрофаги, а также другие клетки: альвеолярные макрофаги лёгких, клетки Лангерганса, фолликулярные дендритные клетки лимфатических узлов, клетки олигодендроглии и астроциты мозга и эпителиальные клетки кишки[142][143]. В лимфоидной ткани ВИЧ размножается на протяжении всего заболевания, поражая макрофаги, активированные и покоящиеся CD4+-лимфоциты и фолликулярные дендритные клетки[144][145]. Количество клеток, содержащих провирусную ДНК, в лимфоидной ткани в 5—10 раз выше, чем среди клеток крови, а репликация ВИЧ в лимфоидной ткани на 1—2 порядка выше, чем в крови. Основным клеточным резервуаром ВИЧ являются CD4+-Т-лимфоциты иммунологической памяти[146].
Для активации CD8+-лимфоцитов и образования антиген-специфических цитотоксических T-лимфоцитов необходима презентация пептидного антигена в комплексе с человеческим лейкоцитарным антигеном класса I. Дендритные клетки, необходимые для начала первичных антиген-специфичных реакций, захватывают антигены, перерабатывают и переносят их на свою поверхность, где эти антигены в комплексе с дополнительными стимулирующими молекулами активируют T-лимфоциты. Заражённые клетки часто не выделяют дополнительных стимулирующих молекул и поэтому не способны вызвать активацию достаточного числа B- и T-лимфоцитов, функция которых зависит от дендритных клеток[136].
На 2023 год ВИЧ-инфекция до сих пор остаётся неизлечимым заболеванием, так как геном вируса интегрируется в хромосомы клеток и может реактивироваться даже после курса антиретровирусной терапии. В настоящее время идёт поиск безопасных способов редактирования генома человека и исключения из него провирусной ДНК[147][148]. В 2014 году был предложен метод удаления генома ВИЧ-1 из заражённых клеток при помощи системы CRISPR/Cas9. С помощью этого метода исследователям удалось вырезать фрагмент провирусной ДНК, заключённый между 5′- и 3′-концевыми LTR-областями из хромосом заражённых клеток в культуре. Кроме того, этот метод оказался также эффективным для профилактики заражения неинфицированных клеток. Описанный подход может привести к разработке способа полного избавления от ВИЧ-инфекции[149][150].
Происхождение[править | править код]

Филогенетическое дерево вирусов:
HIV — вирус иммунодефицита человека
SIV — вирус иммунодефицита обезьян
Методом молекулярной филогении показано, что вирус иммунодефицита человека образовался в конце XIX или в начале XX века[151][152][153][154][155], скорее всего в 1920-х гг[156].
Оба типа вируса иммунодефицита человека ВИЧ-1 и ВИЧ-2 возникли в Западной и Центральной Африке южнее Сахары и передались от обезьян к людям. ВИЧ-1 возник на юге Камеруна в результате эволюции эндемичного вируса иммунодефицита обезьян SIV-cpz, который заражает черномордых шимпанзе (Pan troglodytes troglodytes)[157][158]. ВИЧ-1, как полагают, перешёл видовой барьер, по крайней мере, трижды и породил три группы вирусов: M, N и О[159].
ВИЧ-2 возник на территории Западной Африки (от южного Сенегала до запада Берега Слоновой Кости) в результате эволюции вируса иммунодефицита обезьян SIV-smm, который заражает тёмно-коричневых мангабеев (Cercocebus atys) и узконосых обезьян[160].
Существует доказательство того, что охотники на диких животных (обезьян) или поставщики мяса в Западной и Центральной Африке подвергаются заражению вирусом иммунодефицита обезьян, причём вероятность заражения коррелирует с частотой взаимодействия с обезьянами и их мясом[161]. Однако вирус иммунодефицита обезьян — слабый вирус, и, как правило, подавляется иммунной системой человека в течение недели после заражения. Считается, что необходимо несколько передач вируса от человека к человеку в быстрой последовательности, чтобы вирусу хватило времени мутировать в ВИЧ[162]. Хотя передача вируса иммунодефицита обезьян от человека к человеку происходит редко, определённые социальные факторы могут существенно влиять на частоту заражений. Предполагают, что условия для распространения вируса были неблагоприятны в Африке до XX века. Сопоставление периодов ускоренной эволюции ВИЧ с социо-экономическими изменениями позволяет делать предположения о природе факторов, ускоривших распространение ВИО и ВИЧ.
Генетические исследования показывают, что последний общий предок ВИЧ-1 группы М существовал около 1910 года[163]. Сторонники этой даты связывают распространение ВИЧ с развитием колониализма в Африке и ростом больших городов. Эти факторы привели к таким социальным изменениям в обществе, как увеличение частоты беспорядочных половых связей, распространение проституции и заболеваний, передающихся половым путём (ЗППП)[164]. ЗППП, такие как сифилис, могут сопровождаться генитальными язвами. Исследования показывают, что вероятность передачи ВИЧ во время вагинального полового акта, достаточно низкая при обычных условиях, может быть увеличена в десятки, если не в сотни раз, если один из партнёров страдает от генитальных язв. О степени распространённости ЗППП в колониальных городах в начале 1900-х можно судить по следующим цифрам: в 1928 году по меньшей мере 45 % жительниц восточного Леопольдвиля (ныне — Киншаса, ранний центр распространения ВИЧ группы М) были проститутками, а в 1933 году около 15 % всех жителей этого же города были заражены одной из форм сифилиса. Ретроспективный анализ показал, что начало эпидемии ВИЧ-инфекции в Киншасе совпало с пиком эпидемии генитальных язв в середине 1930-х годов[164].
Альтернативная точка зрения гласит, что основным фактором, способствовавшим адаптации ВИЧ к людям и его распространению, была небезопасная медицинская практика в Африке в годы после Второй мировой войны, такая как использование нестерильных многоразовых шприцев при массовых вакцинациях, инъекциях антибиотиков и противомалярийных средств[110][165][166].
В результате ретроанализа образцов крови, взятых после Второй мировой войны, зафиксирован самый ранний документальный случай наличия ВИЧ в организме человека, кровь у которого взяли в 1959 году[167]. Вирус, возможно, присутствовал в Соединённых Штатах уже в 1966 году[168], но подавляющее большинство случаев заражения ВИЧ, идентифицированных за пределами тропической Африки, можно проследить до одного неустановленного человека, который заразился ВИЧ на Гаити, а затем перенёс инфекцию в США около 1969 года[169].
Мутация CCR5-Δ32[править | править код]
Естественная устойчивость к ВИЧ[править | править код]
Описаны случаи устойчивости людей к ВИЧ. Проникновение вируса в клетку иммунной системы связано с его взаимодействием с поверхностным рецептором, белком CCR5. Делеция (утеря участка гена) CCR5-дельта32 приводит к невосприимчивости её носителя к ВИЧ. Предполагается, что эта мутация возникла примерно две с половиной тысячи лет назад и со временем распространилась в Европе. Сейчас к ВИЧ фактически устойчив в среднем 1 % жителей Европы, 10—15 % европейцев имеют частичную сопротивляемость к ВИЧ[170]. 0,1-0,3 % русского населения почти невосприимчивы к ВИЧ[171]. Учёные Ливерпульского университета объясняют распространение мутации гена CCR5 тем, что она усиливает сопротивляемость к бубонной чуме. Эпидемия «чёрной смерти» 1347 года (а в Скандинавии ещё и 1711 года) способствовала увеличению частоты этого генотипа в Европе.
Мутация в гене CCR2 также уменьшает шанс проникновения ВИЧ в клетку и приводит к задержке развития СПИДа. Существует небольшой процент ВИЧ-положительных людей (около 10 %), у которых СПИД не развивается в течение долгого времени. Их называют нонпрогрессорами (nonprogressors)[172][173].
Важный клеточный компонент защиты против ВИЧ — антивирусный белок APOBEC3G, который вызывает деаминирование ДНК, приводящее к мутационным заменам G на A в вирусной ДНК, синтезируемой в ходе обратной транскрипции. APOBEC3G инактивируется белком Vif ВИЧ-1, который вызывает его убиквитинилирование и деградацию[174].
Обнаружено, что одним из главных элементов антивирусной защиты человека и других приматов является белок TRIM5a, способный распознавать капсид вирусных частиц и препятствовать размножению вируса в клетке. TRIM5a человека и шимпанзе несколько отличаются друг от друга и эффективны против разных вирусов: этот белок защищает шимпанзе от ВИЧ и родственных ему вирусов, а человека — от вируса PtERV1[175]. Обезьяны Нового Света, за исключением мирикины, которая имеет химерный ген TRIM5-CypA, устойчивостью к ВИЧ не обладают[176].
Другой важный элемент антивирусной защиты — интерферон-индуцируемый трансмембранный белок CD317/BST-2 (англ. bone marrow stromal antigen 2)[122][123][177]. CD317 — трансмембранный белок 2-го типа с необычной топологией: он имеет трансмембранный домен рядом с N-концом и гликозилфосфатидилинозитол (GPI) на С-конце, между которыми расположен внеклеточный домен[178]. Показано, что CD317 непосредственно взаимодействует со зрелыми дочерними вирионами, «привязывая» их к поверхности клетки[179]. Для объяснения механизма такого «привязывания» предложено несколько альтернативных моделей, которые, тем не менее, сходятся в следующем: молекулы CD317 формируют параллельный гомодимер; один или два гомодимера связываются одновременно с одним вирионом и клеточной мембраной. При этом с мембраной вириона взаимодействуют либо оба мембранных «якоря» (трансмембранный домен и GPI) одной из молекул CD317, либо один из них[179]. Спектр активности CD317 включает, по крайней мере, четыре семейства вирусов: ретровирусы, филовирусы, аренавирусы и герпесвирусы[177]. Активность данного клеточного фактора ингибируется белками Vpu ВИЧ-1, Env ВИЧ-2 и SIV, Nef SIV, гликопротеином оболочки вируса Эбола и белком К5 герпесвируса саркомы Капоши[118][119][124][125][177][180][181]. Обнаружен кофактор белка CD317 — клеточный белок ВСА2 (Breast cancer-associated gene 2; Rabring7, ZNF364, RNF115) — Е3-убиквитинлигаза класса RING. BCA2 усиливает интернализацию вирионов ВИЧ-1, «привязанных» белком CD317 к поверхности клетки, в CD63+ внутриклеточные везикулы с их последующим разрушением в лизосомах[182].
См. также[править | править код]
- Тимоти Рэй Браун («Берлинский пациент») — первый человек, который вылечился от ВИЧ/СПИДа.
- Роберт Рейфорд («нулевой пациент») — первая зарегистрированная жертва ВИЧ/СПИДа в Северной Америке.
- Арвид Ноэ — первая зарегистрированная жертва ВИЧ/СПИДа в Европе.
- Грете Раск — одна из первых жертв ВИЧ/СПИДа в Европе.
- Гаэтан Дюга — канадский бортпроводник, внёсший значительный вклад в распространение вируса в Северной Америке и ранее ошибочно идентифицировавшийся как «нулевой пациент».
Примечания[править | править код]
- ↑ James E. Rickman. Human genes may predict AIDS progression rate (англ.). Los Alamos National Laboratory News Bulletin (14 июля 2003). Архивировано 23 марта 2004 года.
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ Медпортал. ВИЧ-инфекция и СПИД. Дата обращения: 24 января 2015. Архивировано 20 января 2015 года.
- ↑ Weiss R.A. How does HIV cause AIDS? (англ.) // Science. — 1993. — May (vol. 260, no. 5112). — P. 1273—1279. — doi:10.1126/science.8493571. — Bibcode: 1993Sci…260.1273W. — PMID 8493571.
- ↑ Douek D.C., Roederer M., Koup R.A. Emerging Concepts in the Immunopathogenesis of AIDS (англ.) // Annu. Rev. Med. : journal. — 2009. — Vol. 60. — P. 471—484. — doi:10.1146/annurev.med.60.041807.123549. — PMID 18947296. — PMC 2716400.
- ↑ Kawamura T., Kurtz S. E., Blauvelt A., Shimada S. The role of Langerhans cells in the sexual transmission of HIV. (англ.) // Journal of dermatological science. — 2005. — Vol. 40, no. 3. — P. 147—155. — doi:10.1016/j.jdermsci.2005.08.009. — PMID 16226431. [исправить]
- ↑ Kramer-Hämmerle S., Rothenaigner I., Wolff H., Bell J. E., Brack-Werner R. Cells of the central nervous system as targets and reservoirs of the human immunodeficiency virus. (англ.) // Virus research. — 2005. — Vol. 111, no. 2. — P. 194—213. — doi:10.1016/j.virusres.2005.04.009. — PMID 15885841. [исправить]
- ↑ 1 2 3 4 5 6 7 8 9 NIAID/NIH: The Relationship Between the Human Immunodeficiency Virus and the Acquired Immunodeficiency Syndrome. Дата обращения: 11 июля 2014. Архивировано 10 сентября 2016 года.
- ↑ 1 2 Alimonti J.B., Ball T.B., Fowke K.R. Mechanisms of CD4+ T lymphocyte cell death in human immunodeficiency virus infection and AIDS. (англ.) // Journal of General Virology (англ.) (рус. : journal. — Microbiology Society (англ.) (рус., 2003. — Vol. 84, no. 7. — P. 1649—1661. — doi:10.1099/vir.0.19110-0. — PMID 12810858.
- ↑ 1 2 UNAIDS, WHO. 2007 AIDS epidemic update (англ.) (PDF) 10 (декабрь 2007). Дата обращения: 12 марта 2008. Архивировано 27 мая 2008 года.
- ↑ 1 2 Holmes C.B., Losina E., Walensky R.P., Yazdanpanah Y., Freedberg K.A. Review of human immunodeficiency virus type 1-related opportunistic infections in sub-Saharan Africa (англ.) // Clin. Infect. Dis. : journal. — 2003. — Vol. 36, no. 5. — P. 656‐662. — doi:10.1086/367655. — PMID 12594648.
- ↑ 1 2 Guss D.A. The acquired immune deficiency syndrome: an overview for the emergency physician, Part 1 (англ.) // J. Emerg. Med. : journal. — 1994. — Vol. 12, no. 3. — P. 375—384. — doi:10.1016/0736-4679(94)90281-X. — PMID 8040596.
- ↑ 1 2 Guss D.A. The acquired immune deficiency syndrome: an overview for the emergency physician, Part 2 (англ.) // J. Emerg. Med. : journal. — 1994. — Vol. 12, no. 4. — P. 491—497. — doi:10.1016/0736-4679 (94)90346-8. — PMID 7963396.
- ↑ Роксби, Филиппа. Почему сейчас люди с ВИЧ живут столько же, сколько и здоровые, BBC News Русская служба (11 мая 2017). Архивировано 13 апреля 2019 года. Дата обращения: 25 июня 2020.
- ↑ ВИЧ больше не убивает. Газета.Ru. Дата обращения: 25 июня 2020. Архивировано 13 апреля 2019 года.
- ↑ «Неопределяемый = не передающий». SpidCenter. Дата обращения: 27 января 2021. Архивировано 1 декабря 2020 года.
- ↑ Главная (рус.). NO STIGMA. Дата обращения: 27 января 2021. Архивировано 13 апреля 2019 года.
- ↑ Медработники должны рассказывать о тезисе «U = U» всем ВИЧ+. life4me.plus. Дата обращения: 27 января 2021. Архивировано 13 апреля 2019 года.
- ↑ Центр СПИД – НЕОПРЕДЕЛЯЕМЫЙ = НЕ ПЕРЕДАЮЩИЙ. www.hiv-spb.ru. Дата обращения: 27 января 2021. Архивировано 22 апреля 2021 года.
- ↑ ВИЧ и беременность: что нужно знать, как правильно реагировать и где получить поддержку (рус.). НЭН. Дата обращения: 27 января 2021. Архивировано 14 апреля 2019 года.
- ↑ Public Health Image Library Архивная копия от 25 июля 2014 на Wayback Machine Scanning electron micrograph of HIV-1 virions budding from a cultured lymphocyte. See PHIL 10000 for a colorized view of this image, and PHIL 14270, for a black and white version, both viewed at a lower magnigication
- ↑ Department of Health and Human Services. Centers for Disease Control and Prevention’s Public Health Image Library (PHIL), image #948.Проверено 27 июля 2012.
- ↑ Pneumocystis pneumonia–Los Angeles. (англ.) // MMWR. Morbidity and mortality weekly report. — 1981. — Vol. 30, no. 21. — P. 250—252. — PMID 6265753. [исправить]
- ↑ 1 2 3 4 5 History of AIDS Up to 1986 (англ.). AVERT. Дата обращения: 21 июля 2014. Архивировано 7 октября 2015 года.
- ↑ Pneumocystis carinii pneumonia among persons with hemophilia A (англ.) // MMWR Morb. Mortal. Wkly. Rep. : journal. — 1982. — July (vol. 31, no. 27). — P. 365—367. — PMID 6815443. Архивировано 5 августа 2012 года.
- ↑ Opportunistic infections and Kaposi’s sarcoma among Haitians in the United States (англ.) // MMWR Morb. Mortal. Wkly. Rep. : journal. — 1982. — July (vol. 31, no. 26). — P. 353—354. — PMID 6811853. Архивировано 20 сентября 2011 года.
- ↑ Cohen J. HIV/AIDS: Latin America & Caribbean. HAITI: making headway under hellacious circumstances (англ.) // Science : journal. — 2006. — Vol. 313, no. 5786. — P. 470—473. — doi:10.1126/science.313.5786.470b. — PMID 16873641.
- ↑ Centers for Disease Control (CDC). Persistent, generalized lymphadenopathy among homosexual males (англ.) // MMWR Morb Mortal Wkly Rep. : journal. — 1982. — Vol. 31, no. 19. — P. 249—251. — PMID 6808340. Архивировано 18 октября 2011 года.
- ↑ Barré-Sinoussi F., Chermann J.C., Rey F., Nugeyre M.T., Chamaret S., Gruest J., Dauguet C., Axler-Blin C., Vézinet-Brun F., Rouzioux C., Rozenbaum W., Montagnier L;. Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS) (англ.) // Science : journal. — 1983. — Vol. 220, no. 4599. — P. 868—871. — doi:10.1126/science.6189183. — Bibcode: 1983Sci…220..868B. — PMID 6189183.
- ↑ The history of AIDS 1981—1986 (англ.). AVERT. Дата обращения: 21 июля 2014. Архивировано 10 февраля 2009 года.
- ↑ Update on acquired immune deficiency syndrome (AIDS)–United States. (англ.) // MMWR. Morbidity and mortality weekly report. — 1982. — Vol. 31, no. 37. — P. 507—508. — PMID 6815471. [исправить]
- ↑ Gottlieb M. S., Schroff R., Schanker H. M., Weisman J. D., Fan P. T., Wolf R. A., Saxon A. Pneumocystis carinii pneumonia and mucosal candidiasis in previously healthy homosexual men: evidence of a new acquired cellular immunodeficiency. (англ.) // The New England journal of medicine. — 1981. — Vol. 305, no. 24. — P. 1425—1431. — doi:10.1056/NEJM198112103052401. — PMID 6272109. [исправить]
- ↑ Durack D. T. Opportunistic infections and Kaposi’s sarcoma in homosexual men. (англ.) // The New England journal of medicine. — 1981. — Vol. 305, no. 24. — P. 1465—1467. — doi:10.1056/NEJM198112103052408. — PMID 6272112. [исправить]
- ↑ Goedert J. J., Neuland C. Y., Wallen W. C., Greene M. H., Mann D. L., Murray C., Strong D. M., Fraumeni J. F. Jr., Blattner W. A. Amyl nitrite may alter T lymphocytes in homosexual men. (англ.) // Lancet. — 1982. — Vol. 1, no. 8269. — P. 412—416. — PMID 6121088. [исправить]
- ↑ Jaffe H. W., Choi K., Thomas P. A., Haverkos H. W., Auerbach D. M., Guinan M. E., Rogers M. F., Spira T. J., Darrow W. W., Kramer M. A., Friedman S. M., Monroe J. M., Friedman-Kien A. E., Laubenstein L. J., Marmor M., Safai B., Dritz S. K., Crispi S. J., Fannin S. L., Orkwis J. P., Kelter A., Rushing W. R., Thacker S. B., Curran J. W. National case-control study of Kaposi’s sarcoma and Pneumocystis carinii pneumonia in homosexual men: Part 1. Epidemiologic results. (англ.) // Annals of internal medicine. — 1983. — Vol. 99, no. 2. — P. 145—151. — PMID 6603806. [исправить]
- ↑ Mathur-Wagh U., Enlow R. W., Spigland I., Winchester R. J., Sacks H. S., Rorat E., Yancovitz S. R., Klein M. J., William D. C., Mildvan D. Longitudinal study of persistent generalised lymphadenopathy in homosexual men: relation to acquired immunodeficiency syndrome. (англ.) // Lancet. — 1984. — Vol. 1, no. 8385. — P. 1033—1038. — PMID 6143974. [исправить]
- ↑ Newell G. R., Adams S. C., Mansell P. W., Hersh E. M. Toxicity, immunosuppressive effects and carcinogenic potential of volatile nitrites: possible relationship to Kaposi’s sarcoma. (англ.) // Pharmacotherapy. — 1984. — Vol. 4, no. 5. — P. 284—291. — PMID 6150466. [исправить]
- ↑ Barré-Sinoussi F., Chermann J. C., Rey F., Nugeyre M. T., Chamaret S., Gruest J., Dauguet C., Axler-Blin C., Vézinet-Brun F., Rouzioux C., Rozenbaum W., Montagnier L. Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS). (англ.) // Science (New York, N.Y.). — 1983. — Vol. 220, no. 4599. — P. 868—871. — PMID 6189183. [исправить]
- ↑ Gallo R. C., Sarin P. S., Gelmann E. P., Robert-Guroff M., Richardson E., Kalyanaraman V. S., Mann D., Sidhu G. D., Stahl R. E., Zolla-Pazner S., Leibowitch J., Popovic M. Isolation of human T-cell leukemia virus in acquired immune deficiency syndrome (AIDS). (англ.) // Science (New York, N.Y.). — 1983. — Vol. 220, no. 4599. — P. 865—867. — PMID 6601823. [исправить]
- ↑ Coffin J., Haase A., Levy J. A., Montagnier L., Oroszlan S., Teich N., Temin H., Toyoshima K., Varmus H., Vogt P. What to call the AIDS virus? (англ.) // Nature. — 1986. — Vol. 321, no. 6065. — P. 10. — PMID 3010128. [исправить]
- ↑ The Nobel Prize in Physiology or Medicine 2008 Press Release (англ.). — «Harald zur Hausen, Françoise Barré-Sinoussi, Luc Montagnier». Дата обращения: 21 июля 2014. Архивировано 10 августа 2018 года.
- ↑ 1 2 3 4 5 6 Levy J.A. HIV and the pathogenesis of AIDS. — USA: American Society for Microbiology, 2007. — ISBN 978-1-55581-393-2.
- ↑ Rothenberg R. B., Scarlett M., del Rio C., Reznik D., O’Daniels C. Oral transmission of HIV. (англ.) // AIDS (London, England). — 1998. — Vol. 12, no. 16. — P. 2095—2105. — PMID 9833850. [исправить]
- ↑ Begay O., Jean-Pierre N., Abraham C. J., Chudolij A., Seidor S., Rodriguez A., Ford B. E., Henderson M., Katz D., Zydowsky T., Robbiani M., Fernández-Romero J. A. Identification of personal lubricants that can cause rectal epithelial cell damage and enhance HIV type 1 replication in vitro. (англ.) // AIDS research and human retroviruses. — 2011. — Vol. 27, no. 9. — P. 1019—1024. — doi:10.1089/AID.2010.0252. — PMID 21309617. [исправить]
- ↑ James Wilton. From exposure to infection: The biology of HIV transmission (англ.). Дата обращения: 10 сентября 2014. Архивировано из оригинала 10 сентября 2014 года.
- ↑ Jpnh G Bartlett. [hopkons-hivguide.org Карманный справочник. Лечение ВИЧ-инфекции и СПИДа у взрослых]. — Медицинская школа Университета Джонса Хопкинса, 2008. — 138 с.
- ↑ Cooper E. R., Charurat M., Mofenson L., Hanson I. C., Pitt J., Diaz C., Hayani K., Handelsman E., Smeriglio V., Hoff R., Blattner W. Combination antiretroviral strategies for the treatment of pregnant HIV-1-infected women and prevention of perinatal HIV-1 transmission. (англ.) // Journal of acquired immune deficiency syndromes (1999). — 2002. — Vol. 29, no. 5. — P. 484—494. — PMID 11981365. [исправить]
- ↑ Recommendations for Use of Antiretroviral Drugs in Pregnant HIV-1-Infected Women for Maternal Health and Interventions to Reduce Perinatal HIV-1 Transmission in the United States (англ.). AIDSinfo.nih.gov (12 октября 2006). Дата обращения: 21 июля 2014. Архивировано из оригинала 22 апреля 2006 года.
- ↑ Всемирная организация здравоохранения. HIV transmission through breastfeeding. A review of available evidence. — 2007. — ISBN 9789241596596. Архивная копия от 21 января 2022 на Wayback Machine
- ↑ Kerr C. Bloodsucking fly blamed for transmitting HIV. (англ.) // The Lancet infectious diseases. — 2002. — Vol. 2, no. 5. — P. 265. — PMID 12062985. [исправить]Цитата: «Most bloodsucking insects are not capable of transmitting HIV because they inject saliva and ingest blood through different routes»
- ↑ 1 2 CDC. HIV Transmission (англ.). Дата обращения: 21 июля 2014. Архивировано 4 февраля 2005 года. Centers for Disease Control and Prevention. HIV and Its Transmission (англ.). The Center for HIV Law and Policy. — Разоблачение мифов о передаче ВИЧ бытовым путём, при поцелуях, укусах, через слюну, слёзы и др. Дата обращения: 21 июля 2014. Архивировано 4 марта 2016 года. aids.gov. HOW DO YOU GET HIV OR AIDS? (англ.). U.S. Department of Health & Human Services. Дата обращения: 21 июля 2014. Архивировано 14 мая 2017 года. Baron S., Poast J., Cloyd M. W. Why is HIV rarely transmitted by oral secretions? Saliva can disrupt orally shed, infected leukocytes. (англ.) // Archives of internal medicine. — 1999. — Vol. 159, no. 3. — P. 303—310. — PMID 9989543. [исправить]
- ↑ «Устойчивость вируса ВИЧ во внешней среде» O-spide.ru Официальный интернет-портал Минздрава России о профилактике ВИЧ/СПИД. Дата обращения: 18 июля 2020. Архивировано 19 июля 2020 года.
- ↑ Приведено согласно Figure 1, опубликованной в Pantaleo, G et al. New concepts in the immunopathogenesis of human immunodeficiency virus infection (англ.) // New England Journal of Medicine : journal. — 1993. — 4 February (vol. 328, no. 5). — P. 327—335. — PMID 8093551., также доступна Figure 4 в The relationship between the human immunodeficiency virus and the acquired immunodeficiency syndrome (англ.). US National Institute of Allergy and Infectious Diseases. Дата обращения: 3 ноября 2009. Архивировано 30 ноября 2009 года. Дополнительная информация опубликована в Piutak, M et al. High levels of HIV-1 in plasma during all stages of infection determined by competitive PCR (англ.) // Science : journal. — 1993. — 19 March (vol. 259, no. 510). — P. 1749—1754. — PMID 8096089.
- ↑ Борьба со СПИД в России: как остановить болезнь? РИА Новости (30 ноября 2011). Дата обращения: 16 июня 2013. Архивировано 16 июня 2013 года.
- ↑ 1 2 UNAIDS World AIDS Day Report 2011 (англ.). UNAIDS World AIDS (2011). Дата обращения: 16 июня 2013. Архивировано 16 июня 2013 года.
- ↑ Федеральный центр СПИД: Справка ВИЧ-инфекция в Российской Федерации в 2014 г. Дата обращения: 23 июля 2015. Архивировано из оригинала 15 августа 2015 года.
- ↑ National HIV and STD Testing Resources (англ.). Centers for Disease Control and Prevention. Дата обращения: 21 июля 2014. (недоступная ссылка)
- ↑ aids.gov. Just Diagnosed with HIV AIDS: Understand Your Test Results: Viral Load (англ.). U.S. Department of Health & Human Services. Дата обращения: 21 июля 2014. Архивировано 13 мая 2017 года.
- ↑ WebMD Medical Reference from Healthwise. Human Immunodeficiency Virus (HIV) Test (англ.). Healthwise. Дата обращения: 21 июля 2014. Архивировано 11 ноября 2017 года.
- ↑ ВИЧ.рф тест на ВИЧ. Дата обращения: 12 сентября 2014. Архивировано 12 августа 2020 года.
- ↑ ВИЧ/СПИД: Тестирование и консультирование. Дата обращения: 12 сентября 2014. Архивировано 19 апреля 2018 года.
- ↑ Федеральный закон от 22 июля 1993 г. № 5487-1 “Основы законодательства Российской Федерации об охране здоровья граждан” 0. Российская газета. Дата обращения: 21 июля 2014. Архивировано 25 октября 2020 года.
- ↑ Тест на ВИЧ с точки зрения права. Николай Недзельский. Дата обращения: 21 июля 2014. Архивировано 7 февраля 2016 года.
- ↑ Kristina Allers, Gero Hütter, Jörg Hofmann, Christoph Loddenkemper, Kathrin Rieger, Eckhard Thiel, Thomas Schneider. Evidence for the cure of HIV infection by CCR5Δ32/Δ32 stem cell transplantation // Blood. — 2011-03-10. — Т. 117, вып. 10. — С. 2791–2799. — ISSN 1528-0020 0006-4971, 1528-0020. — doi:10.1182/blood-2010-09-309591.
- ↑ Jon Cohen. Has a second person with HIV been cured? (англ.). Science Mag (4 марта 2019). doi:10.1126/science.aax2247. Дата обращения: 10 июля 2020. Архивировано 8 июля 2020 года.
- ↑ Jon Cohen. An intriguing—but far from proven—HIV cure in the ‘São Paulo Patient’ (англ.). Science Mag (7 июля 2020). doi:10.1126/science.abd6947. Дата обращения: 10 июля 2020. Архивировано 10 июля 2020 года.
- ↑ 1 2 Анастасия Кузнецова–Фантони. Врачи сообщили о ремиссии у пациентки с ВИЧ после переливания пуповинной крови. N + 1 — главное издание о науке, технике и технологиях. Дата обращения: 17 марта 2023.
- ↑ Jingmei Hsu, Koen Van Besien, Marshall J. Glesby, Savita Pahwa, Anne Coletti, Meredith G. Warshaw, Larry Petz, Theodore B. Moore, Ya Hui Chen, Suresh Pallikkuth, Adit Dhummakupt, Ruth Cortado, Amanda Golner, Frederic Bone, Maria Baldo, Marcie Riches, John W. Mellors, Nicole H. Tobin, Renee Browning, Deborah Persaud, Yvonne Bryson, Patricia Anthony, Frederic Bone, Renee Browning, Yvonne Bryson, Anne Coletti, Marshall J. Glesby, Amanda Golner, Rohan Hazra, Jingmei Hsu, Ronald Mitsuyasu, Theodore B. Moore, Savita Pahwe, Deborah Persaud, Lawrence Petz, Nicole H. Tobin, Meredith G. Warshaw, Dwight Yin. HIV-1 remission and possible cure in a woman after haplo-cord blood transplant (англ.) // Cell. — 2023-03-16. — Т. 186, вып. 6. — С. 1115–1126.e8. — ISSN 1097-4172 0092-8674, 1097-4172. — doi:10.1016/j.cell.2023.02.030.
- ↑ aidsmap. Ожидаемая продолжительность жизни для некоторых групп ВИЧ-инфицированных лиц в США теперь значительно превосходит её средний показатель. Дата обращения: 26 января 2015. Архивировано из оригинала 7 марта 2015 года.
- ↑ Антиретровирусная терапия online. Продолжительность жизни людей с ВИЧ, получающих АРВТ в развитых странах. Дата обращения: 26 января 2015. Архивировано 27 мая 2020 года.
- ↑ US National Library of Medicine National Institutes of Health. Closing the Gap: Increases in Life Expectancy among Treated HIV-Positive Individuals in the United States and Canada. Дата обращения: 29 сентября 2017. Архивировано 27 мая 2020 года.
- ↑ Emery S., Neuhaus J. A., Phillips A. N., Babiker A., Cohen C. J., Gatell J. M., Girard P. M., Grund B., Law M., Losso M. H., Palfreeman A., Wood R. Major clinical outcomes in antiretroviral therapy (ART)-naive participants and in those not receiving ART at baseline in the SMART study. (англ.) // The Journal of infectious diseases. — 2008. — Vol. 197, no. 8. — P. 1133—1144. — doi:10.1086/586713. — PMID 18476292. [исправить]
- ↑ Katzenstein D. A., Hammer S. M., Hughes M. D., Gundacker H., Jackson J. B., Fiscus S., Rasheed S., Elbeik T., Reichman R., Japour A., Merigan T. C., Hirsch M. S. The relation of virologic and immunologic markers to clinical outcomes after nucleoside therapy in HIV-infected adults with 200 to 500 CD4 cells per cubic millimeter. AIDS Clinical Trials Group Study 175 Virology Study Team. (англ.) // The New England journal of medicine. — 1996. — Vol. 335, no. 15. — P. 1091—1098. — doi:10.1056/NEJM199610103351502. — PMID 8813039. [исправить]
- ↑ Sterne J. A., Hernán M. A., Ledergerber B., Tilling K., Weber R., Sendi P., Rickenbach M., Robins J. M., Egger M. Long-term effectiveness of potent antiretroviral therapy in preventing AIDS and death: a prospective cohort study. (англ.) // Lancet. — 2005. — Vol. 366, no. 9483. — P. 378—384. — doi:10.1016/S0140-6736(05)67022-5. — PMID 16054937. [исправить]
- ↑ Starting, Monitoring & Switching HIV Treatment (англ.). AVERT. Дата обращения: 21 июля 2014. Архивировано 7 октября 2015 года.
- ↑ AIDSinfo. Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents (англ.). NIH. Дата обращения: 13 августа 2014. Архивировано из оригинала 1 ноября 2016 года.
- ↑ World Health Organization. Consolidated guidelines on the use of antiretroviral drugs for treating and preventing HIV infection (англ.). Дата обращения: 13 августа 2014. Архивировано 11 апреля 2020 года.
- ↑ UNAIDS. Gap report (англ.). Дата обращения: 13 августа 2014. Архивировано 6 мая 2020 года.
- ↑ AVERT. HIV treatment children (англ.). Дата обращения: 13 августа 2014. Архивировано 23 сентября 2015 года.
- ↑ Janet Karpinski, Ilona Hauber, Jan Chemnitz et al. Directed evolution of a recombinase that excises the provirus of most HIV-1 primary isolates with high specificity (англ.) // Nature Biotechnology : journal. — Nature Publishing Group, 2016. — doi:10.1038/nbt.34.
- ↑ Немецким учёным удалось победить вирус иммунодефицита человека Архивная копия от 1 октября 2020 на Wayback Machine Новости высоких технологий (Дата обращения: 1 марта 2016)
- ↑ Janet Karpinski, Ilona Hauber, Jan Chemnitz et al.. Directed evolution of a recombinase that excises the provirus of most HIV-1 primary isolates with high specificity (англ.). Nature Biotechnology (22 февраля 2016). Дата обращения: 1 марта 2016. Архивировано 24 февраля 2016 года.
- ↑ В США одобрен препарат для лечения ВИЧ с новым механизмом действия. Дата обращения: 19 марта 2018. Архивировано 28 ноября 2020 года.
- ↑ Десять проблем здравоохранения, над которыми ВОЗ будет работать в 2019 году. ВОЗ (2019). Дата обращения: 29 марта 2019. Архивировано 19 апреля 2019 года.
- ↑ 1 2 Nyamweya S., Hegedus A., Jaye A., Rowland-Jones S., Flanagan K. L., Macallan D. C. Comparing HIV-1 and HIV-2 infection: Lessons for viral immunopathogenesis. (англ.) // Reviews in medical virology. — 2013. — Vol. 23, no. 4. — P. 221—240. — doi:10.1002/rmv.1739. — PMID 23444290. [исправить]
- ↑ Gelderblom H.R., Ozel M., Pauli G. Morphogenesis and morphology of HIV. Structure relations (англ.) // Arch. Virol. : journal. — 1989. — Vol. 106. — P. 1—13.
- ↑ Lentivirus (англ.). International Committee on Taxonomy of Viruses (ICTV). — Virus Taxonomy: 2013 Release. Дата обращения: 21 июля 2014. Архивировано из оригинала 29 июля 2014 года.
- ↑ Джон Бартлетт. Типы и подтипы ВИЧ // Клинические аспекты ВИЧ-инфекции. — 2009. Архив
- ↑ HIV Strains: Types, Groups and Subtypes (англ.). AVERT. Дата обращения: 21 июля 2014. Архивировано 24 сентября 2015 года.
- ↑ Sharp P. M., Hahn B. H. Origins of HIV and the AIDS pandemic. (англ.) // Cold Spring Harbor perspectives in medicine. — 2011. — Vol. 1, no. 1. — P. 006841. — doi:10.1101/cshperspect.a006841. — PMID 22229120. [исправить]
- ↑ Bobkov A.F., Kazennova E.V., Selimova L.M., et al. Temporal trends in the HIV-1 epidemic in Russia: predominance of subtype A (англ.) // J. Med. Virol. : journal. — 2004. — October (vol. 74, no. 2). — P. 191—196. — doi:10.1002/jmv.20177. — PMID 15332265.
- ↑ 1 2 3 4 Goudsmit, Jaap. Viral Sex; The Nature of AIDS. Oxford University Press. New York, New York, 1997. Pg. 51-58. Retrieved May 25, 2008.
- ↑ 1 2 3 4 [1] Архивная копия от 15 февраля 2009 на Wayback Machine Introduction to HIV types, groups and subtypes. March 3, 2008. Retrieved May 25, 2008.
- ↑ Paraskevis D., Magiorkinis M., Vandamme A. M., Kostrikis L. G., Hatzakis A. Re-analysis of human immunodeficiency virus type 1 isolates from Cyprus and Greece, initially designated ‘subtype I’, reveals a unique complex A/G/H/K/? mosaic pattern. (англ.) // The Journal of general virology. — 2001. — Vol. 82, no. Pt 3. — P. 575—580. — PMID 11172098. [исправить]
- ↑ Hemelaar J., Gouws E., Ghys P.D., Osmanov S. Global and regional distribution of HIV-1 genetic subtypes and recombinants in 2004. (англ.) // AIDS : journal. — 2006. — March (vol. 20, no. 16). — P. W13—23. — doi:10.1097/01.aids.0000247564.73009.bc. — PMID 17053344.
- ↑ First New HIV Strain in 19 Years Identified — Scientific American. Дата обращения: 12 июля 2021. Архивировано 15 ноября 2019 года.
- ↑ Peeters M., Gueye A., Mboup S., Bibollet-Ruche F., Ekaza E., Mulanga C., Ouedrago R., Gandji R., Mpele P., Dibanga G., Koumare B., Saidou M., Esu-Williams E., Lombart J.P., Badombena W., Luo N., Vanden Haesevelde M., Delaporte E. Geographical distribution of HIV-1 group O viruses in Africa (англ.) // AIDS : journal. — 1997. — March (vol. 11, no. 4). — P. 493—498. — doi:10.1097/00002030-199704000-00013. — PMID 9084797.
- ↑ Mourez T, Simon F, Plantier JC. Non-M variants of human immunodeficiency virus type 1. Clin Microbiol Rev. 2013 Jul;26(3):448-61
- ↑ AVERT.org. HIV Strains: Types, Groups and Subtypes (англ.). Дата обращения: 24 июля 2014. Архивировано 24 сентября 2015 года.
- ↑ Julie Yamaguchi, Ruthie Coffey, Ana Vallari, Charlotte Ngansop, Dora Mbanya, Nicaise Ndembi, Lazare Kaptué, Lutz G. Gürtler, Pierre Bodelle, Gerald Schochetman, Sushil G. Devare, Catherine A. Brennan. Identification of HIV Type 1 Group N Infections in a Husband and Wife in Cameroon: Viral Genome Sequences Provide Evidence for Horizontal Transmission (англ.) // AIDS Research and Human Retroviruses : journal. — 2006. — January (vol. 22, no. 1). — P. 83—92. — doi:10.1089/aid.2006.22.83. — PMID 16438650.
- ↑ Plantier J.C., Leoz M., Dickerson J.E., De Oliveira F., Cordonnier F., Lemée V., Damond F., Robertson D.L., Simon F. A new human immunodeficiency virus derived from gorillas (англ.) // Nature Medicine : journal. — 2009. — August (vol. 15, no. 8). — P. 871—872. — doi:10.1038/nm.2016. — PMID 19648927.
- ↑ New HIV strain discovered, Associated Press, CBC News (3 августа 2009). Архивировано 5 августа 2009 года. Дата обращения: 3 августа 2009.
- ↑ Donald G. McNeil, Jr.. Precursor to H.I.V. Was in Monkeys for Millennia, New York Times (16 сентября 2010). Архивировано 11 декабря 2019 года. Дата обращения: 17 сентября 2010. «But P appears to have crossed over from a gorilla; it was discovered only last year, and in only one woman, who was from Cameroon, where lowland gorillas are hunted for meat.».
- ↑ Clavel F., Guétard D., Brun-Vézinet F., Chamaret S., Rey M. A., Santos-Ferreira M. O., Laurent A. G., Dauguet C., Katlama C., Rouzioux C. Isolation of a new human retrovirus from West African patients with AIDS. (англ.) // Science (New York, N.Y.). — 1986. — Vol. 233, no. 4761. — P. 343—346. — PMID 2425430. [исправить]
- ↑ Guyader M., Emerman M., Sonigo P., Clavel F., Montagnier L., Alizon M. Genome organization and transactivation of the human immunodeficiency virus type 2. (англ.) // Nature. — 1987. — Vol. 326, no. 6114. — P. 662—669. — doi:10.1038/326662a0. — PMID 3031510. [исправить]
- ↑ HIV-2 Infection Surveillance–United States, 1987-2009. (англ.) // MMWR. Morbidity and mortality weekly report. — 2011. — Vol. 60, no. 29. — P. 985—988. — PMID 21796096. [исправить] За 12 лет с 1988 по 2010 в США зарегистрированы лишь 242 случая ВИЧ-инфекции
- ↑ Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents (англ.). U.S. Department of Health and Human Services. — «Инфекция ВИЧ-2 эндемична в Западной Африке и имеет лишь ограниченное распространение за пределами этой зоны.» Дата обращения: 21 июля 2014. Архивировано из оригинала 1 декабря 2019 года.
- ↑ Santiago, M. L.; Range, F.; Keele, B. F.; Li, Y.; Bailes, E.; Bibollet-Ruche, F.; Fruteau, C.; Noe, R.; Peeters, M. Simian Immunodeficiency Virus Infection in Free-Ranging Sooty Mangabeys (Cercocebus atys atys) from the Taï Forest, Côte d’Ivoire: Implications for the Origin of Epidemic Human Immunodeficiency Virus Type 2 (англ.) // Journal of Virology : journal. — 2005. — Vol. 79, no. 19. — P. 12515—12527. — doi:10.1128/JVI.79.19.12515-12527.2005. — PMID 16160179. — PMC 1211554.
- ↑ 1 2 Marx P.A., Alcabes P.G., Drucker E. Serial human passage of simian immunodeficiency virus by unsterile injections and the emergence of epidemic human immunodeficiency virus in Africa (англ.) // Philos Trans R Soc Lond B Biol Sci : journal. — 2001. — Vol. 356, no. 1410. — P. 911—920. — doi:10.1098/rstb.2001.0867. — PMID 11405938. — PMC 1088484. Архивировано 29 марта 2016 года.
- ↑ McGovern S.L., Caselli E., Grigorieff N., Shoichet B.K. A common mechanism underlying promiscuous inhibitors from virtual and high-throughput screening (англ.) // Journal of Medical Chemistry : journal. — 2002. — Vol. 45, no. 8. — P. 1712—1722. — doi:10.1021/jm010533y. — PMID 11931626.
- ↑ Compared with overview in: Fisher, Bruce; Harvey, Richard P.; Champe, Pamela C. Lippincott’s Illustrated Reviews: Microbiology (Lippincott’s Illustrated Reviews Series). — Hagerstown, MD: Lippincott Williams & Wilkins, 2007. — ISBN 0-7817-8215-5. Page 3
- ↑ 1 2 3 4 5 6 Los Alamos National Laboratory. HIV Sequence Compendium 2008. — 2008. Архивная копия от 24 ноября 2017 на Wayback Machine
- ↑ 1 2 3 Turner B. G., Summers M. F. Structural biology of HIV. (англ.) // Journal of molecular biology. — 1999. — Vol. 285, no. 1. — P. 1—32. — doi:10.1006/jmbi.1998.2354. — PMID 9878383. [исправить]
- ↑ Pudney J., Song M. J. Electron microscopic analysis of HIV-host cell interactions. (англ.) // Tissue & cell. — 1994. — Vol. 26, no. 4. — P. 539—550. — PMID 8091422. [исправить]
- ↑ 1 2 Orentas R. J., Hildreth J. E. Association of host cell surface adhesion receptors and other membrane proteins with HIV and SIV. (англ.) // AIDS research and human retroviruses. — 1993. — Vol. 9, no. 11. — P. 1157—1165. — PMID 8312057. [исправить]
- ↑ Fauci A. S. HIV and AIDS: 20 years of science. (англ.) // Nature medicine. — 2003. — Vol. 9, no. 7. — P. 839—843. — doi:10.1038/nm0703-839. — PMID 12835701. [исправить]
- ↑ 1 2 3 Guatelli J. C. Interactions of viral protein U (Vpu) with cellular factors. (англ.) // Current topics in microbiology and immunology. — 2009. — Vol. 339. — P. 27—45. — doi:10.1007/978-3-642-02175-6_2. — PMID 20012522. [исправить]
- ↑ 1 2 3 Nomaguchi M., Fujita M., Adachi A. Role of HIV-1 Vpu protein for virus spread and pathogenesis. (англ.) // Microbes and infection / Institut Pasteur. — 2008. — Vol. 10, no. 9. — P. 960—967. — doi:10.1016/j.micinf.2008.07.006. — PMID 18672082. [исправить]
- ↑ Malim M. H., Emerman M. HIV-1 accessory proteins–ensuring viral survival in a hostile environment. (англ.) // Cell host & microbe. — 2008. — Vol. 3, no. 6. — P. 388—398. — doi:10.1016/j.chom.2008.04.008. — PMID 18541215. [исправить]
- ↑ Ho S. K., Coman R. M., Bunger J. C., Rose S. L., O’Brien P., Munoz I., Dunn B. M., Sleasman J. W., Goodenow M. M. Drug-associated changes in amino acid residues in Gag p2, p7(NC), and p6(Gag)/p6(Pol) in human immunodeficiency virus type 1 (HIV-1) display a dominant effect on replicative fitness and drug response. (англ.) // Virology. — 2008. — Vol. 378, no. 2. — P. 272—281. — doi:10.1016/j.virol.2008.05.029. — PMID 18599104. [исправить]
- ↑ 1 2 Neil S. J., Zang T., Bieniasz P. D. Tetherin inhibits retrovirus release and is antagonized by HIV-1 Vpu. (англ.) // Nature. — 2008. — Vol. 451, no. 7177. — P. 425—430. — doi:10.1038/nature06553. — PMID 18200009. [исправить]
- ↑ 1 2 Van Damme N., Goff D., Katsura C., Jorgenson R. L., Mitchell R., Johnson M. C., Stephens E. B., Guatelli J. The interferon-induced protein BST-2 restricts HIV-1 release and is downregulated from the cell surface by the viral Vpu protein. (англ.) // Cell host & microbe. — 2008. — Vol. 3, no. 4. — P. 245—252. — doi:10.1016/j.chom.2008.03.001. — PMID 18342597. [исправить]
- ↑ 1 2 Dubé M., Bego M. G., Paquay C., Cohen A. Modulation of HIV-1-host interaction: role of the Vpu accessory protein. (англ.) // Retrovirology. — 2010. — Vol. 7. — P. 114. — doi:10.1186/1742-4690-7-114. — PMID 21176220. [исправить]
- ↑ 1 2 Ruiz A., Guatelli J. C., Stephens E. B. The Vpu protein: new concepts in virus release and CD4 down-modulation. (англ.) // Current HIV research. — 2010. — Vol. 8, no. 3. — P. 240—252. — PMID 20201792. [исправить]
- ↑ 1 2 3 4 5 6 7 Votteler, J. and Schubert, U. (2008) Human Immunodeficiency Viruses: Molecular Biology. Encyclopedia of Virology. (3rd ed.) 517—525
- ↑ Rhodes D. I., Ashton L., Solomon A., Carr A., Cooper D., Kaldor J., Deacon N. Characterization of three nef-defective human immunodeficiency virus type 1 strains associated with long-term nonprogression. Australian Long-Term Nonprogressor Study Group. (англ.) // Journal of virology. — 2000. — Vol. 74, no. 22. — P. 10581—10588. — PMID 11044102. [исправить]
- ↑ Gorry P. R., McPhee D. A., Verity E., Dyer W. B., Wesselingh S. L., Learmont J., Sullivan J. S., Roche M., Zaunders J. J., Gabuzda D., Crowe S. M., Mills J., Lewin S. R., Brew B. J., Cunningham A. L., Churchill M. J. Pathogenicity and immunogenicity of attenuated, nef-deleted HIV-1 strains in vivo. (англ.) // Retrovirology. — 2007. — Vol. 4. — P. 66. — doi:10.1186/1742-4690-4-66. — PMID 17888184. [исправить]
- ↑ 1 2 3 Montagnier, Luc. (1999) Human Immunodeficiency Viruses (Retroviridae). Encyclopedia of Virology (2nd Ed.) 763—774
- ↑ 1 2 3 HIV-1 dynamics in vivo: virion clearance rate, infected cell life-span, and viral generation time (англ.). Science. 1996 Mar 15;271(5255):1582-6.. Дата обращения: 23 августа 2014. Архивировано из оригинала 5 марта 2016 года., PMID 8599114
- ↑ 1 2 Coakley E., Petropoulos C. J., Whitcomb J. M. Assessing chemokine co-receptor usage in HIV. (англ.) // Current opinion in infectious diseases. — 2005. — Vol. 18, no. 1. — P. 9—15. — PMID 15647694. [исправить]
- ↑ Myszka D. G., Sweet R. W., Hensley P., Brigham-Burke M., Kwong P. D., Hendrickson W. A., Wyatt R., Sodroski J., Doyle M. L. Energetics of the HIV gp120-CD4 binding reaction. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2000. — Vol. 97, no. 16. — P. 9026—9031. — PMID 10922058. [исправить]
- ↑ Wilen CB, Tilton JC, Doms RW. HIV: cell binding and entry. Cold Spring Harb Perspect Med. 2012 Aug 1;2(8)
- ↑ Информация о ВИЧ на сайте NIAID (англ.). Дата обращения: 7 августа 2014. Архивировано 10 сентября 2016 года.
- ↑ Размножение вируса иммунодефицита человека в клетке
- ↑ 1 2 Патогенез ВИЧ-инфекции. Архивная копия от 24 сентября 2015 на Wayback Machine
- ↑ Levy J.A. HIV and the pathogenesis of AIDS. — p. 110, 111, 160, 161 — USA: American Society for Microbiology, 2007. — ISBN 978-1-55581-393-2
- ↑ 1 2 3 Karn J., Stoltzfus C. M. Transcriptional and posttranscriptional regulation of HIV-1 gene expression. (англ.) // Cold Spring Harbor perspectives in medicine. — 2012. — Vol. 2, no. 2. — P. 006916. — doi:10.1101/cshperspect.a006916. — PMID 22355797. [исправить]
- ↑ John Hopkins AIDS Servise Жизненный цикл ВИЧ-инфекции Архивная копия от 8 июля 2007 на Wayback Machine
- ↑ Perelson A. S., Neumann A. U., Markowitz M., Leonard J. M., Ho D. D. HIV-1 dynamics in vivo: virion clearance rate, infected cell life-span, and viral generation time. (англ.) // Science (New York, N.Y.). — 1996. — Vol. 271, no. 5255. — P. 1582—1586. — PMID 8599114. [исправить]
- ↑ Survival outside the body Архивная копия от 29 декабря 2015 на Wayback Machine / HIV transmission & testing, NAM Publications (англ.)
- ↑ ВИЧ-инфекция Под ред. Ю. В. Лобзина, С. С. Козлова, А. Н. Ускова, 2000 год. (недоступная ссылка)
- ↑ Meng G., Wei X., Wu X., Sellers M. T., Decker J. M., Moldoveanu Z., Orenstein J. M., Graham M. F., Kappes J. C., Mestecky J., Shaw G. M., Smith P. D. Primary intestinal epithelial cells selectively transfer R5 HIV-1 to CCR5+ cells. (англ.) // Nature medicine. — 2002. — Vol. 8, no. 2. — P. 150—156. — doi:10.1038/nm0202-150. — PMID 11821899. [исправить]
- ↑ Burton G. F., Keele B. F., Estes J. D., Thacker T. C., Gartner S. Follicular dendritic cell contributions to HIV pathogenesis. (англ.) // Seminars in immunology. — 2002. — Vol. 14, no. 4. — P. 275—284. — PMID 12163303. [исправить]
- ↑ Blauvelt A., Asada H., Saville M. W., Klaus-Kovtun V., Altman D. J., Yarchoan R., Katz S. I. Productive infection of dendritic cells by HIV-1 and their ability to capture virus are mediated through separate pathways. (англ.) // The Journal of clinical investigation. — 1997. — Vol. 100, no. 8. — P. 2043—2053. — doi:10.1172/JCI119737. — PMID 9329969. [исправить]
- ↑ Siliciano RF, Greene WC. «HIV latency». Cold Spring Harb Perspect Med. 2011 Sep;1(1): a007096. doi: 10.1101/cshperspect.a007096
- ↑ Генетический ластик для ВИЧ. Фонд развития межсекторного социального партнёрства. Дата обращения: 21 июля 2014. Архивировано 25 сентября 2020 года.
- ↑ Ye L., Wang J., Beyer A. I., Teque F., Cradick T. J., Qi Z., Chang J. C., Bao G., Muench M. O., Yu J., Levy J. A., Kan Y. W. Seamless modification of wild-type induced pluripotent stem cells to the natural CCR5Δ32 mutation confers resistance to HIV infection. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2014. — Vol. 111, no. 26. — P. 9591—9596. — doi:10.1073/pnas.1407473111. — PMID 24927590. [исправить]
- ↑ Hu W., Kaminski R., Yang F., Zhang Y., Cosentino L., Li F., Luo B., Alvarez-Carbonell D., Garcia-Mesa Y., Karn J., Mo X., Khalili K. RNA-directed gene editing specifically eradicates latent and prevents new HIV-1 infection. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2014. — Vol. 111, no. 31. — P. 11461—11466. — doi:10.1073/pnas.1405186111. — PMID 25049410. [исправить]
- ↑ Кирилл Стасевич. Клетки человека избавили от ВИЧ. Наука и жизнь. nkj.ru (25 июля 2014). Дата обращения: 27 июля 2014. Архивировано 8 августа 2020 года.
- ↑ Gao F., Bailes E., Robertson D.L., et al. Origin of HIV-1 in the Chimpanzee Pan troglodytes troglodytes (англ.) // Nature : journal. — 1999. — Vol. 397, no. 6718. — P. 436—441. — doi:10.1038/17130. — PMID 9989410.
- ↑ Worobey M., Gemmel M., Teuwen D.E., et al. Direct evidence of extensive diversity of HIV-1 in Kinshasa by 1960 (англ.) // Nature : journal. — 2008. — October (vol. 455, no. 7213). — P. 661—664. — doi:10.1038/nature07390. — PMID 18833279. Архивировано 16 августа 2010 года.
- ↑ Salemi, M.; Strimmer, K; Hall, WW; Duffy, M; Delaporte, E; Mboup, S; Peeters, M; Vandamme, A.M. Dating the common ancestor of SIVcpz and HIV-1 group M and the origin of HIV-1 subtypes by using a new method to uncover clock-like molecular evolution (англ.) // The FASEB Journal (англ.) (рус. : journal. — Federation of American Societies for Experimental Biology (англ.) (рус., 2000. — Vol. 15, no. 2. — P. 276—278. — doi:10.1096/fj.00-0449fje. — PMID 11156935.
- ↑ Korber, B.; Muldoon, M; Theiler, J; Gao, F; Gupta, R; Lapedes, A; Hahn, BH; Wolinsky, S; Bhattacharya, T. Timing the Ancestor of the HIV-1 Pandemic Strains (англ.) // Science. — 2000. — Vol. 288, no. 5472. — P. 1789—1796. — doi:10.1126/science.288.5472.1789. — Bibcode: 2000Sci…288.1789K. — PMID 10846155.
- ↑ Worobey M., Gemmel M., Teuwen D.E., et al. Direct evidence of extensive diversity of HIV-1 in Kinshasa by 1960 (англ.) // Nature : journal. — 2008. — October (vol. 455, no. 7213). — P. 661—664. — doi:10.1038/nature07390. — Bibcode: 2008Natur.455..661W. — PMID 18833279.
- ↑ Lenta.ru: Наука и техника: Наука: Учёные определили место и время рождения ВИЧ. Дата обращения: 3 октября 2014. Архивировано 3 октября 2014 года.
- ↑ Gao F., Bailes E., Robertson D.L., et al. Origin of HIV-1 in the chimpanzee Pan troglodytes troglodytes (англ.) // Nature : journal. — 1999. — February (vol. 397, no. 6718). — P. 436—441. — doi:10.1038/17130. — Bibcode: 1999Natur.397..436G. — PMID 9989410.
- ↑ Keele, B. F., van Heuverswyn, F., Li, Y. Y., Bailes, E., Takehisa, J., Santiago, M. L., Bibollet-Ruche, F., Chen, Y., Wain, L. V., Liegois, F., Loul, S., Mpoudi Ngole, E., Bienvenue, Y., Delaporte, E., Brookfield, J. F. Y., Sharp, P. M., Shaw, G. M., Peeters, M., and Hahn, B. H. Chimpanzee Reservoirs of Pandemic and Nonpandemic HIV-1 (англ.) // Science : journal. — 2006. — 28 July (vol. 313, no. 5786). — P. 523—526. — doi:10.1126/science.1126531. — Bibcode: 2006Sci…313..523K. — PMID 16728595. — PMC 2442710.
- ↑ Sharp, P. M.; Bailes, E.; Chaudhuri, R. R.; Rodenburg, C. M.; Santiago, M. O.; Hahn, B. H. The origins of acquired immune deficiency syndrome viruses: where and when? (англ.) // Philosophical Transactions of the Royal Society B: Biological Sciences : journal. — 2001. — Vol. 356, no. 1410. — P. 867—876. — doi:10.1098/rstb.2001.0863. — PMID 11405934. — PMC 1088480. Архивировано 25 октября 2007 года. Архивированная копия. Дата обращения: 4 февраля 2012. Архивировано из оригинала 25 октября 2007 года.
- ↑ Reeves, J. D. and Doms, R. W. Human Immunodeficiency Virus Type 2 (англ.) // Journal of General Virology (англ.) (рус.. — Microbiology Society (англ.) (рус., 2002. — Vol. 83, no. Pt 6. — P. 1253—1265. — doi:10.1099/vir.0.18253-0. — PMID 12029140.
- ↑ Kalish M.L., Wolfe N.D., Ndongmo C.D., McNicholl J., Robbins K.E., et al. Central African hunters exposed to simian immunodeficiency virus (англ.) // Emerg Infect Dis : journal. — 2005. — Vol. 11, no. 12. — P. 1928—1930. — PMID 16485481.
- ↑ Marx P.A., Alcabes P.G., Drucker E. Serial human passage of simian immunodeficiency virus by unsterile injections and the emergence of epidemic human immunodeficiency virus in Africa (англ.) // Philos Trans R Soc Lond B Biol Sci : journal. — 2001. — Vol. 356, no. 1410. — P. 911—920. — doi:10.1098/rstb.2001.0867. — PMID 11405938. — PMC 1088484. Архивировано 17 сентября 2013 года.
- ↑ Worobey, Michael; Gemmel, Marlea; Teuwen, Dirk E.; Haselkorn, Tamara; Kunstman, Kevin; Bunce, Michael; Muyembe, Jean-Jacques; Kabongo, Jean-Marie M.; Kalengayi, Raphaël M. Direct evidence of extensive diversity of HIV-1 in Kinshasa by 1960 (англ.) // Nature : journal. — 2008. — Vol. 455, no. 7213. — P. 661—664. — doi:10.1038/nature07390. — Bibcode: 2008Natur.455..661W. — PMID 18833279. Архивировано 13 января 2012 года. Архивированная копия. Дата обращения: 4 февраля 2012. Архивировано из оригинала 13 января 2012 года.
- ↑ 1 2 Sousa, João Dinis de; Müller, Viktor; Lemey, Philippe; Vandamme, Anne-Mieke; Vandamme, Anne-Mieke. High GUD Incidence in the Early 20th Century Created a Particularly Permissive Time Window for the Origin and Initial Spread of Epidemic HIV Strains (англ.) // PLOS One : journal / Martin, Darren P.. — Public Library of Science, 2010. — Vol. 5, no. 4. — P. e9936. — doi:10.1371/journal.pone.0009936. — PMID 20376191. — PMC 2848574. Архивировано 10 октября 2012 года.
- ↑ Chitnis, Amit; Rawls, Diana; Moore, Jim. Origin of HIV Type 1 in Colonial French Equatorial Africa? (англ.) // AIDS Research and Human Retroviruses : journal. — 2000. — Vol. 16, no. 1. — P. 5—8. — doi:10.1089/088922200309548. — PMID 10628811.
- ↑ Donald G. McNeil, Jr.. Precursor to H.I.V. Was in Monkeys for Millennia, New York Times (16 сентября 2010). Архивировано 11 декабря 2019 года. Дата обращения: 17 сентября 2010. «Dr. Marx believes that the crucial event was the introduction into Africa of millions of inexpensive, mass-produced syringes in the 1950s. … suspect that the growth of colonial cities is to blame. Before 1910, no Central African town had more than 10,000 people. But urban migration rose, increasing sexual contacts and leading to red-light districts.».
- ↑ Zhu, T., Korber, B. T., Nahmias, A. J., Hooper, E., Sharp, P. M. and Ho, D. D. An African HIV-1 Sequence from 1959 and Implications for the Origin of the epidemic (англ.) // Nature : journal. — 1998. — Vol. 391, no. 6667. — P. 594—597. — doi:10.1038/35400. — Bibcode: 1998Natur.391..594Z. — PMID 9468138. Архивировано 27 сентября 2011 года.
- ↑ Kolata, Gina. Boy’s 1969 Death Suggests AIDS Invaded U.S. Several Times, The New York Times (28 октября 1987). Архивировано 11 февраля 2009 года. Дата обращения: 11 февраля 2009.
- ↑ The emergence of HIV/AIDS in the Americas and beyond (англ.). Архивировано 28 марта 2012 года.
- ↑ Randy Dotinga. Genetic HIV Resistance Deciphered (англ.). WIRED.com // Condé Nast. Дата обращения: 21 июля 2014. Архивировано 8 февраля 2017 года.
- ↑ Кузнецов, Даниил. Прививка или смерть : [арх. 20 декабря 2018] // Популярная механика : журн.. — 2018. — № 9.
- ↑ Kaur G., Mehra N. Genetic determinants of HIV-1 infection and progression to AIDS: susceptibility to HIV infection. (англ.) // Tissue antigens. — 2009. — Vol. 73, no. 4. — P. 289—301. — doi:10.1111/j.1399-0039.2009.01220.x. — PMID 19317737. [исправить]
- ↑ Chinen J., Shearer W. T. Molecular virology and immunology of HIV infection. (англ.) // The Journal of allergy and clinical immunology. — 2002. — Vol. 110, no. 2. — P. 189—198. — PMID 12170257. [исправить]
- ↑ Sheehy AM, Gaddis NC, Choi JD, Malim MH (2002) Isolation of a human gene that inhibits HIV-1 infection and is suppressed by the viral Vif protein. Nature. 2002 Aug 8;418 (6898):646-650.
- ↑ Kaiser, Shariser. Restriction of an Extinct Retrovirus by the Human TRIM5α Antiviral Protein (англ.) // Science : journal. — 2007. — 22 June (vol. 316, no. 5832). — P. 1756—1758. Архивировано 13 июля 2007 года.
- ↑ Sayah D. M., Sokolskaja E., Berthoux L., Luban J. Cyclophilin A retrotransposition into TRIM5 explains owl monkey resistance to HIV-1. (англ.) // Nature. — 2004. — Vol. 430, no. 6999. — P. 569—573. — doi:10.1038/nature02777. — PMID 15243629. [исправить]
- ↑ 1 2 3 Tokarev A., Skasko M., Fitzpatrick K., Guatelli J. Antiviral activity of the interferon-induced cellular protein BST-2/tetherin. (англ.) // AIDS research and human retroviruses. — 2009. — Vol. 25, no. 12. — P. 1197—1210. — doi:10.1089/aid.2009.0253. — PMID 19929170. [исправить]
- ↑ Kupzig S., Korolchuk V., Rollason R., Sugden A., Wilde A., Banting G. Bst-2/HM1.24 is a raft-associated apical membrane protein with an unusual topology. (англ.) // Traffic (Copenhagen, Denmark). — 2003. — Vol. 4, no. 10. — P. 694—709. — PMID 12956872. [исправить]
- ↑ 1 2 Perez-Caballero D., Zang T., Ebrahimi A., McNatt M. W., Gregory D. A., Johnson M. C., Bieniasz P. D. Tetherin inhibits HIV-1 release by directly tethering virions to cells. (англ.) // Cell. — 2009. — Vol. 139, no. 3. — P. 499—511. — doi:10.1016/j.cell.2009.08.039. — PMID 19879838. [исправить]
- ↑ Douglas J. L., Gustin J. K., Viswanathan K., Mansouri M., Moses A. V., Früh K. The great escape: viral strategies to counter BST-2/tetherin. (англ.) // PLoS pathogens. — 2010. — Vol. 6, no. 5. — P. e1000913. — doi:10.1371/journal.ppat.1000913. — PMID 20485522. [исправить]
- ↑ Evans D. T., Serra-Moreno R., Singh R. K., Guatelli J. C. BST-2/tetherin: a new component of the innate immune response to enveloped viruses. (англ.) // Trends in microbiology. — 2010. — Vol. 18, no. 9. — P. 388—396. — doi:10.1016/j.tim.2010.06.010. — PMID 20688520. [исправить]
- ↑ Miyakawa K., Ryo A., Murakami T., Ohba K., Yamaoka S., Fukuda M., Guatelli J., Yamamoto N. BCA2/Rabring7 promotes tetherin-dependent HIV-1 restriction. (англ.) // PLoS pathogens. — 2009. — Vol. 5, no. 12. — P. e1000700. — doi:10.1371/journal.ppat.1000700. — PMID 20019814. [исправить]
Литература[править | править код]
- Санитарные правила СП 3.1.5.2826-10 Профилактика ВИЧ-инфекции
- Методические рекомендации МР 3.1.0087-14 Профилактика заражения ВИЧ
- Леви Д. Э. ВИЧ и патогенез СПИДа / Джей Э. Леви; Пер. 3-го изд. с англ. Е. А. Монастырской; Под ред. Г. А. Игнатьевой ; Лаб. изучения опухолеродных вирусов и вирусов иммунодефицита человека, Мед. отделение и Научно-исслед. институт рака Калифорнийского университета, Мед. шк. Университета Калифорнии, Сан-Франциско, Калифорния. — М.: Научный Мир, 2010. — 736 с. — ISBN 978-5-91522-198-6.
- Малый В. П. ВИЧ/СПИД: (вирус иммунодефицита человека, синдром приобретённого иммунодефицита). — М.: Эксмо, 2009. — 672 с. — (Новейший медицинский справочник). — ISBN 978-5-699-31017-3.
- Покровский В. В. (редактор). ВИЧ-инфекция и СПИД: Национальное руководство. — М.: ГЭОТАР-Медиа, 2013. — 608 с. — ISBN 978-5-9704-2442-1.
- Bushman F.D., Nabel G.J., Swanstrom R. (Editors). HIV: From biology to prevention and treatment. — Cold Spring Harbor, New York, USA: Cold Spring Harbor Laboratory Press, 2012. — 572 с. — ISBN 978-193611340-8.
- Levy J.A. HIV and the pathogenesis of AIDS. — Third edition. — ASM Press, 2007. — 644 с. — ISBN 978-1-55581-393-2.
- Pancino G., Silvestri G., Fowke K. (Editors). Models of protection against HIV/SIV: Avoiding AIDS in humans and monkeys. — UK-USA-Canada: Academic Press, 2012. — 345 с. — ISBN 978-0-12-387715-4.
- Pepin J. The origins of AIDS. — New York, USA: Cambridge University Press, 2011. — 293 с. — ISBN 978-0-52118637-7.
- Prasad V.R., Kalpana G.V. (Editors). HIV protocols. — Humana Press, 2009. — 457 с. — ISBN 978-1-58829-859-1.
- Sax P.E., Cohen C.J., Kuritzkes D.R. (Editors). HIV essentials. — Jones and Bartlett Learning, 2012. — 248 с. — ISBN 978-1-4496-5092-6.
- Spearman P., Freed E.O. (Editors). HIV interactions with host cell proteins. — Springer, 2009. — 204 с. — ISBN 978-3-642-02174-9.
- Weeks B.B., Alcamo I.E. AIDS: The biological basis. — USA – Canada – UK: Jones and Bartlett Publishers, 2010. — 360 с. — ISBN 978-0-7637-6324-4.
Ссылки[править | править код]
- ВИЧ на curlie.org
- Второй в мире пациент полностью излечился от ВИЧ // Вести.ру, 11 марта 2020
Из истории эпидемии ВИЧ-инфекции
Первые серологические признаки ВИЧ-инфекции были найдены в образцах сыворотки крови человека из Заира, датируемых 1959 годом, из Уганды, датируемых 1972 годом, из Малави, датируемых 1974 годом, на основании чего можно сделать вывод, что ВИЧ в эти годы уже циркулировал среди африканского населения. Первые случаи СПИДа были описаны в США в 1981 году. Открытие ВИЧ, как причины развития СПИДа произошло в 1983 году. С этого времени эпидемия ВИЧ-инфекции приобрела мировой масштаб и продолжает распространяться даже сейчас, через 30 лет после открытия вируса.
ВИЧ-инфекция
— медленно прогрессирующее инфекционное заболевание, возникающее вследствие заражения вирусом иммунодефицита человека, поражающего иммунную систему, в результате чего организм становится высоко восприимчив к оппортунистическим инфекциям и опухолям, которые в конечном итоге приводят к гибели больного.
Считается, что с момента заражения до достижения стадии СПИДа в отсутствии лечения проходит, в среднем, 10 лет (от 5 до 15 лет).
Источник инфекции – всегда человек, больной или носитель. Одна из разновидностей вируса поражает шимпанзе (диких) Африки. Остальные животные к вирусу невосприимчивы. Наибольшую опасность представляют биологические жидкости зараженного человека: кровь, менструальные и влагалищные выделения, сперма. Другие среды: слезы, слюна, спинномозговая жидкость – менее заразны. Для новорожденных представляет угрозу грудное молоко больной матери.
ВИЧ-инфекция течет медленно и в течение многих лет может не нарушать самочувствие человека.
Что такое СПИД?
СПИД – синдром приобретенного иммунодефицита – тяжелое состояние, которое развивается у человека на фоне выраженного иммунодефицита, вызванного длительным течением ВИЧ-инфекции. У человека отмечается значительное снижение иммунитета и наличие одного или нескольких тяжелых заболеваний, называемых СПИД-ассоциированными. СПИД-ассоциированные заболевания и являются причиной смерти ВИЧ-инфицированных пациентов. СПИДа можно избежать!
ВИЧ – вирус нестойкий, погибает вне среды человеческого организма при высыхании содержащих его жидкостей; практически моментально погибает при температуре выше 56ºС.
В чем розница между ВИЧ-инфекцией и СПИДом?
СПИД (Синдром Приобретенного Иммунодефицита) – это конечная и самая тяжелая стадия развития ВИЧ-инфекции. Разрушительное влияние, которое ВИЧ оказывает на иммунную систему человека в течение нескольких лет, приводит к развитию иммунодефицита. А это означает, что любые инфекции, вирусы и болезни больше не встречают “отпора” на своем пути, и организм уже не в силах бороться с ними. У больного СПИДом развивается множество тяжелых болезней, от которых он в конечном итоге погибает.
Как передается ВИЧ
Путей передачи несколько:
-Половой – распространенный, в группе риска те, кто игнорирует средства защиты, а также страдает другими инфекциями, передающимися половым путем, поскольку трещины, пузырьки и язвочки облегчают вирусу проникновение.
-Через грязные шприцы и инструментарий для пирсинга и татуировок – так заражаются преимущественно наркоманы.
-От больной матери новорожденному.
-При переливании крови и пересадке органов – крайне редко, казуистические случаи.
ВИЧ-инфицированные вне этих путей передачи не представляют для здоровых никакой опасности, потому что вирус не проникает через здоровую (неповрежденную) кожу или слизистую оболочку. Вирус не передается при поцелуе (если на губах и в полости рта нет трещин), через столовые приборы, душ и туалет, белье и одежду, при укусах насекомых.
Некоторые люди и вовсе невосприимчивы к вирусу, исследователи обнаружили на их половых органах особый иммуноглобулин класса А.
Если заражение все же произошло, то вирус проникает в лимфоциты и макрофаги – рабочие клетки иммунной системы. Вирус использует все ресурсы клетки, размножается там, а клетка-хозяин погибает.
Размножившийся вирус выходит и проникает в соседние клетки, разрушая иммунитет. Процесс идет долго, первое время организм успевает продуцировать (произвести) новые макрофаги и лимфоциты, но это не может длиться бесконечно. Без лечения иммунная система не может выполнять свои защитные функции, человек поражается любой инфекцией, утрачивает способность противостоять и раковым клеткам.
Как НЕ передается ВИЧ-инфекция?
-при рукопожатии и прикосновении;
-при поцелуе;
-при пользовании одной посудой;
-при кашле или чихании;
-через постельное бельё или другие личные еещи;
-при пользовании общественным туалетом;
-через укусы насекомых.
Как избежать заражения ВИЧ?
Несмотря на все большее расширение эпидемии ВИЧ, заражения можно избежать. Правила профилактики просты, но надежны. Чтобы полностью предохранить себя от заболевания, достаточно:
-пользоваться презервативами при половых контактах;
-пользоваться стерильными медицинскими инструментами.
Вероятность рождения здоровых детей у ВИЧ-инфицированных матерей значительно возрастает, если во время беременности женщины проходят лечение.
Зачем мне нужно знать, есть ли у меня ВИЧ?
-Чтобы снять тревогу после ситуации, опасной в плане заражения ВИЧ;
-Чтобы не заразить близких и любимых Вам людей;
-Чтобы быть более внимательным к своему здоровью, так как любое заболевание на фоне ВИЧ-инфекции протекает тяжелее и требует специального лечения. Особенно это относится к инфекциям, передающимся половым путем, вирусным гепатитам, туберкулезу и другим заболеваниям;
-Чтобы вовремя начать применять специальные препараты, останавливающие развитие болезни, и не допустить развитие СПИДа;
Раннее выявление ВИЧ-инфекции позволяет своевременно начать лечение и значительно улучшить прогноз жизни ВИЧ-инфицированного человека.
ВИЧ очень опасен, НО его можно избежать!!!
Статью подготовила врач по спортивной медицине филиала в г.Сургуте БУ «Клинический врачебно-физкультурный диспансер” Гаджиханова Ажей Шарапутдиновна
Дата публикации 23 октября 2018Обновлено 6 мая 2022
Определение болезни. Причины заболевания
ВИЧ-инфекция — это хроническое инфекционное заболевание, которое провоцирует вирус иммунодефицита человека, поражающий клетки иммунной системы (СD4). При отсутствии лечения закономерно приводит к синдрому приобретённого иммунодефицита (СПИДа).[6]
Вирус иммунодефицита человека принадлежит семейству ретровирусов (Retroviridae), роду Lentivirus. Впервые информация о болезни появилась в 1970 годах. Сам вирус был выделен в 1983 году одновременно во Франции вирусологом Франсуазой Барре-Синусси и в США учёным Робертом Гало, однако название, одобренное Всемирной организацией здравоохранения, получил только через пять лет — в 1987 году. Тогда же впервые был зарегистрирован случай ВИЧ-инфекции в СССР.[1][2]
В настоящее время выделяют два типа вируса — ВИЧ-1 и ВИЧ-2, которые отличаются по своим структурным характеристикам. На территории России, США, Европы и Центральной Африки распространён вирус первого типа (ВИЧ-1), на территории Индии и Западной Африки эпидемиологическое значение имеет второй тип вируса (ВИЧ-2).
В естественных условиях ВИЧ в высушенном состоянии сохраняет активность на протяжении нескольких часов, в биологических жидкостях — несколько дней, в замороженной сыворотке крови — несколько лет. При нагревании до 70-80°C вирус гибнет через 10 минут, при обработке 70% раствором этилового спирта инактивируется через одну минуту. Также чувствителен к 0,5% раствору гипохлорита натрия, 6% раствору перекиси водорода, 5% раствору лизола, эфира или ацетона.[2]
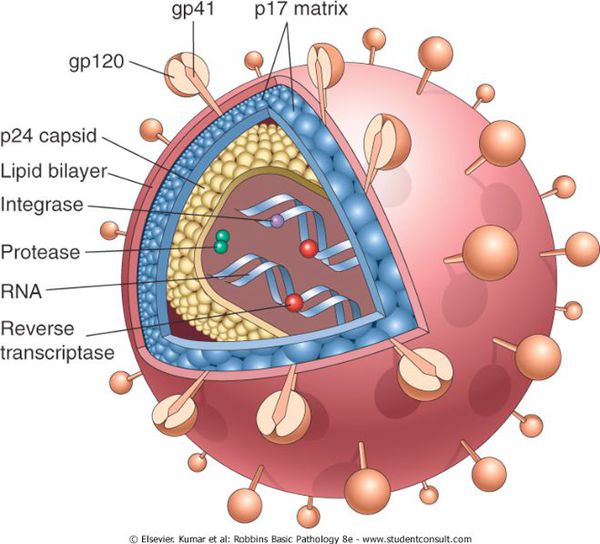
Форма вируса округлая, в центре расположено ядро, содержащее две нити рибонуклеиновой кислоты (РНК) и ферменты, необходимые для размножения — обратную транскриптазу (ревертазу), интегразу, протеазу, РНКазу. Ядро окружено внутренней белковой и наружной липидной оболочкой. Внутренняя оболочка ВИЧ-1 состоит из протеинов p17, p24 и p55. Наружная оболочка “пронизана” гликопротеином gp160, который состоит из фрагментов gp41 и gp120 (так называемых оболочечных белков). Gp41 и gp120 на поверхности вириона образуют отростки, с помощью которых ВИЧ присоединяется к рецепторам клеток-мишеней человека (клеткам организма, которые имеют рецептор — белок CD4).[1][3]
Как передаётся ВИЧ
Пути передачи инфекции:
- Естественные:
- половой (гетеро- и гомосексуальные контакты);
- вертикальный (от заражённой матери к ребёнку во время беременности, родов или кормления грудью).
- Искусственный — парентеральный (в случае различных воздействий, связанных с нарушением слизистых оболочек и кожных покровов, например, использование нестерильных инструментов при употреблении наркотических веществ, медицинских и немедицинских манипуляциях).
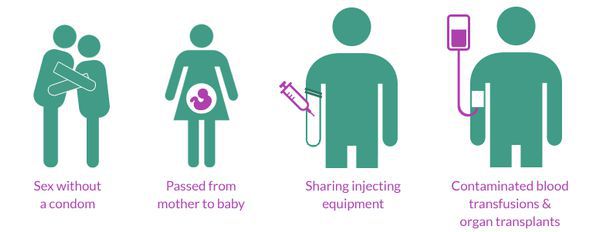
Важно отметить, что при поцелуях, общении, объятиях, рукопожатиях, использовании общей посуды и других предметов быта ВИЧ-инфекция не передаётся.
ВИЧ в России
По данным на 30 июня 2021 года, в России выявлено 1 528 356 человек с подтверждённым диагнозом «ВИЧ-инфекция», в том числе: 1 122 879 пациентов, живущих с ВИЧ, и 405 477 умерших.
ВИЧ-инфекция активно распространяется среди населения. Так, в первом полугодии 2021 года 67,3 % людей заразились при гетеросексуальных контактах, 28,9 % — при употреблении наркотиков и 2,9 % — при гомосексуальных контактах.[7]
Вероятность заразиться ВИЧ
При незащищённом вагинальном контакте женщины заражаются ВИЧ примерно в 8 случаях из 10 000, а мужчины — в 4 случаях. При незащищённом анальном сексе риск заразиться ВИЧ выше: пассивному партнёру вирус передаётся в 138 случаях из 10 000, активному — в 11 случаях.[10]
ВИЧ и беременность
Женщины, которым своевременно назначена антиретровирусная терапия, не передают вирус при беременности и родах. При подавлении вируса роды могут быть проведены естественным путём. Однако грудное вскармливание даже при приёме терапии противопоказано в связи с большим риском заражения ребёнка через грудное молоко.[3][4].
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением – это опасно для вашего здоровья!
Симптомы вич-инфекции
Инкубационный период ВИЧ длится от четырёх недель до трёх месяцев (в единичных случаях — до года).
Первые признаки ВИЧ
ВИЧ-инфекция не имеет специфических симптомов. Все клинические проявления могут относиться как к другим инфекционным и неинфекционным заболеваниям, так и к проявлениям вторичных заболеваний, которые развиваются на фоне иммунодефицита. Однако можно выделить лишь основные симптомы острой ВИЧ-инфекции, которые проявляются в первые три недели – три месяца от момента инфицирования:
- увеличение лимфатических узлов (чаще всего шейных и подмышечных);
- лихорадка (температура при ВИЧ чаще субфебрильная — от 37,1°C до 38,0°C);
- сыпь;
- воспаление нёбных миндалин и, как следствие, боли в горле;
- слабость, бессонница;
- головные боли.
Вышеперечисленные симптомы ВИЧ могут наблюдаться примерно у 30% заболевших. Ещё у 30-40% острая ВИЧ-инфекция может протекать в более тяжёлой форме (с развитием герпетической инфекции, пневмонии, менингита, энцефалита) и примерно у 30% не наблюдается.
Продолжительность клинических проявлений в случае их возникновения варьируется от нескольких дней до нескольких месяцев. Обычно симптомы ВИЧ длятся около 2-3 недель, после чего все проявления исчезают. Исключение может составлять увеличение лимфоузлов, которое часто сохраняется на протяжении всего заболевания.
Не стоит искать у себя какие-либо симптомы ВИЧ. Единственная возможность узнать о наличии или отсутствии ВИЧ-инфекции — пройти лабораторное исследование крови на антитела к ВИЧ минимум через три месяца после “рискованной” ситуации или на РНК ВИЧ минимум через два месяца.
Патогенез вич-инфекции
Проникнув в организм человека любым из вышеперечисленных способов, вирус с помощью специфического гликопротеида gp120 фиксируется на мембране клеток-мишеней, в которых есть белок CD4. Данный рецептор есть у Т-лимфоцитов (Т4, хелперы), он играет главную роль в иммунном ответе. Также белок CD4 есть у у моноцитов, макрофагов, эндотелиальных и других клеток.
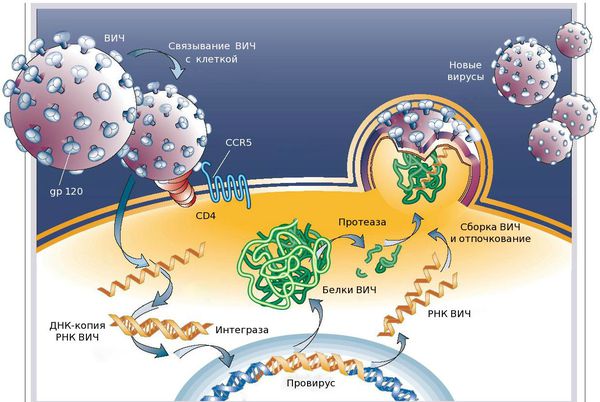
После фиксации на мембране вирус проникает в клетку, там его РНК благодаря ферменту ревертазы синтезирует (создаёт) ДНК, которая встраивается в генетический аппарат здоровой клетки. Там она может существовать в виде провируса в течение всей жизни, при этом оставаясь неактивной. Когда провирус активируется, в заражённой клетке происходит активное накопление новых вирусных частиц, что приводит к разрушению текущей клетки и поражению новых.[3]
Свободный белок gp120 также способен соединяться с рецептором СD4, который присутствует у неинфицированных Т4 лимфоцитов. Вместе они распознаются иммунной системой как чужеродные и разрушаются клетками-киллерами. Ещё одной причиной гибели СD4 клеток являются биологически активные вещества, которые секретируют инфицированные ВИЧ макрофаги. Кроме того, у инфицированных Т-хелперов появляется способность формирования массивных скоплений, в связи с чем их количество резко уменьшается.
Клетки иммунной системы необходимы организму человека для его защиты от бактерий, вирусов, простейших, опухолевых клеток и других чужеродных агентов. Заражённые ВИЧ Т4 клетки не способны осуществлять свою основную функцию, в связи с чем разрушается иммунная система и нарушается нормальная реакция на чужеродные агенты. ВИЧ-инфицированный человек становится беззащитным перед микроорганизмами, даже включая те, которые не представляют опасности для незаражённого человека (оппортунистические инфекции), повышается риск развития онкологических заболеваний.
Также в патологический процесс зачастую вовлекается нервная система. Это становится причиной функциональных, а затем и трофических поражений нейронов и нарушения мозговой деятельности.
Классификация и стадии развития вич-инфекции
Выделяют пять стадий инфицирования:
1) Стадия инкубации — фаза от момента заражения до выработки антител и/или появления реакции, представленных признаками “острой ВИЧ-инфекции”. Продолжительность — от четырёх недель до трёх месяцев (в единичных случаях — до года).
В среднем длительность стадии инкубации составляет от 3 до 6 месяцев. В тот период вирус в организме человека активно размножается, но никак себя не проявляет ни клинически, ни при лабораторном исследовании на антитела к ВИЧ. Однако человек в этой стадии уже заразен.
2) Стадия первичных проявлений — этап, который начинается, соответственно, через 3-6, максимум 12 месяцев от момента заражения. В этот период продолжается активное размножение вируса, и появляется первичный ответ в виде выработки антител или клинических проявлений. Поэтому вторую стадию ВИЧ-инфекции можно выявить при сдаче крови на антитела к ВИЧ.
Стадия первичных проявлений может быть бессимптомной (чаще всего), а также проявляться в виде ряда неспецифических признаков ВИЧ:
- субфебрильная температура;
- сыпь;
- увеличение лимфоузлов;
- кандидоз слизистых;
- герпетическая инфекция;
- ангина;
- пневмония и другие проявления.
Принято считать, что человек находится в стадии острой ВИЧ-инфекции на протяжении 12 месяцев от появления антител к ВИЧ.
3) Субклиническая, или латентная, стадия ВИЧ — период замедленного размножения вируса, по сравнению с предыдущими стадиями. Антитела к ВИЧ в крови продолжают выявляться. Единственный признак ВИЧ — увеличение лимфатических узлов, которое возникает не всегда. Продолжительность стадии без специфического лечения — от 6 до 7 лет (в отдельных случаях может варьироваться от 2 до 20 лет).
4) Стадия вторичных заболеваний — фаза, в которой продолжается репликация ВИЧ. Она сопровождается активной гибелью CD4-лимфоцитов и, следовательно, истощением иммунной системы. Всё это становится причиной развития вторичных (в том числе оппортунистических) инфекционных и/или онкологических заболеваний:
- туберкулёза;
- кандидоза;
- саркомы Капоши;
- опоясывающего герпеса и других болезней.
Продолжительность данной стадии зависит от заболевания, своевременного принятия мер и индивидуальных свойств иммунной системы.
5) Стадия СПИДа (терминальная стадия) — финальный этап течения ВИЧ-инфекции. Происходит развитие тяжёлых вторичных инфекций, угрожающих жизни, их генерализация (распространение по всему организму), развитие онкологических заболеваний и поражение центральной нервной системы, которое может сопровождаться неврологическими симптомами: растерянностью и забывчивостью, неспособностью сконцентрироваться, изменением поведения, головными болями, расстройствами настроения, нарушением координации и трудностями при ходьбе.[9]
При отсутствии своевременно назначенного специфического лечения стадия СПИДа наступает в среднем через 10-12 лет от момента инфицирования.[4]
Осложнения вич-инфекции
Осложнения ВИЧ-инфекции — это вторичные инфекции, развивающиеся на фоне иммунодефицита. К таким заболеваниям относятся:
- Кандидоз (слизистой ротоглотки, дыхательных путей, пищевода) — одна из разновидностей грибковой инфекции, вызывается микроскопическими дрожжеподобными грибами рода Candida. Основные симптомы — боли в горле, при глотании, белый творожистый налёт на языке и/или миндалинах и твёрдом нёбе, субфебрильная лихорадка.
- Опоясывающий герпес — вирусная инфекция, характеризующаяся односторонними герпетиформными высыпаниями на коже (зудящих везикул с жидкостью с их последующим вскрытием и образованием корочек) с сильным болевым синдромом. Возбудитель — Varicella zoster, вирус семейства герпесвирусов, который при первой встрече с организмом (чаще в молодом возрасте) вызывает типичную ветряную оспу. Лечение проводится противогерпетическими препаратами.
- Туберкулёз — инфекционное заболевание, вызываемое различными видами микобактерий группы Mycobacterium. Основные симптомы — лихорадка, кашель, гипергидроз (повышенная потливость, особенно в ночные часы), одышка. Для постановки диагноза необходимо выполнение ФЛГ или КТ лёгких, консультация врача-фтизиатра. У ВИЧ-инфицированных особенностью течения туберкулёза является его частая генерализация, т.е. распространение на другие органы помимо лёгких, что усложняет лечение и, соответственно, ухудшает прогноз.
- Саркома Капоши — многоочаговая опухоль злокачественного характера, поражающая весь организм. Она формируется из эндотелия сосудов, ей свойственно различное клиническое течение. Преимущественно болезнь проявляется новообразованиями кожи, но также она может повлиять на слизистые оболочки, лимфосистему и внутренние органы (прежде всего, на лёгкие и желудочно-кишечный тракт). Лечение должно проводиться совместно с врачом-онкологом.
- Пневмоцистная пневмония — атипичная пневмония, характерная для лиц с иммунодефицитом. Основные симптомы — интенсивная одышка и лихорадка. Для постановки диагноза необходимо выполнения КТ лёгких.
- Церебральный токсоплазмоз — паразитарное заболевание, которое также характерно для лиц с выраженным иммунодефицитом, появляющееся образованием многочисленных очагов в головном мозге. Занимает 2-3 место среди оппортунистических инфекций у больных СПИДом. Имеет различную неврологическую симптоматику — головные боли, снижение памяти, эпилептические припадки и другие проявления. Лечение проводится совместно с врачом-неврологом.
Также могут возникнуть другие бактериальные и вирусные инфекции и онкологические заболевания.[4]
Диагностика вич-инфекции
Для диагностики ВИЧ-инфекции применяется специальный иммуноферментный анализ (ИФА) 4-го поколения, который заключается в реакции “антиген-антитело”. Он позволяет определить наличие антител к ВИЧ в организме человека. Соответственно, тест на ВИЧ будет достоверным только после завершения периода инкубации, т.е. после того, как организм выработает достаточное количество антител (не ранее четвёртой недели после заражения). У большинства людей тест будет достоверным через три месяца, однако для исключения ВИЧ-инфекции на 100% необходимо сдать анализ через 6 и 12 месяцев.
В случае положительного анализа на ВИЧ тот же образец крови исследуется в лаборатории ещё раз: если результат вновь положительный, то необходим тест другого типа — иммунный блоттинг. Положительный результат иммунного блоттинга (после положительного результата ИФА) достоверен на 99,9%, что является максимально точным для любого медицинского теста. Если же иммуноблот отрицательный, то делается вывод, что первый тест был ложноположительным, и ВИЧ у человека нет.
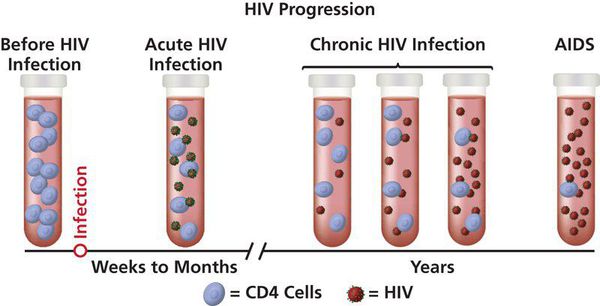
Результат иммуноблота может интерпретироваться как положительный, отрицательный или неопределенный (т.е. наличие в иммуноблоте как минимум одного белка к вирусу). Неопределённый результат может наблюдаться, если анализ сдан в период инкубации: заражение произошло не так давно, поэтому в крови пока находится немного антител к ВИЧ, но спустя некоторое время иммуноблот станет положительным. Также неопределённый результат может возникнуть при отсутствии ВИЧ-инфекции и наличии некоторых хронических заболеваний. В таком случае иммуноблот станет отрицательным, либо будет выявлена причина неопределённого результата.
Как считаю многие, анализ на ВИЧ-инфекцию сдаётся не при любом заборе крови. Однако данное исследование является добровольным для всех, кроме:
- доноров крови;
- иностранцев и лиц без гражданства, которые хотят въехать на территорию Российской Федерации более чем на три месяца;
- медперсонала, работающего с кровью;
- лиц, находящихся в местах лишения свободы.
Люди, не относящиеся ни к одной из перечисленных категорий граждан, не сдают анализ на ВИЧ во время ежегодных профилактических медицинских осмотров, поэтому наличие медицинской книжки также не гарантирует отсутствие ВИЧ-инфекции.
Лечение вич-инфекции
В случае, если ВИЧ-инфекция обнаружена, человек встаёт на учёт в Центре по борьбе со СПИДом, где в дальнейшем наблюдается у врача-инфекциониста.
Лекарственного средства, которое могло бы полностью избавить от ВИЧ, в настоящее время нет. Однако, существуют препараты, значительно продлевающие жизнь и способные предупредить развитие СПИДа. Препараты для лечения показаны всем ВИЧ-инфицированным. Они предоставляются бесплатно после дообследования, назначаемого врачом-инфекционистом.
Препараты для лечения ВИЧ называются антиретровирусными (АРВ). Благодаря АРВ подавляется размножение вируса, в результате чего восстанавливается или не нарушается функция иммунной системы. ВИЧ-инфицированные пациенты, регулярно принимающие данные препараты, не способны передавать вирус даже при незащищённых половых контактах.
Особенность лечения ВИЧ-инфекции заключается в:
- необходимости ежедневного пожизненного приёма препаратов (как правило, не менее трёх);
- контроле эффективности лечения у врача-инфекциониста;
- наблюдении возможных нежелательных явлений, связанных с приёмом препаратов.
Для лечения используются хорошо изученные современные препараты, не оказывающие опасного токсического влияния на другие органы и системы, при условии соблюдения рекомендаций врача и своевременного обследования.
Прогноз. Профилактика
При раннем выявлении и своевременном начале специфического лечения продолжительность жизни ВИЧ-инфицированных людей может не уступать средней продолжительности жизни населения. Поэтому чрезвычайно важно как можно раньше начать наблюдение и лечение у специалиста.
Профилактика ВИЧ
К сожалению, вакцины от данной инфекции пока не существует.
Методами профилактики являются:
- защищённые половые контакты;
- использование стерильных инструментов для проведения различных манипуляций, сопровождающихся нарушением целостности слизистых и кожных покровов;
- тестирование на ВИЧ всего населения не реже 1 раза в год;
- обязательное обследование на ВИЧ при планировании беременности, постановке на учёт в связи с беременностью, а также во время беременности и перед родами;
- обязательный приём препаратов всем ВИЧ-инфицированным женщинам во время беременности;
- приём препаратов всем ВИЧ-инфицированным для снижения вероятности передачи вируса.[4][6]
При положительном результате исследования на антитела к ВИЧ необходимо:
- обратиться в Центр по профилактике и борьбе со СПИДом;
- получить подробную информацию о состоянии своего здоровья, о жизни с ВИЧ и о своих правах и обязанностях;
- начать приём препаратов;
- следовать рекомендациям лечащего врача.
Хотелось бы отдельно отметить, что люди, живущие с ВИЧ, ничем не отличаются от других людей, кроме наличия в их организме вируса.
В последнее время среди ВИЧ-положительных пациентов гомосексуальной ориентации участились случаи развития анального рака под влиянием вируса ВПЧ. Для его профилактики институт СПИДа штата Нью-Йорк рекомендует пациентам проходить скрининг на анальную дисплазию. Он включает:
- сбор анамнеза;
- осмотр и пальцевое ректальное обследование;
- анальный тест Папаниколау — взятие мазка из ануса;
- кольпоскопия [8].
На развитие анального рака будет указывать боль и зуд в области ануса, кровянистые выделения, недержание кала, шишки и язвочки в перианальной зоне. Чтобы устранить осложнение, следует обратиться к колопроктологу.
Эпидемиология ВИЧ, от начала заболевания до сегодняшнего дня
26 января 20194 231
Эпидемиология ВИЧ – это наука, которая изучает распространенность патологии и подсчитывает данные заболеваемости инфекцией. Данная информация необходима для того, чтобы оценить динамику развития ВИЧ в отдельных регионах, странах и в мировом сообществе в целом.
Содержание
Откуда появился СПИД?
Данные эпидемиологии ВИЧ-инфекции указывают, что заболевание существовало еще задолго до официального подтверждения диагноза. Точное место, где появилась инфекция, установить невозможно. Предполагается, что вирус возник в странах Центральной Африки, откуда был завезен в другие страны. Однако эта теория до сих пор считается спорной.
Исторические данные СПИДа
Первые появления заболевания официально зарегистрированы в 1891 году американскими учеными. Поводом для выделения патологии в отдельный диагноз стало большое количество обращений пациентов с сопутствующей патологией, появление которой свидетельствует о нарушении иммунной функции организма. Официальным названием заболевания стала аббревиатура СПИД – синдром приобретенного иммунодефицита.
В 1984 году специалисты из Парижского института (Л.Монтанье с коллегами) выделили возбудитель патологии, которым оказался один из ретровирусов. Определение того, что заболевание имеет природу приобретенного синдрома, который представляет собой вирусное заболевание, позволило начать разработку специфических лекарств против его симптомов.
Уязвимые контингенты
В соответствии со статистикой по эпидемической распространенности СПИДа установлено, что в последнее время происходит развитие эпидемии заболевания. Данные свидетельствуют о том, что случаи заболеваемости ВИЧ-инфекцией зарегистрированы по всему земному шару, в том числе и в развитых странах. Особенно часто обнаруживается инфекция в регионах с низким уровнем развития. К ним относятся страны Африки и Карибские острова. Количество ВИЧ-инфекции в этих регионах наиболее высокое.
Восприимчивость человека к вирусу очень высокая. Из-за специфики передачи патологии число инфицированных значительно больше среди взрослых пациентов, однако иногда регистрируются и случаи заражения в детском возрасте. Специалисты выделяют также среди контингента, пораженного ВИЧ, социальные факторы, влияющие на вероятность инфицирования. В особые группы риска входят следующие пациенты:
- Наркоманы, употребляющие внутривенные наркотики;
- Гомосексуальные пары;
- Пациенты, которым проводилось переливание крови;
- Люди, состоящие в связи с ВИЧ-инфицированными;
- Дети матерей, у которых есть СПИД.
Вероятность заражения вирусом в этих группах значительно выше, чем в целом по популяции.
Этиология
Возбудителем заболевания является вирус иммунодефицита человека, который входит в группу ретровирусов. Он содержит две молекулы РНК и белковый капсид, на который организм человека вырабатывает антитела против ВИЧ. В состав молекулы входит особый фермент – обратная транскриптаза. Ее активность обеспечивает перевод вирусной РНК в ДНК, которая может внедряться в генетический материал человека и вызывать инфекционные заболевания.
Патогенез
Вирусная активность направлена против иммунных клеток организма человека. Патогенные частицы внедряются в лимфоциты, макрофаги и моноциты, нарушая их работу. Основной мишенью вируса являются так называемые CD4+-лимфоциты, которые являются «хелперными» клетками. Именно они обеспечивают узнавание и запоминание патогенных микроорганизмов. Без хелперных клеток иммунитет пациента не может адекватно реагировать на бактерий и вирусов, поэтому в организме появляется большое количество инфекционных процессов.
Клинические проявления СПИДа
В течении заболевании выделяют несколько основных стадий:
- Инкубационный период;
- Первичные проявления патологии;
- Появление вторичных сопутствующих заболеваний;
- Терминальная стадия.
Стадия первичных проявлений характеризуется развитием острой инфекции. У пациента может возникать лихорадка, головная боль, слабость. Частым клиническим проявлением болезни является увеличение всех групп лимфатических узлов – генерализованная лимфоаденопатия. На данном этапе заподозрить наличие ВИЧ практически невозможно, так как симптомы заболевания являются неспецифичными. Поводом обратиться к врачу является длительное сохранение симптомов (в течение нескольких месяцев) и их устойчивость к обычному лечению.
Особенность ВИЧ-инфекции заключается в том, что более поздние симптомы заболевания в первую очередь с сопутствующими заболеваниями. Из-за того, что иммунитет человека неустойчив к инфекциям, он не может справиться с теми возбудителями, которые легко уничтожаются здоровым организмом. Поэтому у больного возникают специфические заболевания, которые считаются маркерами СПИДа. К ним относятся:
- Повторные фарингиты и синуситы;
- Пневмоцистная пневмония;
- Саркома Капоши;
- Волосистая лейкоплакия;
- Туберкулез;
- Опоясывающий лишай;
- Криптококкоз;
- Токсоплазмоз;
- Цитомегаловирусная инфекция.
Возникновение этих патологий является поводом для срочного обращения к врачу. На фоне иммунодефицита также развиваются злокачественные опухоли, например, лимфома. При длительном течении заболевания поражают жизненно важные органы. Эти изменения характерны для терминальной стадии заболевания.
ВИЧ и СПИД: в чем разница, как расшифровывается СПИД?
Необходимо дифференцировать такие понятия, как ВИЧ-инфекция и СПИД. Эти состояния являются последовательными стадиями поражения вирусом. После заражения инфекция проникает в организм человека и начинает распространяться по лимфоцитарным клеткам. На начальных этапах серьезных расстройств со стороны защитной функции не наблюдается, резервы организма справляются с инвазией. На этой стадии заболевание называется ВИЧ-инфекцией. Клинически она сопоставима с периодом первых проявлений заболевания.
После длительного пребывания вируса в организме развивается иммунодефицит – недостаточность защитной системы, на фоне которой появляются сопутствующие заболевания. Этот процесс начинается спустя несколько лет после инфицирования. Возникновение заболеваний-маркеров, поражающих иммунную систему человека, – это признак того, что патология перешла в стадию СПИДа.
ВИЧ-инфицированный и ВИЧ-положительный больной
ВИЧ-инфицированный и ВИЧ-положительный пациент – это схожие понятия, однако между ними есть определенная разница. При попадании в организм вируса иммунодефицита люди становятся ВИЧ-инфицированными. Однако в этот период диагностировать присутствие патологического агента в организме невозможно, так как после инвазии наступает инкубационный период. В это время количество частиц вируса еще недостаточно, чтобы определить их с помощью лабораторных методик диагностики.
Спустя несколько месяцев период инкубации заканчивается, в организме накапливается большое количество возбудителей, которых можно обнаружить с помощью специальной диагностики. Если пациент прошел исследование, и диагноз подтвердился, то его можно считать ВИЧ-положительным.
Источник заражения ВИЧ
Заражение инфекцией возможно только от больного человека посредством инфицированной крови и других биологических жидкостей. Основным резервуаром вируса являются пациенты, которые находятся на той или иной стадии развития заболевания. Риск инфицирования значительно повышается, если человек постоянно находится в контакте с ВИЧ-положительным больным.
Факторы передачи ВИЧ
Факторами передачи ВИЧ-инфекции являются биологические жидкости больного человека, обсемененные вирусными частицами. Патологические агенты могут содержаться в:
- Крови;
- Сперме;
- Слюне;
- Женском молоке;
- Ликворе (спинномозговой жидкости);
- Менструальной крови;
- Вагинальных выделениях.
Наиболее распространенным фактором передачи заболевания является кровь зараженного человека.
Устойчивость возбудителя
Вирус иммунодефицита человека очень чувствителен к каким-либо воздействиям со стороны внешней среды. Он быстро инактивируется при температуре 50-70 градусов. Вирус можно уничтожить с помощью спирта и других растворителей. Однако он продолжительное время сохраняется в крови, предназначенной для переливания. С этим связано большое количество случаев ВИЧ при использовании непроверенной донорской крови.
Как передается ВИЧ?
Для распространения инфекции необходим контакт человека с инфицированным пациентом. Если течение ВИЧ достигло активной фазы, то человек может передать вирус с биологическими жидкостями.
Пути передачи ВИЧ-инфекции
Основными путями передачи возбудителя являются:
- Половой путь – распространение вируса в ходе сексуального контакта через выделяющуюся сперму. При агрессивном половом акте возможно появление крови, которая также дает возможности передачи ВИЧ.
- Артифициальный путь – искусственное заражение пациента. В эту группу входит заражение через внутривенные инъекции. Внедрение вируса возможно также при переливании крови или плазмы из непроверенных источников.
- Вертикальный путь – проникновение вируса в организм через контакт ребенка с инфицированной матерью. Инфекция может передаваться через плаценту, во время родов или в период грудного вскармливания.
Все пути распространения являются одинаково опасными для человека.
Локализация возбудителя в пораженном организме
При проникновении в организм вирус поражает клетки иммунной системы, которые могут распространяться в различные ткани. Помимо крови, частицы возбудителя обнаруживаются в нервной системе, кишечнике, внутренней оболочке сосудов. Активность вируса затрагивает практически все органы человеческого тела.
Группы риска по ВИЧ
Группы риска по ВИЧ – это особые социальные группы, в которые входят пациенты с максимально высокой заболеваемостью инфекцией. К ним относятся наркоманы, гомосексуалисты, люди, часто меняющие половых партнеров.
Факторы риска ВИЧ-инфицирования
Факторы риска по ВИЧ можно разделить на несколько основных групп. К ним относятся поведенческие, биологические и психологические факторы. Отдельно стоит выделить нарушения факторов свертывания крови, имеющиеся у пациентов с гемофилией, васкулитами и другими распространенными патологиями. Однако необходимо учитывать и другие способы передачи, так как вирус может обнаруживаться не только в крови.
Факторы риска, связанные с поведением больного
Статистика показывает, что распространенность ВИЧ-инфекции в среде гомосексуалистов довольно высока. Это связано с особенностью половых сношений у данных пациентов. На фоне сексуального акта более вероятна травматизация слизистых и появление крови, через которую передаются частицы вируса.
Однако не стоит считать, что только гомосексуалисты болеют ВИЧ. Передача инфекции возможна и гетеросексуальных контактах, так как вирус может обнаруживаться и в других биологических материалах – сперме или вагинальном секрете.
Биологические факторы риска инфицирования ВИЧ
К биологическим факторам риска относится рождение ребенка у ВИЧ-инфицированной матери. Заражение возбудителями СПИДа наиболее вероятно при нарушении со стороны ведения родов и послеродового периода. Больным женщинам рекомендуется проводить кесарево сечение, чтобы исключить риск заражения ребенка при прохождении через родовые пути. Другим фактором риска является кормление младенца. Если мать отказывается прекратить грудное вскармливание, то вероятность заражения ребенка значительно повышается.
Психологические факторы риска инфицирования ВИЧ
К психологическому риску заражения ВИЧ относятся особенности полового поведения человека. Если пациент часто меняет половых партнеров, вступает в сомнительные связи, то вероятность заражения при таком образе жизни значительно повышается.
В каких случаях нельзя заразиться ВИЧ?
Заразиться ВИЧ и другими вирусами невозможно при:
- Поцелуях;
- Объятиях;
- Рукопожатиях.
Вирус быстро уничтожается во внешней среде, поэтому контакт с личными вещами больного также не приведет к инфицированию.
Диагноз СПИД
Для подтверждения СПИДа разработан ряд исследований, которые позволяют обнаружить характерные изменения в организме. Специфический признак иммунодефицита в системе Т-лимфоцитов – уменьшение количества хэлперных клеток. В норме они должны определяться в большой концентрации не только в крови, но и в тканях. При недостаточном уровне иммунокомпетентных клеток необходимо заподозрить наличие СПИДа.
Лечение СПИДа
Терапия заболевания должна быть комплексной. Для больных ВИЧ-инфекцией важно не только использование специальных медикаментов, но и соблюдение правил здорового питания. Полноценное лечение обеспечит коррекцию нарушений, характерных для каждого периода болезни, благодаря чему нормализуется состояние пациента.
Рейтинг
( 1 оценка, среднее 5 из 5 ) 0 Понравилась статья? Поделиться с друзьями: Вам также может быть интересно 0 Плакаты на тему ВИЧ и СПИД, готовые макеты и слоганы 2 Можно ли ставить импланты при ВИЧ и о чем можно не говорить врачу 0 Четвертая стадия ВИЧ, что нужно знать о ней 0 Патогенез ВИЧ, особенности развития, методы лечения и профилактики 0 ВИЧ положительный, как это проявляется и что делать заболевшему 2 Вероятность заражения ВИЧ при неопределяемой вирусной нагрузке Добавить комментарий
Имя
Комментарий
Свежие записи
- Коронавирус#оставайтесьдома
- Как провести тест на ВИЧ в домашних условиях, несколько вариантов исследований
- Различные риски заражения ВИЧ инфекцией, обобщающая информация
- Пересадка костного мозга с мутирующим геном помогает полностью вылечить ВИЧ
- Симптомы ВИЧ, как распознать болезнь
- Политика конфиденциальности
- Карта сайта
© 2020 ВИЧ – серийный убийца
ВИЧ: причины появления, симптомы, диагностика и способы лечения.
Определение
ВИЧ (вирус иммунодефицита человека) – инфекционное хроническое заболевание, передающееся контактным путем, медленно прогрессирующее и характеризующееся поражением иммунной системы с развитием синдрома приобретенного иммунодефицита (СПИДа). СПИД – это финальная стадия ВИЧ-инфекции, когда из-за ослабленной иммунной системы человек становится беззащитным перед любыми инфекциями и некоторыми видами рака. Опасность представляют так называемые оппортунистические инфекции – заболевания, вызываемые условно-патогенной или непатогенной флорой: вирусами, бактериями, грибами, которые у здоровых людей не приводят к серьезным последствиям или протекают легко и излечиваются самостоятельно. При СПИДе они наслаиваются друг на друга, имеют затяжное течение, плохо поддаются терапии и могут стать причиной летального исхода.
Причины появления ВИЧ
Источником инфекции является человек, инфицированный ВИЧ, на любых стадиях заболевания. Вирус передается через кровь, сперму, секрет влагалища, грудное молоко.
Половой путь (незащищенный секс с инфицированным партнером) – доминирующий фактор распространения ВИЧ-инфекции.
Передача ВИЧ от матери ребенку может произойти на любом сроке беременности (через плаценту), во время родов (при прохождении через родовые пути) и грудного вскармливания (при наличии язвочек, трещин на сосках матери и во рту ребенка).
Высокий риск инфицирования существует при внутривенном введении наркотических веществ нестерильными шприцами, при переливании ВИЧ-инфицированной крови и ее препаратов, использовании медицинского и немедицинского инструментария, загрязненного биологическими жидкостями человека, инфицированного ВИЧ. Кроме того, опасность могут представлять органы и ткани доноров, используемые для трансплантации.

Попадая в кровоток, вирус проникает в Т-лимфоциты хелперы, или CD-4 клетки (рановидность лейкоцитов), которые помогают организму бороться с инфекциями. Т-хелперы имеют на поверхности так называемые CD4-рецепторы. ВИЧ связывается с этими рецепторами, проникает в клетку, размножается в ней и в конечном счете уничтожает ее. Со временем вирусная нагрузка увеличивается, а количество Т-хелперов снижается.
При отсутствии лечения через несколько лет из-за значительного снижения числа Т-хелперов появляются связанные со СПИДом состояния и симптомы.
Классификация заболевания
- Стадия инкубации – от момента заражения до появления реакции организма в виде клинических проявлений острой инфекции и/или выработки антител (специфических белков, продуцируемых в ответ на проникновение антигена, в данном случае – вируса).
- Стадия первичных проявлений клинических симптомов:
а) бессимптомное течение (симптомов нет, вырабатываются антитела);
б) острая ВИЧ-инфекция без вторичных заболеваний: наблюдается увеличение лимфоузлов, повышение температуры, фарингит, высыпания на коже и слизистых оболочках, реже – увеличение печени, селезенки, диарея;
в) острая ВИЧ-инфекция с вторичными заболеваниями (ангиной, бактериальной пневмонией, кандидозом, герпетической инфекцией и др.). Эти проявления, как правило, слабо выражены, кратковременны, поддаются терапии. - Субклиническая стадия – единственным клиническим проявлением заболевания является увеличение лимфатических узлов.
- Стадия вторичных заболеваний:
а) потеря массы тела менее 10%, грибковые, вирусные, бактериальные поражения кожи и слизистых, повторные фарингиты, синуситы, опоясывающий лишай;
б) потеря массы тела более 10%, диарея или лихорадка более месяца, повторные стойкие вирусные, бактериальные, грибковые, протозойные (вызванные простейшими) поражения внутренних органов, локализованная саркома Капоши (множественные злокачественные новообразования на коже и слизистых), повторный или генерализованный (по всему телу) опоясывающий лишай;
в) кахексия (истощение), генерализованные вирусные, бактериальные, грибковые, протозойные, паразитарные заболевания, пневмоцистная пневмония, туберкулез, злокачественные опухоли, поражения центральной нервной системы. - Терминальная стадия – имеющиеся вторичные заболевания приобретают необратимый характер, летальный исход наступает в течение нескольких месяцев после их развития.
Симптомы ВИЧ/СПИДа
После инкубационного периода продолжительностью от нескольких дней до нескольких недель у большинства зараженных возникает острое заболевание с гриппоподобными симптомами (повышение температуры тела, ломота, общая слабость, отсутствие аппетита, головная боль, боль в горле, увеличение лимфатических узлов, кожные высыпания). Возможны похудание, образование язвочек на слизистой полости рта. Эта фаза продолжается, как правило, 7-10 дней. Из-за неспецифичности проявлений диагноз «ВИЧ» устанавливается редко. Редко на этой стадии заболевания фиксируются оппортунистические инфекции,. отмечается кашель с мокротой, боль в грудной клетке (при развитии пневмонии), болезненные пузырьковые высыпания на коже (при опоясывающем герпесе). Как правило, самочувствие быстро нормализуется без специфического лечения ВИЧ.
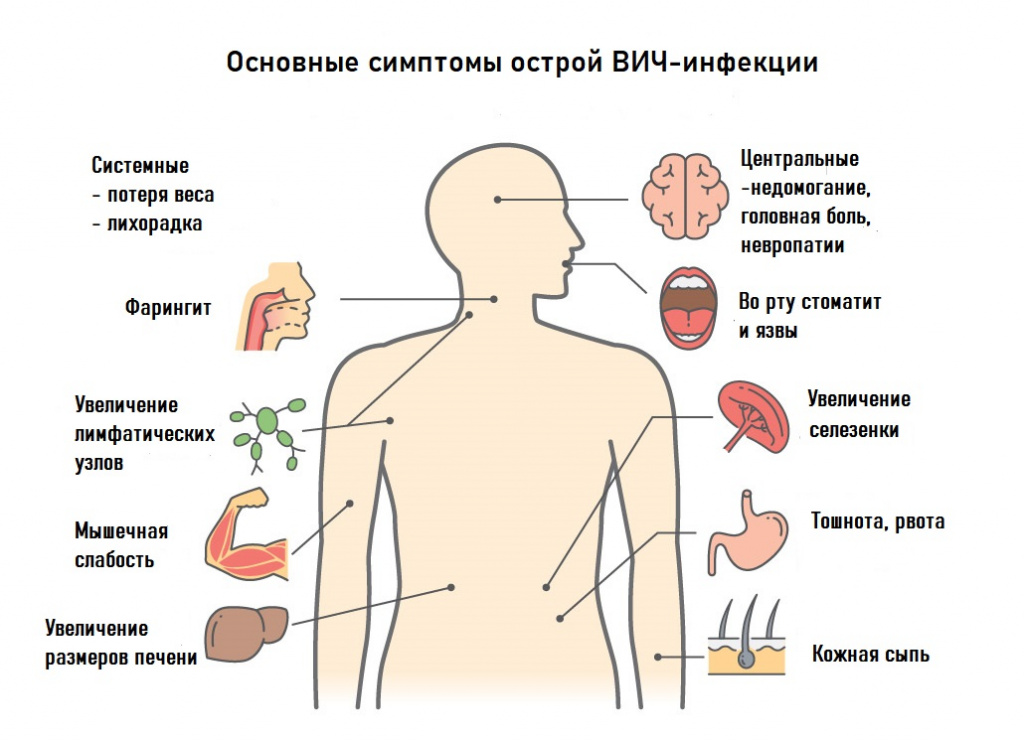
После этой стадии устанавливается временное равновесие между инфекционным процессом и сдерживающим его развитие противовирусным иммунитетом.
В течение длительного времени (8-10 лет и более) инфекция протекает бессимптомно или с персистирующей генерализованной лимфаденопатией – сохраняющимся не менее 3 месяцев увеличением минимум двух групп лимфоузлов.
В дальнейшем продолжается активное размножение вируса и разрушение Т-лимфоцитов, развивается стадия вторичных изменений, для которой характерно прогрессирующее снижение веса, общая слабость, стойкое повышение температуры, озноб, выраженная потливость. Клинические проявления оппортунистических заболеваний обусловливают клиническую картину этой стадии: пациентов беспокоят кашель и одышка, тошнота, рвота, боли в животе, тяжелая диарея, кожные высыпания, сильные головные боли, снижение памяти и внимания и др.
Диагностика ВИЧ
Лабораторные методы исследования:
- Скрининг на ВИЧ.
- Обследование, подтверждающее факт инфицирования ВИЧ (при положительных или сомнительных результатах скрининга).
- Измерение и контроль количества вируса в крови человека – определение вирусной нагрузки у лиц с установленным диагнозом «ВИЧ».
- Определение иммунного статуса у пациентов с ВИЧ-инфекцией.
Скрининг (обследование здоровых людей) на ВИЧ должен быть проведен любому человеку, который считает, что может быть заражен, а также перед любой госпитализацией и операцией, всем беременным женщинам и их половым партнерам.
Обследование целесообразно проходить людям с высоким риском заражения ВИЧ, например, при наличии заболеваний, имеющих одинаковый с ВИЧ-инфекцией механизм передачи (вирусные гепатиты В и С, заболевания, передающиеся половым путем), лицам, имеющим регулярные незащищенные половые контакты, инъекционным наркоманам, детям, рожденным от матерей с ВИЧ-инфекцией, медицинским работникам, напрямую контактирующим с кровью на работе и др.
Существуют экспресс-тесты для скрининга ВИЧ, которые можно делать в домашних условиях. Для определения специфических антител/антигенов к ВИЧ (ВИЧ-1, 2, антиген p24) используют кровь, слюну или мочу. Точность любого экспресс-теста ниже, чем теста, проводимого в лаборатории.
Для стандартного скринингового обследования определяют антитела к ВИЧ 1 и 2 и антиген ВИЧ 1 и 2 (HIV Ag/Ab Combo) в крови с помощью иммуноферментного анализа (ИФА).
В случае положительного или сомнительного результата для исключения ошибки проводят подтверждающие тесты для выявления антител к отдельным наружным и внутренним белкам вируса (иммунный блот) и/или определения нуклеиновой кислоты ВИЧ-1.
Определение вирусной нагрузки выполняют, когда человеку впервые ставится диагноз, чтобы установить статус заболевания, и в последующем через определенные промежутки времени для контроля эффективности лечения.
В начале заболевания и в процессе лечения для оценки состояния иммунной системы измеряют количество Т-лимфоцитов хелперов и соотношение Т-лимфоцитов хелперов и Т-лимфоцитов киллеров.
Дополнительно проводят клинический анализ крови, расширенный биохимический анализ крови: АСТ, АЛТ, креатинин, холестерин общий, глюкоза, общий белок, обследование на другие инфекции, имеющие схожие с ВИЧ пути передачи.
Креатинин (в крови) (Creatinine)
Синонимы: Анализ крови на креатинин; Сывороточный креатинин; Креатинин сыворотки, оценка СКФ. Сreat; Сre; Blood Creatinine; Serum Creatinine; Serum Creat.
Краткая характеристика определя�…
Глюкоза (в крови) (Glucose)
Материал для исследования
Сыворотка или плазма крови. Если нет возможности центрифугировать пробу через 30 минут после взятия для отделения сыворотки/плазм…
Общий белок (в крови) (Protein total)
Синонимы: Общий белок сыворотки крови; Общий сывороточный белок.
Total Protein; Serum Тotal Protein; Total Serum Protein; TProt; ТР.
Краткая характеристика определяемого вещества Общий бе�…
Постановка диагноза «ВИЧ» не подразумевает специального инструментального обследования, но его выполняют для диагностики вторичных заболеваний, которые могут влиять на тактику лечения и на исход терапии. Это рентгенография органов грудной клетки, УЗИ органов брюшной полости.
К каким врачам обращаться
ВИЧ может быть заподозрен врачом любой специальности, чаще
терапевтом
или врачом общей практики при наличии определенных жалоб пациента или при плановом лабораторном обследовании.
Основным специалистом, который занимается углубленной диагностикой, проводит динамическое наблюдение и лечение заболевания, является врач-инфекционист.
Лечение ВИЧ
В настоящее время основой терапии пациентов с ВИЧ-инфекцией является антиретровирусная терапия (АРТ) – комбинация нескольких противовирусных препаратов, которые подавляют размножение вируса, воздействуя на разные этапы его жизнедеятельности, защищают и восстанавливают клетки иммунной системы.
Раннее начало лечения позволяет достичь не только улучшения клинического прогноза заболевания, но и снижения уровня распространенности ВИЧ-инфекции в популяции.
Цель АРТ – увеличение продолжительности и сохранение или улучшение качества жизни пациентов; снижение контагиозности (заразности) пациента, что значительно уменьшает риск передачи ВИЧ.
Основная задача терапии – максимальное подавление размножения ВИЧ, что сопровождается снижением содержания РНК ВИЧ в крови (вирусной нагрузки) до неопределяемого методом ПЦР уровня и, как следствие, увеличением количества Т-лимфоцитов.
Лекарственная терапия всегда проводится с согласия пациента. Лечение должно быть непрерывным и проводиться пожизненно. Перерывы в лечении могут привести к увеличению вирусной нагрузки, повышению риска развития лекарственной устойчивости (невосприимчивости вируса к противовирусному лечению), снижению иммунной функции и прогрессированию заболевания.
Осложнения
Осложнениями ВИЧ чаще всего являются разнообразные оппортунистические инфекции и злокачественные опухоли (саркома Капоши, лимфома).
Профилактика ВИЧ
Вакцины и лекарства, которое излечивает ВИЧ-инфекцию, на сегодняшний день не существует. Ранняя диагностика ВИЧ, избегание действий с высоким риском заражения чрезвычайно важны для предотвращения распространения инфекции.
Лечение ВИЧ-инфицированных матерей во время беременности, меры предосторожности при родах и отказ от грудного вскармливания могут значительно снизить риск передачи инфекции от матери ребенку.
ВИЧ-негативным лицам, подверженным высокому риску заражения (гомосексуалистам, трансгендерам, работникам коммерческого секса, потребителям инъекционных наркотиков, а также неинфицированным ВИЧ сексуальным партнерам больных с установленным диагнозом), следует использовать метод доконтактной профилактики – прием лекарственных препаратов от ВИЧ-инфекции.
Медицинским работникам, контактирующим с кровью, необходимо соблюдать универсальные методы предосторожности.
Источники:
- Клинические рекомендации. ВИЧ-инфекция у взрослых. Национальная ассоциация специалистов по профилактике, диагностике и лечению ВИЧ-инфекции. 2019, 212 с.
- ВИЧ-инфекция и СПИД. Национальное руководство под редакцией академика РАН В.В. Покровского. 2-е издание переработанное и дополненное. Москва, Издательская группа «ГЭОТАР-Медиа». 2020, 686 с.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Информация проверена экспертом

Лишова Екатерина Александровна
Высшее медицинское образование, опыт работы – 19 лет
Поделитесь этой статьей сейчас
Рекомендации
-
6026
14 Мая
-
6033
14 Мая
-
6005
14 Мая
Похожие статьи
Герпес
Герпес: причины появления, симптомы, диагностика и способы лечения.
Конъюнктивит
Конъюнктивит: причины появления, классификация, симптомы, диагностика и способы лечения.
Блефарит
Блефарит: причины появления, симптомы, диагностика и способы лечения.
