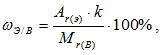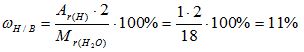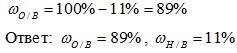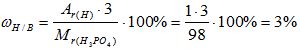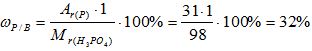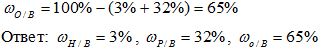За окном – дождь и пронизывающий ветер. Холодно. В такую погоду музы особенно активны. Они слетаются в гости и садятся ко мне на плечо. На правое. Сразу все. И, свесив ноги, начинают болтать друг с другом. Я им уже не нужна. Ребята, о чем это вы? Мне, как и вам, тоже хочется чая с имбирем. И шоколада. И венских вафель. Но я обещала написать статью (и не одну) о массовой доле элемента. Такие расчеты очень важны для развития логических основ алгоритмики. Умение определять массовую долю (или компоненты системы по известной массовой доле) пригодится и во время учебы в медицинском, и во врачебной практике. Поэтому, берем тетрадку, ручку, карандаш и ластик, читаем статью и записываем вместе со мной решение задач. Вначале, как всегда, теория практики. Разберемся с основными понятиями.
Доля – часть чего-нибудь (толковый словарь С.И. Ожегова)
Массовая доля – число, показывающее отношение массы части к общей массе целого или по-другому, отношение массы компонента системы к массе всей системы. Эта величина обозначается греческой буквой “омега” и может выражаться в долях единицы или в процентах.
Например, мы купили у бабули на рынке ведро яблок и груш общей массой 10 кг. Дома разделили фрукты на две кучки. Масса груш составила 3 кг. Значит, массовая доля груш 3/10 = 0,3 (30%). Вспомнили, как рассчитать массовую долю? Отлично! Поехали дальше.
Массовая доля элемента в соединении – число, показывающее, какую часть составляет масса всех атомов данного элемента в молекуле вещества от общей массы молекулы, определяется отношением массы атомов к массе молекулы. Разберемся на примере конкретной задачи
Задача 1
Определите массовую долю железа в оксиде железа (III)
Записываем формулу массовой доли в общем виде, затем конкретизируем ее. Читаем внимательно и следим за моими руками. Массовая доля элемента в соединении определяется отношением массы атомов (числитель) к массе молекулы (знаменатель), то есть:
1) в числителе мы работаем с атомами того элемента, чью массовую долю определяем, для этого умножаем атомную массу элемента (молярная масса атомов) на число атомов этого элемента
2) в знаменателе мы записываем молярную массу вещества
Это очень легкая прямая задача. Попробуем решить обратные задачи – по известной массовой доле определяем неизвестный элемент (вернее, его атомную массу), либо неизвестное число атомов углерода в общей формуле класса органических веществ.
Задача 2
Соединение элемента имеет формулу Э2О3, массовая доля элемента в нем 68,42%. Установите элемент.
Для определения неизвестного элемента необходимо рассчитать его атомную массу (молярную массу атомов), а затем по Периодической системе химических элементов Д.И. Менделеева по атомной массе определяем химический элемент.
Алгоритм решения задачи строим на основании алгебраической формулы определения массовой доли элемента в соединении. Атомную массу элемента обозначаем как неизвестное Х. В числителе записываем массу атомов того элемента, чья массовая доля представлена в условии, в знаменателе – молярную массу вещества в общем виде. Решаем уравнение. По рассчитанной атомной массе определяем элемент. Это хром. Записываем формулу и называем вещество.
Задача 3
Оксид неизвестного пятивалентного элемента содержит 56,34% кислорода. Определите этот элемент.
Задача 4
Массовая доля водорода в алкине CnH2n-2 составляет 12,2 %. Определите число атомов углерода
Алгоритм решения задачи строим на основании алгебраической формулы определения массовой доли элемента в соединении. В числителе записываем массу атомов того элемента, чья массовая доля представлена в условии, в знаменателе – молярную массу вещества в общем виде. Решаем уравнение, определяем неизвестное n, записываем формулу, называем вещество. Это гексин.
Задача 5
Массовая доля водорода в молекуле алкина CnH2n-2 равна 11,11 %. Определите число атомов углерода
Если вы думаете, что все так просто, вы очень и очень ошибаетесь. То ли еще будет! Гораздо более веселые задачи вас ожидают в следующей статье – “Массовая доля элемента в соединении”. Но это будет завтра. Сегодня музы устали от пустой болтовни и улетели в теплые края. А я, довольная проделанной работой, иду пить чай с имбирем, лимоном и медом! Чего и вам желаю.
Приходите ко мне на занятия, и вы будете поражены тем, что всего за ТРИ ЧАСА сможете усвоить объем знаний, намного превышающий тот, который вам вкладывали в голову на протяжении ТРЕХ ЛЕТ! Занятие будет проходить динамично, интересно, весело, но главное, РЕЗУЛЬТАТИВНО! Вы блестяще сдадите ЕГЭ по химии и станете студентом престижного медицинского ВУЗа!
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
Расчёт массовой доли химических элементов по формуле вещества
Формула для вычисления массовой доли элемента в веществе
Зная химическую формулу, можно вычислить массовую долю химических элементов в веществе. Массовая доля элемента в вещества обозначается греч. буквой «омега» – ωЭ/В и рассчитывается по формуле:
где k – число атомов этого элемента в молекуле.
Задача 1
Какова массовая доля водорода и кислорода в воде (Н2О)?
Решение:
1) Вычисляем относительную молекулярную массу воды:
Mr(Н2О) = 2*Аr(Н) + 1*Аr(О) = 2*1 + 1* 16 = 18
2) Вычисляем массовую долю водорода в воде:
3) Вычисляем массовую долю кислорода в воде. Так как в состав воды входят атомы только двух химических элементов, массовая доля кислорода будет равна:
Рис. 1. Оформление решения задачи 1
Задача 2
Рассчитайте массовую долю элементов в веществе H3PO4.
Решение:
1) Вычисляем относительную молекулярную массу вещества:
Mr(Н3РО4) = 3*Аr(Н) + 1*Аr(Р) + 4*Аr(О)= 3*1 + 1* 31 +4*16 = 98
2) Вычисляем массовую долю водорода в веществе:
3) Вычисляем массовую долю фосфора в веществе:
4) Вычисляем массовую долю кислорода в веществе:
Последнее изменение: Воскресенье, 15 Октябрь 2017, 21:29
Назад
Массовая доля химического элемента в соединении
Урок посвящен изучению понятия «массовая доля химического элемента в веществе». Вы научитесь рассчитывать массовую долю элемента в веществе.
I. Понятие “массовая доля химического элемента”
Представьте, что вам предстоит поровну разделить еще с четырьмя друзьями яблочный пирог. Вес пирога – 500г. Кусок какой массы достанется каждому? Масса каждого куска будет равна 100 г. Долю одного куска от всего пирога можно вычислить, разделив массу куска на массу всего пирога, т.е. 100/500 = 1/5 или 20%.
Массовая доля части от целого – отношение массы части к массе целого. Массовая доля обозначается буквой греческого алфавита («омега») – ω. Измеряется массовая доля в долях или %. Она принимает значения от 0 до 1 или 0 до 100%.
Массовая для элемента в данном веществе (w) – отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле к относительной молекулярной массе вещества.
Понятие «массовая доля» применимо и в химии: можно вычислять массовую долю химического элемента в веществе.
w(элемента) = (n· Ar(элемента) · 100%) / Mr(вещества)
w – массовая доля элемента в веществе,
n – индекс в химической формуле,
Ar – относительная атомная масса,
Mr – относительная молекулярная масса вещества.
Массовые доли выражают в процентах или в долях:
w(элемента) = 20% или 0,2.
II. Алгоритм решения задач
Задача: вычислите массовые доли элементов в фосфорной кислоте, имеющей простейшую химическую формулу H3PO4, с точностью до сотых.
|
Дано: Фосфорная кислота H3PO4 |
Решение: 1. Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав фосфорной кислоты Ar(H)=1 2. Вычисляем относительную молекулярную массу соединения Mr(H3PO4) = 3·Ar(H) + Ar(P) + 4·Ar(O) = 3·1 + 31 + 4·16 = 98 3. Вычисляем массовые доли элементов по формуле: w(элемента) = (n· Ar(элемента) · 100%) / Mr(вещества) w(H) = n(H)·Ar(H)·100% / Mr(H3PO4) = 3·1·100% / 98 = 3,06% w(P) = n(P)·Ar(P)·100% / Mr(H3PO4) = 1·31·100% / 98 = 31,63% w(O) = n(O)·Ar(O)·100% / Mr(H3PO4) = 4·16·100% / 98 = 65,31% Проверка Сумма значений массовых долей всех элементов должна составить 100% w(H) + w(P) + w(O) = 100% Подставляем значения, 3,06% + 31,63% + 65,31% = 100% Таким образом, массовые доли элементов в фосфорной кислоте вычислены правильно. |
|
Найти: w%(H) w%(P) w%(O) |
Ответ: w(H) = 3,06% w(P) = 31,63% w(O) = 65,31% |
III. Работа с тренажерами
Тренажёр 1
Тренажёр 2
Статьи
Линия УМК О. С. Габриеляна. Химия (8-9)
Химия
Массовая доля вещества
Ребятам, впервые пришедшим на урок химии, кажется: «Ух, какой отличный предмет. Столько разноцветных баночек и скляночек в лабораторном ящике. Вот сейчас я как нахимичу, друзья ахнут и выпадут в осадок».
Однако, при виде ровных рядков непонятных формул на доске энтузиазм у ребят испаряется быстрее, чем происходит взгонка кристаллов йода. Если подходить к химии, как к науке, которой нет места в реальной жизни, и просто заучивать ряды формул, то интерес может умереть очень быстро.
10 января 2019
Но все становится намного веселее, если поискать примеры химических реакций вокруг нас.
Костер в летнем походе, сквашивание овощей, изменение вкуса любимых блюд с помощью соли или сахара — это все химия.
Сегодня мы разберем одну из базовых тем «Массовая доля вещества в растворе».
Если хорошо изучить тему и научиться быстро решать задачи, можно не только определить, сколько ложек сахара бабушка добавила в свой чай, но и находить ответы на сложные криминалистические задачи.
Но перед тем, как приступить к практической части, стоит разобраться с теорией.
ОСНОВНЫЕ ТЕРМИНЫ
Основными терминами в этой теме будут:
-
Раствор — однородная смесь различных веществ в жидком виде.
-
Компоненты — вещества, которые подлежат смешиванию для получения раствора.
-
Растворитель — жидкий компонент, к которому добавляют субстанции для получения раствора.
-
Растворенное вещество — твердые или жидкие вещества, которые добавляют к растворителю для получения раствора.
-
Массовая доля — отношение массы вещества к массе раствора, в котором оно содержится.
-
Концентрация — отношение количества растворенного вещества к растворителю, выраженное в процентах.
Когда мы смешиваем между собой жидкости, которые идеально растворяются друг в друге, например воду и спирт, то можем любой из этих компонентов считать растворителем. Однако традиционно в водных растворах вода является растворителем, а второй ингредиент — растворенным веществом.
НЕОБХОДИМЫЕ ФОРМУЛЫ
Массовая доля вещества обозначается буквой греческого алфавита ω — омега. Чтобы ее определить, используется формула для вычисления массовой доли вещества.
ω (в-ва)= m (в-ва)/ m (р-ра) (1)
В этом равенстве массовая доля принимает значение от 0 до 1.
Однако в задачах чаще используется процентное соотношение, которое получается по следующей формуле:
ω (в-ва)= m (в-ва)/ m (р-ра)*100% (2)
Масса раствора равна сумме его компонентов.
m (р-ра)=m (в-ва)+m (р-ля) (3)
В случае двухкомпонентного раствора массовая доля растворенного вещества и массовая доля растворителя в сумме дают 100%
ω (в-ва)+ω (р-ля)=100% (4)
Масса раствора находится сложением масс компонентов, входящих в раствор
m (р-ра)=m (в-ва)+m (р-ля)(5)
Для успешного решения задачи на определение массовой доли вещества в растворе следует вспомнить еще одну формулу, которая связывает массу вещества, его объем и плотность.
m (в-ва)=p(в-ва)*V(в-ва) (6)
Напомним, что плотность воды составляет 1 г/мл. Это значит, что 100 мл воды весит ровно 100 гр.
Если возникает недопонимание теоретической части, более подробно теория изложена в учебнике «Химия. 8 класс» под редакцией О. С. Габриеляна, который можно найти на портале электронных учебников LECTA
#ADVERTISING_INSERT#
Как найти омега в Химии?
Ученик
(116),
закрыт
7 лет назад
Вячек
Высший разум
(391245)
8 лет назад
Буквой “w” (греческая “омега”) в химии обычно обозначают массовую долю – или вещества в растворе, или элемента в сложном веществе. Для обоих случаев существую стандартные формулы:
1) w(в-ва) = m(в-ва) /m(р-ра)
2) w(эл-та) = n*Ar(эл-та) /M(в-ва), где n – количество атомов элемента в веществе, Аr – относительная атомная масса элемента (берётся в таблице Менделеева), Mr – относительная молекулярная масса сложного вещества