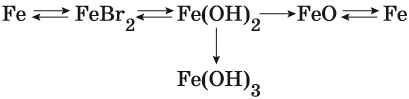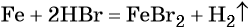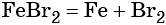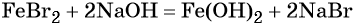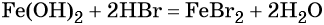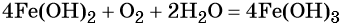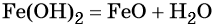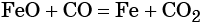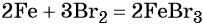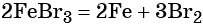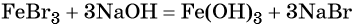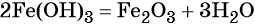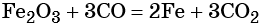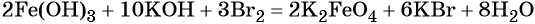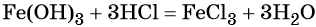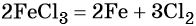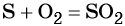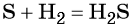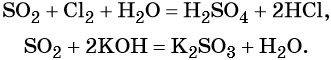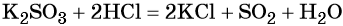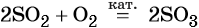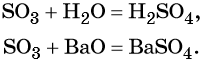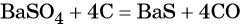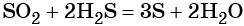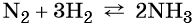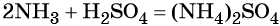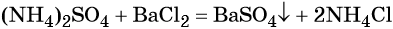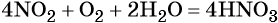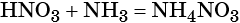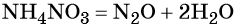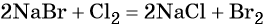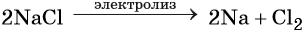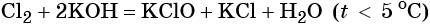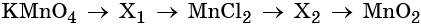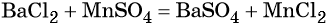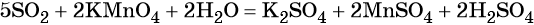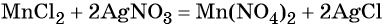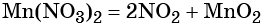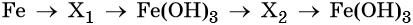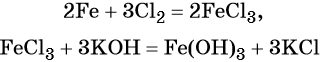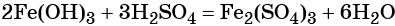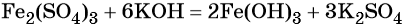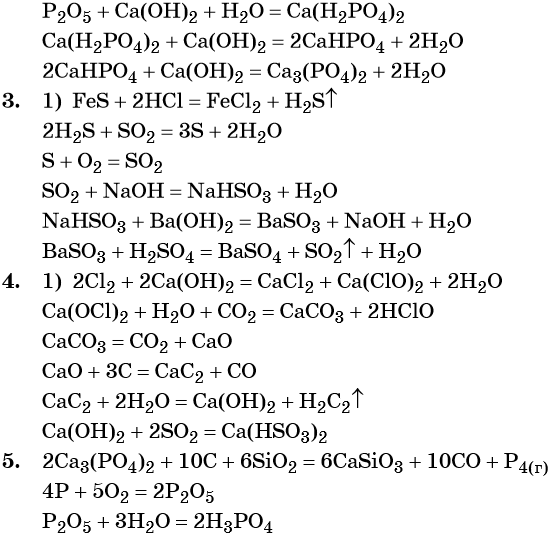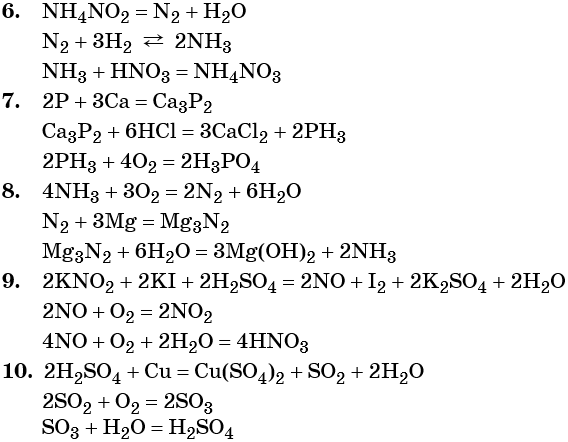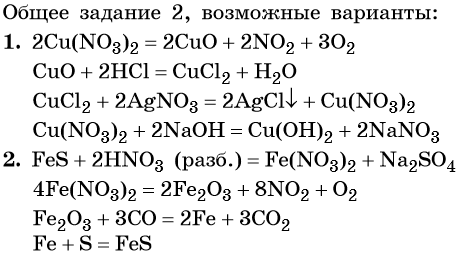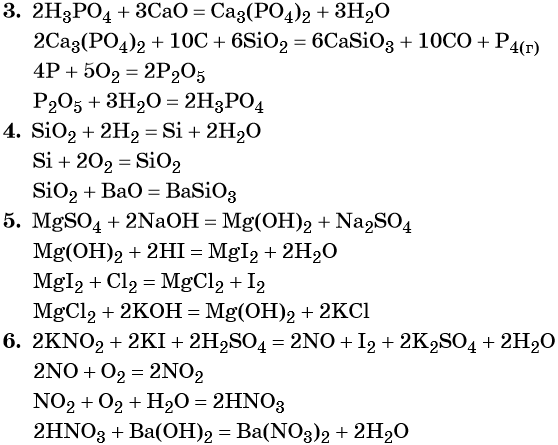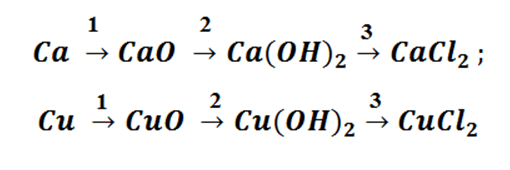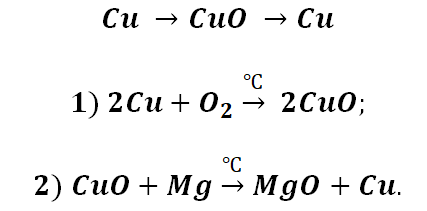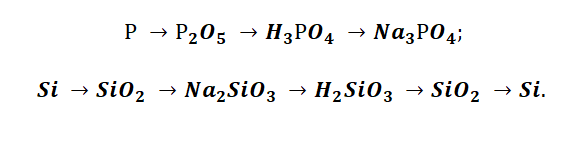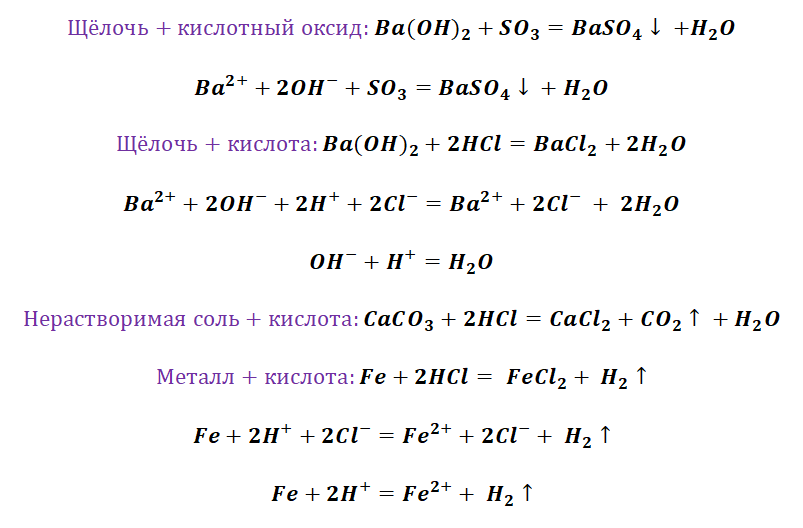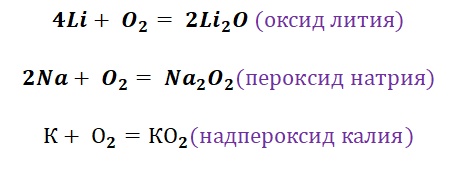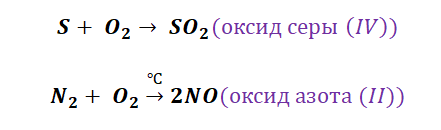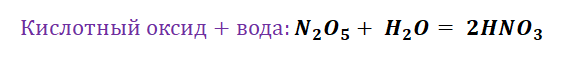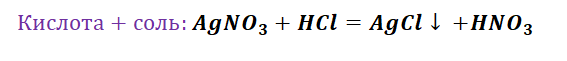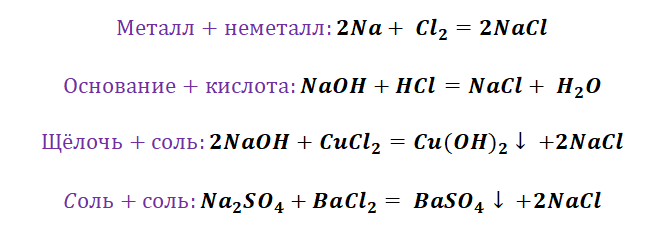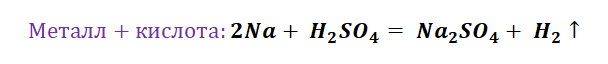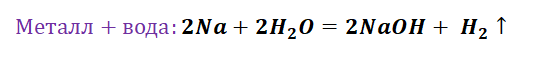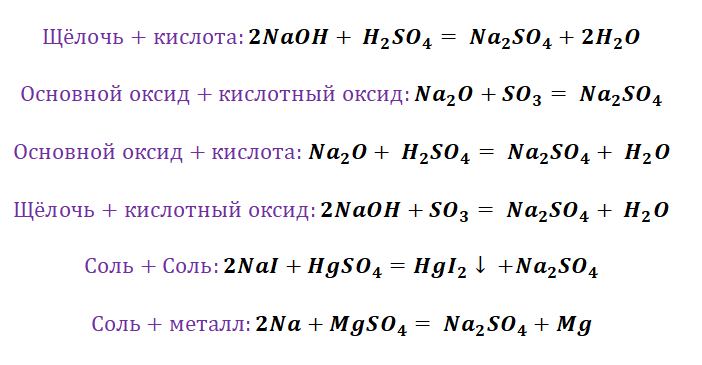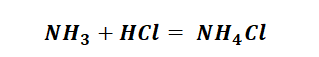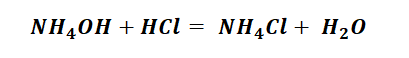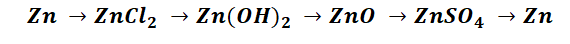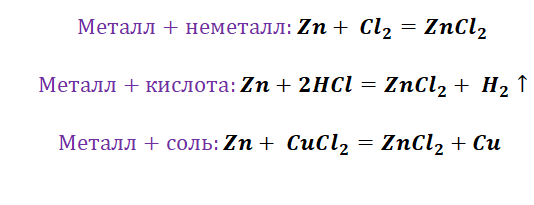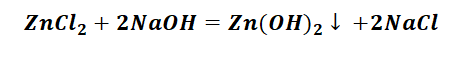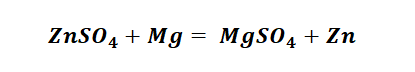Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних
веществ в другие, которые характеризуют генетическую связь между основными
классами органических и неорганических соединений.
Схему превращения одних веществ в другие называют «цепочкой превращений».
Для выполнения этих заданий необходимо знать основные
классы соединений, их номенклатуру, химические свойства, механизм
осуществления реакций.
Алгоритм решения
«цепочки превращений»
1 шаг. Перепишите
цепочку, которую необходимо решить
Ca → CaO → Ca(OH)2
→ Ca3(PO4)2
2 шаг. Пронумеруйте
количество реакций для удобства решения
1
2 3
Ca → CaO → Ca(OH)2
→ Ca3(PO4)2
Таким
образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг. Запишем 1
уравнение реакции – из кальция (Сa) надо получить оксид кальция (CaO). Вспомним,
что данное превращение происходит, когда металлы окисляются на воздухе, вступая
в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте
уравнивать реакции!
1) 2Сa + O2 2Ca+2O-2
4 шаг.
Осуществляем второе превращение. Из оксида кальция (CaO) нужно
получить гидроксид кальция (Ca(OH)2). Это уравнение
возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в
итоге получается щелочь – растворимое в воде основание). Записываем
уравнение и уравниваем его.
2) 2Ca+2O-2 + H2O → Ca 2+(OH)2–
5 шаг. Осуществляем
3 превращение. Из гидроксида кальция (Ca(OH)2)
необходимо получить соль – фосфат кальция (Ca3(PO4)2).
Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода.
Значит, для этой реакции подойдет фосфорная кислота – H3PO4, так как
именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
3) 3Ca2+(OH)2–
+ 2H3+PO43- → Ca32+(PO4)23-
+ 6H2O
ЦЕПОЧКИ ПРЕВРАЩЕНИЙ: КАКИЕ БЫВАЮТ И ОСНОВНОЙ АЛГОРИТМ РЕШЕНИЯ
Цепочки превращений – вид качественных задач по химии.
ОСНОВНЫЕ РАЗНОВИДНОСТИ ЦЕПОЧЕК ПРЕВРАЩЕНИЙ
Можно выделить несколько основных разновидностей подобных задач:
1. Цепочки превращений, в которых известны все вещества
Предлагаются формулы конкретных химических веществ. Формулы дают представление о том, к какому (каким) классу (классам) веществ относятся участники цепочки. Это значительно упрощает ее решение. И это, пожалуй, самый простой вид цепочек превращений.
2. Цепочки с неизвестными веществами
Одно из веществ цепи может быть не известно и зашифровано с помощью какой-либо буквы (латиница или кириллица). В таком случае, над стрелкой указывается вещество, которое необходимо добавить к предыдущему, чтобы получилось зашифрованное вещество. Если этого не делать, то можно предположить несколько вариантов решения.
Очень часто вместо химических формул предлагаются названия соединений. Это очень полезно для отработки знаний их номенклатуры и умений по названию определять принадлежность к определенному классу. Например:
В цепочках данного вида могут быть не известны несколько веществ или даже все, кроме одного, например, исходного.
3. Цепочки превращений, в которых указаны только степени окисления основного химического элемента
Многие химические элементы имеют несколько степеней окисления. Подобные задачи направлены на знание окислительно-восстановительных свойств веществ и на отработку умений составлять окислительно-восстановительные реакции.
4. Цепочки превращений с неизвестными промежуточными веществами
В подобных случаях предлагаются только исходное вещество и конечный продукт. Так, в данном примере из пропана напрямую получить этиловый эфир аланина невозможно. Промежуточных стадий получения конечного продукта может быть несколько. Это определяет тот, кто решает данную цепочку превращений. Ясно, что и путей решения может быть несколько.
ЦЕПОЧКИ ПРЕВРАЩЕНИЙ: ОСНОВНОЙ АЛГОРИТМ РЕШЕНИЯ
Главное правило в решении любой цепочки превращений: из каждого предыдущего вещества необходимо получить следующее за ним.
На конкретном примере рассмотрим основной алгоритм решения:
1) записываем цепочку;
2) под формулами веществ подписываем их названия;
3) над стрелками ставим номера реакций;
4) решаем цепочку, записывая каждую реакцию под своим номером;
5) если требуется, над стрелками в реакциях указываем условия протекания реакций.
Цепочки превращений направлены на закрепление и углубление знаний химических свойств веществ и способов их получения. Они помогают развивать логическое мышление, память, умение выявлять закономерности. Часто требуют не стандартного подхода к решению.
Если вам известны другие виды цепочек превращений, пожалуйста, напишите в комментариях.
Продолжение следует…
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Материал опубликовала
| Светлова Елена Александровна1655
Высшее образование. Педагогический стаж 26 лет. Высшая квалификационная категория. Победитель ПНПО “Лучших учителей России” 2014 и 2022 г.г. Руководитель школьного объединения “Эколог”. Россия, Ивановская обл., Приволжск |
4
Алгоритм решения “цепочек превращений”.
Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних веществ в другие, которые характеризуют генетическую связь между основными классами органических и неорганических соединений.
Схему превращения одних веществ в другие называют «цепочкой превращений».
Для выполнения этих заданий необходимо знать основные классы соединений, их номенклатуру, химические свойства, механизм осуществления реакций.
Алгоритм решения «цепочки превращений»
1 шаг. Перепишите цепочку, которую необходимо решить
Ca → CaO → Ca(OH)2 → Ca3(PO4)2
2 шаг. Пронумеруйте количество реакций для удобства решения
1 2 3
Ca → CaO → Ca(OH)2 → Ca3(PO4)2
Таким образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг. Запишем 1 уравнение реакции – из кальция (Сa) надо получить оксид кальция (CaO). Вспомним, что данное превращение происходит, когда металлы окисляются на воздухе, вступая в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте уравнивать реакции!
2Сa + O2 
4 шаг. Осуществляем второе превращение. Из оксида кальция (CaO) нужно получить гидроксид кальция (Ca(OH)2). Это уравнение возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в итоге получается щелочь – растворимое в воде основание). Записываем уравнение и уравниваем его.
2) 2Ca+2O-2 + H2O → Ca 2+(OH)2–
5 шаг. Осуществляем 3 превращение. Из гидроксида кальция (Ca(OH)2) необходимо получить соль – фосфат кальция (Ca3(PO4)2). Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода. Значит, для этой реакции подойдет фосфорная кислота – H3PO4, так как именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
3) 3Ca2+(OH)2– + 2H3+PO43- → Ca32+(PO4)23- + 6H2O
Опубликовано 17.05.20 в 10:05
Размер файла: 19.52 Кбайт
Взаимосвязь различных классов неорганических веществ
Рассмотрим её на нескольких примерах.
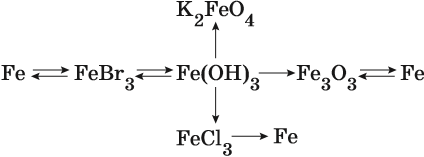
Пример 1. Взаимосвязь соединений железа.
Переход из железа в бромид железа (II) возможен при реакции железа с бромоводородной кислотой:
Получить из бромида железа (II) чистое железо можно при электролизе расплава:
При добавлении к бромиду железа (II) щёлочи образуется гидроксид железа (II):
Обратный переход возможен при взаимодействии гидроксида железа (II) с бромоводородной кислотой:
Окисление гидроксида железа (II) приводит к гидроксиду железа (III):
При нагревании гидроксид железа (II) теряет воду, превращаясь в оксид железа (II):
Восстановление оксида железа (II) приводит к железу:
Пример 2. Взаимосвязь соединений железа.
Реакция железа с бромом приводит к бромиду железа (III):
Получить из этого соединения железо можно электролизом расплава:
Переход из бромида железа (III) в гидроксид железа (III) возможен под действием щёлочи:
При нагревании гидроксид железа (III) теряет воду, превращаясь в оксид железа (III):
Восстановлением оксида железа (III) можно получить железо:
Железо в степени окисления +6 можно получить из гидроксида железа (III) по реакции:
Гидроксид железа (III) под действием соляной кислоты переходит в хлорид железа (III):
Из хлорида железа (III) электролизом можно получить железо:
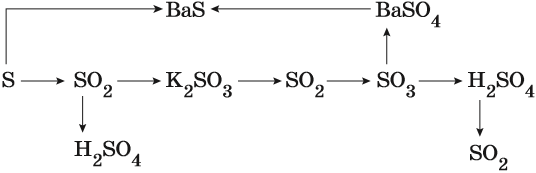
Пример 3. Взаимосвязь соединений серы.
Сера окисляется кислородом воздуха до оксида серы (IV):
Взаимодействие серы с водородом приводит к сероводороду:
Оксид серы (IV) может вступить в окислительно-восстановительную реакцию с образованием серной кислоты или в обменную реакцию с образованием сульфита калия:
Под действием сильных кислот сульфит калия разлагается до SO2:
Каталитическое окисление SO2 приводит к оксиду серы (VI):
Из оксида серы (VI) можно получить как серную кислоту, так и сульфат бария:
Из сульфата бария восстановлением углём можно получить сульфид бария:
Восстановление SO2 приводит к сере:
Пример 4. Осуществить следующую цепочку превращений: N2 → NH3 → (NH4)2SO4 → NH4Cl.
Азот взаимодействует с водородом при повышенной температуре в присутствии катализатора с образованием аммиака:
Реакция газообразного аммиака с серной кислотой приводит к сульфату аммония:
При взаимодействии водных растворов сульфата аммония и хлорида бария образуется нерастворимый сульфат бария, эта реакция идёт до конца. После отделения осадка и упаривания водного раствора можно выделить чистый хлорид аммония:
Пример 5. Осуществить следующую цепочку превращений: NO2 → HNO3 → NH4NO3 → N2O.
Оксид азота (IV) при взаимодействии с кислородом и водой даёт азотную кислоту:
При реакции азотной кислоты с аммиаком образуется нитрат аммония:
Контролируемое разложение нитрата аммония приводит к образованию оксида азота (I) и воды:
Пример 6. Осуществить следующую цепочку превращений: NaBr → NaCl → Cl2 → KClO.
Хлор способен вытеснять бром из бромидов:
Электролиз расплава хлорида натрия приводит к образованию молекулярного хлора:
Гипохлорид калия образуется при взаимодействии газообразного хлора с водным раствором гидроксида калия при охлаждении:
Особенностью заданий, в которых требуется определить неизвестное вещество Х как промежуточный продукт в цепочке химических превращений, является принципиальная возможность наличия нескольких правильных ответов. Вам нужно обосновать свой выбор.
Пример 7. Предложите формулы неизвестных веществ в приведённых ниже последовательностях химических превращений и обоснуйте этот выбор. Приведите уравнения химических реакций, с помощью которых эти превращения можно осуществить:
Каким же может быть вещество X1? Возможны несколько вариантов. Предположим, что марганец в этом соединении имеет степень окисления +2, тогда этим веществом будет, например, сульфат марганца (II). Почему? Из него удобно получит хлорид марганца (II) с помощью обменной реакции:
Данная реакция пойдёт до конца, потому что сульфат бария выпадет в осадок.
Перманганат калия — сильный окислитель, который при реакции с восстановителем в кислой среде может понизить свою степень окисления до +2. Чтобы получить сульфат марганца (II) из перманганата калия, можно использовать окислительно-восстановительную реакцию:
Другой вариант ответа:
Из хлорида марганца (II) можно получить нитрат марганца (II) с помощью обменной реакции с нитратом серебра. Эта реакция идёт до конца благодаря образованию нерастворимого хлорида серебра:
Термическое разложение нитрата марганца (II) — обычный способ получения оксида марганца (IV):
Пример 8. Предложите формулы неизвестных веществ в приведённых ниже последовательностях химических превращений и обоснуйте этот выбор. Приведите уравнения химических реакций, с помощью которых эти превращения можно осуществить:
Наиболее рациональным вариантом будет следующий. Вначале железо под действием хлора окисляется до хлорида железа (III) (вещество X1), из которого по обменной реакции получают гидроксид железа (III):
Веществом (X2) может быть любая растворимая соль железа (III), например сульфат, нитрат и т. д.:
Под действием расчётного количества щёлочи в осадок выпадает гидроксид железа (III):
Тренировочные задания
Общее задание 1. Составьте уравнения реакций, с помощью которых можно осуществить следующие цепочки превращений:
1. Al → AlCl3 → Al(OH)3 → KAlO2 → K[Al(OH)4] → Al(OH)3.
2. Ca3(PO4)2 → P → P2O5 → → Ca(H2PO4)2 → CaHPO4 → Ca3(PO4)2.
3. FeS → H2S → S → SO2 → NaHSO3 → BaSO3 → BaSO4.
4. Cl2 → CaOCl2 → CaCO3 → CaO → → CaC2 → Ca(OH)2 → Ca(HSO3)2.
5. Ca3(PO4)2 → P → P2O5 → H3PO4.
6. NH4NO2 → N2 → NH3 → NH4NO3.
7. P → Ca3P2 → PH3 → H3PO4.
8. NH3 → N2 → Mg3N2 → NH3.
9. KNO2 → NO → NO2 → HNO3.
10. H2SO4 → SO2 → SO3 → H2SO4.
11. HCl → Cl2 → KClO3 → Cl2.
12. Cl2 → NaCl → HCl → AlCl3.
13. KCl → Cl2 → NaClO → NaClO3.
14. HBr → NaBr → Br2 → HBr.
15. KBr → Br2 → HBr → NaBr.
16. NaCl → HCl → Cl2 → KClO3.
17. Mg → Mg3N2 → NH3 → Al(OH)3.
18. Ba(NO3)2 → Fe(NO3)2 → Fe2O3 → Fe.
Общее задание 2. Предложите формулы неизвестных веществ в приведённых ниже последовательностях химических превращений и обоснуйте ваш выбор. Приведите уравнения химических реакций, с помощью которых эти превращения можно осуществить:
1. Cu(NO3)2 → X1 → CuCl2 → X2 → Cu(OH)2.
2. FeS → X1 → Fe2O3 → X2 → FeS.
3. H3PO4 → X1 → P → X2 → H3PO4.
4. SiO2 → Si → X → BaSiO3.
5. MgSO4 → X1 → MgI2 → X2 → Mg(OH)2.
6. KNO2 → X1 → NO2 → X2 → Ba(NO3)2.
Ответы
Химия
План урока:
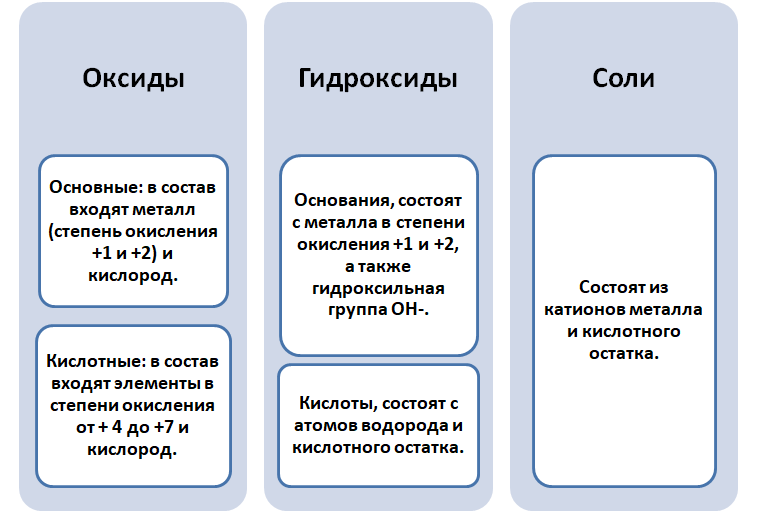
Почему связь между классами веществ считается генетической
Чтобы разобраться в этом вопросе. Вспомним состав классов веществ, с которыми Вы познакомились на предыдущих занятиях.
Обратите внимание, что соли содержат в себе частицы как оснований (атомы металла), так и кислот (кислотных остатков). Если соль рассматривать как «венец» превращений, то давайте, попытаемся прийти к истокам. Всё начинается с простого, точнее металла и неметалла, как простых веществ.
Попробуем построить генетический ряд металлов, переходя от одного класса к другому.
Возьмём, к примеру, металлы кальций и медь, подставив их в цепочку уравнений.
Обратите внимание, что данные металлы отличаются своей реакционной способностью.
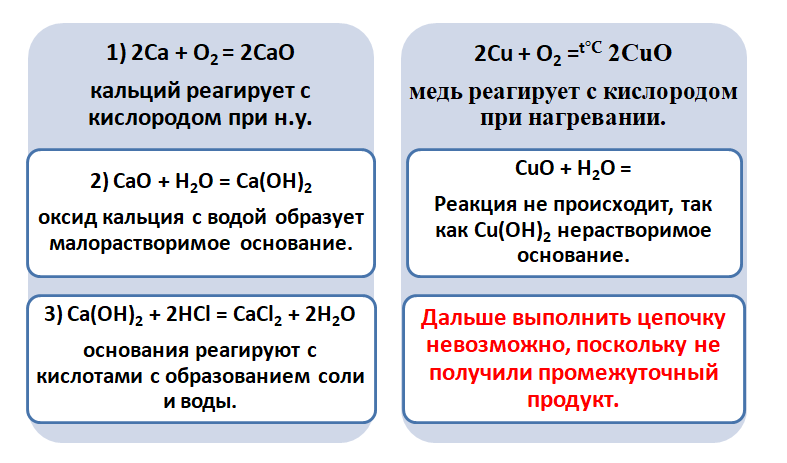
Получается, эта генетическая связь соединений присуща только для активных металлов, оксиды которых, реагируя с водой, дают продукт в виде щёлочи.
Для металлов, которые отличаются малой активностью, переход от вещества, находящегося в простом состоянии, к соли, происходит путём превращений.
Поскольку основные оксиды реагируют с металлами (более активными, чем металлы, которые входят в состав оксида), то эту схему можно сократить.
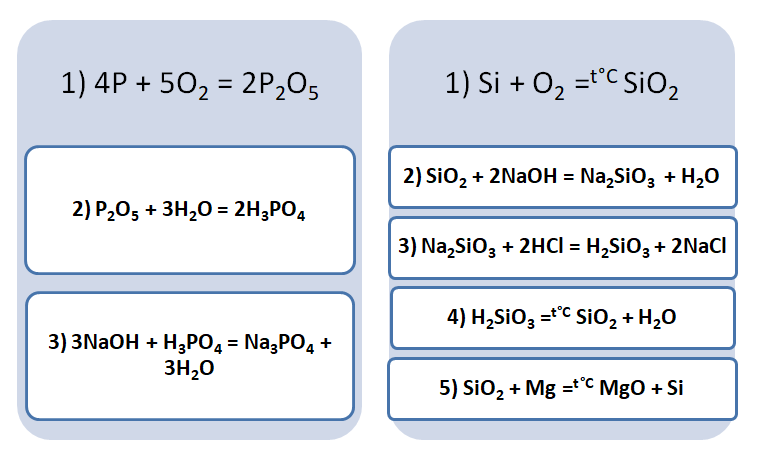
Аналогичным способом можно составить генетический ряд неметаллов, начиная от неметалла заканчивая солью или неметаллом.
Подставим в цепочку уравнений фосфор и кремний.
А возможны иные пути решения данных цепочек уравнений. Способы получения кислотных оксидов реализуются путём взаимодействия простых веществ с кислородом. А вот не с каждого оксида можно получить ему соответствующую кислоту, путём прибавления воды. Поскольку кремниевая кислота нерастворима в воде, то необходимо получить сначала соль, а потом уже и кислоту.
В данном решении предлагается добыть соль Na3PO4, взаимодействием основания и кислоты. Однако можно использовать и другие варианты, которые также будут верны.
Если объединить генетические ряды металлов и неметаллов, получим дружную семью неорганических соединений, где каждое вещество связано неразрывной нитью с другими классами. Таблица 1.
Данная таблица отображает, как реагируют между собой вещества и какие продукты возможны, вследствие реакции.
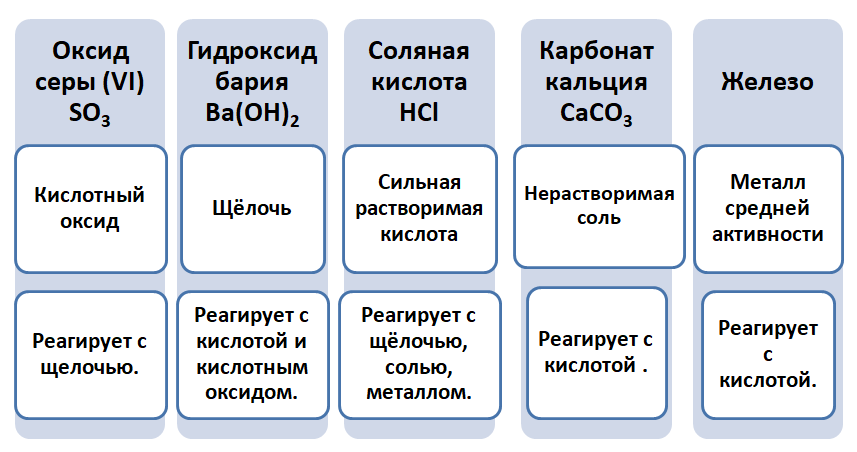
Промоделируем на примере: В вашем распоряжении имеются следующие вещества: оксид серы (VI), гидроксид бария, соляная кислота, карбонат кальция и железо. Ваша задача спрогнозировать, между какими соединениями возможна реакция и, записать, соответствующие уравнения реакций.
Подтвердив свои прогнозы молекулярно-ионными уравнениями в сокращённом и полном виде.
Родственные связи между металлами и неметаллами
Кислород является типичным представителем неметаллов. Он является достаточно сильным окислителем, перед которым может устоять только фтор. Получение основных оксидов происходит путём взаимодействия кислорода и металлов. Однако не все металлы охотно с ним реагируют. Щелочные реагируют бурно, именно поэтому их хранение осуществляется под слоем керосина. Необходимо заметить, что щелочные металлы не образуют оксиды во время взаимодействия с О2. Их чрезвычайная активность позволяет получать только для их характерные продукты, это будут пероксиды и надпероксиды (за исключением лития, продукт Li2O).
А вот, чтобы менее активные металлы – железо или медь прореагировали, необходимо нагревание.
Получение кислотных оксидов происходит аналогично взаимодействием неметаллов с О2.
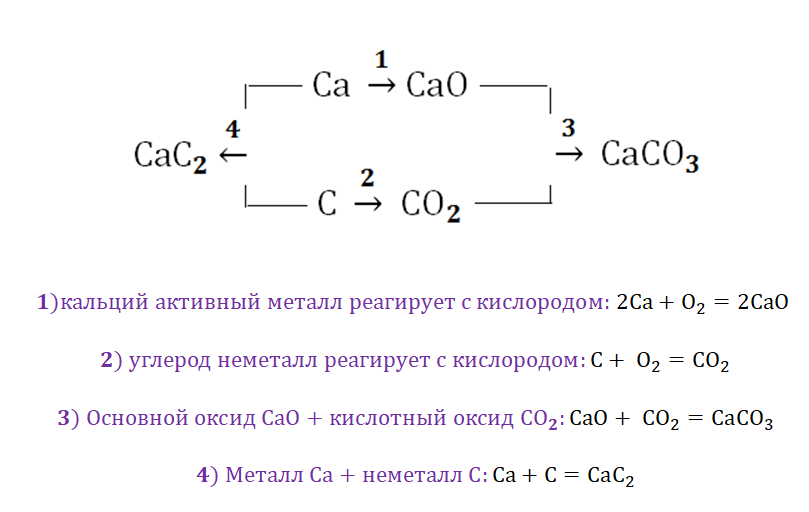
Металлы и неметаллы в химии рассматриваются как противоположности, которые, как заряды (положительные и отрицательные) имеют свойства притягиваться. Рассмотрим на примере металла кальций и неметалла углерод.
Соль СаСО3 имеет истоки от простых веществ Са и С, промежуточным звеном являются оксиды этих веществ, для которых свойственно реагировать между собой.
Вспомним с Вами один с основных постулатов химии, а именно, закон постоянства состава вещества.
Представим, что мы с Вами химики-первооткрыватели и нам предстоит сложная задача получить азотную кислоту, которая имеет важную роль в химической промышленности. Получение кислот возможно несколькими способами. Обращаясь к таблице 1, делаем вывод, что нам доступно несколько способов, а именно.
Взаимодействие кислот с солями приведёт нас к желаемому результату, однако не забывайте, что в продукте должны увидеть газ, осадок либо окрашивание.
Способы получения средних солей доказательно показывают связь между веществами. Снова выручалочкой нам послужит таблица 1. Наша задача получить вещество, без которого, полагаем, Вы не представляете своё существование, это соль NaCl. Используя данные, видим, что доступно для её получения 4 способа (Вы ищете, где продуктом является соль и применяете данные на свой пример).
Рассмотрим подробно каждый с них.
Способы получения солей отличаются, причиной этому является то, какую именно соль мы хотим получить, кислородсодержащей,сильной или слабой кислоты. К примеру, получение Na2SO4 будет отличаться от предыдущего примера с NaCl. Количество способов будет больше, так как это соль кислородсодержащей кислоты.
Здесь следуют отметить особенность щелочных, а также щелочно-земельных металлов, для которых свойственно взаимодействие с водой. По сути, идёт два параллельных процесса.
Полученная щёлочь реагирует с кислотой.
Способы получения солей аммония несколько отличаются, от солей металлов, тем, что аммиак непосредственно реагирует с кислотами (смотри урок химическая связь) с образованием донорно-акцепторных связей.
Гидроксид аммония имеет способность взаимодействовать с кислотами, с образованием необходимого продукта, не иначе как солей аммония.
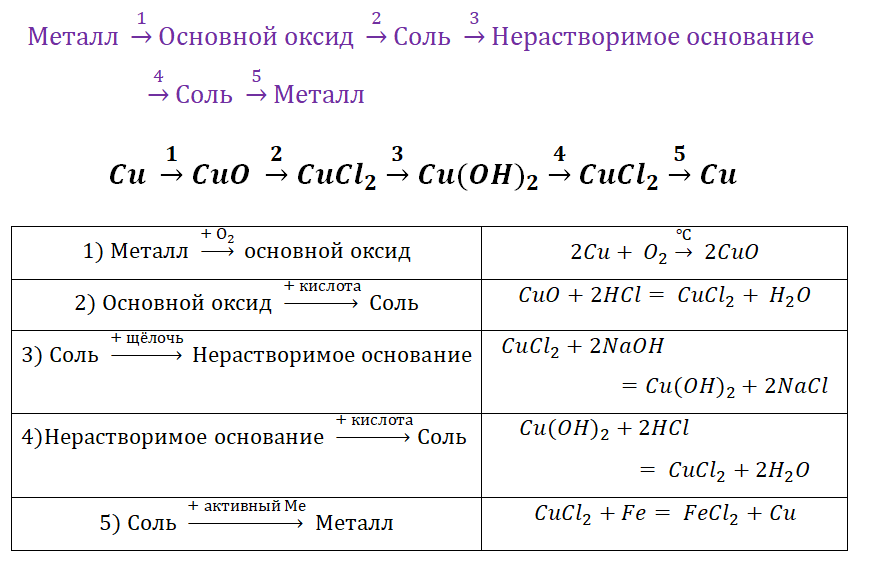
Наверняка некоторые из Вас пугал вид заданий, который был цепочек уравнений. Обобщая всё выше сказанное, рассмотрим несколько примеров.
Чтобы справится с данной задачей, проанализируем условие. Первое, что необходимо выделить – это количество уравнений (смотрим по стрелочкам, их 5). Второе определим исходное вещество – цинк, металл средней силы. Чтобы получить с него соль (не забываем о таблице 1), можно использовать 3 способа:
Выбор за Вами, одного из трёх уравнений. Переходим к следующей части цепочки ZnCl2 → Zn(OH)2. Здесь решением будет один вариант, это прибавление щёлочи.
Zn(OH)2 относится к нерастворимым основанием, поэтому при нагревании распадаются.
И наконец, итоговый продукт, металл. Его необходимо выделить из соли. Для этого необходимо взять металл, сила которого будет больше. Если эту информацию забыли, то освежить эти данные сможете с помощью урока Соли и их свойства.
Решение цепочек химических уравнений на первый взгляд кажется не посильной задачей, но если внимательно изучить свойства веществ, то они кажутся не такими уж и сложными.
Взаимопревращение между классами веществ
Обобщая сведения о свойствах неорганических соединений, составим схему 1. Взаимосвязь между классами неорганических веществ.
Эта схема и таблица 1 будут служить Вам волшебной палочкой в изучении неорганической химии.
Алгоритм решения «цепочек превращений» веществ. Инструкция для учащихся 8 класса
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних веществ в другие, которые характеризуют генетическую связь между основными классами органических и неорганических соединений.
Схему превращения одних веществ в другие называют «цепочкой превращений » .
Для выполнения этих заданий необходимо знать основные классы соединений, их номенклатуру, химические свойства, механизм осуществления реакций.
Алгоритм решения «цепочки превращений»
1 шаг. Перепишите цепочку, которую необходимо решить
2 шаг. Пронумеруйте количество реакций для удобства решения
Таким образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг. Запишем 1 уравнение реакции – из кальция (С a ) надо получить оксид кальция ( CaO ). Вспомним, что данное превращение происходит, когда металлы окисляются на воздухе, вступая в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте уравнивать реакции!
2 С a + O 2 2Ca +2 O -2
4 шаг. Осуществляем второе превращение. Из оксида кальция ( CaO ) нужно получить гидроксид кальция ( Ca ( OH ) 2 ). Это уравнение возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в итоге получается щелочь – растворимое в воде основание). Записываем уравнение и уравниваем его.
2) 2 Ca +2 O -2 + H 2 O → Ca 2+ ( OH ) 2 —
5 шаг . Осуществляем 3 превращение. Из гидроксида кальция ( Ca ( OH ) 2 ) необходимо получить соль – фосфат кальция ( Ca 3 ( PO 4 ) 2 ). Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода. Значит, для этой реакции подойдет фосфорная кислота – H 3 PO 4 , так как именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 924 человека из 80 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 20 человек из 11 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 35 человек из 23 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 580 067 материалов в базе
Материал подходит для УМК
«Химия», Габриелян О.С.
§ 43. Генетическая связь между классами веществ
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Другие материалы
- 16.05.2020
- 206
- 3
- 14.04.2020
- 306
- 6
- 28.03.2020
- 863
- 5
- 14.03.2020
- 376
- 7
- 11.02.2020
- 1145
- 1
- 05.02.2020
- 1542
- 100
- 16.01.2020
- 1315
- 15
- 13.01.2020
- 362
- 1
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 17.05.2020 31722
- DOCX 19.5 кбайт
- 218 скачиваний
- Рейтинг: 5 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Светлова Елена Александровна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 7 лет и 1 месяц
- Подписчики: 3
- Всего просмотров: 65799
- Всего материалов: 42
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Минпросвещения подключит студотряды к обновлению школьной инфраструктуры
Время чтения: 1 минута
Количество бюджетных мест в вузах по IT-программам вырастет до 160 тыс.
Время чтения: 2 минуты
В Ростовской и Воронежской областях организуют обучение эвакуированных из Донбасса детей
Время чтения: 1 минута
В Швеции запретят использовать мобильные телефоны на уроках
Время чтения: 1 минута
Минпросвещения упростит процедуру подачи документов в детский сад
Время чтения: 1 минута
РДШ организовало сбор гуманитарной помощи для детей из ДНР
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Как решать химические уравнения — схемы и примеры решения для разных реакций
Основные термины и понятия
Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
Уравнение можно сократить на 16H + и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO — 3 + 4 H + = Fe3 + + 2SO 2- 4 + 5NO + 2H2O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
источники:
http://infourok.ru/algoritm-resheniya-cepochek-prevrashenij-veshestv-instrukciya-dlya-uchashihsya-8-klassa-4304493.html
http://nauka.club/khimiya/khimicheskie-uravneniya.html