В уроке 9 «Молярная масса и молярный объем» из курса «Химия для чайников» выясним, что подразумевается под молярной массой и молярным объемом; приведем формулы для их вычисления. Напоминаю, что в прошлом уроке «Химическое количество вещества и моль» мы выяснили, что такое химическое количество вещества; рассмотрели моль в качестве единицы количества вещества, а также познакомились с постоянной Авогадро.

Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
Молярная масса вещества Х обозначается символом M(Х). Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):
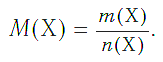
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
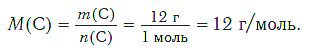
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
Например:
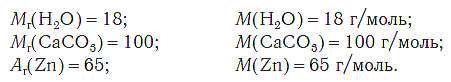
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.

Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
![]()
и, наоборот, химическое количество по массе:
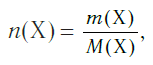
а также число структурных единиц:
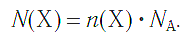
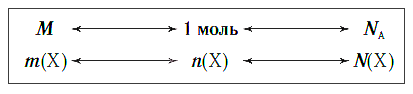
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
Молярный объем
В отличие от твердых и жидких веществ все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом и обозначается Vm.
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х):
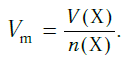
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм3/моль. Другими словами, молярный объем любого газа при нормальных условиях:
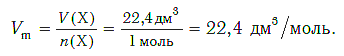
Молярный объем — это объем, равный 22,4 дм3, который занимает 1 моль любого газа при нормальных условиях.
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Спойлер

[свернуть]
Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Спойлер

[свернуть]
Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Спойлер

[свернуть]
Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Спойлер

[свернуть]
Краткие выводы урока:
- Масса вещества химическим количеством 1 моль называется его молярной массой. Она равна отношению массы данной порции вещества к его химическому количеству.
- Объем газообразных веществ химическим количеством 1 моль при нормальных условиях одинаков и равен 22,4 дм3.
- Величина, равная 22,4 дм3/моль, называется молярным объемом газов.
Надеюсь урок 9 «Молярная масса и молярный объем» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Основные химические понятия».
Молярный объем


4.2
Средняя оценка: 4.2
Всего получено оценок: 260.
4.2
Средняя оценка: 4.2
Всего получено оценок: 260.
При изучении химических веществ важными понятиями являются такие величины, как молярная масса, плотность вещества, молярный объем. Так, что же такое молярный объем, и в чем его отличие для веществ в разном агрегатном состоянии?
Молярный объем: общая информация
Чтобы вычислить молярный объем химического вещества необходимо молярную массу этого вещества разделить на его плотность. Таким образом, молярный объем вычисляется по формуле:
Vm=M/p,
где Vm – молярный объем вещества, М – молярная масса, p – плотность. В Международной системе СИ эта величина измеряется в кубический метр на моль (м 3 /моль).
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа.
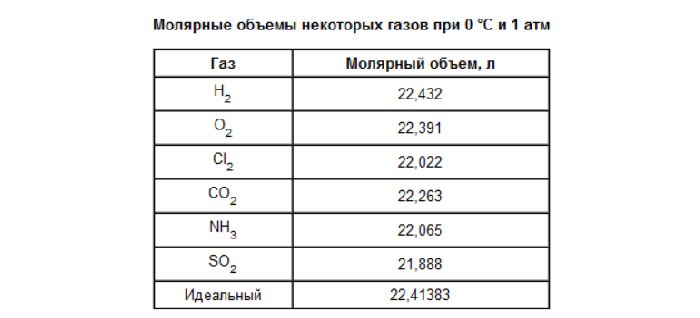
Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм 3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм 3 /м.
Молярный объем при нормальных условиях можно вывести, используя уравнение состояния для идеального газа, которое называется уравнением Клайперона-Менделеева:
P*V=n*R*T,
где R – универсальная газовая постоянная, R=8.314 Дж/моль*К=0,0821 л*атм/моль К
Объем одного моля газа V=RT/P=8.314*273.15/101.325=22.413 л/моль, где Т и Р – значение температуры (К) и давления при нормальных условиях.
Закон Авогадро
В 1811 году А. Авогадро выдвинул гипотезу, что в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковой число молекул. Позже гипотеза подтвердилась и стала законом, носящим имя великого итальянского ученого.
Закон становится понятен, если вспомнить, что в газообразном виде расстояние между частицами несопоставимо больше, чем размеры самих частиц.
Таким образом, из закона Авогадро можно сделать следующие выводы:
- В равных объёмах любых газов, взятых при одной и той же температуре и при одном и том же давлении, содержится одно и то же число молекул.
- 1 моль совершенно различных газов при одинаковых условиях занимает одинаковый объем.
- Один моль любого газа при нормальных условиях занимает объем 22,41 л.
Следствие из закона Авогадро и понятие молярного объема основаны на том, что моль любого вещества содержит одинаковое число частиц (для газов – молекул), равное постоянной Авогадро.
Чтобы узнать число молей растворенного вещества содержится в одном литре раствора, необходимо определить молярную концентрацию вещества по формуле c=n/V, где n – количество растворенного вещества, выражаемое в молях, V – объем раствора, выражаемый в литрах С – молярность.

Что мы узнали?
В школьной программе по химии 8 класса изучается тема «Молярный объем». В одном моле газа всегда содержится одинаковый объем, равный 22,41 кубический метр/моль. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Александр Котков
10/10
-

Артак Саркисян
10/10
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 260.
А какая ваша оценка?
Молярный объём
Vm
— это отношение объёма данной порции вещества к его количеству.
Численно молярный объём равен объёму (1) моль вещества.
Обрати внимание!
Молярный объём любого газа при нормальных условиях (давлении (101,3) кПа и температуре (0) °С) равен (22,4) дм³/моль.
Вычисление объёма газа по его количеству
Преобразуем формулу молярного объёма — выразим из неё
V
:
— объём газа равен произведению его количества на молярный объём.
Пример:
вычисли объём (н. у.) метана количеством (1,5) моль.
дм³.
Вычисление количества газа по его объёму
Выразим из формулы молярного объёма
n
:
— количество газа можно вычислить, если его объём разделить на молярный объём.
Пример:
вычисли количество водорода, соответствующее при н. у. его объёму (11,2) дм³.
моль.
Моля́рный объём Vm — отношение объёма вещества к его количеству, численно равен объёму одного моля вещества. Термин «молярный объём» может быть применён к простым веществам, химическим соединениям и смесям. В общем случае он зависит от температуры, давления и агрегатного состояния вещества. Молярный объём также можно получить делением молярной массы M вещества на его плотность ρ: таким образом, Vm = V/n = M/ρ. Молярный объём характеризует плотность упаковки молекул в данном веществе. Для простых веществ иногда используется термин атомный объём[1].
В Международной системе единиц (СИ) единицей измерения молярного объёма является кубический метр на моль (русское обозначение: м3/моль; международное: m3/mol).
Молярный объём смеси[править | править код]
Для смеси веществ, при расчёте молярного объёма, количеством вещества считают сумму количеств всех веществ, составляющих смесь. Если известна плотность смеси ρc, мольные доли компонентов xi и их молярные массы Mi, молярный объём смеси можно найти как отношение средней молярной массы смеси (суммы молярных масс её компонентов, умноженных на их мольные доли) к плотности смеси.
Молярный объём газов[править | править код]
Согласно закону Авогадро, одинаковые количества газов при одинаковых условиях занимают одинаковый объём. Молярный объём идеального газа рассчитывается по формуле, выводящейся из уравнения состояния идеального газа
,
где T — термодинамическая температура, P — давление, R = 8,314 462 618 153 24 (точно) м3⋅Па⋅К−1⋅моль−1 — универсальная газовая постоянная.
При стандартных условиях (T = 273,15 K (0 °C), P = 101 325 Па) молярный объём идеального газа Vm = 22,413 969 545… л/моль[2][3]. Молярные объёмы идеального газа при других давлениях и температурах, часто принимаемых в качестве стандартных:
- Vm = 24,465 403 697… л/моль (T = 298,15 K (25 °C), P = 101 325 Па),
- Vm = 22,710 954 641… л/моль (T = 273,15 K (0 °C), P = 100 000 Па)[4],
- Vm = 24,789 570 296… л/моль (T = 298,15 K (25 °C), P = 100 000 Па).
| Газ | Vm, л/моль | Газ | Vm, л/моль |
|---|---|---|---|
| He | 22,426 | CO | 22,408 |
| Ne | 22,428 | CO2 | 22,262 |
| Ar | 22,394 | N2O | 22,260 |
| Kr | 22,388 | SO2 | 21,889 |
| Xe | 22,266 | CH4 | 22,376 |
| H2 | 22,430 | C2H6 | 22,176 |
| O2 | 22,393 | C2H4 | 22,255 |
| N2 | 22,404 | C2H2 | 22,157 |
Молярные объёмы реальных газов в той или иной степени отличаются от молярного объёма идеального газа, однако во многих случаях для практических вычислений отклонениями от идеальности можно пренебречь. Различие молярных объёмов идеального и реального газа связано в первую очередь с силами притяжения между молекулами и с конечным объёмом молекулы реального газа; в связи с этим, уравнение состояния реального газа с большей точностью описывается не формулой Менделеева — Клапейрона (уравнением состояния идеального газа), а формулой Ван-дер-Ваальса:
В таблице справа приведены молярные объёмы некоторых реальных газов (T = 273,15 K (0 °C), P = 101 325 Па)[5]. Видно, что для газов с относительно большими молекулами (двуокись серы, углеводороды) молярный объём несколько меньше молярного объёма идеального газа (22,414 л/моль в указанных условиях); для газов с маленькими молекулами (гелий, неон, водород) молярный объём несколько больше «идеального».
С молярным объёмом идеального газа связана постоянная Лошмидта NL — количество молекул идеального газа в единице объёма при стандартных условиях:
Молярный объём кристаллов[править | править код]
Объём Vя элементарной ячейки кристалла можно вычислить из параметров кристаллической структуры, которые определяются с помощью рентгеноструктурного анализа. Объём ячейки связан с молярным объёмом следующим образом:
- Vm = VяNA/Z,
где Z — количество формульных единиц в элементарной ячейке.
Значения молярного объёма химических элементов[править | править код]
Ниже приведены значения молярного (атомного) объёма простых веществ в см3/моль (10−6 м3/моль, 10−3 л/моль) при нормальных условиях либо (для элементов, газообразных при н.у.) при температуре конденсации и нормальном давлении.
| Группа | I A (1) | II A (2) | III B (3) | IV B (4) | V B (5) | VI B (6) | VII B (7) | VIII B (8) | VIII B (9) | VIII B (10) | I B (11) | II B (12) | III A (13) | IV A (14) | V A (15) | VI A (16) | VII A (17) | VIII A (18) |
| Период | ||||||||||||||||||
| 1 | H 14,0 |
He 31,8 |
||||||||||||||||
| 2 | Li 13,1 |
Be 5 |
B 4,6 |
C 5,3 |
N 17,3 |
O 14 |
F 17,1 |
Ne 16,8 |
||||||||||
| 3 | Na 23,7 |
Mg 14 |
Al 10 |
Si 12,1 |
P 17 |
S 15,5 |
Cl 18,7 |
Ar 24,2 |
||||||||||
| 4 | K 45,3 |
Ca 29,9 |
Sc 15 |
Ti 10,6 |
V 8,35 |
Cr 7,23 |
Mn 7,39 |
Fe 7,1 |
Co 6,7 |
Ni 6,6 |
Cu 7,1 |
Zn 9,2 |
Ga 11,8 |
Ge 13,6 |
As 13,1 |
Se 16,5 |
Br 23,5 |
Kr 32,2 |
| 5 | Rb 55,9 |
Sr 33,7 |
Y 19,8 |
Zr 14,1 |
Nb 10,8 |
Mo 9,4 |
Tc 8,5 |
Ru 8,3 |
Rh 8,3 |
Pd 8,9 |
Ag 10,3 |
Cd 13,1 |
In 15,7 |
Sn 16,3 |
Sb 18,4 |
Te 20,5 |
I 25,7 |
Xe 42,9 |
| 6 | Cs 70 |
Ba 39 |
* | Hf 13,6 |
Ta 10,9 |
W 9,53 |
Re 8,85 |
Os 8,43 |
Ir 8,54 |
Pt 9,1 |
Au 10,2 |
Hg 14,8 |
Tl 17,2 |
Pb 18,3 |
Bi 21,3 |
Po 22,7 |
At н/д |
Rn н/д |
| 7 | Fr н/д |
Ra 45 |
** | Rf н/д |
Db н/д |
Sg н/д |
Bh н/д |
Hs н/д |
Mt н/д |
Ds н/д |
Rg н/д |
Cn н/д |
Nh н/д |
Fl н/д |
Mc н/д |
Lv н/д |
Ts н/д |
Og н/д |
| Лантаноиды | * | La 22,5 |
Ce 21 |
Pr 20,8 |
Nd 20,6 |
Pm 19,96 |
Sm 19,9 |
Eu 28,9 |
Gd 19,9 |
Tb 19,2 |
Dy 19 |
Ho 18,7 |
Er 18,4 |
Tm 18,1 |
Yb 24,8 |
Lu 17,8 |
||
| Актиноиды | ** | Ac 22,54 |
Th 19,8 |
Pa 15 |
U 12,5 |
Np 21,1 |
Pu 12,12 |
Am 20,8 |
Cm 18,28 |
Bk 16,8 |
Cf 16,5 |
Es н/д |
Fm н/д |
Md н/д |
No н/д |
Lr н/д |
||
См. также[править | править код]
- Число Авогадро
- Удельный объём
- Молярная масса
- Молярная теплоёмкость
Примечания[править | править код]
- ↑ Для молекулярных кристаллов простых веществ молярный объём, определяемый через 1 моль молекул, не равен атомному объёму, поскольку количество атомов не равно количеству молекул. В этих случаях необходимо уточнять, относится ли указанная величина к молекулярному или к атомному молярному объёму. Так, атомный молярный объём иода (кристаллы, состоящие из двухатомных молекул I2) вдвое меньше молекулярного молярного объёма.
- ↑ CODATA Value: molar volume of ideal gas (273.15 K, 101.325 kPa). Дата обращения: 17 ноября 2022.
- ↑ После изменения определений основных единиц СИ в 2019 году универсальная газовая константа стала не измеряемой, а определяемой (точно фиксированной) величиной, будучи произведением точно фиксированных величин — постоянной Больцмана и постоянной Авогадро. Это же относится и к стандартному молярному объёму.
- ↑ CODATA Value: molar volume of ideal gas (273.15 K, 100 kPa). Дата обращения: 17 ноября 2022.
- ↑ 1 2 Battino R. The Ostwald coefficient of gas solubility (англ.) // Fluid Phase Equilibria. — 1984. — Vol. 15, no. 3. — P. 231—240. — ISSN 0378-3812. — doi:10.1016/0378-3812(84)87009-0. [исправить]; Table 2.
Просмотров 3.3к. Опубликовано 28.06.2022
Единицей измерения молекулярной опухоли является л/моль, и эта величина постоянна при нормальных условиях, поэтому молекулярная опухоль составляет 22,4 л/моль.
Как найти объем в химии ℹ️
Вы знаете, что один и тот же химикат любого вещества содержит одинаковое количество структурных единиц. Однако у каждого вещества есть своя структурная единица массы. Поэтому масса одной и той же химической массы разных веществ также отличается.
Молекулярная масса — это масса той части вещества, которая приходится на один моль химической массы.
Молекулярная масса вещества X обозначается символом m(x). Она равна отношению массы конкретного вещества M(x) (г или кг) к химической массе N(x) (моль).
В Международной системе единиц молекулярный вес выражается в кг/моль. В химии чаще используется единица измерения Г/моль.
Определите молекулярную массу углерода. Масса углерода в одном моле стехиометрической массы составляет 0,012 кг или 12 г. Поэтому:.
Молекулярная масса любого вещества численно равна его относительной молекулярной массе, выраженной в Г/моль.

На рисунке 47 показан пример веществ (H2O, CACO3и Zn) с одинаковой химической массой — 1 моль. Как видите, массы различных веществ с одним молем химической массы различны.

Молекулярный вес является важной характеристикой всех индивидуальных веществ. Она отражает взаимосвязь между массой вещества и его химическим количеством. Знание одной из этих величин позволяет определить массу другой — химической — величины.
И наоборот, химическое количество по массе:.
А также количество структурных подразделений:.
Связь между свойствами этих трех веществ в их кумулятивном состоянии можно представить с помощью простой диаграммы.

Формула и алгоритм нахождения объёма
Сегодня мы изучаем важный навык в химии — как находить количество различных растворов и других веществ. Эти знания необходимы, потому что они помогут вам решить многие проблемы как в тетради, так и в жизни. Все, что вам нужно знать, — это состоявшийся человек.
Важно понимать, что тип опухоли, которую нужно найти, может варьироваться в зависимости от сущности, которую нужно найти, а точнее, от общего состояния этой сущности. Типы нахождения объемов газа и жидкости противоположны друг другу.
Точный и правильный вид для нахождения объема жидкости: C = n/v.
- C – молярная масса раствора (моль на литр).
- n – количество вещества (моль).
- V – объём вещества-жидкости (литры).
Используя другую задачу и другие данные, существует второй тип для нахождения объема жидкости: v = m/p.
- V – объём и измеряется он в миллилитрах.
- m – масса, измеряется в граммах.
- p – плотность, измеряется в граммах, делённых на миллилитры.
Если в дополнение к объему вам нужно найти массу, вы можете сделать это, зная тип и количество интересующего вас вещества. Используя тип вещества, найдите его молекулярную массу, сложив атомные массы всех элементов, входящих в его состав.
Например, возьмем M(AUSO2). В наших расчетах мы должны получить 197 + 32 + 16 * 2 = 261 г/моль. После этих вычислений находим массу по типу m = n*m: где
- m – масса.
- n – количество вещества, которое измеряется в молях (моль).
- M – молярная масса вещества: граммы, делённые на моль.
Количество вещества обычно указывается в задаче. Если нет, то это может быть опечатка или ошибка в задаче, и вместо того, чтобы пытаться самостоятельно вычислить несуществующую цену, следует обратиться за помощью и объяснениями к преподавателю. В этой статье приведены основные алгоритмы типов и разрешений.
Существует также тип для определения количества газа. Это: v= n*vm:.
- V – объём газа (литры).
- n – количество вещества (моль).
- Vm – молярный объём газа (литры/моль).
Однако существуют определенные исключения. Исключением является то, что при нормальных условиях, т.е. при определенном давлении и температуре, объем газа постоянен и составляет 22,3 л/моль.
Также возможен третий вариант. Если сама задача содержит уравнения реакций, то решение должно проходить по-другому. Из полученных уравнений вы можете найти количество каждого вещества, равное коэффициенту. Например, Ch4 + 2O2 = CO2+H2O. Из этого уравнения следует, что при взаимодействии 1 моль метана и 2 моль кислорода образуется 1 моль углерода и 1 моль воды. Учитывая, что речь идет о количестве вещества одного компонента, нетрудно найти количества всех остальных веществ. Если количество метана составляет 0,3 моль, то n(Ch4) = 0,6 моль, n(CO2) = 0,3 моль и n(H2O) = 0,3 моль.

б) Газовые законы объем газа
В дополнение к приведенным выше формулам, для решения задач вычислительной химии часто необходимо использовать газовые законы, известные из физики.
При постоянной температуре объем данного количества газа обратно пропорционален давлению, при котором он находится.
При постоянном давлении изменение объема газа прямо пропорционально температуре.
Комбинированный закон Бойля-Мариотта и Гей-Люссака для газов.
Кроме того, если известна масса или количество газа, его объем можно рассчитать по формуле Менделеева-Клапейрона
где n — число молекул вещества, m — масса (г), b — молекулярная масса газа (г/моль) и R — глобальная газовая постоянная, равная 8,31 Дж/(моль х К).
4. определение объема газа очень примитивно, если это газ при почти стандартных условиях. Помните, что один моль газа при этих условиях занимает 22,4 литра. Затем можно произвести расчеты, исходя из заданных условий.
Ключевые слова: решение задач на количество вещества, решение задач по химии на массу и объем, количество содержащегося вещества, количество содержащихся молекул, определение объема (v.o.), обнаружение массы, ее массовые частицы, масса определенных молекул, названия веществ, обнаружение массы молекул, определение абсолютной массы молекул, количество содержащихся атомов, относительная плотность. Определение.
Количество вещества — это число строительных блоков (атомов, молекул, ионов), содержащихся в конкретном образце этого вещества. Единицей измерения количества вещества является моль. Количество вещества (n) связано с числом строительных блоков (N), массой (m) и объемом (V) (для газообразных веществ при температуре нулевой концентрации), содержащихся в образце вещества, следующей формулой

В котором.
Vm = 22,4 л/моль (мл/моль, м 3/кмоль) в н.у., Na = 6,02-10 23 (постоянная Авогадро) и молекулярная масса (М) численно равна относительной молекулярной массе вещества:.

Существование такой связи означает, что знание одной из величин (количества, массы, объема или числа структурных единиц вещества) позволяет определить все остальные величины.
РЕШЕНИЯ ПРОСТЫХ ЗАДАЧ
Вопрос 1: Сколько вещества содержится в 33 г оксида углерода (IV)?

Ответ: ν(CO2) = 0,75 моль.
Задача № 2. Сколько молекул содержится в 2,5 моль кислорода?

Ответ: n (O2) = 1,505-1024.
Внимание. В этом сборнике лекций вы будете решать задачи общей сложности. Решения сложных задач и задач с кратким ответом см. в конспекте лекций «Решение упражнений по количественным свойствам».

Задача №3. Определите объем (н.у.), занимаемый 0,25 моль водорода.
Задача № 4. Какова масса куска оксида серы (IV) в объеме 13,44 л (об.)?

Вопрос № 5. Если 3 моль кислорода O2Чтобы. Определите массу кислорода, его количество и число молекул кислорода.
Ответ: m = 96 g- v = 67. 2 l- n(o2) = 1.81-10 24.
Работа №6. масса водорода h2. Определите количество водорода, его количество se. Количество доступных молекул водорода.

Ответ: 5 моль-112 L- 3,01- 10 24.
Работа № 7. Пример количества хлора.2 Н.О.С. Найдите количество хлора, его массу и число молекул хлора.

Ответ: 2,5 моль- 177,5 г- 1,5- 10 24.
Работа № 8. 2.4-10 23. Есть молекулы монооксида углерода (IV) CO2. Определите количество углекислого газа, его массу и количество углекислого газа (Н.С.).

Ответ: 0,4 моль — 17,6 г — 8,96 л.
Вопрос нет. 9. какова масса участка оксида азота (IV), содержащего 4,816-10 23 точки? Каков его объем (Н.С.)?

Вопрос нет. 10. 1,806-10 Масса простого отрезка вещества, содержащего 24 точки, равна 6 г. Определите молекулярный вес вещества и назовите его.

Внимание. В данном пособии рассматриваются задачи нормальной сложности. Нажмите на кнопку ниже, чтобы перейти к решению задач на количество и краткому ответу …
Решайте задачи на количество, массу и объем. Выберите следующие шаги: 1.
4. определение объема газа очень примитивно, если это газ при почти стандартных условиях. Помните, что один моль газа при этих условиях занимает 22,4 литра. Затем можно произвести расчеты, исходя из заданных условий.
Молярный объем: общая информация
Чтобы рассчитать молекулярный вес химического вещества, молекулярный вес вещества делится на его плотность. Таким образом, молекулярный вес рассчитывается по следующему типу
где VM — молекулярный вес вещества, m — молекулярная масса, p — плотность. В международной системе СИ это количество измеряется в кубических метрах на моль (м 3 /моль).
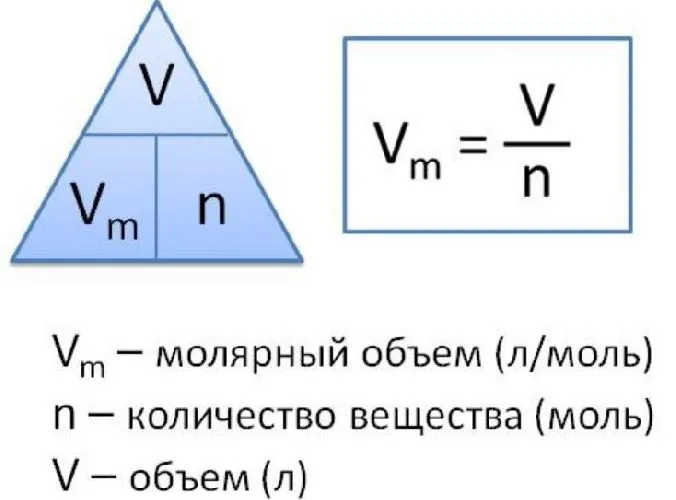
Рисунок 1.Типы молекулярных опухолей.
Молекулярная масса газов отличается от молекулярной массы жидкостей и твердых тел тем, что один молярный элемент газа всегда занимает один и тот же объем (при соблюдении одинаковых параметров).
При расчете объема газа при нормальных условиях, так как объем газа зависит от температуры и давления. Нормальными условиями являются температура 0°C и давление 101 325 кПа.
Молекулярный объем одного моля газа при нормальных условиях всегда одинаков и равен 22,41 DM3 /моль. Этот объем называется молекулярным весом идеального газа. Это означает, что для одного моля газа (кислорода, водорода, воздуха) объем составляет 22,41 дм3 /м.
Молекулярная масса при нормальных условиях может быть получена с помощью законного уравнения для идеального газа, называемого уравнением Клайперона-Менделеева
Где r — глобальная постоянная газа, r = 8,314 дж/моль*k = 0,0821 л*атм/моль k
Объем молярного газа v = rt/p = 8,314*273,15/101,325 = 22,413 л/моль, где t и p — значения температуры (к) и давления при нормальных условиях.
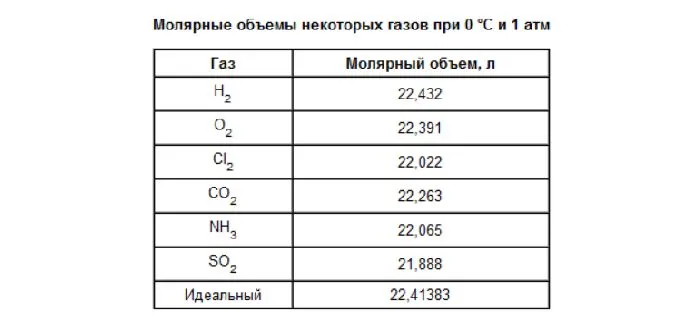
Рисунок 2.Таблица молекулярных опухолей.
Закон Авогадро
В 1811 году А. Авогадро предположил, что равные объемы различных газов (температура и давление) содержат одинаковые молекулы. Впоследствии этот случай был подтвержден и стал законом, названным в честь великого итальянского ученого.
Рисунок 3: Амедео Авогадро.
Закон становится понятным, если вспомнить, что расстояние между частицами в виде газа несравненно больше, чем размер самих частиц.
Таким образом, из закона Авогадро можно сделать следующие выводы.
- В равных объёмах любых газов, взятых при одной и той же температуре и при одном и том же давлении, содержится одно и то же число молекул.
- 1 моль совершенно различных газов при одинаковых условиях занимает одинаковый объем.
- Один моль любого газа при нормальных условиях занимает объем 22,41 л.
Следствия закона Авогадро и понятие молекулярного объема основаны на том, что молекулы любого вещества содержат число частиц (в случае газов и молекул), равное постоянной Авогадро.
Чтобы найти количество молей растворенного вещества в литре раствора, необходимо определить молекулярную концентрацию вещества по формуле c = n / V Где n — количество растворенного вещества, выраженное в молях; V — объем раствора, выраженный в литрах C — молекулярный.
При расчетах газа часто необходимо преобразовать заданные условия в нормальные и наоборот. Таким образом, полезно использовать уравнения, полученные из законов газовой связи Бойля-Мариотта и Гей-Люссака.
Молярный объем

В этом видео учащиеся вспоминают основные формулы и физические величины, знакомятся с новыми понятиями молекулярного объема и учатся решать задачи на основе новых материалов. Это значительно облегчает изучение новых тем.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к видеоурокам этого и других наборов, необходимо приобрести их в каталоге и добавить в личный кабинет.



Конспект урока «Молярный объем»
Молекулярный объем — это объем одного моля вещества. Понятие молекулярного объема применимо к газам. Например, если взять 1 моль воды, то 18 г воды не взвешивают на весах, потому что это совершенно неудобно. Зная, что плотность воды составляет 1 г/мл, мы измеряем ее объем в цилиндре или мензурке.

В этом случае молекулярный объем воды составит 18 мл/моль. Молекулярный объем твердых тел и жидкостей зависит от их плотности. Вода, кислота, сахар и соль имеют разную плотность и, следовательно, разный молекулярный объем.
Если проглотить одну молекулу кислорода, одну молекулу углекислого газа и одну молекулу водорода, то при одинаковых нормальных условиях они занимают одинаковый объем, равный 22,4 л. Эти газы также содержат одинаковое число частиц, т.е. 6,02-1023. Нормальные условия или a.c. — это температура 0°C (градусов Цельсия) и давление 760 мм рт.ст. (миллиметров рт.ст.) или 101,3 кПа (килопаскалей).

Таким образом, молекулярный объем — это объем одного моля газа. Как и другие объемы, он обозначается как молекулярный объем, но с символом V.m .
Молекулярный объем — это также физическая величина, равная отношению объема вещества к количеству вещества. Он может быть записан в следующих типах форматов
Vm =
V — объем газа, а n — количество вещества.
Из этого уравнения также можно найти V.
V = n-Vm
Единицей измерения молекулярной опухоли является л/моль, и эта величина постоянна при нормальных условиях, поэтому молекулярная опухоль составляет 22,4 л/моль.

Объем 1 кмоль называется объемным объемом и измеряется в м 3 / кмоль. То есть 22,4 м 3 / кмоль, а объем 1 ммоль называется объемным объемом и измеряется в мл / моль. Другими словами, объем составляет 22, 4 мл/моль.
Используйте новую формулу для решения задачи.
1. найдите объем азота (N2 ) объемом 2 моль.
Найдите объем азота (N2) в объеме 2 моль. По условию, дано 2 моль азота. Найдите объем азота. Чтобы решить эту задачу, используйте уравнение, чтобы найти объем газа относительно объема вещества. Другими словами, умножьте объем молекулы на объем вещества. Подставьте значение в формулу. То есть 22,4 литра на моль, умноженные на 2 моля, дают 44,8 литра. Таким образом, 2 моль азота занимают объем 44,8 л.

2. найти объем озона (O3 ) имеет объем 67,2 литра.
Согласно этой задаче, учитывая объем озона — 67,2 литра, необходимо найти количество вещества озона. Чтобы решить проблему, используйте тип. Объем делится на молекулярный вес, и значения в формуле обмениваются. Итак, разделив 67,2 литра на 22,4 литра на молекулу, получаем 3 молекулы. Таким образом, 3 моль озона занимают объем 67,2 л.
Таким образом, молекулярный объем — это объем одного моля газа. Как и другие объемы, он обозначается как молекулярный объем, но с символом V.m .
Закон объемных отношений
Если в результате реакции также образуется газ, напишите уравнение реакции между газами.
Соотношение объемов реактора и вещества: 2:1:2. Получим соотношение этих газовых опухолей при нормальных условиях.


Как видите, коэффициент газовой опухоли соответствует отношению предыдущего коэффициента типа вещества в уравнении.
В этой же ситуации объемы реакционных газов и газообразных продуктов реакции относятся друг к другу как небольшие целые числа. Это закон Гей-Лоссака о пропорциональности объемов.
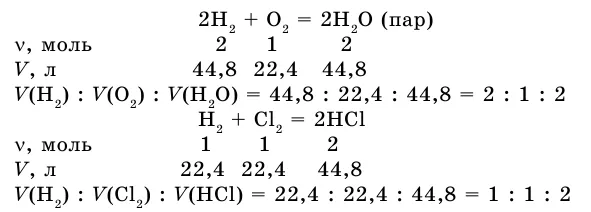
Из изученных примеров можно сделать вывод, что при решении задачи удобно использовать коэффициенты, так как они указывают на количество вещества в уравнении химической реакции.
Согласно уравнению, определите количество кислорода, необходимое для окисления 60 л серы (IV) оксидом серы (VI).

- 1. Моль — мера количества вещества. В 1 моль любого вещества содержится число Авогадро структурных единиц (6,02-1023).
- 2. Молярная масса вещества (М) численно равна относительной молекулярной массе (Мг).
- 3. Расчеты по химическим уравнениям производятся на основе закона сохранения масс веществ.
- 4. В равных объемах газов, взятых при одинаковых условиях, содержится одинаковое число молекул. (Закон Авогадро.)
- 5. Относительной плотностью одного газа по отношению к другому газу (Dy(X)) называется отношение масс газов, взятых в равных объемах при одинаковых условиях.
- 6. Объемы реагирующих газообразных веществ относятся между собой и к объемам образующихся газообразных продуктов, как небольшие целые числа, равные коэффициентам в уравнении химической реакции. (Закон объемных отношений Гей-Люссака.)
- 7. При нормальных условиях (н. у.) любой газ занимает 22,4 л. Эта величина называется молярным объемом (У = 22,4 л/моль).
Услуги в области химии:.
Лекции по химии:.
Лекции по неорганической химии:.
Лекции по органической химии:.
Отправляйте задания в любое время дня и ночи
Официальный сайт Брилёновой Натальи Валерьевны, профессора факультета информатики Екатеринбургского государственного института.
Все права интеллектуальной собственности на загруженный материал сохраняются за бенефициарами этого материала. Коммерческое и/или иное использование запрещено за пределами материалов предварительного изучения NataliblileNova.ru. Публикация и распространение опубликованных материалов не предназначены для получения коммерческой и/или иной выгоды.
Этот сайт предназначен для облегчения образовательного пути студентов. Наталья Брилёнова не предлагает и не оказывает товары и услуги.
Обязательно ссылайтесь на сайт Natalibrilenova.ru в случае создания копий материалов.



