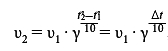Как найти массу по термохимическому уравнению
Алгоритм 8
Расчеты по термохимическим уравнениям. Вычисление массы вещества по известному количеству теплоты
Пример. По термохимическому уравнению
С + О2 = СО2 + 412 кДж вычислите массу сгоревшего угля, если количество теплоты, выделившееся в результате реакции, составляет 82,4 кДж.
С помощью соответствующих обозначений запишем условие задачи, найдем молярную массу вещества, о котором идет речь в условии задачи
Запишем термохимическое уравнение реакции. Обозначим вопросительным знаком количество вещества, массу которого надо
найти, и надпишем количество теплоты, записанное в условии задачи. Под формулой вещества обозначим молярное соотношение, вытекающее из уравнения реакции. Вычислим количество вещества, массу которого требуется найти.
Решение:
Для этого составим пропорцию
х/1=82,4/412, откуда х= 0,2.
Следовательно, n(С)=0,2 моль
Перейдем от количества вещества к массе вещества. Для этого используем молярную массу вещества
химэко
Меню сайта
Категории каталога
| 8 класс [27] |
| 9 класс [16] |
| 10 класс [30] |
| 11 класс [5] |
| Экзамен [4] |
| Лаборатория [7] |
| Опорные конспекты [0] |
| Переменка [6] |
| НОТ школьника [9] |
| Решение задач [9] |
| Творческие работы учащихся [3] |
| Учебные пособия [5] |
Форма входа
Приветствую Вас Гость!
Поиск
Друзья сайта
Наш опрос
Статистика
Термохимические уравнения включают в себя кроме химических формул тепловой эффект реакции. Числовое значение в уравнении реакции строго соответствует количествам веществ, участников реакции, т.е. коэффициентам. Благодаря этому соответствию, можно установить пропорциональные отношения между количеством вещества или массой и количеством теплоты в этой реакции.
Например: Термохимическое уравнение разложения малахита
Мы видим, что на разложение 1 моля малахита необходимо израсходовать 47 кДж, при этом образуется 2 моля оксида меди, 1 моль воды и 1 моль углекислого газа. Если мы затратим энергии в 2 раза больше, мы сумеем разложить 2 моля малахита, при этом получим 4 моля оксида меди, 2 моля воды и 2 моля углекислого газа.
Аналогично можно установить пропорциональные отношения, используя коэффициенты и молярные массы участников реакции. 47 кДж энергии затратится на разложение 94 г малахита, при этом выделится 160 г оксида меди, 18 г воды и 44 г углекислого газа. Пропорция несложная, но, используя массовые числа, учащиеся часто допускают расчетные ошибки, поэтому я рекомендую решать задачи с пропорциями через количество вещества.
Задача 1. Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения.
2 Mq + O 2 = 2 MqO + 1204 кДж
1) Определяем количества оксида магния, используя формулу для нахождения количества вещества через массу.
n ( MqO ) = 120г/ 40 г/моль = 3 моль
2) Составляем пропорцию с учетом коэффициентов в уравнении реакции
Расчёты по термохимическим уравнениям
Теоретический материал представлен на страницах:
Любая химическая реакция сопровождается поглощением или выделением энергии. Термохимические уравнения показывают соотношение между кол-вом веществ, вступающих в реакцию, и кол-вом энергии, которую выделяют, либо поглощают эти вещества в процессе химической реакции.
Главное отличие термохимического уравнения от молекулярного заключается в том, что кроме формул и коэффициентов, в нем указывается еще и кол-во энергии (теплоты реакции), относящееся к числу молей реагирующих веществ, соответствующему коэффициентам в уравнении реакции.
Теплота реакции (тепловой эффект) обозначается буквой Q (измеряется в кДж), и записывается в конце уравнения. Знак «плюс» перед числом обозначает выделившееся кол-во энергии, знак «минус» — кол-во поглощенной энергии.
Реакции, протекающие с выделением энергии, называются экзотермическими; с поглощением энергии — эндотермическими.
Если известна масса одного из двух реагирующих веществ, на основе термохимического уравнения можно определить кол-во теплоты реакции.
Пример 1 . Определить теплоту реакции горения 320 г серы.
- Согласно уравнения реакции, при сгорании 1 моля серы выделяется 297 кДж энергии, нам надо узнать, сколько энергии выделится при сгорании 320 г серы.
- Для решения задачи необходимо составить и решить простую пропорцию:
- Переходим от молей к граммам:
- В пропорции заменяем моли на граммы:
Если известно кол-во выделенной (поглощенной) теплоты в ходе реакции, можно определить массы прореагировавших веществ.
Пример 2 . Определить кол-во сгоревшего угля, если в ходе горения было выделено 33520 кДж энергии.
- Согласно уравнения реакции, при сгорании 1 моль углерода (масса 1 моль С = 12 г) выделилсь 402,24 кДж энергии.
- Составляем и решаем пропорцию:
Пример 3 . При горении 1 л метана (н.у) выделяется 39 кДж энергии. Составить термохимическое уравнение реакции и вычислить тепловой эффект.
Пример 4 . При горении 2,4 г магния (н.у) выделяется 60,12 кДж энергии. Составить термохимическое уравнение реакции.
Пример 5 . Два моля аммиака образуются в результате взаимодействия 1 моля азота с тремя молями водорода. Необходимо составить уравнение термохимической реакции, в ходе которой выделяется 92 кДж тепла, а все вещества, участвующие в реакции, являются газами.
Это очень простая задача, решение которой указано в условии.
Второй вариант записи термохимического уравнения.
Пример 6 . Составить термохимическое уравнение эндотермической реакции образования двухвалентного оксида азота из азота и кислорода с поглощением 180 кДж энергии. Записать это уравнение для образования 1 моля NO.
Первая часть задания не вызывает трудностей:
В этом термохимическом уравнении 2 моля оксида азота образуется при взаимодействии 1 моля азота и 1 моля кислорода. Для того, чтобы переписать данное уравнение для 1 моля оксида азота, необходимо все коэффициенты и кол-во теплоты разделить на 2:
Пример 7 . При образовании 50 г карбоната кальция (CaCO3) выделилось 80 кДж энергии. Определить тепловой эффект реакции разложения одного моля карбоната кальция.
- Определяем кол-во энергии, выделяемое при образовании 1 моля CaCO3 (М(CaCO3)=100 г/моль):
- Термохимическое уравнение реакции образования 1 моль карбоната кальция имеет вид:
- Термохимическое уравнение реакции разложения 1 моль карбоната кальция имеет вид:
- Q=-160 кДж
Пример 8 . Рассчитать кол-во выделенной энергии при образовании 2 л аммиака при н.у.
- Согласно термохимического уравнения — 1 моль аммиака образовался из полумоля азота и полутора молей водорода. Составляем пропорцию:
Пример 9 . Рассчитать тепловой эффект реакции:
- На основании первого следствия из закона Гесса:
- Теплоты образования простых веществ равны нулю:
- Теплоты образования сложных веществ берем из таблицы:
- Подставляем числовые значения в уравнение:
- Термохимическое уравнение реакции будет иметь вид:
Пример 10 . Рассчитать тепловой эффект реакции:
- Тепловой эффект реакции будем рассчитывать по формуле, вытекающей из второго следствия закона Гесса:
- Тепловые эффекты сгорания C2H4 и C2H6 можно взять из приведенных выше термохимический уравнений.
- Тепловой эффект сгорания водорода можно вычислить из термохимического уравнения образования 1 моля воды (теплоту образования воды берем из таблицы):
- Подставляем численные значения в формулу:
- Термохимическое уравнение реакции будет иметь вид:
Пример 11 . Определить скорость изменения реакции синтеза аммиака при а) увеличении концентрации исходных веществ в 2 раза; б) уменьшении давления в реакционной смеси в 2 раза:
- Записываем кинетическое уравнение данной реакции:
- Если концентрации исходных веществ будут увеличены в 2 раза, кинетическое уравнение примет вид:
- Составляем отношение и решаем его:
- Увеличение концентрации исходных веществ в 2 раза приведет к ускорению скорости реакции в 16 раз.
- Исходя из того факта, что концентрации газов пропорциональны давлению (при уменьшении давления в 2 раза концентрации также уменьшатся в 2 раза), логично предположить, что при снижении в 2 раза давления скорость протекания реакции снизится в 16 раз. Убедимся в этом, составив соотношение кинетических уравнений.
- Исхдное кинетическое уравнение:
- Для удобства чтения формул сделаем подстановку:
- Кинетическое уравнение при снижении давления в 2 раза:
- Соотошение:
- При уменьшении давления в реакционной смеси в 2 раза скорость протекания реакции уменьшится в 16 раз.
Пример 12 . Определить скорость изменения реакции с температурным коэффициентом 4 (γ=4) при повышении температуры с 10°C до 30°C.
Для решения задачи воспользуемся правилом Вант-Гоффа, которое выражается следующей математической формулой:
Все, что нам нужно сделать — подставить численные значения в формулу и провести расчеты:
При повышении температуры с 10 до 30 градусов Цельсия скорость реакции увеличится в 16 раз.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
источники:
http://himekoscho.ucoz.ru/load/termokhimicheskie_uravnenija/27-1-0-130
http://prosto-o-slognom.ru/chimia_primery/005-termochimicheskie_uravneniya.html
Алгоритм 8
Расчеты по термохимическим уравнениям. Вычисление массы вещества по известному количеству теплоты
Пример. По термохимическому уравнению
С + О2 = СО2 + 412 кДж вычислите массу сгоревшего угля, если количество теплоты, выделившееся в результате реакции, составляет 82,4 кДж.
С помощью соответствующих обозначений запишем условие задачи, найдем молярную массу вещества, о котором идет речь в условии задачи
Дано:
Q = 82,4 кДж
Qр-ции = 412кДж
—————–
m(С) = ? г
М(С) = 12 г/моль
Запишем термохимическое уравнение реакции. Обозначим вопросительным знаком количество вещества, массу которого надо
найти, и надпишем количество теплоты, записанное в условии задачи. Под формулой вещества обозначим молярное соотношение, вытекающее из уравнения реакции. Вычислим количество вещества, массу которого требуется найти.
Решение:
?моль 82,4 кДж
С + О2 = СО2 + 412 кДж
1 моль
Для этого составим пропорцию
х/1=82,4/412, откуда х= 0,2.
Следовательно, n(С)=0,2 моль
Перейдем от количества вещества к массе вещества. Для этого используем молярную массу вещества
m=n•М
m(С)=n(C)•М(С)
m(C)=0,2моль•12г/моль=2,4
Запишем ответ
Ответ: m(С) = 2,4 г
Приветствую вас, уважаемые читатели, на своем канале!
В данной статье разберем вопрос 27 – расчеты теплового эффекта (по термохимическим уравнениям).
Теорию по данному заданию можно посмотреть здесь.
Данное задание не претерпело изменений. Рассмотрим пять примеров.
Пример 1 (из демонстрационного варианта ЕГЭ 2022)
Синтез аммиака протекает в соответствии с термохимических уравнением реакции:
N2(г) + 3H2(г) = 2NH3(г) + 92 кДж.
Определите количество теплоты, которое выделится в результате образования 560 мл (н.у.) газообразного аммиака. (Запишите число с точностью до сотых.)
Решение
1) Перепишем уравнение реакции, укажем мольное соотношение и тепловой эффект по реакции:
2) Переведем объем в литры – 0,56 л, количество теплоты обозначим за Q. Все эти данные подпишем над уравнением реакции:
3) Так как известен объем аммиака (NH3), то по реакции объем равен: 2*22,4:
4) Составим пропорцию и решим ее:
0,56/44,8 = Q/92
Q = 1,15 кДж.
Ответ: 1,15
Пример 2 (авторы: Е.А. Дацук и A.А. Степенин 2022)
В реакцию, термохимическое уравнение которой
C2H5OH(ж) + 3O2(г) = 2CO2(г) + 3H2O(ж) + 1374 кДж,
вступило 16,1 г этанола. Вычислите количество выделившейся при этом теплоты (в кДж). Ответ запишите с точностью до десятых.
Решение
1) Перепишем уравнение реакции, укажем мольное соотношение и тепловой эффект по реакции:
2) Масса этанола (С2H5OH) равна 16,1 г; количество теплоты обозначим за Q. Все эти данные подпишем над уравнением реакции:
3) Так как известна масса этанола (С2H5OH), то по реакции масса равна: 1*46:
4) Составим пропорцию и решим ее:
16,1/46 = Q/1374
Q = 480,9 кДж.
Ответ: 480,9
Пример 3 (авторы: Е.А. Дацук и A.А. Степенин 2022)
Теплота образования оксида алюминия из простых веществ составляет 1676 кДж/моль. Вычислите объем кислорода (при н.у.), вступивший в реакцию с алюминием, если в результате получено 502,8 кДж тепла. Ответ запишите с точностью до сотых.
Решение
1) Запишем уравнение реакции и укажем тепловой эффект реакции:
Откуда взялось число 3352? В условии сказано, что для 1-го моль оксида алюминия теплота составляет 1676 кДж, соответственно, для 2-х моль – 3352 кДж.
2) Объем кислорода (O2) обозначим за V, теплота равна 502,8 кДж. Все эти данные подпишем над уравнением реакции:
3) Необходимо найти объем кислорода (O2), поэтому по реакции объем равен: 3*22,4:
4) Составим пропорцию и решим ее:
V/67,2 = 502,8/3352
V = 10,08 л.
Ответ: 10,08
Пример 4 (автор: Ю. Н. Медведев 2022)
Определите тепловой эффект реакции
2С2H2 + 5O2 = 4CO2 + 2H2O + Q,
если известно, что при сгорании 3,36 л (при н.у.) ацетилена выделяется 195,75 кДж теплоты. (Запишите число с точностью до целых.)
Решение
1) Перепишем уравнение реакции, укажем мольное соотношение и тепловой эффект по реакции:
Тепловой эффект – неизвестный параметр, который необходимо найти.
2) Известен объем ацетилена (С2H2) 3,36 л и теплота 195,75 кДж. Все эти данные подпишем над уравнением реакции:
3) Так как известен объем ацетилена (С2H2), то объем по реакции равен: 2*22,4:
4) Составим пропорцию и решим ее:
3,36/44,8 = 195,75/Q
Q = 2610 кДж.
Ответ: 2610
Пример 5 (авторы: С.И. Широкопояс и И.С. Борисов 2022)
При сгорании навески неизвестного органического вещества выделяется 560 кДж теплоты и образуется 60 л углекислого газа. Вычислите количество теплоты, выделяющееся при образовании 108 л углекислого газа в тех же условиях. (Запишите ответ с точностью до целых)
Решение
Данную задачу можно решить через пропорцию без уравнения реакции, так как даны одинаковые условия.
Составим пропорцию:
60 л – 560 кДж
108 л – Q кДж, где Q – теплота, выделяющаяся при образовании 108 л углекислого газа (CO2).
Q = 1008 кДж.
Ответ: 1008
Если есть вопросы, то пишите в комментариях.
Разборы примеров предыдущих вопросов можно посмотреть здесь:
– вопрос 1;
– вопрос 2;
– вопрос 4.
Не забываем поставить лайк этой статье и подписаться на канал!
Всем успехов в изучении химии!
Термохимические
уравнения включают в себя кроме химических формул тепловой эффект реакции.
Числовое значение в уравнении реакции строго соответствует количествам веществ,
участников реакции, т.е. коэффициентам.
Благодаря этому соответствию, можно установить пропорциональные отношения между
количеством вещества или массой и количеством теплоты в этой реакции.
Например: Термохимическое уравнение разложения малахита
(CuOH)2 CO3 = 2CuO
+ H 2 O + CO 2 –
47 кДж
Мы видим, что на разложение 1
моля малахита необходимо израсходовать 47 кДж, при этом образуется 2 моля
оксида меди, 1 моль воды и 1 моль углекислого газа. Если мы затратим энергии в
2 раза больше, мы сумеем разложить 2 моля малахита, при этом получим 4 моля
оксида меди, 2 моля воды и 2 моля углекислого газа.
Аналогично
можно установить пропорциональные отношения, используя коэффициенты и молярные массы
участников реакции. 47 кДж энергии
затратится на разложение 94 г малахита, при этом выделится 160 г оксида меди,
18 г воды и 44 г углекислого газа. Пропорция несложная, но, используя массовые числа, учащиеся часто
допускают расчетные ошибки, поэтому я рекомендую решать задачи с пропорциями
через количество вещества.
Решим задачи:
Задача 1. Определите количество теплоты, которое
выделится при образовании 120 г MgO в результате реакции
горения магния, с помощью термохимического уравнения.
2 Mq + O2 = 2MqO + 1204 кДж
|
Дано: m (Mg0) = 120г Найти: Q1 -? |
Решение: 1) Определяем n = m / M n(MqO) = 120г/ 40 г/моль = 3 моль 2) Составляем По По |
Отсюда
|
3 моль* 1204кДж |
|||
|
Q1 |
= |
———————– |
= 1803 кДж |
|
2моль |
Ответ: При образовании 120г
оксида магния выделится 1803 кДж энергии.
Задача 2. В результате реакции, термохимическое
уравнение которой
2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж
выделилось 652,5 кДж теплоты. Определите массу сгоревшего
ацетилена.
|
Дано: Q1 = 652,5 кДж Найти: m(C2H2)-? |
Решение: 1) Установим По По условию х моль ———- 652,5 кДж Решаем
2) Определяем массу ацетилена по формуле m |
Ответ: масса сгоревшего ацетилена 13 г.
Задача 3. В
результате горения 48 г метана выделилось 2406 кДж теплоты. Составьте
термохимическое уравнение этой реакции.
|
Дано: m(CH4)= 48г Q1 = 2406 кДж Найти: Q -? |
Решение: 1. Запишем уравнение реакции горения метана в общем виде CH4+ 2O2 = CO2 +2H2O 2. Определим количество n = m / M n(CH4) = 48г/ 16 г/моль = 3 моль 3. Составляем пропорцию с учетом коэффициентов в По условию 3моля CH4 По уравнению 1 моль CH4 Решаем
Ответ: термохимическое уравнение реакции горения CH4+ 2O2 = CO2 +2H2O |
Задача 4. Какой объем
кислорода (при н.у.) выделится в результате реакции, термохимическое уравнение
которой
2KClO3 = 2KCl + 3O2 – 91 кДж,
если на разложение
бертолетовой соли было затрачено 182 кДж теплоты.
|
Дано: Q1 = 91 кДж Найти: V (O2)-? |
Решение: 1)Установим По По условию х моль ———- 182 кДж Решаем
2) Вычислим объем (Vm = 22б4 л.моль) V = n * Vm V(O2) = 6 моль * 22,4 л/моль = 134,4 л |
Ответ: объем выделившегося кислорода равен 134,4 л.
Решите самостоятельно:
1. Согласно термохимическому уравнению реакции
CH4+ 2O2 = CO2 +2H2O + 802 кДж
определите количество теплоты, выделившейся при сжигании 24
г метана.
2. Тепловой эффект реакции горения серы равен 297 кДж.
Какая масса серы сгорела, если выделилось
742,5 кДж теплоты.
3. По термохимическому
уравнению H2+ Cl2 = 2HCl + 184,36 кДж рассчитайте, какой объем затрачен на образование хлороводорода (при н.у.), если при этом
выделилось 921,8 кДж теплоты.
Проверьте
решение на тренажере
Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции.
Любая химическая реакция сопровождается выделением или поглощением энергии в виде теплоты.
По признаку выделения или поглощения теплоты различают экзотермические и эндотермические реакции.
Экзотермические реакции – такие реакции, в ходе которых тепло выделяется (+Q).
Эндотермические реакции – реакции, при протекании которых тепло поглощается (-Q).
Тепловым эффектом реакции (Q) называют количество теплоты, которое выделяется или поглощается при взаимодействии определенного количества исходных реагентов.
Термохимическим уравнением называют уравнение, в котором указан тепловой эффект химической реакции. Так, например, термохимическими являются уравнения:
Также следует отметить, что термохимические уравнения в обязательном порядке должны включать информацию об агрегатных состояниях реагентов и продуктов, поскольку от этого зависит значение теплового эффекта.
Расчеты теплового эффекта реакции
Пример типовой задачи на нахождение теплового эффекта реакции:
При взаимодействии 45 г глюкозы с избытком кислорода в соответствии с уравнением
C6H12O6(тв.) + 6O2(г) = 6CO2(г) + 6H2O(г) + Q
выделилось 700 кДж теплоты. Определите тепловой эффект реакции. (Запишите число с точностью до целых.)
Решение:
Рассчитаем количество вещества глюкозы:
n(C6H12O6) = m(C6H12O6) / M(C6H12O6) = 45 г / 180 г/моль = 0,25 моль
Т.е. при взаимодействии 0,25 моль глюкозы с кислородом выделяется 700 кДж теплоты. Из представленного в условии термохимического уравнения следует, что при взаимодействии 1 моль глюкозы с кислородом образуется количество теплоты, равное Q (тепловой эффект реакции). Тогда верна следующая пропорция:
0,25 моль глюкозы — 700 кДж
1 моль глюкозы — Q
Из этой пропорции следует соответствующее ей уравнение:
0,25 / 1 = 700 / Q
Решая которое, находим, что:
Q = 2800 кДж
Таким образом, тепловой эффект реакции составляет 2800 кДж.
Расчёты по термохимическим уравнениям
Намного чаще в заданиях ЕГЭ по термохимии значение теплового эффекта уже известно, т.к. в условии дается полное термохимическое уравнение.
Рассчитать в таком случае требуется либо количество теплоты, выделяющееся/поглощающееся при известном количестве реагента или продукта, либо же, наоборот, по известному значению теплоты требуется определить массу, объем или количество вещества какого-либо фигуранта реакции.
Пример 1
В соответствии с термохимическим уравнением реакции
3Fe3O4(тв.) + 8Al(тв.) = 9Fe(тв.) + 4Al2O3(тв.) + 3330 кДж
образовалось 68 г оксида алюминия. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.)
Решение
Рассчитаем количество вещества оксида алюминия:
n(Al2O3) = m(Al2O3) / M(Al2O3) = 68 г / 102 г/моль = 0,667 моль
В соответствии с термохимическим уравнением реакции при образовании 4 моль оксида алюминия выделяется 3330 кДж. В нашем же случае образуется 0,6667 моль оксида алюминия. Обозначив количество теплоты, выделившейся при этом, через x кДж составим пропорцию:
4 моль Al2O3 — 3330 кДж
0,667 моль Al2O3 — x кДж
Данной пропорции соответствует уравнение:
4 / 0,667 = 3330 / x
Решая которое, находим, что x = 555 кДж
Т.е. при образовании 68 г оксида алюминия в соответствии с термохимическим уравнением в условии выделяется 555 кДж теплоты.
Пример 2
В результате реакции, термохимическое уравнение которой
4FeS2(тв.) + 11O2(г) = 8SO2(г) + 2Fe2O3(тв.) + 3310 кДж
выделилось 1655 кДж теплоты. Определите объем (л) выделившегося диоксида серы (н.у.). (Запишите число с точностью до целых.)
Решение
В соответствии с термохимическим уравнением реакции при образовании 8 моль SO2 выделяется 3310 кДж теплоты. В нашем же случае выделилось 1655 кДж теплоты. Пусть количество вещества SO2, образовавшегося при этом, равняется x моль. Тогда справедливой является следующая пропорция:
8 моль SO2 — 3310 кДж
x моль SO2 — 1655 кДж
Из которой следует уравнение:
8 / х = 3310 / 1655
Решая которое, находим, что:
x = 4 моль
Таким образом, количество вещества SO2, образовавшееся при этом, составляет 4 моль. Следовательно, его объем равен:
V(SO2) = Vm ∙ n(SO2) = 22,4 л/моль ∙ 4 моль = 89,6 л ≈ 90 л (округляем до целых, т.к. это требуется в условии.)
Больше разобранных задач на тепловой эффект химической реакции можно найти здесь.