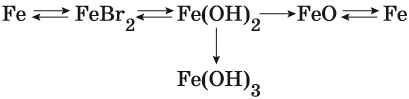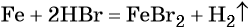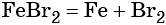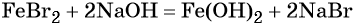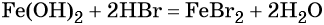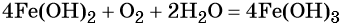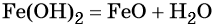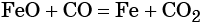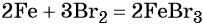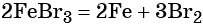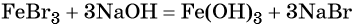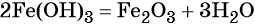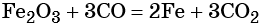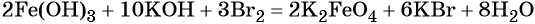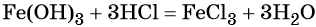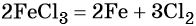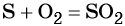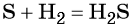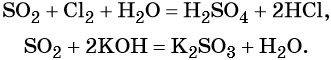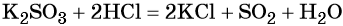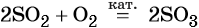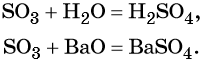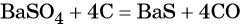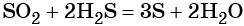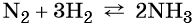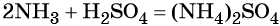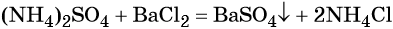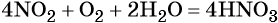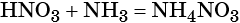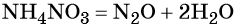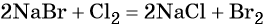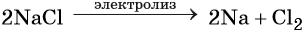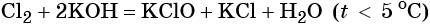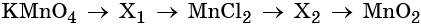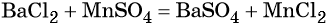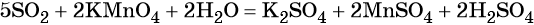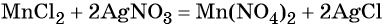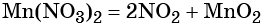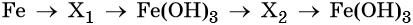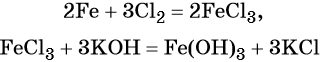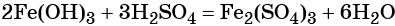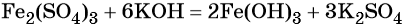artem3076
+10
Решено
8 лет назад
Химия
5 – 9 классы
Как практически осуществить следующие цепочки превращений?Составьте соответствующие уравнения реакций,укажите их типы и тепловые эффекты.
НЕ ЗНАЮ КАК СТАВИТЬ СТРЕЛКУ НА КЛАВИАТУРЕ ПОЭТОМУ ВМЕСТО СТРЕЛКИ ВОТ ЭТО –
1)H2O2-O2-Al2O3 2)KMnO4-O2-Cao 3)KNO3-O2-CO 4)HgO-O2-P2O3
Смотреть ответ
1
Ответ
4
(5 оценок)
17
DashaNikitina451
8 лет назад
Светило науки – 459 ответов – 0 раз оказано помощи
2H₂O₂ = O₂ + 2H₂O
3O₂ + 4Al = 2Al₂O₃
2KMnO₄ = K₂MnO₄ + MnO₂ + O₂
O₂ + 2Ca = 2CaO
2KNO₃ = 2KNO₂ + O₂
O₂ + 2C = 2CO
2HgO = 2Hg + O₂
3O₂ + 4P = 2P₂O₃
(5 оценок)
https://vashotvet.com/task/9668498
Как практически осуществить следующие цепочки превращений?
Составьте соответствующие уравнения реакций, укажите их типы и тепловые эффекты.
НЕ ЗНАЮ КАК СТАВИТЬ СТРЕЛКУ НА КЛАВИАТУРЕ ПОЭТОМУ ВМЕСТО СТРЕЛКИ ВОТ ЭТО – 1)H2O2 – O2 – Al2O3 2)KMnO4 – O2 – Cao 3)KNO3 – O2 – CO 4)HgO – O2 – P2O3.
Вы находитесь на странице вопроса Как практически осуществить следующие цепочки превращений? из категории Химия.
Уровень сложности вопроса рассчитан на учащихся 5 – 9 классов. На странице
можно узнать правильный ответ, сверить его со своим вариантом и обсудить
возможные версии с другими пользователями сайта посредством обратной связи.
Если ответ вызывает сомнения или покажется вам неполным, для проверки
найдите ответы на аналогичные вопросы по теме в этой же категории, или создайте
новый вопрос, используя ключевые слова: введите вопрос в поисковую строку,
нажав кнопку в верхней части страницы.
Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних
веществ в другие, которые характеризуют генетическую связь между основными
классами органических и неорганических соединений.
Схему превращения одних веществ в другие называют «цепочкой превращений».
Для выполнения этих заданий необходимо знать основные
классы соединений, их номенклатуру, химические свойства, механизм
осуществления реакций.
Алгоритм решения
«цепочки превращений»
1 шаг. Перепишите
цепочку, которую необходимо решить
Ca → CaO → Ca(OH)2
→ Ca3(PO4)2
2 шаг. Пронумеруйте
количество реакций для удобства решения
1
2 3
Ca → CaO → Ca(OH)2
→ Ca3(PO4)2
Таким
образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг. Запишем 1
уравнение реакции – из кальция (Сa) надо получить оксид кальция (CaO). Вспомним,
что данное превращение происходит, когда металлы окисляются на воздухе, вступая
в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте
уравнивать реакции!
1) 2Сa + O2 2Ca+2O-2
4 шаг.
Осуществляем второе превращение. Из оксида кальция (CaO) нужно
получить гидроксид кальция (Ca(OH)2). Это уравнение
возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в
итоге получается щелочь – растворимое в воде основание). Записываем
уравнение и уравниваем его.
2) 2Ca+2O-2 + H2O → Ca 2+(OH)2–
5 шаг. Осуществляем
3 превращение. Из гидроксида кальция (Ca(OH)2)
необходимо получить соль – фосфат кальция (Ca3(PO4)2).
Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода.
Значит, для этой реакции подойдет фосфорная кислота – H3PO4, так как
именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
3) 3Ca2+(OH)2–
+ 2H3+PO43- → Ca32+(PO4)23-
+ 6H2O
Химические цепочки превращений: примеры и способы решения
Химические цепочки превращений — это один из наиболее часто встречающихся в школьных учебниках, а также на самостоятельных, проверочных и контрольных типов задач по химии. Чтобы успешно их решать, нужно понимать, как именно они устроены и каким образом стоит подходить к ним. Рассмотрим, как решать цепочки превращений в общем и на конкретных примерах.
Общие принципы решения химических цепочек превращений
Для начала нужно внимательно прочитать условие задачи и изучить цепочку. Четко поняв, что требуется в задаче, можно переходить непосредственно к ее решению.
- Выписав отдельно цепочку химических превращений, пронумеруйте количество необходимых реакций (они обозначены стрелочками от одного вещества к другому).
- Определите, к какому классу веществ относится каждый член цепочки и, если необходимо, выпишите на черновике отдельно в столбик каждое вещество из цепочки и его класс. В случае когда имеются неназванные вещества и их класс неизвестен, проанализируйте, какие вещества могут быть получены из исходного и какого класса вещество должно выступить исходным для следующего после неназванного вещества элемента цепочки.
- Проанализируйте, каким образом можно получить вещество этого класса из исходного для каждого элемента цепочки. В случае если прямая реакция невозможна, подумайте, какие классы веществ можно получить из исходного вещества и из каких получаемых веществ можно позже синтезировать конечное требуемое вещество.
- Составьте схему уравнения первой из необходимых реакций. Не забудьте расставить коэффициенты в уравнении.
- Последовательно осуществите цепочку химических превращений, рассматривая каждую реакцию в отдельности. Проверьте себя, уделяя внимание оформлению реакций.
Пример решения цепочки превращений
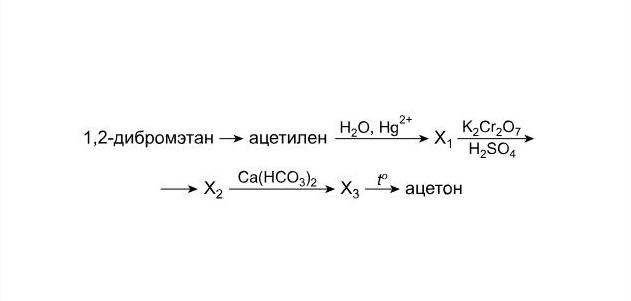
Допустим, в задаче имеется химическая цепочка превращений следующего вида:
Необходимо найти вещества, обозначенные как Х1, Х2 и Х3, и осуществить указанные реакции. Рассмотрим, какие реакции необходимо выполнить для решения этой цепочки после того, как вы пронумеруете стрелки и определите классы веществ.
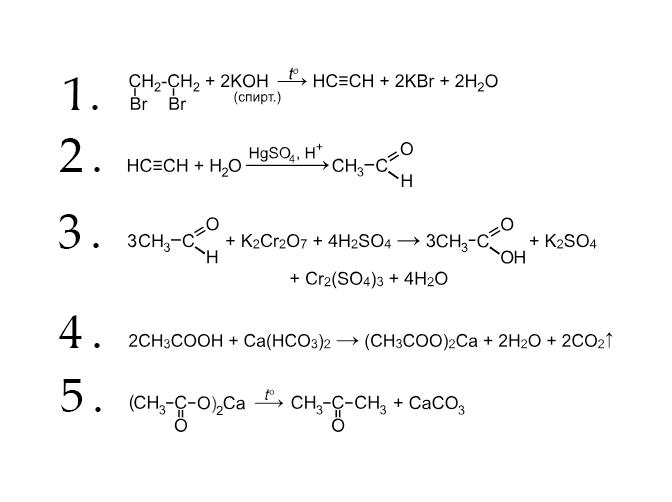
- Для того чтобы из 1,2-дибромэтана получить ацетилен, нужно воздействовать на него спиртовым раствором щелочи при нагревании. В ходе этой реакции от одной из молекул 1,2-дибромэтана отщепятся две молекулы бромоводорода. Эти молекулы будут нейтрализованы щелочью.
- Далее, исходя из условий протекания реакции, вы делаете вывод, что это реакция М. Г. Кучерова. Она приводит к образованию ацетальдегида.
- Ацетальдегид, реагируя в присутствии серной кислоты с дихроматом калия, дает уксусную кислоту.
- Гидрокарбонат вступает в реакцию обмена с раствором кислоты.
- Полученный ацетат щелочноземельного металла при нагревании разлагается, образуя карбонат металла и кетон.
Таким образом, записанное поэтапно решение данной химической цепочки превращений будет выглядеть так:
Полезные советы
Решая цепочки химических уравнений, важно помнить, что конечный результат зависит от каждой последовательно верно решенной реакции в этой цепочке. Следовательно, проверяя себя на последнем этапе, нужно перепроверить возможность каждой реакции и правильность составления и решения уравнения.
Кроме того, если вы сомневаетесь, верно ли вывели ту или иную формулу вещества, вы можете заглянуть на этапе обучения в справочник химических веществ. Важно при этом помнить, что надо не просто сверяться с ним, а запоминать формулы и стараться в дальнейшем самостоятельно воспроизводить их.
Алгоритм решения «цепочек превращений» веществ. Инструкция для учащихся 8 класса
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних веществ в другие, которые характеризуют генетическую связь между основными классами органических и неорганических соединений.
Схему превращения одних веществ в другие называют «цепочкой превращений » .
Для выполнения этих заданий необходимо знать основные классы соединений, их номенклатуру, химические свойства, механизм осуществления реакций.
Алгоритм решения «цепочки превращений»
1 шаг. Перепишите цепочку, которую необходимо решить
2 шаг. Пронумеруйте количество реакций для удобства решения
Таким образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг. Запишем 1 уравнение реакции – из кальция (С a ) надо получить оксид кальция ( CaO ). Вспомним, что данное превращение происходит, когда металлы окисляются на воздухе, вступая в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте уравнивать реакции!
2 С a + O 2 2Ca +2 O -2
4 шаг. Осуществляем второе превращение. Из оксида кальция ( CaO ) нужно получить гидроксид кальция ( Ca ( OH ) 2 ). Это уравнение возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в итоге получается щелочь – растворимое в воде основание). Записываем уравнение и уравниваем его.
2) 2 Ca +2 O -2 + H 2 O → Ca 2+ ( OH ) 2 —
5 шаг . Осуществляем 3 превращение. Из гидроксида кальция ( Ca ( OH ) 2 ) необходимо получить соль – фосфат кальция ( Ca 3 ( PO 4 ) 2 ). Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода. Значит, для этой реакции подойдет фосфорная кислота – H 3 PO 4 , так как именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 924 человека из 80 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 20 человек из 11 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 35 человек из 23 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 579 564 материала в базе
Материал подходит для УМК
«Химия», Габриелян О.С.
§ 43. Генетическая связь между классами веществ
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Другие материалы
- 16.05.2020
- 206
- 3
- 14.04.2020
- 306
- 6
- 28.03.2020
- 863
- 5
- 14.03.2020
- 376
- 7
- 11.02.2020
- 1145
- 1
- 05.02.2020
- 1542
- 100
- 16.01.2020
- 1315
- 15
- 13.01.2020
- 362
- 1
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 17.05.2020 31703
- DOCX 19.5 кбайт
- 218 скачиваний
- Рейтинг: 5 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Светлова Елена Александровна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 7 лет и 1 месяц
- Подписчики: 3
- Всего просмотров: 65777
- Всего материалов: 42
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Инфоурок стал резидентом Сколково
Время чтения: 2 минуты
В Ростовской и Воронежской областях организуют обучение эвакуированных из Донбасса детей
Время чтения: 1 минута
Университет им. Герцена и РАО создадут портрет современного школьника
Время чтения: 2 минуты
РДШ организовало сбор гуманитарной помощи для детей из ДНР
Время чтения: 1 минута
В Курганской области дистанционный режим для школьников продлили до конца февраля
Время чтения: 1 минута
Минпросвещения упростит процедуру подачи документов в детский сад
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Взаимосвязь различных классов неорганических веществ
Рассмотрим её на нескольких примерах.
Пример 1. Взаимосвязь соединений железа.
Переход из железа в бромид железа (II) возможен при реакции железа с бромоводородной кислотой:
Получить из бромида железа (II) чистое железо можно при электролизе расплава:
При добавлении к бромиду железа (II) щёлочи образуется гидроксид железа (II):
Обратный переход возможен при взаимодействии гидроксида железа (II) с бромоводородной кислотой:
Окисление гидроксида железа (II) приводит к гидроксиду железа (III):
При нагревании гидроксид железа (II) теряет воду, превращаясь в оксид железа (II):
Восстановление оксида железа (II) приводит к железу:
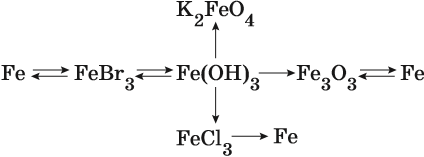
Пример 2. Взаимосвязь соединений железа.
Реакция железа с бромом приводит к бромиду железа (III):
Получить из этого соединения железо можно электролизом расплава:
Переход из бромида железа (III) в гидроксид железа (III) возможен под действием щёлочи:
При нагревании гидроксид железа (III) теряет воду, превращаясь в оксид железа (III):
Восстановлением оксида железа (III) можно получить железо:
Железо в степени окисления +6 можно получить из гидроксида железа (III) по реакции:
Гидроксид железа (III) под действием соляной кислоты переходит в хлорид железа (III):
Из хлорида железа (III) электролизом можно получить железо:
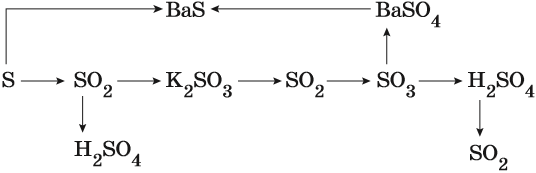
Пример 3. Взаимосвязь соединений серы.
Сера окисляется кислородом воздуха до оксида серы (IV):
Взаимодействие серы с водородом приводит к сероводороду:
Оксид серы (IV) может вступить в окислительно-восстановительную реакцию с образованием серной кислоты или в обменную реакцию с образованием сульфита калия:
Под действием сильных кислот сульфит калия разлагается до SO2:
Каталитическое окисление SO2 приводит к оксиду серы (VI):
Из оксида серы (VI) можно получить как серную кислоту, так и сульфат бария:
Из сульфата бария восстановлением углём можно получить сульфид бария:
Восстановление SO2 приводит к сере:
Пример 4. Осуществить следующую цепочку превращений: N2 → NH3 → (NH4)2SO4 → NH4Cl.
Азот взаимодействует с водородом при повышенной температуре в присутствии катализатора с образованием аммиака:
Реакция газообразного аммиака с серной кислотой приводит к сульфату аммония:
При взаимодействии водных растворов сульфата аммония и хлорида бария образуется нерастворимый сульфат бария, эта реакция идёт до конца. После отделения осадка и упаривания водного раствора можно выделить чистый хлорид аммония:
Пример 5. Осуществить следующую цепочку превращений: NO2 → HNO3 → NH4NO3 → N2O.
Оксид азота (IV) при взаимодействии с кислородом и водой даёт азотную кислоту:
При реакции азотной кислоты с аммиаком образуется нитрат аммония:
Контролируемое разложение нитрата аммония приводит к образованию оксида азота (I) и воды:
Пример 6. Осуществить следующую цепочку превращений: NaBr → NaCl → Cl2 → KClO.
Хлор способен вытеснять бром из бромидов:
Электролиз расплава хлорида натрия приводит к образованию молекулярного хлора:
Гипохлорид калия образуется при взаимодействии газообразного хлора с водным раствором гидроксида калия при охлаждении:
Особенностью заданий, в которых требуется определить неизвестное вещество Х как промежуточный продукт в цепочке химических превращений, является принципиальная возможность наличия нескольких правильных ответов. Вам нужно обосновать свой выбор.
Пример 7. Предложите формулы неизвестных веществ в приведённых ниже последовательностях химических превращений и обоснуйте этот выбор. Приведите уравнения химических реакций, с помощью которых эти превращения можно осуществить:
Каким же может быть вещество X1? Возможны несколько вариантов. Предположим, что марганец в этом соединении имеет степень окисления +2, тогда этим веществом будет, например, сульфат марганца (II). Почему? Из него удобно получит хлорид марганца (II) с помощью обменной реакции:
Данная реакция пойдёт до конца, потому что сульфат бария выпадет в осадок.
Перманганат калия — сильный окислитель, который при реакции с восстановителем в кислой среде может понизить свою степень окисления до +2. Чтобы получить сульфат марганца (II) из перманганата калия, можно использовать окислительно-восстановительную реакцию:
Другой вариант ответа:
Из хлорида марганца (II) можно получить нитрат марганца (II) с помощью обменной реакции с нитратом серебра. Эта реакция идёт до конца благодаря образованию нерастворимого хлорида серебра:
Термическое разложение нитрата марганца (II) — обычный способ получения оксида марганца (IV):
Пример 8. Предложите формулы неизвестных веществ в приведённых ниже последовательностях химических превращений и обоснуйте этот выбор. Приведите уравнения химических реакций, с помощью которых эти превращения можно осуществить:
Наиболее рациональным вариантом будет следующий. Вначале железо под действием хлора окисляется до хлорида железа (III) (вещество X1), из которого по обменной реакции получают гидроксид железа (III):
Веществом (X2) может быть любая растворимая соль железа (III), например сульфат, нитрат и т. д.:
Под действием расчётного количества щёлочи в осадок выпадает гидроксид железа (III):
Тренировочные задания
Общее задание 1. Составьте уравнения реакций, с помощью которых можно осуществить следующие цепочки превращений:
12. Cl2 → NaCl → HCl → AlCl3.
13. KCl → Cl2 → NaClO → NaClO3.
14. HBr → NaBr → Br2 → HBr.
15. KBr → Br2 → HBr → NaBr.
16. NaCl → HCl → Cl2 → KClO3.
Общее задание 2. Предложите формулы неизвестных веществ в приведённых ниже последовательностях химических превращений и обоснуйте ваш выбор. Приведите уравнения химических реакций, с помощью которых эти превращения можно осуществить:
4. SiO2 → Si → X → BaSiO3.
источники:
http://infourok.ru/algoritm-resheniya-cepochek-prevrashenij-veshestv-instrukciya-dlya-uchashihsya-8-klassa-4304493.html
http://himi4ka.ru/ogje-2018-po-himii/urok-19-vzaimosvjaz-razlichnyh-klassov-neorganicheskih-veshhestv.html
Задания. Цепочки химических превращений
-
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
C → CO2 → CaCO3 → CaCl2 → Ca(NO3)2 → Ca3(PO4)2
-
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
S → SO2 → H2SO3 → SO2 → CaSO3 → CaSO4
-
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Na → NaOH → Na2CO3 → CO2 → CaCO3 → CO2
-
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Mg → MgO → MgCO3 → MgO → Mg(OH)2 → MgCl2
-
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Al → Al2O3 → AlCl3 → Al(OH)3 → Al2(SO4)3 → Al(OH)3
-
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
P → P2O5 → H3PO4 → H2O → NaOH → Na3PO4
-
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Si → SiO2 → Na2SiO3 → H2SiO3 → SiO2 → Li2SiO3
-
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Ca → CaO → CaCO3 → CaCl2 → Ca(OH)2 → CaCO3
-
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
N2O5 → HNO3 → Ca(NO3)2 → CaCO3 → Ca(NO3)2 → Ca(OH)2
-
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Mg(OH)2
→ MgO → MgCO3 → MgCl2 → Mg(NO3)2 → Mg3(PO4)2
-
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
C → CO2 → CaCO3 → CaCl2 → Ca(NO3)2 → Ca3(PO4)2
-
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Al → Al2O3 → AlCl3 → Al(OH)3 → Al2(SO4)3 → Al(OH)3
-
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
P → P2O
5 → H3PO4 → H2O → NaOH → Na3PO4
infourok.ru
Практическая работа по химии №1 «Осуществление цепочки химических превращений» (9 класс)
Практическая работа №1. 9 класс
Осуществление цепочки химических превращений
Цель: Осуществить цепочку химических превращений; изучить способы получения и свойства гидроксидов металла (меди)
ВАРИАНТ 1.
1.Повторите правила техники безопасности
2. Проведите реакции, в которых осуществляются предложенные ниже химические превращения:
CuSO4 → Cu(OH)2 → CuO → Cu
Инструкция к выполнению первой цепочки переходов.
Опыт.1) Для осуществления цепочки превращений выданы пробирки №1, №2. В пробирку №1 прилейте 1-2 мл раствора CuSO4 . Для осуществления 1-ого опыта приливайте к этому раствору 1 мл необходимого реактива.
2) Второй и третий переход проводите в этой же пробирке (№1). Составьте молекулярные и ионные уравнения реакций.
Для отчёта оформите таблицу
Действие (рисунок)
Наблюдение
Выводы, запись уравнений реакций
,
ВАРИАНТ 2.
1.Повторите правила техники безопасности
2. Проведите реакции, в которых осуществляются предложенные ниже химические превращения:
ZnCl2 → Zn(OH)2 → ZnCl2
↓
Na2 [Zn(OH)4]
Опыт. Инструкция к выполнению цепочки переходов.
1) Для осуществления цепочки переходов выданы пробирки №1, №2;
а) в пробирку прилейте 1-2 мл раствора хлорида цинка. Получите гидроксид цинка, для этого добавьте несколько капель необходимого реактива. Полученный гидроксид разлейте в две пробирки.
б) в пр.№1 получите ZnCl2, в пр.№2 получите Na2Zn(OH)4. Что наблюдаете?
Составьте молекулярные и ионные уравнения реакций. Для отчёта оформите таблицу:
Действие (рисунок)
Наблюдение
Выводы, запись уравнений реакций
infourok.ru
Методическая разработка «Алгоритм решения превращений по химии»
Методические рекомендации решения «цепочек» превращения по химии.
В заданиях ля школьников по химии на любом этапе обучения и для любой параллели всегда имеются задания со схемами последовательных превращений одних веществ в другие, которые характеризуют связь между основными классами органических и неорганических веществ. Многостадийную схему превращения одних веществ в другие в определенной последовательности часто называют «цепочкой». Для выполнения этих заданий необходимо знать основные классы неорганических и органических соединений, номенклатуру, химические свойства, в том числе продукты термического разложения веществ, механизмы реакций.
«Цепочки» – это оптимальный способ проверить большой объем знаний (практически по всем разделам общей, неорганической и органической химии) в одной задаче.
Для того, чтобы успешно решать цепочки химических превращений из одного вещества в другое, необходимо изучить свойства веществ, их взаимодействия и особенности каждого класса соединений. Среди качественных задач решение цепочек веществ встречаются чаще всего.
Алгоритм решения «цепочки»:
1.Внимательно прочитайте условие задачи. Если необходимо, можете сделать это не один раз.
Напишите уравнения, с помощью которых можно получить следующие превращения:
Al → → Al2O3 → Al(OH)3 → K[AL(OH)4] → AlCl3 → Al(NO3)3 → AlPO4.
Для каждого превращения составьте уравнения реакций. Если переход в одну стадия невозможен, составьте два и более уравнений реакций.
2.Выпишите цепочку отдельно, из условия задачи. Вы можете пронумеровать количество реакций и ли веществ для удобства. Помните, что каждое следующее вещество является исходным для последующего. Определите к какому классу веществ относиться каждый член цепочки. Под первым номером стоит металл алюминий. исходным продуктом реакции должна стать соль. По свойствам металла, соль получается при взаимодействии с кислотой. В данном случае с азотной кислотой. Проанализируйте возможна ли эта реакция. Составьте схему уравнения, расставьте коэффициенты. Первое превращение готова. Далее следуйте шаг за шагом, постепенно продвигаясь к последнему веществу, фосфату алюминия.
3.Проверьте себя еще раз. Пробегитесь взглядом по уравнениям реакций, проверьте везде ли стоят нужные коэффициенты. Не забудьте правильно оформить уравнения реакций.
Решение
1.Al + 6HNO3(конц.) => Al(NO3)3 + 3NO2 + 3h3O
2.4Al(NO3)3 => 2AL2O3 + 12NO2 + 3O2
3.Al2O3 + 3h3SO4 => Al2(SO4)3 + 3h3O
Al2(SO4)3 + 6NaOH => 2Al(OH)3 + 3Na2SO4
4.Al(OH)3 +KOH => K[Al(OH)4]
5.K[Al(OH)4] + 4HCl => KCl + AlCl3 + 4h3O
6.AlCl3 + 3AgNO3 => Al(NO3)3 + 3AgCl
7.Al(NO3)3 + K3PO4 => AlPO4 + 3KNO3
Решите «цепочки» самостоятельно:
Ca → CaO → Ca(OH)2 →CaCl2
NaOH
Na2O Na2CO3
NaNO3
Mg→MgO→Mg(OH)2→MgCl2
K2O→ KOH→K2SO4
KNO3
S →SO2 → H2SO3
Na2SO3
Cu→CuO→CuCl2→Cu(OH)2
→CuO
Ba Ba(NO3)2 Ba(OH)2 BaO
Zn ZnO Zn(OH)2 ZnSO4
Cu CuO Cu(OH)2 CuO
Fe FeCl2 Fe (OH)2 FeO
Ca CaSO4 Ca(OH)2 CaO
Si SiO2 H2SiO3 K2SiO3
N2 N2O5 HNO3 NaNO3
O2 H2O H2 HCl
H2 H2O Ca(OH)2 CaO
Fe FeO Fe(OH)2 FeCl2
Ca CaO Ca(OH)2 Ca(NO3)2
K K2O KOH K2SO4
Na Na2O NaOH Na2СО3
P P2O5 H3PO4 Na
3PO4
Mg MgO Mg(OH)2 MgSO4
Ba BaO Ba(OH)2 BaCl2
Ca → CaO → Ca(OH)2 →Ca(NO3)2
Cu(OH)2 → CuO → CuCl2→ Cu(OH)2
S → SO2 → H2SO3 → CaSO3
Fe(OH)3 → Fe2O3 → Fe2(SO4)3 → Fe(OH)3
P → P2O5 → H3PO4 → Na3PO4
H2O → O2 → CO2 → CaCO3
Fe(OH)2 → FeO → Fe → FeCl2
C → CO2 → Na2CO3 → H2CO3
infourok.ru
Практическая работа №1 «Осуществление цепочки химических превращений» 9 класс по УМК Габриеляна
Практическая работа №1 «Осуществление цепочки химических превращений» 1вариант
Цель: 1. Экспериментально осуществить следующие превращения ( соблюдайте правила техники безопасности)
CuSO4 → Cu(OH)2 → CuO
CuCl2
-
Составить уравнения реакций обмена в молекулярном и ионном виде.
-
Практическую работу оформить в виде таблицы
Описание эксперимента
Наблюдаемые явления
Уравнения химических реакций
Практическая работа №1 «Осуществление цепочки химических превращений» 2 вариант
Цель: 1. Экспериментально осуществить следующие превращения ( соблюдайте правила техники безопасности)
FeCl3 → Fe(OH)3 → Fe2O3
FeSO4
-
Составить уравнения реакций обмена в молекулярном и ионном виде.
-
Практическую работу оформить в виде таблицы
Описание эксперимента
Наблюдаемые явления
Уравнения химических реакций
Практическая работа №1 «Осуществление цепочки химических превращений» 3 вариант
Цель: 1. Экспериментально осуществить следующие превращения ( соблюдайте правила техники безопасности)
Al2(SO4)3→ Al(OH)3→ Al2O3
AlCl3
Составить уравнения реакций обмена в молекулярном и ионном виде.
-
Практическую работу оформить в виде таблицы
Описание эксперимента
Наблюдаемые явления
Уравнения химических реакций
infourok.ru
Решение качественных задач-2. Цепочки превращений. Видеоурок. Химия 10 Класс
Данный текст представляет собой неотредактированную версию стенограммы, которая в дальнейшем будет отредактирована.
InternetUrok.ru
Химия. 10 класс
Урок 70. Решение качественных задач-2. Цепочки превращений
Загорский Вячеслав Викторович, д.п.н., проф. Специализированного учебно-научного центра МГУ (школа им. А.Н. Колмогорова при МГУ),
многократный лауреат грантов «Учитель Москвы»
24.03. 2011 г.
При участии: Менделеевой Екатерины Александровны, к.х.н., доц. СУНЦ МГУ
Морозовой Натальи Игоревны, к.х.н., ст. преп. СУНЦ МГУ
Решение качественных задач по химии — цепочка превращений
Здравствуйте! Тема сегодняшнего урока – «Решение качественных задач. Цепочки превращений». Некоторые задачи на цепочки превращений фактически являются качественными задачами, в которых нужно проанализировать органические соединения, зашифрованные буквами алфавита.
Вспомним такую задачу из прошлого урока: «Вещество А представляет собой легко кипящую жидкость с приятным запахом. При гидролизе А образуется два соединения с одинаковым числом атомов углерода. Плотность паров одного из этих соединений В лишь немного превышает плотность воздуха. Вещество В может быть окислено оксидом меди. Вещество С, которое используется для сохранения биологических препаратов. Приведите возможные формулы веществ А, В, С».
А теперь решим задачу, которая представляет собой подобную цепочку в чистом виде. Требуется установить структурные формулы и названия веществ от А до Е. В этой цепочке есть определенное начало, что облегчает наши действия. Начальная формула дана однозначно. Фактически такая задача сводится к написанию последовательных уравнений реакции. Сами уравнения нам пока не ясны, но зато указаны условия. Исходное вещество должно прореагировать с бромом на свету. Это типичная реакция радикального замещения. Замещение у вторичных атомов протекает быстрее, чем у первичных. Поэтому при среднем атоме углерода замещается атом водорода существенно быстрее, чем при крайних, и основным продуктом превращений будет вещество А — 2 бром пропан. Затем 2 бром пропан реагирует со спиртовым раствором щелочи. Если раствор щелочи не водный, а именно спиртовой, то происходит отщепление – элиминирование бромоводорода, при этом образуется вещество В, а именно – пропен.
Пропен присоединяет молекулу хлора, в общем-то, в любых условиях. И получается вещество С — 1, 2 дихлорпропан. Затем снова спиртовой раствор щелочи. Реакция идет так же, как и с 2 бром пропаном. Отщепляется молекула галоген водорода. Но здесь два атома галогена, поэтому отщепятся два галоген водорода, а именно два хлороводорода. В результате получится не двойная, а тройная связь. И тогда вещество Д – пропин.
И, наконец, пропин присоединяет воду в кислой среде в присутствии соли ртути. Подобное присоединение идет по правилам Морковникова, т.е. водород уходит на край молекулы, а гидроксильная группа идет в центр. В результате получается непредельный спирт или енол. Но такие спирты неустойчивы, и он тут же перегруппировывается в кетон. Простейший кетон, который называется ацетон. Таким образом, задача решена.
Следующая разновидность цепочек содержит вещества с относительно простыми молекулярными формулами, и нужно подобрать условия, при которых одно вещество будет превращаться в другое.
Рассмотрим такую цепочку. Как превратить этиловый спирт в этилен?
Чтобы получить непредельный углеводород из спирта, нужно забрать у спирта воду. Такая реакция называется дегидратацией. Обычно ее проводят, нагревая этиловый спирт с концентрированной серной кислотой. Затем этилен или этен надо превратить в дихлорэтан. Для того чтобы присоединить хлор, достаточно просто взаимодействия даже в темноте. Затем из 1, 2 дихлорэтана, который получается в этих условиях, нужно получить ацетилен или этин. Нельзя просто отщепить молекулу хлора. Тогда получится этен или этилен. Поэтому нужно отщепить две молекулы хлороводорода. Чтобы произвести такое отщепление или элиминирование, нужно подействовать спиртовым раствором щелочи. И, наконец, последний шаг: из этина или ацетилена нужно получить бензол. Для того чтобы произошла такая реакция, она называется тримеризация, необходим катализатор, имеющий типичную для бензола гексагональную или шестиугольную структуру. В качестве катализатора чаще всего используют активированный уголь или оксид хрома. Данная задача решена.
Мы подобрали все условия реакции.
Еще одна разновидность задач на цепочки – это задачи, в которых в цепочке находятся уже относительно сложные молекулярные формулы. В таком случае расшифровка цепочки является уже не очень простой задачей.
Рассмотрим это на конкретном примере. Данная цепочка превращений сложна еще и тем, что требует определенного внимания. Она двойная. Мы видим, что стрелки расходятся от центра цепочки к ее краям. Сразу видно, что число атомов водорода в формулах всех перечисленных веществ относительно мало, т.е. такое соотношение углерода и водорода характерно для аренов или производных бензола. В формулах большинства веществ в данной цепочке находятся 7 атомов углерода. Скорее всего, они как-то генетически связаны с формулой, имеющей одно бензольное кольцо и один метильный радикал.
Состав вещества, отвечающего такой формуле С7Н8. Исходное вещество находится в середине цепочки. По сравнению с предложенной нами, так называемой базовой формулой, соответствующей талуолу, в нем не хватает 3-х атомов водорода. Зато есть азот и кислород. Предположим, что 3 атома водорода были замещены другими группами.
Какие это могут быть группы? Исходя из видимого нами состава, можно предположить, что одна из групп – это нитрогруппа. Но тогда остается 2 атома кислорода. Атомы кислорода не могут быть сами по себе заместителями в ароматическом ядре. Они не входят и в состав спиртовых групп, потому что для этого не хватит водорода в исходной формуле. Тогда логично предположить, что атомы кислорода замещают атомы водорода не в бензольном ядре, а в метильном радикале.
Если мы заменим метильную группу карбоксильной группой, т.е. кислотной, мы как раз получим ту формулу, которая соответствует находящейся в условии задачи. В исходной формуле находятся и нитрогруппа, и карбоксильная группа. Исходное вещество – нитробензольная кислота. Однако мы пока не можем судить о взаимном расположении этих заместителей. Надо выбрать направление цепочки. Здесь скорее помогает интуитивная оценка имеющейся у нас ситуации. Предположим, мы пойдем влево. У соседнего вещества на 2 атома кислорода меньше, но больше на 3 атома водорода и появился атом хлора. Если число атомов кислорода уменьшилось и возникли атомы водорода, по-видимому, произошло восстановление. При восстановлении нитрогруппа превращается в аминогруппу, тогда не очень понятно, откуда взялся атом хлора. Однако если восстановление протекало в кислой среде, то вместо амина образуется аммониевая соль. Тогда соответствующий анион – хлорид.
Итак, условия реакции восстановления – взаимодействие с активным металлом в солянокислой среде. Металлом может быть, например, цинк. Теперь пойдем еще на 1 шаг влево по данной цепочке.
При таком переходе у нас как бы пропал атом хлора, но появился атом калия и уменьшилось число атомов водорода. Эта комбинация из изменений намекает нам на то, что кислая среда сменилась на основную или щелочную. И тогда хлорид в аминогруппе заменяется солью калия, которая будет, разумеется, не по аминогруппе, а по карбоксильной группе кислоты. Такая реакция протекает при взаимодействии предшествовавшего вещества – соли аммония с концентрированным раствором щелочи.
Теперь двинемся по той же цепочке вправо. Условия реакция здесь довольно однозначные – нужно нитрование. Однако условия нитрования потребуются весьма жесткие, потому что уже есть две функциональные группы, которые не способствуют подобным реакциям. Поэтому придется довольно сильно нагревать вещество с нитрующей смесью. И карбоксильная группа, и нитрогруппа ориентируют новые заместители в метоположение. А поскольку, согласно цепочке, в результате реакции образовалось только одно вещество, то ориентация этих двух исходных заместителей является согласованной. Такая ситуация возможна только в одном случае: и карбоксильная группа, и нитрогруппа по отношению друг другу находятся в метоположении. А продуктом реакции является 3, 5 динитробензольная кислота. Это вещество превращается далее, например, за счет взаимодействия по карбоксильной группе. Возможно образование сложного эфира со спиртом, содержащим 2 атома углерода. И тогда последний продукт – это этиловый эфир 3, 5 динитробензольной кислоты. Реакция идет в кислой среде. Итак, цепочка превращений расшифрована.
На этом наш урок закончен. До свидания.
interneturok.ru
Инструктивная карточка для проведения практической работы №1 «Осуществление цепочки превращений» по химии 9 класс
Данная инструктивная карточка предназначена для учащихся при проведении практической работы №1 по УМК О.С. Габриеляна. Может быть использованна при проведении похожих практических работ в УМК других авторов.
Просмотр содержимого документа
«Инструктивная карточка для проведения практической работы №1 «Осуществление цепочки превращений» по химии 9 класс»
Практическая работа №1
«Осуществление цепочки химических превращений металлов».
CuSO4 –Cu(OH)2 – CuO – CuSO4
Цель работы: научиться осуществлять цепочки химических превращений, исходя из предложенных веществ; закрепить практические навыки проведения химических опытов; повторить технику безопасности при проведении практических опытов по химии.
Реактивы и оборудование: сульфат меди CuSO4, щелочь NaOH, серная кислота Н2 SO4; спиртовка, штатив с набором пробирок, спички, спиртовка, держатель для пробирок
ИНТСТУКТАЖ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ
Опыт №1. Получение Cu(OH)2
В пробирку с CuSO4 добавить NaOH. Что наблюдаете?
Составьте уравнение реакции в молекулярном и ионном виде. Укажите тип химической реакции
Опыт №2. Получение CuO
Пробирку с Cu(OH)2 нагреть. Что наблюдаете?
Составьте уравнение реакции.
Опыт №3. Получение CuSO4
В пробирку с полученным осадком добавьте кислоту и при необходимости немного нагрейте. Что наблюдаете?
Составьте уравнение реакции в молекулярном и ионном виде. Укажите тип химической реакции
После выполнения работы составьте отчет в виде таблицы.
|
Что делаю? |
Что наблюдаю? |
Уравнения реакции или выводы |
Сделайте вывод о проделанной работе.
kopilkaurokov.ru
Цепочки превращений — 9 класс — Каталог файлов
Цепочки превращений — 9 класс — Каталог файлов — Персональный сайт
| Приветствую Вас, Гость · RSS |
|
|
Персональный сайт учителя химии Политовой Светланы Викторовны
spolitova.ucoz.ru
No related posts.