Алгоритмы составления химических формул
Составление
химических формул для соединений двух
химических элементов в тех случаях,
когда для каждого элемента существует
только одна стехиометрическая валентность.
|
Алгоритм |
Составление |
|
|
Установление |
Аl |
О |
|
Определение |
АIII |
ОII |
|
Вычисление |
6 |
|
|
Определение |
2 |
3 |
|
Указание числового |
2 |
|
|
Указание |
Аl2 |
О3 |
|
Составление |
Аl2О3 |
Составление
химических формул для соединений,
которые существуют в водном растворе
в виде ионов.
|
Алгоритм |
Составление |
|
|
Установление |
Аl3+ |
SО42– |
|
Определение |
3 |
2 |
|
Вычисление |
6 |
|
|
Определение |
2 |
3 |
|
Указание числового |
2 |
|
|
Указание |
Аl2 |
(SО4)3 |
|
Составление |
Аl2(SО4)3 |
Написание химических формул
Для
указания в химических формулах
стехиометрических индексов и зарядов
ионов существуют следующие правила.
1. Если
стехиометрический индекс относится к
группе атомов, обозначающие эту группу
химические символы ставятся в скобки:
С3Н5(ОН)3
– в молекуле глицерина содержатся 3
гидроксигруппы;
Ca(NО3)2
– в формульной единице нитрата кальция
содержатся ионы кальция и нитрат-ионы
в соотношении 1 : 2.
2.
Данные о заряде сложного многоатомного
иона в химической формуле относятся ко
всему иону:
SО42–
– сульфат-ион – имеет двухкратный
отрицательный заряд;
NН4+
– ион аммония – имеет одинарный
положительный заряд.
3.
Химическая формула комплексного иона
ставится в квадратные скобки, за которыми
указывается его заряд; она состоит из:
– химического
символа центрального атома;
– химической
формулы лиганда в круглых скобках;
– нижнего
индекса, указывающего число лигандов.
[Fe(CN)6]4–
– гексацианоферрат(II)-ион; в имеющем
четыре отрицательных заряда ионе шесть
лигандов СN–
(цианид-ион) связаны с центральным атомом
FеII
(катион железа Fe2+).
[Cu(NH3)4]2+
–
ион тетраамминмеди (II); в имеющем два
положи-тельных заряда ионе четыре
лиганда NH3
(молекула аммиака) связаны с центральным
атомом меди (ион Сu2+).
4.
Химическая формула воды в гидратах и
кристаллогидратах отделяется точкой
от химической формулы основного
вещества.
CuSO4
· 5H2O
– пентагидрат сульфата меди (II)
(медный купорос).
Классификация неорганических веществ и их свойства
Все
неорганические вещества делятся на
простые и сложные.
Простые
вещества подразделяются на металлы,
неметаллы и инертные газы.
Важнейшими
классами сложных неорганических веществ
являются: оксиды,
основания, кислоты, амфотерные гидрооксиды,
соли.
Оксиды
—
это соединения двух элементов, один из
которых кислород. Общая формула
оксидов:
ЭmOn
где
m
–
число
атомов элемента Э;
n
– число атомов кислорода.
Примеры
оксидов: К2О,
CaO,
SO2,
P2O5
Основания
– это сложные вещества, молекулы которых
состоят из атома металла и одной или
нескольких гидроксидных групп – ОН.
Общая формула оснований:
Me(ОН)y
где у
– число
гидроксидных групп, равное валентности
металла (Me).
Примеры
оснований: NaOH,
Ca(OH)2,
Со(ОН)3
Кислоты
—
это сложные вещества, содержащие атомы
водорода, которые могут замещаться
атомами металла.
Общая
формула кислот
НхАсу
где
Ас – кислотный остаток (от англ., acid
– кислота);
х
– число
атомов водорода, равное валентности
кислотного остатка.
Примеры
кислот: НС1, HNO3,
H2SO4,
H3PO4
Амфотерные
гидроксиды
– это сложные вещества, которые имеют
свойства кислот и свойства оснований.
Поэтому формулы амфотерных гидроксидов
можно записывать в форме оснований
и в форме кислот. Примеры амфотерных
гидроксидов:
Zn(OH)2
= H2ZnO2
Al(OH)3
= H3AlO3
форма
форма
оснований
кислот
Соли
– это сложные вещества, которые являются
продуктами замещения атомов водорода
в молекулах кислот атомами металла или
продуктами замещения гидроксидных
групп в молекулах оснований кислотными
остатками. Например:
|
НСl |
|
NаСl |
|
Са(ОН)2 |
|
Са(NО3)2 |
Состав
нормальных солей выражается общей
формулой:
Мех
(Ас)
у
где х
— число
атомов металла; у
—
число кислотных остатков.
Примеры
солей: K3PO4;
Mg
SO4;
Al2(SO)3;
FeCl3.
Оксиды
|
Название |
= |
“Оксид” |
+ |
Название (в |
+ |
Валентность |
Например:
СО – оксид углерода (II)
– (читается: “оксид углерода два”);
СО2
– оксид углерода (IV);
Fe2O3
– оксид железа (III).
Если
элемент имеет постоянную валентность,
ее в названии оксида не указывают.
Например: Nа2О
– оксид натрия; Аl2О3
– оксид алюминия.
Классификация
Все
оксиды делятся на солеобразующие и
несолеобразующие (или индифферентные).
Несолеобразующие
(индифферентные) оксиды
— это оксиды, которые не образуют
солей при взаимодействии с кислотами
и основаниями. Их немного. Запомните
четыре несолеобразующих оксида: СО,
SiO,
N2O,
NO.
Солеобразующие
оксиды
— это оксиды, которые образуют соли
при взаимодействии с кислотами или
основаниями. Например:
Na2O
+ 2НС1 = 2NaCl
+ Н 2О
оксид
кислота соль
|
SO3 |
+ |
2NaOH |
= |
Na2SO4 |
+ |
Н2О |
|
оксид |
основание |
соль |
Многие
солеобразующие оксиды взаимодействуют
с водой. Продукты взаимодействия оксидов
с водой называются гидратами оксидов
(или гидроксидами). Например:
|
Na2O |
= |
H2O |
+ |
2NaOH |
|
оксид |
гидроксид |
Некоторые
оксиды с водой не взаимодействуют, но
им соответствуют гидроксиды, которые
можно получить косвенным (непрямым)
путем. В зависимости от характера
соответствующих гидроксидов все
солеобразующие оксиды делятся на три
типа: основные, кислотные, амфотерные.
Основные
оксиды
— это оксиды, гидраты которых являются
основаниями. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
Основные |
Основания |
Все
основные оксиды являются оксидами
металлов.
Кислотные
оксиды
— это оксиды, гидраты которых являются
кислотами. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
Кислотные |
Кислоты |
Большинство
кислотных оксидов являются оксидами
неметаллов. Кислотными оксидами
являются также оксиды некоторых металлов
с высокой валентностью. Например:
 ,
,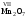
Амфотерные
оксиды
— это оксиды, которым соответствуют
амфотерные гидроксиды.
Все
амфотерные оксиды являются оксидами
металлов.
Следовательно,
неметаллы
образуют только кислотные
оксиды;
металлы
образуют
все основные,
все амфотерные
и некоторые кислотные
оксиды.
Все
оксиды одновалентных
металлов (Na2O,
K2O,
Cu2O
и др.) являются основными. Большинство
оксидов двухвалентных
металлов (CaO,
BaO,
FeO
и др.) также являются основными. Исключения:
BeO,
ZnO,
PbO,
SnO,
которые являются амфотерными. Большинство
оксидов трех-
и
четырехвалентных
металлов являются
амфотерными:
 ,
, ,
, ,
,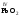 ,
,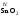 и др. Оксиды металлов свалентностью
и др. Оксиды металлов свалентностью
V,
VI,
VII
.являются
кислотными:
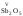 ,
, ,
, и
и
др.
Металлы
с переменной валентностью могут
образовывать оксиды всех трех типов.
Например:
СrО – основный оксид, Сr2О3
– амфотерный оксид, СrО3
– кислотный оксид.
Графические
формулы
В
молекуле оксида атом металла непосредственно
соединяется с атомами кислорода.

Соседние файлы в папке Химия(лабы+теория)
- #
- #
- #

Классификация гидроксидов и оснований
Материал по химии
Основания и гидроксиды.
Для того, чтобы разбираться в классификации, сначала нужно понять, что такое основание и чем оно отличается от других веществ. Перечислим несколько оснований:
NaOH – гидроксид натрия
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа
Все три примера относятся к основаниям, но в названии значится, что это гидроксиды. В чем разница между этими понятиями?
Гидроксиды – это вещества, в состав которых какой-либо элемент имеет связь с гидроксильной группой (‒ОН). Но не все гидроксиды – это основания: кислоты, например, тоже являются гидроксидами.
Классификация гидроксидов и оснований
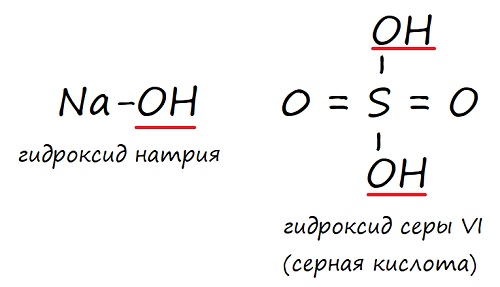
Основные и ксилотные кидроксиды
Таким образом, все основания – это гидроксиды, но не все гидроксиды – это основания. Ввиду того, что группа гидроксидов очень разнообразна, её принято делить на три подгруппы.
Таб. «Классификация гидроксидов»
|
Гидроксид |
||
|
Основный |
Амфотерный |
Кислотный |
|
В состав входят гидроксогруппа (-ы) и металл в степени окисления «+1» или «+2» за исключением Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2 |
В состав входят гидроксогруппы и металл в степени окисления «+3» или «+4», а также Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2 |
В состав входят гидроксогруппа (-ы) и неметалл, либо гидроксогруппа (-ы) и металл в степени окисления «+5», «+6» или «+7» |
|
Общий состав: ЭОН |
Общий состав: ЭОН/НЭО |
Общий состав: НЭО |
|
Примеры: Cr(OH)2 KOH Mg(OH)2 |
Примеры: Cr(OH)3/HCrO2 Mn(OH)4/H2MnO3 Al(OH)3/HAlO2 |
Примеры: HNO3 H3PO4 HMnO4 |
Э – элемент. К основным гидроксидам так же относят гидроксид аммония – NH4OH, хотя правильнее его записывать как гидрат аммония – NH3·H2O.
Амфотерные гидроксиды имеют промежуточный характер между основными и кислотными, поэтому имеют обе формы написания.
Задание в формате ЕГЭ с ответом:
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: амфотерного гидроксида, двухосновного основания, кислотного гидроксида. Запишите соответствующую последовательность цифр.
1) NaOH 2) NH3*H2O 3) HMnO4 4) Be(OH)2 5) KMnO4 6) Na[Al(OH)4] 7) MnO2 8) Ca(OH)2 9) KOH
Пример задания из КИМ ЕГЭ:
Среди перечисленных веществ выберите три формулы, соответствующие амфотерным гидроксидам:
- H2Cr2O7
- Be(OH)2
- Al(OH)3
- Fe(OH)2
- Ga(OH)3
- H2SO4
Задание по образцу ФИПИ:
Кислотный гидроксид может образовать следующий элемент:
- натрий
- мышьяк
- алюминий
- хлор
- молибден
- цинк
Кислотные гидроксиды образуют неметаллы в любой степени окисления, поэтому подходит мышьяк и хлор, а также металлы в степени окисления +5 и выше, поэтому подходит молибден – он находится в шестой группе Периодической системы, значит, может образовать ион со степенью окисления +6
Перевод формулы амфотерного гидроксида из основной формы в кислотную.
Пример 1.
-
Возьмём любой амфотерный гидроксид: Al(OH)3;
-
Поменяем порядок элементов на кислотную форму (водород → элемент → кислород) без учета индексов основной формы: HAlO;
-
Расставим степени окисления:
-
Молекула должна быть электронейтральной (количество положительных и отрицательных зарядов должно быть равным), для этого кислорода должно быть в два раза больше, поэтому после него ставим индекс «2»: HAlO2
Пример 2.
-
Zn(OH)2;
-
HZnO
-
Согласно этой формуле после кислорода придется поставить индекс «1,5», но индексы могут быть выражены только целыми числами, поэтому сначала приведем количество положительных зарядов к четному значению, домножив элемент с нечетной степенью окисления (водород) на 2, получим формулу: H2ZnO, она пока всё равно не является электронейтральной, сумма её зарядов может быть выражена следующим уравнением: +2+2‒2 = +2, а должно быть = 0
|
+ |
+2 |
‒2 |
|
H2 |
Zn |
O |
|
+2 |
+2 |
‒2 |
|
+4 |
‒2 |
Чтобы количество отрицательных зарядов тоже стало равно четырем, количество кислорода нужно умножить вдвое, поставив после него индекс «2». Получается формула H2ZnO2
Таб. «Общие формулы амфотерных гидроксидов в зависимости от степени окисления металла в них»
|
Степень окисления |
+2 |
+3 |
+4 |
|
Основная формула |
Me(OH)2 |
Me(OH)3 |
Me(OH)4 |
|
Кислотная формула |
H2MeO2 |
HMeO2 |
H2MeO3 |
|
Пример |
H2BeO2 |
HCrO2 |
H2MnO3 |
Me – металл.
Классификация основных гидроксидов (оснований) по количеству гидроксо-групп.
|
Основания |
|
|
Однокислотные |
Двукислотные |
|
LiOH NaOH KOH |
Ca(OH)2 Fe(OH)2 Ba(OH)2 |
Однокислотные основания при диссоциации образуют лишь один гидроксид ион:
LiOH ↔ Li+ + OH‒
NaOH ↔ Na+ + OH‒
Двукислотные основания при диссоциации образуют два гидроксид-иона:
Ca(OH)2 ↔ Ca2+ + 2OH‒
Ba(OH)2 ↔ Ba2+ + 2OH‒
Основные гидроксиды не могут быть трёхкислотными или четырёхкислотными, так как в них металл будет иметь степень окисления «+3» или «+4», а это уже будет не основанием, а амфотерным гидроксидом.
Почему количество гидроксильных групп называется кислотностью? Потому что на нейтрализацию оснований требуется протон водорода из кислоты. Для нейтрализации однокислотных оснований потребуется один протон водорода, а на нейтрализацию двукислотного основания – два протона водорода и так далее. Например:
Молекулярное уравнение (МУ): NaOH + HCl = NaCl + H2O
Полное ионное уравнение (ПИУ): Na+ + OH‒ + H+ + Cl‒ = Na+ + Cl‒ + H2O
Сокращение одинаковых ионов: Na+ + OH‒ + H+ + Cl‒ = Na+ + Cl‒ + H2O
Сокращенное ионное уравнение (СИУ): OH‒ + H+ = H2O
На нейтрализацию однокислотного основания потребовался один протон водорода из соляной кислоты.
Классификация оснований по силе
Основания также можно поделить на сильные и слабые. Сильные диссоциируют очень быстро, даже двухосновные распадаются на ионы на столько быстро, что можно не учитывать ступенчатость этого процесса:
LiOH ↔ Li+ + OH‒
Ba(OH)2 ↔ Ba2+ + 2OH‒
Слабые основания диссоциируют очень медленно, ступенчато:
Fe(OH)2 ↔ FeOH+ + OH‒ (первая ступень)
FeOH+ ↔ Fe2+ + OH‒ (вторая ступень)
Сильные основания растворимы или малорастворимы (исключение: гидроксид аммония будучи растворимым остаётся слабым основанием) и называются щелочами. Слабые основания нерастворимы.
Таб. «Сильные и слабые основания»
|
Основания |
|
|
Сильные (щелочи) |
Слабые |
|
Растворимы |
Нерастворимы (искл. NH4OH) |
|
Гидроксиды металлов IA-подгруппы, а также кальция, стронция и бария |
Все остальные |
|
Примеры: LiOH, NaOH, KOH, CsOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 |
Примеры: Mg(OH)2, Fe(OH)2, CuOH, Cr(OH)2, Mn(OH)2, Cu(OH)2 |
Как написать формулы оксидов, соответствующих гидроксидам
Гидроксиды – это сложные вещества, к которым относятся кислоты и основания. Название состоит из двух частей – «гидро» (вода) и оксид. Если оксид кислотный, в результате его взаимодействия с водой получится гидроксид – кислота. Если же оксид основный (не основной, как иногда ошибочно называют), то и гидроксид будет представлять собой основание.

Инструкция
Для того чтобы правильно писать формулы, которые соответствуют гидроксидам – кислотам и основаниям, необходимо иметь представление об оксидах. Оксиды – это сложные вещества, состоящие из двух элементов, одним из которых является кислород. Гидроксиды в своем составе имеют еще и атомы водорода. Формулы оксидов очень легко написать, используя упрощенную схему. Для этого достаточно от соответствующего гидроксида «вычесть» все молекулы воды, которые входят в состав гидроксида. Если составной частью кислоты или основания является одна молекула воды, то нужно уменьшить количество атомов водорода на 2, а атомов кислорода на 1. Если же в состав гидроксида входят две молекулы воды, то и количество атомов водорода и кислорода нужно будет уменьшить на 4 и 2 соответственно.
H2SO4, серная кислота. Отнимите 2 атома водорода и 1 атом кислорода – получите SO3 или оксид серы (VI).
H2SO3, сернистая кислота. По аналогии с предыдущим примером получается SO2 или оксид серы (IV).
H2CO3, угольная кислота. Образуется CO2 или оксид углерода (IV).
H2SiO3, кремниевая кислота. Следовательно, получится SiO2 или оксид кремния.
Ca(OH)2, гидроксид кальция. Вычтите молекулу воды и останется CaO или оксид кальция.
В некоторых формулах гидроксидов имеется нечетное количество атомов водорода, а потому требуется удвоение. Кроме этого, удвоению подвергаются и остальные элементы, входящие в состав гидроксида, после чего, по аналогии, вычитаются все образовавшиеся молекулы воды.
NaOH, гидроксид натрия. Удвойте количество атомов каждого элемента и получите Na2O2H2. Вычтите молекулу воды и останется Na2O или оксид натрия.
Al(OH)3, гидроксид алюминия. Удвойте количество атомов – Al2O6H6. Вычтите три образовавшиеся молекулы воды и получится Al2O3, оксид алюминия.
HNO3, азотная кислота. Удвойте количество каждого элемента – получите H2N2O6. Вычтите из нее одну молекулу воды и получится N2O5 – оксид азота (V).
HNO2, азотистая кислота. Произведите удвоение числа каждого элемента – получите H2N2O4. Вычтите из нее одну молекулу воды и получится N2O3 – оксид азота (III).
H3PO4, ортофосфорная кислота. Удвойте количество каждого элемента – получите H6P2O8. Вычтите из нее три молекулы воды и получится P2O5 – оксид фосфора (V).
HMnO4, марганцовая кислота. Выполните удвоение количества атомов и получите H2Mn2O8. Вычтите молекулу воды (2 атома водорода и 1 атом кислорода), в результате будет Mn2O7 – оксид марганца (VII).
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.