Доброго времени суток, дорогие читатели!
Сегодня поговорим о ковалентной полярной связи.
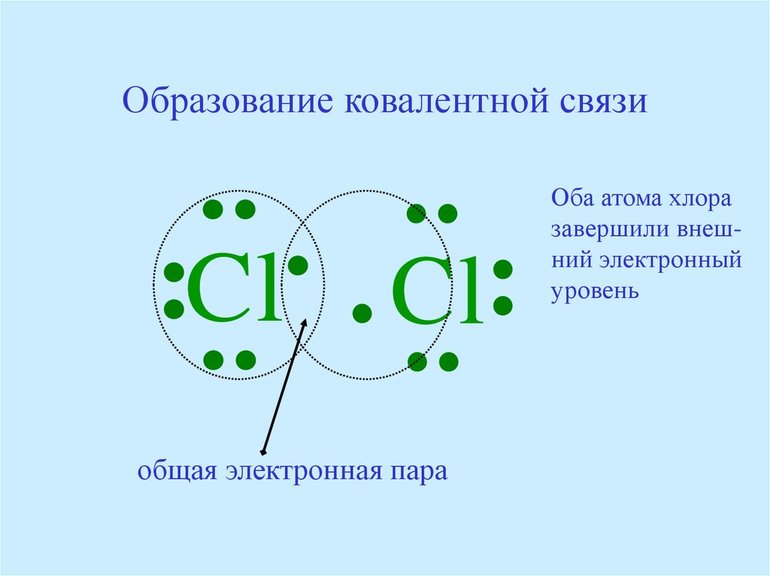
Для начала рассмотрим схему образования связи на примере HCl.
1) Водород — это элемент IA группы. Имеет один электрон на внешнем уровне, неспаренный:
2) Хлор — это элемент VIIA группы. Имеет на внешнем уровне один неспаренный электрон (напоминаю, что число неспаренных электронов для элементов главных подгрупп можно определить по формуле: 8 — N, где N — это номер группы):
3) Эти два атома объединяются, образуя общую электронную пару:
Но, общая электронная пара не будет распределена одинаково между атомами, а будет смещена в сторону более электроотрицательного элемента.
Электроотрицательность (ЭО) — это способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании связи.
Ряд электроотрицательности:
Или, в Периодической таблице определяется так:
— в пределах группы (в главной подгруппе) или сверху вниз ЭО уменьшается.
— в пределах периода или слева направо ЭО увеличивается.
Исходя из ряда ЭО, видим, что водород более слабый неметалл, а хлор — более сильный, следовательно общая электронная пара будет смещаться в сторону хлора:
В результате смещения образуется частичный заряд, который называется «дельта» и обозначается так:
То есть, водород заряжен знаком «+», а хлор — «-».
Итак, что такое ковалентная полярная связь?
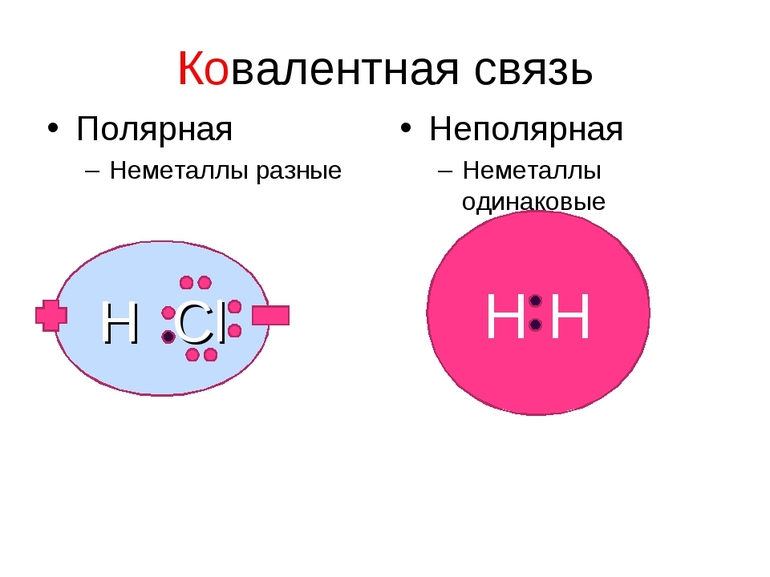
Ковалентная полярная связь — это связь между двумя атомами с разной ЭО за счет смещения общих электронных пар.
Ковалентная связь — это связь между двумя неметаллами с разной ЭО! (Отличие от других видов связи).
Рассмотрим еще примеры образования связи:
Давайте сделаем выводы по ковалентной полярной связи:
1) Ковалентная полярная связь — это связь между двумя атомами с разной ЭО за счет смещения общих электронных пар.
2) Ковалентная связь — это связь между двумя неметаллами с разной ЭО!(Отличие от других видов связи).
3) Электроотрицательность (ЭО) — это способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании связи.
Спасибо за прочтение статьи!
Если информация оказалась полезной, то ставьте лайк и подписывайтесь на канал!
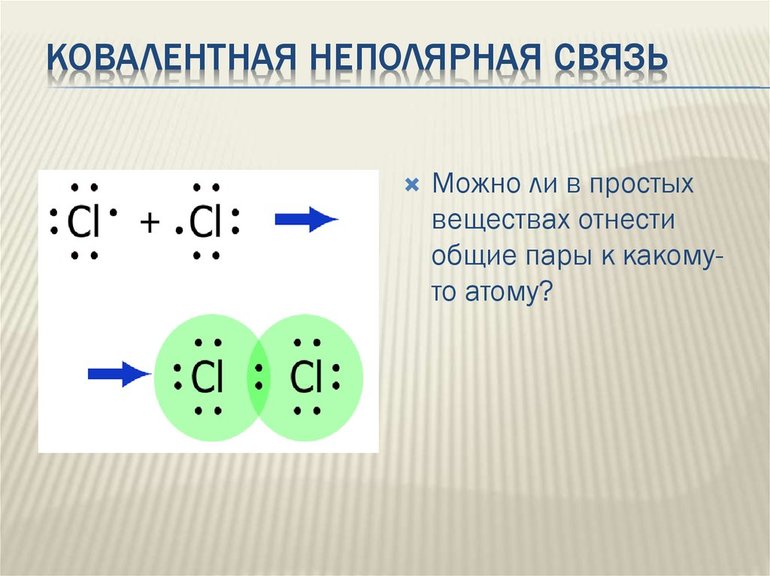
Общие электронные пары, образующиеся в простых веществах
H2,O2,Cl2,F2,N2
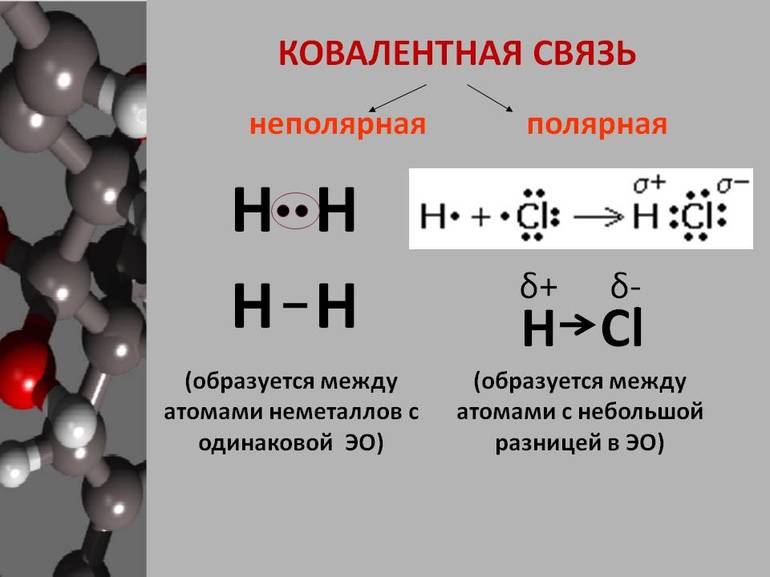
, в одинаковой степени принадлежат обоим атомам. Такая ковалентная связь называется неполярной.
Ковалентная неполярная связь соединяет атомы в простых веществах-неметаллах.
Если ковалентная связь образуется между разными атомами, то общая электронная пара смещается к тому из них, который имеет более высокую электроотрицательность (ЭО). Он получает частичный отрицательный заряд. Атом, имеющий меньшую ЭО, становится заряжённым положительно. В этом случае образуется полярная ковалентная связь.
Ковалентная полярная связь образуется между атомами неметаллов в сложных веществах.
Рассмотрим образование ковалентных связей в сложных веществах.
1. Образование молекулы хлороводорода.
У атома водорода на внешнем уровне — один электрон. У хлора на внешнем уровне — семь электронов, один из которых неспаренный.
Образуется одна общая электронная пара, которая смещена к атому хлора. В результате
появляются частичные заряды: на атоме хлора — отрицательный, а на атоме водорода — положительный. Сдвиг электронной плотности принято обозначать греческой буквой дельта
δ
:
Рис. (1). Образование молекулы хлороводорода
Структурная формула хлороводорода
H−Cl
Подобным образом соединяются атомы в молекулах других галогеноводородов:
2. Образование молекулы воды.
На внешнем уровне атома кислорода — шесть электронов, два из которых неспаренные.
Атом кислорода образует две общие электронные пары с двумя атомами водорода.
Электронная плотность этих общих пар сдвинута к более электроотрицательному кислороду. Атом кислорода имеет отрицательный заряд, а атомы водорода — положительный.
Рис. (2). Образование молекулы воды
Сходное строение имеет молекула сероводорода. Структурные формулы воды и сероводорода:
H−OH−S||HH
3. Образование молекулы аммиака.
У атома азота — пять внешних электронов, три из которых неспаренные.
Атом азота присоединяет к себе три атома водорода.
Азот — более электроотрицательный элемент, поэтому на его атоме будет отрицательный заряд, а на атомах водорода — положительные заряды.
Рис. (3). Образование молекулы аммиака
Структурная формула аммиака:
H−N−H|H
Для того чтобы определить знаки частичных зарядов на атомах в веществе, надо сравнить ЭО неметаллов.
Пример:
определим частичные заряды атомов в соединении
CCl4
.
Вспомним положение углерода и хлора в ряду ЭО:
По положению элементов в этом ряду видно, что более электроотрицательный элемент в этой паре — хлор. Его атом оттягивает к себе общие электронные пары от атома углерода. Значит, на атоме хлора будет частичный отрицательный заряд, а на атоме углерода — частичный положительный:
Полярную ковалентную связь часто изображают стрелкой:
H→Cl
. Стрелка показывает направление смещения общей электронной плотности.
Источники:
Рис. 1. Образование молекулы хлороводорода © ЯКласс
Рис. 2. Образование молекулы воды © ЯКласс
Рис. 3. Образование молекулы аммиака © ЯКласс
Концепции и немного истории
Валентность показывает на присутствие конкретной силы. Появление подобной связи случается через обобщение атомных электронов, у которых нет «пары». Ковалентная связь случается между атомами неметаллов и может быть замечена как в молекулах, так и в кристаллах.
В первый раз ковалентность была открыта в 1916 г. химиком из Америки Дж. Льюисом, и прошло некоторое время, пока сформировалась гипотеза, а потом её смогли обобществить, и она была доказана опытным путём. Химики узнали, что это за прецедент, при котором выявили: электроотрицательность неметаллов довольно велика, и при содействии 2-х физических атомов притягивание электронов может быть сложной задачей и даже неосуществимой, поскольку они в 2-х атомах соединяются, и между ними случается ковалентность атомов.
Типы ковалентной связи
Характеристика ковалентности — это действие, которое случается в веществах с неметаллическими качествами. Выявляется она при совместном участии атомных электронов в различных элементах. Схема образования ковалентной полярной связи — взаимодействующие атомы имеют различный способ электроотрицательности, а открытые электроны не принадлежат тождественно 2 атомам.
Большую часть времени электроны приближаются к первому атому, чем ко второму. Случаем ковалентности полярной могут быть взаимодействия, которые выявляются в молекуле хлористого водорода, где раскрытые электроны в ответе за ковалентность и ближе к атому хлора, чем водород. И дело в том, что электроотрицательный показатель у первого вещества выше, чем у второго. Хорошим примером ковалентной полярной связи будет вода.
Эти одинарные химические взаимодействия происходят из-за появления накопительных молекулярных частей электронов, которые являются общими для двух взаимодействующих частей. Появление электронных пар связано с перекрытием орбиталей. Такие типы взаимодействий в химии происходят между частями обоих элементов.
Вещества со строением такой структуры:
- газы;
- вода;
- алкоголь;
- углеводы;
- белковая пища;
- кислотная органика.
Ковалентность появляется методом открытия пар электронов в несложных субстанциях или же сложных соединениях.
Чтобы квалифицировать природу кристаллической химической связи, надо взглянуть на атомную составляющую частиц, находящихся в формуле. Взаимодействия описанного типа образуются лишь только между веществами, в которых доминируют неметаллические качества. В случае если слияние имеет атомы похожих или же различных неметаллов, то взаимодействия между ними считаются ковалентными.
Полюсное взаимодействие
Когда в соединении совместно есть металл и неметалл, выявляется, что элементы образуют ионное соединение. Ковалентная полярность связывает решётку атомов всевозможных неметаллов друг с другом.
Это бывают атомы:
- хлора и водорода;
- фосфора и кислорода;
- аммиака.
Есть другое определение таких веществ. Это говорит о том, что кратная цепь возникает между неметаллами с разными показателями электроотрицательного появления. В 2-х случаях возможно выделить многообразие атомов, где была замечена эта связь.
Выставленные соединения в нормальных критериях наличествуют в водянистом или же газообразном агрегатном состоянии. Формулы Дж. Льюиса могут помочь понять устройство и насыщаемость связывания атомных ядер.
Действие получения ковалентности для атомов с разными значениями электроотрицательности объединяется к образованию совместной плотности электрического состояния. Как правило, он сдвинут к составляющей, что содержит самую возвышенную степень электроотрицательности. По причине возникающего смещения всей пары в направленности вещества с большим числом электроотрицательности в нём отчасти появляется негативный заряд. Вследствие этого, появляется слияние с 2-мя по-разному заряженными полюсами. Нередко при формировании полярных отношений применяется акцепторный или же донорно-акцепторный механизм.
Путь образования ковалентных связей:
- Акцепторный (обмена). Любой атом выделяет 1 неспаренный электрон.
- Донорно-акцепторный ковалентный тип. Один атом (донор) гарантирует электрическую пару, а акцептор орбиталь для неё.
Устройство образования ковалентных связей описывается как конфигурация взаимодействия, свойственная не для всех полярных соединений. Примерами считаются вещества органического и неорганического происхождения.
Неполярная структура
Неполярная ковалентность связывает составляющие с неметаллическими качествами, что точно так же равно электроотрицательному значению. Другими словами, элементы с неполярностью предполагают собой соединения, состоящие из различных чисел похожих неметаллов. Формула вещества с ковалентной неполярной связью: N2.
Примером ковалентной неполярной связи считаются вещества простой структуры: О2, N2, Cl2. Составление этого типа взаимодействия и других неметаллических частей включает экстремальные электроны. Валентность относится к количеству электронов, важных для окончания обычной наружной оболочки. Атом имеет возможность предоставить или же получить негативно заряженные частички.
Эта работа относится к уровню двухэлектронных или же двухцентровых цепей. В этом случае пара электронов занимает общую долю между 2-мя орбиталями. В структурных формулах пара электронов записывается в виде части по горизонтали. Каждая связь демонстрирует количество общих пар электронов в молекуле. Потребуется затратить наибольшее число энергии для разрушения с помощью этой связи, вследствие чего эти вещества станут одними из самых мощных по шкале крепости.
По донорно-акцепторному механизму неполярные части буквально не связаны. Ковалентная неполярная связь представляет собой структуру, образующуюся совместными электронными парами. Эти пары в равной степени принадлежат 2 атомам.
Однообразие ковалентных неполярных и полярных связей заключается в возникновении абсолютной электрической плотности. Лишь только в ином случае приобретённые электрические совместные части в равной степени принадлежат 2 атомам, занимающим центральное состояние. В итоге выборочные положительные и отрицательные заряды не образуются, что значит полученные цепочки считаются неполярными.
Неполярность приводит к образованию совместной пары, в итоге конечная степень атома будет законченной. Качества этих веществ, имеющих определённые структуры, выделяются от тех, что с металлическими или же ионными взаимодействиями. В обменном процессе ковалентности между атомами любой из них представляет собой один неспаренный электрон, образующий электрическую ковалентность. В этом случае они могут иметь обратные заряды.
Случаем подобной ковалентной связи могут быть взаимодействия, которые видятся в молекуле водорода. Когда атомы вещества намереваются совместно действовать, их электрические части попадают друг в друга. В итоге плотность между ядрами возрастает, они сами притягиваются, а энергия системы миниатюризируется. Впрочем, в случае если ядра делаются очень близкими, они начинают отталкиваться, и, таким образом, между ними появляется подходящее расстояние.
Что касается донорно-акцепторного вида ковалентности, то это случается, когда 1 из частиц, донор, предположит собственную электрическую пару для связи, а 2-я, акцептор, считается свободной орбиталью.
Квалифицирование ковалентности
Смысл ковалентной неполярной связи такой — это взаимодействие, которое появляется между похожими атомами. В молекулах с неполярной ковалентностью совместные пары электронов находятся на равных расстояниях от атомных ядер. К примеру, в молекуле воздуха атомы имеют 8 электрических конфигураций, в то время как они имеют 4 совместные электрические пары. Препараты с неполярной ковалентностью, как правило, предполагают собой газы, воду или же сравнительно низколегированные твёрдые вещества.
Чтобы верно квалифицировать ковалентную полярную и неполярную связь, достаточно понять свойство и формулу молекул, в случае, если они состоят из атомов различных составляющих, взаимодействие будет полярным, а если из 1-го, то станет неполярным. Ещё надо знать, что неполярные связи в целом могут встречаться лишь только между неметаллами, и это связано с механизмом ковалентных взаимодействий.
Основной
особенностью ковалентной полярной связи является то, что она образуется
между атомами различных неметаллов. Как, например, в молекуле HCl.
У атома водорода в нашем случае один неспаренный электрон, ему до
завершения внешнего энергетического уровня не хватает одного электрона.
У атома хлора семь электронов на внешнем уровне, один из которых
неспаренный, ему тоже не хватает одного электрона до завершения уровня.
Тогда атом водорода и атом хлора объединяют свои неспаренные электроны и
между ними образуется химическая связь. Эту связь тоже можно изобразить в виде
чёрточки.
Образовавшаяся
общая электронная пара не в равной степени будет принадлежать этим атомам.
Для этой оценки используют понятие электроотрицательности. Электроотрицательность
(ЭО) – способность атомов химического элемента притягивать к себе общие
электронные пары, участвующие в образовании химической связи.
Электроотрицательность
служит характеристикой металличности и неметалличности химических элементов.
Первое место по электроотрицательности занимает фтор, он же самый
неметаллический, второе место занимает кислород и третье – азот.
Т.к.
электроотрицательность – мера металличности, то она, как правило, по
периодам и группам изменяется в той же последовательности, т.е. в периодах
слева направо увеличивается, а в группах сверху вниз уменьшается.
Посмотрев
на молекулу HCl, можно с уверенностью
определить, что в данной молекуле более электроотрицательный атом хлора,
поэтому общая электронная пара будет смещена больше к нему. В результате
этого, на атомах появляются частичные заряды. Смещение электронной
плотности показывается стрелкой, а частичные заряды буквой дельта. В
молекуле появляется два полюса: положительный и отрицательный, поэтому
такую связь называют полярной.
Механизм
образования связей в молекуле воды (Н2О)
Водород
– элемент IA группы,
значит, у него один электрон, который участвует в образовании химической связи.
У второго атома водорода тоже один электрон, который участвует в образовании
химической связи. Атом кислорода находится в VIA
группе, поэтому у него на внешнем уровне 6 электронов, а число неспаренных
находим по формуле 8 – 6 = 2. Эти два электрона и будут участвовать в
образовании химической связи. Неспаренные электроны объединяются и образуется
две общие электронные пары. Из этих атомов более электроотрицательный кислород,
поэтому именно к нему будут смещены общие пары электронов и молекула будет
полярной, связь – ковалентной полярной.
Доказано,
что молекула воды на самом деле имеет не линейное строение, а угловое. В
этой молекуле атом водорода связан только одной связью с кислородом, а
кислород двумя связями с атомами водорода. Это число ковалентных связей,
которыми атом одного химического элемента связан с атомами этого же или других
элементов, называется валентностью.
Условно
валентность обозначается черточкой, когда необходимо записать
структурные формулы. Например, в молекуле NH3,
атом азота связан с тремя атомами водорода. Поэтому говорят, азот
трехвалентен. В молекуле СН4 четырехвалентный углерод
связан с одновалентными атомами водорода.
Следует
различать элементы с постоянной и переменной валентностью. Элементами с
постоянной валентность являются:
·
H, Cl,
F – одновалентные,
·
О
– двухвалентный,
·
B, Al
– трехвалентные.
Элементы
с переменной валентностью: S,
N, C,
P и др.
Для
вывода формулы соединения азота с кислородом, где азот
четырехвалентен, нужно сделать так: записываем знаки NO.
Над знаками элементов ставим валентности римскими цифрами. У азота она дана по
условию – четыре, у кислорода она постоянная и равна двум. Найдем наименьшее
общее кратное между валентностями. Наименьшее общее кратное равно четырем.
Разделим наименьшее общее кратное на валентности и получим индексы. Четыре
делим на четыре будет единица, помните, индекс единица не ставится, затем
четыре делим на два, будет два, следовательно, индекс у кислорода будет два.
Аналогично
поступают, когда по формуле, необходимо найти валентности элементов.
Определим валентность фосфора в соединении Р2О3. У
кислорода, как нам известно, валентность постоянная и равна двум. Определим
число валентностей всех атомов кислорода, для этого 2 умножим на три, будет
шесть. Разделим шесть на число атомов фосфора, т.е. на два, в результате будет
три, значит, валентность фосфора в нашем случае равна трем.