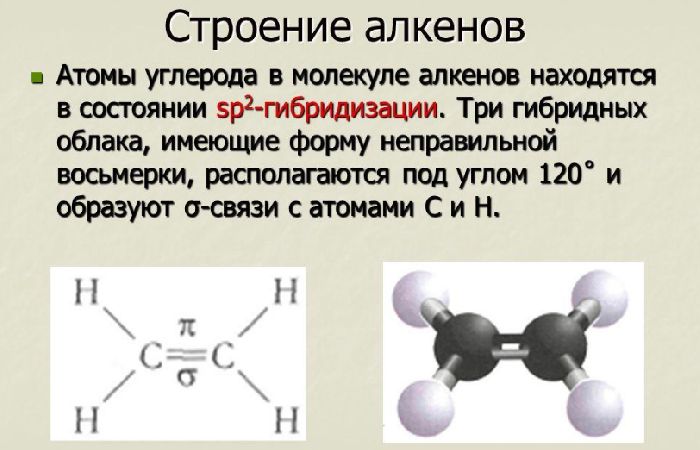
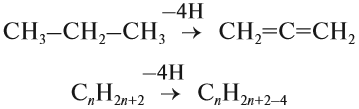
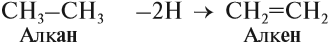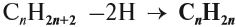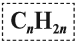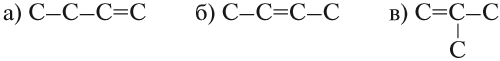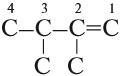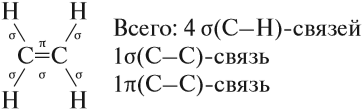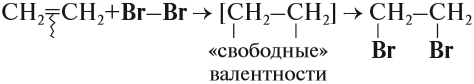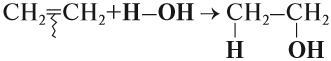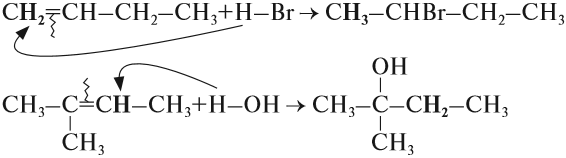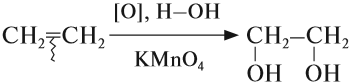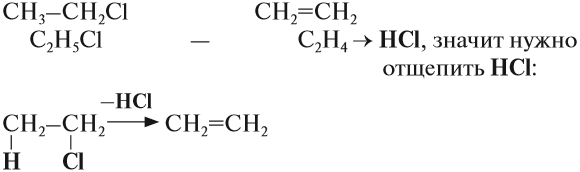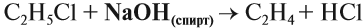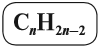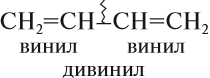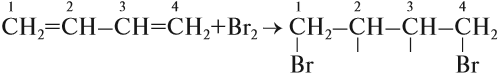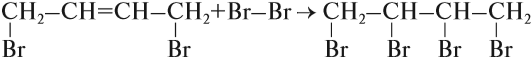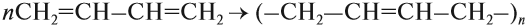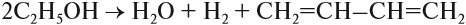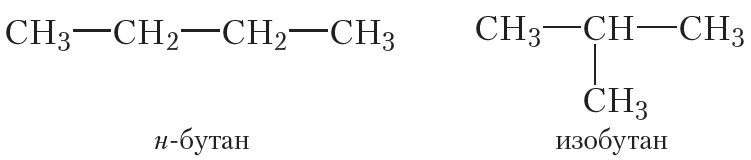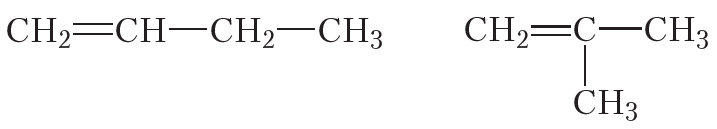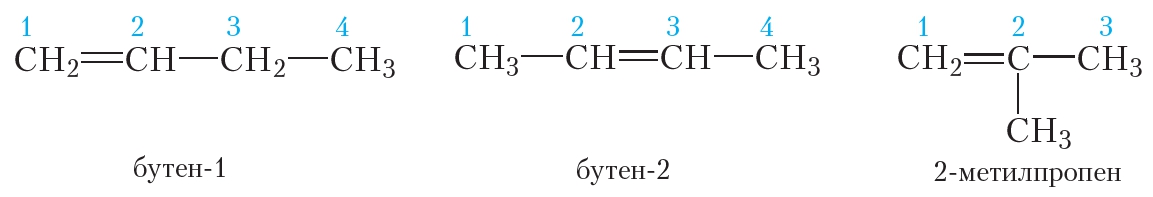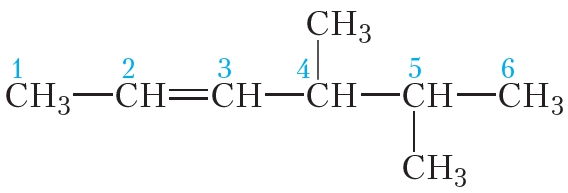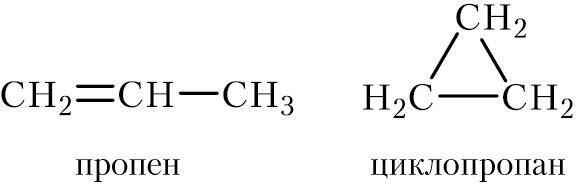Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкенов.
Строение, изомерия и гомологический ряд алкенов
Химические свойства алкенов
Получение алкенов
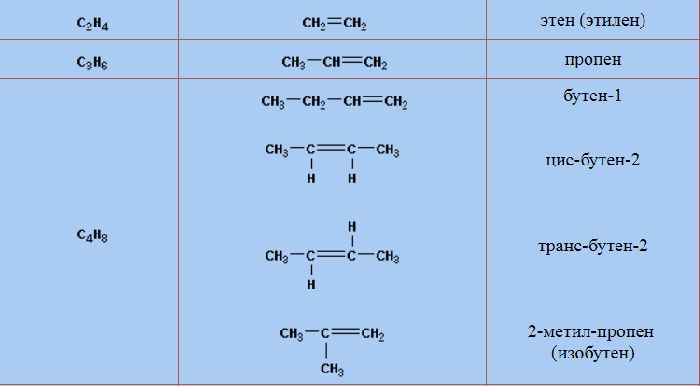
Гомологический ряд алкенов
Все алкены имеют некоторые общие или похожие физические и химические свойства. Схожие по строению алкены, которые отличаются на одну или несколько групп –СН2–, называют гомологами. Такие алкены образуют гомологический ряд.
Самый первый представитель гомологического ряда алкенов – этен (этилен) C2H4, или СH2=СH2.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь.
| Название алкена | Формула алкена |
| Этилен (этен) | C2H4 |
| Пропилен (пропен) | C3H6 |
| Бутилен (бутен) | C4H8 |
| Пентен | C5H10 |
| Гексен | C6H12 |
| Гептен | C7H14 |
| Октен | C8H16 |
| Нонен | C9H18 |
Общая формула гомологического ряда алкенов CnH2n.
Первые четыре члена гомологического ряда алкенов – газы, начиная с C5 – жидкости.
Алкены легче воды, не растворимы в воде и не смешиваются с ней.
Строение алкенов
Рассмотрим особенности строения алкенов на примере этилена.
В молекуле этилена присутствуют химические связи C–H и С=С.
Связь C–H ковалентная слабополярная одинарная σ-связь. Связь С=С – двойная, ковалентная неполярная, одна из связей σ, вторая π-связь. Атомы углерода при двойной связи образуют по три σ-связи и одну π-связь. Следовательно, гибридизация атомов углерода при двойной связи в молекулах алкенов – sp2:
При образовании связи σ-связи между атомами углерода происходит перекрывание sp2-гибридных орбиталей атомов углерода:
При образовании π-связи между атомами углерода происходит перекрывание негибридных орбиталей атомов углерода:
Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три гибридные орбитали атомов углерода при двойной связи в алкенах направлены в пространстве под углом 120о друг к другу:
Изображение с сайта orgchem.ru
Это соответствует плоско-треугольному строению молекулы.
Например, молекуле этилена C2H4 соответствует плоское строение.
Изображение с сайта orgchem.ru
Молекулам линейных алкенов с большим числом атомов углерода соответствует пространственное строение.
Например, в молекуле пропилена присутствует атом углерода в sp3-гибридном состоянии, в составе метильного фрагмента СН3. Такой фрагмент имеет тетраэдрическое строение и располагается вне плоскости двойной связи.
Изображение с сайта orgchem.ru
Изомерия алкенов
Для алкенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратной связи и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
Изомеры с различным углеродным скелетом и с формулой С4Н8 — бутен-1 и метилпропен
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкены являются межклассовыми изомерами с циклоалканами. Общая формула и алкенов, и циклоалканов — CnH2n.
Межклассовые изомеры с общей формулой С3Н6 — пропилен и циклопропан
Изомеры с различным положением двойной связи отличаются положением двойной связи в углеродном скелете.
Изомеры положения двойной связи, которые соответствуют формуле С4Н8 — бутен-1 и бутен-2
Пространственная изомерия
Для алкенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у алкенов.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
Для бутена-2 характерна цис- и транс-изомерия. В цис-изомере метильные радикалы CH3 располагаются по одну сторону от плоскости двойной связи, в транс-изомере — по разные стороны.
| цис-Бутен-2 | транс-Бутен-2 |

|
Цис-транс-изомерия не характерна для тех алкенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
Для пентена-1 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода)
Номенклатура алкенов
В названиях алкенов для обозначения двойной связи используется суффикс -ЕН.
Например, алкен имеет название 2-метилпропен.
При этом правила составления названий (номенклатура) для алкенов в целом такие же, как и для алканов, но дополняются некоторыми пунктами:
1. Углеродная цепь, в составе которой есть двойная связь, считается главной.
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода при двойной связи получили наименьший номер. Нумерацию следует начинать с более близкого к двойной связи конца цепи.
3. В конце молекулы вместо суффикса АН добавляют суффикс ЕН и указывают наименьший номер атома углерода при двойной связи в углеродной цепи.
4. Для простейших алкенов применяются также исторически сложившиеся (тривиальные) названия:
Радикалы, содержащие двойную связь, также носят тривиальные названия:
| Формула радикала | Тривиальное название |
| CH2=CH- | винил |
| CH2=CH-CH2— | аллил |
Химические свойства алкенов
Алкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов.
Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С-С | 348 | 0,154 |
| С=С | 620 | 0,133 |
Можно примерно оценить энергию π-связи в составе двойной связи С=С:
Еπ = Е(С=С) — Е(С-С) = 620 — 348 = 272 кДж/моль
Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам.
Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена.
1.1. Гидрирование
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
Например, при гидрировании бутена-2 образуется бутан.
Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление.
1.2. Галогенирование алкенов
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь.
Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан.
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
Например, при взаимодействии этилена с бромоводородом образуется бромэтан.
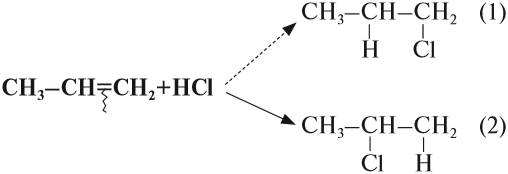
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан.
1.4. Гидратация
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
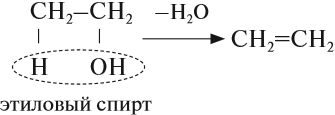
Например, при взаимодействии этилена с водой образуется этиловый спирт.
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2.
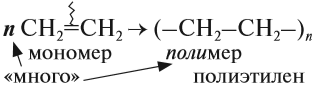
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен.
2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида)
Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида
2.2. Мягкое окисление
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2)
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:
При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:
При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
Например, при окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия:
Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон:
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
2.3. Горение алкенов
Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкенов выглядит так:
CnH2n + 3n/2O2 → nCO2 + nH2O + Q
Например, уравнение сгорания пропилена:
2C3H6 + 9O2 → 6CO2 + 6H2O
3. Замещение в боковой цепи
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.
При взаимодействии алкенов с хлором или бромом при нагревании до 500оС или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1
4. Изомеризация алкенов
При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
Например, при изомеризации бутена-1 может образоваться бутен-2 или 2-метилпропен
CH2=CH-CH2-CH3 → CH3-CH=CH-CH3
Получение алкенов
1. Дегидрирование алканов
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, образуются двойные и тройные связи.
Например, при дегидрировании этана может образоваться этилен или ацетилен:
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
2. Крекинг алканов
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Например, при крекинге н-пентана образуется смесь, в состав которой входят этилен, пропан, метан, бутилен, пропилен, этан и другие углеводороды.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
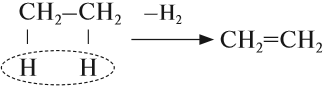
3. Дегидрогалогенирование галогеналканов
Галогеналканы взаимодействуют с щелочами в спиртовом растворе. При этом происходит дегидрогалогенирование – отщепление (элиминирование) атомов водорода и галогена от галогеналкана.
Например, при взаимодействии хлорэтана с спиртовым раствором гидроксида натрия образуется этилен.
При отщеплении галогена и водорода от некоторых галогеналканов могут образоваться различные органические продукты. В таком случае выполняется правило Зайцева.
Правило Зайцева: отщепление атома водорода при дегидрогалогенировании и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода.
Например, при взаимодействии 2-хлорбутана со спиртовым раствором гидроксида натрия преимущественно образуется бутен-2. Бутен-1 образуется в небольшом количестве (примерно 20%). В реакции мы указываем основной продукт.
4. Дегидратация спиртов
При нагревании спиртов (выше 140оС) в присутствии водоотнимающих веществ (концентрированная серная кислота, фосфорная кислота) или катализаторов (оксид алюминия) протекает дегидратация. Дегидратация — это отщепление молекул воды.
При дегидратации спиртов образуются алкены.
Например, при дегидратации этанола при высокой температуре образуется этилен.
Дегидратация более сложных молекул также протекает по правилу Зайцева.
Например, при дегидратации бутанола-2 преимущественно образуется бутен-2.
5. Дегалогенирование дигалогеналканов
Дигалогеналканы, в молекулах которых два атома галогена расположены у соседних атомов углерода, реагируют с активными металлами с образованием алкенов.
Как правило, для отщепления используют двухвалентные активные металлы — цинк или магний.
Например, 1,2-дихлорпропан реагирует с цинком с образованием пропилена
6. Гидрирование алкинов
Гидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.
При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
Например, при гидрировании бутина-1 в присутствии палладия преимущественно образуется бутен-1.
7. Гидрирование алкадиенов
Гидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением.
При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2):
Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
При комнатной и повышенной температуре основным продуктом реакции является 1,4-продукт (бутен-2).
При полном гидрировании дивинила образуется бутан:
План урока:
Что такое алкены?
Элементарный состав алкенов и их номенклатура
Физические свойства алкенов
Химические свойства алкенов
Применение алкенов
Что такое алкены?
Алкенами называются углеводороды, в которых есть одна двойная связь. На 1 уроке органической химии рассказывалось, что появление в составе молекулы кратных связей влияет на их химические свойства, о чем будет рассмотрено ниже.
Элементарный состав алкенов и их номенклатура
Для всех молекул алкенов ученые представили формулу, которая связывает соотношение водорода и углерода в молекуле. Общая формула алкенов выглядит так: СnH2n.
Теперь разберемся, как воспользоваться формулой на некоторых примерах.
Число атомов углерода в молекуле задается произвольно, начиная от 2 (т.к. двойная связь может образовываться только между двумя атомами углерода). Для примера мы примем, что число атомов углерода (т.е. n)равно 2.
Подставим это значение в формулу и запишем:
C2H2*2 = C2H4.
Мы получили, что алкен, имеющий в своем составе 2 атома углерода, имеет формулу C2H4.
Теперь представим, что в молекуле алкена не 2, а 3 или 5, или даже 10 атомов углерода.
Запишем формулы этих веществ:
C3H2*3 = C3H6
C5H2*5 = C5H10
C10H2*10 = C10H20
Вот мы получили некоторые формулы веществ, теперь нужно разобраться, а как их можно назвать?
Номенклатура алкенов
Вспомним, что номенклатура – это правило, по которому составляются названия органических веществ. Строение углеродного скелета позволяет разделить алкены на 2 типа, в которых он имеет вид:
- цепочки, т.е. имеет линейное строение (рисунок 1 а);
- цепочки, у которой есть заместители, т.е. имеет разветвленное строение (рисунок 1 б).
Рисунок 1. Виды алкенов.
Номенклатура линейных алкенов
Если вспомним 2 урок по органической химии, в котором рассказывалось про номенклатуру радикалов и алканов, то вспомним, что есть зависимость между числом углеродных атомов в цепочке молекулы и корнем названия. Точно такая же зависимость характерна для алкенов и других органических соединений, и корень названия алкена указывается в зависимости от числа атомов углерода в его цепочке. Для полного названия необходимо добавить суффикс, который у алкенов –ен, что и указано в таблице ниже.
Стоит знать, что алкены линейного строения образуют гомологический ряд алкенов.
Таблица 1. Название алкенов линейного строения.
Для этена было принято еще одно собственное название – этилен.
Чтобы описание алкена было более точно, то необходимо изобразить его структурную формулу и посмотреть, рядом с каким атомом углерода стоит кратная связь. После этого указать его номер через дефис в конце названия.
Но стоит помнить, что нумерация атомов углерода начинается с того конца, к которому кратная связь ближе.
Например, назовем гексен, в котором кратная связь находится в разных частях углеродного скелета.
Номенклатура алкенов с заместителями
Чтобы назвать алкен с заместителями, следует пользоваться алгоритмом:
- Пронумеровать самую длинную углеродную цепь, начиная с того конца, к которому ближе двойная связь.
- В приставке названия указать номер атома углерода, у которого стоит заместитель, и назвать его в соответствии с таблицей радикалов.
- Если у разных атомов углерода стоит один и тот же заместитель, то сначала перечисляются номера атомов, у которых он стоит, а затем через дефис указать общее количество и название.
- В соответствии с длиной цепочки углеродного скелета, выбрать корень названия из таблицы 1.
- Добавить суффикс –ен и через дефис указать, у какого атома углерода стоит кратная связь.
Дадим название веществу, которое имеет структурную формулу, представленную ниже.
Название вещества: 5,5-диметил-2-этил-6-бромгептен-2
Строение алкенов
Два атома углерода в молекуле алкена имеют гибридизацию sp2. Это значит, что гибридизованы его s и только 2 p орбитали, при этом одна p орбиталь имеет свою прежнюю гантелевидную форму. Между sp2-гибридизованными атомами получается двойная связь: одна образуется при перекрывании гибридных орбиталей (рисунок 2 а), а вторая – при перекрывании p-орбиталей (рисунок 2 б).
Рисунок 2. – Образование двойной связи.
Изомерия алкенов
Вспомним, что изомерами называются вещества, у которых одинаковый элементарный состав, но разное структурное строение.
На примере пентена-2 рассмотрим, какие виды изомерии встречаются у алкенов.
- Структурная изомерия. Например, пентен-2 и 2-метилбутен-2 имеют одинаковый элементный состав, но разную длину углеродной цепи и количество заместителей.
- Положение кратной связи. Например, пентен-2 и пентен-1.
- Межклассовая. Циклопентан и пентен-2 относятся к разным классам углеводородов, хоть и имеют одинаковый элементный состав.
- Геометрическая. По отношению к кратной связи заместители могут располагаться либо по одну сторону (цис-изомерия), либо по разные (транс-изомерия).
Все виды изомерии алкенов показаны на рисунке 3.
Рисунок 3. – Виды изомерии алкенов на примере пентена-2.
Физические свойства алкенов
Как и алканы, физические свойства алкенов зависят от количества атомов углерода в его цепочке.
Агрегатные состояния алкенов
Алкены, имеющие в своем составе от 2 до 4 атомов углерода – газы, с 5 до 17 – жидкости, а с 18 – твердые вещества, что показано на рисунке 5.
Рисунок 4. – Газообразный, жидкий и твердый алкены.
Источник
Температура кипения и некоторые другие физические свойства алкенов
Помимо количества атомов углерода в молекуле, на физические свойства алкенов влияет и строение его молекул. Например, чем выше разветвленность, тем выше температура плавления и кипения, а также плотность. Например, в таблице 2 2-метилпропен и бутен-1 имеют одинаковый состав, но при этом разные структурные формулы и разные показатели температур кипения и плавления.
Таблица 2. – Температуры кипения и плавления алкенов
Следует отметить, что алкены хорошо растворимы в органических растворителях, однако плохо растворимы в воде.
В обычных условиях алкены с водой не взаимодействуют (для этого необходимо использовать катализаторы и повышенную температуру), поэтому газообразные алкены водой не поглощаются. Например, если этилен попадет в воду, то он пузырьками выйдет из нее.
Жидкие алкены образуют систему с границей раздела фаз, например, как представлено на рисунке 5.
Рисунок 5. – Несмешивающиеся жидкости.
Твердые алкены ведут себя аналогично камню в воде, т.е. не растворяются.
Способы получения алкенов
Алкены добываются из недр земли или с помощью химических реакций. Первый способ не так распространен в промышленности, ввиду хорошей реакционной способности алкенов, из-за чего они довольно быстро превращаются в другие соединения.
Алкены – востребованные в химическом синтезе реагенты, поэтому были найдены способы их синтеза при помощи химических реакций, которые описаны ниже.
Ниже рассмотрим способы получения алкенов с записью уравнения в общем виде (т.е. используя для обозначения некоторой части углеродной цепи некий радикал R-), а так же с конкретной подставкой метил радикала (CН3-).
Помимо этого, в общем виде химических формул будут встречаться заместители-галогены, которые будут обозначены в общем случае как –Hal. При конкретном примере в качестве галогена будет выступать –Cl.
Итак, химические способы получения алкенов:
- Дегидрирование алканов.Алканы при высокой температуре на катализаторе из оксида хрома претерпевают необратимые изменения и становятся алкенами.
- Термический крекинг алканов.
Крекинг – это химическая реакция, при которой углеводороды с длинной углеродной цепочкой превращаются в соединения с углеродными цепочками меньшей длины. Под термическим крекингом нужно понимать, что такой процесс разложения проводят при повышенной температуре (от 800 до 1000 °С).
- Дегалогенирование. Дегалогенирование – один из видов реакций разложения, при протекании которой от молекулы алкилгалогенида отщепляются атомы галогена. Для проведения такой реакции необходимо использовать дигалогеналкан, у которого атомы галогена находятся у соседних атомов углерода. В присутствии цинка в качестве катализатора и при повышенной температуре от дигалогеналкана отрываются атомы галогена, и между соседними атомами углерода образуется двойная связь. В качестве побочного продукта выделяется соль цинка.
- Дегидрогалогенирование. Дегидрогалогенирование – реакция разложения, в результате которой отщепляется молекула галогенводорода (вспомним, что галогенводороды – это HCl, HBr, HIи HF). Реагентом в такой реакции является алкилгалогенид, от которого при высокой температуре отщепляется галогенводород, а он сам становится алкеном. Выделяющейся в качестве побочного продукта галогенводород взаимодействует с раствором щелочи, т.е. нейтрализуется.
- Дегидратация спиртов в присутствии серной кислоты. Дегидратация – реакция разложения, при которой от органической молекулы отщепляется молекула воды. Чаще всего для такой реакции в качестве реагента используется спирт. Двойная связь образуется, когда от одного атома углерода «отрывается» OH-группа, а от соседнего – атом водорода.Чтобы реакция прошла, необходимо использовать концентрированную серную кислоту в качестве катализатора и нагреть.
- Дегидратация спиртов в присутствии оксида алюминия. Оксид алюминия – вещество, которое чувствительно к влаге, и активно взаимодействует даже с небольшим количеством воды, образуя гидроксид алюминия. Эту способность оксида алюминия используют для того, чтобы сместить равновесие реакции в сторону продуктов, путем уменьшения концентрации одного из них (воды).
- Гидрирование алкинов. При взаимодействии алкина с водородом в присутствии палладия и солей свинца образуется алкен.
Химические свойства алкенов
Наличие кратной связи в молекуле алкена делает их более реакционноспособными, если сравнивать с алканами. Другими словами, алкенам характерен более широкий набор химических реакций, и помимо реакций горения и разложения, они вступают в реакции присоединения и полимеризации. Реакции присоединения – один из характерных химических свойств алкенов.
Реакции замещения, как правило, для алкенов не характерны, т.к. в основном все реакции идут таким образом, чтобы разрушилась кратная связь.
Уравнения химических свойств алкенов будут представлены ниже
Реакции присоединения алкенов
Именно этот тип реакций наиболее часто встречается в практике синтеза органических соединений из алкенов.
Реакцию присоединения можно представить как взаимодействие алкена с веществом А-Б.
- Гидрирование. На платиновом катализаторе, под воздействием высокой температуры, алкен взаимодействует с водородом, в результате чего образуется алкан. Атомы водорода встают по обе стороны кратной связи.
- Галогенирование(качественная реакция с бромом). Вспомним, что бром – жидкость коричневого цвета. При пропускании через раствор брома в воде газообразного алкена образуется дигалогеналкан: атомы брома присоединяются к соседним атомам углерода, а жидкость меняет свой цвет. Эта реакция является качественной для алкенов (т.е. при анализе веществ с ее помощью можно определить, является ли исследуемое вещество алкеном или нет). Аналогично идет присоединение и других галогенов (хлора и иода).
На рисунке 6 наглядно видно, что представляет собой качественная реакция. В 2 пробирки, заполненные одинаковыми реагентами (в данном случае бромом), добавляют алкен(слева) и алкан (справа). После прохождения реакции видно, что в левой пробирке реакция прошла (раствор обесцветился), а в правой нет (бром просто частично растворился в алкане).
Рисунок 6. – Качественная реакция на алкен – взаимодействие с бромной водой.
- Гидрогалогенирование. Правило Марковникова. При взаимодействии алкена с галогенводородом, присоединение к кратной связи идет по правилу: водород присоединяется к тому атому углерода, у которого содержится большее число атомов водорода (т.е. к более гидрированному). Соответственно, атом галогена присоединяется к соседнему атому углерода. На примере ниже видно, что у углерода справа 2 атома водорода, а слева – 1. Значит, в соответствии с правилом, водород присоединится к тому атому углерода, у которого водорода 2, т.е. к стоящему справа.
Последний атом водорода можно не указывать при записи структурной формулы, включив его в общее количество водородов при углероде, т.е. записав:
При использовании специальных катализаторов может происходить присоединение и против правила Марковникова (т.е. когда атом водорода присоединится к менее гидрированному атому углерода), но в школьном курсе такие реакции не рассматриваются.
- Гидратация. Гидратация – реакция присоединения молекулы воды. При взаимодействии с водой в присутствии кислот, алкен превращается в спирт. Правило Марковникова также характерно для данной реакции: водород присоединяется к более гидрированному атому углерода.
Реакции окисления
Под воздействием различных окислителей алкены превращаются в определенные соединения, которые широко используются в дальнейшем органическом синтезе.
В качестве окислителей используются перманганат или дихромат калия. В общем случае, над стрелкой реакции окислитель обозначается как [O].
- Окисление в присутствии перманганата калия (качественная реакция). Водный раствор перманганата калия имеет розовый цвет, но при пропускании через него газообразного алкена, он обесцвечивается. В результате реакции на месте кратной связи образуются гидроксильные группы и такие соединения называются гликолями.
- Окисление алкенов до альдегидов. При взаимодействии с окислителем в кислой среде алкен превращается в альдегид, в качестве побочных продуктов выделяются углекислый газ и вода.
Реакции полимеризации и горения алкенов
Полимеризация – реакция, в результате которой из многих одинаковых молекул с низкой молекулярной массой образуются молекулы с большой молекулярной массой. Продукты реакций полимеризации называют полимерами. Они состоят из цепочки повторяющихся между собой «звеньев». Звенья имеют вид соединения, из которого был получен полимер.
Например, если полимеризовался этилен, то в результате реакции полимеризации образуется полиэтилен.
Как и многие органические соединения, при реакции горения алкенов образуются углекислый газ и вода.Общая формула горения алкенов выглядит так:
Например, при сгорании этилена, реакция горения будет выглядеть следующим образом:
Применение алкенов
Алкены используют в химической промышленности в качестве реагента для получения пластмасс, спиртов, альдегидов и др. соединений, про которые будет рассказано на последующих уроках.
Также алкены используют в сельском хозяйстве в качестве веществ, которые помогают овощам быстрее созреть.
Некоторые алкены используют при сварке металлических изделий, что изображено на рисунке 7.
Рисунок 7. – Газовая сварка с использованием этилена.
Алкены

4.5
Средняя оценка: 4.5
Всего получено оценок: 1614.
4.5
Средняя оценка: 4.5
Всего получено оценок: 1614.
Ациклические непредельные углеводороды с одной двойной связью между атомами углерода называются алкенами. Простейший алкен – этилен (C2H4), образующий гомологический ряд.
Описание
Алкены – класс веществ органической химии. Второе название класса – олефины. Общая формула алкенов – CnH2n.
Алкены обязательно содержат одну двойную связь, которая может располагаться в любом месте молекулы. Атомы, связанные двойной связью, находятся в состоянии sp2-гибридизации, т.е. в соединении атомов участвуют одна s- и две р-орбитали. При этом одна р-орбиталь остаётся свободной.
Алкены, в зависимости от нахождения в гомологическом ряду, отличаются физическими свойствами. Первые три алкена в гомологическом ряду – газы. Вещества, содержащие от пяти до 17 атомов углерода, относятся к жидкостям. Высшие алкены, содержащие более 17 атомов углерода, являются твёрдыми веществами.
Номенклатура
Названия алкенов в гомологическом ряду соответствуют названиям алканов, но суффикс «-ан» заменён на «-ен». Названия и формулы веществ приведены в таблице алкенов.
|
Название |
Формула |
|
Этен (этилен) |
C2H4 |
|
Пропен (пропилен) |
C3H6 |
|
Бутен (бутилен) |
C4H8 |
|
Пентен |
C5H10 |
|
Гексен |
C6H12 |
|
Гептен |
C7H14 |
|
Октен |
C8H16 |
|
Нонен |
C9H18 |
|
Децен |
C10H20 |
Название может содержать две цифры. В начале названия цифра указывает на расположение заместителей (в формуле записывается в скобках). Вторая цифра, стоящая в конце названия, указывает положение двойной связи. Нумерация атомов начинается с конца, к которому ближе расположена двойная связь. Например, название «5-метилгексен-2» указывает, что к пятому атому гексена присоединён метил, а двойная связь находится между вторым и третьим атомом.
Алкены, кроме этилена, имеют изомеры. Пропилену свойственна межклассовая изомерия. Его единственным изомером является циклопропан (C3H6). Изменения углеродного скелета и положения двойной связи, а также структурная изомерия характерны веществам, начиная с бутилена (бутен-1, бутен-2, изобутилен, цис-бутен-2, транс-бутен-2).
Получение
Алкены в отличие от алканов практически не встречаются в природе. Небольшое количество этилена содержат растения. Некоторые феромоны насекомых относятся к классу алкенов.
Олефины синтезируют промышленным и лабораторным путём. В промышленности применяется крекинг – высокотемпературная переработка нефти, а также дегидратация (обезвоживание) спиртов.
В лабораториях используются:
- дегидратация спиртов в присутствии сильных кислот;
- дегидрогалогенирование – отщепление галогенводорода при нагревании;
- дегалогенирование дигалогеналканов – отщепление галогенов в присутствии цинка;
- синтез Гофмана – разложение аммониевых оснований;
- реакция Чугаева – взаимодействие спиртов с сероуглеродом и гидроксидом натрия;
- метод Виттига – взаимодействие карбонильных соединений и алкилиденфосфоранов;
- метод Коупа – разложение N-окисей третичных аминов.
Используются и другие методы. Например, реакция Бурда, Кнёвенагеля, Перкина, Кори-Винтера.
Химические свойства
Алкены – активные вещества. Они реагируют:
- с водородом:
CH3-СН2-СН=СН2 + Н2 → CH3-CH2-СН2-СН3;
- с галогенами:
СН2=СН2 + Cl2 → Cl-CH2-CH2-Cl;
- с галогеноводородами:
СН2=СН2 + HCl → CH3-CH2-Cl;
- с водой:
СН2=СН2 + H2O → CH3-CH2OH;
- с кислородом:
СН2=СН2 + 3O2 → 2CO2↑ + 2H2O.
Алкены способны образовывать полимеры. Реакция полимеризации протекает в присутствии катализатора под действием давления и высокой температуры. Полимеризация помогает получить прочные материалы: полиэтилен, полипропилен, поливинилхлорид.
Что мы узнали?
Из темы урока узнали, что такое алкены. Это класс органических веществ, содержащий одну двойную связь между атомами углерода. Названия алкенов образуются путём присоединения суффикса «-ен». В зависимости от количества атомов углерода алкены могут находиться в газообразном, жидком или твёрдом состоянии. Алкены получают искусственными путями, т.к. в природе вещества практически не встречаются. Это активные соединения, вступающие в реакции с неорганическими веществами.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Кирилл Климов
7/10
-
Ольга Данилова
9/10
-
Дмитрий Туманов
10/10
-
Александра Патрикеева
10/10
-
Софья Кузнецова
10/10
-
Юлия Самольская
9/10
-
Елизавета Малахова
10/10
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 1614.
А какая ваша оценка?
Содержание
- Гомологический ряд, номенклатура, изомерия
- Строение молекул
- Свойства алкенов
- Физические свойства
- Химические свойства
- Получение и применение алкенов
- Понятие об алкадиенах (диены)
- Выводы
Гомологический ряд, номенклатура, изомерия
Алкены — это нециклические углеводороды, в молекулах которых есть одна двойная связь.
Алкены относятся к группе непредельных углеводородов. Непредельными углеводородами являются вещества, в состав молекул которых входит меньшее, чем у алканов, число атомов водорода. Поэтому они способны к реакциям присоединения, т. е. являются ненасыщенными.
Вопрос. Может ли существовать алкен, в состав которого входит один атом углерода?
Поскольку двойная связь связывает два атома углерода, минимальное число атомов углерода в молекуле алкена равно двум. Сравним состав алкана и алкена:
Общая формула:
Таким образом, алкены образует гомологический ряд, общая формула которого
Вопрос. Почему в названиях алкенов появился суффикс ЕН? (См. урок 17.7.)
Упражнение 19.1. Составьте графические формулы алкенов для n = 4.
Решение. Состав этого углеводорода С4Н8. Он содержит двойную связь. Для него возможны три углеродные цепочки:
Допишите атомы водорода к этим цепочкам и убедитесь, что это — изомеры.
Вывод. Начиная с бутена (n = 4) у алкенов возможна структурная изомерия, которая связана
- со строением углеродной цепи: (а) и (в);
- с положением двойной связи: (а) и (б).
Кроме того, для некоторых алкенов возможна пространственная (цис-транс-) изомерия. Цис-транс-изомеры отличаются друг от друга расположением одинаковых атомов или групп атомов по отношению к двойной связи. Такие изомеры есть у алкенов, в молекулах которых около двойной связи имеются разные радикалы (атомы, группы). Например, у бутена-2 [это формула (б)] второй и третий атомы углерода связаны с двумя разными группами: –СН3 и –Н:
Задание 19.1. Назовите оставшиеся два изомера бутена (а) и (в).
Таким образом, в названиях алкенов присутствие двойной связи обозначают при помощи суффикса ЕН, а положение двойной связи показывают цифрой, которую записывают после суффикса. Эта цифра указывает на меньший номер атома углерода при двойной связи. Нумерация атомов углерода основной, главной цепи начинается с того конца, к которому ближе двойная связь.
Упражнение 19.2. Назвать углеводород:
Решение. Основная цепь содержит 4 атома углерода, причём двойная связь соединяет атомы углерода № 1 и № 2 (нумеруем справа налево, так как к правому концу ближе двойная связь). Получаем: бутен-1.
У второго и третьего атомов углерода имеются радикалы «метил», всего их два (обозначение — ДИ); получаем: 2,3-диметилбутен-1.
Задание 19.2. Составьте графические формулы изомеров алкена с n = 5; назовите полученные соединения.
Кроме рассмотренных выше названий по международной номенклатуре IUPAC, на практике применяются и так называемые тривиальные названия. Например, этен обычно называют этилен, пропен — пропилен и т. д. Поэтому алкены называются «этиленовые углеводороды», тем более что по свойствам похожи на этилен.
Строение молекул
Молекулы алкенов отличаются по строению от молекул алканов тем, что они содержат двойную связь. Рассмотрим строение этой связи. Эта связь ковалентная, но неоднородная. Одна из двух связей имеет ту же природу, что и связь в молекулах алканов, т. е. это прочная σ-связь. Другая связь двойной связи образуется иначе, она менее прочная и обозначается буквой π(пи). Это π-связь. Таким образом, в молекуле этена (этилена) имеется:
Вопрос. Какая связь будет легче разрушаться в химических реакциях: σ- или π-связь?
В результате алкены (и любые другие углеводороды), имеющие π-связь, легко, иногда даже при обычных условиях, вступают в химические реакции, причём эти реакции происходят за счёт разрыва π-связи.
Свойства алкенов
Физические свойства
По физическим свойствам алкены почти не отличаются от алканов: низшие алкены (этилен, пропилен и др.) — газы, а с увеличением молекулярной массы увеличиваются и температуры кипения и температуры плавления. Это неполярные вещества, поэтому они практически нерастворимы в воде, но хорошо растворяются в бензине, маслах.
Химические свойства
Наиболее характерной реакцией для алкенов является реакция присоединения. В ходе этой реакции разрывается непрочная π-связь, в результате у обоих атомов углерода, которые соединялись этой связью, появляются «свободные» валентности, за счёт чего и происходит присоединение:
Эта реакция бромирования этилена (и других алкенов) происходит при нормальных условиях под действием раствора брома в воде (бромной воды). В результате цвет бромной воды изменяется: был жёлтым, становится бесцветным.
Поэтому реакция обесцвечивания бромной воды является качественной* на двойную связь.
* Качественной называется химическая реакция, при помощи которой можно обнаружить вещество в смеси или в растворе. В результате качественной реакции изменяется цвет, выделяется газ, осадок.
Упражнение 19.3. В двух пробирках находятся бесцветные жидкости: н-пентан и пентен-1. Как при помощи химической реакции определить, где какая жидкость находится?
Решение. В обе пробирки добавляем жёлтую бромную воду и сильно встряхиваем: в пробирке, где был пентен-1, смесь обесцветится, а в другой пробирке цвет бромной воды не изменится.
Задание 19.3. Составьте уравнения реакций этих процессов.
Аналогично происходят и другие реакции присоединения: с Н2 (гидрирование), с Н2O (гидратация), с НСl и т. д. При этом в результате реакции присоединения двойная связь всегда разрушается (разрывается π-связь). Изменяется характер химической связи: вместо двойной связи появляется простая связь. Образуется одно вещество:
Задание 19.4. Составьте уравнения реакций:
- пропен + водород;
- бутен-2 + вода.
Во всех случаях, которые рассматривались ранее, в результате реакции присоединения могло получиться только одно вещество (один изомер). Но так бывает не всегда. Попробуем составить уравнение реакции пропена с хлороводородом:
Какой изомер получится: (1)? или (2)? или оба? Эта задача решается при помощи правила Марковникова (1869 год)*.
* Марковников Владимир Васильевич (25.12.1837–11.02.1904) — русский химик-органик. Ввёл понятие о взаимном влиянии атомов как главном содержании теории химического строения.
Соединения типа Н-Х присоединяются по месту разрыва двойной связи так, что при этом атом водорода (вещества Н-Х) присоединяется к атому углерода, у которого было больше атомов водорода (наиболее гидрогенизированный атом углерода).
Вопрос. Какой изомер получился при гидрировании бутена-2: (1) или (2)?
При составлении уравнений таких реакций, конечно, нужно «считать» атомы водорода только у тех атомов углерода, которые связаны двойной связью:
Задание 19.5. Составьте уравнения реакций:
- пропен + бром;
- бутен-1 + хлороводород;
- 2-метилпропен + вода.
В отличие от алканов, алкены вступают в реакции окисления* и при обычных условиях. Так, если этилен пропустить через розовый раствор перманганата калия (КМnО4), то раствор станет бесцветным:
* Реакции мягкого окисления, в которых не разрушается углеродная цепь атомов, обозначается [O], а формула вещества-окислителя записывается под стрелочкой.
Вопрос. Является ли эта реакция качественной на двойную связь?
Таким образом, для обнаружения двойной связи в углеводороде, можно воспользоваться любой из качественных реакций:
- обесцвечивание бромной воды;
- обесцвечивание раствора перманганата калия.
Алкены горят, но, в отличие от газообразных алканов, пламя которых бесцветно, газообразные алкены горят светящимся (ярким) пламенем.
Задание 19.6. Составьте уравнение реакции горения этилена.
Алкены легко вступают в реакцию полимеризации. Это процесс, при котором из большого числа молекул (мономеров) образуется ОДНА большая молекула (полимер):
Вопрос. Является ли полиэтилен химически активным веществом? Почему?
Полиэтилен, в отличие от этилена, уже не содержит двойной связи, поэтому он химически инертен, т. е. практически не вступает в химические реакции. Поэтому из него делают плёнки, различные изделия, которые широко применяются в быту (полиэтиленовые пакеты*) и в химической промышленности (трубы, ёмкости и др.).
* Полиэтиленовые пакеты часто неправильно называют «целлофановыми», хотя целлофан — совсем другой материал (см. урок 26).
Получение и применение алкенов
Главный промышленный источник алкенов — природный газ, нефть и продукты их переработки (например, продукты крекинга).
Основным способом получения алкенов является реакция отщепления. В этом случае от двух соседних атомов углерода отщепляется по одному атому или группе:
В лаборатории алкены можно получить реакцией дегидратации (отщепления воды) спиртов. Эта реакция происходит при нагревании в присутствии концентрированной серной кислоты:
Упражнение 19.4. Какую молекулу нужно отщепить от хлорэтана, чтобы получить алкен?
Решение. Сравним состав хлорэтана и этилена:
Эта реакция происходит под действием спиртового раствора щёлочи. Уравнение этого процесса записывается так:
Вопрос. Какую молекулу нужно отщепить от 1,2-дихлорэтана для получения этилена?
Алкены легко вступают в химические реакции, поэтому они применяются для получения различных веществ: спиртов, растворителей, полимеров. Например, из этилена получают этиловый спирт, растворители (хлорэтан и дихлорэтан), полиэтилен.
Задание 19.7. Составьте уравнения реакций получения перечисленных веществ.
Плёнки полиэтилена находят большое применение не только для хранения пищевых продуктов: ими устилают дно каналов, чтобы уменьшить потери влаги; полиэтиленовую пленку используют для устройства парников; ею оборачивают трубы, чтобы уменьшить потери от коррозии и т. д.
Понятие об алкадиенах (диены)
Алкадиены — это углеводороды, в молекулах которых есть две двойные связи.
Алкадиены относят к группе непредельных ненасыщенных углеводородов.
Для того чтобы вывести общую формулу гомологического ряда алкадиенов, сравним состав алканов и алкадиенов:
Таким образом, алкадиены образуют гомологический ряд, общая формула которого
Первый член гомологического ряда алкадиенов С3Н4 называется пропадиен. Таким образом, названия составляют, используя те же принципы номенклатуры IUPAC, с использованием суффикса диен.
Вопрос. На что указывает этот суффикс?
Некоторые диены (так кратко обозначают представителей этого гомологического ряда) имеют тривиальные названия. Например, бутадиен-1,3 известен под названием дивинил, поскольку каждая его половинка является непредельным радикалом, который называется «винил»:
Его гомолог — 2-метилбутадиен-1,3 называется изопрен.
Задание 19.8. Составьте графическую формулу этого соединения.
Начиная с n = 4, возникает изомерия, которая связана не только со строением углеродной цепи, но и положением кратных связей. По этому признаку различают:
- диены с кумулированными связями С–С–С=С=С;
- диены с сопряжёнными связями С–С=С–С=С;
- диены с изолированными связями С=С–С–С=С.
Наибольшее значение и применение имеют диены с сопряжёнными связями. Рассмотрим их свойства.
Для алкадиенов, как и для алкенов, характерны реакции присоединения, которые идут в две стадии. Но диены с сопряжёнными связями вначале присоединяют бром (или другое вещество) в положение 1,4:
Образовавшиеся «свободные валентности» замыкаются, образуя двойную связь.
Вопрос. Возможна ли для полученного соединения реакция присоединения?
Поскольку полученное вещество содержит двойную связь, возможна вторая стадия этого процесса:
Установлено, что на первой стадии присоединения образуется 2 изомера: 80 % указанного вещества (1,4-дибромбутен-2) и 20 % 3,4-дибромбутена-1*.
* Здесь нумерация цепи идёт по двойной связи, так как галогены не являются функциональной группой.
Задание 19.9. Составьте формулы обоих соединений.
Большое практическое значение имеет процесс полимеризации сопряжённых диенов. Вначале, как в случае бромирования, возникает двойная связь в положении 2,3:
Поскольку в полученном полимере имеется двойная связь, такие полимеры имеют два изомера: цис- и транс- (см. урок 19.1). Цис-изомеры таких полимеров являются эластичными и называются каучуки.
Каучуки — это эластичные полимеры, из которых получают резину. Резина образуется из каучука в результате вулканизации. Дело в том, что чистый каучук имеет крайне низкие эксплуатационные качества. Он становится твёрдым и хрупким на морозе, липким на жаре, быстро окисляется, крайне непрочен.
Бутадиен получают синтезом Лебедева**, который заключается в том, что этиловый спирт в присутствии определённых катализаторов подвергают одновременно дегидрированию и дегидратации:
** Лебедев Сергей Васильевич (25.07.1874–02.05.1934) — советский химик. Впервые получил (1910) образец синтетического бутадиенового каучука, разработал (1930) методы получения резины и резинотехнических изделий из синтетического каучука. По способу Лебедева впервые получен (1932) промышленный синтетический каучук.
Для алкадиенов, так же как и для алкенов, характерна реакция окисления. Например, они обесцвечивают раствор перманганата калия. При этом образуются многоатомные спирты.
Производные изопрена широко распространены в природе. К ним относятся многие душистые вещества (мяты, лимона), витамины (каротин, витамин А), а также холестерин.
Выводы
Алкены и алкадиены — это непредельные углеводороды, содержащие двойные связи. Для таких веществ характерны реакции
- присоединения;
- окисления;
- полимеризации.
Все они происходят за счёт разрыва π-связи, которая входит в состав двойной связи.
Алкадиены с сопряжёнными связями образуют полимеры с особыми свойствами — каучуки.
Печатать книгу
| Сайт: | Профильное обучение |
| Курс: | Химия. 10 класс |
| Книга: | § 13. Алкены. Структурная изомерия и номенклатура |
| Напечатано:: | Гость |
| Дата: | Среда, 17 Май 2023, 09:59 |
Оглавление
- Структурная изомерия алкенов
- Номенклатура алкенов
- *Межклассовая изомерия алкенов и циклоалканов
- Вопросы и задания
Структурная изомерия алкенов
Ранее отмечалось, что многообразие органических соединений во многом обусловлено явлением изомерии — возможностью существования соединений одинакового состава, но различного строения. Соединения, имеющие одинаковую молекулярную, но разную структурную формулу, называются структурными изомерами. Рассмотрим структурную изомерию алкенов.
Очевидно, что не существует алкенов, изомерных этилену и пропилену. Аналогичная ситуация наблюдалась и для алканов с числом атомов углерода, равным два и три, — у этана и пропана также нет изомеров. Явление изомерии у алканов проявляется, начиная с бутана. Вспомним строение молекул н-бутана и изобутана:
Изомеры бутана имеют разное строение углеродного скелета: у н-бутана линейное, у изобутана — разветвлённое.
Рассмотрим возможное строение алкенов состава С4Н8. Так же, как и для алканов, для алкенов имеет место изомерия углеродного скелета:
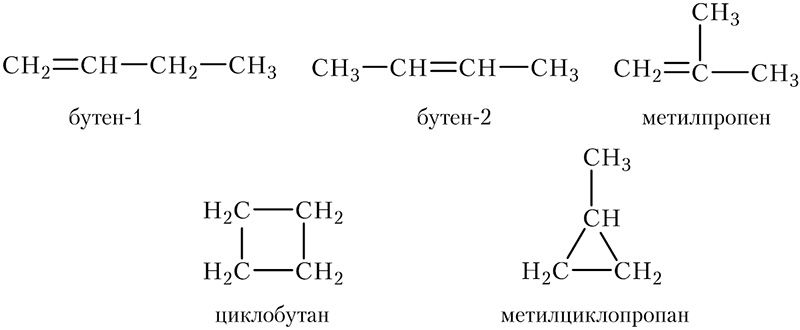
Кроме того, у алкенов появляется новый вид структурной изомерии — изомерия положения двойной связи:
Таким образом, существует три изомерных алкена состава C4H8. Напишем структурные формулы этих изомеров:
Соединения 1 и 2 являются изомерами положения двойной связи. Соединение 3 является изомером углеродного скелета по отношению к соединениям 1 и 2.

Вы можете познакомиться с межклассовой изомерией алкенов и циклоалканов, перейдя по ссылке в QR-коде.
Номенклатура алкенов
В отличие от алканов, в названии алкенов вместо суффикса -ан используется суффикс -ен, обозначающий двойную связь. Атомы углерода главной цепи нумеруют, начиная с того конца, к которому ближе двойная связь. Положение двойной связи указывают номером атома углерода, от которого она начинается.
Этилен в соответствии с правилами номенклатуры называется этен.
Пропилен — пропен. Назовём изомерные алкены состава C4H8:
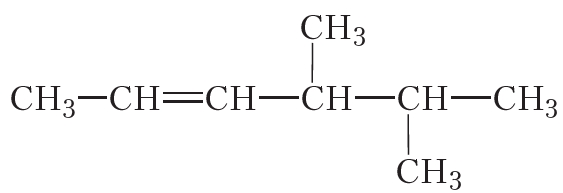
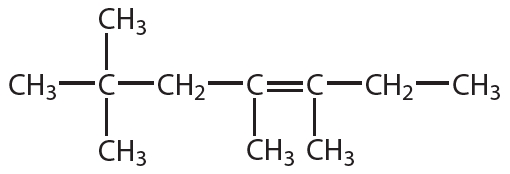
Рассмотрим более сложный пример. Назовём алкен, структурная формула которого:
Выберем главную цепь соединения. В данном случае выбор не представляет трудностей, это самая длинная горизонтально расположенная цепь, она включает двойную связь. Пронумеруем атомы углерода. Нумерацию начинаем с того конца, к которому ближе двойная связь:
Главная цепь включает шесть атомов углерода, двойная связь начинается со второго атома углерода, поэтому на конце названия будет суффикс -ен с цифрой 2. Положения двух метильных групп при четвёртом и пятом атомах углерода обозначаются, как и в случае алканов, соответствующими номерами. В итоге, название соединения: 4,5-диметилгексен-2.
Возможности изомерии в ряду алкенов шире, чем у алканов, так как кроме изомерии углеродного скелета возможна изомерия положения двойной связи.
Принципы построения названий алкенов похожи на рассмотренные ранее для алканов. Положение двойной связи указывается номером атома углерода главной цепи, с которого начинается связь. Атомы углерода главной цепи нумеруют с того конца, к которому ближе двойная связь.
*Межклассовая изомерия алкенов и циклоалканов
Существует два класса соединений, имеющих состав СnН2n, — алкены и циклоалканы. Например, формулу C3H6 имеют два вещества:
Пропен и циклопропан являются изомерами, так как имеют одинаковую молекулярную формулу, но разное строение. Вместе с тем пропен и циклопропан относятся к разным классам органических веществ.
Изомеры, относящиеся к различным классам соединений, называются межклассовыми изомерами, а соответствующий вид изомерии — межклассовой изомерией.
Таким образом, количество структурных изомеров состава С4Н8 не ограничивается тремя алкенами, такой же состав имеют циклобутан и метилциклопропан. Приведём формулы и названия всех структурных изомеров состава C4H8:
Задание
Напишите структурные формулы соединений состава С5Н10 и дайте им названия.
Вопросы и задания
1. Напишите структурные формулы алкенов состава С5Н10 и дайте им названия.
2. Назовите алкен, структурная формула которого:
3. Напишите структурные формулы следующих алкенов:
а) 2,3,4-триметилпентен-1;
б) 4,5-диметил-3-этилгексен-2.
4*. Напишите структурные формулы изомерных соединений состава С5Н10 и дайте им названия.