
Основные термины и понятия

Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:
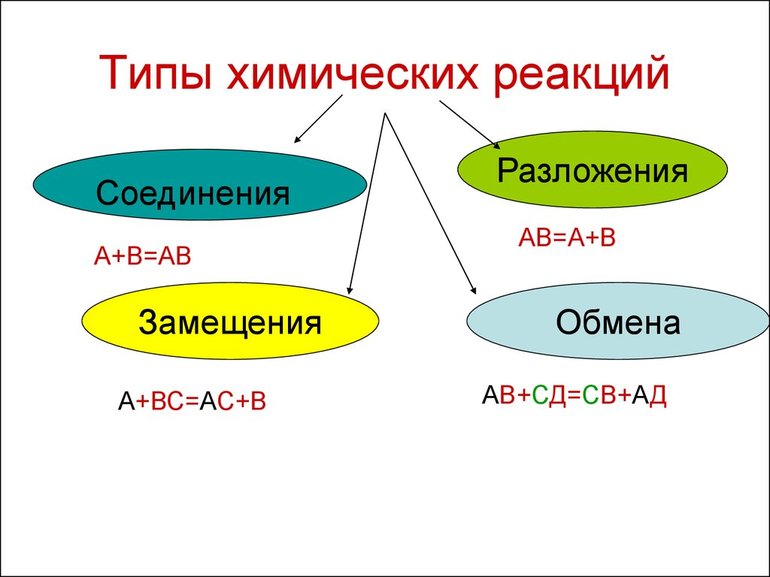
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс

Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
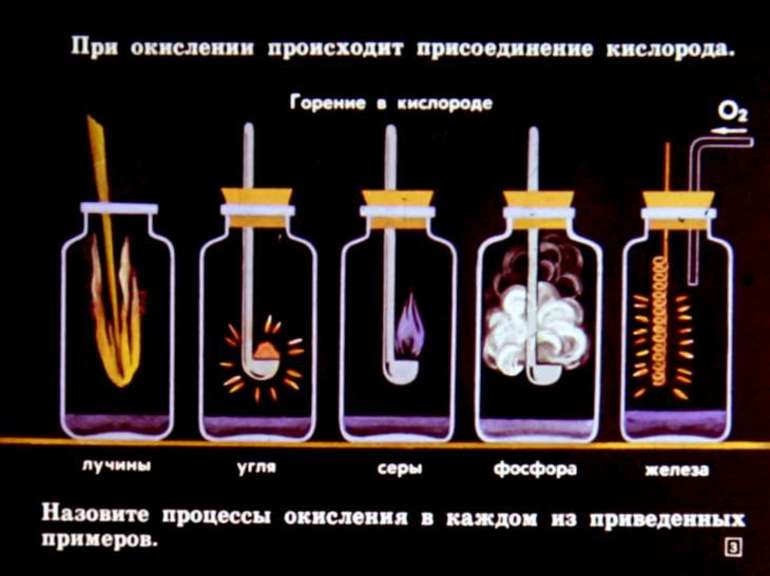
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
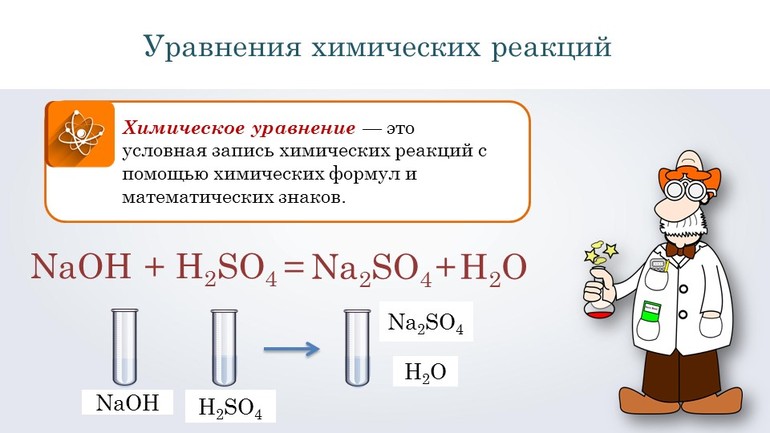
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
-
Уравнение можно сократить на 16H+ и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO–3 + 4 H+ = Fe3+ + 2SO2-4 + 5NO + 2H2O.
- Добавив в обе части нужное количество ионов, записывают молекулярное уравнение: FeS2 + 8HNO3 = Fe (NO 3) 3 + 2H2SO4 + 5NO + 2H2O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта

Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
Химия – это наука о веществах, их свойствах и превращениях.
То есть, если с окружающими нас веществами ничего не происходит, то это не относится к химии. Но что значит, «ничего не происходит»? Если в поле нас вдруг застала гроза, и мы все промокли, как говорится «до нитки», то это ли не превращение: ведь одежда была сухой, а стала мокрой.
Если, к примеру взять железный гвоздь, обработать его напильником, а затем собрать железные опилки (Fe), то это ли так же не превращение: был гвоздь – стал порошок. Но если после этого собрать прибор и провести получение кислорода (О2): нагреть перманганат калия (КМпО4) и собрать в пробирку кислород, а затем в неё поместить раскалённые «до красна» эти железные опилки, то они вспыхнут ярким пламенем и после сгорания превратятся в порошок бурого цвета. И это так же превращение. Так где же химия? Несмотря на то, что в этих примерах меняется форма (железный гвоздь) и состояние одежды (сухая, мокрая) – это не превращения. Дело в том, что сам по себе гвоздь как был веществом (железо), так им и остался, несмотря на другую свою форму, а воду от дождя как впитала наша одежда, так потом его и испарила в атмосферу. Сама вода не изменилась. Так что же такое превращения с точки зрения химии?
Превращениями с точки зрения химии называются такие явления, которые сопровождаются изменением состава вещества. Возьмём в качестве примера тот же гвоздь. Не важно, какую форму он принял после обработки напильником, но после того как собранные от него железные опилки поместили в атмосферу кислорода – он превратился в оксид железа (Fe2O3). Значит, что-то всё-таки изменилось? Да, изменилось. Было вещество гвоздь, но под воздействием кислорода сформировалось новое вещество – оксид элемента железа. Молекулярное уравнение этого превращения можно отобразить следующими химическими символами:
4Fe + 3O2 = 2Fe2O3 (1)
Для непосвящённого в химии человека сразу возникают вопросы. Что такое «молекулярное уравнение», что такое Fe? Почему поставлены цифры «4», «3», «2»? Что такое маленькие цифры «2» и «3» в формуле Fe2O3 ? Это значит, наступило время во всём разобраться по порядку.
Знаки химических элементов.
Несмотря на то, что химию начинают изучать в 8-м классе, а некоторые даже раньше, многим известен великий русский химик Д. И. Менделеев. И конечно же, его знаменитая «Периодическая система химических элементов». Иначе, проще, её называют «Таблица Менделеева».

В этой таблице, в соответствующем порядке, располагаются элементы. К настоящему времени их известно около 120. Названия многих элементов нам были известны ещё давно. Это: железо, алюминий, кислород, углерод, золото, кремний. Раньше мы не задумываясь применяли эти слова, отождествляя их с предметами: железный болт, алюминиевая проволока, кислород в атмосфере, золотое кольцо и т.д. и т.д. Но на самом деле все эти вещества (болт, проволока, кольцо) состоят из соответствующих им элементов. Весь парадокс состоит в том, что элемент нельзя потрогать, взять в руки. Как же так? В таблице Менделеева они есть, а взять их нельзя! Да, именно так. Химический элемент – это абстрактное (то есть отвлечённое) понятие, и используется в химии, впрочем как и в других науках, для расчётов, составления уравнений, при решении задач. Каждый элемент отличается от другого тем, что для него характерна своя электронная конфигурация атома. Количество протонов в ядре атома равно количеству электронов в его орбиталях. К примеру, водород – элемент №1. Его атом состоит из 1-го протона и 1-го электрона. Гелий – элемент №2. Его атом состоит из 2-х протонов и 2-х электронов. Литий – элемент №3. Его атом состоит из 3-х протонов и 3-х электронов. Дармштадтий – элемент №110. Его атом состоит из 110-и протонов и 110-и электронов.
Каждый элемент обозначается определённым символом, латинскими буквами, и имеет определённое прочтение в переводе с латинского. Например, водород имеет символ «Н», читается как «гидрогениум» или «аш». Кремний имеет символ «Si» читается как «силициум». Ртуть имеет символ «Нg» и читается как «гидраргирум». И так далее. Все эти обозначения можно найти в любом учебнике химии за 8-й класс. Для нас сейчас главное уяснить то, что при составлении химических уравнений, необходимо оперировать указанными символами элементов.
Простые и сложные вещества.
Обозначая единичными символами химических элементов различные вещества (Hg ртуть, Fe железо, Cu медь, Zn цинк, Al алюминий) мы по сути обозначаем простые вещества, то есть вещества, состоящие из атомов одного вида (содержащие одно и то же количество протонов и нейтронов в атоме). Например, если во взаимодействие вступают вещества железо и сера, то уравнение примет следующую форму записи:
Fe + S = FeS (2)
К простым веществам относятся металлы (Ва, К, Na, Mg, Ag), а так же неметаллы (S, P, Si, Cl2, N2, O2, H2). Причём следует обратить
особое внимание на то, что все металлы обозначаются единичными символами: К, Ва, Са, Аl, V, Mg и т.д., а неметаллы – либо простыми символами: C,S,P или могут иметь различные индексы, которые указывают на их молекулярное строение: H2, Сl2, О2, J2, P4, S8. В дальнейшем это будет иметь очень большое значение при составлении уравнений. Совсем не трудно догадаться, что сложными веществами являются вещества, образованные из атомов разного вида, например,
1). Оксиды:
оксид алюминия Al2O3,  оксид натрия Na2O,
оксид натрия Na2O,
оксид меди CuO,
оксид цинка ZnO,
оксид титана Ti2O3 ,
угарный газ или оксид углерода (+2) CO,
оксид серы (+6) SO3
2). Основания:
гидроксид железа (+3) Fe(OH)3,
гидроксид меди Cu(OH)2 ,
гидроксид калия или щёлочь калия КOH,
гидроксид натрия NaOH.
3). Кислоты:
соляная кислота HCl,
сернистая кислота H2SO3,
азотная кислота HNO3
4). Соли:
тиосульфат натрия Na2S2O3,
сульфат натрия или глауберова соль Na2SO4 ,
карбонат кальция или известняк СаCO3,
хлорид меди CuCl2
5). Органические вещества:
ацетат натрия СН3СООNa,
метан СН4,
ацетилен С2Н2 ,
глюкоза С6Н12О6
Наконец, после того как мы выяснили структуру различных веществ, можно приступать к составлению химических уравнений.
Химическое уравнение.
Само слово «уравнение» производное от слова «уравнять», т.е. разделить нечто на равные части. В математике уравнения составляют чуть ли не самую сущность этой науки. К примеру, можно привести такое простое уравнение, в котором левая и правая части будут равны «2» :
40 : (9 + 11) = (50 х 2) : ( 80 – 30 );
И в химических уравнениях тот же принцип: левая и правая части уравнения должны соответствовать одинаковым количествам атомов, участвующим в них элементов. Или, если приводится ионное уравнение, то в нём число частицтак же должно соответствовать этому требованию. Химическим уравнением называется условная запись химической реакции с помощью химических формул и математических знаков . Химическое уравнение по своей сути отражает ту или иную химическую реакцию, то есть процесс взаимодействия веществ, в процессе которых возникают новые вещества. Например, необходимо написать молекулярное уравнение реакции, в которой принимают участие хлорид бария ВаСl2 и серная кислота H2SO4. В результате этой реакции образуется нерастворимый осадок – сульфат бария ВаSO4 и соляная кислота НСl :
ВаСl2 + H2SO4 = BaSO4 + 2НСl (3)
Прежде всего необходимо уяснить, что большая цифра «2», стоящая перед веществом НСlназывается коэффициентом, а малые цифры «2», «4» под формулами ВаСl2, H2SO4 ,BaSO4 называются индексами. И коэффициенты и индексы в химических уравнениях выполняют роль множителей, а не слагаемых. Что бы правильно записать химическое уравнение, необходимо расставить коэффициенты в уравнении реакции. Теперь приступим к подсчёту атомов элементов в левой и правой частях уравнения. В левой части уравнения: в веществе ВаСl2 содержатся 1 атом бария (Ва), 2 атома хлора (Сl). В веществе H2SO4: 2 атома водорода (Н), 1 атом серы (S) и 4 атома кислорода (О) . В правой части уравнения: в веществе BaSO4 1 атом бария (Ва) 1 атом серы (S) и 4 атома кислорода (О), в веществе НСl: 1 атом водорода (Н) и 1 атом хлора (Сl). Откуда следует, что в правой части уравнения количество атомов водорода и хлора вдвое меньше, чем в левой части. Следовательно, перед формулой НСl в правой части уравнения необходимо поставить коэффициент «2». Если теперь сложить количества атомов элементов, участвующих в данной реакции, и слева и справа, то получим следующий баланс:

В обеих частях уравнения количества атомов элементов, участвующих в реакции, равны, следовательно оно составлено правильно.

Химические уравнение и химические реакции
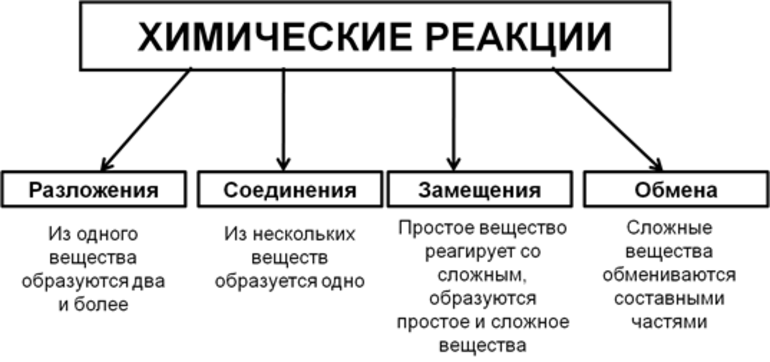
Как мы уже выяснили, химические уравнения являются отражением химических реакций. Химическими реакциями называются такие явления, в процессе которых происходит превращение одних веществ в другие. Среди их многообразия можно выделить два основных типа:
1). Реакции соединения
2). Реакции разложения.
В подавляющем своём большинстве химические реакции принадлежат к реакциям присоединения, поскольку с отдельно взятым веществом редко могут происходить изменения в его составе, если оно не подвергается воздействиям извне (растворению, нагреванию, действию света). Ничто так не характеризует химическое явление, или реакцию, как изменения, происходящие при взаимодействии двух и более веществ. Такие явления могут осуществляться самопроизвольно и сопровождаться повышением или понижением температуры, световыми эффектами, изменением цвета, образованием осадка, выделением газообразных продуктов, шумом.
Для наглядности приведём несколько уравнений, отражающих процессы реакций соединения, в процессе которых получаются хлорид натрия (NaCl), хлорид цинка (ZnCl2), осадок хлорида серебра (AgCl), хлорид алюминия (AlCl3)
Cl2 + 2Nа = 2NaCl (4)
СuCl2+ Zn= ZnCl2 + Сu (5)
AgNO3 + КCl = AgCl+ 2KNO3 (6)
3HCl+ Al(OH)3 = AlCl3 + 3Н2О (7)
Cреди реакций соединения следует особым образом отметить следующие: замещения (5), обмена (6), и как частный случай реакции обмена – реакцию нейтрализации (7).
К реакциям замещения относятся такие, при осуществлении которой атомы простого вещества замещают атомы одного из элементов в сложном веществе. В примере (5) атомы цинка замещают из раствора СuCl2 атомы меди, при этом цинк переходит в растворимую соль ZnCl2, а медь выделяется из раствора в металлическом состоянии.
К реакциям обмена относятся такие реакции, при которых два сложных вещества обмениваются своими составными частями.В случае реакции (6) растворимые соли AgNO3 и КCl при сливании обоих растворов образуют нерастворимый осадок соли AgCl. При этом они обмениваются своими составными частями – катионами и анионами. Катионы калия К+ присоединяются к анионам NO3, а катионы серебра Ag+ – к анионам Cl–.
К особому, частному случаю, реакций обмена относится реакция нейтрализации. К реакциям нейтрализации относятся такие реакции, в процессе которых кислоты реагируют с основаниями, в результате образуется соль и вода. В примере (7) соляная кислота HCl, реагируя с основанием Al(OH)3 образует соль AlCl3 и воду. При этом катионы алюминия Al3+ от основания обмениваются с анионами Сl– от кислоты. В итоге происходит нейтрализация соляной кислоты.
К реакциям разложения относятся такие, при котором из одного сложного образуются два и более новых простых или сложных веществ, но более простого состава. В качестве реакций можно привести такие, в процессе которых разлагаются 1). Нитрат калия(КNO3) с образованием нитрита калия (КNO2) и кислорода (O2); 2). Перманганат калия (KMnO4): образуются манганат калия (К2МnO4), оксид марганца (MnO2) и кислород (O2); 3). Карбонат кальция или мрамор; в процессе образуются углекислый газ (CO2) и оксид кальция (СаО)
2КNO3 =2КNO2 + O2 (8)
2KMnO4 = К2МnO4 + MnO2 + O2 (9)
СаCO3 = CaO + CO2 (10)
В реакции (8) из сложного вещества образуется одно сложное и одно простое. В реакции (9) – два сложных и одно простое. В реакции (10) – два сложных вещества , но более простых по составу
Разложению подвергаются все классы сложных веществ:
1). Оксиды: оксид серебра 2Ag2O = 4Ag + O2 (11)
2). Гидроксиды: гидроксид железа 2Fe(OH)3 = Fe2O3 + 3H2O (12)
3). Кислоты: серная кислота H2SO4 = SO3 + H2O (13)
4). Соли: карбонат кальция СаCO3 = СаO + CO2 (14)
5). Органические вещества: спиртовое брожение глюкозы
С6Н12О6 = 2С2Н5ОH + 2CO2 (15)
Согласно другой классификации, все химические реакции можно разделить на два типа: реакции, идущие с выделением теплоты, их называют экзотермические, и реакции, идущие с поглощением теплоты – эндотермические. Критерием таких процессов является тепловой эффект реакции. Как правило, к экзотермическим реакциям относятся реакции окисления, т.е. взаимодействия с кислородом, например сгорание метана:
СН4 + 2O2 = СО2 + 2Н2О + Q (16)
а к эндотермическим реакциям – реакции разложения, уже приводимые выше (11) – (15). Знак Q в конце уравнения указывает на то, выделяется ли теплота в процессе реакции (+Q) или поглощается (-Q):
СаCO3 = СаO+CO2 – Q (17)
Можно так же рассматривать все химические реакции по типу изменения степени окисления, участвующих в их превращениях элементов. К примеру, в реакции (17) участвующие в ней элементы не меняют свои степени окисления:
Са+2C+4O3-2 = Са+2O-2+C+4O2-2 (18)
А в реакции (16) элементы меняют свои степени окисления:
2Mg0 + O20 = 2Mg+2O-2
Реакции такого типа относятся к окислительно-восстановительным. Они будут рассматриваться отдельно. Для составления уравнений по реакциям такого типа необходимо использовать метод полуреакцийи применять уравнение электронного баланса.
После приведения различных типов химических реакций, можно приступать к принципу составлений химических уравнений, иначе, подбору коэффициентов в левой и правой их частях.
СЛОЖНА-А-А 🙀 Ты же знаешь, что если не разобраться в теме сейчас, то потом придется исправлять оценки. Беги на бесплатное онлайн-занятие с репетитором (подробности тут + 🎁).
Механизмы составления химических уравнений.
К какому бы типу ни относилась та или иная химическая реакция, её запись ( химическое уравнение) должна соответствовать условию равенства количества атомов до реакции и после реакции.
Существуют такие уравнения (17), которые не требуют уравнивания, т.е. расстановки коэффициентов. Но в большинстве случаях, как в примерах (3), (7), (15), необходимо предпринимать действия, направленные на уравнивание левой и правой частей уравнения. Какими же принципами необходимо руководствоваться в таких случаях? Существует ли какая ни будь система в подборе коэффициентов? Существует, и не одна. К таковым системам относятся:
1). Подбор коэффициентов по заданным формулам.
2). Составление по валентностям реагирующих веществ.
3). Составление по степеням окисления реагирующих веществ.
В первом случае полагается, что нам известны формулы реагирующих веществ как до реакции, так и после. К примеру, дано следующее уравнение:
N2 + О2 →N2О3 (19)
Принято считать, что пока не установлено равенство между атомами элементов до реакции и после, знак равенства (=) в уравнении не ставится, а заменяется стрелкой (→). Теперь приступим к собственно уравниванию. В левой части уравнения имеются 2 атома азота (N2) и два атома кислорода (О2), а в правой – два атома азота (N2) и три атома кислорода (О3). По количеству атомов азота его уравнивать не надо, но по кислороду необходимо добиться равенства, поскольку до реакции их участвовало два атома, а после реакции стало три атома. Составим следующую схему:
до реакции после реакции
О2 О3
Определим наименьшее кратное между данными количествами атомов, это будет «6».
О2 О3
6 /
Разделим это число в левой части уравнения по кислороду на «2». Получим число «3», поставим его в решаемое уравнение:
N2 + 3О2 →N2О3
Так же разделим число «6» для правой части уравнения на «3». Получим число «2», так же поставим его в решаемое уравнение:
N2 + 3О2 → 2N2О3
Количества атомов кислорода и в левой и в правой частях уравнения стали равны, соответственно по 6 атомов:
3О2 → 2О3
Но количество атомов азота в обеих частях уравнения не будут соответствовать друг другу:
N2→ 2N2
В левой – два атома, в правой – четыре атома. Следовательно, что бы добиться равенства, необходимо удвоить количество азота в левой части уравнения, поставив коэффициент «2»:
2N2→ 2N2
Таким образом, равенство по азоту соблюдено и в целом, уравнение примет вид:
2N2 + 3О2 → 2N2О3
Теперь в уравнении можно вместо стрелки поставит знак равенства:
2N2 + 3О2 = 2N2О3 (20)
Приведём другой пример. Дано следующее уравнение реакции:
Р + Cl2→ РCl5
В левой части уравнения имеется 1 атом фосфора (Р) и два атома хлора (Cl2), а в правой – один атом фосфора (Р) и пять атомов кислорода (Cl5). По количеству атомов фосфора его уравнивать не надо, но по хлору необходимо добиться равенства, поскольку до реакции их участвовало два атома, а после реакции стало пять атома. Составим следующую схему:
до реакции после реакции
Cl2 Cl5
Определим наименьшее кратное между данными количествами атомов, это будет «10».
Cl2 Cl5
10 /
Разделим это число в левой части уравнения по хлору на «2». Получим число «5», поставим его в решаемое уравнение:
Р + 5Cl2→ РCl5
Так же разделим число «10» для правой части уравнения на «5». Получим число «2», так же поставим его в решаемое уравнение:
Р + 5Cl2→ 2РCl5
Количества атомов хлора и в левой и в правой частях уравнения стали равны, соответственно по 10 атомов:
5Cl2→ 2Cl5
Но количество атомов фосфора в обеих частях уравнения не будут соответствовать друг другу:
Р → 2Р
Следовательно, что бы добиться равенства, необходимо удвоить количество фосфора в левой части уравнения, поставив коэффициент «2»:
2Р → 2Р
Таким образом, равенство по фосфору соблюдено и в целом, уравнение примет вид:
2Р + 5Cl2= 2РCl5 (21)
При составлении уравнений по валентностям необходимо дать определение валентности и установить значения для наиболее известных элементов. Валентность – это одно из ранее применяемых понятий, в настоящее время в ряде школьных программ не используется. Но при его помощи легче объяснить принципы составления уравнений химических реакций. Под валентностью понимают число химических связей, которые тот или иной атом может образовывать с другим, или другими атомами. Валентность не имеет знака ( + или – ) и обозначается римскими цифрами, как правило, над символами химических элементов, например:
I II III IV V
H O N S Р
Откуда берутся эти значения? Как их применять при составлении химических уравнений? Числовые значения валентностей элементов совпадают с их номером группы Периодической системы химических элементов Д. И. Менделеева (Таблица 1).

Для других элементов значения валентностей могут иметь иные значения, но никогда не больше номера группы, в которой они расположены. Причём для чётных номеров групп (IV и VI ) валентности элементов принимают только чётные значения, а для нечётных – могут иметь как чётные, так и нечётные значения (Таблица.2).

Конечно же, в значениях валентностей для некоторых элементов имеются исключения, но в каждом конкретном случае эти моменты обычно оговариваются. Теперь рассмотрим общий принцип составления химических уравнений по заданным валентностям для тех или иных элементов. Чаще всего данный метод приемлем в случае составления уравнений химических реакций соединения простых веществ, например, при взаимодействии с кислородом (реакции окисления). Допустим, необходимо отобразить реакцию окисления алюминия. Но напомним, что металлы обозначаются единичными атомами (Al), а неметаллы, находящиеся в газообразном состоянии – с индексами «2» – (О2). Сначала напишем общую схему реакции:
Al + О2 →AlО
На данном этапе ещё не известно, какое правильное написание должно быть у оксида алюминия. И вот именно на данном этапе нам на помощь придёт знание валентностей элементов. Для алюминия и кислорода проставим их над предполагаемой формулой этого оксида:
III II
Al О
После чего «крест»-на-«крест» у этих символов элементов поставим внизу соответствующие индексы:
III II
Al2 О3
Состав химического соединения Al2О3 определён. Дальнейшая схема уравнения реакции примет вид:
Al+ О2 →Al2О3
Остаётся только уравнять левую и правую его части. Поступим таким же способом, как в случае составления уравнения (19). Количества атомов кислорода уравняем, прибегая к нахождению наименьшего кратного:
до реакции после реакции
О2 О3
6 /
Разделим это число в левой части уравнения по кислороду на «2». Получим число «3», поставим его в решаемое уравнение. Так же разделим число «6» для правой части уравнения на «3». Получим число «2», так же поставим его в решаемое уравнение:
Al + 3О2 → 2Al2О3
Что бы добиться равенства по алюминию, необходимо скорректировать его количество в левой части уравнения, поставив коэффициент «4»:
4Al + 3О2 → 2Al2О3
Таким образом, равенство по алюминию и кислороду соблюдено и в целом, уравнение примет окончательный вид:
4Al + 3О2 = 2Al2О3 (22)
Применяя метод валентностей, можно прогнозировать, какое вещество образуется в процессе химической реакции, как будет выглядеть его формула. Допустим, в реакцию соединения вступили азот и водород с соответствующими валентностями III и I. Напишем общую схему реакции:
N2 + Н2 → NН
Для азота и водорода проставим валентности над предполагаемой формулой этого соединения:
III I
N Н
Как и прежде «крест»-на-«крест» у этих символов элементов поставим внизу соответствующие индексы:
III I
N Н3
Дальнейшая схема уравнения реакции примет вид:
N2 + Н2 → NН3
Уравнивая уже известным способом, через наименьшее кратное для водорода, равное «6»,получим искомые коэффициенты, и уравнение в целом:
N2 + 3Н2 = 2NН3 (23)
При составлении уравнений по степеням окисления реагирующих веществ необходимо напомнить, что степенью окисления того или иного элемента называется число принятых или отданных в процессе химической реакции электронов. Степень окисления в соединениях в основном, численно совпадает со значениями валентностей элемента. Но отличаются знаком. Например, для водорода валентность равна I, а степень окисления (+1) или (-1). Для кислорода валентность равна II, а степень окисления (-2). Для азота валентности равны I,II,III,IV,V, а степени окисления (-3), (+1), (+2), (+3), (+4), (+5) и т.д. Степени окисления наиболее часто применяемых в уравнениях элементов, приведены в таблице 3.

В случае реакций соединения принцип составления уравнений по степеням окисления такой же, как и при составлении по валентностям. Например, приведём уравнение реакции окисления хлора кислородом, в которой хлор образует соединение со степенью окисления +7. Запишем предполагаемое уравнение:
Cl2 + О2 →ClО
Поставим над предполагаемым соединением ClО степени окисления соответствующих атомов:
+7 -2
Cl О
Как и в предыдущих случаях установим, что искомая формула соединения примет вид:
+7 -2
Cl2О7
Уравнение реакции примет следующий вид:
Cl2 + О2 → Cl2О7
Уравнивая по кислороду, найдя наименьшее кратное между двумя и семи, равное «14», установим в итоге равенство:
2Cl2 + 7О2 = 2Cl2О7 (24)
Несколько иной способ необходимо применять со степенями окисления при составлении реакций обмена, нейтрализации, замещения. В ряде случаев предоставляется затруднительным узнать: какие соединения образуются при взаимодействии сложных веществ?
Как узнать: что получится в процессе реакции?
Действительно, как узнать: какие продукты реакции могут возникнут в ходе конкретной реакции? К примеру, что образуется при взаимодействии нитрата бария и сульфата калия?
Ва(NО3) 2 + К2SO4 → ?
Может быть ВаК2(NО3) 2 + SO4 ?Или Ва + NО3SO4 + К2? Или ещё что-то? Конечно же, в процессе этой реакции образуются соединения: ВаSO4 и КNО3 . А откуда это известно? И как правильно написать формулы веществ? Начнём с того, что чаще всего упускается из вида: с самого понятия «реакция обмена». Это значит, что при данных реакциях вещества меняются друг с другом составными частями. Поскольку реакции обмена в большинстве своём осуществляются межу основаниями, кислотами или солями, то частями, которыми они будут меняться, являются катионы металлов ( Na+, Mg2+,Al3+,Ca2+,Cr3+), ионов Н+ или ОН–, анионов – остатков кислот,(Cl–, NO32-,SO32-, SO42-, CO32-, PO43-). В общем виде реакцию обмена можно привести в следующей записи:
Kt1An1 + Kt2An1 = Kt1An2 + Kt2An1 (25)
Где Kt1 и Kt2 – катионы металлов (1) и (2), а An1 и An2 – соответствующие им анионы (1) и (2). При этом обязательно надо учитывать, что в соединениях до реакции и после реакции на первом месте всегда устанавливаются катионы, а анионы – на втором. Следовательно, если в реакцию вступит хлорид калия и нитрат серебра, оба в растворённом состоянии
KCl + AgNO3→
то в процессе её образуются вещества KNO3 и AgClи соответствующее уравнение примет вид:
KCl + AgNO3=KNO3 + AgCl (26)
При реакциях нейтрализации протоны от кислот (Н+) будут соединяться с анионами гидроксила (ОН–) с образованием воды (Н2О):
НCl + КОН = КCl + Н2O (27)
Степени окисления катионов металлов и заряды анионов кислотных остатков указаны в таблице растворимости веществ (кислот, солей и оснований в воде). По горизонтали приведены катионы металлов, а по вертикали – анионы кислотных остатков.

Исходя из этого, при составлении уравнения реакции обмена, необходимо вначале в левой его части установить степени окисления принимающих в этом химическом процессе частиц. Например, требуется написать уравнение взаимодействия между хлоридом кальция и карбонатом натрия.Составим исходную схему этой реакции:
СаCl + NаСО3 →
Над катионами и анионами проставим соответствующие заряды:
Са2+Cl– + Nа+СО32- →
Совершив уже известное действие «крест»-на-«крест», определим реальные формулы исходных веществ:
СаCl2 + Nа2СО3 →
Исходя из принципа обмена катионами и анионами (25), установим предварительные формулы образующихся в ходе реакции веществ:
СаCl2 + Nа2СО3 → СаСО3 + NаCl
Над их катионами и анионами проставим соответствующие заряды:
Са2+СО32- + Nа+Cl–
Формулы веществ записаны правильно, в соответствии с зарядами катионов и анионов. Составим полное уравнение, уравняв левую и правую его части по натрию и хлору:
СаCl2 + Nа2СО3 = СаСО3 + 2NаCl (28)
В качестве другого примера приведём уравнение реакции нейтрализации между гидроксидом бария и ортофосфорной кислотой:
ВаОН + НРО4 →
Над катионами и анионами проставим соответствующие заряды:
Ва2+ ОН– + Н+РО43- →
Определим реальные формулы исходных веществ:
Ва(ОН)2 + Н3РО4 →
Исходя из принципа обмена катионами и анионами (25), установим предварительные формулы образующихся в ходе реакции веществ, учитывая, что при реакции обмена одним из веществ обязательно должна быть вода:
Ва(ОН)2 + Н3РО4 → Ва2+ РО43- + Н2O
Определим правильную запись формулы соли, образовавшейся в процессе реакции:
Ва(ОН)2 + Н3РО4 → Ва3(РО4)2 + Н2O
Уравняем левую часть уравнения по барию:
3Ва (ОН)2 + Н3РО4 → Ва3(РО4)2 + Н2O
Поскольку в правой части уравнения остаток ортофосфорной кислоты взят дважды, (РО4)2, то слева необходимо также удвоить её количество:
3Ва (ОН)2 + 2Н3РО4 → Ва3(РО4)2 + Н2O
Осталось привести в соответствие количество атомов водорода и кислорода в правой части у воды. Так как слева общее количество атомов водорода равно 12, то справа оно так же должно соответствовать двенадцати, поэтому перед формулой воды необходимо поставить коэффициент «6» (поскольку в молекуле воды уже имеется 2 атома водорода). По кислороду так же соблюдено равенство: слева 14 и справа 14. Итак, уравнение имеет правильную форму записи:
3Ва (ОН)2 + 2Н3РО4 → Ва3(РО4)2 + 6Н2O (29)
Возможность осуществления химических реакций
Мир состоит из великого множества веществ. Неисчислимо так же количество вариантов химических реакций между ними. Но можем ли мы, написав на бумаге то или иное уравнение утверждать, что ему будет соответствовать химическая реакция? Существует ошибочное мнение, что если правильно расставить коэффициенты в уравнении, то оно будет осуществимо и на практике. Например, если взять раствор серной кислоты и опустить в него цинк, то можно наблюдать процесс выделения водорода:
Zn+ H2SO4 = ZnSO4 + H2 (30)
Но если в этот же раствор опустить медь, то процесс выделения газа наблюдаться не будет. Реакция не осуществима.
Cu+ H2SO4≠
В случае, если будет взята концентрированная серная кислота, она будет реагировать с медью:
Cu + 2H2SO4 = CuSO4 + SO2 + 2Н2O (31)
В реакции (23) между газами азотом и водородом наблюдается термодинамическое равновесие, т.е. сколько молекул аммиака NН3 образуется в единицу времени, столько же их и распадётся обратно на азот и водород. Смещение химического равновесия можно добиться повышением давления и понижением температуры
N2 + 3Н2 = 2NН3
Если взять раствор гидроксида калия и прилить к нему раствор сульфата натрия, то никаких изменений наблюдаться не будет, реакция будет не осуществима:

КОН + Na2SO4 ≠
Раствор хлорида натрия при взаимодействии с бромом не будет образовывать бром, несмотря на то, что данная реакция может быть отнесена к реакции замещения:
NаCl + Br2≠
В чём же причины таких несоответствий? Дело в том, что оказывается недостаточно только правильно определять формулы соединений, необходимо знать специфику взаимодействия металлов с кислотами, умело пользоваться таблицей растворимости веществ, знать правила замещения в ряду активности металлов и галогенов. В этой статье излагаются только самые основные принципы как расставить коэффициенты в уравнениях реакций, как написать молекулярные уравнения, как определить состав химического соединения.
Химия, как наука, чрезвычайно разнообразна и многогранна. В приведённой статье отражена лишь малая часть процессов, происходящих в реальном мире. Не рассмотрены типы окислительно-восстановительных реакций, термохимические уравнения, электролиз, процессы органического синтеза и многое, многое другое. Но об этом в следующих статьях.
Молодец! Раз ты дочитал это до конца, вероятно, ты все отлично усвоил. Но если вдруг что-то еще непонятно – попробуй онлайн-занятие с репетитором (подробности тут + 🎁).
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
В уроке 12 «Составление уравнений химических реакций» из курса «Химия для чайников» мы научимся составлять уравнения химических реакций и правильно расставлять в них коэффициенты.

Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород → соединение меди с кислородом.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
![]()
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой CuO ставим коэффициент 2:
![]()
Теперь число атомов меди после реакции (в правой части схемы) равно двум, а до реакции (в левой части схемы) — только одному, поэтому перед формулой меди Cu так же поставим коэффициент 2. В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
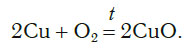
Это уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).
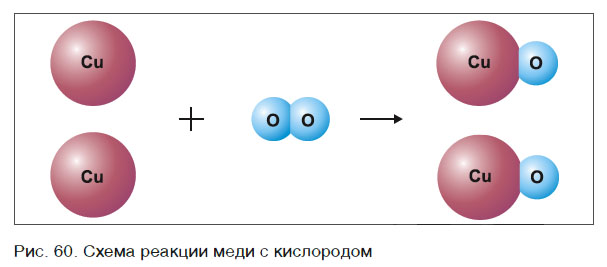
Рассмотрим еще один пример химической реакции между веществами СН4 (метан) и кислородом. Составим схему реакции, в которой слева запишем формулы метана и кислорода, а справа — формулы продуктов реакции — воды и соединения углерода с кислородом (углекислый газ):
![]()
Обратите внимание, что в левой части схемы число атомов углерода равно их числу в правой части. Поэтому уравнивать нужно числа атомов водорода и кислорода. Чтобы уравнять число атомов водорода, поставим перед формулой воды коэффициент 2:
![]()
Теперь число атомов водорода справа стало 2×2=4 и слева — также четыре. Далее посчитаем число атомов кислорода в правой части схемы: два атома кислорода в молекуле углекислого газа (1×2=2) и два атома кислорода в двух молекулах воды (2×1=2), суммарно 2+2=4. В левой части схемы кислорода только два атома в молекуле кислорода. Для того чтобы уравнять число атомов кислорода, поставим коэффициент 2 перед формулой кислорода:
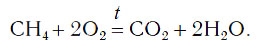
В результате проведенных действий число атомов всех химических элементов до реакции равно их числу после реакции. Уравнение составлено. Читается оно так: це-аш-четыре плюс два о-два равно це-о-два плюс два аш-два-о (рис. 61).
Данный способ расстановки коэффициентов называют методом подбора.
В химии существуют и другие методы уравнивания чисел атомов элементов в левой и правой частях уравнений реакций, с которыми мы познакомимся позднее.
Краткие выводы урока:
Для составления уравнений химических реакций необходимо соблюдать следующий порядок действий.
- Установить состав исходных веществ и продуктов реакции.
- Записать формулы исходных веществ слева, продуктов реакции — справа.
- Между левой и правой частями уравнения сначала поставить стрелку.
- Расставить коэффициенты, т. е. уравнять числа атомов каждого химического элемента до и после реакции.
- Связать левую и правую части уравнения знаком «=» (равно).
Надеюсь урок 12 «Составление уравнений химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Друзья, один из нас читает сейчас курс химии в старшей школе (10-11 кл.) С удивлением было обнаружено, что за два предыдущих года (8-9 кл.) некоторым ученикам не объяснили смысл и правила написания уравнений химических реакций. Они (ученики) уравнения реакций просто не понимают. Вопрос “как это вообще возможно – не объяснить УР” оставим за кадром, поговорим о самих уравнениях.
Смысл уравнения прост: описать, сколько каких веществ вступило в реакцию, и что при этом получилось. Собственно, можно было бы обходиться без уравнений. Можно было бы описывать химическую реакцию обычными словами, русским по белому. Получалось бы примерно так:
Два моля гидроксида натрия взаимодействуют с одним молем серной кислоты, в результате чего получается один моль сульфата натрия и два моля воды.
Удобно? По нашему мнению, не особо. Куда проще так:
2NaOH + H2SO4 = Na2SO4 + 2H2O
Ведь каждое вещество имеет формулу, и намного быстрее написать “NaOH” вместо “гидроксид натрия”. Вдобавок, используя формулы, мы чётко видим, атомы каких элементов задействованы в реакции. И можем их посчитать! Зачем? Потому что должны. Потому что законы сохранения вещества/массы/энергии и т.п. не позволяют никакому атому пропасть “в никуда” или возникнуть “из ниоткуда”. Иными словами: сколько атомов какого-либо элемента было ДО реакции, столько же осталось и ПОСЛЕ. И мы это обязаны показать. Да, они теперь в составе другого вещества, ну и что же? Для верного написания важно лишь их количество. Это всё те же атомы, другим “из ниоткуда” не возникнуть. Уравнение – от слова “равенство”, в том числе – равенство в количестве атомов одинаковых элементов.
Атомы, конечно, очень маленькие частицы. И их, конечно, очень-очень-очень много. Так, в 18 граммах воды H2O (это – примерно одна столовая ложка) содержится около 602000000000000000000000 молекул воды, соответственно – столько же атомов кислорода (число Авогадро, да. 6,02*10^23). Писать в уравнении такие гигантские цифры – ну очень неудобно, согласитесь. Мы их и не пишем. Мы пишем количество молей, помня, что один моль – это как раз 6,02*10^23 атомов (или молекул, или ионов).
Эти цифры мы пишем перед формулой вещества, просто-напросто сравнивая “сколько было” молей таких атомов и “сколько стало”. Т.е. – что в левой части уравнения (до знака равенства), и что – справа. Запишем, для примера, уравнение реакции между гидроксидом натрия и серной кислотой. NaOH + H2SO4 = Na2SO4 + H2O. Здесь слева один моль натрия (единицы мы никогда не пишем, они подразумеваются “по умолчанию”. Т.е. не “Na1O1H1”, а просто – “NaOH”). Справа же, после знака равенства, натрия – два моля. Na2SO4. Значит, не один, а два моля натрия было и в начале, не может же целый моль атомов взяться из ниоткуда! Т.е. мы просто обязаны указать для левой части записи: “два моля натрия”. Как? Пишем цифру 2. Перед формулой! Мы не имеем никакого права вписывать цифры внутри формулы, иначе это получится другое вещество. Если, к примеру, в H2O поменять двойку на любую другую цифру, это уже не будет вещество “вода”, это будет что-то другое и скорее всего ошибочное. По той же самой причине нельзя записать так: “Na2OH”.
Итак, пишем “2” перед гидроксидом натрия: 2NaOH + H2SO4 = Na2SO4 + H2O. Цифра перед формулой вещества действует для всех элементов в этой формуле. Это как общий множитель перед скобкой в математике – действует на всё, что в скобках. Запись “2NaOH” означает два моля атомов натрия, два моля атомов кислорода и два моля атомов водорода. (В растворе это вещество диссоциирует (распадается) не на атомы, конечно, а на ионы Na (+) и OH (-), заряженные частицы. Для уравнения это не имеет никакого значения).
Едем дальше, подсчитываем атомы остальных элементов. Два моля атомов водорода из 2NaOH и ещё два – из H2SO4. В сумме – четыре. А справа, после знака равенства? Всего два, из H2O. Надо, чтобы справа тоже было четыре. Записать H4O вместо H2O – недопустимо, это уже не вода тогда, а невесть что. Можем только перед формулой воды поставить цифру. Какую? Конечно, “2”. Ведь два водорода в H2O уже есть, а с “общим множителем” как раз получится 2 x 2 = 4.
Имеем: 2NaOH + H2SO4 = Na2SO4 + 2H2O. Посчитаем количество молей атомов кислорода: слева 2 в 2NaOH и ещё 4 – в H2SO4. 2 + 4 = 6. Справа 4 в Na2SO4 и ещё 2 в 2H2O. 4 + 2 = 6. Совпало, никаких дополнительных цифр ставить не надо: кислород этого “не требует”. Сера: 1 слева и 1 справа, тоже всё в порядке. То есть, уравнение записано верно. Количество атомов одного и того же элемента слева (до знака равенства) и справа (после знака равенства) одинаковое. Уравняли. Что нам это даёт, кроме чувства глубокого морального удовлетворения от того, что законы Вселенной соблюдены? Это даёт нам возможность вести расчёты по этим уравнениям. Ведь расставленные нами цифры перед формулами (мы называем их “коэффициенты”) показывают соотношение в количествах реагентов и продуктов. Запись “2NaOH + H2SO4 = ” показывает, что 2 моля NaOH реагирует с 1 молем H2SO4. И это соотношение будет выполняться всегда: если гидроксида натрия будет не 2, а 20 молей, то серной кислоты потребуется не 1, а 10 молей. Соответственно, по имеющимся данным для одного вещества всегда получится рассчитать, сколько нужно другого и сколько образуется продуктов реакции. Пример:
Сколько потребуется серной кислоты для реакции с гидроксидом натрия, если того взято 120 граммов, а реакция прошла полностью?
Многие расчётные задачи по химии сводятся к подобной. Чаще всего, в них бывает дополнительный балласт условий, чтобы действий вышло побольше. Могут даваться массовые доли растворов (например, может быть сказано – 120 граммов 20%-го раствора NaOH, и тогда ещё одним действием понадобится перейти к “чистым” веществам). Но про это как-нибудь в другой раз. Любая подобная задача всё равно сводится к “расчётам по молям”. Для этого запишем уравнение реакции и посчитаем, сколько молей NaOH составят 120 граммов.
2NaOH + H2SO4 = Na2SO4 + 2H2O. Молярная масса NaOH считается при помощи таблицы Менделеева (складываются атомные массы всех элементов: у натрия – 23, у кислорода – 16 и у водорода – 1). M (NaOH) = 23 + 16 + 1 = 40 г/моль. По условию у нас есть 120 граммов NaOH, соответственно, это 3 моля (масса m, молярная масса M и количество вещества n связаны формулой m = Mn откуда следует n = m/M). Теперь к уравнению: мы своими руками записали 2 перед NaOH. Это означает, что 2 моля гидроксида натрия будут реагировать с 1 молем серной кислоты. Но у нас 3 моля гидроксида натрия! Очевидно, если двум молям NaOH нужен один моль H2SO4, то трём молям NaOH понадобится 1,5 моля H2SO4. Это, вообще-то, решается пропорцией:
Но в случае таких простых чисел – всё легко считается и в уме. 1,5 моля серной кислоты надо “перевести” в граммы, через молярную массу H2SO4 (считается по таблице Менделеева и получается 98 г/моль). m = Mn, m (H2SO4) = 98 г/моль x 1,5 моля = 147 граммов. Это и будет ответом, который получен на основе верно записанного уравнения химической реакции. Вот для чего нужны уравнения: для расчётов.
Множество уравнений реакций, которые попадаются в школьной программе, можно уравнять простым подбором нужных коэффициентов. Что называется, “на пальцах” посчитать. Но иногда это бывает непросто, неочевидно. Хотите – напишем несколько “лайфхаков” для таких случаев? Вообще, мы бы хотели получить “обратную связь”: нужно ли время от времени делать лонгриды по “школьным” темам? Что скажете, друзья?
Составление уравнений химических реакций
Урок посвящен изучению алгоритма составления уравнения химической реакции. В ходе урока вы научитесь составлять схему и уравнение химической реакции, зная формулы исходных веществ и продуктов реакции.
I. Схема химической реакции
Сущность химической реакции с позиции атомно-молекулярной теории заключается в том, что продукты реакции образуются из тех же атомов, которые входили в состав исходных веществ.
Пример 1. При разложении воды образуются простые вещества – водород и кислород (Рис.1.).

Рис. 1. Разложение воды под действие электрического тока
Запишем формулу исходного вещества воды слева, а формулы продуктов реакции – водорода и кислорода – справа. Между ними поставим стрелку:
Н2О → Н2 + О2
Эта запись является схемой реакции.
Схема реакции показывает только состав исходных веществ и продуктов реакции, но не может полностью отражать сущность реакции. В состав молекулы воды входит один атом кислорода, а в состав простого вещества кислорода входят два атома. Это значит, что не выполняется закон сохранения массы веществ.
II. Химические уравнения реакций
Химическое уравнение – это условная запись химической реакции посредством химических формул и коэффициентов.
Видео – эксперимент: “Нагревание смеси железа и серы”
В результате химического взаимодействия серы и железа получено вещество – сульфид железа (II) – оно отличается от исходной смеси. Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно их разделить и с помощью магнита. Произошло химическое превращение.
Исходные вещества, принимающие участие в химических реакциях называются реагентами.
Новые вещества, образующиеся в результате химической реакции называются продуктами.
Запишем протекающую реакцию в виде уравнения химической реакции:
Fe + S = FeS
Рассмотрим еще один пример: 2Н2О = 2Н2 + О2
Чтобы не было противоречий с законом сохранения массы веществ, нужно уравнять число атомов каждого химического элемента слева и справа от стрелки.
Чтобы образовалась одна молекула кислорода, в реакцию должны вступить две молекулы воды. Поставив коэффициент «2» перед формулой воды. Теперь уравняем количество атомов водорода, поставив коэффициент «2» перед формулой Н2, вместо стрелки поставим знак равенства:
Эта запись является уравнением химической реакции. В отличие от схемы реакции, уравнение учитывает, что число атомов каждого химического элемента в реакции не меняется.
Цифры, стоящие перед формулой вещества, называются коэффициентами. Коэффициент показывает количество молекул вещества.
Прочитать записанное уравнение можно так: «Из двух молекул воды образуется две молекулы водорода и 1 молекула кислорода».
III. Алгоритм составления уравнения химической реакции
|
Составим уравнение химической реакции взаимодействия фосфора и кислорода |
|
1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H2; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку: P + O2 → |
|
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов: P + O2 → P2O5 |
|
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
4P + 5O2 = 2P2O5 |
IV. Работа с тренажерами
V. Задания для закрепления
Задание №1
Преобразуйте следующие схемы в уравнения химических реакций расставив необходимые коэффициенты и заменив стрелки на знак равенства:
Zn + O2 → ZnO
Fe + Cl2→ FeCl3
Mg + HCl → MgCl2 + H2
Al(OH)3 → Al2O3 + H2O
HNO3→ H2O+NO2+O2
CaO+H2O→ Ca(OH)2
H2+Cl2→ HCl
KClO3→ KClO4+KCl
Fe(OH)2+H2O+O2→ Fe(OH)3
KBr+Cl2→ KCl+Br2
Задание №2
Используя алгоритм составления уравнений химических реакций, составьте уравнения реакций взаимодействия между следующими парами веществ:
1) Na и O2
2) Na и Cl2
3) Al и S



