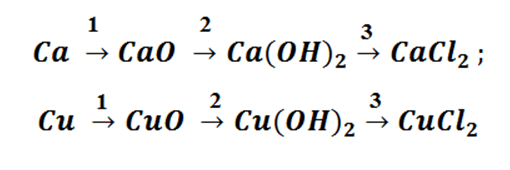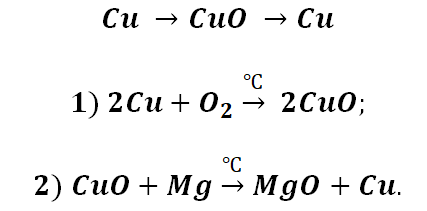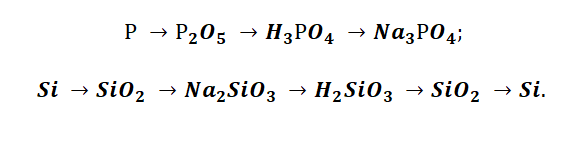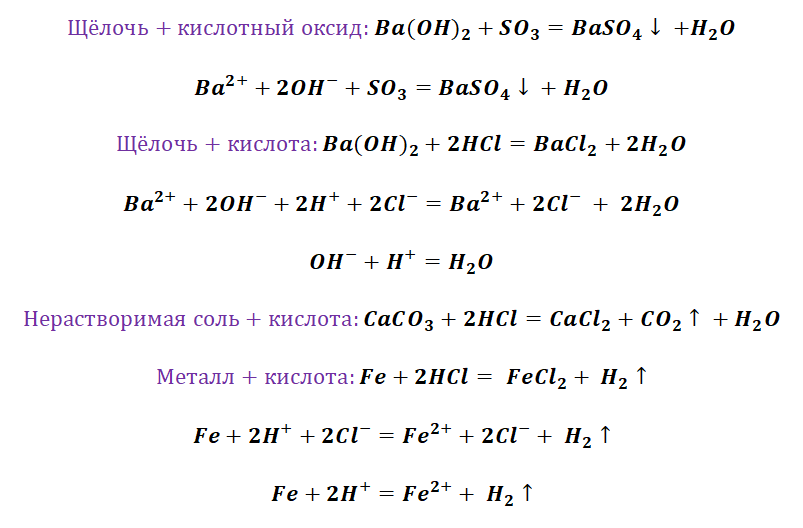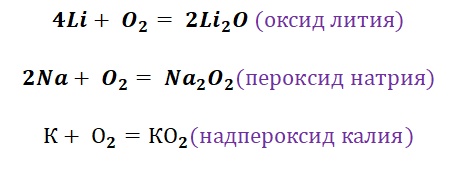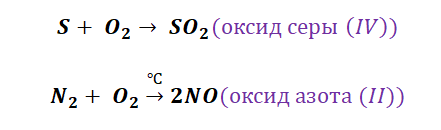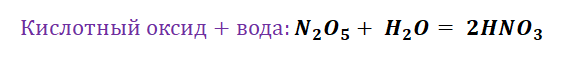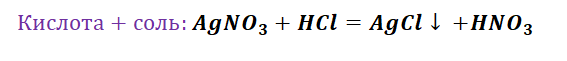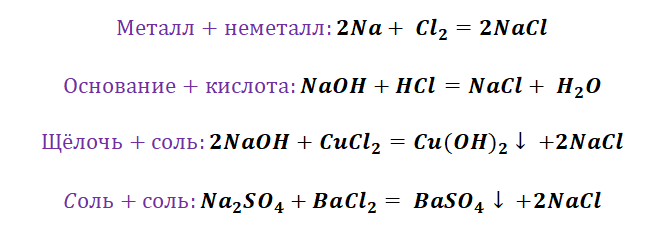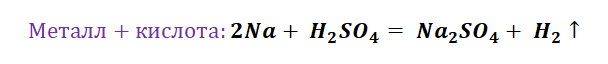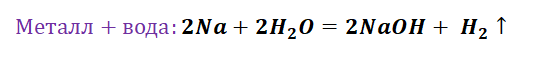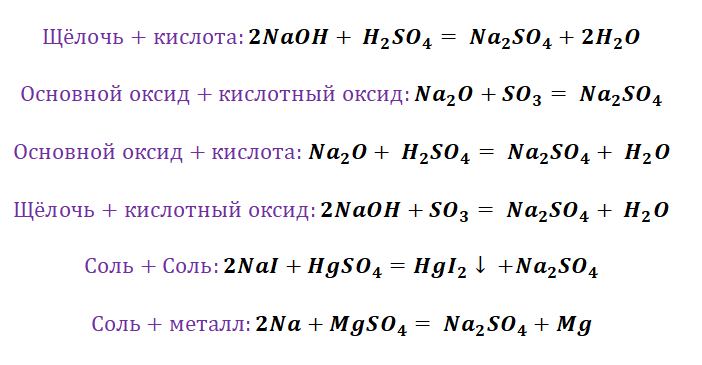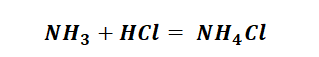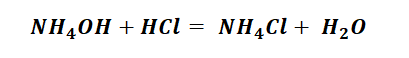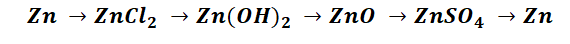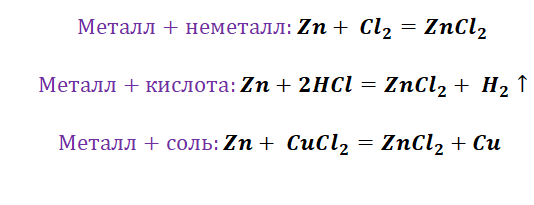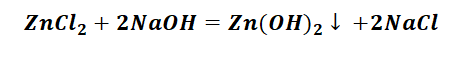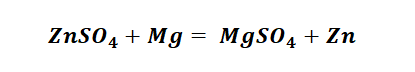Содержание
- Урок №48. Химические свойства металлов. Ряд активности (электрохимический ряд) металлов
- Алгоритм решения «цепочек превращений» веществ. Инструкция для учащихся 8 класса
- Онлайн-конференция
- «Современная профориентация педагогов и родителей, перспективы рынка труда и особенности личности подростка»
- Свидетельство и скидка на обучение каждому участнику
- Дистанционное обучение как современный формат преподавания
- Методическая работа в онлайн-образовании
- Современные педтехнологии в деятельности учителя
- Оставьте свой комментарий
- Подарочные сертификаты
- Генетические цепочки металлы I. II. III группы главной подгруппы.
- Онлайн-конференция
- «Современная профориентация педагогов и родителей, перспективы рынка труда и особенности личности подростка»
- Свидетельство и скидка на обучение каждому участнику
- Дистанционное обучение как современный формат преподавания
- Методическая работа в онлайн-образовании
- Современные педтехнологии в деятельности учителя
- Оставьте свой комментарий
- Подарочные сертификаты
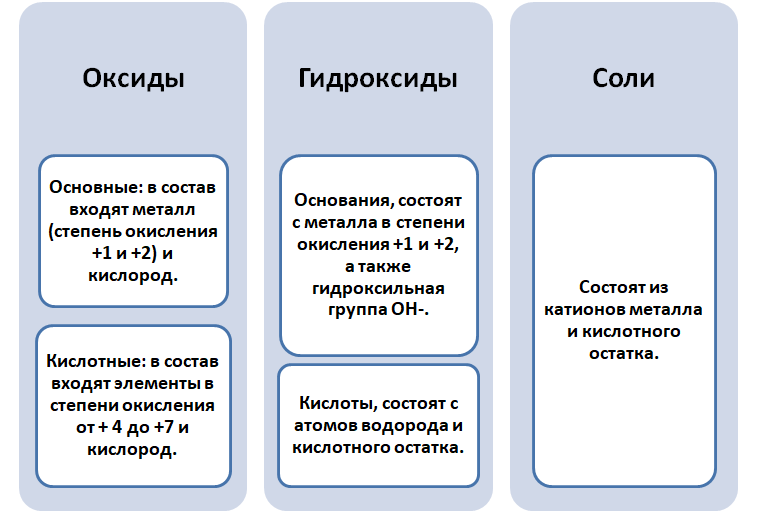
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Химические свойства металлов определяются их активностью. Простые вещества – металлы в химических реакциях всегда являются восстановителями . Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются восстановительные свойства).
Среди металлов традиционно выделяют несколько групп.
Входящие в их состав представители характеризуются отличной от других металлов химической активностью. Такими группами являются:
благородные металлы (серебро, золото, платина, иридий);
щелочные металлы – I(A) группа ;
щелочноземельные металлы – II(A) группа , кроме Be, Mg.
Металлы встпают в реакции с простыми веществами – неметаллами (кислород, галогены, сера, азот, фосфор и др.) и сложными веществами (вода, кислоты, растворы солей)
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды:
4Li + O 2 = обыч. усл . = 2Li 2 O
2Mg + O 2 = t, °C = 2MgO
Серебро, золото и платина с кислородом не реагируют
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и йодом), образуя галогениды – Ме +n Г -1 n
2Na + Cl 2 = 2NaCl
2Al + 3Cl 2 = 2AlCl 3
3. Металлы взаимодействуют с серой, образуя сульфиды.
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
3Ca + N 2 = t, °C = Ca 3 N 2
3Na + P = t, °C = Na 3 P
Взаимодействие со сложными веществами
I. Взаимодействие воды с металлами
1). Взаимодействие с самыми активными металлами, находящимися в периодической системе в I(А) и II(А) группах (щелочные и щелочноземельные металлы) и алюминий . В результате образуются основание и газ водород .
Me + H 2 O = Me(OH) n + H 2 (р. замещения)
Внимание! Алюминий и магний ведут себя также:
2Al + 6H 2 O = 2Al(OH) 3 +3H 2
Магний (в горячей воде):
Mg + 2H 2 O = t°C = Mg(OH) 2 +H 2
2) Взаимодействие с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.
Металлы средней активности, стоящие в ряду активности до (Н 2 ) – Be, Fe, Pb, Cr, Ni, Mn, Zn – реагируют с образованием оксида металла и водорода
Me + Н 2 О = Ме х О у + Н 2 (р. замещения)
Бериллий с водой образует амфотерный оксид:
Be + H 2 O = t°C = BeO + H 2
Раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe 3 O 4 и водород:
3Fe + 4H 2 O = t°C = FeO‧Fe 2 O 3 + 4H 2
3) Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Cu + H 2 O ≠ нет реакции
II. Взаимодействие растворов кислот с металлами
Металлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот ( раствор азотной кислоты – исключение ), образуя соль и водород.
Кислота (раствор) + Me до (Н2) = Соль + H 2 ↑
Zn + H 2 SO 4 = ZnSO 4 + H 2 ↑
III. Взаимодействие кислот-окислителей с металлами
Металлы особо реагируют с серной концентрированной и азотной кислотами:
H 2 SO 4 (конц.) + Me = Сульфат + H 2 O + Х
2H 2 SO 4 (конц.) + Cu = t°C = CuSO 4 + 2H 2 O + SO 2 ↑
8Na 0 + 5H 2 +6 SO 4 = 4Na 2 +1 SO 4 + H 2 S -2 ↑ + 4H 2 O
HNO 3 + Me = Нитрат + H 2 O + Х
4HNO 3 (k) + Cu = Cu(NO 3 ) 2 + 4H 2 O + 2NO 2 ↑
8HNO 3 (p) + 3Cu = 3Cu(NO 3 ) 2 + 4H 2 O + 2NO↑
4Zn + 10HNO 3 (раствор горячий) = t˚C = 4Zn(NO 3 ) 2 + N 2 O + 5H 2 O
4Zn + 10HNO 3 (оч. разб. горячий) = t˚C = 4Zn(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O
Zn + 4HNO 3 (конц. горячий) = t˚C = Zn(NO 3 ) 2 + 2NO 2 + 2H 2 O
IV. С растворами солей менее активных металлов
Ме + Соль = Новый металл + Новая соль
Fe + CuCl 2 = FeCl 2 + Cu
Активность металла в реакциях с кислотами, водными растворами солей и др. можно определить, используя электрохимический ряд, предложенный в 1865 г русским учёным Н. Н. Бекетовым: от калия к золоту восстановительная способность (способность отдавать электроны) уменьшается, все металлы, стоящие в ряду левее водорода, могут вытеснять его из растворов кислот; медь, серебро, ртуть, платина, золото, расположенные правее, не вытесняют водород.
Источник
Алгоритм решения «цепочек превращений» веществ. Инструкция для учащихся 8 класса
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних веществ в другие, которые характеризуют генетическую связь между основными классами органических и неорганических соединений.
Схему превращения одних веществ в другие называют «цепочкой превращений » .
Для выполнения этих заданий необходимо знать основные классы соединений, их номенклатуру, химические свойства, механизм осуществления реакций.
Алгоритм решения «цепочки превращений»
1 шаг. Перепишите цепочку, которую необходимо решить
2 шаг. Пронумеруйте количество реакций для удобства решения
Таким образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг. Запишем 1 уравнение реакции – из кальция (С a ) надо получить оксид кальция ( CaO ). Вспомним, что данное превращение происходит, когда металлы окисляются на воздухе, вступая в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте уравнивать реакции!
2 С a + O 2 2Ca +2 O -2
4 шаг. Осуществляем второе превращение. Из оксида кальция ( CaO ) нужно получить гидроксид кальция ( Ca ( OH ) 2 ). Это уравнение возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в итоге получается щелочь – растворимое в воде основание). Записываем уравнение и уравниваем его.
2) 2 Ca +2 O -2 + H 2 O → Ca 2+ ( OH ) 2 —
5 шаг . Осуществляем 3 превращение. Из гидроксида кальция ( Ca ( OH ) 2 ) необходимо получить соль – фосфат кальция ( Ca 3 ( PO 4 ) 2 ). Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода. Значит, для этой реакции подойдет фосфорная кислота – H 3 PO 4 , так как именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.

Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 1038 человек из 81 региона

Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
- Сейчас обучается 64 человека из 27 регионов

Курс повышения квалификации
Современные педтехнологии в деятельности учителя
- Курс добавлен 23.09.2021
- Сейчас обучается 93 человека из 43 регионов
Ищем педагогов в команду «Инфоурок»

Номер материала: ДБ-1162271
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.

Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута

Во Франции планируют ввести уголовное наказание за буллинг в школе
Время чтения: 1 минута

Госдума приняла закон об использовании онлайн-ресурсов в школах
Время чтения: 2 минуты

Более 50 российских школ перешли на дистанционку из-за коронавируса
Время чтения: 1 минута

Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута

Трехлетнюю олимпиаду среди школ запустят в России в 2022 году
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Источник
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Карточка № 1. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Mg → MgO → MgCO 3 → Mg ( OH ) 2 → Mg ( NO 3 ) 2 → MgO
Карточка № 2. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Ca → CaO → Ca ( OH ) 2 → CaSO 4 → BaSO 4
Карточка № 3. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 4. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 5. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 6. 9 класс.
Генетическая связь между классами соединений.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 7. 9 класс.
Генетическая связь между классами соединений.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 8. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Li 3 PO 4 ← LiOH ← Li → Li 2 O → LiOH → LiCl
Карточка № 9. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Mg → MgS → MgO → MgCO 3 → Mg ( OH ) 2 → Mg ( NO 3 ) 2
Карточка № 10. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 11. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
MgS → MgO → MgSO 3 → Mg ( OH ) 2 → Mg ( NO 3 ) 2 → MgO
Карточка № 12. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 13. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
CaO → CaSO 4 → Ca ( OH ) 2 → CaS → CaO → CaBr 2
Карточка № 14. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
MgO → MgSO 4 → Mg ( OH ) 2 → MgO → Mg → MgS
Карточка № 15. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Ba → BaS → BaO → Ba ( OH ) 2 → BaCl 2 → BaSO 4
Карточка № 16. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Ca → CaSO 4 → Ca ( OH ) 2 → CaO → CaS → CaO
Карточка № 17. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
MgO → MgSO 4 → Mg ( OH ) 2 → MgO → Mg → Mg 3 N 2
Карточка № 18. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Ba → BaS → BaO → Ba ( OH ) 2 → BaCl 2 → BaSO 4
Карточка № 19. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 20 . 9 класс.
Генетическая связь между классами соединений.
Напишите реакции, с помощью которых можно осуществить превращения.
Карточка № 21 . 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Li 3 PO 4 ← LiOH ← Li → Li 2 O → LiCl → Li → LiBr

Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 1038 человек из 81 региона

Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
- Сейчас обучается 64 человека из 27 регионов

Курс повышения квалификации
Современные педтехнологии в деятельности учителя
- Курс добавлен 23.09.2021
- Сейчас обучается 93 человека из 43 регионов
Ищем педагогов в команду «Инфоурок»

Номер материала: ДБ-555471
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.

Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута

Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута

В МГПУ сформулировали новые принципы повышения квалификации
Время чтения: 4 минуты

Минпросвещения намерено расширить программу ускоренного обучения рабочим профессиям
Время чтения: 2 минуты

Госдума приняла закон об использовании онлайн-ресурсов в школах
Время чтения: 2 минуты

Для школьников к 1 сентября разработают короткие экскурсионные маршруты
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Источник
План урока:
Почему связь между классами веществ считается генетической
Родственные связи между металлами и неметаллами
Взаимопревращения между классами веществ
Почему связь между классами веществ считается генетической
Чтобы разобраться в этом вопросе. Вспомним состав классов веществ, с которыми Вы познакомились на предыдущих занятиях.
Обратите внимание, что соли содержат в себе частицы как оснований (атомы металла), так и кислот (кислотных остатков). Если соль рассматривать как «венец» превращений, то давайте, попытаемся прийти к истокам. Всё начинается с простого, точнее металла и неметалла, как простых веществ.
Попробуем построить генетический ряд металлов, переходя от одного класса к другому.
Возьмём, к примеру, металлы кальций и медь, подставив их в цепочку уравнений.
Обратите внимание, что данные металлы отличаются своей реакционной способностью.
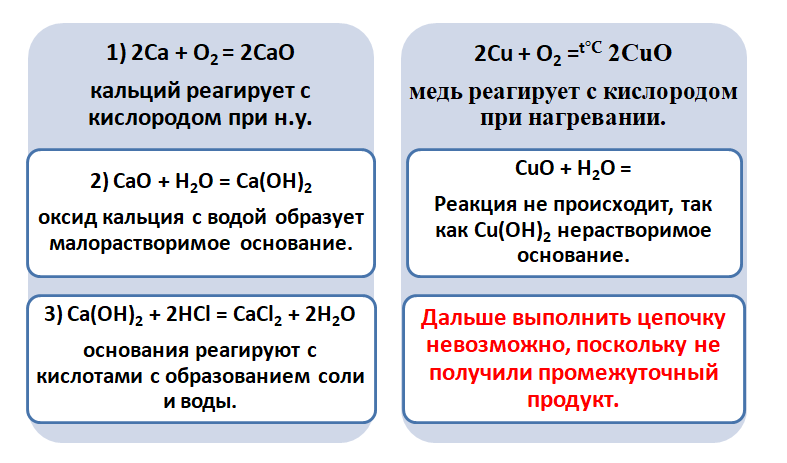
Получается, эта генетическая связь соединений присуща только для активных металлов, оксиды которых, реагируя с водой, дают продукт в виде щёлочи.
Для металлов, которые отличаются малой активностью, переход от вещества, находящегося в простом состоянии, к соли, происходит путём превращений.
Поскольку основные оксиды реагируют с металлами (более активными, чем металлы, которые входят в состав оксида), то эту схему можно сократить.
Аналогичным способом можно составить генетический ряд неметаллов, начиная от неметалла заканчивая солью или неметаллом.
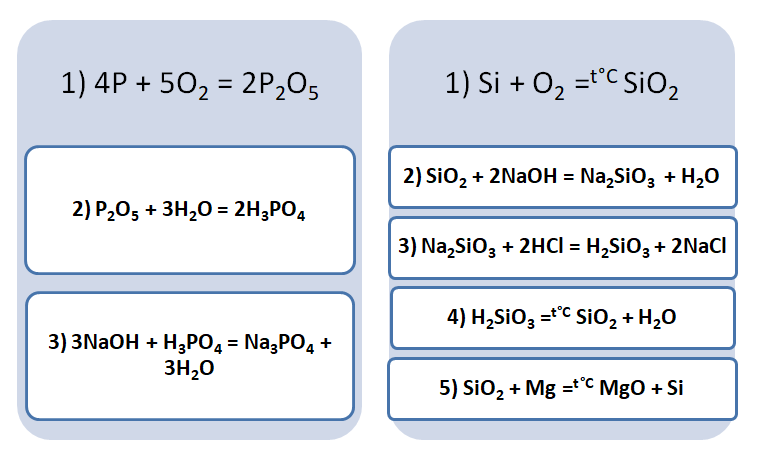
Подставим в цепочку уравнений фосфор и кремний.
А возможны иные пути решения данных цепочек уравнений. Способы получения кислотных оксидов реализуются путём взаимодействия простых веществ с кислородом. А вот не с каждого оксида можно получить ему соответствующую кислоту, путём прибавления воды. Поскольку кремниевая кислота нерастворима в воде, то необходимо получить сначала соль, а потом уже и кислоту.
В данном решении предлагается добыть соль Na3PO4, взаимодействием основания и кислоты. Однако можно использовать и другие варианты, которые также будут верны.
Если объединить генетические ряды металлов и неметаллов, получим дружную семью неорганических соединений, где каждое вещество связано неразрывной нитью с другими классами. Таблица 1.
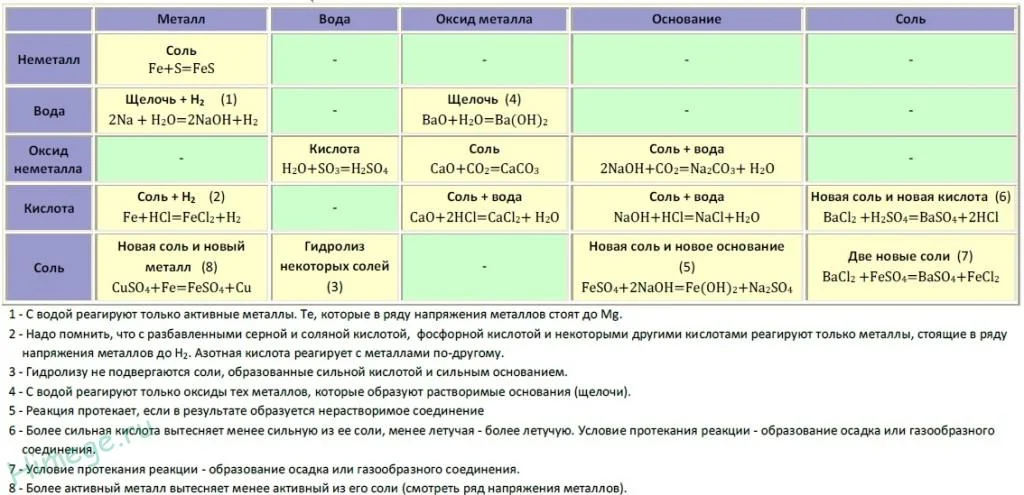
Источник
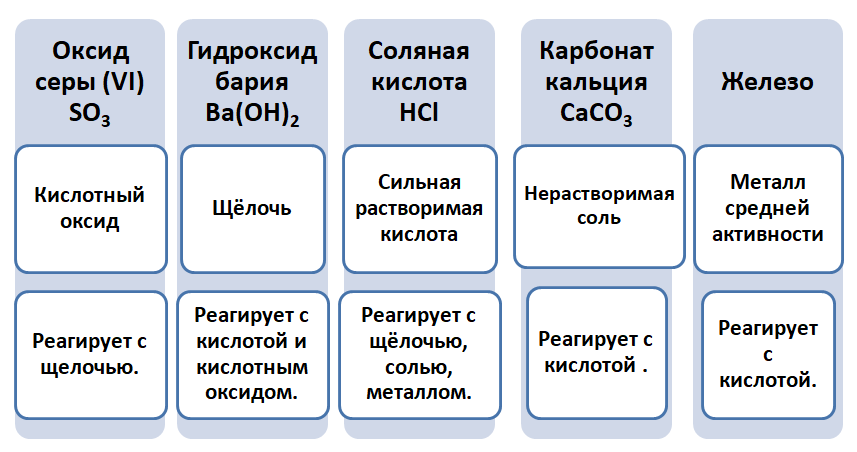
Данная таблица отображает, как реагируют между собой вещества и какие продукты возможны, вследствие реакции.
Промоделируем на примере: В вашем распоряжении имеются следующие вещества: оксид серы (VI), гидроксид бария, соляная кислота, карбонат кальция и железо. Ваша задача спрогнозировать, между какими соединениями возможна реакция и, записать, соответствующие уравнения реакций.
Подтвердив свои прогнозы молекулярно-ионными уравнениями в сокращённом и полном виде.
Родственные связи между металлами и неметаллами
Кислород является типичным представителем неметаллов. Он является достаточно сильным окислителем, перед которым может устоять только фтор. Получение основных оксидов происходит путём взаимодействия кислорода и металлов. Однако не все металлы охотно с ним реагируют. Щелочные реагируют бурно, именно поэтому их хранение осуществляется под слоем керосина. Необходимо заметить, что щелочные металлы не образуют оксиды во время взаимодействия с О2. Их чрезвычайная активность позволяет получать только для их характерные продукты, это будут пероксиды и надпероксиды (за исключением лития, продукт Li2O).
А вот, чтобы менее активные металлы – железо или медь прореагировали, необходимо нагревание.
Получение кислотных оксидов происходит аналогично взаимодействием неметаллов с О2.
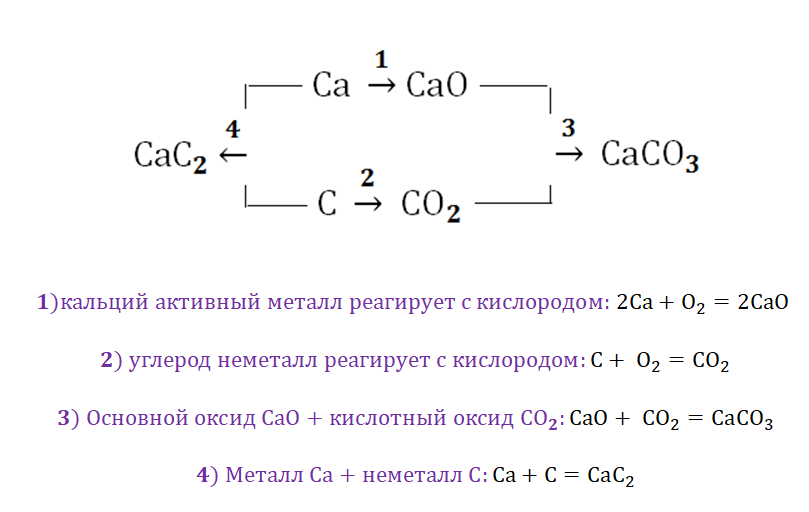
Металлы и неметаллы в химии рассматриваются как противоположности, которые, как заряды (положительные и отрицательные) имеют свойства притягиваться. Рассмотрим на примере металла кальций и неметалла углерод.
Соль СаСО3 имеет истоки от простых веществ Са и С, промежуточным звеном являются оксиды этих веществ, для которых свойственно реагировать между собой.
Вспомним с Вами один с основных постулатов химии, а именно, закон постоянства состава вещества.

Источник
Представим, что мы с Вами химики-первооткрыватели и нам предстоит сложная задача получить азотную кислоту, которая имеет важную роль в химической промышленности. Получение кислот возможно несколькими способами. Обращаясь к таблице 1, делаем вывод, что нам доступно несколько способов, а именно.
Взаимодействие кислот с солями приведёт нас к желаемому результату, однако не забывайте, что в продукте должны увидеть газ, осадок либо окрашивание.
Способы получения средних солей доказательно показывают связь между веществами. Снова выручалочкой нам послужит таблица 1. Наша задача получить вещество, без которого, полагаем, Вы не представляете своё существование, это соль NaCl. Используя данные, видим, что доступно для её получения 4 способа (Вы ищете, где продуктом является соль и применяете данные на свой пример).
Рассмотрим подробно каждый с них.
Способы получения солей отличаются, причиной этому является то, какую именно соль мы хотим получить, кислородсодержащей,сильной или слабой кислоты. К примеру, получение Na2SO4 будет отличаться от предыдущего примера с NaCl. Количество способов будет больше, так как это соль кислородсодержащей кислоты.
Здесь следуют отметить особенность щелочных, а также щелочно-земельных металлов, для которых свойственно взаимодействие с водой. По сути, идёт два параллельных процесса.
Полученная щёлочь реагирует с кислотой.
Способы получения солей аммония несколько отличаются, от солей металлов, тем, что аммиак непосредственно реагирует с кислотами (смотри урок химическая связь) с образованием донорно-акцепторных связей.
Гидроксид аммония имеет способность взаимодействовать с кислотами, с образованием необходимого продукта, не иначе как солей аммония.
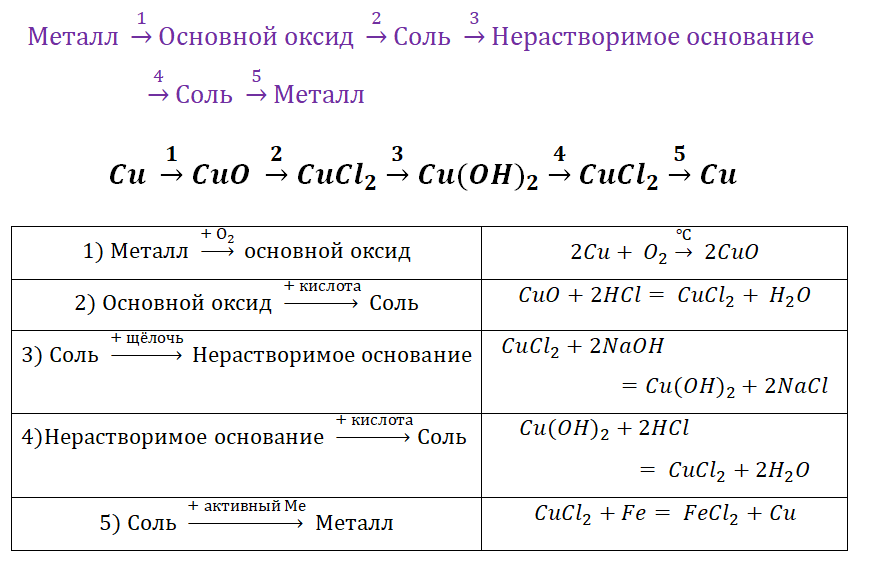
Наверняка некоторые из Вас пугал вид заданий, который был цепочек уравнений. Обобщая всё выше сказанное, рассмотрим несколько примеров.
Пример 1.
Чтобы справится с данной задачей, проанализируем условие. Первое, что необходимо выделить – это количество уравнений (смотрим по стрелочкам, их 5). Второе определим исходное вещество – цинк, металл средней силы. Чтобы получить с него соль (не забываем о таблице 1), можно использовать 3 способа:
Выбор за Вами, одного из трёх уравнений. Переходим к следующей части цепочки ZnCl2 → Zn(OH)2. Здесь решением будет один вариант, это прибавление щёлочи.
Zn(OH)2 относится к нерастворимым основанием, поэтому при нагревании распадаются.
И наконец, итоговый продукт, металл. Его необходимо выделить из соли. Для этого необходимо взять металл, сила которого будет больше. Если эту информацию забыли, то освежить эти данные сможете с помощью урока Соли и их свойства.
Решение цепочек химических уравнений на первый взгляд кажется не посильной задачей, но если внимательно изучить свойства веществ, то они кажутся не такими уж и сложными.
Взаимопревращение между классами веществ
Обобщая сведения о свойствах неорганических соединений, составим схему 1. Взаимосвязь между классами неорганических веществ.
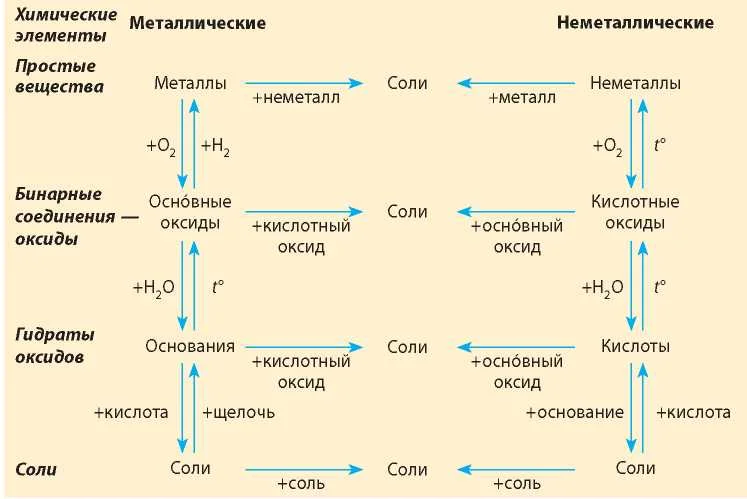
Источник
Эта схема и таблица 1 будут служить Вам волшебной палочкой в изучении неорганической химии.
При изучении генетических рядов, после изучения материала, удобно предложить каждому обучающемуся цепочку превращения. Хорошо, когда выбор материала достаточно велик. В данном материале представлено двадцать восемь цепочек превращения. Их можно использовать, как на уроках в 8 классах, так и в 9, 11.Цепочки металлов (8-9 класс, химия)
1. Осуществите превращения:
Mg MgO MgCl2 Mg(OH)2 MgSO4
Любые два уравнения напишите в полном и сокращенном ионном виде.
Вариант 1.
1. Осуществите превращения:
Li Li2O LiOH LiCl2 LiNO3
Любые два уравнения напишите в полном и сокращенном ионном виде.
Вариант 2.
1. Осуществите превращения:
Na Na2O NaOH Na2CO3 NaBr
Любые два уравнения напишите в полном и сокращенном ионном виде.
Вариант 3.
1. Осуществите превращения:
Ca CaО Ca(OH)2 CaCO3 CaCl2
Любые два уравнения напишите в полном и сокращенном ионном виде.
Вариант 4.
1. Осуществите превращения:
Al Al2O3 Al(NO3)3 Al(OH)3 Al2O3
Любые два уравнения напишите в полном и сокращенном ионном виде.
Вариант 5.
1. Осуществите превращения:
Fe Fe2O3 FeCl3 Fe(OH)3 Fe(NO3)3
Любые два уравнения напишите в полном и сокращенном ионном виде.
Вариант 6.
1. Осуществите превращения:
Zn ZnO Zn(NO3)2 Zn(OH)2 ZnO
Любые два уравнения напишите в полном и сокращенном ионном виде.
Вариант 7.
1. Осуществите превращения:
Cu CuO CuCl2 Cu(OH)2 CuO
Любые два уравнения напишите в полном и сокращенном ионном виде.
Вариант 8.
1. Осуществите превращения:
Fe FeO FeCl2 Fe(OH)2 FeO
Любые два уравнения напишите в полном и сокращенном ионном виде.
Вариант 9.
Вариант 10 1. Осуществите превращения:
Cr Cr2O3 CrCl3 Cr(OH)3 Cr2O3
Любые два уравнения напишите в полном и сокращенном ионном виде.
1. Осуществите превращения:
Zn ZnO ZnCl2 Zn(OH)2 ZnO
Любые два уравнения напишите в полном и сокращенном ионном виде.
Вариант 11
1. Осуществите превращения:
Mg MgCl2 Mg(OH)2 MgSO4 MgCl2
Любые два уравнения напишите в полном и сокращенном ионном виде.
Вариант 12
1. Осуществите превращения:
Ca CaO Ca(OH)2 CaCO3 CaO
Любые два уравнения напишите в полном и сокращенном ионном виде.
Вариант 13
1. Осуществите превращения:
MnO2 Mn MnSO4 Mn(OH)2 MnCl2
Любые два уравнения напишите в полном и сокращенном ионном виде.
Вариант 14
1. Осуществите превращения:
Ba BaO Ba(OH)2 BaCO3 BaCl2
Любые два уравнения напишите в полном и сокращенном ионном виде.
Вариант 15
1. Осуществите превращения:
Zn ZnO ZnCl2 Zn(OH)2 Zn(NO3)2
Любые два уравнения напишите в полном и сокращенном ионном виде.
Вариант 16
Вариант 17
1. Осуществите превращения:
Fe FeSO4 Fe(OH)2 FeO FeCl2
Любые два уравнения напишите в полном и сокращенном ионном виде.
1. Осуществите превращения:
Cu CuO Cu(NO3) 2 Cu(OH)2 CuO
Любые два уравнения напишите в полном и сокращенном ионном виде.
Вариант 18
1. Осуществите превращения:
Fe FeO FeCl2 Fe(OH)2 FeSO4
Вариант 19 Любые два уравнения напишите в полном и сокращенном ионном виде.
1. Осуществите превращения:
Mg MgO MgSO4 Mg(OH)2 MgCl2
Любые два уравнения напишите в полном и сокращенном ионном виде.
Вариант 28.
Цепочки металлов (8-9 класс, химия)

Цепочки металлов (8-9 класс, химия)

Цепочки металлов (8-9 класс, химия)

Материалы на данной страницы взяты из открытых истончиков либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.
Введите ваш emailВаш email
Составить и решить 2 цепочки превращений по металлам и неметаллам (каждая цепочка должна иметь не менее 4 уравнений ; среди них должны быть ОВР и ионные реакции).
На этой странице находится вопрос Составить и решить 2 цепочки превращений по металлам и неметаллам (каждая цепочка должна иметь не менее 4 уравнений ; среди них должны быть ОВР и ионные реакции)?, относящийся к категории
Химия. По уровню сложности данный вопрос соответствует знаниям
учащихся 5 – 9 классов. Здесь вы найдете правильный ответ, сможете
обсудить и сверить свой вариант ответа с мнениями пользователями сайта. С
помощью автоматического поиска на этой же странице можно найти похожие
вопросы и ответы на них в категории Химия. Если ответы вызывают
сомнение, сформулируйте вопрос иначе. Для этого нажмите кнопку вверху.
Практическая работа.
«Осуществление цепочки хим. превращений металлов. Решение экспериментальных задач на распознавание и получение веществ».
Цель урока: образовательная: продолжить формировать умения:
- составлять технологическую карту;
- применять теоретические знания о металлах и их соединениях при выполнении химического эксперимента;
- проводить химический эксперимент, соблюдая правила ТБ, записывать уравнения химических реакций;
- работать с реактивами, химической посудой простейшими приборами;
продолжить формировать ОУУН:
- самостоятельно организовывать учебную деятельность, работать в группе;
- наблюдать, делать выводы, подводить итоги проделанной экспериментальной работы, оформлять технологическую карту по результатам эксперимента;
Оборудование урока
- Реактивы и оборудование для проведения практической работы.
- Технологические карты, инструкционные карты, проектор, компьютер, слайд презентация.
Ход урока.
1. Орг. момент.
Актуализация познавательной деятельности.
Активизация мыслительной деятельности.
2. Постановка целей и задач урока.
Провести химический эксперимент по теме: «Металлы и их соединения».
Показать умения:
- Соблюдать правила ТБ при выполнении эксперимента;
- Работать в группе, следя и помогая организовать работу всех членов группы;
- Применять теоретические знания при выполнении химического эксперимента.
3. Установка на достижение цели.
Достигнуть поставленную цель вам поможет алгоритм работы, алгоритм вы увидите и на инструкционной карте (слайд №2).
Для успешного выполнения практической работы повторим признаки химических реакций (слайды №3-4).
Успешно провести и описать эксперимент вам поможет памятка «Учимся наблюдать» (слайд №5).
Провести химический эксперимент вы должны, соблюдая правила по ТБ, вспомним их (слайд №6).
Результаты практической работы вносим в технологическую карту (слайд №7). Испытывая затруднения обращайтесь к «Скорой химической помощи»..
4. ПРАКТИЧЕСКИЙ БЛОК.
Учитель является консультантом.
ПРАКТИЧЕСКАЯ РАБОТА № 1
«Осуществление цепочки хим. превращений металлов. Решение экспериментальных задач на распознавание и получение веществ».
Алгоритм работы:
- Запишите в тетрадях:
Практическая работа №
Тема: « ».
Цель работы:
- Повторите правила техники безопасности.
- Изучите инструкцию.
- Выполните эксперимент, соблюдая правила ТБ.
- Оформите технологическую карту.
- Оцените успешность выполненной работы.
Опыт 1.
Осуществите цепочку превращений:
CuSO4 →Cu(OH)2 →CuO → Cu
Результаты опыта занесите в технологическую карту.
|
Ход эксперимента |
Наблюдения |
Выводы и уравнения реакций |
|
Опыт 2.
В трех пробирках (1, 2, 3) даны растворы: хлорид натрия (NaCl), хлорид алюминия (AlCl3), хлорид железа (III) (FeCl3) Опытным путем определите, какие вещества находятся в каждой из пробирок. Составьте уравнения соответствующих реакций в молекулярном и ионном виде*.
Результаты опыта занесите в технологическую карту.
|
Ход эксперимента |
Наблюдения |
Выводы и уравнения реакций |
|
Опыт 3.
Получите оксид железа (III) (Fe2O3), исходя из хлорида железа (III) (FeCl3)
Результаты опыта занесите в технологическую карту.
|
Ход эксперимента |
Наблюдения |
Выводы и уравнения реакций |
|
Я успел(а) выполнить работу! Я молодчина! Я хорошо подготовился к уроку!