Загрузить PDF
Загрузить PDF
Изображение точечных структур Льюиса (также известных как структуры Льюиса или диаграммы Льюиса) может показаться сложной задачей, особенно для тех, кто только начинает изучать химию. Однако эти структуры помогают понять конфигурацию связей и валентных электронов в различных атомах и молекулах. Сложность схемы зависит от того, изображаете ли вы точечную структуру Льюиса для двухатомной ковалентной молекулы, более сложной ковалентной молекулы или молекул с ионной связью.
-
1
Запишите символ каждого элемента. Напишите рядом символы двух атомов. Таким образом вы представите атомы, соединенные ковалентной связью. Оставьте достаточно места между символами, чтобы обозначить электроны и связи.[1]
- При ковалентной связи электроны делятся между двумя атомами. Обычно ковалентные связи возникают между двумя неметаллическими элементами.
-
2
Определите кратность связи между двумя атомами. Атомы могут быть связаны одинарной, двойной или тройной связью. Обычно это определяется правилом октетов, или «стремлением» каждого атома заполнить свою валентную оболочку 8 электронами (а в случае водорода — 2 электронами). Чтобы найти, сколько электронов будет иметь каждый атом, определите количество валентных электронов в молекуле, а затем умножьте его на 2 (каждая связь включает 2 электрона) и добавьте число неподеленных электронов.[2]
- Например, O2 (газообразный кислород) имеет 6 валентных электронов. Умножим 6 на 2 и получим 12.
- Чтобы определить, соблюдено ли правило октета, используйте точки для представления валентных электронов вокруг каждого атома. В случае O2 один атом кислорода имеет 8 электронов (таким образом, правило октета соблюдено), а второй — только 6 (то есть правило октета не выполняется). Это означает, что между двумя атомами кислорода требуется более одной связи. Следовательно, для двойной связи между атомами необходимо два электрона, чтобы правило октета выполнялось для обоих атомов.
-
3
Нарисуйте связи. Каждая связь изображается линией между двумя атомами. Для одинарной связи нужно просто соединить линией два атома. В случае двойной или тройной связи необходимо провести соответственно две или три линии.[3]
- Например, в N2 (газообразном азоте) два атома связаны тройной связью. Таким образом, на диаграмме Льюиса эта молекула будет изображена как 3 параллельные линии, соединяющие 2 атома N.
-
4
Обозначьте несвязанные электроны. Некоторые электроны одного или обоих атомов могут остаться несвязанными. В этом случае их следует обозначить точками вокруг соответствующих атомов. Как правило, атомы не имеют более 8 свободных электронов. Проверьте результат: посчитайте каждую точку как 1 электрон и каждую линию как 2 электрона.[4]
- Например, в O2 (газообразном кислороде) атомы соединены двумя параллельными линиями, и возле каждого атома стоят две пары точек, которые обозначают свободные электроны.
Реклама
-
1
Определите, какой из атомов является центральным. Обычно этот атом является наименее электроотрицательным. Благодаря этому он наиболее способен образовывать связи с другими атомами. Термин «центральный атом» означает, что все другие атомы в молекуле связаны именно с этим атомом (но необязательно друг с другом).[5]
- В качестве центральных атомов часто выступают атомы фосфора и углерода.
- В некоторых более сложных молекулах может быть несколько центральных атомов.
- Учтите, что в таблице Менделеева электроотрицательность увеличивается слева направо и уменьшается сверху вниз.
-
2
Проверьте, сколько валентных электронов имеет центральный атом. Обычно (но не всегда) атомы стремятся окружить себя 8 валентными электронами (правило октета). При соединении центрального атома с другими атомами конфигурация с минимальной энергией в большинстве случаев соответствует октету. Это поможет вам определить количество связей между центральным атомом и другими атомами, так как каждая связь осуществляется двумя электронами.[6]
- Для некоторых больших атомов, например атомов фосфора, правило октета может нарушаться.
- Например, в молекуле диоксида углерода (CO2) два атома кислорода ковалентно связаны двойной связью с центральным атомом углерода. В результате правило октета выполняется для всех трех атомов.
- В пентахлориде фосфора (PCl5) правило октета нарушается — в этом соединении вокруг центрального атома располагается 5 связывающих пар. Эта молекула имеет 5 атомов хлора, которые ковалентно связаны с центральным атомом фосфора. Таким образом, правило октета выполняется для каждого из 5 атомов хлора, но превышается для атома фосфора.
-
3
Запишите символ центрального атома. Если вы имеете дело с многоатомными ковалентными молекулами, лучше начать с центрального атома. Не записывайте символы всех атомов одновременно. Оставьте достаточно места вокруг центрального атома, чтобы можно было разместить другие символы после того, как вы определите их расположение.[7]
-
4
Изобразите электронную структуру центрального атома. Для каждой несвязанной пары электронов поставьте по 2 маленькие точки вокруг центрального атома. Каждую связь изобразите линией, отходящей от атома. Двойные и тройные связи отобразите соответственно двумя или тремя линиями. Таким образом вы покажете, как другие атомы соединены с центральным.[8]
-
5
Добавьте остальные атомы. Каждый атом будет соединяться с центральным. Запишите символы каждого атома на концах линий, которые вы провели от центрального атома. Тем самым вы укажете на то, что электроны распределяются между центральным атомом и этими атомами.[9]
-
6
Отметьте оставшиеся электроны. Учтите каждую связь как два электрона, а двойную или тройную связь как четыре или шесть электронов соответственно. Затем добавьте электронные пары вокруг каждого атома, так чтобы выполнялось правило октета. Проверьте, все ли правильно: каждая точка соответствует одному электрону, а линия — двум электронам. В сумме должно выйти 8.[10]
- Конечно, исключение составляют те атомы, которые превышают правило октета, а также атом водорода, у которого может быть лишь 0 или 2 валентных электрона.
- При образовании молекулы водорода два атома водорода соединяются ковалентной связью, поэтому у молекулы нет свободных электронов.
Реклама
-
1
Запишите символ химического элемента. Ион обозначается тем же символом, что и соответствующий атом. Оставьте достаточно места вокруг символа, чтобы позже указать электроны и добавить скобки. Иногда ионы представляют собой многоатомные молекулы, которые содержат более одного атома. В этом случае их обозначают путем записи символов всех входящих в молекулу атомов.[11]
- Чтобы записать полиатомный ион (например, NO3– или SO42-), воспользуйтесь рекомендациями, приведенными в предыдущем разделе «Ковалентные молекулы, состоящие из трех или более атомов».
-
2
Обозначьте электроны. Обычно атомы нейтральны и не обладают положительным или отрицательным зарядом. Однако если атом теряет или приобретает электроны, его электрический заряд изменяется. В этом случае атом становится заряженной частицей, ионом. Обозначьте на структуре Льюиса дополнительные электроны или удалите те электроны, которые атом потерял.[12]
- Если вы добавляете электроны, не забывайте о правиле октета.
- Если атом теряет электроны, образуется положительный ион (катион). Например, при ионизации атом лития теряет свой единственный валентный электрон. Его структура Льюиса представляет собой символ «Li» без точек.
- Если атом приобретает дополнительные электроны, он превращается в отрицательный ион (анион). Имеющий 7 валентных электронов атом хлора при ионизации приобретает еще один электрон, в результате чего у него образуется заполненная оболочка из 8 электронов. В этом случае структура Льюиса будет представлять собой символ «Cl», окруженный четырьмя парами точек.
-
3
Обозначьте заряд иона. Подсчет точек вокруг каждого атома для того, чтобы выяснить заряд иона, может оказаться довольно утомительным занятием. Чтобы упростить чтение структур Льюиса, на них обозначают заряды ионов. Для этого символ элемента (или несколько образующих полиатомную структуру символов) заключают в квадратные скобки и записывают заряд за скобками в верхнем правом углу.[13]
- Например, ион магния с пустой внешней электронной оболочкой обозначают как [Mg]2+.
Реклама
Советы
- Точечные структуры Льюиса должны быть одинаковыми для тех элементов, которые принадлежат к одной периодической группе, хотя встречаются некоторые исключения.
Реклама
Об этой статье
Эту страницу просматривали 37 849 раз.
Была ли эта статья полезной?
From Wikipedia, the free encyclopedia
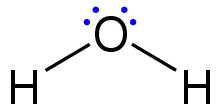
Lewis structure of a water molecule.
Lewis structures, also known as Lewis dot formulas, Lewis dot structures, electron dot structures, or Lewis electron dot structures (LEDS), are diagrams that show the bonding between atoms of a molecule, as well as the lone pairs of electrons that may exist in the molecule.[1][2][3] A Lewis structure can be drawn for any covalently bonded molecule, as well as coordination compounds. The Lewis structure was named after Gilbert N. Lewis, who introduced it in his 1916 article The Atom and the Molecule.[4] Lewis structures extend the concept of the electron dot diagram by adding lines between atoms to represent shared pairs in a chemical bond.
Lewis structures show each atom and its position in the structure of the molecule using its chemical symbol. Lines are drawn between atoms that are bonded to one another (pairs of dots can be used instead of lines). Excess electrons that form lone pairs are represented as pairs of dots, and are placed next to the atoms.
Although main group elements of the second period and beyond usually react by gaining, losing, or sharing electrons until they have achieved a valence shell electron configuration with a full octet of (8) electrons, hydrogen (H) can only form bonds which share just two electrons.
Construction and electron counting[edit]
The total number of electrons represented in a Lewis structure is equal to the sum of the numbers of valence electrons on each individual atom. Non-valence electrons are not represented in Lewis structures.
Once the total number of available electrons has been determined, electrons must be placed into the structure according to these steps:
- The atoms are first connected by single bonds.
- If t is the total number of electrons and n the number of single bonds, t-2n electrons remain to be placed. These should be placed as lone pairs: one pair of dots for each pair of electrons available. Lone pairs should initially be placed on outer atoms (other than hydrogen) until each outer atom has eight electrons in bonding pairs and lone pairs; extra lone pairs may then be placed on the central atom. When in doubt, lone pairs should be placed on more electronegative atoms first.
- Once all lone pairs are placed, atoms (especially the central atoms) may not have an octet of electrons. In this case, the atoms must form a double bond; a lone pair of electrons is moved to form a second bond between the two atoms. As the bonding pair is shared between the two atoms, the atom that originally had the lone pair still has an octet; the other atom now has two more electrons in its valence shell.
Lewis structures for polyatomic ions may be drawn by the same method. When counting electrons, negative ions should have extra electrons placed in their Lewis structures; positive ions should have fewer electrons than an uncharged molecule. When the Lewis structure of an ion is written, the entire structure is placed in brackets, and the charge is written as a superscript on the upper right, outside the brackets.
A simpler method has been proposed for constructing Lewis structures, eliminating the need for electron counting: the atoms are drawn showing the valence electrons; bonds are then formed by pairing up valence electrons of the atoms involved in the bond-making process, and anions and cations are formed by adding or removing electrons to/from the appropriate atoms.[5]
A trick is to count up valence electrons, then count up the number of electrons needed to complete the octet rule (or with hydrogen just 2 electrons), then take the difference of these two numbers. The answer is the number of electrons that make up the bonds. The rest of the electrons just go to fill all the other atoms’ octets.
Another simple and general procedure to write Lewis structures and resonance forms has been proposed.[6]
Formal charge[edit]
In terms of Lewis structures, formal charge is used in the description, comparison, and assessment of likely topological and resonance structures[7] by determining the apparent electronic charge of each atom within, based upon its electron dot structure, assuming exclusive covalency or non-polar bonding. It has uses in determining possible electron re-configuration when referring to reaction mechanisms, and often results in the same sign as the partial charge of the atom, with exceptions. In general, the formal charge of an atom can be calculated using the following formula, assuming non-standard definitions for the markup used:
where:
is the formal charge.
represents the number of valence electrons in a free atom of the element.
represents the number of unshared electrons on the atom.
represents the total number of electrons in bonds the atom has with another.
The formal charge of an atom is computed as the difference between the number of valence electrons that a neutral atom would have and the number of electrons that belong to it in the Lewis structure. Electrons in covalent bonds are split equally between the atoms involved in the bond. The total of the formal charges on an ion should be equal to the charge on the ion, and the total of the formal charges on a neutral molecule should be equal to zero.
Resonance[edit]
For some molecules and ions, it is difficult to determine which lone pairs should be moved to form double or triple bonds, and two or more different resonance structures may be written for the same molecule or ion. In such cases it is usual to write all of them with two-way arrows in between (see Example below). This is sometimes the case when multiple atoms of the same type surround the central atom, and is especially common for polyatomic ions.
When this situation occurs, the molecule’s Lewis structure is said to be a resonance structure, and the molecule exists as a resonance hybrid. Each of the different possibilities is superimposed on the others, and the molecule is considered to have a Lewis structure equivalent to some combination of these states.
The nitrate ion (NO3−), for instance, must form a double bond between nitrogen and one of the oxygens to satisfy the octet rule for nitrogen. However, because the molecule is symmetrical, it does not matter which of the oxygens forms the double bond. In this case, there are three possible resonance structures. Expressing resonance when drawing Lewis structures may be done either by drawing each of the possible resonance forms and placing double-headed arrows between them or by using dashed lines to represent the partial bonds (although the latter is a good representation of the resonance hybrid which is not, formally speaking, a Lewis structure).
When comparing resonance structures for the same molecule, usually those with the fewest formal charges contribute more to the overall resonance hybrid. When formal charges are necessary, resonance structures that have negative charges on the more electronegative elements and positive charges on the less electronegative elements are favored.
Single bonds can also be moved in the same way to create resonance structures for hypervalent molecules such as sulfur hexafluoride, which is the correct description according to quantum chemical calculations instead of the common expanded octet model.
The resonance structure should not be interpreted to indicate that the molecule switches between forms, but that the molecule acts as the average of multiple forms.
Example[edit]
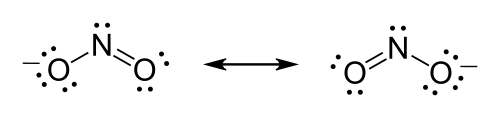
The formula of the nitrite ion is NO−2.
- Nitrogen is the least electronegative atom of the two, so it is the central atom by multiple criteria.
- Count valence electrons. Nitrogen has 5 valence electrons; each oxygen has 6, for a total of (6 × 2) + 5 = 17. The ion has a charge of −1, which indicates an extra electron, so the total number of electrons is 18.
- Connect the atoms by single bonds. Each oxygen must be bonded to the nitrogen, which uses four electrons—two in each bond.
- Place lone pairs. The 14 remaining electrons should initially be placed as 7 lone pairs. Each oxygen may take a maximum of 3 lone pairs, giving each oxygen 8 electrons including the bonding pair. The seventh lone pair must be placed on the nitrogen atom.
- Satisfy the octet rule. Both oxygen atoms currently have 8 electrons assigned to them. The nitrogen atom has only 6 electrons assigned to it. One of the lone pairs on an oxygen atom must form a double bond, but either atom will work equally well. Therefore, there is a resonance structure.
- Tie up loose ends. Two Lewis structures must be drawn: Each structure has one of the two oxygen atoms double-bonded to the nitrogen atom. The second oxygen atom in each structure will be single-bonded to the nitrogen atom. Place brackets around each structure, and add the charge (−) to the upper right outside the brackets. Draw a double-headed arrow between the two resonance forms.
Alternative formations[edit]
Two varieties of condensed structural formula, both showing butane
Chemical structures may be written in more compact forms, particularly when showing organic molecules. In condensed structural formulas, many or even all of the covalent bonds may be left out, with subscripts indicating the number of identical groups attached to a particular atom.
Another shorthand structural diagram is the skeletal formula (also known as a bond-line formula or carbon skeleton diagram). In a skeletal formula, carbon atoms are not signified by the symbol C but by the vertices of the lines. Hydrogen atoms bonded to carbon are not shown—they can be inferred by counting the number of bonds to a particular carbon atom—each carbon is assumed to have four bonds in total, so any bonds not shown are, by implication, to hydrogen atoms.
Other diagrams may be more complex than Lewis structures, showing bonds in 3D using various forms such as space-filling diagrams.
Usage and limitations[edit]
Despite their simplicity and development in the early twentieth century, when understanding of chemical bonding was still rudimentary, Lewis structures capture many of the key features of the electronic structure of a range of molecular systems, including those of relevance to chemical reactivity. Thus, they continue to enjoy widespread use by chemists and chemistry educators. This is especially true in the field of organic chemistry, where the traditional valence-bond model of bonding still dominates, and mechanisms are often understood in terms of curve-arrow notation superimposed upon skeletal formulae, which are shorthand versions of Lewis structures. Due to the greater variety of bonding schemes encountered in inorganic and organometallic chemistry, many of the molecules encountered require the use of fully delocalized molecular orbitals to adequately describe their bonding, making Lewis structures comparatively less important (although they are still common).
It is important to note that there are simple and archetypal molecular systems for which a Lewis description, at least in unmodified form, is misleading or inaccurate. Notably, the naive drawing of Lewis structures for molecules known experimentally to contain unpaired electrons (e.g., O2, NO, and ClO2) leads to incorrect inferences of bond orders, bond lengths, and/or magnetic properties. A simple Lewis model also does not account for the phenomenon of aromaticity. For instance, Lewis structures do not offer an explanation for why cyclic C6H6 (benzene) experiences special stabilization beyond normal delocalization effects, while C4H4 (cyclobutadiene) actually experiences a special destabilization. Molecular orbital theory provides the most straightforward explanation for these phenomena.
See also[edit]
- Valence shell electron pair repulsion theory
- Molecular geometry
- Structural formula
- Natural bond orbital
References[edit]
- ^ IUPAC definition of Lewis formula
- ^ Zumdahl, S. (2005) Chemical Principles Houghton-Mifflin (ISBN 0-618-37206-7)
- ^ G.L. Miessler; D.A. Tarr (2003), Inorganic Chemistry (2nd ed.), Pearson Prentice–Hall, ISBN 0-13-035471-6
- ^ Lewis, G. N. (1916), “The Atom and the Molecule”, J. Am. Chem. Soc., 38 (4): 762–85, doi:10.1021/ja02261a002, S2CID 95865413
- ^ Miburo, Barnabe B. (1993), “Simplified Lewis Structure Drawing for Non-science Majors”, J. Chem. Educ., 75 (3): 317, Bibcode:1998JChEd..75..317M, doi:10.1021/ed075p317
- ^ Lever, A. B. P. (1972), “Lewis Structures and the Octet Rule”, J. Chem. Educ., 49 (12): 819, Bibcode:1972JChEd..49..819L, doi:10.1021/ed049p819
- ^ Miessler, G. L. and Tarr, D. A., Inorganic Chemistry (2nd ed., Prentice Hall 1998) ISBN 0-13-841891-8, pp. 49–53 – Explanation of formal charge usage.
External links[edit]
- Lewis Dot Diagrams of Selected Elements
Определение структуры Льюиса и пример
На чтение 4 мин. Просмотров 146 Опубликовано 27.05.2021
Структуры Льюиса имеют множество названий, включая структуры электронных точек Льюиса, точечные диаграммы Льюиса и структуры электронных точек. Все эти имена относятся к одному и тому же типу диаграммы, которая предназначена для отображения расположения связей и электронных пар.
Содержание
- Ключевые выводы: Структура Льюиса
- Определение
- Как это работает
- Как написать его
- Источники
Ключевые выводы: Структура Льюиса
- Структура Льюиса – это диаграмма, которая показывает ковалентные связи и неподеленные электронные пары в молекуле.
- Льюис структуры основаны на правиле октетов.
- Хотя структуры Льюиса полезны для описания химической связи, они ограничены тем, что не учитывают ароматичность и не описывают точно магнитное поведение.
Определение
Структура Льюиса – это структурное представление молекулы, где точки используются для обозначения положений электронов вокруг атомов и линии или пары точек представляют ковалентные связи между атомами. Целью построения точечной структуры Льюиса является выявление неподеленных электронных пар в молекулах, чтобы помочь определить образование химической связи. Структуры Льюиса могут быть созданы для молекул, содержащих ковалентные связи, и для координационных соединений. Причина в том, что электроны связаны ковалентной связью. В ионной связи это больше похоже на то, что один атом отдает электрон другому атому.
Структуры Льюиса названы в честь Гилберта Н. Льюиса, который представил эту идею в статье «Атом и молекула» в 1916 году.
Также известен как: Структуры Льюиса также называют Льюисом точечные диаграммы, электронные точечные диаграммы, точечные формулы Льюиса или электронные точечные формулы. Технически структуры Льюиса и структуры электронных точек отличаются, поскольку структуры электронных точек показывают все электроны в виде точек, в то время как структуры Льюиса показывают общие пары в химической связи, рисуя линию.
Как это работает
Структура Льюиса основана на концепции правила октетов, согласно которому атомы разделяют электроны, так что каждый атом имеет восемь электронов на своей внешней оболочке. Например, атом кислорода имеет шесть электронов на внешней оболочке. В структуре Льюиса эти шесть точек расположены так, что у атома есть две неподеленные пары и два одиночных электрона. Две пары будут находиться друг напротив друга вокруг символа O, а два отдельных электрона будут на других сторонах атома, напротив друг друга.
In Обычно отдельные электроны пишутся сбоку от символа элемента. Неправильное размещение будет (например), четыре электрона на одной стороне атома и два на противоположной стороне. Когда кислород связывается с двумя атомами водорода, образуя воду, каждый атом водорода имеет одну точку для своего одинокого электрона. Точечная структура электронов для воды показывает, что одиночные электроны кислорода разделяют пространство с одиночными электронами водорода. Все восемь точек вокруг кислорода заполнены, поэтому молекула имеет стабильный октет..
Как написать его
Для нейтральной молекулы выполните следующие действия:
- Определите, сколько валентных электронов имеет каждый атом в молекуле. Как и в случае углекислого газа, каждый углерод имеет четыре валентных электрона. Кислород имеет шесть валентных электронов.
- Если молекула имеет более одного типа атомов, самый металлический или наименее электроотрицательный атом находится в центре. Если вы не знаете электроотрицательность, помните, что тенденция заключается в том, что электроотрицательность уменьшается по мере удаления от фтора в периодической таблице.
- Расположите электроны так, чтобы каждый атом вносил один электрон, чтобы сформировать одинарную связь между каждый атом.
- Наконец, посчитайте электроны вокруг каждого атома. Если у каждого восемь или один октет, то октет завершен. Если нет, переходите к следующему шагу.
- Если у вас есть атом, у которого отсутствуют точки, перерисуйте структуру, чтобы определенные электроны образовали пары, чтобы число на каждом атоме достигло восьми. Например, в случае диоксида углерода исходная структура имеет семь электронов, связанных с каждым атомом кислорода, и шесть электронов для атома углерода. Окончательная структура помещает две пары (два набора из двух точек) на каждый атом кислорода, две электронные точки кислорода, обращенные к атому углерода, и два набора углеродных точек (по два электрона с каждой стороны). Между кислородом и углеродом находится по четыре электрона, которые изображены в виде двойных связей.
Источники
- Льюис, Дж. Н. «Атом и молекула», Журнал Американского химического общества .
- Вайнхольд, Фрэнк и Лэндис, Кларк Р. . “Валентность и связывание: перспектива орбитального донора-акцептора естественной связи”. Cambridge University Press.
- Zumdahl, S. “Chemical Principles”. Houghton-Mifflin.
В этой статье объясняется sp-гибридизация, как нарисовать структуру sp-льюиса для sp-гибридизированной молекулы и другие детали, упомянутые в заголовке.
Атомные орбитали перекрываются, образуя новые орбитали, которые различаются по энергии, форме и силе. Этот процесс называется гибридизацией. В sp-гибридизация, одна s-орбиталь объединяется с ap-орбиталью (px,py,pz). Это также известно как линейная гибридизация.
- Каждая sp-гибридная орбиталь сильнее, чем чистая s- или чистая p-орбиталь.
- Количество атомных орбиталей, участвующих в гибридизации, дает такое же количество гибридных орбиталей.

- В случае sp-гибридизированной молекулы, подобной Be, электронная конфигурация Be в основном состоянии имеет вид [He]2s2 . Он подвергается возбуждению, продвигая электрон из 2s в 2p, и приобретает конфигурацию [He]2s1 2p1 .
- 2s- и 2p-орбитали Be объединяются, образуя две эквивалентные sp-гибридные орбитали.
- Эти гибридные орбитали образуют сигма-связь с двумя 3p-орбиталями Cl.

Правило октета
Атомы пытаются достичь электронной конфигурации октета, либо разделяя валентные электроны (ковалентная связь), либо передавая валентные электроны, либо теряя, либо приобретая (ионная связь).
- Прежде чем научиться рисовать структура льюиса для любой молекулы нам нужно знать правило октета.
- В 1916 году Кёссель и Льюис разработали очень важную теорию, известную как электронная теория химической связи.
- Согласно этой теории, атомы имеют тенденцию достигать восьми электронов (октетов) в своей внешней оболочке, чтобы обрести стабильность, как благородный газ.. Это известно как правило октета.
- Есть некоторые исключения из этого правила (водород, гелий, литий и т.
- В некоторых случаях валентных электронов в центральном атоме тоже может быть больше восьми, как это обнаружено в PF.5 и СФ6, где P имеет десять валентных электронов, а S имеет 12 валентных электронов. Это исключения из правила октета.
Структура Льюиса представляет собой диаграмму, которая показывает, как неподеленные пары и электроны пары связи распределены в молекуле.
- В структуре Льюиса используется правило октетов. Мы изображаем электроны точками и связи тире.
- Наблюдения и советы этой статьи мы подготовили на основании опыта команды структура льюиса не представляет фактическую форму молекулы, но помогает понять формирование молекул.
- Мы рисуем Структуры Льюиса помнить о некоторых правилах и рекомендациях.
- Во-первых, мы будем валентные электроны каждого атома в молекуле. Например, в случае BeCl2 ( sp-гибридизированная молекула), общее число валентных электронов равно 2 + (7 X 2) = 16 (два у Be и семь у каждого атома хлора).
- Тогда мы определить центральный атом молекулы. Обычно это атом с наименьшим числом или с наименьшей электроотрицательностью.
- В BeCl2 , Be — центральный атом.
- Другой способ идентификации центрального атома заключается в том, что он может быть единственным, который может образовывать более одной связи.
- Валентные электроны должны быть расположены так, чтобы каждый атом имел общую пару электронов и образовывал связь.
- Затем расположить остальные электронные пары для образования одиночных пар или множественных связей пока каждый атом не завершит свой октет.
- В случае анионов мы добавляем электроны в соответствии с имеющимся на них отрицательным зарядом. Если анион имеет заряд -1, мы добавим электрон.
- Точно так же в случае катионов мы будем вычитать электроны в зависимости от заряда катиона.
- Наблюдения и советы этой статьи мы подготовили на основании опыта команды структура льюиса BeCl2 показан ниже.
- Be не завершает свой октет в BeCl2 поскольку Be не следует правилу октетов. Это исключение.
Форма структуры Sp Льюиса
Чтобы предсказать форму молекулы, мы используем Теория ВСЭПР.
Наблюдения и советы этой статьи мы подготовили на основании опыта команды Форму молекулы нельзя предсказать по закону Льюиса. структура (это говорит нам только о расположении электронов).
В BeCl2 , Be имеет два валентных электрона, используемых для образования связей с двумя атомами хлора.
Be не имеет неподеленной пары, а две пары связей выровнять на 180 градусов друг к другу, образуя линейная форма.
Формальный заряд
Поскольку разные атомы имеют разную электроотрицательность, электроны в химической связи распределяются неравномерно.
- Если мы забудем об электроотрицательности и предположим, что электроны в связи распределены поровну, то заряд, приписываемый атому в молекуле, будет равен официальное обвинение.
- Если мы подсчитаем количество валентных электронов в свободном атоме (не связанном с каким-либо другим атомом или изолированным атомом), а затем подсчитаем количество валентных электронов в этом атоме в молекуле, разница даст нам формальный заряд этого атома.
- Это гипотетический заряд, который не отражает распределение электронной плотности.
- Формальный заряд атома в молекуле = V-1/2[B]-N
- Ссылка на V – общее количество валентных электронов на свободных атомах, B – общее количество общих электронов, а N – общее количество несвязанных неподеленных электронов..
- Be имеет два валентных электрона в изолированном состоянии, общее количество общих электронов равно четырем (две пары связей), а количество неподеленных электронов/неподеленной пары равно нулю.
- Используя приведенную выше информацию, формальный заряд Be в BeCl2 is 2-1/2[4]-0= 0.
- Cl имеет семь валентных электронов в изолированном состоянии, общее количество общих электронов равно четырем (две пары связей), и у него шесть неподеленных электронов.
- Используя приведенную выше информацию, формальный заряд каждого атома хлора в BeCl2
is 7-1/2[2]-6=zero.
Резонанс структуры Сп-Льюиса
Мы можем нарисовать несколько структуры Льюиса для молекулы, которая имеет неподеленные пары или может образовывать множественные связи.
Это называется резонанс структуры Льюиса формулы.
Формальный заряд помогает предсказать наиболее стабильную структуру Льюиса в случае резонанса, когда возможно более одной структуры Льюиса.
Структуры Льюиса с низким формальным зарядом являются наиболее устойчивыми
.
Мы нарисуем различные структуры Льюиса СО.2 и определить наиболее стабильную структуру с помощью формального заряда.
Sp полярный или неполярный
Полярность и неполярность зависят от разницы электроотрицательностей между атомами и чистого дипольного момента молекулы.
Полярность и неполярность зависят от разницы электроотрицательностей между атомами и суммарного дипольного момента молекулы..
Когда связанные атомы имеют одинаковую электроотрицательность, они делят электроны поровну, и молекула будет неполярный.
Иногда, полярные связи в молекуле могут иметь симметричная геометрия так что они компенсировать дипольный момент друг друга. В результате молекула неполярный.
Когда связанные электроны не распределяются поровну из-за разницы в электроотрицательности, электронная плотность больше на более электроотрицательном атоме. В результате в молекуле будет слабоположительный центр и слабоотрицательный центр (будет образовываться диполь).
Sp гибридные молекулы имеют линейную структуру. Если одни и те же атомы присутствуют вокруг центрального атома в sp-гибридизированной молекуле, соединение неполярно, даже если отдельные связи полярны.
Это связано с тем, что в приведенном выше случае чистый дипольный момент равен нулю.
Следовательно, BeCl2 неполярный несмотря на разницу в электроотрицательности между Be и Cl (отдельные связи Be-Cl полярны, но молекула Be неполярна из-за чистый дипольный момент равен нулю).
Использование структуры sp lewis
Чтобы понять химическую связь, нам нужно идентифицировать неподеленную пару и пару электронов связи в молекуле.
- Структура Льюиса помогает визуализировать расположение электронов валентной оболочки в молекуле.
- Это помогает понять химическую связь.
Содержание
- Что такое структура Льюиса?
- Как это сделать?
- Что такое правило октетов?
- Применяя математическую формулу
- Где разместить наименее электроотрицательные атомы
- Симметрия и формальные обвинения
- Ограничения правила октетов
- Примеры структур Льюиса
- Йод
- Аммиак
- C2ЧАС6ИЛИ
- Перманганат-ион
- Дихромат-ион
- Ссылки
В Структура Льюиса Это все, что представляет собой ковалентные связи внутри молекулы или иона. В нем эти связи и электроны представлены точками или длинными штрихами, хотя в большинстве случаев точки соответствуют неподеленным электронам, а штрихы – ковалентным связям.
Но что такое ковалентная связь? Это разделение пары электронов (или точек) между любыми двумя атомами периодической таблицы. С помощью этих диаграмм можно нарисовать множество скелетов для данного соединения. Какой из них правильный, будет зависеть от формальных зарядов и химической природы самих атомов.
На изображении выше у вас есть пример того, что такое структура Льюиса. В этом случае представляемое соединение представляет собой 2-бромпропан. Вы можете видеть черные точки, соответствующие электронам, как тем, которые участвуют в связях, так и тем, которые не делятся (единственная пара чуть выше Br).
Если бы пары точек «:» были заменены длинным тире «-», то углеродный скелет 2-бромпропана был бы представлен как: C – C – C. Почему это не могло быть C – H – H – C вместо нарисованного «молекулярного каркаса»? Ответ кроется в электронных характеристиках каждого атома.
Таким образом, поскольку водород имеет один электрон и одну орбиталь, доступную для заполнения, он образует только одну ковалентную связь. Следовательно, он никогда не может образовывать две связи (не путать с водородными связями). С другой стороны, электронная конфигурация атома углерода позволяет (и требует) образование четырех ковалентных связей.
По этой причине структуры Льюиса, в которых участвуют С и Н, должны быть когерентными и учитывать то, что регулируется их электронными конфигурациями. Таким образом, если углерод имеет более четырех связей или водород более одной, то эскиз можно отбросить и начать новый, более соответствующий реальности.
Именно здесь появляется один из основных мотивов или подтверждений этих структур, введенный Гилбертом Ньютоном Льюисом в его поисках молекулярных представлений, верных экспериментальным данным: молекулярная структура и формальные заряды.
Все существующие соединения могут быть представлены структурами Льюиса, что дает первое приближение к тому, какими могут быть молекулы или ионы.
Что такое структура Льюиса?
Это типичная структура валентных электронов и ковалентных связей в молекуле или ионе, которая позволяет получить представление о ее молекулярной структуре.
Однако эта структура не может предсказать некоторые важные детали, такие как геометрия молекулы относительно атома и его окружения (квадрат, тригональная плоскость, бипирамидальность и т. Д.).
Точно так же он ничего не говорит о том, что такое химическая гибридизация его атомов, но он говорит, где расположены двойные или тройные связи и есть ли резонанс в структуре.
Обладая этой информацией, можно спорить о реакционной способности соединения, его стабильности, о том, как и по какому механизму будет следовать молекула, когда она вступит в реакцию.
По этой причине структуры Льюиса никогда не перестают рассматриваться и очень полезны, поскольку в них можно сконцентрировать новое химическое обучение.
Как это сделать?
Чтобы нарисовать или набросать структуру, формулу или диаграмму Льюиса, необходима химическая формула соединения. Без него вы даже не сможете узнать, из каких атомов он состоит. После этого периодическая таблица Менделеева используется для определения того, к каким группам они принадлежат.
Например, если у вас есть соединение C14ИЛИ2N3 тогда нам придется искать группы, в которых находятся углерод, кислород и азот. Как только это будет сделано, неважно, что это за соединение, количество валентных электронов останется прежним, поэтому рано или поздно они запоминаются.
Таким образом, углерод относится к группе IVA, кислород – к группе VIA, а азот – к VA. Номер группы равен количеству валентных электронов (точек). Все они имеют общую тенденцию заполнять октет валентной оболочки.
Что такое правило октетов?
Это говорит о том, что для достижения стабильности атомы имеют тенденцию завершать свой энергетический уровень с помощью восьми электронов. Это относится ко всем неметаллическим элементам или элементам, содержащимся в блоках s или p периодической таблицы.
Однако не все элементы подчиняются правилу октетов. Частными случаями являются переходные металлы, структура которых основана больше на формальных зарядах и их групповом номере.
Применяя математическую формулу
Зная, к какой группе принадлежат элементы, и, следовательно, количество валентных электронов, доступных для образования связей, мы используем следующую формулу, которая полезна для построения структур Льюиса:
C = N – D
Где C означает общие электроны, то есть те, которые участвуют в ковалентных связях. Поскольку каждая связь состоит из двух электронов, то C / 2 равно количеству связей (или штрихов), которые необходимо нарисовать.
N являются электроны нужны, который должен иметь атом в своей валентной оболочке, чтобы быть изоэлектронным благородному газу, который следует за ним в тот же период. Для всех элементов, кроме H (поскольку для сравнения с He требуется два электрона), им нужно восемь электронов.
D – это доступные электроны, которые определяются группой или числом валентных электронов. Таким образом, поскольку Cl принадлежит к группе VIIA, он должен быть окружен семью черными точками или электронами, и имейте в виду, что пара необходима для образования связи.
Имея атомы, их точки и количество связей C / 2, структура Льюиса может быть импровизирована. Но дополнительно необходимо иметь представление о других «правилах».
Где разместить наименее электроотрицательные атомы
Наименее электроотрицательные атомы в подавляющем большинстве структур занимают центры. По этой причине, если у вас есть соединение с атомами P, O и F, P, следовательно, должен находиться в центре гипотетической структуры.
Также важно отметить, что водороды обычно связываются с сильно электроотрицательными атомами. Если у вас есть Zn, H и O в составе, H будет идти вместе с O, а не с Zn (Zn – O – H, а не H – Zn – O). Из этого правила есть исключения, но обычно это происходит с неметаллическими атомами.
Симметрия и формальные обвинения
Природа отдает предпочтение созданию максимально симметричных молекулярных структур. Это помогает избежать создания беспорядочных структур с атомами, расположенными таким образом, что они не подчиняются какой-либо видимой схеме.
Например, для соединения C2К3, где A – фиктивный атом, наиболее вероятной структурой будет A – C – A – C – A. Обратите внимание на симметрию его сторон, оба отражения друг друга.
Формальные заряды также играют важную роль при рисовании структур Льюиса, особенно для ионов. Таким образом, связи могут быть добавлены или удалены так, чтобы формальный заряд атома соответствовал показанному общему заряду. Этот критерий очень полезен для соединений переходных металлов.
Ограничения правила октетов
Не все правила соблюдаются, что не обязательно означает, что структура неправильная. Типичные примеры этого наблюдаются во многих соединениях, в которых задействованы элементы группы IIIA (B, Al, Ga, In, Tl). Трифторид алюминия (AlF3).
Применяя затем формулу, описанную выше, мы имеем:
D = 1 × 3 (один атом алюминия) + 7 × 3 (три атома фтора) = 24 электрона
Здесь 3 и 7 – соответствующие группы или числа валентных электронов, доступных для алюминия и фтора. Затем, учитывая необходимые электроны N:
N = 8 × 1 (один атом алюминия) + 8 × 3 (три атома фтора) = 32 электрона
И поэтому общие электроны:
C = N – D
C = 32-24 = 8 электронов
C / 2 = 4 звена
Поскольку алюминий является наименее электроотрицательным атомом, его нужно поместить в центр, а фтор образует только одну связь. Учитывая это, мы имеем структуру Льюиса группы AlF3 (верхнее изображение). Общие электроны выделены зелеными точками, чтобы отличить их от других.
Хотя расчеты предсказывают, что должно быть образовано 4 связи, в алюминии не хватает электронов, а также нет четвертого атома фтора. В результате алюминий не соответствует правилу октетов, и этот факт не отражается в расчетах.
Примеры структур Льюиса
Йод
Йод является галогеном и поэтому относится к группе VIIA. Тогда он имеет семь валентных электронов, и эту простую двухатомную молекулу можно представить импровизацией или применением формулы:
D = 2 × 7 (два атома йода) = 14 электронов
N = 2 × 8 = 16 электронов
C = 16 – 14 = 2 электрона
C / 2 = 1 ссылка
Из 14 электронов 2 участвуют в ковалентной связи (зеленые точки и штрих), 12 остаются неразделенными; и поскольку они представляют собой два атома йода, необходимо разделить 6 на один из них (его валентные электроны). Только такая структура возможна в этой молекуле, геометрия которой линейна.
Аммиак
Какова структура Льюиса у молекулы аммиака? Поскольку азот принадлежит к группе VA, он имеет пять валентных электронов, и тогда:
D = 1 × 5 (один атом азота) + 1 × 3 (три атома водорода) = 8 электронов
N = 8 × 1 + 2 × 3 = 14 электронов
C = 14-8 = 6 электронов
C / 2 = 3 звена
На этот раз формула верна с количеством ссылок (три зеленые ссылки). Поскольку в связях участвуют 6 из 8 доступных электронов, остается неподеленная пара, которая расположена над атомом азота.
Эта структура говорит все, что нужно знать об аммиачной основе. Применяя знания о TEV и TRPEV, можно сделать вывод, что геометрия тетраэдрическая, искаженная свободной парой азота, и, следовательно, ее гибридизация является sp.3.
C2ЧАС6ИЛИ
Формула соответствует органическому соединению. Перед применением формулы следует помнить, что атомы водорода образуют одинарную связь, кислород два, углерод четыре, и что структура должна быть как можно более симметричной. Действуя, как в предыдущих примерах, мы имеем:
D = 6 × 1 (шесть атомов водорода) + 6 × 1 (один атом кислорода) + 4 × 2 (два атома углерода) = 20 электронов
N = 6 × 2 (шесть атомов водорода) + 8 × 1 (один атом кислорода) + 8 × 2 (два атома углерода) = 36 электронов
C = 36-20 = 16 электронов
C / 2 = 8 звеньев
Количество зеленых штрихов соответствует 8 рассчитанным ссылкам. Предлагаемая структура Льюиса представляет собой этанол CH3CH2ОЙ. Однако было бы правильно также предложить строение диметилового эфира CH3ОСН3, что еще более симметрично.
Какой из двух «более» правильный? И то, и другое одинаково, поскольку структуры возникли как структурные изомеры одной и той же молекулярной формулы C2ЧАС6ИЛИ.
Перманганат-ион
Ситуация усложняется, когда желательно получить структуры Льюиса для соединений переходных металлов. Марганец относится к группе VIIB, аналогично электрон отрицательного заряда должен быть добавлен к имеющимся электронам. Применяя формулу, мы имеем:
D = 7 × 1 (один атом марганца) + 6 × 4 (четыре атома кислорода) + 1 электрон для заряда = 32 электрона
N = 8 × 1 + 8 × 4 = 40 электронов
C = 40-32 = 8 общих электронов
C / 2 = 4 звена
Однако переходные металлы могут иметь более восьми валентных электронов. Кроме того, для иона MnO4– демонстрируют отрицательный заряд, необходимо уменьшить формальные заряды атомов кислорода. Как? Через двойные связи.
Если все ссылки MnO4– были простыми, формальные заряды кислорода были бы равны -1. Поскольку их четыре, результирующий заряд для аниона будет -4, что, очевидно, неверно. Когда образуются двойные связи, гарантируется, что одиночный кислород имеет отрицательный формальный заряд, отраженный в ионе.
В перманганат-ионе видно, что есть резонанс. Это означает, что одинарная связь Mn – O делокализована между четырьмя атомами O.
Дихромат-ион
Наконец, аналогичный случай имеет место с дихромат-ионом (Cr2ИЛИ7). Хром принадлежит к группе VIB, поэтому имеет шесть валентных электронов. Снова применяя формулу:
D = 6 × 2 (два атома хрома) + 6 × 7 (семь атомов кислорода) + 2 электрона, умноженные на двухвалентный заряд = 56 электронов
N = 8 × 2 + 8 × 7 = 72 электрона
C = 72 – 56 = 16 общих электронов
C / 2 = 8 звеньев
Но здесь не 8 связей, а 12. По тем же причинам, обнаруженным в перманганат-ионе, должны остаться два атома кислорода с отрицательными формальными зарядами, которые в сумме составляют -2, заряд дихромат-иона.
Таким образом, добавляется столько двойных связей, сколько необходимо. Таким образом, мы приходим к льюисовской структуре изображения Cr2ИЛИ72–.
Ссылки
- Уиттен, Дэвис, Пек и Стэнли. Химия. (8-е изд.). CENGAGE Learning, стр. 251.
- Lewis Structures. Взято с: chemed.chem.purdue.edu
- Стивен А. Хардингер, факультет химии и биохимии Калифорнийского университета в Лос-Анджелесе. (2017). Структура Льюиса. Взято с: chem.ucla.edu
- Уэйн Бреслин. (2012). Рисование структур Льюиса. Взято с: terpconnect.umd.edu
- Веб-мастер. (2012). Льюис («электронная точка») Структуры. Департамент химии, Университет штата Мэн, Ороно. Взято с: chemistry.umeche.maine.edu
- Ланкастер, Шон. (25 апреля 2017 г.). Как определить количество точек в структуре точек Льюиса элемента. Наука. Получено с: sciencing.com