Br (бром) – элемент с прядковым номером 35 в периодической системе.
Находится в IV периоде. Температура плавления: -7.3 ℃. Плотность: 3.14 г/см3.
Электронная формула атома брома в порядке возрастания энергий орбиталей:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
Электронная формула атома брома в порядке следования уровней:
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5
Сокращенная электронная конфигурация Br:
[Ar] 3d10 4s2 4p5
Ниже приведена электронно-графическая схема атома брома

Распределение электронов по энергетическим уровням в атоме Br
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 18
4-й уровень (N): 7

Валентные электроны брома
Количество валентных электронов в атоме брома – 7.
Ниже приведены их квантовые числа (N – главное, L – орбитальное, M – магнитное, S – спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 4 | 0 | 0 | +1/2 |
| s | 4 | 0 | 0 | -1/2 |
| p | 4 | 1 | -1 | +1/2 |
| p | 4 | 1 | 0 | +1/2 |
| p | 4 | 1 | 1 | +1/2 |
| p | 4 | 1 | -1 | -1/2 |
| p | 4 | 1 | 0 | -1/2 |
Степени окисления, которые может проявлять бром: -1, +1, +3, +4, +5, +7
Электронное строение атома брома
Электронное строение нейтрального атома брома в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме брома.
Br
+35
2
8
18
7
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме брома.
| 4 | ↑↓ | ↑↓ | ↑↓ | ↑ | ||||||||
| 3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||||||||
| 1 | ↑↓ | |||||||||||
| s | p | d |
Валентные орбитали атома брома выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома брома.
35Br 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5
Сокращённая электронная конфигурация атома брома.
35Br [Ar] 3d10 4s2 4p5
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома брома.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 4s | 4 | 0 | 0 | +½ |
| -½ | ||||
| 4p | 4 | 1 | -1 | +½ |
| -½ | ||||
| 1 | +½ | |||
| -½ | ||||
| 2 | +½ |
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,651 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,896 -
разное
16,900
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
| Символ | Br– |
| Номер | 35 |
| Атомный вес | 79.9010000 |
| Латинское название | Bromum |
| Русское название | Бром |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема брома
Br: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 →
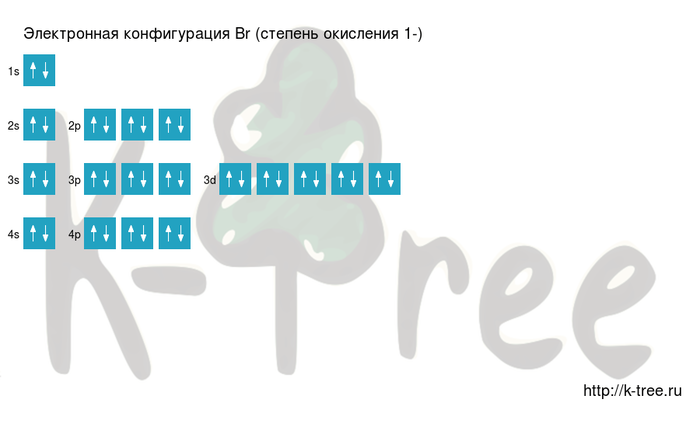
Br–:1s22s22p63s23p64s23d104p6
Одинаковую электронную конфигурацию имеют
ион брома -1 и
As-3, Se-2, Kr, Rb+1, Sr+2, Y+3, Zr+4, Tc+7
Порядок заполнения оболочек атома брома (Br–) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ – до 6, на
‘d’ – до 10 и на ‘f’ до 14
Бром имеет 35 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
Степень окисления брома
Атомы брома в соединениях имеют степени окисления 7, 5, 4, 3, 1, 0, -1.
Степень окисления – это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Степень окисления иона Br– = -1
Ионы брома
Валентность Br–
Атомы брома в соединениях проявляют валентность VII, V, IV, III, I.
Валентность брома характеризует способность атома Br к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Br 1-
Квантовые числа определяются последним электроном в конфигурации,
для иона Br эти числа имеют значение N = 4, L = 1, Ml = 1, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Перейти к другим элементам таблицы менделеева
Где Br в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Составление электронных формул элементов исходя из положения их в таблице Д.И. Менделеева
Электронные структуры атомов марганца и брома
Задача 4
Исходя из электронных структур атомов марганца и брома, их места в периодической системе, объясните сходство и различие их химических свойств.
Решение:
Марганец – 25 –й элемент таблицы Менделеева. Электронная формула марганца имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d5
Валентные электроны находятся на 4s и 3d подуровнях. На валентных орбиталях атома марганца находится 7электронов.
Бром – 35 элемент периодической таблицы Электронная формула брома имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
Валентные электроны находятся на 4s и 4р подуровнях. На валентных орбиталях атома находится 7 электронов.
Таким образом, марганец и бром не являются электронными аналогами и не должны размещаться в одной и той же подгруппе. Но на валентных орбиталях атомов этих элементов находится одинаковое число электронов – 7. Поэтому оба элемента помещают в одну и ту же группу периодической системы Д.И.Менделеева. Марганец – d-элемент VIIB-группы, а бром – p-элемент VIIA-группы.
На внешнем энергетическом уровне у атома марганца два электрона, а у брома – семь. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а следовательно, тенденцией терять эти электроны. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем уровне содержат более трех электронов, обладают определенным сродством к электрону, а следовательно, приобретают отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих p- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у марганца сильнее выражены, чем у брома.
Электронная формула ванадия
Задача 5.
Напишите электронно-графическую формулу для 23 элемента, определите его валентные электроны и охарактеризуйте их с помощью квантовых чисел.
Решение:
Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение – s, p, d, f), x – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n+1 (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s>2s>2р>3s>3р>4s>3d>4р>5s>4d>5р>6s>(5d1) >4f>5d>6р>7s>(6d1-2)>5f>6d>7р
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для 23 элемента – ванадия( V –порядковый № 23) электронная формула имеют вид:
V23 1s22s22р63s23р64s23d3
Валентные электроны ванадия – 4s23d3 – находятся на 4s и 3d подуровнях На валентных орбиталях атома ванадия находится 5 электронов. Поэтому элемент помещают в пятую группу периодической системы Д.И.Менделеева.
