…
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители.
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4— восстанавливается до Mn2+ (см. схему):
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
2) Определить окислитель и восстановитель
Найдем степень окисления элементов:
Na2S+4O3 + KMn+7O4 + H2SO4 = Na2S+6O4 + Mn+2SO4 + K2SO4 + H2O
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S+4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn+7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S+4 – 2e— = S+6 | 5 восстановитель, процесс окисления
Mn+7 +5e— = Mn+2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn+7, ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S+4 коэффициентом перед окислителем:
5Na2S+4O3 + 2KMn+7O4 + H2SO4 = 5Na2S+6O4 + 2Mn+2SO4 + K2SO4 + H2O
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO42-, из которых 5 – за счет превращения 5SO32- → 5SO42-, а 3 – за счет молекул серной кислоты 8SO42-— 5SO42- = 3SO42-.
Таким образом, серной кислоты надо взять 3 молекулы:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + H2O
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H+ + 3O-2 = 3H2O
Окончательный вид уравнения следующий:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H+ — кислая среда, OH— — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
Na2SO3 + KMnO4 + H2SO4 = Na2SO4 + MnSO4 + K2SO4 + H2O
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO32- + MnO4— + 2H+ = Mn2+ + SO42- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4— принимает 5 электронов восстанавливаясь в кислой среде до Mn2+. При этом освобождается кислород, входящий в состав MnO4—, который, соединяясь с H+ образует воду:
MnO4— + 8H+ + 5e— = Mn2+ + 4H2O
Восстановитель SO32- — окисляется до SO42-, отдав 2 электрона. Как видно образовавшийся ион SO42- содержит больше кислорода, чем исходный SO32-. Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H+:
SO32- + H2O — 2e— = SO42- + 2H+
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4— + 8H+ + 5e— = Mn2+ + 4H2O |2 окислитель, процесс восстановления
SO32- + H2O — 2e— = SO42- + 2H+ |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4— + 16H+ + 5SO32- + 5H2O = 2Mn2+ + 8H2O + 5SO42- + 10H+
Сократив подобные члены, находим ионное уравнение:
2MnO4— + 5SO32- + 6H+ = 2Mn2+ + 5SO42- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
Na2SO3 + KMnO4 + H2O = Na2SO4 + MnO2 + KOH
В ионном виде уравнение принимает вид:
SO32- + MnO4— + H2O = MnO2 + SO42- + OH—
Также, как и предыдущем примере, окислителем является MnO4—, а восстановителем SO32-.
В нейтральной и слабощелочной среде MnO4— принимает 3 электрона и восстанавливается до MnО2. SO32-— окисляется до SO42-, отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4— + 2H2O + 3e— = MnО2 + 4OH— |2 окислитель, процесс восстановления
SO32- + 2OH—— 2e— = SO42- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
3SO32- + 2MnO4— + H2O =2MnO2 + 3SO42- + 2OH—
3Na2SO3 + 2KMnO4 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
Na2SO3 + KMnO4 + KOH = Na2SO4 + K2MnO4 + H2O
В ионном виде уравнение принимает вид:
SO32- + MnO4— + OH— = MnO2 + SO42- + H2O
В щелочной среде окислитель MnO4— принимает 1 электрон и восстанавливается до MnО42-. Восстановитель SO32-— окисляется до SO42-, отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4— + e— = MnО2 |2 окислитель, процесс восстановления
SO32- + 2OH—— 2e— = SO42- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
SO32- + 2MnO4— + 2OH— = 2MnО42- + SO42- + H2O
Na2SO3 + 2KMnO4 + H2O = 2K2MnO4 + 3Na2SO4 + 2KOH
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
Метод полуреакций (электронно-ионного баланса)
Данный метод
применяется для составления уравнений
ОВР в водных растворах с участием
электролитов.
В этом методе не
используется понятие степень окисления,
а рассматривается обмен электронами
между реальными частицами, присутствующими
в растворе – ионами и молекулами. Метод
полуреакций позволяет использовать в
качестве исходных неполные схемы
реакций.
К недостаткам
этого метода следует отнести его
некоторую громоздкость и ограниченность
в применении только растворами
электролитов.
Алгоритм применения
метода полуреакций (электронно – ионного
баланса)
1. Написать схему
реакции. Схема может быть полной или
неполной. В случае использования неполной
схемы из продуктов реакции необходимо
знать только частицу, в которую перешел
окислитель и частицу, в которую перешел
восстановитель в ходе ОВР.
Пример:
а) полная схема
реакции:
Na2Cr2O7
+ K2SO3
+ H2SO4
Cr2(SO4)3
+ K2SO4
+ Na2SO4
+ H2O;
б) неполная схема
этой же реакции, достаточная для
применения метода полуреакций:
Na2Cr2O7
+ K2SO3
+ H2SO4
Cr+3
+ SO![]() + . . . .
+ . . . .
Пока для простоты
будем использовать полную схему
взаимодействия. Применение метода
полуреакций к неполным схемам рассмотрено
в конце этой главы.
2. Написать ионную
схему реакции. При этом, на ионы разбиваются
только сильные электролиты, хорошо
растворимые в воде (как при составлении
обменных ионных уравнений):
2Na+
+ Cr2O![]() + 2K+
+ 2K+
+ SO![]() + 2H+
+ 2H+
+ SO![]()
2Cr+3
+ SO![]() + 2K+
+ 2K+
+ SO![]() + 2Na+
+ 2Na+
+
SO![]()
+ H2O.
П р и м е ч а н и е.
Стехиометрические коэффициенты перед
ионами можно не указывать. Они не имеют
никакого смысла, так как данное выражение
является схемой, а не уравнением реакции:
Na+
+ Cr2O![]() + K+
+ K+
+ SO![]() + H+
+ H+
+ SO![]()
Cr+3
+ SO![]() + K+
+ K+
+SO![]() + Na+
+ Na+
+ SO![]() + H2O.
+ H2O.
3. Сравнить правую
и левую части ионной схемы и найти
частицы, изменившие свою химическую
форму. Под изменением химической формы
подразумевается:
а) изменение заряда
частицы;
б) изменение
формульного состава частицы.
П р и м е ч а н и е.
В данном пункте частицы H+
, OH–
и H2O
не рассматриваются.
SO![]()
SO![]() (произошло
(произошло
изменение формульного состава частицы);
Сr2O![]()
Cr+3 (произошло
изменение как формульного состава, так
и заряда частицы).
4. Составить
уравнения полуреакций окисления и
восстановления. Это делается в такой
последовательности.
а) уравниваются
правые и левые части полуреакций по
всем атомам, кроме кислорода и водорода:
SO![]()
SO![]() ,
,
Cr2O![]()
2Cr+3,
б) полуреакции
уравниваются по кислороду и водороду
с учетом кислотности среды (далее будет
рассмотрено отдельно)
SO![]() + H2O
+ H2O
SO![]() + 2H+,
+ 2H+,
Cr2O![]() + 14 H+
+ 14 H+
2Cr+3
+ 7H2O,
в) полуреакции
уравниваются по зарядам с помощью
электронов. В первой полуреакции
суммарный заряд частиц слева = -2, а справа
= 0. Значит, справа нужно прибавить 2![]() (или слева отнять 2
(или слева отнять 2![]() ):
):
SO![]() + H2O
+ H2O
– 2![]() = SO
= SO![]() + 2H+
+ 2H+
.
Для уравнивания
второй полуреакции слева нужно прибавить
6![]() :
:
Cr2O![]() + 14H+
+ 14H+
+ 6![]() = 2Cr+3
= 2Cr+3
+ 7H2O.
Полученные выражения
являются уравнениями полуреакций.
5. Сделать электронный
баланс, то есть подобрать коэффициенты,
на которые необходимо умножить полуреакции
окисления и восстановления, чтобы
количество электронов, ушедших от
восстановителя было равно числу
электронов, пришедших к окислителю:

 SO
SO![]() + H2O
+ H2O
– 2![]() = SO
= SO![]() + 2H+
+ 2H+
3
Cr2O![]() + 14H+
+ 14H+
+ 6![]() = 2Cr+3
= 2Cr+3
+ 7H2O
1
6. Умножить верхнее
и нижнее уравнения полуреакций на
коэффициенты электронного баланса.
Затем сложить их и получить сокращенное
ионное уравнение ОВР. В данном примере
полуреакцию окисления нужно умножить
на 3, а полуреакцию восстановления – на
1. После сложения получаем:
3SO![]()
+ 3H2O
+ Cr2O![]()
+ 14H+
= 3SO![]()
+ 6H+
+
2Cr+3
+ 7H2O.
Далее сокращаем
(по Н2О
и Н+):
3SO![]() + Cr2O
+ Cr2O![]() + 8H+
+ 8H+
= 3SO![]() + 2Cr+3
+ 2Cr+3
+ 4H2O.
Данное выражение
является сокращенным ионным уравнением
взаимодействия между восстановителем
(SO![]() )
)
и окислителем (Cr2O![]() )
)
в кислой среде.
Если необходимо
получить молекулярное уравнение реакции,
то следует выполнить еще один пункт.
7. Сокращенное
ионное уравнение сложить с дополнительным
ионным уравнением и получить полное
ионное уравнение, которое затем
преобразовать в молекулярное уравнение
ОВР.
3SO![]() + Cr2O
+ Cr2O![]() + 8H+
+ 8H+
= 3SO![]() + 2Cr+3
+ 2Cr+3
+ 4H2O
,
6K+
+ 2Na+
+ 4SO![]() = 6K+
= 6K+
+ 3SO![]() + 2Na+
+ 2Na+
+ SO![]()
—————————————————————————-
6K+
+ 3SO![]() + 2Na+
+ 2Na+
+ Cr2O![]() + 8H+
+ 8H+
+ 4SO![]() =
=
= 6K+
+ 3SO![]() + 2Cr+3
+ 2Cr+3
+ 3SO![]() + 4H2O
+ 4H2O
+ 2Na+
+ SO![]() .
.
3K2SO3
+ Na2Cr2O7
+ 4H2SO4
= Cr2(SO4)3
+ 3K2SO4
+ Na2SO4
+ 4H2O.
П р и м е ч а н и е.
В целях экономии времени полное ионное
уравнение ОВР обычно не пишут, а при
сложении сокращенного ионного с
дополнительным ионным уравнением сразу
же получают молекулярное уравнение.
Уравнивание
полуреакций по кислороду и водороду с
учетом
кислотности
cреды
Как известно, в
растворе среда может быть кислой,
щелочной или нейтральной.
П р и м е ч а н и е.
Если среда в растворе слабокислая (рН
немного меньше 7) или слабо щелочная (рН
немного больше 7) уравнивание производят,
считая среду практически нейтральной.
I. Среда кислая (рН
7). Для составления полуреакции разрешены
частицы только 2-х видов: это ион Н+
и молекула Н2О.
Полезно запомнить
следующую схему:
2H+
+ O*
H2O.
По элементному
составу 2 иона Н+
и один атом “связанного” кислорода
(О*)
эквивалентны одной молекуле воды. Под
“связанным” кислородом понимается
атом кислорода, входящий в состав любой
кислородсодержащей частицы (например:
в молекуле СО2
два “связанных” кислорода, а в ионе
SO![]() – их четыре).
– их четыре).
Пример 1. SO![]()
SO![]() .
.
Ион SO![]() содержит 3 О*,
содержит 3 О*,
а ион SO![]() содержит 4 О*
содержит 4 О*
. Чтобы уравнять по кислороду, слева
следует добавить 1 молекулу Н2О.
При этом справа должно появиться 2 иона
Н+
(чтобы сошлось по водороду):
SO![]() + H2O
+ H2O
SO![]() + 2H+.
+ 2H+.
Пример
2. Cr2O![]()
2Cr+3.
Слева 7 атомов
кислорода, а справа – ни одного. Слева
добавляем 14 Н+
, при этом справа появляется 7 Н2О.
Пример 3. NO![]()
NH![]() .
.
Cлева следует
добавить 10 Н+.
Из них 6 Н+
“свяжут” 3 кислорода в 3 молекулы воды,
а 4 Н+
необходимы для получения иона аммония:
NO![]() + 10 H+
+ 10 H+
NH![]() + 3H2O
+ 3H2O
.
П р и м е ч а н и е.
Полученные в этих примерах схемы
полуреакций не являются уравнениями.
Далее их следует уравнять по зарядам с
помощью электронов.
II. Среда щелочная
(рН
7). В данном случае для уравнивания по
кислороду и водороду можно использовать
только ионы ОН–
и молекулы Н2О.
Между этими частицами имеет место
следующее соотношение (по элементному
составу):
2OH–
~ H2O
+ O*.
Пример
1. SO![]()
SO![]() ,
,
SO![]() + 2OH–
+ 2OH–
SO![]() + H2O.
+ H2O.
Пример
2. CrO![]()
Cr+3,
CrO![]() + 4H2O
+ 4H2O
Cr+3
+ 8OH–.
Пример
3. MnO2
MnO![]() ,
,
MnO2
+ 4OH–
MnO![]() + 2H2O.
+ 2H2O.
Пример
4. N2H4
N2,
N2H4
+ 4OH–
N2
+ 4H2O.
III. Среда нейтральная
(рН
7). Для уравнивания по кислороду и водороду
в схеме полуреакции слева можно писать
только Н2О.
Справа могут появиться или Н+
или OH–.
Пример 1. SO![]()
SO![]() ,
,
SO![]() + H2O
+ H2O
SO![]() + 2H+.
+ 2H+.
Обратите внимание:
в данном случае схема реакции совпадает
с таковой для случая кислой среды.
Пример
2. NO![]()
NO![]() ,
,
NO![]() + H2O
+ H2O
NO![]() + 2OH–
+ 2OH–
.
Полученное выражение
аналогично переходу нитрата в нитрит
в щелочной среде.
Применение метода
полуреакций для неполных схем
Рассмотрим следующий
пример: к раствору KMnO4
добавили несколько капель H2SO4
(т.е. создали кислую среду), а затем
добавили раствор Na2SO3
. Составить уравнение ОВР. Условие
задачи можно записать в виде схемы:
KMnO4
+ Na2SO3
+ H2SO4
. . . .
или в ионном виде:
K+
+ MnO![]() + 2Na+
+ 2Na+
+ SO![]() + 2H+
+ 2H+
+ SO![]()
. . . .
Из литературы
известно, что ион MnO![]() является довольно сильным окислителем
является довольно сильным окислителем
в любых средах. В кислой среде (в нашем
случае) имеет место переход: MnO![]()
Mn+2.
Так же известно,
что SO![]() в любых средах склонен проявлять
в любых средах склонен проявлять
восстановительные свойства. Причем,
независимо от cреды сульфит переходит
в сульфат: SO![]()
SO![]() .
.
Напишем уравнения
соответствующих полуреакций и сделаем
электронный баланс:
 MnO
MnO![]()
+ 8H+
+ 5![]()
= Mn+2
+ 4H2O
2
SO![]()
+ H2O
– 2![]()
= SO![]()
+ 2H+
5
Умножим уравнения
полуреакций на коэффициенты электронного
баланса и сложим. После сокращения
одинаковых ионов получим сокращенное
ионное уравнение ОВР:
2MnO![]()
+ 16 H+
+ 5H2O
= 2Mn+2
+ 8H2O
+ 5SO![]()
+ 10 H+,
2MnO![]() + 6 H+
+ 6 H+
+ 5SO![]() = 2Mn+2
= 2Mn+2
+ 3H2O
+ 5SO![]() .
.
Напишем снизу
дополнительное ионное уравнение:
2MnO![]() + 6 H+
+ 6 H+
+ 5SO![]() = 2Mn+2
= 2Mn+2
+ 3H2O
+ 5SO![]() .
.
2K+
+ 3SO![]() + 10Na+
+ 10Na+
= 2SO![]() + 10Na+
+ 10Na+
+ 2K+
+ SO![]() .
.
Далее получаем
молекулярное уравнение ОВР:
2KMnO4
+ 3H2SO4
+ 5Na2SO3
= 2MnSO4
+ 3H2O
+ 5Na2SO4
+ K2SO4.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Метод электронного баланса и ионно-электронный метод (метод полуреакций)
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители .
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4 — восстанавливается до Mn 2+ (см. схему):
Найдем степень окисления элементов:
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S +4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn +7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S +4 – 2e — = S +6 | 5 восстановитель, процесс окисления
Mn +7 +5e — = Mn +2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn +7 , ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S +4 коэффициентом перед окислителем:
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO4 2- , из которых 5 – за счет превращения 5SO3 2- → 5SO4 2- , а 3 – за счет молекул серной кислоты 8SO4 2- — 5SO4 2- = 3SO4 2- .
Таким образом, серной кислоты надо взять 3 молекулы:
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H + + 3O -2 = 3H2O
Окончательный вид уравнения следующий:
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H + — кислая среда, OH — — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO3 2- + MnO4 — + 2H + = Mn 2+ + SO4 2- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4 — принимает 5 электронов восстанавливаясь в кислой среде до Mn 2+ . При этом освобождается кислород, входящий в состав MnO4 — , который, соединяясь с H + образует воду:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O
Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона. Как видно образовавшийся ион SO4 2- содержит больше кислорода, чем исходный SO3 2- . Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H + :
SO3 2- + H2O — 2e — = SO4 2- + 2H +
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O |2 окислитель, процесс восстановления
SO3 2- + H2O — 2e — = SO4 2- + 2H + |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4 — + 16H + + 5SO3 2- + 5H2O = 2Mn 2+ + 8H2O + 5SO4 2- + 10H +
Сократив подобные члены, находим ионное уравнение:
2MnO4 — + 5SO3 2- + 6H + = 2Mn 2+ + 5SO4 2- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
В ионном виде уравнение принимает вид:
Также, как и предыдущем примере, окислителем является MnO4 — , а восстановителем SO3 2- .
В нейтральной и слабощелочной среде MnO4 — принимает 3 электрона и восстанавливается до MnО2. SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + 2H2O + 3e — = MnО2 + 4OH — |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
В ионном виде уравнение принимает вид:
В щелочной среде окислитель MnO4 — принимает 1 электрон и восстанавливается до MnО4 2- . Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + e — = MnО2 |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
“Метод полуреакций, или электронно-ионного баланса”
Разделы: Химия
Тема: метод полуреакций или электронно-ионного баланса
Цель: расширить и углубить знания об ОВР.
Задачи:
- научить определять возможность протекания ОВР между данными веществами;
- научить устанавливать продукты реакции с опорой на схемы;
- раскрыть сущность метода полуреакций;
- рассмотреть правила и алгоритмы составления уравнений ОВР;
- научить применять полученные знания для решения конкретных задач.
Формы обучения: разъяснение, рассуждение, общая характеристика.
Методы обучения: словесные (беседа, объяснение), наглядные (компьютерные), практические (упражнения).
Общедидактические методы: объяснительно-иллюстративный, частично-поисковый, проблемный.
Ход урока.
1. Проверка домашнего задания.
Опрос у доски:
1) Самостоятельная работа у доски : определите тип следующих ОВР:

Подготовка устного ответа: классификация ОВР.
2) Самостоятельная работа у доски: расставить коэффициенты методом электронного баланса, указать окислитель и восстановитель, процессы окисления и восстановления:

3) Устный ответ: теория ОВР.
2. Новый материал.
Сегодня на уроке мы познакомимся со способами прогнозирования продуктов в ОВР и новом методе расстановки коэффициентов в ОВР – методе полуреакций или электронно-ионного баланса.
Чтобы написать уравнение реакции, протекающей в смеси заданных веществ, нужно ответить на следующие вопросы:
а) возможна ли в принципе ОВР между данными веществами;
б) если да, то установить продукты реакции;
в) подобрать коэффициенты в уравнении реакции.
Рассмотрим эти вопросы по порядку.
Что касается первого из них, вспомним, что в любой ОВР один из участников окисляется, т.е. повышает свою валентность, а другой – восстанавливается, т.е. понижает валентность. Поэтому реакция невозможна, если оба ее участника находятся в состояниях наиболее высокой или наиболее низкой степени окисления.
Исходя из сказанного, попробуем предположить возможность протекания ОВР.
Например, определим возможна ли ОВР между  .
.
Определите степени окисления элементов.
Учащиеся определяют степени окисления элементов по формулам соединений. Рассматривают строение атомов серы и хлора, определяют высшую и низшую степень окисления элементов.
Формулируем вывод: степени окисления серы (-2) и хлора (-1) являются для них предельно низкими, следовательно, и сера, и хлор могут выступать только в роли восстановителя. Т.е. реакция между  невозможна.
невозможна.
Рассмотрим другой пример. Возможно ли взаимодействие между ионами  ?
?
Учащиеся рассматривают степени окисления марганца и хрома в ионах, определяют исходя из строения атомов, что оба металла находятся в высшей степени окисления, следовательно, могут выступать только в роли окислителя. Делают вывод: реакция между ионами  и
и  невозможна.
невозможна.
Если же один из участников может повысить, а другой понизить свои степени окисления, реакция в принципе возможна.
Указать продукты реакции только из общих соображений в таких реакциях практически невозможно. Исследование химических свойств элементов как раз и представляет собой экспериментальное выяснение того, при каких условиях его соединения вступают в реакцию с другими элементами и соединениями и какие продукты при этом получаются.
Часто в ОВР участвуют соединения хрома и марганца. Особый интерес представляет поведение пероксида водорода в ОВР. Для прогнозирования продуктов реакций с их участием можно использовать следующие схемы.
Учитель проецирует с помощью видеопроектора схемы на экран, учащиеся для удобства имеют схемы на партах (Приложение 1).
Что касается собственно процедуры подбора коэффициентов в уравнениях, то для реакций в растворах удобен так называемый метод полуреакций, или электронно-ионный. В нем сначала записывают и уравнивают отдельно процессы окисления и восстановления, а полная реакция получается их сложением.
Учитель проецирует с помощью видеопроектора схемы на экран, учащиеся для удобства имеют схемы на партах (Приложение 2).
Кроме алгоритма составления полуреакций, необходимо придерживаться нескольких очевидных правил:
- В кислой среде ни в левой, ни в правой части не должно быть ионов Уравнивание осуществляется за счет ионов и молекул воды.
- В щелочной среде ни в левой, ни в правой части не должно быть ионов . Уравнивание осуществляется за счет ионов и молекул воды.
- В нейтральной среде ни ионов , ни в левой части быть не должно. Однако в правой части среди продуктов реакции они могут появиться.
Рассмотрим, как работают предложенные схемы на конкретных примерах.
Задача. Закончить уравнение реакции между бихроматом калия и соляной кислотой.
Ион содержит хром в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что среда кислотная (HCl).
Полуреакция восстановления: 
Ионы могут только окисляться, т.к. хлор имеет самую низшую степень окисления. Составим полуреакцию окисления: 

Суммируем сначала левые, а затем правые части полуреакций, не забывая предварительно умножить множитель на коэффициент, если он стоит перед формулой.

Получили сокращенное ионное уравнение.
Добавляем недостающие катионы или анионы, учитывая, что количество добавляемых ионов в правую и левую части ионного уравнения должно быть одинаковым.
В данном случае источником ионов ─ была соль , поэтому с каждым молем в раствор попадает 2 моль ионов . В реакции они участия не принимают, поэтому в неизменном виде должны перейти в правую часть уравнения. Вместе с 14 моль ионов в раствор вносится 14 моль ионов . Из них 6 участвует в реакции в качестве восстановителя, а остальные 8, как и ионы , в неизменном виде остаются после реакции, т.е. дописываются в правую часть.
В результате получаем:
После этого можно объединить ионы в формулы реальных веществ:
Рассмотрим другой пример.
Задача. Закончить уравнение реакции → …
Ион содержит марганец в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что среда нейтральная.
Полуреакция восстановления:
Если ион будет выступать в роли окислителя, то пероксид водорода – в роли восстановителя. По схеме составляем полуреакцию восстановления:
Оформляем уравнение ОВР, протекающей в нейтральной среде:
- Т.к в нейтральной среде ни ионов , ни в левой части быть не должно, значит, для уравнивания атомов кислорода в правую часть добавляем воду:
- Оформление полуреакции становится подобным оформлению полуреакции в щелочной среде: в противоположную часть добавляем удвоенное число гидроксид-ионов:
- Перед ставим коэффициент, показывающий разницу в числе атомов кислорода в правой и левой частях полуреакций, а перед – его удвоенный коэффициент:
- Подсчитываем заряды в полуреакциях, уравниваем заряд. Балансируем (уравниваем) число отданных и принятых электронов в полуреакциях:
- Суммируем сначала левые, а затем правые части полуреакций, не забывая предварительно умножить множитель на коэффициент, если он стоит перед формулой:
- Сокращаем в правой и левой части одинаковые молекулы и ионы:
Таким образом, получаем ионное уравнение.
- Добавляем недостающие катионы или анионы, учитывая, что количество добавляемых ионов в правую и левую части ионного уравнения должно быть одинаковым:
Также рассмотрим пример ОВР, протекающей с щелочной среде.
Задача. Закончить уравнение реакции:
Определяем окислитель и восстановитель в данной ОВР. В нитрате ртути (II) ртуть содержится в ее высшей степени окисления, следовательно, может выступать только в роли окислителя. Составим полуреакцию восстановления.
Полуреакция восстановления:
- Если ион будет выступать в роли окислителя, то пероксид водорода – в роли восстановителя. По схеме составляем полуреакцию восстановления пероксида водорода в щелочной среде:
- Оформляем уравнение ОВР, протекающей в щелочной среде:
- Добавляем недостающие катионы и анионы.
Преимущества электронно-ионного метода при составлении уравнений реакций и подборе коэффициентов в сравнении с методом электронного баланса особенно проявляются при составлении уравнений реакций с участием органических соединений.
Задача. Составьте уравнение окисления ацетилена раствором до щавелевой кислоты в нейтральной среде.
Составляем схему реакции:
выступаем в роли окислителя, т.к. содержит марганец в его высшей степени окисления.
Следовательно, схема полуреакции восстановления имеет вид:
Схема полуреакции окисления:
Оформляем уравнение ОВР, протекающей в нейтральной среде:
- Т.к в нейтральной среде ни ионов , ни в левой части быть не должно, значит, для уравнивания атомов кислорода в правую часть добавляем воду:
- Оформление полуреакции становится подобным оформлению полуреакции в щелочной среде: в противоположную часть добавляем удвоенное число гидроксид-ионов. Перед ставим коэффициент, показывающий разницу в числе атомов кислорода в правой и левой частях полуреакций, а перед его удвоенный коэффициент. Подсчитываем заряды в полуреакциях, уравниваем заряд. Балансируем (уравниваем) число отданных и принятых электронов в полуреакциях:
- Составляем ионное уравнение:
- Сокращаем в правой и левой части одинаковые молекулы, добавляем недостающие катионы:
Задача. Составьте уравнение реакции окисления фенола дихроматом калия в кислой среде до хинона:
Ион содержит хром в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что среда кислотная .
Используем правила оформления уравнений ОВР, протекающих в кислотной среде.
Сокращаем в правой и левой части одинаковые молекулы, добавляем недостающие катионыи анионы:
Рассмотрев метод электронно-ионного баланса или метод полуреакций можно выделить следующие достоинства данного метода:
- Рассматриваются реально существующие ионы и вещества.
- Не нужно знать все получающиеся вещества, они появляются в уравнении реакции при его выводе.
- Необязательно знать степени окисления. Понятие степени окисления в органической химии употребляется реже, чем о неорганической химии.
- Этот метод дает сведения не только о числе электронов, участвующих в каждой полуреакции, но и о том, как изменяется среда.
- Сокращенные ионные уравнения лучше передают смысл протекающих процессов и позволяют делать определенные предположения о строении продуктов реакции.
Домашнее задание: Закончить уравнения:
В качестве проверочной работы по изученной теме предлагаю учащимся лабораторные опыты. Учащимся необходимо провести ОВР, объяснить происходящие явления, составив уравнения реакций с помощью метода полуреакций.
Лабораторные опыты «Окислительно-восстановительные реакции»
В три стакана налейте малиновый раствор перманганата калия. Добавьте в первый стакан немного раствора серной кислоты, во второй – воду, в третий – концентрированный раствор гидроксида калия. Окраска растворов при этом не изменяется. Добавьте во все стаканы по 5 мл сульфита калия и хорошо перемешайте смеси стеклянной палочкой.
Задание: объясните изменение окраски растворов, составив ОВР методом полуреакций.
Литература:
Д.Д. Друзцова, Л.Б. Бестаева Окислительно-восстановительные реакции. – М.:Дрофа,2005.
Метод полуреакций – составление уравнений ОВР
Любая окислительно-восстановительная реакция состоит из двух “половинок” – в ходе ОВР идут два процесса – процесс окисления вещества-восстановителя и процесс восстановления вещества-окислителя. Оба эти процесса могут быть описаны соответственными ионными уравнениями, которые потом можно суммировать и получить итоговое общее ионное уравнение реакции, а потом записать молекулярное уравнение.
В качестве примера составим уравнение реакции сероводорода с раствором калия перманганата в кислой среде методом полуреакций. Ранее это уравнение было составлено методом электронного баланса.
В ходе реакции происходит разложение молекул сероводорода на серу и водород, о чем свидетельствует постепенное помутнение раствора перманганата калия (сера выпадает в осадок). Процесс окисления сероводорода запишем в виде уравнения полуреакции окисления:
Поскольку в левой и правой частях схемы кол-во атомов серы и водорода равно, то стрелку можно заменить на знак равенства, уравняв предварительно число зарядов в исходном веществе и продуктах реакции:
Параллельно с помутнение раствора идет и смена его окраски – из малинового раствор становится бесцветным,что объясняется переходом ионов MnO4 – , имеющих малиновую окраску, в практически бесцветный катион марганца Mn 2+ . Эта полуреакция восстановления выражается схемой:
А куда же делся атом кислорода? – обязательно спросит внимательный читатель. В кислой среде атом кислорода, входящий в состав иона, соединяется с атомами водорода, выделяющимися в ходе полуреакции окисления, образуя молекулу воды, при этом, поскольку из одного иона освобождается аж 4 атома кислорода, то для их связывания требуется 8 атомов водорода:
Чтобы уравнять заряды в левой и правой части схемы, в левую часть надо добавить 5 электронов (в левой части сумма зарядов +7, а в левой +2):
Для получения суммарного уравнения реакции, необходимо почленно сложить две полуреакции, предварительно уравняв кол-во отданных и полученных электронов, по аналогии с методом электронного баланса:
Проверяем кол-во атомов и заряды в левой и правой частях суммарного уравнения, они равны, значит уравнение составлено правильно (водорода – по 16 атомов; серы – по 5; марганца – по 2; кислорода – по 8; заряды – по +4).
Чтобы перейти от ионного уравнения к молекулярному, надо в левой части подобрать к катионам и анионам их “пары” – анионы и катионы соответственно, после чего подобранные ионы записать и в правую часть уравнения, после этого ионы объединяются в молекулы, и получается молекулярное уравнение.
Результат аналогичен уравнению, полученному методом электронного баланса.
Правила составления уравнений ОВР методом полуреакций
- На первом этапе в ионном виде записывают полуреакцию окисления и полуреакцию восстановления, в которых указывают вещество-восстановитель и вещество-окислитель, с продуктами их реакции.
- Сильные электролиты записываются в виде ионов.
- Слабые электролиты, газы и твердые вещества, выпадающие в осадок – в виде молекул.
- Продукты реакции между восстановителем и окислителем устанавливаются по справочникам или по “шпаргалке”, приведенной на странице “Определение продуктов ОВР” (это самый сложный этап для начинающих).
- Записывают схему реакции, в которой многоточием обозначают неизвестные продукты реакции.
- Что делать с кислородом:
- Если в исходном веществе кислорода содержится больше, чем в продуктах реакции, то “лишний” кислород в растворах с кислой средой связывается с катионами водорода, образуя молекулы воды (O -2 +2H + =H2O); в нейтральных растворах – в гидроксид-ионы: O -2 +H2O=2OH – ;
- Если в исходном веществе кислорода содержится меньше, чем в продуктах реакции, то “недостающий” кислород “забирается” из молекул воды (в растворах с кислой и нейтральной средой): H2O=O -2 +2H + ; в щелочных растворах – за счет гидроксид-ионов: 2OH – =O -2 +H2O.
- В левой и правой частях уравнения должны быть равны суммарное число и знак электрических зарядов.
Достоинства метода полуреакций:
- Работают с реально существующими ионами (MnO4 – ), а не виртуальными (Mn +7 ).
- Нет необходимости знать степени окисления атомов.
- Прослеживается роль среды, в которой происходит взаимодействие веществ.
- Не нужно знать все продукты реакции, они выводятся “сами собой” в процессе составления уравнения.
Пример составления уравнения ОВР для кислотной среды
Составление уравнения реакции серы с азотной кислотой:
- S+HNO3
- S 0 → SO4 2- – процесс окисления восстановителя.
- NO3 – → NO – процесс восстановления окислителя.
- Приводим в “порядок” первую полуреакцию окисления:
- S 0 → SO4 2- – отличник должен здесь спросить, откуда справа взялся кислород? Немного терпения, сейчас все станет ясно.
- в правую часть схемы, где присутствует избыток кислорода, добавляется катион водорода:
S 0 → SO4 2- +H + - у внимательного читателя тут же должен возникнуть вопрос – а откуда взялся катион водорода? Отвечаем: из молекулы воды, которая добавляется в левую часть схемы:
S 0 +H2O → SO4 2- +H + - Вот теперь настало время уравнять в обеих частях схемы кислород, который, теперь понятно, откуда взялся:
S 0 +4H2O → SO4 2- +H + - Теперь надо уравнять водород:
S 0 +4H2O → SO4 2- +8H + - С атомами элементов в обеих частях схемы полный порядок, осталось разобраться с зарядами – в левой части заряд нулевой; в правой: (-2)+8(+1)=+6:
S 0 +4H2O-6e – → SO4 2- +8H +
- Делаем аналогичную работу со второй полуреакцией восстановления:
- NO3 – → NO
- Добавляем водород, в левую часть, где присутствует “лишний” кислород:
NO3 – +H + → NO - В правую часть добавляем воду:
NO3 – +H + → NO+H2O - Уравниваем кислород:
NO3 – +H + → NO+2H2O - Уравниваем водород:
NO3 – +4H + → NO+2H2O - Уравниваем заряды:
NO3 – +4H + +3e – → NO+2H2O
- Уравниваем кол-во электронов, которые были отданы и приняты в двух полуреакциях:
- Суммируем левые и правые части, предварительно умножив на коэффициент (2) члены второй полуреакции:
- Проводим сокращение одинаковых членов в левой и правой частях схемы и добавляем в пару к анионам “нужные” катионы, чтобы образовались молекулы, в нашем случае это будут молекулы азотной и серной кислоты, для этого мы добавим катион водорода (2H + ):
- Суммарное молекулярное уравнение:
S+2HNO3 = H2SO4+2NO – в результате взаимодействия серы с азотной кислотой получается серная кислота и оксид азота (II).
Пример составления уравнения ОВР для кислотной среды
“Фокус” уравнивания кол-ва атомов кислорода и водорода для уравнений ОВР в щелочной среде заключается в следующем:
- Вода (H2O) добавляется в ту часть полуреакции, в которой присутствует избыток кислорода.
- Соответственно, в противоположную часть уравнения-схемы добавляется удвоенное число гидроксид-ионов (OH – ).
- Перед формулой молекулы воды ставится коэффициент, уравнивающий разницу кол-ва атомов кислорода в левой и правой частях полуреакции.
- Перед формулой гидроксид-иона ставится удвоенный коэффициент.
- Восстановитель присоединяет атомы кислорода из гидроксид-ионов.
- MnO2+KClO3+KOH → ?
- MnO2 → MnO4 2- оксид марганца является восстановителем, он будет связывать гидроксид-ионы.
- Поскольку в правой части схемы килорода больше (на 2 атома), то вода добавляется сюда же, перед ее формулой ставится коэффициент 2, соответственно, в левую часть схемы полуреакции добавляют 4 гидроксид-иона:
MnO2+4OH – → MnO4 2- +2H2O - Уравниваем заряды:
MnO2+4OH – -2e – → MnO4 2- +2H2O - ClO3 – → Cl – – полуреакция восстановления.
- Избыток кислорода (3 “лишних” атома) находится в левой части схемы полуреакции, сюда же добавляем и 3 молекулы воды, а в правую часть 6 гидроксид-ионов:
ClO3 – +3H2O → Cl – +6OH – - Уравниваем заряды:
ClO3 – +3H2O+6e – → Cl – +6OH – - Уравниваем в полуреакциях кол-во отданных и принятых электронов (6 и 2 сокращаем на 2), и получаем суммарное уравнение, путем сложения двух уравнений полуреакций:
- Проводим сокращение подобных слагаемых и добавляем катионы калия, чтобы перейти к молекулярной форме уравнения реакции:
- Молекулярное уравнение реакции:
3MnO2+6KOH+KClO3 = 3K2MnO4+3H2O+KCl
Пример составления уравнения ОВР для нейтральной среды
Среду нейтральной можно счситать лишь условно, в любом случае, среда будет либо слабощелочной, либо слабокислотной.
Составляя уравнение ОВР методом полуреакций для нейтральной среды, одну полуреакцию составляют, как для кислотной среды – в левую часть схемы добавляют молекулу воды, в правую – катион водорода), вторую – как для щелочной (в левую часть добавляют молекулу воды, в правую – гидроксид-ион).
- Na2SO3+KMnO4+H2O
- SO3 2- → SO4 2- – процесс окисления восстановителя;
- MnO4 – → MnO2 – процесс восстановления окислителя;
- Схема реакции:
SO3 2- +MnO4 – → SO4 2- +MnO2+. - Составляем уравнения полуреакций:
- Молекулярное уравнение:
Еще один пример:
- S+KMnO4 → ?
- S → SO4 2-
- MnO4 – → MnO2
- Первую полуреакцию оформляем, как для кислотной среды; вторую – как для щелочной:
- Сокращаем обе части равенства на 8 молекул воды, и добавляем катионы калия:
- Молекулярное уравнение:
S+2KMnO4 = K2SO4+2MnO2
Более подробно составление уравнений окислительно-восстановительных реакций методом полуреакций в различных средах рассмотрено на странице Влияние среды на протекание ОВР.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки:
Политика конфиденциальности Об авторе
[spoiler title=”источники:”]
http://urok.1sept.ru/articles/520408
http://prosto-o-slognom.ru/chimia_ovr/09_metod_polureaktsij.html
[/spoiler]
Тема: метод полуреакций или электронно-ионного баланса
Цель: расширить и углубить знания об ОВР.
Задачи:
- научить определять возможность протекания ОВР между данными веществами;
- научить устанавливать продукты реакции с опорой на схемы;
- раскрыть сущность метода полуреакций;
- рассмотреть правила и алгоритмы составления уравнений ОВР;
- научить применять полученные знания для решения конкретных задач.
Формы обучения: разъяснение, рассуждение, общая характеристика.
Методы обучения: словесные (беседа, объяснение), наглядные (компьютерные), практические (упражнения).
Общедидактические методы: объяснительно-иллюстративный, частично-поисковый, проблемный.
Ход урока.
1. Проверка домашнего задания.
Опрос у доски:
1) Самостоятельная работа у доски : определите тип следующих ОВР:
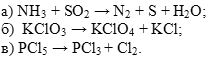
Подготовка устного ответа: классификация ОВР.
2) Самостоятельная работа у доски: расставить коэффициенты методом электронного баланса, указать окислитель и восстановитель, процессы окисления и восстановления:
![]()
3) Устный ответ: теория ОВР.
2. Новый материал.
Сегодня на уроке мы познакомимся со способами прогнозирования продуктов в ОВР и новом методе расстановки коэффициентов в ОВР – методе полуреакций или электронно-ионного баланса.
Чтобы написать уравнение реакции, протекающей в смеси заданных веществ, нужно ответить на следующие вопросы:
а) возможна ли в принципе ОВР между данными веществами;
б) если да, то установить продукты реакции;
в) подобрать коэффициенты в уравнении реакции.
Рассмотрим эти вопросы по порядку.
Что касается первого из них, вспомним, что в любой ОВР один из участников окисляется, т.е. повышает свою валентность, а другой – восстанавливается, т.е. понижает валентность. Поэтому реакция невозможна, если оба ее участника находятся в состояниях наиболее высокой или наиболее низкой степени окисления.
Исходя из сказанного, попробуем предположить возможность протекания ОВР.
Например, определим возможна ли ОВР между ![]() .
.
Определите степени окисления элементов.
Учащиеся определяют степени окисления элементов по формулам соединений. Рассматривают строение атомов серы и хлора, определяют высшую и низшую степень окисления элементов.
Формулируем вывод: степени окисления серы (-2) и хлора (-1) являются для них предельно низкими, следовательно, и сера, и хлор могут выступать только в роли восстановителя. Т.е. реакция между ![]() невозможна.
невозможна.
Рассмотрим другой пример. Возможно ли взаимодействие между ионами ![]() ?
?
Учащиеся рассматривают степени окисления марганца и хрома в ионах, определяют исходя из строения атомов, что оба металла находятся в высшей степени окисления, следовательно, могут выступать только в роли окислителя. Делают вывод: реакция между ионами ![]() и
и ![]() невозможна.
невозможна.
Если же один из участников может повысить, а другой понизить свои степени окисления, реакция в принципе возможна.
Указать продукты реакции только из общих соображений в таких реакциях практически невозможно. Исследование химических свойств элементов как раз и представляет собой экспериментальное выяснение того, при каких условиях его соединения вступают в реакцию с другими элементами и соединениями и какие продукты при этом получаются.
Часто в ОВР участвуют соединения хрома и марганца. Особый интерес представляет поведение пероксида водорода в ОВР. Для прогнозирования продуктов реакций с их участием можно использовать следующие схемы.
Учитель проецирует с помощью видеопроектора схемы на экран, учащиеся для удобства имеют схемы на партах (Приложение 1).
Что касается собственно процедуры подбора коэффициентов в уравнениях, то для реакций в растворах удобен так называемый метод полуреакций, или электронно-ионный. В нем сначала записывают и уравнивают отдельно процессы окисления и восстановления, а полная реакция получается их сложением.
Учитель проецирует с помощью видеопроектора схемы на экран, учащиеся для удобства имеют схемы на партах (Приложение 2).
Кроме алгоритма составления полуреакций, необходимо придерживаться нескольких очевидных правил:
- В кислой среде ни в левой, ни в правой части не должно быть ионов
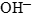 Уравнивание осуществляется за счет ионов
Уравнивание осуществляется за счет ионов 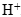 и молекул воды.
и молекул воды. - В щелочной среде ни в левой, ни в правой части не должно быть ионов
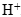 . Уравнивание осуществляется за счет ионов
. Уравнивание осуществляется за счет ионов 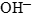 и молекул воды.
и молекул воды. - В нейтральной среде ни ионов
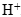 , ни
, ни 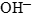 в левой части быть не должно. Однако в правой части среди продуктов реакции они могут появиться.
в левой части быть не должно. Однако в правой части среди продуктов реакции они могут появиться.
Рассмотрим, как работают предложенные схемы на конкретных примерах.
Задача. Закончить уравнение реакции между бихроматом калия и соляной кислотой.
Ион ![]() содержит хром в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что среда кислотная (HCl).
содержит хром в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что среда кислотная (HCl).
Полуреакция восстановления: ![]()
Ионы ![]() могут только окисляться, т.к. хлор имеет самую низшую степень окисления. Составим полуреакцию окисления:
могут только окисляться, т.к. хлор имеет самую низшую степень окисления. Составим полуреакцию окисления: ![]()

Суммируем сначала левые, а затем правые части полуреакций, не забывая предварительно умножить множитель на коэффициент, если он стоит перед формулой.
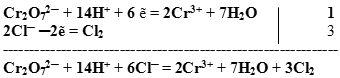
Получили сокращенное ионное уравнение.
Добавляем недостающие катионы или анионы, учитывая, что количество добавляемых ионов в правую и левую части ионного уравнения должно быть одинаковым.
В данном случае источником ионов ![]() ─ была соль
─ была соль ![]() , поэтому с каждым молем
, поэтому с каждым молем ![]() в раствор попадает 2 моль ионов
в раствор попадает 2 моль ионов ![]() . В реакции они участия не принимают, поэтому в неизменном виде должны перейти в правую часть уравнения. Вместе с 14 моль ионов
. В реакции они участия не принимают, поэтому в неизменном виде должны перейти в правую часть уравнения. Вместе с 14 моль ионов ![]() в раствор вносится 14 моль ионов
в раствор вносится 14 моль ионов ![]() . Из них 6 участвует в реакции в качестве восстановителя, а остальные 8, как и ионы
. Из них 6 участвует в реакции в качестве восстановителя, а остальные 8, как и ионы ![]() , в неизменном виде остаются после реакции, т.е. дописываются в правую часть.
, в неизменном виде остаются после реакции, т.е. дописываются в правую часть.
В результате получаем:
![]()
После этого можно объединить ионы в формулы реальных веществ:
![]()
Рассмотрим другой пример.
Задача. Закончить уравнение реакции ![]() → …
→ …
Ион ![]() содержит марганец в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что среда нейтральная.
содержит марганец в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что среда нейтральная.
Полуреакция восстановления: ![]()
Если ион ![]() будет выступать в роли окислителя, то пероксид водорода – в роли восстановителя. По схеме составляем полуреакцию восстановления:
будет выступать в роли окислителя, то пероксид водорода – в роли восстановителя. По схеме составляем полуреакцию восстановления:
![]()
Оформляем уравнение ОВР, протекающей в нейтральной среде:
![]()
- Оформление полуреакции становится подобным оформлению полуреакции в щелочной среде: в противоположную часть добавляем удвоенное число гидроксид-ионов:
![]()
![]()
- Подсчитываем заряды в полуреакциях, уравниваем заряд. Балансируем (уравниваем) число отданных и принятых электронов в полуреакциях:
![]()
- Суммируем сначала левые, а затем правые части полуреакций, не забывая предварительно умножить множитель на коэффициент, если он стоит перед формулой:
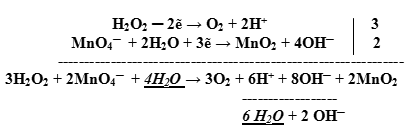
- Сокращаем в правой и левой части одинаковые молекулы и ионы:
![]()
Таким образом, получаем ионное уравнение.
- Добавляем недостающие катионы или анионы, учитывая, что количество добавляемых ионов в правую и левую части ионного уравнения должно быть одинаковым:
![]()
Также рассмотрим пример ОВР, протекающей с щелочной среде.
Задача. Закончить уравнение реакции: ![]()
Определяем окислитель и восстановитель в данной ОВР. В нитрате ртути (II) ртуть содержится в ее высшей степени окисления, следовательно, может выступать только в роли окислителя. Составим полуреакцию восстановления.
Полуреакция восстановления:
![]()
- Если ион
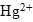 будет выступать в роли окислителя, то пероксид водорода – в роли восстановителя. По схеме составляем полуреакцию восстановления пероксида водорода в щелочной среде:
будет выступать в роли окислителя, то пероксид водорода – в роли восстановителя. По схеме составляем полуреакцию восстановления пероксида водорода в щелочной среде:
![]()
- Оформляем уравнение ОВР, протекающей в щелочной среде:
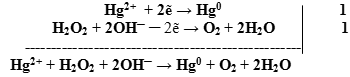
- Добавляем недостающие катионы и анионы.
![]()
Преимущества электронно-ионного метода при составлении уравнений реакций и подборе коэффициентов в сравнении с методом электронного баланса особенно проявляются при составлении уравнений реакций с участием органических соединений.
Задача. Составьте уравнение окисления ацетилена раствором ![]() до щавелевой кислоты в нейтральной среде.
до щавелевой кислоты в нейтральной среде.
Составляем схему реакции:
![]()
![]() выступаем в роли окислителя, т.к. содержит марганец в его высшей степени окисления.
выступаем в роли окислителя, т.к. содержит марганец в его высшей степени окисления.
Следовательно, схема полуреакции восстановления имеет вид:
![]()
Схема полуреакции окисления:
![]()
Оформляем уравнение ОВР, протекающей в нейтральной среде:
![]()
![]()
- Составляем ионное уравнение:
![]()
- Сокращаем в правой и левой части одинаковые молекулы, добавляем недостающие катионы:
![]()
Задача. Составьте уравнение реакции окисления фенола дихроматом калия в кислой среде до хинона:
![]()
Ион ![]() содержит хром в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что среда кислотная
содержит хром в его высшей степени окисления, следовательно, может выступать только в роли окислителя. По схеме составим полуреакцию, учитывая, что среда кислотная ![]() .
.
![]()
Используем правила оформления уравнений ОВР, протекающих в кислотной среде.
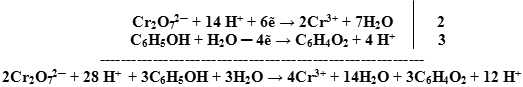
Сокращаем в правой и левой части одинаковые молекулы, добавляем недостающие катионыи анионы:
![]()
Рассмотрев метод электронно-ионного баланса или метод полуреакций можно выделить следующие достоинства данного метода:
- Рассматриваются реально существующие ионы и вещества.
- Не нужно знать все получающиеся вещества, они появляются в уравнении реакции при его выводе.
- Необязательно знать степени окисления. Понятие степени окисления в органической химии употребляется реже, чем о неорганической химии.
- Этот метод дает сведения не только о числе электронов, участвующих в каждой полуреакции, но и о том, как изменяется среда.
- Сокращенные ионные уравнения лучше передают смысл протекающих процессов и позволяют делать определенные предположения о строении продуктов реакции.
Домашнее задание: Закончить уравнения:
![]()
В качестве проверочной работы по изученной теме предлагаю учащимся лабораторные опыты. Учащимся необходимо провести ОВР, объяснить происходящие явления, составив уравнения реакций с помощью метода полуреакций.
Лабораторные опыты «Окислительно-восстановительные реакции»
В три стакана налейте малиновый раствор перманганата калия. Добавьте в первый стакан немного раствора серной кислоты, во второй – воду, в третий – концентрированный раствор гидроксида калия. Окраска растворов при этом не изменяется. Добавьте во все стаканы по 5 мл сульфита калия и хорошо перемешайте смеси стеклянной палочкой.
Задание: объясните изменение окраски растворов, составив ОВР методом полуреакций.
Литература:
Д.Д. Друзцова, Л.Б. Бестаева Окислительно-восстановительные реакции. – М.:Дрофа,2005.
Здравствуйте, уважаемые читатели!
Коэффициенты в уравнениях большинства окислительно-восстановительных реакций зачастую невозможно подобрать без составления баланса, отражающего перераспределение электронов между частицей-окислителем и частицей-восстановителем.
Как правило, при этом используют либо метод электронного баланса (ЭБ), либо метод электронно-ионного баланса (ЭИБ) (иногда последний называют методом полуреакций). Есть ли различия в этих двух методах и насколько они существенны? Об этом можно судить по информации, представленной в таблице:
Как можно увидеть из таблицы, несмотря на то, что метод ЭБ “безотказен” и имеет более широкий спектр применения, чем ЭИБ, он в меньшей степени отражает сущность химических процессов ОВР, протекающих в растворах. Как следствие, излишняя(по сравнению с ЭИБ) заформализованность метода приводит к повышению трудоемкости при расставлении коэффициентов в уравнениях ОВР как в неорганике, так и в органике.
В последнее время метод ЭИБ практически не рассматривается в школьной программе. Возможно, это связано с его низкой востребованностью при подготовке к ЕГЭ по химии. Тем не менее, в большинстве дисциплин химического профиля, преподаваемых в вузах, а также при подготовке к олимпиадам необходимо именно устойчивое, сформированное в школе знание ЭИБ.
В связи с этим я приглашаю всех заинтересованных лиц (преподавателей, учеников) на вебинар, посвященный применению ЭИБ в неорганике и органике. Время проведения вебинара – 1 ноября, 18-21 час.
План вебинара:
1.Сравнительная характеристика методов электронного (ЭБ) и электронно-ионного балансов (ЭИБ)
2.Алгоритм ЭИБ
а)форма записи основных реагентов
б) дополнительные реагенты в уравнениях полуреакций
в)написание уравнений полуреакций для кислой среды
г)написание уравнений полуреакций для щелочной среды
д)составление ЭИБ в целом
3. ЭИБ в неорганике
4. ЭИБ в органике.
Участие в вебинаре платное. Записи вебинара не будет.
Зарегистрироваться можно по ссылке:
https://docs.google.com/forms/d/1C2ea8ER5_LbeVIqstjOh3q_t421YfexwsXvBDzcONE8/edit?usp=sharing
Всего доброго!
